Gustavo Grünberg 1 , Ximena Gelpi 2 , Virginia Quintana 2
Rev Chil Anest Vol. 38 Núm. 1 pp. 15-23|doi:
PDF|ePub|RIS
Resumen
El objetivo de este estudio fue determinar si los suspiros manuales o automáticos de la máquina de anestesia reducen las alteraciones del intercambio gaseoso durante la anestesia para neurocirugía prolongada. Metodología: Se realizó un estudio prospectivo, randomizado, de 27 pacientes neuroquirúrgicos, operados con anestesia general y ventilación controlada, con fracción inspirada de oxígeno (FIO2) de 1, sin presión positiva de final de espiración (PEEP). Los pacientes fueron aleatoriamente asignados a 3 grupos: Grupo control (C): volumen corriente (VC) 10 ml/kg y frecuencia respiratoria (FR) 10/min; Grupo SM: VC y FR igual, más 3 insuflaciones manuales horarias, y Grupo SA: igual VC y FR, con suspiro automático de la máquina de anestesia. Se realizaron gasometrías arteriales basales, a los 30, 120, 240 y 360 minutos de la intubación traqueal, y a las 2 horas del ingreso a Sala de Recuperación Postanestésica (SRPA). Resultados: Se calcularon los siguientes índices: presión arterial de oxígeno/fracción inspirada de oxígeno (PaFIO2), presión arterial/presión alveolar de oxígeno (PaO2/PAO2), y diferencia alvéolo – arterial de oxígeno (DA-a O2). El PaFIO2 no tuvo modificaciones significativas, mientras que el índice PaO2/PAO2 tuvo un descenso y la DA-a O2 un aumento significativo (p < 0,05) con respecto a los valores basales durante la anestesia, con recuperación parcial en SRPA. No se encontraron diferencias significativas entre los 3 grupos estudiados. Conclusiones: Durante la anestesia prolongada con ventilación mecánica controlada con FIO2 1 se produjeron alteraciones del intercambio gaseoso que no disminuyeron mediante la administración de suspiros manuales ni automáticos de la máquina de anestesia.
Summary
Gas exchange alterations during mechanical ventilation in prolonged neurosurgery
The objective of this study was to determine if manual or automatic anesthesia machine sights can reduce gas exchange alterations during prolonged neurosurgery under general anesthesia. Methodology: We made a prospective, randomized, controlled research on 27 neurosurgical patients, who had been operated under general anesthesia, and controlled mechanical ventilation with fraction of inspired oxygen of 1 (FIO2), without positive end expiratory pressure (PEEP). Patients were randomized into 3 groups; Group C: tidal volume (VT) 10 ml/kg, and respiratory frequency (RF) of 10/min; Group SM: same VT and RF, plus 3 manual inflations per hour; and Group SA: same VT and RF, with automatic sigh of anesthesia machine. Basal arterial blood gases were determined; 30, 120, 240 and 360 minutes after tracheal intubation, and 2 hours after arriving to the Post Anesthesia Care Unit (PACU). Results: The following ratios were calculated: arterial oxygen pressure/fraction of inspired oxygen (PaFIO2), arterial oxygen pressure/alveolar oxygen pressure (PaO2/PAO2), and the difference between alveolar oxygen pressure – arterial oxygen pressure (DA-aO2). The PaFIO2 did not have significant modifications, while the PaO2/PAO2 index had a reduction and the DA-aO2 had a significant increase (p < 0,05) with respect to the basal values during anesthesia, with partial recovery in PACU. We didn’t found differences between the three groups studied. Conclusions: During prolonged anesthesia with controlled mechanical ventilation with FIO2 1 gas exchange alterations took place, and they were not modified by the administration of manual inflations or automatic sighs of the anesthesia machine.
Introducción
La cirugía y la anestesia determinan importantes cambios fisiopatológicos a nivel pulmonar, predisponen al paciente al desarrollo de complicaciones respiratorias que pueden manifestarse por hipoxemia relativa y/o absoluta, intra y postoperatoria, como resultado de alteraciones del intercambio gaseoso 1 –5 .
La ventilación mecánica le brinda al paciente las mejores condiciones respiratorias para la realización de cirugías prolongadas, especialmente para neurocirugía, pero a su vez tiene la capacidad potencial de generar alteraciones propias a nivel del intercambio gaseoso pulmonar 1 –5 .
La modificación de la dinámica ventilatoria, producto del cambio de las presiones intra y extrapulmonares (generadas por el ventilador de la máquina de anestesia), de la posición quirúrgica, y de la cirugía en sí misma (cuando se trabaja en tórax y/o abdomen), determina la disminución de la capacidad residual funcional, con un aumento del volumen de cierre, lo que favorece la aparición de zonas pulmonares perfundidas (Q) pero no ventiladas (V), generando lo que se denomina “Shunt” (relación V/Q = 0), y que se asocian además a un aumento del espacio muerto fisiológico, zonas pulmonares en las cuales la ventilación es adecuada pero no la perfusión (alta relación V/Q). En las zonas no ventiladas se van a originar atelectasias que se traducen gasométricamente como una hipoxemia relativa, con disminución del índice presión arterial de oxígeno/fracción inspirada de oxígeno (PaFIO2), y aumento de la diferencia alvéolo-arterial de oxígeno (DA-aO2) 3–8.
Actualmente se han desarrollado aparatos de anestesia con múltiples posibilidades (diferentes formas de flujo inspiratorio y/o espiratorio, presión positiva al final de la espiración (PEEP), patrón ventilatorio variable, etc.), integradas a sistemas de monitorización que permiten visualizar las curvas de flujo y/o presión/volumen, y con el cálculo automático de compliance. Sin embargo, a pesar de estos avances, la mayoría de las máquinas de anestesia de uso habitual en nuestro medio no tienen aún estas posibilidades, y la mayoría de las veces no permiten administrar mezclas de oxígeno con aire, sino sólo con óxido nitroso.
En neurocirugía, tanto la ventilación como la oxigenación deben ser óptimas, por lo que deben monitorizarse de manera estricta para asegurar las mejores condiciones a nivel del sistema nervioso central. La presión intracraneana (PIC) es afectada por la ventilación y oxigenación arterial, pero también por factores de la mecánica ventilatoria, como la presión intratorácica máxima y media, y el uso de PEEP. Por lo tanto, durante la ventilación mecánica estos factores deben ser manejados muy cuidadosamente. La PEEP elevada, así como las maniobras de reclutamiento alveolar que se plantean actualmente para tratar de recuperar zonas pulmonares colapsadas, pueden determinar aumentos de la presión intratorácica con el consiguiente aumento de la presión venosa central (PVC). Este mecanismo puede reducir el drenaje venoso encefálico produciendo congestión venosa y aumento de la presión intracraneana (PIC), lo que su vez, aumenta el sangrado quirúrgico y favorece el desarrollo de edema cerebral. Por lo tanto, se debe buscar el equilibrio entre una ventilación mecánica que brinde las mejores condiciones quirúrgicas, pero que a su vez no determine por sí misma alteraciones respiratorias significativas.
Los suspiros, ya sean realizados manualmente o automáticos por la máquina de anestesia, son maniobras breves, que no alteran el drenaje venoso cerebral ni elevan la PIC de forma sostenida, permitiendo ventilar zonas pulmonares que tienden al colapso durante la ventilación mecánica monótona 9 .
Como hipótesis de este trabajo se planteó que las alteraciones del intercambio gaseoso pueden ser reducidas mediante maniobras de reclutamiento pulmonar que no interfieran con la dinámica cerebral durante la neurocirugía, como las insuflaciones pulmonares manuales breves y los suspiros mecánicos automáticos periódicos, a pesar de la ventilación con FIO2 1 y sin PEEP.
Objetivo
El objetivo de este estudio fue determinar si las maniobras de insuflación pulmonar manual y/o automática reducen las alteraciones del intercambio gaseoso pulmonar durante la neurocirugía prolongada.
Material y Método
Se realizó un estudio prospectivo, aleatorio y controlado de 27 pacientes, coordinados para neurocirugía en decúbito dorsal o ligeramente lateralizados, con una duración de la anestesia y cirugía previstas mayor a las 3 horas. Este trabajo fue realizado en el Hospital de Clínicas Dr. Manuel Quintela, Montevideo, Uruguay, en el transcurso del año 2005.
Se excluyeron a todos los pacientes intervenidos en decúbito ventral, sentados, o “park bench”, los procedimientos neuroquirúrgicos de duración habitual menor a las 3 horas, y cuando fue necesario premedicar a los pacientes.
Se obtuvo el consentimiento informado antes de ingresar a sala de operaciones. El procedimiento empleado estuvo pautado en los aspectos éticos, en base a la Declaración de Helsinki de 1975 en la versión revisada de 1983 y 1996.
Una vez en sala de operaciones se colocó la monitorización estándar inicial (electrocardiograma, presión arterial no invasiva, oxímetro de pulso).
Previo a la inducción anestésica se colocó una vía arterial radial calibre 20 G con anestesia local, y se extrajo la primera gasometría arterial con el paciente ventilando espontáneamente al aire (VEA). Luego se conectó el sistema de registro de la presión arterial invasiva para la medida continua de la presión arterial sistólica, diastólica y media, que se mantuvo durante toda la cirugía.
Se realizó una técnica anestésica estándar para neurocirugía: Inducción con tiopental a dosis tituladas de 3-5 mg/kg; relajación muscular para la intubación y mantenimiento con un bolo inicial de 0,6 mg/kg de atracurio y luego una infusión continua de 0,5 mg • kg-1 • hora-1; analgesia en base a fentanil, con un bolo depreinducción de 2-3 µg/kg, más una infusión continua de 2-4 µg • kg-1 • hora-1; como agente inhalatorio se utilizó isoflurano a 0,5-1 CAM (concentración alveolar mínima).
La fracción inspirada de oxígeno (FIO2) en condiciones basales fue la atmosférica (0,21). Durante la anestesia se usó una FIO21 (100%) debido a que la máquina de anestesia no permitía la mezcla con aire. En el postoperatorio en Sala de Recuperación Postanestésica, en los pacientes ventilando espontáneamente con máscara de flujo libre se consideró la FIO2 como 0,4, y en los ventilados se utilizó 0,5-1 según el caso.
Luego de la intubación se conectó el ventilador con los parámetros pautados y el capnógrafo. Se colocó una vía venosa central yugular derecha en todos los casos, realizándose medidas seriadas de presión venosa central (PVC), sonda vesical para control de diuresis, y termómetro esofágico.
Se registró la cantidad y calidad de la reposición, el sangrado, y las dosis de los fármacos. Todos los pacientes fueron ventilados con una máquina de anestesia Datex – Ohmeda Model 7000 Excel 110 SE, que fue chequeada sistemáticamente antes del inicio de cada anestesia, aceptándose una fuga máxima de 50 ml/min. El flujo de gas fresco seleccionado para todos los casos fue de 2 litros/minuto.
El volumen corriente (VC) al inicio de la anestesia fue de 10 ml/kg, la frecuencia respiratoria (FR) de 10/min, y la relación inspiración–espiración (I:E), de 1:2. Los parámetros fueron ajustados según la presión en vía aérea (menor de 30 cmH2O), capnografía, gasometría y estado del cerebro. En los casos en los que fue necesario ajustar el patrón ventilatorio, se mantuvo el mismo volumen corriente, y se aumentó o redujo la frecuencia respiratoria.
Los pacientes fueron aleatorizados en 3 grupos:
-
Grupo C (control): VC y FR con las características mencionadas.
-
Grupo SM: VC y FR basal, más un ciclo horario de 3 insuflaciones manuales con la Bolsa Reservorio, llevando la presión en la vía aérea a 30 cmH2O, manteniéndola durante 10 segundos y permitiendo luego la espiración pasiva sin PEEP.
-
Grupo SA: VC y FR basal más suspiro automático de la máquina de anestesia. El suspiro automático de esta máquina de anestesia aporta un 150% del VC, se repite cada 64 respiraciones, con un límite de presión en vía aérea de 30 cmH2O, y un volumen máximo de 1,5 litros.
Se confeccionó una planilla para registro de todos los datos intraoperatorios y gasometrías arteriales a intervalos preestablecidos hasta las 2 horas del postoperatorio.
Las gasometrías fueron extraídas de la vía arterial, luego de haber descartado 10 ml de sangre para evitar la contaminación de la muestra con el suero fisiológico heparinizado de lavado.
El orden de extracción de las gasometrías fue el siguiente:
-
Gasometría basal: previa a la administración de drogas anestésicas, e inmediatamente luego de colocada la vía arterial, con el paciente en decúbito dorsal, ventilando espontáneamente al aire.
-
A los 30 minutos de la intubación traqueal con ventilación controlada.
-
A las 2, 4 y 6 horas luego de la intubación.
-
A las 2 horas luego de ingresar el paciente a Sala de Recuperación Postanestésica (SRPA) o Unidad de Cuidados Intensivos (UCI), con el paciente ventilando espontáneamente con máscara de flujo libre, o intubado y ventilado cuando fue necesario.
Se calculó la presión alveolar de oxígeno (PAO2) a partir de la ecuación del gas alveolar:
PAO2= FIO2 x (Pb- PH2O) – PACO2 R
Pb = presión barométrica.
PH2O = presión del vapor de agua a 37 ºC (usualmente se asume en 47 mmHg).
PACO2= medida de la PCO2 alveolar (se asume que debe ser igual a la PCO2 arterial).
R = índice de intercambio respiratorio o cociente respiratorio.
El índice de intercambio gaseoso (R), en condiciones estables suele ser menor de 1, dado que se consume más O2 (VO2) que el CO2 (VCO2) que se produce. Se acepta que dicho valor es de 0,8, y es el que se utilizó para el cálculo de la PAO2. Se determinó el índice PaO2/PAO2, y PaO2/FIO2 (PaFIO2). Los resultados se expresaron como promedios y desviación estándar (DE).
El análisis estadístico de los datos se realizó utilizando el programa Microsoft® Excel 2002, y se utilizó la prueba T de Students para variables continuas, independientes y con distribución normal para analizar las diferencias entre los grupos, y la misma prueba pero para variables dependientes para valorar los cambios dentro de cada grupo.
Se compararon los resultados de cada grupo con respecto a los valores basales, cada grupo con respecto al control, y el grupo SM con el SA. Se eligió como nivel de significación un valor de p < 0,05.
Resultados
No se encontraron diferencias entre los grupos en cuanto a edad, sexo, peso, talla, estado físico según ASA, y antecedentes personales. Estos resultados se muestran en la Tabla 1.
Tabla 1 Características de los pacientes estudiados. Se muestran promedios y resultados de la comparación entre los 3 grupos (valor de p)
|
Grupo |
Control (C) |
Suspiro Manual (SM) |
Suspiro Automático (SA) |
Prueba de T |
||
|
C -SM |
C – SA |
SM – SA |
||||
|
Edad |
49 ± 15 |
51 ± 15 |
47 ± 13 |
0,75 |
0,83 |
0,59 |
|
Peso |
68,7 ± 10,7 |
74,3 ± 10,6 |
75,6 ± 10,4 |
0,27 |
0,18 |
0,81 |
|
Altura |
1,65 ± 0,05 |
1,65 ± 0,12 |
1,69 ± 0,11 |
0,94 |
0,54 |
0,62 |
|
ASA |
2,4 ± 0,5 |
2,4 ± 0,5 |
2,3 ± 0,5 |
1,00 |
0,65 |
0,65 |
|
Sexo masculino |
5 |
5 |
5 |
Prueba de Fisher |
||
|
Sexo femenino |
4 |
4 |
4 |
0,68 |
0,68 |
0,68 |
|
Tabaquismo |
4 |
3 |
2 |
0,5 |
0,31 |
0,5 |
|
Obesidad |
1 |
1 |
0,5 |
0,5 |
0,76 |
|
Aunque invariablemente hubo alteraciones del intercambio gaseoso, independientemente del método de ventilación empleado, los resultados no mostraron diferencias significativas entre los 3 grupos estudiados en los índices de intercambio gaseoso analizados: PaFIO2, PaO2/PAO2, y DA-a O2.
En la Tabla 2 se muestra el valor promedio y el desvío estándar del PaFIO2 (PaO2/FIO2), de la relación PaO2/PAO2, y la DA-aO2 para los diferentes momentos estudiados, extraídos a partir de las gasometrías. Estos promedios se ilustran en los Gráficos 1, 2 y 3, en los que se pueden apreciar los cambios a lo largo del tiempo de los índices calculados. El Gráfico 1 muestra que no hubo grandes modificaciones del PaFIO2 con respecto a los valores basales y al resultado en RPA. Se compararon los valores de PaFIO2 a las horas 0,5-2-4-6 y en RPA con respecto al basal, y entre sí, siendo no significativa la diferencia (p > 0,05). En los gráficos 2 y 3 se ven los resultados de la PaO2/PAO2 y la DA-aO2, respectivamente. En los mismos se evidencian las alteraciones del intercambio gaseoso, con un descenso del índice PaO2/PAO2 y un aumento de la DA-aO2 a los 30 minutos y 2 horas, con una diferencia significativa (p < 0,05) con respecto a los valores basales. La DA-aO2 aumenta a los 30 minutos de iniciada la anestesia y se mantiene constante hasta la RPA, donde disminuye, pero no retorna a los valores basales.
Tabla 2 Resultados del cálculo del PaFIO2, índice PaO2/PAO2 y DA-aO2. Se muestran los valores promedios y el desvío estándar
|
Tiempo |
Grupo |
N |
PaFIO2 ± DE (mmHg) |
PaO2/PAO2 ± DE |
DA-aO2±DE (mmHg)
|
|
0 |
C |
8 |
398,1 ± 85,6 |
0,8 ± 0,2 |
16,4 ± 19,8 |
|
SM |
9 |
412,5 ± 4,8 |
0,8 ± 0,1 |
26,6 ± 24,2 |
|
|
SA |
7 |
469,4 ± 126,2 |
0,9 ± 0,2 |
6,9 ± 20,4 |
|
|
30 min |
C |
8 |
435,7 ± 41,2 |
0,7 ± 0,1 |
228,2 ± 40,5 |
|
SM |
9 |
381,5 ± 94,7 |
0,6 ± 0,1 |
281,5 ± 94,0 |
|
|
SA |
9 |
387,5 ± 101,9 |
0,6 ± 0,2 |
279,7 ± 100,3 |
|
|
120 min |
C |
9 |
442,3 ± 26,6 |
0,7 ± 0,0 |
224,0 ± 25,3 |
|
SM |
9 |
386,8 ± 114,5 |
0,6 ± 0,2 |
280,2 ± 111,8 |
|
|
SA |
9 |
411,6 ± 84,3 |
0,6 ± 0,1 |
258,3 ± 89,3 |
|
|
240 min |
C |
7 |
443,3 ± 63,0 |
0,7 ± 0,1 |
226,4 ± 62,6 |
|
SM |
8 |
405,2 ± 116,2 |
0,6 ± 0,2 |
271,1 ± 124,2 |
|
|
SA |
6 |
404,9 ± 65,7 |
0,6 ± 0,1 |
263,2 ± 66,9 |
|
|
360 min |
C |
2 |
433,9 ± 72,3 |
0,6 ± 0,1 |
239,5 ± 61,7 |
|
SM |
4 |
410,0 ± 91,3 |
0,6 ± 0,1 |
262,0 ± 94,2 |
|
|
SA |
2 |
420,0 ± 63,7 |
0,6 ± 0,1 |
252,7 ± 67,5 |
|
|
RPA |
C |
8 |
412,7 ± 97,3 |
0,7 ± 0,2 |
136,2 ± 149,1 |
|
SM |
8 |
379,4 ± 122,6 |
0,6 ± 0,2 |
128,7 ± 138,8 |
|
|
SA |
9 |
435,3 ± 169,7 |
0,7 ± 0,3 |
83,9 ± 123,4 |
|
|
C = Grupo Control. SM = Suspiro manual. SA = Suspiro automático. PaFIO2 = Índice Presión alveolar de oxígeno / fracción inspirada de oxígeno. PaO2/PAO2 = Índice Presión arterial de oxígeno / presión alveolar de oxígeno. DA-aO2 = Diferencia alvéolo arterial de oxígeno. DE = desvío estándar. RPA = Recuperación Postanestésica. PaFIO2 = Índice Presión alveolar de oxígeno / fracción inspirada de oxígeno. |
|||||
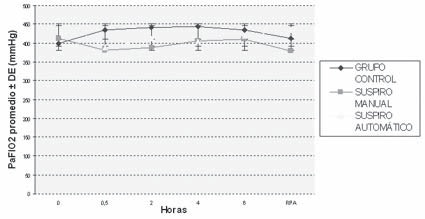
Gráfico 1 Evolución del PaFIO2 a lo largo de la anestesia. PaFIO2 = Presión arterial / fracción inspirada de oxígeno; RPA = Sala de Recuperación Postanestésica; DE = Desvío Estándar. En este gráfico se muestran las variaciones de la PaFIO2 como valores promedio y desvío estándar, desde el momento de inicio de la anestesia hasta las 2 horas posteriores a la llegada a la Sala de Recuperación Postanestésica. Como se puede apreciar en el mismo, son varios los puntos de cruce entre una y otra curva.
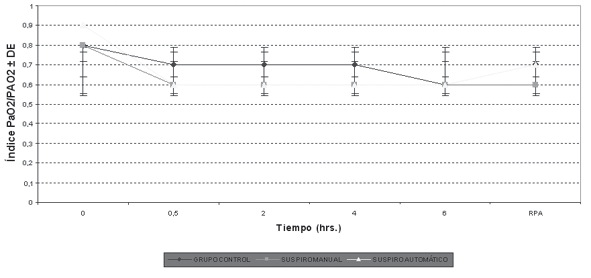
Gráfico 2 Modificaciones del índice PaO2 durante la cirugía. PaO2/PAO2 = Índice Presión arterial de oxígeno / presión alveolar de oxígeno; DE = Desvío Estándar; RPA = Recuperación Postanestésica. En este gráfico se puede ver la caída del índice PaO2/PAO2 luego de los primeros 30 minutos de anestesia, con una evolución similar para los 3 grupos.
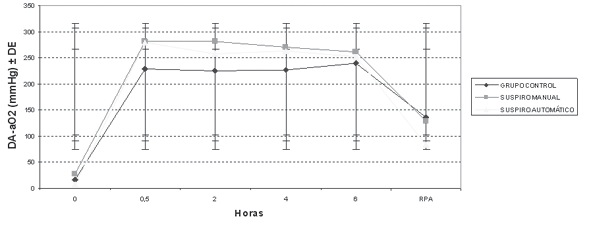
Gráfico 3 Da – aO2 promedio para los diferentes momentos registrados. DA-aO2 = Diferencia alvéolo arterial de oxígeno; DE = Desvío Estándar; RPA = Recuperación Postanestésica. Este gráfico se ilustra muy claramente el deterioro en el intercambio gaseoso que ocurre durante la ventilación mecánica. Desde el tiempo 0 (gasometría basal) a los 30 minutos hay un aumento significativo (p < 0,05 en los 3 grupos) y que permanece estable entre los 30 minutos y 6 horas, para recuperarse en la Sala de Recuperación Postanestésica.
En el postoperatorio hubo 4 pacientes que requirieron asistencia ventilatoria (por causas neuroquirúrgicas): 2 en el Grupo C y 2 en el Grupo SM. Los 2 pacientes del Grupo C fueron ventilados con FIO2 1; un paciente del Grupo SM fue ventilado con FIO2 1 y el otro con FIO2 0,5.
En 2 pacientes (1 del Grupo C, y 1 del Grupo SA) no se logró colocar la vía arterial rápidamente, por lo que se optó por proceder con la inducción anestésica y colocarla después de la intubación. En un paciente del grupo SA, la gasometría arterial fue informada como coagulada. Por lo tanto, no se contó con los valores basales en estos 3 pacientes.
En la tabla 2 se señala el número de muestras que se obtuvo en cada grupo en las diferentes horas. Los registros gasométricos que faltan fueron por omisión (en un caso), y a partir de la cuarta hora por finalización de la cirugía.
A las 2 horas de finalizada la cirugía se perdieron 2 pacientes, uno en el grupo C, y otro en el grupo SM, por diferentes razones.
Discusión
Los resultados de la muestra de pacientes estudiada no mostraron diferencias significativas en los índices de intercambio gaseoso analizados: PaFIO2, PaO2/PAO2, y DA-a O2 entre los 3 grupos, por lo que no se pudo demostrar que las maniobras realizadas (suspiro manual o automático de la máquina de anestesia) determinen una mejora en el intercambio gaseoso de los pacientes con respecto al grupo control.
Si bien hay numerosos estudios sobre las alteraciones del intercambio gaseoso durante la anestesia y cirugía, no encontramos trabajos que investiguen estas alteraciones durante la neuroanestesia específicamente. Como sabemos, en toda cirugía abdominal y/o torácica se presentan factores vinculados a la cirugía que pueden producir y/o aumentar las alteraciones ventilatorias y/o del intercambio gaseoso, determinadas por el apoyo sobre el abdomen y/o tórax por parte de los cirujanos, o a que directamente están trabajando sobre las estructuras intratorácicas 11 ,15–16 . Esta fue una de las razones por las que se descartó para este estudio este tipo de cirugías, y se seleccionó la neurociugía, dado que el propósito del mismo fue evaluar las alteraciones del intercambio vinculadas sólo a la ventilación mecánica, y la anestesia.
Otro factor, a nuestro criterio muy importante para realizar este estudio, fue la necesidad de reevaluar la utilización de máquinas de anestesia que no tengan la posibilidad de mezcla con aire. Como confirma la mayor parte de la bibliografía, las maniobras de reclutamiento alveolar no tienen efecto sostenido cuando se utiliza FIO2 1, y las atelectasias por reabsorción están siempre presentes y pueden alterar de manera importante el intercambio gaseoso. En nuestro medio, la mayor parte de las máquinas de anestesia (como la que se utilizó en el estudio) tienen como única forma de reducir la FIO2 el usar mezclas con óxido nitroso, y no tienen la capacidad de aportar un nivel significativo y/o modificable de PEEP. Por lo tanto, cuando no se quiere o puede usar óxido nitroso por factores del paciente o de la cirugía, la única opción que permiten es usar 100% de oxígeno.
Las modificaciones de los índices estudiados que se produjeron durante la anestesia en este grupo de pacientes nos muestran que invariablemente hubo alteraciones del intercambio gaseoso, independientemente del método de ventilación empleado. Estos hallazgos confirman las investigaciones previas al respecto, y las repercusiones propias de la anestesia y ventilación mecánica con FIO2 1 1 –5 . Luego del inicio de la anestesia, rápidamente se produjo un aumento de la DA-aO2 y una disminución del índice PaO2/PAO2 como traducción de la alteración del intercambio gaseoso. A los 30 minutos, y a las 2 horas, los cambios fueron significativos (p < 0,05) para los 3 grupos con respecto a la gasometría inicial. A las 4 horas, la DA-aO2 continuó manteniendo una elevación significativa con respecto a la gasometría inicial en los 3 grupos. A las 6 horas, en el grupo SA el aumento no fue significativo (p > 0,05), pero sí en los grupos C y SM. El número de pacientes que siguieron anestesiados a las 6 horas fue escaso, y sólo 2 pacientes en el grupo SA, lo que explica que siendo similares los valores promedio con respecto a las 4 horas, no haya dado una diferencia significativa.
A las 2 horas de llegado el paciente a la SRPA, la DA-aO2 y el índice PaO2/PAO2 mostraron cambios significativos con respecto a los basales en el grupo C y en el grupo SM, pero no en el grupo SA. Este resultado, aunque no concluyente, podría sugerir que en el grupo SA la alteración V/Q (ventilación/perfusión) haya sido menor. Sin embargo, si bien la DA-aO2 promedio fue menor en el grupo SA, la diferencia no fue significativa con respecto a los otros 2 grupos. Además, este grupo fue el que tuvo menor número de pacientes con cirugías que superaron las 4 horas.
Una de las mayores limitantes de este estudio fue que el número de pacientes de la muestra fue bajo, y no se contó con un grupo similar de pacientes ventilados con FIO2 menores, con y sin diferentes niveles de PEEP, para valorar la efectividad de las maniobras de reclutamiento alveolar estudiadas en diferentes condiciones. Sin embargo, se estudió un grupo muy seleccionado en cuanto a características personales y tipo de cirugía, y los resultados obtenidos fueron muy similares.
Numerosos estudios demuestran que la presencia de atelectasias postoperatorias se correlaciona con alteraciones de la relación V/Q y shunt intrapulmonar 6 ,7,10–12 , por lo que se puede plantear que en este estudio los mecanismos responsables de la alteración del intercambio gaseoso hayan sido los mismos.
La pérdida del tono muscular, producto del efecto de los relajantes musculares y agentes inhalatorios, determina la disminución de la capacidad residual funcional y aumento del volumen de cierre, lo que brinda las condiciones ideales para el desarrollo de atelectasias 13 , 14 . La investigación de las causas del deterioro del intercambio gaseoso, si bien es muy importante, no fue parte de los objetivos de este estudio, que estuvo dirigido fundamentalmente a evaluar las repercusiones gasométricas con implicancias clínicas.
Un elemento que interesa señalar es que si bien a los 30 minutos, 2, 4 y 6 horas hubo un deterioro significativo del intercambio gaseoso manifestado por los cambios de la Da-aO2 y el índice PaO2/PAO2 con respecto al valor basal, no hubo cambios significativos entre los 30 minutos y las 6 horas. Esto nos permite plantear que a pesar de la duración de la anestesia, el deterioro que se produjo en los primeros minutos se mantuvo en niveles similares y no fue progresivo. Este aspecto es uno de los hallazgos más interesantes de la investigación, que nos deja interrogantes en cuanto al papel que juega el cambio de las presiones pulmonares y el efecto de los anestésicos, y por otro lado, las atelectasias por reabsorción por FIO2 1. Si comparamos estos resultados con el estudio de Joyce y Williams sobre la cinética de las atelectasias de reabsorción durante la anestesia 15 , vemos un modelo similar, que correlaciona la producción de las mismas a la FIO2 1, y un tiempo de aparición menor a los 30 minutos en estas condiciones.
En el control postoperatorio en SRPA, hay una clara recuperación de la DA-aO2, que es significativa en los 3 grupos con respecto a los 30 minutos y las 2 horas. En los grupos SM y SA también hubo una recuperación significativa de la DA-aO2 con respecto a las 4 horas.
A pesar la DA-aO2 y el índice PaO2/PAO2 se modificaron como señal de alteración del intercambio gaseoso, el PaFIO2 mantuvo niveles adecuados en los 3 grupos durante todos los momentos del estudio. La interpretación de este evento no puede ser realizado de manera aislada, y deben considerarse varios factores, como ser que se trató de pacientes con pulmones sanos; en todos los casos la máquina de anestesia aportó una PEEP mínima no modificable, de 4 cmH2O y el volumen corriente administrado fue elevado (10 ml/kg).
En el grupo SM, cuando la insuflación coincidió con la hora de extracción de la gasometría, primero se obtuvo la muestra de sangre arterial y luego se realizaron las insuflaciones manuales. El motivo de seguir esta secuencia fue para evitar que los resultados fueran consecuencia de un efecto transitorio e inmediato de esta maniobra.
Los estudios de reclutamiento alveolar en pacientes con distress respiratorio encontraron que las maniobras de reclutamiento alveolar no tienen efecto sostenido si se ventila con FIO2 de 1 y no se coloca una PEEP significativa 10 ,12,16–24. Sin embargo, el estudio de Pelosi et al 25 , no encontró una mejora en la función respiratoria en pacientes normales anestesiados con la utilización de PEEP. A pesar de estos elementos, los valores hallados de PaO2 y PaFIO2 fueron elevados, dentro de los valores esperados (“normales”), y no hubo que excluir ningún paciente del estudio por presentar alteraciones del intercambio gaseoso que ameritaran algún tipo de maniobra adicional.
Conclusiones
En los 3 grupos de pacientes estudiados se produjeron modificaciones significativas en la DA-aO2 y el índice PaO2/PAO2 con respecto al estado basal, indicando la aparición de alteraciones del intercambio gaseoso durante la anestesia.
Las alteraciones del intercambio gaseoso aparecieron a los pocos minutos del inicio de la anestesia, no fueron progresivas a lo largo de la misma, y revirtieron parcialmente en el postoperatorio.
En esta muestra de pacientes ventilados con FIO2 1 y sin PEEP, las insuflaciones manuales, así como el uso del suspiro automático de la máquina de anestesia no fueron efectivos para reducir las alteraciones del intercambio gaseoso con respecto al grupo control.
Agradecimientos: A todos los que colaboraron con la recolección de datos: Dra. Marta Surbano, Dra. Alejandra Karadjian, Dra. Graciela Rodríguez, Dra. Ivana Prestes, Dra. Teresita Barrios, Dra. Marcela
Cerizola, Dr. Juan Pablo Bouchacourt.
Bibliografía
-
Wagner PD, Dueck R. Mechanisms of abnormal gas exchange during anesthesia. Int J Clin Monit Comput. 1984; 1: 59-71.
-
Mutch WA, Eschun GM, Kowalski SE, et al. Biologically variable ventilation prevents deterioration of gas exchange during prolonged anaesthesia. Br J Anaesth 2000; 84: 197-203.
-
Ocampo BT. Cuidado respiratorio perioperatorio. Evaluación preoperatoria y preparación para la cirugía. Rev Col Anest 1995; 23: 237-41.
-
Domínguez JG, García De La Vega FJ, Maldonado A. Ventilación Mecánica en Anestesia. Rev Anest Méx. 1996; 8: 213-20.
-
Rothen HU, Sporre B, Engberg G, et al. Airway closure, atelectasis and gas exchange during general anaesthesia. Br J Anaesth 1998; 81: 681-6.
-
Cruz JD. Fisiología respiratoria aplicada en la práctica de anestesia. Rev Col Anest 1993; 21: 129-33.
-
Rothen HU, Sporre B, Engberg G, et al. Re-expansion of atelectasis during general anaesthesia: a computed tomography study. Br J Anaesth 1993; 71: 788-95.
-
Baz M, Neme J, Briva A, et al. Insuficiencia respiratoria. En: Fi-siopatología. Mecanismos de las disfunciones orgánicas. Prof. Dr. Héctor Píriz. Oficina del Libro de la Facultad de Medicina. FEFMUR. Montevideo, 2006; 9: 265-89.
-
Girling KJ. New developments in anaesthesia for neurological surgery. Curr Opin Anaesthesiol 2000; 13: 503-7.
-
Coussa M, Proietti S, Schnyder P, et al. Prevention of Atelectasis Formation During the Induction of General Anesthesia in Morbidly Obese Patients. Anesth Analg 2004; 98: 1491-5.
-
Hedenstierna G. Alveolar collapse and closure of airways: regular effects of anaesthesia. Clin Physiol and Funct Imag. 2003; 23: 123-9.
-
Tokics L, Hedenstierna G, Strandberg A, et al. Lung collapse and gas exchange during general anesthesia: effects of spontaneous breathing, muscle paralysis, and positive end-expiratory pressure. Anesthesiology 1987; 66: 157-67.
-
Parker JC, Hernández LA, Peevy KJ. Mechanism of ventilator-induced lung injury. Crit Care Med 1993; 21: 131-43.
-
Oczenski W, Hörmann C, Keller C, et al. Recruitment Maneuvers after a Positive End-expiratory Pressure Trial Do Not Induce Sustained Effects in Early Adult Respiratory Distress Syndrome. Anesthesiology 2004; 101: 620-5.
-
Joyce CJ, Williams AB. Kinetics of absorption atelectasis during anesthesia: a mathematical model. J Appl Physiol 1999; 86: 1116-25.
-
Tusman G, Bohn SH, Vázquez de Anda GF, et al. Alveolar recruitment strategy improves arterial oxygenation during general anaesthesia. Br J Anaesth 1999; 82: 8-13.
-
Neuman P, Rothen HU, Bergland JE, et al. Positive end-expiratory pressure prevents atelectasis during general anaesthesia even in the presence of a high inspired oxygen concentration. Acta Anaesthesiol Scand. 1999; 43: 295-301.
-
Rothen HV, Sporre B, Engberg G et al. Prevention of atelectasis during general anaesthesia. Lancet 1995; 345: 1387-91.
-
Rothen HV, Sporre B, Engberg G et al. Influence of gas composition on recurrence on atelectasis after a reexpansion maneuver during general anesthesia. Anesthesiology 1995; 82: 832-42.
-
Hedenstierna G, Rothen H. Atelectasis formation during anesthesia: causes and measures to prevent it. J Clin Monit Comput 2000; 16: 329-35.
-
Rothen HU, Neuman P, Berlung JE, et al. Dynamics of re-expansion of atelectasis during general anesthesia. Br J Anaesth. 1999; 82: 551-6.
-
Brismar B, Hedenstierna G, Lundquist H, et al. Pulmonary densities during anesthesia with muscular relaxation- a proposal of atelectasis. Anesthesiology 1985; 62: 422-8.
-
Grasso S, Mascia L, Del Turco M, Malacame P, Giunta F, Brochard L, et al. Effects of recruiting maneuvers in patients with acute respiratory distress syndrome ventilated with protective ventilatory strategy. Anesthesiology 2002; 96(4): 795-802.
-
Goddon S, Fujino Y, Hromi J, Kacmarek R. Optimal mean airway pressure during high_frequency oscillation. Anesthesiology 2001; 94: 862-9.
-
Pelosi P, Ravagnan I, Giurati G et al. Positive end-expiratory pressure improves respiratory function in obese but not in normal subjects during anesthesia and paralysis. Anesthesiology 1999; 91: 1221-31.


 Creative Commons Attribution
Creative Commons Attribution