Ricardo Bustamante B. 1
Rev Chil Anest Vol. 40 4 pp. 316-334|doi:
PDF|ePub|RIS
Las reacciones adversas son reconocidas como una de las causas más comunes de muerte en la práctica médica 1 . Durante el acto anestésico se usan muchas drogas que pueden provocar reacciones adversas, ya sea relacionadas con sus propiedades farmacológicas y generalmente dosis dependientes, o no relacionadas con ellas y menos dependientes de la dosis, por lo que en los últimos años se ha puesto énfasis en las reacciones que ocurren en el período perioperatorio. Estas reacciones incluyen intolerancia a las drogas, reacciones idiosincráticas, alergia inducida por drogas mediada inmunológicamente y alergia inducida por drogas no mediada inmunológicamente 2 .
En la actualidad es un hecho indiscutible que, en los adultos, las reacciones alérgicas perioperatorias son más frecuentes a los bloqueadores neuromusculares (BNM) que a otros productos usados en anestesia 3 . Aunque antiguamente, algunas reacciones más leves eran atribuidas a los efectos farmacológicos y podían ser prevenidas con antihistamínicos, hoy por hoy está claro que la mayoría de estas reacciones son inmunológicas, mediadas por IgE específicas, para las que no existe ninguna premedicación eficaz.
Terminología
Hace algunos años, se propuso que todas las manifestaciones clínicas que constituyen el cuadro conocido como anafilaxia, deberían ser llamadas “reacciones anafilactoídeas”, a menos que se hubiera demostrado un mecanismo inmunológico. Esta proposición fue muy atractiva, porque enfatizaba la importancia clínica de realizar un adecuado reporte y diagnóstico después del evento. Sin embargo, se trataba de una sobre simplificación y los términos anafiláctico y anafilactoídeo fueron usados inconsistentemente en la literatura, ocasionando una gran confusión.
Debido a la gran cantidad de terminología, y al avance de la inmunología clínica, en 2003, el Comité de Revisión de Nomenclatura de la WAO (World Allergy Organization) 4 , propuso una actualización de la terminología aceptada hasta entonces por la EAACI (European Academy of Allergy and Inmunology) 5 , haciendo un intento por uniformar términos poco claros y heterogéneos. Desde entonces, las reacciones de tipo anafiláctico deben ser reclasificadas en anafilaxias alérgicas y no alérgicas. A su vez, las reacciones anafilácticas alérgicas se subclasifican en mediadas por IgE y no mediadas por IgE. Aunque esta terminología, no ha sido universalmente aceptada 6 , los anestesiólogos no podemos marginarnos de su utilización.
La anafilaxia es una reacción de hipersensibilidad severa, generalizada o sistémica que pone en riesgo la vida. Debe usarse el término anafilaxia alérgica cuando la reacción es mediada por un mecanismo inmunológico (generalmente por IgE como es el caso de los BNM, pero excepcionalmente por IgG, que producen complejos inmunes con el antígeno y activan el complemento, como el caso de los dextranos) 7 . Tanto la anafilaxia alérgica como la no alérgica son el resultado de la liberación de mediadores preformados y nuevamente sintetizados en mastocitos y basófilos. Una anafilaxia derivada de cualquier otra causa que no sea inmunológica debe denominarse anafilaxia no alérgica, y evitar antiguos términos como reacción seudoalérgica o anafilactoídea.
El mecanismo preciso de la anafilaxia no alérgica o liberación directa de histamina no está completamente dilucidado, pero no implica un mecanismo inmunológico, y, por lo tanto, no necesita un contacto previo con la sustancia involucrada. Se considera generalmente una estimulación farmacológica directa de mastocitos y basófilos, que libera mediadores inflamatorios, especialmente histamina, de una manera dosis-dependiente 8 ,9 . La respuesta clínica de esta anafilaxia no alérgica es generalmente más suave, aunque hay individuos que son desproporcionadamente susceptibles. En la anafilaxia alérgica que involucra anticuerpos IgE, el antecedente de contacto previo tampoco es necesario, y la sensibilización puede producirse por sustancias cruzadas, como ocurre especialmente en el caso de los BNM.
Incidencia
La tasa exacta de anafilaxia en anestesia es difícil de estimar; la incidencia es diferente en los diferentes países. La mayoría de la información proviene de reporte de casos y estudios retrospectivos en lugares con prácticas clínicas diferentes y desigual prolijidad de los registros. En Chile no hay datos publicados.
Durante el período perioperatorio la mortalidad del total de reacciones anafilácticas es de un 3% a un 9% de los casos 10 ,11,12 y un grupo adicional de un 2% de pacientes queda con daño neurológico significativo 13 .
Aunque hay diferencias, que se deben probablemente a las prácticas clínicas y sistemas de reporte, globalmente la incidencia es baja. De este modo, es probable que cada anestesista se encuentre sólo con pocos casos en el transcurso de su carrera, por lo que la rapidez con que se hace el diagnóstico clínico y lo apropiado del tratamiento no es muy uniforme.
La incidencia de anafilaxia a BNM puede ser determinada sólo calculando el número de casos de anafilaxia documentados alergológicamente (numerador), comparados con el número de pacientes que ha recibido BNM durante el mismo período (denominador).
El estudio mejor realizado en este sentido es el del Groupe d’Etudes des Réactions Anafilactoïdes Peranesthésiques (GERAP), que trata de evitar el sesgo derivado del sub-reporte de casos, mediante el método captura-recaptura 14 , basado en la correlación de dos fuentes diferentes de datos (en este caso, la base de datos del GERAP y la base de datos del Sistema Francés de Fármacovigilancia), con el propósito de identificar el número de casos. Con este método se estimó una incidencia de anafilaxia alérgica global de 1 en 10.060 anestesias (1 en 5.540 en mujeres y 1 en 15.490 en hombres). La incidencia estimada de anafilaxia a los BNM fue de 1 en 18.400 anestesias (1 en 10.550 en mujeres y 1 en 25.090 en hombres) 15 .
En Francia los niños menores de 10 años son responsables de un poco menos del 5% del total de anafilaxia peroperatoria. Un estudio prospectivo multicéntrico llevado a cabo entre 1991-92 en centros hospitalarios pediátricos franceses y belgas en 162.551 niños, demostró una incidencia de anafilaxia alérgica de 1 en 7.741 anestesias 16 . Un estudio posterior determinó una incidencia mucho mayor (1 en 2.100), pero la cifra está muy sesgada por cirugías múltiples (la mitad de los niños estudiados fueron operados entre 2 y 31 veces) y errores metodológicos 17 . No se reportan paros cardíacos en los niños.
Finalmente, un reciente reporte de Mertes, estimó la evolución de la incidencia de la anafilaxia alérgica cada 5 años, demostrando que es más baja en las edades extremas de la vida. En los adultos la incidencia es mayor en las mujeres que en los hombres y el grupo más afectado está entre los 40 y 49 años. Las hormonas sexuales podrían ser responsables de esta gran diferencia entre sexos, pues coincide con el período fértil de la mujer. En los niños no hay diferencias entre los sexos (50% cada uno) ni en el mecanismo de la reacción (45,9% alérgicas versus 54,1% no alérgicas) (Figura 1) 15 .
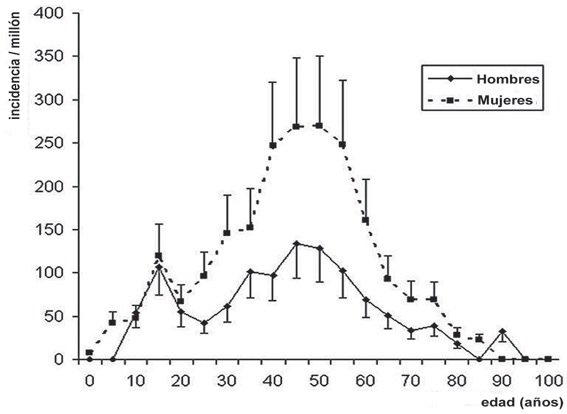
Figura 1 Incidencia de anafilaxia alérgica en Francia, de acuerdo a sexo y rangos de 5 años de edad, estimada mediante el método captura-recaptura 15 .
La mayor incidencia de anafilaxia alérgica a los BNM constituye una excepción, pues las moléculas pequeñas, como las usadas generalmente en anestesia, no son antigénicas por sí mismas, sino que necesitan una proteína transportadora para serlo. El grupo amonio cuaternario es responsable tanto del efecto bloqueador neuromuscular como de las propiedades alergénicas de la molécula; esta bivalencia de los BNM explica la liberación de mediadores que ocurre en un paciente sensibilizado, aun en ausencia de proteína transportadora 18 .
La anafilaxia a los BNM tiene particularidades dignas de destacar:
-
Hasta un 50% de estas reacciones ocurren después de la primera exposición, lo que es contradictorio con el mecanismo de anafilaxia.
-
Hay un fuerte predominio de las mujeres de 2:1 a 8:1.
-
Hay una alta incidencia de reacciones cruzadas entre los distintos BNM.
Sustancias responsables
Casi todas las drogas y sustancias usadas durante la cirugía y la anestesia, con la excepción de los agentes inhalatorios y las soluciones cristaloides, han sido reportadas como potencialmente causantes de anafilaxia 19 . Además, según los diferentes reportes, entre el 8% y el 73% de los pacientes sometidos a anestesia general presentan algún grado de liberación de histamina 20 ,21 .
Los BNM liberadores de histamina, como el mivacurio y el atracurio, están más relacionados con anafilaxia no alérgica y, por el contrario, la succinilcolina y los BNM aminoesteroides están más relacionados con anafilaxia alérgica.
A partir de los años 80, en Francia, Australia, Nueva Zelanda y el Reino Unido se ha desarrollado una intensa política de investigación alergológica sistemática en los pacientes con alergias perianestésicas. El GERAP, ha realizado 7 estudios cada dos años documentando la epidemiología de cerca de 5.000 reacciones anafilácticas con riesgo vital en Francia desde 1984. Esto ha permitido seguir la evolución del riesgo por más de 20 años.
El último reporte publicado en 2011 por el Mertes, abarca 2.516 casos estudiados entre los años 1997-2004 (que incluye pacientes de 3 encuestas anteriores del GERAP), de los cuales 1.816 casos son reacciones mediadas inmunológicamente (72,18% de anafilaxias alérgicas versus 27,82% de anafilaxias no alérgicas). Los agentes involucrados con la mayor incidencia de reacciones anafilácticas alérgicas perioperatorias, demostradas con exámenes de laboratorio son: los BNM (58%), el látex (19,6%) y los antibióticos (12,8%) (Figura 2) 15 .
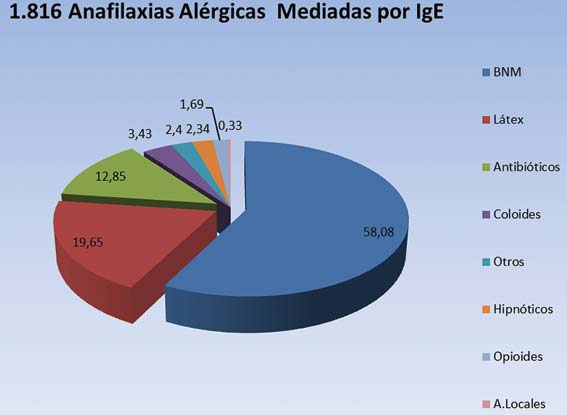
Figura 2 Sustancias implicadas en 1.816 anafilaxias alérgicas en el último reporte de Mertes, que comprende el período comprendido entre enero de 1997 a diciembre de 2004 en Francia. Los agentes más implicados en la última encuesta son los BNM, el látex y los antibióticos 15 .
Un antiguo reporte de la Sociedad Francesa de Anestesia Pediátrica determinó que en los niños el látex era la primera causa de anafilaxia alérgica perioperatoria (1 en 10.159 anestesias), en tanto que los BNM estaban raramente implicados (1 en 81.275) 22 . El más reciente estudio del GERAP confirma la supremacía del látex (42% de incidencia relativa), sin embargo, probablemente por el aumento de su uso en niños, los BNM adquieren la segunda posición (32%) y los antibióticos la tercera (9%) 15 . La distribución de la sensibilización de acuerdo con la edad es muy diferente para estas substancias: la sensibilización al látex se diagnostica a partir de los 2 años y su distribución permanece homogénea en los niños hasta llegar a la adolescencia, en que la anafilaxia a los BNM comienza a ser más frecuente.
Bloqueadores Neuromusculares
Los BNM pueden ser responsables de inducir dos tipos de reacciones: reacciones anafilácticas alérgicas, IgE dependientes, cuyos principales epítopes antigénicos son las estructuras de amonio cuaternario (NH4 +) y terciario (NH3 +)23 , y reacciones anafilácticas no alérgicas, especialmente relacionada con el grupo de las bencilisoquinolinas, producto de la estimulación no específica de los mastocitos 24 .
La incidencia de anafilaxia alérgica a los BNM es sorprendentemente diferente de un lugar a otro, pudiendo ser hasta 6 veces más frecuente en un país que en otro.
En Francia, aunque la incidencia relativa de los BNM ha tendido a disminuir en el transcurso del tiempo, probablemente por una indicación más selectiva en el uso de estos fármacos, a pesar de todo, en los 7 reportes del GERAP, la responsabilidad de los BNM en las anafilaxias alérgicas sigue siendo preponderante: entre el 54% y el 81% según el período observado. La disminución de la incidencia relativa de los BNM ha contribuido a aumentar la incidencia de reacciones a otros productos usados durante el acto quirúrgico: el látex (22,3%) y los antibióticos (14,7%).
Con el tiempo, la incidencia relativa entre los BNM ha ido cambiando en relación a la práctica anestesiológica; el mayor o menor uso de algunas drogas y la aparición u obsolescencia de otras, reflejando su uso en el mercado. Es así como en los últimos años se ha producido una desaparición de las reacciones anafilácticas a la galamina, una disminución de las reacciones anafilácticas a la succinilcolina y el vecuronio, y un aumento a drogas más recientemente incorporadas como el rocuronio (Figura 3-Tabla 1).
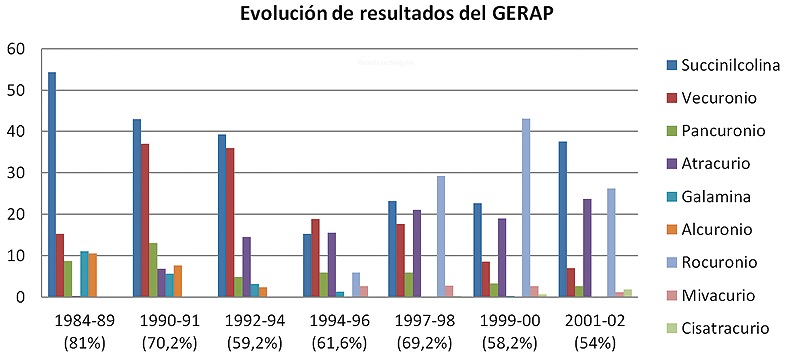
Figura 3 Evolución del porcentaje de incidencia relativa de reacciones anafilácticas a los BNM en Francia en los últimos años. Se señala el período estudiado y el porcentaje que corresponde a BNM entre paréntesis 25 , 26 , 27 , 28 , 29 , 30 , 31 .
Tabla 1 Incidencia relativa de reacciones anafilácticas de los diferentes BNM implicados según las 7 encuestas del GERAP. En la última encuesta, las mayores incidencias son para la succinilcolina, el rocuronio y el atracurio, pero esto debe ser correlacionado con su utilización en clínica 25 , 26 , 27 , 28 , 29 , 30 , 31
|
BNM |
1984 – 8925 n = 821 (%) |
1990 – 9126 n = 813 (%) |
1992 – 9427 n = 1.030 (%) |
1994 – 9628 n = 734 (%) |
1997 – 9829 n = 486 (%) |
1999 – 0030 n = 518 (%) |
2001 – 0231 n = 502 (%) |
| Succinilcolina |
54,3 |
43,0 |
39,3 |
15,3 |
23,2 |
22,6 |
37,6 |
| Vecuronio |
15,3 |
37,0 |
36,0 |
18,8 |
17,6 |
8,5 |
7,0 |
| Pancuronio |
8,7 |
13,0 |
4,8 |
5,9 |
5,9 |
3,3 |
2,6 |
| Atracurio |
0,2 |
6,8 |
14,5 |
15,5 |
21,1 |
19,0 |
23,7 |
| Galamina |
11 |
5,6 |
3,1 |
1,3 |
0 |
0,3 |
0 |
| Alcuronio |
10,5 |
7,6 |
2,3 |
0 |
0 |
0 |
0 |
| Rocuronio |
0 |
0 |
0 |
5,9 |
29,2 |
43,1 |
26,2 |
| Mivacurio |
0 |
0 |
0 |
2,6 |
2,7 |
2,6 |
1,1 |
| Cisatracurio |
0 |
0 |
0 |
0 |
0,3 |
0,6 |
1,8 |
El último reporte publicado en 2011 por Mertes, abarca 1.067 casos de anafilaxia alérgica a los BNM estudiados entre los años 1997-2004 (que incluye pacientes de 3 encuestas anteriores del GERAP). Los BNM más involucrados en reacciones anafilácticas alérgicas perioperatorias son: la succinilcolina (33,4%), el rocuronio (29,3%), el atracurio (19,3%) y el vecuronio (10,2%) (Figura 4) 15 .
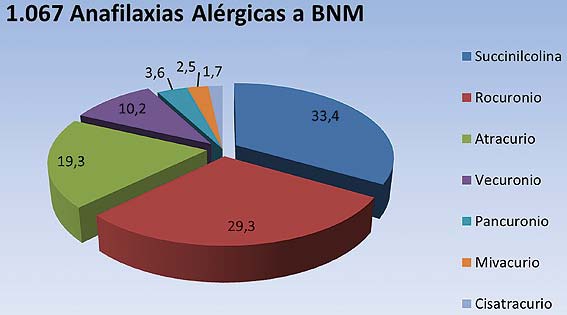
Figura 4 Incidencia relativa de anafilaxia alérgica entre los diferentes BNM, según el último reporte de Mertes, en 1.067 casos estudiados entre enero de 1997 y diciembre de 2004. Los agentes más implicados son: succinilcolina, rocuronio, atracurio y vecuronio 15 .
La incidencia debe ser interpretada teniendo en cuenta la utilización de los diferentes BNM en clínica. En Francia el atracurio es el BNM más utilizado (60%) y es responsable de sólo un 23% de los casos de anafilaxia alérgica; por el contrario, la succinilcolina que se usa poco (8%) es responsable del 37% de los casos y el rocuronio, que se usa menos aún (6,5%) contribuye con el 26% de la incidencia relativa 31 (Tabla 2). De este modo, Mertes y Laxenaire clasificaron a los BNM en 3 grupos de acuerdo a su potencialidad de desencadenar anafilaxia alérgica: uno de riesgo elevado (succinilcolina y rocuronio), uno de riesgo intermedio (vecuronio y pancuronio) y otro de bajo riesgo (atracurio, mivacurio y cisatracurio).
Tabla 2 Relación entre el uso de BNM en Francia y la incidencia de reacciones anafilácticas alérgicas en el bienio 2001-2002 31
|
Pacientes expuestos |
Reacciones anafilácticas |
|
|
(n = 5.721.172) % |
(n = 271) % |
|
| Atracurio |
60,3 |
23,7 |
| Cisatracurio |
14,7 |
1,8 |
| Succinilcolina |
8,2 |
37,6 |
| Rocuronio |
6,5 |
26,2 |
| Vecuronio |
4,9 |
7,0 |
| Pancuronio |
1,9 |
2,6 |
| Mivacurio |
3,5 |
1,1 |
| Total |
100% |
100% |
El aumento de la incidencia relativa de los BNM, especialmente en Francia, se basa en el estudio de las pruebas cutáneas, sin embargo, publicaciones bastante anteriores han demostrado que principalmente los BNM del grupo aminoesteroide, producen pruebas cutáneas falsas positivas 32 ,33 . Los umbrales de respuesta a las pruebas cutáneas no han sido claramente definidos, lo que puede producir resultados poco fidedignos. La ausencia de un acuerdo internacional para las diluciones de las intradermorreacciones y pruebas de escarificación, puede ser la causa de la gran diferencia de incidencia reportada en distintos centros.
En Australia en cambio, no se ha efectuado reportes cada dos años, sino que la base de datos es publicada en forma acumulativa y proviene de un solo centro diagnóstico, que involucra pacientes de Australia y Nueva Zelanda 34 . En este grupo, el 59% de los 1.600 pacientes estudiados corresponden a BNM, proporción que no difiere a los resultados en Francia.
Con sus resultados Fisher y Baldo hicieron una clasificación de los BNM tan arbitraria como la de Laxenaire y Mertes, de acuerdo a su potencialidad de desencadenar anafilaxia alérgica, pero que no es coincidente: un grupo de riesgo elevado (succinilcolina y d-tubocurarina), uno de riesgo intermedio (atracurio, cisatracurio, rocuronio y mivacurio) y otro de bajo riesgo (vecuronio y pancuronio).
En todo caso, con la excepción de los datos reportados en Dinamarca, en todos los estudios publicados en Australia, Nueva Zelanda, Reino Unido, Francia, Noruega, Bélgica y España, los BNM son el grupo más reportado como causa de anafilaxia durante la anestesia. En Dinamarca, hasta el año 2006 y estudiados sólo 56 pacientes, los opioides, los antibióticos y la clorhexidina eran los grupos más implicados, y los BNM sólo en un 8,7%, comparado con un 58% en Francia en 526 casos estudiados en ese bienio 35 . En Dinamarca, el BNM más implicado es el cisatracurio.
De este modo, existe una gran diferencia en las poblaciones, probablemente por factores ambientales que reaccionan cruzadamente más que por causas genéticas, pero la anafilaxia a los BNM sigue siendo una realidad, aunque con incidencia variable: como editorializa P. M. Mertes en Acta Anestesiológica “Este debe ser un incentivo en favor de recalcar la importancia de tratar el problema, en vez de debatir sobre su existencia” 36 .
La incidencia de reacciones no alérgicas a los BNM (no mediadas por IgE), representa entre un 20% y un 50% de las reacciones adversas a los BNM; un estudio reciente basado en los reportes de efectos adversos del Reino Unido demuestra que las reacciones no alérgicas ocurren casi con la misma frecuencia que las alérgicas 37 . El mecanismo preciso de las reacciones no mediadas por IgE es difícil de establecer, pero se presume que son el resultado de una activación directa e inespecífica de mastocitos y basófilos, que produce una liberación de histamina, generalmente menos severa que las reacciones mediadas por IgE. Los BNM que liberan histamina son del grupo de las bencilisoquinolinas: d-tubocurarina, atracurio y mivacurio (el cisatracurio no libera histamina en dosis clínicas), con la excepción del rapacuronio, que era del grupo aminoesteroide. Aunque el cisatracurio no libera histamina como el atracurio, su potencial anafiláctico alérgico no es proporcionalmente menor 38 . El atracurio tiene una incidencia de efectos secundarios graves por liberación de histamina de un 1% 39 .
-
• Rocuronio
Casi todos los estudios están de acuerdo en que la succinilcolina es el fármaco que produce una mayor incidencia relativa de anafilaxia en relación a los otros BNM. También hay más o menos acuerdo en que el pancuronio y el cisatracurio son los BNM que se asocian con menor frecuencia a anafilaxia intraoperatoria.
Por el contrario, existe una gran discrepancia en relación a la incidencia de reacciones anafilácticas por rocuronio. Mientras en Estados Unidos 40 ocurre en 1/445.000 anestesias, y es donde se usa el 80% de la droga que se produce en el mundo, en Francia es considerado un BNM de riesgo elevado y en Noruega se reporta en 1/3.500 anestesias (55 reacciones y 3 muertes en 4 años) 41 , lo que llevó incluso a intervenir a la autoridad noruega, recomendando la eliminación del rocuronio de la práctica rutinaria y su uso reservado para las intubaciones de urgencia. Los BNM en conjunto, dan cuenta de un 93,2% de las anafilaxias alérgicas en Noruega. Esta gran disparidad es muy difícil de explicar, especialmente porque no ocurre lo mismo en países con una carga genética similar, como Dinamarca o Suecia 42 .
La baja incidencia de anafilaxia alérgica al rocuronio en Estados Unidos, probablemente subvaluada, talvez se debe a que no existen allí estudios epidemiológicos serios de los posibles agentes causales de anafilaxia durante la anestesia, ni menos un estudio específico de los BNM. En lugar de eso, los datos se obtienen de reportes voluntarios de efectos adversos a drogas de la Food and Drug Administration (FDA). Además, no existe ninguna estandarización de las pruebas de intradermorreacción, por lo que la incidencia relativa es desconocida.
Por otra parte, la alta incidencia de anafilaxia alérgica al rocuronio en Noruega, probablemente sobrevaluada, se podría atribuir a diferentes grados de sensibilización inmunológica al amonio cuaternario. En Noruega se usa indiscriminadamente, sin prescripción médica, un jarabe antitusígeno opioide, que en Suecia es más restringido; un derivado de la codeína (pholcodine), que contiene amonio cuaternario. Se detectan anticuerpos IgE al phocoldine (Galenphol®) en el 6% de la población donante de sangre de Noruega y en el 0% de Suecia. La hipótesis del pholcodine es refrendada por los resultados de un estudio multicéntrico realizado en Europa y Estados Unidos, que demuestra una asociación estadísticamente significativa entre el consumo de pholcodine y la prevalencia de sensibilización por IgE a pholcodine y succinilcolina en varios países 43 . El estudio también revela que otras sustancias, aún desconocidas, pudieran estar implicadas en la sensibilización a los BNM. Se trataría entonces de resultados falsos positivos de las pruebas cutáneas, que estarían sobreestimando la contribución del rocuronio en la incidencia de anafilaxia alérgica. Es así que, probablemente la restricción del uso de rocuronio por parte de la autoridad noruega fue precipitada, y resultante de un estudio con muchas limitaciones estadísticas.
Existe aun controversia en relación a las diluciones y concentraciones máximas en que deben usarse los BNM en las pruebas cutáneas. La Sociedad Francesa de Anestesia y Reanimación, la Sociedad Francesa de Alergología, así como las guías de los países escandinavos y otros autores, han efectuado recomendaciones detalladas de las diluciones y concentraciones máximas que deben ser utilizadas 44 . La exactitud de estas recomendaciones se ha confirmado con un estudio prospectivo realizado en 120 voluntarios sanos, en quienes se efectuó intradermorreacciones con todos los BNM en concentraciones crecientes 45 . En las recomendaciones para la intradermorreacción para rocuronio, uno de los aspectos más debatidos, se aumentó la dilución de partida de 1/100 a 1/200 y la concentración máxima disminuyó de 100 a 50 µg·ml-1, sin embargo, la prueba de escarificación se sigue efectuando con el rocuronio sin diluir, lo que pudiera ser responsable de ocasionar resultados falsos positivos (Tabla 3).
Tabla 3 Diluciones recomendada por la SFAR y refrendadas en países escandinavos 52
| Agente |
Concentración (mg/ml) |
Escarificación |
Intradermorreacción |
||
|
Dilución |
Conc. Máxima (µg•ml-1) |
Dilución
|
Conc. Máxima (µg•ml-1) |
||
| Succinilcolina |
50 |
1/5 |
10 |
1/500 |
100 |
| Atracurio |
10 |
1/10 |
1 |
1/1.000 |
10 |
| Cisatracurio |
2 |
Sin diluir |
2 |
1/100 |
20 |
| Mivacurio |
2 |
1/10 |
0,2 |
1/1.000 |
2 |
| Pancuronio |
2 |
Sin diluir |
2 |
1/10 |
200 |
| Rocuronio |
10 |
Sin diluir |
10 |
1/200 |
50 |
| Vecuronio |
4 |
Sin diluir |
4 |
1/10 |
400 |
Algunos autores han cuestionado la prolijidad con que se llevan a cabo las pruebas cutáneas en el diagnóstico de la alergia a los BNM, argumentando que la alta incidencia reportada puede deberse a resultados falsos positivos por inadecuadas diluciones de rocuronio en los test de escarificación e intradermorreacción.
De este modo, Levy y colaboradores han sugerido que las pruebas cutáneas para el diagnóstico de hipersensibilidad al rocuronio y al cisatracurio deben realizarse con concentraciones menores que 1/1.000 y 1/10.000 respectivamente. El uso de concentraciones mayores, pueden ser las responsables de la alta incidencia de pruebas cutáneas positivas reportadas en Francia, que explicaría la aparición de falsos positivos. En su estudio, se demostró que concentraciones mayores a 1/1.000 de rocuronio, producen respuestas claramente positivas en 29 de 30 voluntarios en ausencia de degranulación de mastocitos 46 . Además, D’Honeur evaluó 30 pruebas de escarificación en voluntarios sanos y encontró que el 50% de los sujetos tenían una respuesta positiva al rocuronio y el 40% al vecuronio, sin diluir. El estudio demuestra que soluciones no diluidas o no suficientemente diluidas de rocuronio (1/100, 1/10) pueden inducir resultados falsos positivos, especialmente en mujeres 47 . Esto sugiere que para evitar falsos positivos los tests de escarificación con rocuronio y vecuronio, en pacientes que han experimentado anafilaxia deben hacerse con soluciones diluidas, recomendando una solución 1/10 para los hombres y 1/100 para las mujeres.
En Australia, usando una dilución de 1/1.000 para las intradermorreacciones, se ha demostrado que el rocuronio tiene un riesgo potencial intermedio de incidencia de anafilaxia. Desde su introducción en 1996, el aumento de la incidencia de anafilaxia se correlaciona perfectamente con el aumento de su uso en clínica 48 (Figura 5), por lo que es altamente probable que no exista una alarma especial para el uso del rocuronio como agente de uso diario.
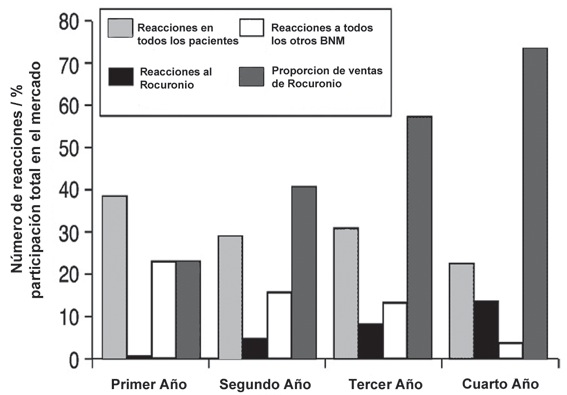
Figura 5 Aumento simultáneo del número de reacciones a rocuronio, con el porcentaje de ventas en el mercado los 4 primeros de años de uso en Nueva Gales del Sur (Australia) 56 .
Biopsias de las pápulas de rocuronio realizadas en sujetos sanos falsos positivos confirman la ausencia de degranulación de mastocitos, mientras que las de pacientes con antecedentes de anafilaxia, son altamente confiables y detectan entrecruzamiento con IgE inducido por droga, con la correspondiente liberación de mediadores inflamatorios. De esta forma, las pruebas cutáneas realizadas en pacientes controles versus aquéllos con antecedente de anafilaxia no pueden ni deben compararse.
El aparente aumento de la incidencia de anafilaxia al rocuronio en algunos países debe ser interpretado con precaución, hasta que se tengan estudios epidemiológicos más numerosos. Pudiera deberse a múltiples factores clínicos, metodológicos y estadísticos que han contribuido a esta aparente contradicción 49 , entre ellos:
-
Un reflejo de su uso en clínica y su venta en el mercado; los últimos años ha habido un aumento importante del uso de la droga en relación a otros BNM.
-
Problemas estadísticos:
-
Sesgo derivado del reporte de efectos adversos de las nuevas drogas 50 .
-
Número pequeño de las muestras: la incidencia de anafilaxia es tan baja, que se requeriría un estudio que abarcara 30 millones de pacientes para obtener resultados concluyentes 51 .
-
Una alta incidencia de falsos positivos en las pruebas cutáneas de pacientes sin antecedentes de un cuadro clínico de anafilaxia y el uso de diluciones menores a las necesarias en las pruebas cutáneas 52 .
-
La diferencia ambiental en relación con la exposición a alérgenos, como el caso del pholcodine 53 .
-
La posibilidad real de diferencias genéticas en la población 54 .
-
La presencia del grupo propenil-amonio, que está presente tanto en el rocuronio como el alcuronio, un BNM al que en el pasado se le atribuyó un alto riesgo de anafilaxia.
-
• Prevención
No existen factores de riesgo de sensibilización que pudieran justificar un estudio alergológico previo para el uso de BNM. La prevalencia de sensibilización a los BNM en la población general (pruebas cutáneas probablemente falsas positivas) puede llegar a un 10%, lo que excede con creces la posibilidad de una anafilaxia. Hasta ahora aún no se sabe cómo los pacientes se hacen sensibles. Ni siquiera es totalmente necesario un previo contacto con los agentes, pues muchos pacientes hacen una reacción alérgica a los BNM durante su primera anestesia.
El único factor predictivo real de una anafilaxia a un BNM, es haber tenido una reacción alérgica previa demostrada a uno de ellos, por lo que la única manera de evitar una reacción alérgica, sería evitar el uso de BNM. Aunque hay estudios que demuestran que inclusive se puede efectuar satisfactoriamente una intubación endotraqueal sin BNM en caso necesario 55 ,56 y en algunas instituciones se ha racionalizado el uso de BNM 57 , muchas veces esto es impracticable.
Las recomendaciones para un paciente con historia de colapso cardiovascular durante una anestesia previa que se presenta a una urgencia sin haber investigado anafilaxia son:
-
Usar un ambiente libre de látex.
-
Usar agentes inhalatorios.
-
Si se cuenta con el registro de la anestesia anterior:
-
Evitar todas las drogas usadas antes del colapso, excepto los agentes inhalatorios.
-
Si el paciente recibió BNM antes del colapso, evitar todos los BNM si es posible, debido a la alta incidencia de reactividad cruzada: administrar un BNM a un paciente sensibilizado a otro BNM es extremadamente riesgoso si no se ha efectuado el máximo esfuerzo por diagnosticar las reacciones cruzadas.
-
Si no se cuenta con el registro de la anestesia anterior:
-
Evitar todos los BNM haciendo un balance riesgo-beneficio de lo que esto significa.
-
Preferir la anestesia loco-regional.
-
Evitar la clorhexidina (la alergia a la povidona es menos frecuente).
-
La reacción anterior pudo haber sido no alérgica: evitar liberadores de histamina.
-
No hay evidencia de que la profilaxis, ya sea con antihistamínicos o esteroides, impidan o reduzcan la severidad de la reacción y sólo ofrece una falsa sensación de seguridad.
-
• Reacciones cruzadas
Los iones amonio cuaternario y terciario son los principales componentes de los sitios alergénicos de los BNM 58 . La gran ubicuidad de estos grupos en los diferentes BNM, de manera que algunos tienen 2 o incluso 3 amonios cuaternarios, permite explicar en parte la alta incidencia de reacciones cruzadas 59 .
La incidencia de reacciones cruzadas entre diferentes BNM es de alrededor de 65-75% si se determina con pruebas cutáneas y de hasta 80-100% si se determina con radioinmunoensayo. Aunque algunos pares de drogas tienen reacciones cruzadas más comúnmente, los modelos de reactividad cruzada varían considerablemente entre pacientes. La mayor incidencia de reacciones cruzadas ocurre con el vecuronio (87,5%) y el rocuronio (80,6%), mientras que con el atracurio y la succinilcolina se observa sólo en el 76,8% y 54,3% respectivamente. Las combinaciones más frecuentes son el vecuronio con el pancuronio y la succinilcolina con los BNM aminoesteroides 60 . Se observa reacciones cruzadas preferentemente entre miembros del mismo grupo químico, aminoesteroides o bencilisoquinolinas, y entre succinilcolina y otros BNM 61 .
La gran cantidad de reacciones cruzadas se debe a la presencia de un epítope común (amonio cuaternario-terciario), que hace que las pruebas diagnósticos tengan poca sensibilidad; esto ha hecho que algunos autores consideren evitar el uso de todos ellos en caso de antecedentes clínicos y una prueba diagnóstica positiva a uno de ellos. Sin embargo, es inusual que un individuo sea alérgico a todos los BNM, por lo que otros recomiendan esmerarse en el diagnóstico para no limitar las posibilidades anestésicas de un paciente.
La gran variabilidad de modelos de reacción cruzada que existe entre pacientes puede deberse a que aunque los iones amonio cuaternario y terciario son los sitios reactivos más importantes, el reconocimiento del antígeno por parte de las IgE, depende también del ambiente molecular del grupo amonio, que es función de la hidrofobicidad y la distancia con los grupos polares (hidroxilos). Otra explicación posible, es que el determinante antigénico puede extenderse hacia la parte adyacente de la molécula. Los anticuerpos IgE pudieran también complementarse con estructuras diferentes al amonio cuaternario 62 .
Entre el 17% y el 50% de las anafilaxias alérgicas por BNM, puede sobrevenir en una primera administración 29 ,63 , lo que sugiere una sensibilización previa por una sustancia diferente que tenga el epítope común (amonio cuaternario), como algunos cosméticos de uso habitual, pastas de dientes, detergentes y jarabes para la tos. Además, la neostigmina y la morfina también contienen iones de amonio cuaternario que pudieran tener reacciones cruzadas con los BNM. La reacción cruzada a todos los BNM es muy poco frecuente, pero parece ser más frecuente en el grupo aminoesteroide que en el bencilisoquinolínico 64 .
Conclusión: la incidencia de reacciones cruzadas es tan alta y la sensibilidad diagnóstica es tan baja, que cuando hay antecedentes de anafilaxia a un BNM, si es posible, hay que evitar el uso de cualquier BNM; si esto fuera inevitable, debe usarse el que haya salido negativo al estudio de pruebas cutáneas, aceptando que ello no garantiza que no ocurra anafilaxia. Aunque raros, se han reportado en la literatura algunos casos de reincidencia de anafilaxia después de administrar un BNM considerado seguro 65 ,66 .
Diagnóstico
El diagnóstico etiológico de una anafilaxia que ocurre durante una anestesia se basa en una tríada que incluye evidencias clínicas, biológicas y alergológicas. El diagnóstico comprende confirmar la naturaleza de la reacción, identificar al agente responsable, detectar posibles reacciones cruzadas entre diferentes BNM y proporcionar recomendaciones para futuros procedimientos anestésicos 67 .
Los pacientes que presentan una anafilaxia intraoperatoria deben ser estudiados con una batería de exámenes, algunos de los cuales deben ser realizados durante o inmediatamente después de la reacción, y otros secundariamente 4 a 6 semanas posteriormente a la reacción.
El estudio inmediato corresponde fundamentalmente a la determinación de los niveles de triptasa sérica para confirmar una reacción anafiláctica, y la búsqueda de IgE específicas, destinadas a identificar el agente. El aumento de los niveles de histamina es tan fugaz, que su estudio es muy poco realizado en la actualidad.
El estudio secundario incluye 2 tipos de pruebas cutáneas: la prueba de escarificación (PST, de prickskin test) y la prueba de intradermorreacción (IDT, de intradermoreaction test) además de la búsqueda de IgE específicas, ya sea si no se hizo en forma inmediata o si el resultado fue negativo.
Desgraciadamente ninguno de estos exámenes ha demostrado una validez absoluta y deben ser correlacionados con la clínica. En muchos países no hay centros de alergoanestesiología y lo único con que se cuenta finalmente es el listado de los fármacos utilizados durante la anestesia y la posibilidad de realizar las pruebas cutáneas y estudio de niveles de IgE anti-látex por radioinmunoensayo.
-
• Evidencias clínicas
La historia clínica puede ser crucial en algunos casos de anafilaxia, pero es muy difícil que los pacientes reconozcan como antecedente una alergia a BNM. Cualquier reacción grave durante una anestesia previa pudo tratarse de una anafilaxia y es el mayor factor de riesgo para que ocurra una nueva reacción si se vuelve a administrar el agente involucrado; en tales casos, el estudio diagnóstico es mandatorio ante una intervención electiva. Una historia de intolerancia a los alimentos es más frecuente en las anafilaxias alérgicas en general 15 . Específicamente para los BNM no se ha identificado un predictor de riesgo. El antecedente de atopia es considerado un factor de riesgo en el caso del látex, pero no de los BNM 68 .
El diagnóstico inicial de anafilaxia es presuntivo, pero es muy importante tenerlo en cuenta, pues puede progresar rápidamente a un cuadro que puede llegar a ser mortal. Los signos y síntomas pueden diferir de los casos de anafilaxia no relacionados con la anestesia.
Los signos y síntomas incluyen manifestaciones cutáneas, respiratorias y cardiovasculares. Se clasifican de acuerdo a la escala de Ring y Messmer 69 :
-
Grado I: Signos cutáneo-mucosos generalizados: eritema, urticaria con o sin angioedema.
-
Grado II: Daño multivisceral moderado, con signos cutáneo-mucosos, hipotensión y taquicardia moderada, hiperactividad bronquial (tos, disnea).
-
Grado III: Daño multivisceral severo, con riesgo vital, que impone una terapia específica agresiva (colapso cardiovascular, taquicardia o bradicardia, arritmias, broncoespasmo). Los signos cutáneos pueden estar ausentes, o aparecer sólo después de la recuperación de la presión arterial.
-
Grado IV: Colapso cardiocirculatorio. Paro cardiorrespiratorio.
La distinción entre anafilaxia alérgica y no alérgica no puede efectuarse sólo por las manifestaciones clínicas, sin embargo, el cuadro tiende a ser más severo en las reacciones alérgicas y menos en las reacciones no alérgicas. La mayor parte de las anafilaxias alérgicas son grado II (23%) o grado III (60%), en que el colapso vascular y broncoespasmo son más frecuentes. Mientras que las anafilaxias no alérgicas son grado I (55%) y II (30%), en que los signos cutáneos son más frecuentes (Figura 6) 30 . Hay reacciones anafilácticas alérgicas grado I, pero no hay reacciones anafilácticas no alérgicas grado IV. Así mismo, las anafilaxias provocadas por los BNM tienden a ser más graves que las provocadas por el látex (Figura 7) 30 .
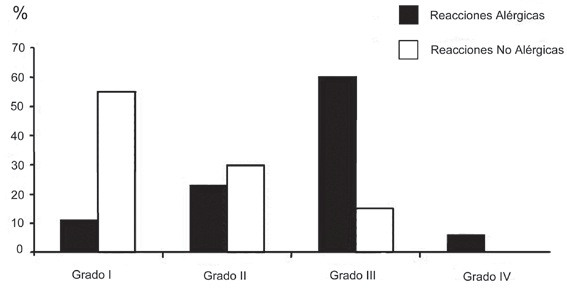
Figura 6 Grados de severidad clínica de las reacciones anafilácticas alérgicas y no alérgicas durante la anestesia 31 .
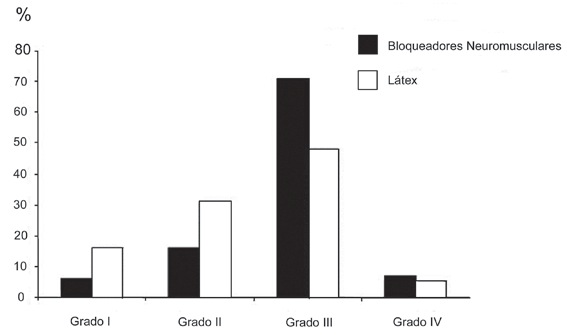
Figura 7 Grados de severidad clínica de las reacciones anafilácticas alérgicas y no alérgicas según el agente incriminado 31 .
En el transcurso de la anestesia, especialmente durante la inducción, en un paciente monitorizado, cuando baja la presión arterial, hay una modificación brusca de la frecuencia cardíaca (sube en el 85% y baja en el 15% de los casos), o aumenta la presión en la vía aérea, habitualmente se piensa en otro diagnóstico y no en anafilaxia. Es probable que en tales caos muchas reacciones grado I-II sean inadvertidas y el tratamiento de algunas reacciones grado III-IV sea postergado. Se puede pensar en una serie de eventos, desde los más simples (no relacionados con la administración de succinilcolina) hasta los más sofisticados (relacionados con la administración de succinilcolina) (Tabla 4) 70 .
Tabla 4 Diagnóstico diferencial 70
|
Diagnóstico Diferencial de Anafilaxia Durante la Anestesia |
| Sin la implicancia de la succinilcolina: |
| · Sobredosis de drogas e interacciones |
| · Efectos cardiacos y cardiovasculares de algunos fármacos |
| · Reactividad bronquial |
| · Arritmias |
| · Infarto del miocardio |
| · Taponamiento pericárdico |
| · Edema pulmonar |
| · Tromboembolismo pulmonar |
| · Neumotórax a tensión |
| · Shock hemorrágico |
| · Embolia venosa |
| · Sepsis |
| · Deficiencia de inhibidor de C1 esterasa |
| · Mastocitosis |
| Relacionadas con la succinilcolina: |
| · Hipertermia maligna |
| · Miotonías y espasmo de maséteros |
| · Hiperkalemia |
Un estudio realizado en 42 anestesistas con experiencia ayudados por un instructor en Dinamarca, que fueron confrontados a un simulador de anafilaxia, demostró que ninguno de ellos pudo diagnosticar el cuadro en los 10 primeros minutos, y sólo el 25% logró hacerlo después de 15 minutos 71 .
La anafilaxia por BNM generalmente ocurre entre 1 a 10 minutos después de la inducción de la anestesia. Los signos clínicos iniciales reportados más frecuentemente son la ausencia de pulso, rush cutáneo, dificultad en la ventilación por broncoespasmo, desaturación y baja inexplicable de la ETCO2 72 . Los signos cutáneos pueden quedar ocultos por los campos quirúrgicos o por efecto de vasoconstricción del tejido subcutáneo, pudiendo aparecer sólo después del restablecimiento de la presión arterial. El broncoespasmo es más frecuente y grave en los pacientes con hipereactividad bronquial. Las manifestaciones más severas pueden comprometer un solo signo: la mayoría de las veces colapso cardiovascular o signos cutáneos.
La amplia variedad de las manifestaciones clínicas que ocurren en una anafilaxia alérgica y no alérgica se puede apreciar en un reporte que incluye más de 2.500 casos estudiados entre 1997 y 2004, publicado en el Journal of Allergy and Clinnic Immunology por Paul Mertes y colaboradores (Tabla 5) 15 . Se presentan signos cutáneos en sólo dos tercios de las anafilaxias alérgicas y en casi la totalidad de las no alérgicas. Los síntomas cardiovasculares, por el contrario, son mucho más frecuentes en las anafilaxias alérgicas (84%) que en las no alérgicas (36%), con una mayor incidencia de colapso cardiovascular en las alérgicas (55% versus 10%). El broncoespamo, es también más frecuente en las reacciones alérgicas (41%) que en las no alérgicas (19%). El paro cardíaco ocurre casi sólo en las anafilaxias alérgicas (97 casos versus 2 casos).
Tabla 5 Características clínicas de 2.516 anafilaxias ocurridas en Francia, estudiadas entre enero de 1997
y diciembre de 2004 15
|
Características clínicas |
Anafilaxias Alérgicas |
Anafilaxias No Alérgicas |
||
|
n = 1.816 |
72,1% |
n = 700 |
27,8% |
|
| Signos cardiovasculares |
1.526 |
84,04 |
255 |
36,39 |
| – Hipotensión arterial |
397 |
21,86 |
141 |
20,14 |
| – Colapso cardiovascular |
997 |
54,90 |
74 |
10,57 |
| – Paro cardiaco |
97 |
5,34 |
2 |
0,29 |
| Broncoespasmo |
751 |
41,35 |
135 |
19,29 |
| Signos cutáneos |
1.276 |
70,24 |
667 |
95,34 |
| – Eritema |
858 |
47,27 |
479 |
68,41 |
| – Urticaria |
369 |
20,31 |
179 |
25,62 |
| – Angioedema |
201 |
11,08 |
58 |
8,30 |
Los signos y síntomas pueden presentarse en forma múltiple o única. Cuando aparecen en forma única, en las reacciones alérgicas suele ser colapso cardiovascular, manifestaciones cutáneas, paro cardiaco, hipotensión y broncoespasmo. En las reacciones no alérgicas suele presentarse aisladamente como manifestaciones cutáneas. El angioedema nunca se presenta solo.
Aumentan la severidad de la reacción estados asociados a una disminución de la eficiencia de la respuesta a las catecolaminas endógenas 73 : historia de asma, uso de bloqueadores beta adrenérgicos y anestesia neuroaxial.
Se han identificado tres predictores de gravedad clínica de una anafilaxia alérgica, que pueden estar solos o asociados. La presencia de al menos uno de estos síntomas debe alertar al anestesiólogo sobre la gravedad del cuadro en curso 74 :
-
La precocidad con que sobreviene una reacción: la expresión clínica es tanto más grave cuando los primeros signos se observan precozmente después del contacto con el alérgeno.
-
La ausencia de signos cutáneo-mucosos al comienzo de la reacción: traduce una hipoperfusión tisular periférica. Pueden aparecer después de la restauración de la hemodinamia.
-
Una bradicardia sinusal que aparece rápidamente después de una taquicardia inicial. Se trata de la bradicardia paradojal típica del shock hipovolémico grave (reflejo de Bezold-Jarisch), un reflejo de defensa del organismo para tratar de mantener el llenado ventricular en un paciente muy hipovolémico.
El cuadro clínico de una reacción anafiláctica alérgica y no alérgica es indistinguible, aunque por razones inexplicables, las reacciones a BNM y antibióticos parecen ser más severas que las reacciones al látex. De este modo el diagnóstico diferencial no puede hacerse en base a la presentación clínica sino que debe recurrirse a las evidencias biológicas y alergológicas.
-
• Evidencias biológicas
-
a) Histamina-Triptasa:
La histamina es liberada fugazmente por los basófilos. La liberación de histamina puede ocurrir por activación directa (en el caso de la anafilaxia no alérgica), o mediada por IgE (en la anafilaxia alérgica). Sus niveles aumentados confirman la degranulación de basófilos pero no permiten distinguir el mecanismo de la anafilaxia. Sus niveles máximos son inmediatos después de la reacción y su vida media es de sólo 20 minutos. Como su detección sirve solo hasta una hora después de ocurrida la reacción, generalmente no se realiza; además, su sensibilidad es sólo de 75%, su especificidad de 51%, su valor predictivo positivo de 75% y su valor predictivo negativo de 75% 75 .
La triptasa es una proteasa liberada predominantemente por los mastocitos, que está compuesta de dos formas principales: alfa y beta-triptasa, que son homólogas en un 90%. En los sujetos sanos se encuentra en forma de alfa-triptasa, mientras que la beta-triptasa refleja la activación de los mastocitos con liberación de mediadores. Aunque los basófilos también contienen triptasa, su concentración es 300 a 700 veces menor que en los mastocitos de la piel y los pulmones.
Las concentraciones de triptasa son máximas después de 15 a 60 minutos de las primeras manifestaciones clínicas y tienen una vida media de 90 minutos. Pueden detectarse niveles elevados hasta 6 horas después de la reacción. El tiempo óptimo para la toma de la triptasa sérica es de 1-4 horas después de iniciada la reacción, pero puede estar aumentada incluso post mortem en caso necesario. Debe tomarse una muestra control al menos 24 horas después de la reacción, para descartar una mastocitosis.
La beta-triptasa tiene valores normales inferiores a 12 µg·L-1. Los niveles de beta-triptasa sérica están significativamente elevados (> 25 µg·L-1) en el 68% de las anafilaxias alérgicas (con una media de 45 µg·L-1 y valores extremos entre 1-1.020 µg·L-1), mientras que están aumentadas en sólo el 4% de las anafilaxias no alérgicas (con una media de 6 µg·L-1 y valores extremos entre 1-106 µg·L-1) 15 . Un estudio de Fisher encontró anticuerpos IgE en 125 de 130 pacientes con triptasa sérica elevada 76 .
Los niveles normales de triptasa, sin embargo, no excluyen una reacción inmunológica, pues la anafilaxia puede ser causada por basófilos o activación del complemento. El mismo estudio de Fisher citado anteriormente, encontró anticuerpos IgE en 7 pacientes con niveles normales de triptasa sérica 83 .
La sensibilidad del examen es de un 64%, la especificidad de un 89,3%, el valor predictivo positivo es de un 92,6% y el negativo de un 54,4%. Estos valores mejoran si se realiza conjuntamente con la detección de los niveles de histamina. La determinación más ampliamente usada es la ImmunoCAP®, que se realiza por radioinmunoensayo y mide la suma de las concentraciones de alfa y beta-triptasa. Los niveles de triptasa sérica no contribuyen en la identificación del compuesto causante.
En Chile, las determinaciones de triptasa sérica pueden realizarse en el Hospital Clínico de la Universidad de Chile, en la Clínica Las Condes y en la Clínica Miguel de Servet.
-
b) IgE específicas:
La presencia de anticuerpos específicos para un BNM es evidencia de una sensibilización alérgica a ese agente, proporcionando así una posible explicación del mecanismo de la anafilaxia y de la droga específica responsable de la reacción. La negatividad de los resultados no es rara, pues las IgE pueden haber sido consumidas durante la reacción, de modo que la ausencia de IgE específicas en el estudio inmediato no descarta el origen alérgico de la reacción.
La muestra debe ser tomada en el momento de la reacción en el estudio primario, y hasta los 6 meses en el secundario, sin embargo, la determinación de niveles de IgE específicas no está disponible en todas partes, excepto la determinación de IgE para succinilcolina, que tiene una sensibilidad de sólo un 30-60%.
En centros muy especializados se ha desarrollado una serie de técnicas mediante radioinmunoensayo (RIA) que pueden detectar IgE específicas para BNM usando un compuesto con amonio cuaternario acoplado a sefarosa (QAS-RIA) 77 , o acoplando p-aminofenilfosforil colina (que contiene iones de amonio cuaternario) sobre agarosa (PAPPC-RIA) 78 . Ambos métodos tienen una sensibilidad similar, de alrededor de 88%. Más recientemente se ha efectuado la cuantificación de IgE específicas para rocuronio con el método ImmunoCAP, con la que se obtiene una sensibilidad de más de 85% y una especificidad absoluta 79 .
Como las técnicas de radioinmunoensayo específicas para cada BNM se realizan en muy pocos centros en el mundo, algunos laboratorios han adoptado como alternativa la detección de anticuerpos específicos del amonio cuaternario de la morfina o pholcodine (un antitusígeno derivado de la morfina que posee 2 amonios cuaternarios) para la determinación de alergia a los BNM, pues la morfina tiene un único grupo amonio cuaternario substituido, que se une ávidamente a los anticuerpos IgE específicos de los BNM. De este modo, los métodos ImmunoCAP desarrollados así para la morfina (MOR ImmunoCAP) y el pholcodine (PHO-conjugado) han resultado más sensibles y específicos para la detección de anticuerpos IgE contra BNM que la determinación de anticuerpos específicos de cada uno de ellos 80 .
La frecuencia de sensibilización al amonio cuaternario en la población de 20-40 años sin factor de riesgo identificado es de 9,3%, por lo que el examen no sirve como chequeo preoperatorio 81 .
En Chile, las determinaciones de IgE específicas para BNM sérica pueden realizarse en el Hospital Clínico de la Universidad de Chile, en la Clínica Las Condes y en la Clínica Miguel de Servet.
-
• Evidencias alergológicas
Conjuntamente con la historia clínica, las pruebas cutáneas (PST e IDT), son el pilar fundamental del diagnóstico de una reacción mediada por IgE. En algunos países se efectúan las pruebas de liberación de mediadores y el análisis flujo citométrico de basófilos activados in vitro, que pueden tener utilidad en el caso de los BNM. Las pruebas de liberación de mediadores requieren de un laboratorio especializado y el análisis flujo citométrico de basófilos activados in vitro está en etapa de evaluación.
-
a) Pruebas cutáneas:
Las pruebas cutáneas constituyen una herramienta útil para:
-
Identificar el agente causante, y de esta forma evitarlo definitivamente.
-
Determinar el mecanismo fisiopatológico de la reacción (alérgico versus no alérgico).
-
Sugerir una droga alternativa segura en caso de necesidad futura.
Las pruebas cutáneas son muy confiables, pero no son infalibles. La sensibilidad de las pruebas cutáneas a los BNM es de 94-97% 82 . En los hipnóticos y antibióticos también tienen una buena sensibilidad (95%), pero tienen un valor muy limitado en reacciones a coloides y medios de contraste. Deben realizarse 4 a 6 semanas después de la reacción (para evitar falsos negativos debido a depleción de los mastocitos), por profesionales con experiencia en interpretar resultados con agentes usados en anestesia 83 . Las pruebas cutáneas a los BNM pueden permanecer positivas por varios años.
Las pruebas cutáneas deben incluir el conjunto de medicamentos administrados antes de ocurrir la reacción y el látex 84 . Si se ha administrado un BNM, debe realizarse una prueba para el agente implicado y para cada uno de los otros BNM, debido a la alta incidencia de reacciones cruzadas y a la necesidad de poder recomendar alternativas en futuras intervenciones quirúrgicas 44 ,85,86 .
Se recomienda comenzar con el PST y reservar la IDT en caso de un PST negativo, dudoso para investigación de reacciones cruzadas a BNM, porque las IDT es más probable que gatillen reacciones alérgicas sistémicas.
Si el PST es negativo, el IDT se realiza inyectando 0,02-0,05 ml de la droga usando soluciones preparadas comercialmente, diluidas o no según el caso, sin exceder las recomendaciones establecidas para cada agente. Deben utilizarse procedimientos y diluciones estandarizadas y precisamente definidas para cada fármaco o sustancia testeada con el fin de evitar reacciones falsas positivas, debido a la propiedad que tienen algunas drogas de producir liberación directa de histamina.
En paralelo deben realizarse controles negativos con solución salina y controles positivos con codeína o histamina. Las pruebas cutáneas se realizan en el antebrazo o espalda y se leen luego de 15 a 20 minutos. El SPT se considera positivo cuando el diámetro de la pápula es por lo menos igual a la mitad de la pápula resultante del control positivo y al menos 3 mm mayor que el control negativo. El IDT se considera positivo si el diámetro de la pápula mide el doble o más que la pápula inyectada.
Si el IDT es negativo, debe aumentarse 10 veces la concentración, con intervalos de 15 a 20 minutos, hasta que la prueba resulte positiva o hasta llegar a la máxima concentración recomendada.
Existe algún grado de controversia en relación a las ventajas del PST versus IDT. En términos generales las IDT son más sensibles pero menos específicas que las PST. Los estudios que comparan ambas técnicas muestran sólo mínimas diferencias entre ellas 87 ,88 , sin embargo, los PST tienen una pequeña tendencia a producir resultados falsos negativos, mientras que las IDT una pequeña tendencia a producir resultados falsos positivos, especialmente cuando las drogas que se ensayan producen liberación de histamina directa 89 . En el caso de los BNM se recomienda el PST para el diagnóstico del agente responsable, pero se prefiere el IDT para investigar las reacciones cruzadas.
La mayoría de las veces puede recomendarse otro BNM en base a las pruebas cutáneas, pero para una mayor seguridad, es recomendable que la concentración del agente sea aumentada, para disminuir la posibilidad de falsos negativos; además, es razonable la realización de una prueba de liberación de mediadores (o el estudio de activación de los basófilos si hubiera disponibilidad).
En Chile no hay ningún laboratorio con experiencia en realizar pruebas cutáneas estandarizadas específicamente para BNM.
-
b) Pruebas de liberación de mediadores:
En los pacientes con anticuerpos IgE, los mastocitos, pero especialmente los basófilos circulantes, están sensibilizados y pueden ser gatillados por estimulación con diferentes umbrales alergénicos. La muestra debe tener menos de 24 horas y los pacientes no deben estar en tratamiento con altas dosis de esteroides.
Existen 2 categorías de pruebas de liberación de mediadores: la prueba de liberación de histamina y la prueba de liberación de sulfoleukotrieno (test de estimulación de alérgeno celular-CAST). La sensibilidad del test de liberación de histamina es de 65% y la especificidad de un 100% 90 . La concordancia entre el test de liberación de histamina y la determinación de IgE por QAS-RIA es de 64%.
A pesar de su buena especificidad, la aplicación diagnóstica rutinaria de estos tests queda limitada por su difícil realización experimental y baja sensibilidad. Podrían tener utilidad en la investigación de la reactividad cruzada a los BNM en pacientes que se sabe están sensibilizados a uno de ellos, para recomendar su eventual utilización en futuras anestesias.
-
c) Análisis flujo citométrico de basófilos activados in vitro:
La activación de los basófilos no sólo secreta mediadores cuantificables, si no que sobre regula la expresión de diferentes marcadores que pueden ser detectados en forma eficiente por citometría de flujo, usando anticuerpos monoclonales específicos, especialmente anti-CD63 y con menor frecuencia anti-CD203c.
En Chile, está disponible la prueba de liberación de sulfoleukotrieno (test de estimulación de alérgeno celular-CAST) sólo en el laboratorio de la Clínica Miguel de Servet (Almirante Pastene 150). Este estudio puede efectuarse para la mayoría de los BNM de uso actual: rocuronio, succinilcolina, atracurio, mivacurio y pancuronio. Su uso está validado para la anafilaxia a los BNM y las reacciones cruzadas entre ellos 91 .
Conclusión: para asegurar un adecuado diagnóstico y efectuar una apropiada recomendación para futuras anestesias, la interpretación alergológica debe estar siempre ligada a la clínica:
-
Una historia clínica sugerente (reacción severa, grado III-IV), asociada a un aumento de la triptasa sérica (aunque una triptasa normal no descarta el diagnóstico) y pruebas cutáneas positivas al agente sospechoso, confirman el diagnóstico de anafilaxia alérgica a ese agente y debe ser informado el paciente y evitado en próximas anestesias.
-
Una historia clínica sugerente (reacción leve, grado I-II), asociada a una liberación (o no) de histamina, sin aumento de triptasa sérica y negatividad de pruebas cutáneas, sugiere una reacción no alérgica: liberación de histamina por agentes potentemente liberadores como el atracurio, el mivacurio y la vancomicina.
-
En lo posible, la confirmación del agente incriminado debe basarse en la evaluación inmunológica usando más de un examen; en caso de discrepancia entre diferentes exámenes, debe recomendarse un agente alternativo que haya resultado completamente negativo.
Tratamiento
El tratamiento de un shock de tipo restrictivo como el shock anafiláctico, escapa a los objetivos de esta publicación, y ha sido abordado recientemente en esta Revista 92 . Existen algunas novedades terapéuticas en relación al tratamiento del shock anafiláctico.
-
• Azul de metileno
Es sabido que el azul de metileno interfiere con la relajación de la musculatura lisa de los vasos sanguíneos mediada por óxido nítrico y se ha usado con éxito en el tratamiento del shock anafiláctico resistente a epinefrina y vasopresina 93 . Sin embargo, se necesitan estudios pre-clínicos y clínicos para comprender mejor el mecanismo y validar su potencial utilidad clínica como terapia de rescate en el shock anafiláctico.
-
• Arginina-Vasopresina
Debido a que una de las causas que contribuye al fracaso de las catecolaminas en el manejo del shock anafiláctico es la desensibilización de los receptores adrenérgicos, la arginina vasopresina (hormona antidiurética) teóricamente parece una buena alternativa, debido a que sus efectos vasoconstrictores son mediados por receptores noradrenérgicos arginina vasopresina V1 y a su efecto en disminuir la concentración intracelular del segundo mensajero del óxido nítrico (guanosina 3’,5’-monofosfato cíclico) 94 .
-
• Sugammadex
La pronta discontinuación de la droga posiblemente incriminada, para evitar lo antes posible la exposición al agente, forma parte del tratamiento primario de una anafilaxia. En el caso de los BNM, la única alternativa para evitar la exposición al agente desencadenante es la suspensión de infusiones, sin embargo, la forma de administración habitual de los BNM es en bolos de carga y repetición, por lo que el agente mantiene la respuesta anafiláctica hasta que sea eliminado del organismo.
En el caso del rocuronio, uno de los agentes supuestamente más implicados en anafilaxia alérgica, se planteó desde el punto de vista teórico la posibilidad de “remover” el rocuronio libre de la circulación mediante la administración de sugammadex 95 . Esta hipótesis presuponía que el complejo rocuronio-sugammadex no se unía a los anticuerpos específicos de la membrana de los mastocitos. El grupo amonio del rocuronio no queda totalmente encapsulado por la molécula de sugammadex, por lo que el epítope podría seguir quedando expuesto al antígeno. Además el sugammadex podría unirse a otros esteroides universalmente usados en el tratamiento de la anafilaxia. Aunque la importancia clínica de esta interacción es desconocida, la afinidad del sugammadex por otros esteroides como la aldosterona, cortisona e hidrocortisona es 120 veces menor que con el rocuronio.
El primer caso de anafilaxia a rocuronio que después de 20 minutos de tratamiento convencional con adrenalina, volumen y maniobras de resucitación, se administró un frasco ampolla de 500 mg de sugammadex (6,6 mg·kg-1) fue publicado en el BJA en 2011 96 . El resultado fue que 45 segundos después de su administración, mientras aún se efectuaban maniobras de compresión torácica, la paciente abrió los ojos, intentó extubarse y hubo una mejoría significativa de las condiciones hemodinámicas.
La incidencia de la complicación es tan baja, que mientras no haya mayor evidencia, hay base farmacológica y fisiopatológica suficiente, que hace razonable recomendar la administración de sugammadex cuando se sospecha anafilaxia a rocuronio o vecuronio, que no ha respondido al tratamiento tradicional. Puesto que el objetivo de la administración de sugammadex en este contexto sería la quelación de todas las moléculas de rocuronio circulante, y teniendo en cuenta que ocurre recién administrado, la dosis de sugammadex debería ser aquélla que se usa como rescate en situación de no-poder-ventilar-no-poder-intubar: 16 mg·kg-1.
La Sociedad de Anestesiología de Chile ha elaborado recientemente las Recomendaciones Clínicas sobre Anafilaxia en Anestesia y ha publicado un Poster con el esquema del tratamiento del Shock Anafiláctico (Figura 8) 97 .

Figura 8 Esquema del tratamiento del Shock Anafiláctico perioperatorio recomendado por la Sociedad de Anestesiología de Chile (Descargar en link de la página web de la Sociedad de Anestesiología de Chile: http://www.sachile.cl/medicos/recomendaciones/anafilaxia/anafilaxiabig_ok.jpg).
Referencias
- Pirmohamed M, Park BK. Adverse drug reactions: back to the future. Br J ClinPharmacol 2003; 55: 486-492.
- Ebo DG, Fisher MM, Hagendorens MM, et al. Anaphylaxis during anaesthesia: diagnostic approach. Allergy 2007; 62: 471-487.
- Laxenaire MC. Le risque allergique des curares. Can J Anesth 2003; 50: 429-433.
- Johansson SGO, Blieber T, Dahl R, et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Comettee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 2004; 113: 832-836.
- Johansson SG, Hourihane JO, Bousquet J, et al. A revised nomenclature for allergy: An EAACI position statement from the EAACI Nomenclature task force. Allergy 2001; 56: 813-824.
- Sampson HA, Muñoz-Furlog A, Campbell RL, et al. Second symposium on the definition and management of anaphylaxis: summary report. Second National Institute of Allergy and Infectius Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol 2006; 117: 391-397.
- Hedin H, Richter W. Pathomechanisms of dextran-induced anaphylactoid/anaphylactic reactions in man. Int Arch Allergy Appl Immunol 1982; 68: 122-126.
- Levy J. The Allergic Response. En: Barash P, Cullen B, Stoelting R, editores. Clinical Anesthesia. Segunda Edición, Philadelphia, J.B. Lippencitt Company, 1992; 1431-1445.
- Moss J. Muscle relaxants and histamine release. Acta Anaesthesiol Scand 1995 (Sup): 106: S7-S12.
- Lienhart A, Auroy Y, Pesquignot F, et al. Survey of anesthesia-related mortality in France. Anesthesiology 2006; 105: 1087-1097.
- Light KP, Lovell AT, Butt H, et al. Adverse effects of neuromuscular blocking agents based on yellow card reporting in the U.K.: are there differences between males and females? Pharmacoepidemiol Drug Saf 2006; 15: 151-160.
- Mitsuhata H, Matsumoto S, Hasegawa J. The epidemiology and clinical features of anaphylactic and anaphylactoid reactions in the perioperative period in Japan. Masui 1992; 41: 1664-1669.
- Fisher MM, Baldo BA. The incidence and clinical features of anaphylactic reactions during anaesthesia in Australia. Ann Fr Anest Réanim 1993; 12: 97-104.
- Saeger JD, Schumock GT, Kong SX. Estimating the rate of adverse drugs reactions with capture-recatture analysis. Am J Health Syst Pharmacol 1996; 53: 178-181.
- Mertes PM, Alla F, Tréchot P, et al. Anaphylaxis during anesthesia in France: An 8-year national survey. J Allergy Clin Immunol 2011; 128: 366-373.
- Murat I. Anaphylactic reactions during paediatric anaesthesia: Results of the survey of the French Society of Paediatric Anaesthetists (ADARPED) 1991-1992. Paediatr Anaesth 1993; 3: 339-343.
- Karila C, Brunet-Langot D, Labbez F, et al. Anaphylaxis during anesthesia: results of a12-year survey at a French pediatric center. Allergy 2005; 60: 828-834.
- Baldo BA, Fisher MM. Substituted ammonium ions as allergenic determinants in drug allergy. Nature 1983; 306: 262-264.
- Bustamante R, Luxoro C. Anafilaxia perioperatoria: cuadro clínico y diagnóstico. Rev Chil Anest 2010; 39: 36-52.
- Duda D, Lorenz W, Menke H, et al. Histamine release during induction of anaesthesia and preparation for operation in patients undergoing general surgery: Incidence and clinically severe cases. Agents Actions 1992; 36: C149-C154.
- Lorenz W, Duda D, Dick W, et al. Incidence and clinical importance of perioperative histamine release: randomized study of volume loading and antihistamines after induction of anaesthesia. Lancet 1994; 343: 933-940.
- Murat I. Anaphylactic reactions during paediatric anaesthesia: Results of the survey of the French Society of Paediatric Anaesthetists (ADARPED) 1991-1992. Paediatr Anaesth 1993; 3: 339-343.
- Didier A, Cador D, Bongrand P, et al. Role of the quaternary amonium ion determinants in allergy to muscle relaxants. J Allergy Clin Immunol 1987; 79: 578-584.
- Koppert W, Blunk JA, Petersen LJ, et al. Differents patterns of mast cell activation by muscle relaxants in human skin. Anesthesiology 2001; 95: 659-667.
- Laxenaire MC, Moneret-Vautrin DA, Widmer S, et al. Substances anesthésiques responsables de chocs anaphylactiques. Enquête multicentrique française. Ann Fr Anesth Réanim 1990; 9: 501-506.
- Laxenaire MC. Médicamentset substances responsables des chocs anaphylactiques peranesthésiques. Enquête épidémiologique multicentrique française. Ann Fr Anesth Réanim 1993; 12: 91-96.
- Laxenaire MC. Substences responsables des chocs anaphylactiques peranesthésiques. Troisième enquête multicentrique française (1992-1994). Ann Fr Anesth Réanim1996; 15: 1211-1218.
- Laxenaire MC. Epidemiologie des reactions anaphylactoïdes paranesthésiques. Quatrième enquête multicentrique (juillett 1994-décembre 1996). Ann Fr Anesth Réanim 1999; 18: 796-809.
- Laxenaire MC, Mertes P. Anaphylaxis during anaesthesia. Results of a 2 year survey in France. Br J Anaesth 2001; 87: 549-558.
- Mertes PM, Laxenaire MC, Alla F. Anaphylactic and Anaphylactoid Reactions Occurring during Anesthesia in France. Anesthesiology 2003; 99: 536-545.
- Mertes PM, Laxenaire MC. Épidemiologie des reactions anaphylactiques et anaphylactoïdes peranesthésiques en France: Septième enquête multicentrique (Janvier 2001-Décembre 2002). Ann Fr Anesth Réanim 2004; 23: 1133-1143.
- Levy JH, Adelson D, Walker B. Wheal and flare responses to muscle relaxants in humans. Agents Actions 1991; 34: 302-308.
- Levy JH, Brister NW, Shearin A, et al. Wheal and flare responses to opioids in humans. Anesthesiology 1989; 70: 756-760.
- Fisher M, Baldo BA. Anaphylaxis during anaesthesia: current aspects of diagnosis and prevention. Eur J Anaesthesiol 1994; 11: 263-284.
- Harvey LH, Roed-Petersen J, Menné T, Busum B. Danish Anaesthesia Allergy Centre-Preliminary results. Acta Anaesthesiol Scand 2001; 45: 1204-1209.
- Mertes, PM. Anaphylactic reactions during anaesthesia-let us treat the problem rather than debating its existence. Acta Anesthesiol Scand 2005; 49: 431-433.
- Light KP, Lovell AT, Butt H, et al. Adverse effects of neuromuscular blocking agents based on yellow card reporting in the UK: are there differences between males and females? Phaermacoepidemiol Drug Saf 2006; 15: 151-160.
- Krombach J, Hunzelmann N, Köster F, et al. Anaphylactoid Reactions After Cisatracurium Administration in Six Patients. Anesth Analg 2001; 93: 1257-1259.
- Wastila WB, Maehr RB, Turner CL, et al. Comparative pharmacology of cisatracurium (51W89), atracurium, and five isomers in cats. Anesthesiology 1996; 85: 169-177.
- Bhananker SM, O’Donnell JT, Salemi JM, Bishop MJ. The Risk of Anaphylactic Reactions To Rocuronium in the United States Is Comparable to That of Vecuronium: An Analysis of Food and Drug Administration Reporting of Adverse Events. Anesth Analg 2005; 101: 819-822.
- Harboe T, Guttormsen AB, IrgensA, et al. Anaphylaxis during anaesthesia in Norway. Anesthesiology 2005; 102: 897-903.
- Guttormsen AB. Allergic reactions during anaesthesia-increased attention to the problem in Denmark and Norway. Acta Anaesthesiol Scand 2001; 45: 1189-1190.
- Johansson SG, Florvaag E, Oman H, et al. National pholcodine consumption and prevalence of IgE-sensitization: a multicenter study. Allergy 2009; 65: 498-502.
- Mertes PM, Laxenaire MC, Lienhart A, et al. Reducing the risk of anaphylaxis during anaesthesia: Guidelines for clinical practice. J Investig Allergol Clin Immunol 2005; 15: 91-101.
- Mertes PM, Moneret-Vautrin DA, Leynadier F, et al. Skin reactions to intradermal neuromuscular blocking agents injections: a randomized multicenter trial in healthy volunteers. Anesthesiology 2007; 107: 245-252.
- Levy JH, Gottge M, Szlam F, et al. Wheal and flare responses to intradermal rocuronium and cisatracurium in humans. Br J Anaesth 2000; 85: 844-849.
- D’Honneur G, Combes X, Chassard D, Merle JC. Skin Sensitivity to Rocuronium and Vecuronium: A Randomized Controlled Prick-Testing Study in Healthy Volunteers. Anest Analg 2004; 98: 986-989.
- Rose M, Fisher M. Rocuronium: high risk for anaphylaxis? Br J Anaesth 2001; 86: 678-682.
- Hepner DL, Castells MC. Anaphylaxis during the perioperative period. Anesth Analg 2003; 97: 1381-1395.
- Mertes PM, Guttormsen AB, Harboe T, et al. Can spontaneous adverse event reporting systems really be used to compare rates of adverse events between drugs? Anesth Analg 2007; 104: 471-472.
- Laake JH, Rottingen JA. Rocuronium and anaphylaxis: a statistical challenge. Acta Anaesthesiol Scand 2001; 45: 1196-1203.
- Levy JH. Anaphylactic Reactions to Neuromuscular Blocking Drugs: Are We Making the Correct Diagnosis? Anesth Analg 2004: 98: 881-882.
- Florvaag E, Johansson JA. The Pholcodinestory. Immunol Allergy Clin North Am 2009; 29: 419-427.
- Gueant JL, Gueant-Rodríguez RM, Cornejo García JA, et al. Gene variants of IL13, IL4 and IL4RA are predictors of beta-lactam allergy. J Allergy Clin Immunol 2009; 123: 509-510.
- Beaussier M, Raucoules-Aime M. Indications for curarization for intratracheal intubation. Scheduled surgery, patients without particular risk during the preanesthetic examination. Ann Fr Anesth Réanim 2000; 19 (Sup. 2): S378-S386.
- Woods AW, Allam S. Tracheal intubation without the use of neuromuscular blocking agents. Br J Anaesth 2005; 94: 150-158.
- Baillard C, Korinek AM, Galanton V, et al. Anaphylaxis to rocuronium. Br J Anaesth 2002; 88: 600-602.
- Baldo BA, Fisher MM. Substituted ammonium ions as allergenic determinants in drug allergy. Nature 1983; 306: 262-264.
- Fisher MM. Anaphylaxis to muscle relaxants: cross sensitivity between relaxants. Anesth Intensive Care 1980; 8: 211-213.
- Fisher M, Merefield D, Baldo B. Failure to prevent an anaphylactic reaction to a second neuromuscular blocking agent during anaesthesis. Br J Anaesth 1999; 82: 770-773.
- Birnbaum J, Vervloet D. Allergy to muscle relaxants. Clin Rev Allergy 1991; 9: 281-293.
- Laxenaire MC, Gastin I, Moneret-Vautrin DA, et al. Cross-reactivity of rocuronium with other neuromuscular blocking agents. Eur J Anaesthesiol 1995; 11 (Sup l): S55-S64.
- Fisher MM. Anaphylaxis to muscle relaxants: cross sensitivity between relaxants. Anaesth Intensive Care 1980; 8: 211-213.
- Mertes PM, Aimone-Gastin I, Guéant-Rodríguez RM, et al. Hypersensitivity reactions to neuromuscular blocking agents. Curr Pharm Des 2008; 14: 2809-2825.
- Fisher MM, Merefield D, Baldo B. Failure to prevent an anaphylactic reaction to a second neuromuscular blocking drug during anaesthesia. Br J Anaesth 19991; 82: 770-773.
- Thacker MA, Davis FM. Subsequent general anaesthesia in patients with a history of previous anaphylactoid/anaphylactic reaction to muscle relaxant. Anaesth Intensive Care 1999; 27; 190-193.
- Kroigaard M, Garvey LH, Gillbert L, et al. Scandinavian Clinical Practice Guidelines on the diagnosis, management and follow-up of anaphylaxis during anaesthesia. Acta Anaesthesiol Scand 2007; 51: 655-670.
- Birnbaum J, Porri F, Pradal D, et al. Allergy during anesthesia. Clin Exp Allergy 1994; 24: 916-921.
- Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volumen substitutes. Lancet 1977; 1: 466-469.
- Mertes PM, Takima K, Regnier-Kimmoun, et al. Perioperative Anaphylaxis. Med Clin N Am 2010; 94: 761-789.
- Jacobson J, Lindekaer AL, Ostergaard HT, et al. Management of anaphylactic shock evaluated using a full-scale anaesthesia simulator. Acta Anaesthesiol Scand 2001; 45: 315-319.
- Mertes PM, Laxenaire MC. Allergic Reactions occurring during anaesthesia. Eur J Anaesthesiol 2002; 19: 240-262.
- Whittington T, Fisher M. Anaphylactic and anaphilactoid reaction, Bailliere’s Clinical Anesthesiology 1998; 12: 301-323.
- Dewatcher P, Mouton-Faivre C, Emala CW. Anaphylaxis and Anesthesia: Controversies and New Insights. Anesthesiology 2009; 111: 1141-1150.
- Laroche D, Lefrencois C, Gerald JL, et al. Early diagnosis of anaphylactic reactions to neuromuscular blocking agents drugs. Br J Anaesth 1992; 69; 611-614.
- Fisher MM, Baldo BA. Mast cell tryptase in anesthetic anaphylactoid reactions. Br J Anaesth 1998; 80: 26-29.
- Guéant JL, Mata E, Morin B, et al. Evaluation of a new reactive solid phase for radioimmunoassay of serum specific IgE against muscle relaxant drugs. Allergy 1991; 46: 452-458.
- Gigoux L, Ricard-Blum S, Ville G, et al. A new radioimmunoassay using a commercially available solid support for the detection of IgE antibodies against muscle relaxants. J Allergy Clin Immunol 1992; 90: 153-159.
- Ebo DG, Venemalm L, Bridts CH, et al. Immunoglobulin E antibodies to rocuronium: a new diagnostic tool. Anesthesiology 2007; 107: 253-259.
- Fisher M, Baldo B. Immunoassays in the diagnosis of anaphylaxis to neuromuscular blocking drugs: the value of morphine for the detection of IgE antibodies in allergic subjects. Intensive Care 2000: 28: 167-170.
- Porri F, Lemiere C, Birnhaum J, et al. Prevalence of muscle relaxant sensivity in a general population: implications for a preoperative screening. Clin Exp Allergy 1999; 29: 72-75.
- Laxenaire MC, Moneret-Vautrin DA. Allergy and anaesthesia. Curr Opinion Anaesthesiol 1992; 5: 436-412.
- Soetsens FM. Anaphylaxis during anaesthesia: diagnosis and treatment. Acta Anaesthesiol Belg 2004; 55: 229-237.
- Kroigaard M, Garvey LH, Menne T, et al. Allergic reactions in anesthesia: are suspected causes confirmed on subsequent testing? Br J Anaesth 2005; 95: 468-471.
- Mertes PM, Laxenaire MC. Anaphylaxis during general anaesthesia: prevention and management. CNS Drugs 2000; 14: 115-133.
- Mertes PM, Laxenaire MC. Allergy and anaphylaxis in anaesthesia. Minerva Anestesiol 2004; 70: 285-291.
- Leynadier F, Sansarricq M, Didier JM, et al. Prick test in the diagnosis of anaphylaxis of general anesthetic allergy. Br J Anaesth 1987; 59: 683-689.
- Fisher MM, Bowey CJ. Intradermal comparing with prick testing in the diagnosis of anaesthetic allergy. Br J Anaesth 1997; 79: 59-63.
- Fisher M, Baldo BA. Anaphylaxis during anaesthesia: current aspects of diagnosis and prevention. Eur J Anaesthesiol 1994; 11: 263-284.
- Mata E, Gueant JL, Moneret-Vautrin DA, et al. Clinical evaluation of in vitro leukocyte histamine release in allegy to muscle relaxant drugs. Allergy 1992; 47: 471-476.
- Mertes PM, Lambert M, Guéant-Rodríguez RM, et al. Perioperative Anaphilaxis. Immunol Allergy Clin N Am 2009; 29: 429-451.
- Luxoro C, Bustamante R. Anafilaxia Perioperatoria: tratamiento y manejo alergoanestésico. Rev Chil Anest 2010; 39; 53-58.
- Del Duca D, Sheth SS, Clarke AE, et al. Use of methylene blur for cathecholamine-refractory vasoplegia from protamine and aprotinin. Ann Thor Surg 2008: 87: 640-642.
- Dewatcher P, Raeth-Fries I, Jouan-Hureaux V, et al. A comparison of epinephrine only, arginine vasopresine only, and epinephrine following arginine vasopressin on the survival rate in a rat model of anaphylactic shock. Anesthesiology 2007; 106: 620-624.
- Jones, PM, Turkstra TP. Mitigation of rocuronium induced anaphylaxis by sugammadex: the great unknown: Anaesthesia 2010; 65: 89-90.
- McDonnell NJ, Pavy TJ, Green LK, Platt PR. Sugammadex in the management of rocuronium-induced anaphylaxis. Br J Anaesth 2011; 106: 199-201.
- Recomendaciones Clínicas: Anafilaxia en anestesia. (Acceso el 15 de noviembre de 2011 en: http://www.sachile.cl/medicos/recomendaciones/anafilaxia/presentacion.ph p ).


 Creative Commons Attribution
Creative Commons Attribution