René Asenjo G.* y Carlos Montalván R.**
Reve Chil Anest Vol. 42 Número 1 pp. 113-123|doi:
PDF|ePub|RIS
1.- Marcapasos Cardíacos
Desde que en 1958 se hizo el primer implante de un marcapaso (MP) se han realizado grandes adelantos en estos aparatos. Los equipos iniciales permitían evitar el síncope y la muerte por asistolia. Los avances tecnológicos han permitido agregar nuevas funciones, de modo que actualmente son capaces de mantener la sincronía aurículo-ventricular (AV), aumentar la frecuencia cardíaca (FC) según las necesidades del paciente, almacenar y entregar datos diagnósticos, y evaluar el estado del MP y de la integridad de los electrodos 1 , 2 . Equipos más sofisticados permiten realizar estimulación auricular y/o ventricular programada no invasivamente a través de ellos para convertir taquiarritmias, cambiar automáticamente su modo de estimulación si se produce una taquiarritmia supraventricular (SV) y monitorizar permanentemente la impedancia de los electrodos y cambiar a estimulación unipolar (UP) si se detecta una fractura o falla del asilamiento del electrodo, para evitar la pérdida de captura.
En los últimos años se ha conocido mejor que en algunos pacientes la estimulación ventricular genera contracción disincrónica, la que puede tener efectos deletéreos cuando la función sistólica está deprimida 3 . El desarrollo tecnológico de los MP actuales permite resolver este problema básicamente de dos maneras 4 , 5 : en los pacientes que tienen conducción AV adecuada puede implantarse un MP que tenga una función para buscar automáticamente conducción AV intrínseca para privilegiar la contracción ventricular espontánea y para el caso de los enfermos con disfunción ventricular izquierda y QRS ancho se han diseñado MP resincronizadores, los que mediante un electrodo en ventrículo derecho (VD) y otro en el ventrículo izquierdo (VI), implantado generalmente vía seno coronario (SC), más el electrodo auricular derecho en los pacientes en ritmo sinusal, permiten una estimulación simultánea de ambos ventrículos evitando o corrigiendo la contracción disincrónica que produciría la estimulación en VD con un MP convencional.
Estos adelantos permiten que en la actualidad los MP no sólo sean más seguros y prevengan el síncope y muerte por asistolia sino que también, y cuando son indicados y programados adecuadamente, puedan optimizar la función cardíaca, mejorando la capacidad funcional y calidad de vida, y en el caso de los resincronizadores incrementar la sobrevida en la población de pacientes con severa disfunción ventricular 6 –10 .
-
Características de los marcapasos
El MP es un dispositivo que libera un estímulo eléctrico a través de un electrodo que está en contacto con el corazón. Este electrodo sensa actividad eléctrica cardíaca, la transmite al MP y éste se inhibe o envía un estímulo con intervalos y características determinados en el circuito electrónico del MP mediante la programación realizada 1 , 2 . Todos los MP actuales son de demanda, por lo que se inhiben cuando hay actividad cardíaca intrínseca. La fuente de energía es una batería de litio-yodo, de características predecibles en cuanto a la entrega de energía y longevidad, permitiendo una estimulación segura por muchos años. Todos los MP actuales son programables y difieren entre los fabricantes por las funciones que ofrecen. Mediante un programador especialmente elaborado por cada fabricante el MP puede ser “interrogado” y programado por telemetría 1 , 2 .
Los MP que sólo estimulan aurícula o ventrículo se denominan unicamerales (UC) y requieren solamente un electrodo ubicado en la cavidad a estimular. En cambio, los MP con capacidad de estimular aurícula y ventrículo se denominan bicamerales (BC) o secuenciales (Figura 1). Estos requieren de un cable-electrodo en aurícula y otro en ventrículo, aunque también se dispone de sistemas BC con electrodo único con un electrodo distal en ventrículo y otro flotante en aurícula derecha, que funciona sensando aurícula lo que gatilla un estímulo en ventrículo (VDD), permitiendo así la sincronía AV. Finalmente están los MP resincronizadores, o tricamerales, o para estimulación biventricular, utilizados para terapia de resincronización ventricular (TRV) en pacientes con insuficiencia cardiaca y QRS ancho, y que como antes mencionamos requieren de un tercer electrodo para estimular VI.
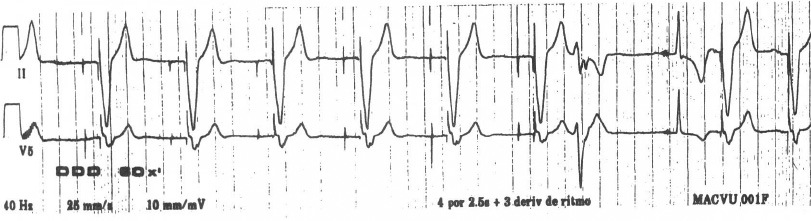
Figura 1 Trazado electrocardiográfico de un marcapaso bicameral. Se aprecian ambas espigas (auricular y ventricular).
-
Codificación y modos de estimulación
Con el objeto de identificar fácilmente los modos de estimulación existentes se ha desarrollado una codificación internacional por la North American Society of Pacing and Electrophysiology (NASPE) y la British Pacing and Electrophysiology Group (BPED). Esta nomenclatura, conocida como codificación NBG, se basa en 5 letras (Tabla 1). A las posibilidades existentes para cada letra hemos agregado la alternativa “S”, usada por los fabricantes para identificar a los MPs que pueden usarse indistintamente en aurícula o ventrículo 1 , 2 .
Tabla 1 Codificación internacional de estimulación cardiaca
|
Cámara estimulada |
Cámara sensada |
Modo de respuesta |
Respuesta de frecuencia |
Resincronizador |
|
A |
A |
I |
R |
|
|
V |
V |
I |
R |
|
|
V |
D |
D |
R |
|
|
D |
D |
D |
R |
V |
|
A: aurícula; V: ventrículo; I: inhibido; D: dual o doble (en el caso de la cámara estimulada o sensada se refiere a ambas cámaras, y en el caso de modo de respuesta significa respuesta dual, es decir puede inhibirse o gatillar una un estímulo; R: capacidad de respuesta de frecuencia; V: indica estimulación bi ventrícula (ref 2, con permiso). |
||||
- La primera letra identifica la cámara estimulada: V = ventrículo, A = aurícula; D = ambas cámaras, O = ninguna y S = aurícula o ventrículo.
- La segunda posición indica la cámara sensada: V, A, D, O y S igual que para la primera letra.
- La tercera señala el modo de respuesta al sensado: I = inhibido (el estímulo es inhibido al sensar un evento). T = gatillado (el sensado de un evento gatilla un estímulo). D = ambos (un estímulo puede ser gatillado por un evento sensado en una cámara e inhibido por uno sensado en la otra). En la práctica, en los MP bicamerales (DDD) un evento sensado inhibe el estímulo en la cámara donde se sensa, pero al mismo tiempo la estimulación y sensado auricular gatillan un estímulo ventricular. O = ninguna respuesta al sensado.
- La cuarta letra corresponde a la programabilidad: O = no programable. P = programable hasta 3 parámetros. M = programabilidad de más de 3 parámetros. C = Capacidad de comunicación por telemetría y R = capacidad de respuesta de frecuencia. En la actualidad todos los MP son multiprogramables y tienen capacidad de telemetría por lo que esta letra es utilizada para señalar la respuesta de frecuencia.
- Finalmente, el significado de la quinta posición que indicaba la capacidad de funciones antitaquicardia del generador, ha sido cambiada y ahora se usa para distinguir a los pacientes que tienen MP con resincronización o estimulación en más de un sitio: O = ninguna, A = más de un electrodo en aurículas, V = más de un electrodo en ventrículos, y D = en ambas cámaras. Así en un paciente con un MP para TRV el código sería DDDRV
2.- Marcapasos para terapia de resincronización ventricular
La estimulación biventricular o TRV, desarrollada en las últimas 2 décadas, es uno de los avances más importantes en el manejo de la insuficiencia cardiaca, al demostrarse que en pacientes bien seleccionados mejora los parámetros de función ventricular, la capacidad funcional, la calidad de vida, y la sobrevida 6 , 10 . Las bases para la TRV se fundamentan en las observaciones de que un retardo de conducción intraventricular, cuya manifestación electrocardiográfica más común es el bloqueo completo de la rama izquierda, se asocia a una contracción ventricular asincrónica, ya que el septum interventricular se contrae antes que los segmentos basales y laterales del VI. Esto implica que algunos segmentos del VI se contraen mientras otros se están relajando, lo que repercute negativamente en la función sistólica y diastólica ventricular izquierda y produce insuficiencia mitral, entre los efectos más importantes 5 .
El implante de un MP para TRV requiere de un electrodo convencional en VD, el que es recomendable insertarlo en la región septal alta, y otro especialmente diseñado para estimular en la región basal de la pared lateral o póstero lateral del VI. A estas zonas se accede a través del SC desde donde el electrodo se avanza a una rama venosa lateral o póstero lateral del VI (Figura 2). Adicionalmente, si el paciente mantiene ritmo sinusal se inserta un electrodo auricular convencional en la aurícula derecha, y en el caso de los enfermos en FA permanente sólo se insertan los electrodos ventriculares. Los electrodos implantados se conectan a un MP especialmente diseñado, el que tiene canales separados para VD y VI, lo que permite estimular en ambos ventrículos en forma diferenciada según los requerimientos de cada paciente. Esto se define posterior al implante, midiendo mediante distintos métodos ecocardiográficos el grado de retardo entre septum y la pared lateral del VI. El MP se programa adelantando la estimulación en el canal del VI hasta que no exista retardo o se minimice al máximo. Así se corrige el retardo eléctrico y mecánico de la contracción ventricular izquierda – es decir se sincroniza- lo que produce mejoría de los parámetros de la función sistólica y diastólica del VI y disminuye el reflujo mitral, sin aumentar el consumo de O2 miocárdico 5 . En el ECG el cambio es inmediato, observándose que el QRS se angosta y aparece una onda Q en las derivaciones laterales y onda R en VI, como producto de la estimulación desde la región lateral del VI (Figuras 3 y 4), lo que difiere de la estimulación exclusiva desde ventrículo derecho, en que hay un patrón QS en las derivaciones precordiales derechas y QRS habitualmente positivo en precordiales izquierdas, además de un eje eléctrico izquierdo
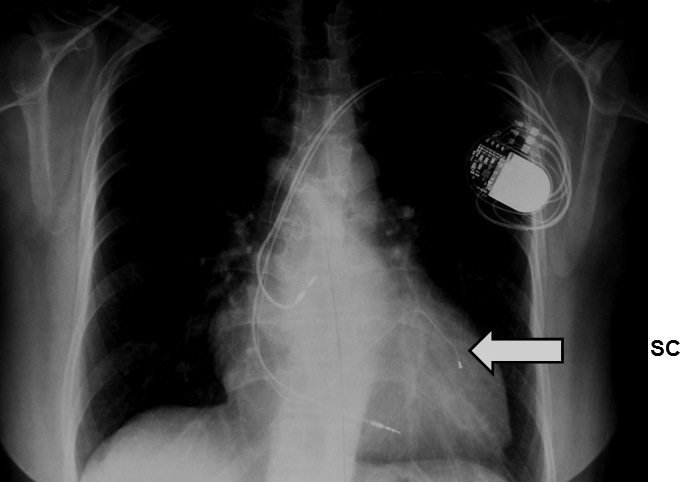
Figura 2 Radiografía de un paciente portador de un marcapaso para terapia de resincronización ventricular. La flecha señala el electrodo que estimula el ventrículo izquierdo a través del seno coronario.
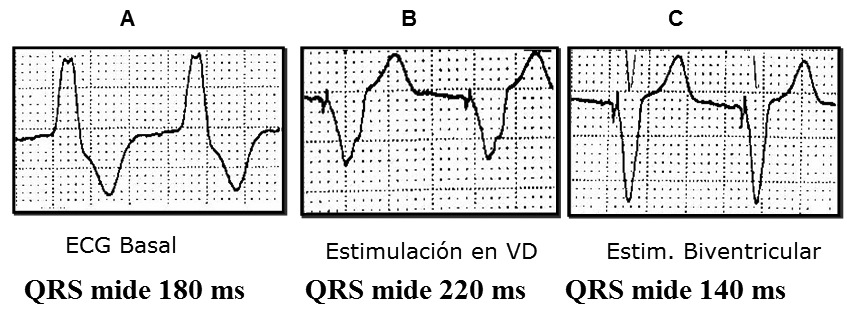
Figura 3 Efecto eléctrico de la TRV.
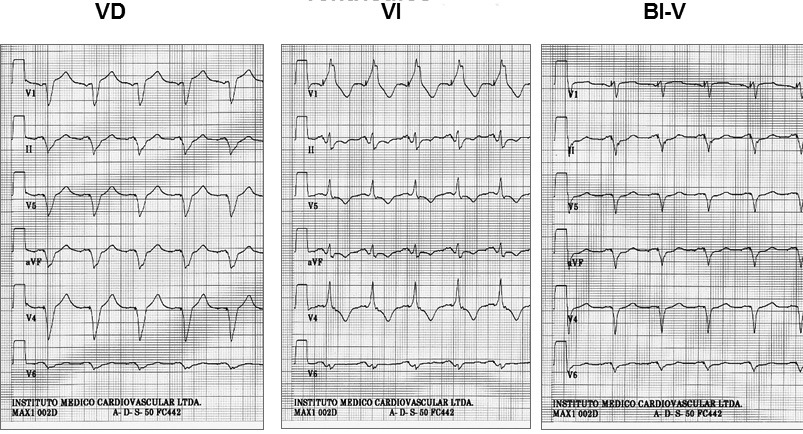
Figura 4 ECG de derivaciones precordiales durante pacing en ventrículo derecho (VD), ventrículo izquierdo (VI) y simultáneo en ambos ventrículos (BI-V).
3.- Desfibrilador automático implantable
El cardiodesfibrilador implantable (CDI) fue desarrollado en la década del 70 por Michel Mirowski para revertir una taquiarritmia ventricular maligna que de no ser tratada culminaría en una muerte súbita (MS).
Desde el primer implante realizado en 1980, el número de sistemas implantados en Europa y Norteamérica ha aumentado exponencialmente y, aunque en una proporción considerablemente menor, también ha aumentado en nuestro país y en el resto de Sudamérica. Sin embargo, y a pesar de las evidencias contundentes que confirman que es superior a la terapia con drogas antiarrítmicas para la prevención primaria y secundaria de la MS 11 – 14 , su alto costo (US$10.000 a 20.000) hace que en países con menos recursos sea aún una terapia subutilizada.
-
¿Por qué es necesario el CDI?
Existen numerosos datos estadísticos que avalan la necesidad de contar con una forma de terapia que rápidamente pueda convertir una taquicardia ventricular (TV) con compromiso hemodinámico, o una fibrilación ventricular (FV) 15 .
Una TV puede inducir FV y esta arritmia si no es rápidamente convertida puede producir la muerte o dejar graves secuelas neurológicas. En Europa cada año alrededor de 750.000 personas presentan MS, y en los Estados Unidos de Norteamérica la cifra oscila entre 300.000 y 400.000. En cerca del 80% de los casos la causa es una TV o una FV. En cerca del 70% de estos pacientes la arritmia inicial es una TV que degenera en FV, y esta última es la arritmia primaria en 10 a 20% de los casos. Para los restante pacientes una bradiarritmia es la causa de MS 2 . En Chile no se conocen cifras confiables de la magnitud de este problema.
Al menos el 75% de estos pacientes con paro cardíaco extrahospitalario no asociado a un infarto del miocardio (IAM) no sobreviven al evento y mueren antes de llegar al hospital. De los que alcanzan a ser atendidos sólo entre 5 y 25% egresan vivos de un hospital. Las patologías responsables de estas arritmias malignas son la enfermedad coronaria en 80% de los pacientes, miocardiopatía dilatada en cerca del 10%, otras cardiopatías en 5% y, ausencia total de enfermedad Cardíaca demostrable en los restantes pacientes2.
En pacientes que sobreviven a un paro cardíaco y son tratados con terapia antiarrítmica la recurrencia de MS ocurre en 10 a 40% a los 2 años de seguimiento. El CDI al detectar una TV o FV la convierte a los pocos segundos, lo que la hace una terapia altamente exitosa para tratar esta arritmia y que no deja secuelas, por lo que en la actualidad, sin duda, es el mejor tratamiento que puede recibir un paciente con riego de MS. De hecho, con el implante de un CDI en estos pacientes se ha logrado reducir la mortalidad por esta causa a 1 a 2% por año.
-
Componentes, funciones y selección de un CDI
El sistema está compuesto de un generador y un electrodo de desfibrilación, sensado y estimulación. El generador -envuelto en una carcasa de titanio- está compuesto de una batería de litio, plata y óxido de vanadio que aporta unos 6 V, uno o dos capacitores que convierten el voltaje de la batería a alto voltaje para el shock de desfibrilación, y un circuito electrónico para detectar arritmias, aplicar distintas terapias en forma consecutiva – pulsos de sobreestimulación y shock de baja energía para una TV, y de alta energía para FV – además de estimulación cardiaca igual como lo hace un MP 2 , 15 . Adicionalmente tiene la capacidad de depositar numerosos datos para su análisis mediante telemetría, como electrogramas y detalles de cada evento arrítmico diagnosticado y tratado, entre los más destacables. Cuando se cumplen los criterios programados para liberar un shock la batería carga los capacitores hasta el voltaje programado (30 a 35 J según el fabricante) en un lapso de tiempo cercano a 5 segundos, según el voltaje requerido y la antigüedad del generador.
Los primeros sistemas eran implantados por toracotomía y la descarga era liberada a través de dos parches epicárdicos. Desde 1989 se utilizan electrodos transvenosos, por lo que las descargas se aplican entre 1 ó 2 electrodos intracavitarios y la carcasa del generador que actúa como un polo activo. Este cable electrodo tiene incorporado el electrodo de sensado, de estimulación y el de desfibrilación ventricular, simplificando el sistema a un generador y un cable electrodo intracavitario, similar a un marcapasos (MP). Adicionalmente, un CDI puede ser unicameral (similar a un MP VVIR), bicameral (con función de un MP DDDR), o ser parte de un sistema para TRV (CDI + TRV). La indicación de un dispositivo uni o bicameral depende principalmente de la necesidad de estimular en aurícula, aunque también suele preferirse un sistema bicameral para mejorar el diagnóstico adecuado de taquiarritmias SV y evitar descargas inapropiadas por esta causa2. El implante de un CDI es un procedimiento técnicamente muy parecido al implante de un MP endocavitario, y actualmente es realizado con anestesia local. Terminado el implante, en el mismo pabellón y a través del dispositivo recién implantado, se induce FV (Figura 5) y se prueba la eficacia del sistema para revertir esta arritmia, para lo cual se administra sedación profunda.
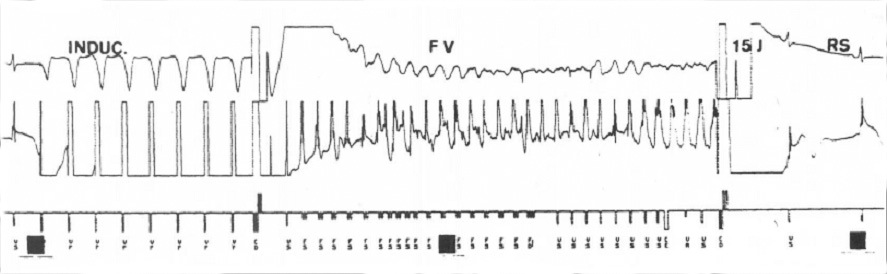
Figura 5 Trazado obtenido durante la prueba posterior a la implantación de cardiodesfibrilador implantable. Se aprecia la inducción de la arritmia, la fibrilación ventricular, la descarga y la recuperación del ritmo sinusal.
En la Figura 6 se muestra la radiografía de tórax de un paciente con CDI. La gran mayoría de los pacientes requieren una programación del CDI para diagnosticar y tratar una TV y una FV. Así, generalmente el dispositivo se programa con una zona para diagnosticar TV (por lo general frecuencia ventricular entre 150 y 200/min), y otra para FV (habitualmente frecuencia ventricular de 200/min o más). Para tratar la TV el CDI puede aplicar pulsos de estimulación ventricular en varias secuencias y ciclos que son programables, y si luego de varios intentos la arritmia persiste, aplica varias secuencias de shock de baja energía (usualmente 2 a 10 J) hasta lograr convertir la taquicardia (Figura 7). Si la detección de la taquicardia corresponde a una FV, la que puede iniciarse como tal o ser producto de una TV que espontáneamente degenera en FV, o ser consecuencia de alguna de las terapias para convertir una TV (las que en vez de convertirla la degeneran en FV), el CDI aplica una descarga de alta energía (15 a 35 J según lo programado por el electrofisiólogo, la que se repite en forma consecutiva hasta 6 veces por evento, luego de lo cual el dispositivo asume que el paciente no es recuperable. Luego de las terapias para convertir una TV o FV alrededor de un 20% de los pacientes presentan bradiarritmias transitorias, lo que es resuelto con la función de MP que posee el dispositivo.
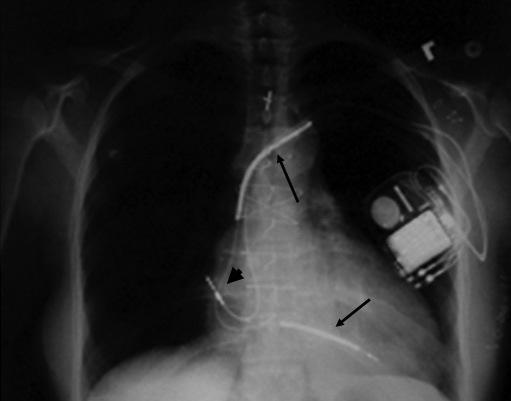
Figura 6 Radiografía de tórax de un paciente portador de un cardiodesfibrilador implantable.
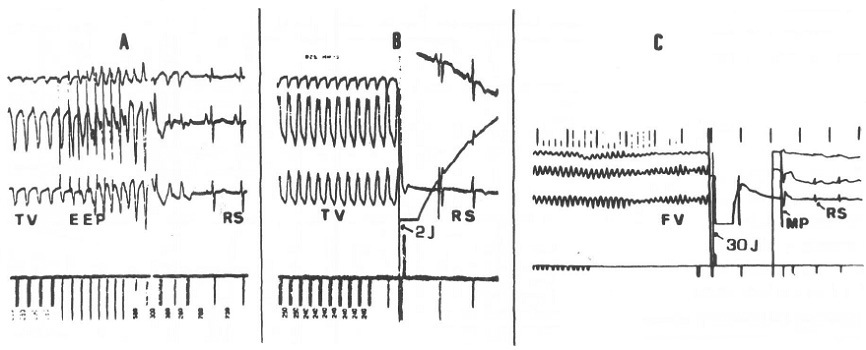
Figura 7 Conversión de una taquicardia ventricular a ritmo sinusal.
-
Evaluación preoperatoria
Además de la evaluación general que debe tener todo paciente que va a ser sometido a anestesia, en uno que es portador de este tipo de dispositivos se necesita determinar claramente lo siguiente: ¿tiene un marcapasos o desfibrilador automático?, ¿qué tipo de aparato tiene?, ¿en qué grado es dependiente del marcapasos?, y finalmente, ¿cómo está funcionando ese dispositivo? 16 .
Para establecer si el paciente que atendemos tiene o no uno de estos dispositivos, es necesaria una historia clínica completa y un examen físico orientado a buscar elementos que nos indiquen que se ha instalado un MP, MP para TRV o CDI, como cicatrices o una prominencia a nivel torácico o abdominal. El paciente muchas veces aporta el dato claramente al principio de la entrevista, otras veces es necesario revisar los registros en la ficha clínica, radiografías previas, electrocardiogramas, etc., incluso información que pueden aportar los fabricantes o proveedores.
La información del tipo de dispositivo se obtiene de la etiqueta que provee el fabricante, que habitualmente se adjunta a la ficha clínica. Como fuente adicional se puede acceder al código del dispositivo a través de una radiografía de tórax.
La dependencia de la función del marcapasos del dispositivo es una información muy relevante para el anestesiólogo; y, en general, es proporcionada por el cardiólogo interconsultor. Sin embargo, una anamnesis detallada y una revisión de la indicación del aparato nos permiten orientarnos al respecto: la evidencia de un síncope secundario a una bradiarritmia o el antecedente de una ablación del nodo aurículo ventricular hacen suponer una dependencia exclusiva o importante del aparato.
La función del MP/CDI, se evalúa a través de un interrogatorio por telemetría, el que entrega datos acerca de la configuración, modos disponibles y duración de la batería. Si no es posible un interrogatorio exhaustivo, al menos debería objetivarse la presencia de actividad eléctrica producida por el marcapasos, y que ésta se acompaña de una actividad mecánica efectiva (pulso palpable, onda de pletismografía o curva de presión arterial invasiva).
En la evaluación preoperatoria no hay que olvidar que muchas veces estos pacientes tienen una reserva cardiovascular limitada, lo que puede condicionar la monitorización y el manejo anestésico perioperatorio. Esto es más esperable en pacientes que tienen un MP para TRV y por lo tanto insuficiencia cardíaca avanzada y fracción de eyección ventricular izquierda menor de 35%, y en la mayoría de los pacientes con un CDI. Por lo tanto, la evaluación y optimización de sus enfermedades concomitantes es fundamental en esta etapa.
Hay algunos dispositivos que pueden simular una batería de marcapasos cardíaco, como por ejemplo en pacientes con aparatos destinados a controlar la Enfermedad de Parkinson, la epilepsia, y otros trastornos no relacionados a problemas cardíacos, que pueden inducir a error durante la evaluación preanestésica 21 .
Un aspecto relevante en el manejo de estos pacientes, y que muchas veces inquieta a los anestesiólogos, es el uso de un imán durante la cirugía. Si bien es cierto es importante contar con un imán en el pabellón, su uso debe ser cuidadoso, y teniendo en cuenta lo siguiente: la utilidad del imán originalmente se correlacionó con la posibilidad de darse cuenta de la duración de la batería y algunos factores importantes relativos a los umbrales. Su aplicación no estaba pensada para tratar emergencias o prevenir una interferencia electromagnética. Por otra parte, el resultado de su aplicación no es igual para todos ellos 17 . Por ejemplo, si aplicamos un imán a un CDI, éste no pasará a modo asincrónico en su función de MP, pero en algunas marcas se desactiva su función de CDI (en otras marcas la respuesta al imán es programable). En el caso de un MP, éste se transforma en asincrónico y además estimula a una frecuencia mayor (generalmente 90 a 100/min) durante su aplicación y retorna a la frecuencia programada y estimulación sincrónica una vez que retiramos el imán. Por lo tanto, su principal utilidad es cuando se usa bisturí eléctrico cerca de la fuente de poder o de los electrodos en pacientes dependientes de MP. La aplicación del bisturí eléctrico puede ser leída por el MP como actividad cardiaca e inhibirse, con la consiguiente asistolia si el enfermo no tiene ritmo propio. Esto se evita colocando un imán sobre el MP durante la aplicación del bisturí eléctrico. Este problema es más probable que ocurra cuando los MP son unipolares y la aplicación del bisturí eléctrico también es monopolar. La otra utilidad del imán es la detención de una taquicardia mediada por MP (Figura 8) y en el caso de un CDI que no fue desactivado, lo que suele realizarse en pacientes eléctricamente inestables y con riesgo de hacer taquiarritmias en pabellón, se aplica el imán sobre el dispositivo durante el uso de bisturí eléctrico, y se retira cuando deja de usarse.
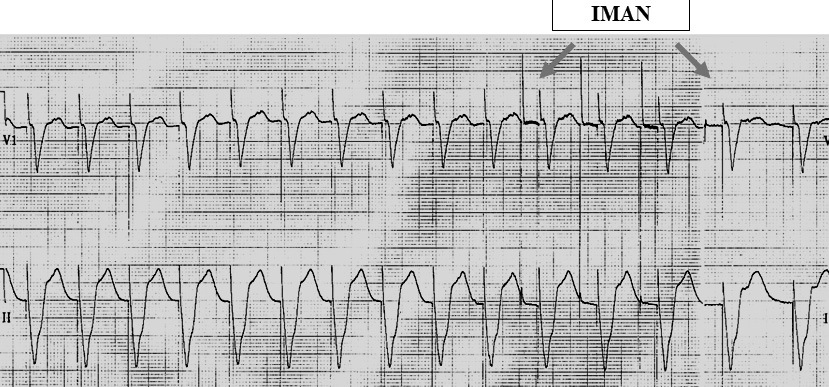
Figura 8 MP DDD 60-120/min. Efecto de la aplicación de un imán en una taquicardia mediada por MP.
Por otro lado, el principal problema del uso de imán en un paciente con MP es que al estimular en forma asincrónica, si el paciente tiene ritmo propio va haber competencia con éste, lo que podría generar un estímulo en período vulnerable y que éste gatille una fibrilación ventricular. El anestesiólogo debe ver el monitor al usar un imán y estar preparado para tratar esta, muy rara, pero potencialmente fatal complicación.
La mejor forma de saber la respuesta del dispositivo al imán y su programación, es consultar con su electrofisiólogo tratante, o solicitar la información al proveedor local. En la literatura es posible encontrar tablas respecto al efecto del imán sobre los distintos aparatos disponibles en el mercado 22 .
Por lo tanto, actualmente, el interrogatorio con un programador sigue siendo el método más confiable y seguro para conocer el estado de la batería del dispositivo, el estado de los cables y la adecuada programación. En cirugía electiva, la reprogramación del aparato a un modo asincrónico, o la desprogramación de ciertas características específicas debe hacerse en conjunto con el electrofisiólogo tratante, teniendo en cuenta los riesgos que esto puede implicar y las posibles interferencias electromagnéticas que se pueden encontrar en pabellón y que pueden afectar su funcionamiento.
-
Interferencia electromagnética
Esto se refiere a la influencia que un campo electromagnético tiene en el funcionamiento de cualquier dispositivo electrónico. Esto puede suceder de dos formas: conducida y radiada 18 . La interferencia electromagnética conducida ocurre cuando una fuente electromagnética entra en contacto directo con el cuerpo, por ejemplo con un bisturí eléctrico o un desfibrilador. Cuando el cuerpo se expone a un campo electromagnético, como por ejemplo en un resonador magnético, ocurre una interferencia radiada. En relación al uso del bisturí eléctrico, las variables que determinan la probabilidad de interferencia con el funcionamiento de un MP/CDI son: la intensidad a la cual se usa, la frecuencia y forma de onda de la señal, la distancia entre el lugar donde se está aplicando el bisturí eléctrico y los cables del dispositivo (MP/CDI), y la orientación de los cables con respecto al campo electromagnético. La corriente de corte puede producir más interferencia que la corriente de coagulación 19 . Cuando se usan aparatos bipolares o multipolares, se genera un campo electromagnético muy localizado, y por lo tanto, la interferencia es menor comparada con los aparatos monopolares. Los factores que determinan la sensibilidad de un MP/CDI a un campo electromagnético incluyen: la presencia y número de cables electrodos, la distancia entre el ánodo y el cátodo del dispositivo implantado (menor distancia en cables bipolares que unipolares), y la sensibilidad programada del aparato a un estímulo eléctrico. Actualmente casi todos los MP son bipolares, y todos los CDI usan sensibilidad bipolar por lo que tienen menos posibilidades de ser afectados por interferencia (Figura 9).
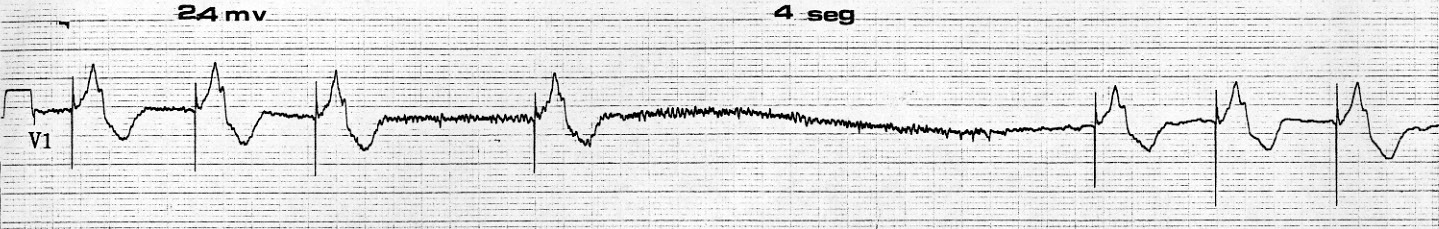
Figura 9 Interferencia de un campo electromagnético sobre la función del marcapaso. El marcapaso se inhibe de descargar, produciendo un período de asistolia en un paciente sin actividad eléctrica propia.
Teóricamente, la interferencia electromagnética generada por un instrumento quirúrgico eléctrico en un MP/CDI, se puede manifestar de las siguientes formas 20 :
- La señal puede ser malinterpretada como fisiológica o fisiopatológica, temporalmente inhibiendo o gatillando un estímulo. Por ejemplo, la señal puede ser interpretada como actividad cardíaca intrínseca inhibiendo el marcapasos, o como una taquicardia/fibrilación ventricular gatillando una descarga en un CDI.
- La señal puede ser interpretada como ruido, volviendo el dispositivo, temporal o permanentemente, a una modalidad preseleccionada por el fabricante.
- Altos niveles de energía pueden pasar a través de los cables y producir daño a los tejidos contiguos.
- Un tren continuo de impulsos eléctricos puede ser conducido por los cables y producir un estímulo en aurícula o ventrículo que genere arritmias severas.
- Altos niveles de energía pueden producir daño permanente de la batería o de todo el dispositivo.
- El uso de bisturí eléctrico en un paciente con batería residual muy baja puede terminar de agotarla.
En la literatura es posible encontrar evidencia de posible interferencia electromagnética con: bisturí eléctrico 23 , 24 , ablación por radiofrecuencia 25 , 26 y resonancia nuclear magnética 27 , 28 . En relación a litotricia, radioterapia y terapia electro-convulsiva, la evidencia es contradictoria ya que hay reportes que sí muestran interferencia en estas situaciones, y otros reportes que no. Hay comunicaciones de casos clínicos en que se han producido frecuencias cardíacas anormalmente elevadas como resultado de interferencias electromagnéticas entre monitores cardíacos y MP/CDI con sensores de ventilación minuto activos 30 .
Por tanto, en relación a interferencia, lo que se sugiere es evaluar si efectivamente ésta es posible de ocurrir. Si es así; en pacientes dependientes de la función de marcapasos del dispositivo, se sugiere dejar en modo asincrónico, ya sea vía reprogramación del dispositivo, o mediante la aplicación de un imán. Además en estos casos sería aconsejable suspender algunos algoritmos especiales como funciones de adaptación de frecuencia. En el caso de CDI, se debe evaluar el riesgo arrítmico; si es alto, es preferible activar la respuesta al imán en los dispositivos en que esta función es programable, y dejar el CDI activo, y desactivarlo transitoriamente aplicando sobre el un imán cada vez que se use el bisturí eléctrico. Si el riego es bajo se programa previamente a modo monitor y se reprograma al terminar la cirugía.
En todo paciente con MP, resincronizador o CDI que va a pabellón se sugiere el uso de bisturí eléctrico bipolar o bisturí ultrasónico (armónico). Desfibriladores y marcapasos externos debieran estar siempre disponibles durante y después del procedimiento.
La técnica anestésica no alteran la función del MP/CDI, sin embargo, las alteraciones fisiológicas que puede producir en el paciente, podrían inducir respuestas anormales en el dispositivo, y en la interacción dispositivo-paciente.
-
Manejo durante la cirugía (o durante el procedimiento) de pacientes portadores de MP/CDI
No es necesaria una técnica de monitorización especial aparte de la que es habitual en pabellón o donde se realice el procedimiento.
La electrocardiografía es fundamental y obligatoria en estos pacientes, al igual que algún método de monitorización del pulso periférico (palpación del pulso, auscultación de ruidos cardíacos, pletismografía, etc.) 29 .
-
Manejo de las potenciales fuentes de interferencia electromagnética 16 :
- Bisturí eléctrico: Posicionar el bisturí y la placa de tierra de tal forma que la corriente que fluye entre ambos no pase por el generador ni los cables del MP/CDI. Evitar utilizar el bisturí eléctrico cerca del generador y los cables (se recomienda una distancia mayor de 15 cm). Si es necesario usar el bisturí eléctrico, hacerlo mediante pulsos cortos, intermitentes e irregulares a la más baja energía posible. Usar bisturí eléctrico bipolar o bisturí ultrasónico, cada vez que sea posible.
- Ablación por radiofrecuencia: Evitar el contacto directo del catéter de ablación con la batería y cables del MP/CDI. Evitar que el circuito del sistema de ablación pase a través de la batería y cables del MP/CDI.
- Litotricia: Evitar dirigir el haz de litotricia cerca de la batería del dispositivo. Podría ser necesario inhabilitar el estímulo auricular si el sistema de litotricia se gatilla en la onda R.
- Resonancia Nuclear Magnética: De acuerdo a la evidencia disponible hasta ahora, estaría contraindicada en pacientes portadores de MP/CDI. Cabe destacar que actualmente hay 2 fabricantes en Chile con MP que permiten el uso de resonancia, por lo que ya hay bastantes pacientes con estos dispositivos implantados. Sin embargo, aún no hay disponibles resincronizadores ni CDI para resonancia.
- Radioterapia: Puede ser aplicada si el campo de irradiación está fuera del lugar donde se encuentra el MP/CDI.
- Terapia electro-convulsiva: Se podría aplicar en forma segura tomando ciertas precauciones: inhabilitar las funciones del CDI, estar preparados para tratar arritmias que puedan ocurrir durante o después del procedimiento y tener disponible un MP externo en caso necesario.
- Desfibrilación o cardioversión de emergencia: Detener inmediatamente cualquier fuente de interferencia electro-magnética, considerar rehabilitar las funciones antitaquiarritmia mediante reprogramación o retiro del imán si es el caso. Si no hay tiempo o si lo anterior no resuelve el problema, administrar la descarga eléctrica de acuerdo a las guías de RCP, si es posible tratando de usar la menor cantidad de energía y evitando posicionar las paletas del desfibrilador directamente encima del dispositivo (deben estar a más de 15 cm). Las paletas deben posicionarse en forma perpendicular al eje del MP/CDI y electrodos, en posición antero-posterior. Debe tenerse en cuenta que luego de la descarga puede haber aumento transitorio del umbral de estimulación (Figura 10), lo que puede generar asistolia en pacientes sin ritmo propio. Esto generalmente dura algunos segundos, pero si se mantiene se debe usar MP externo mientras se reprograma el MP.

Figura 10 MP DDD: falla de captura en aurícula y ventrículo de 5 s en paciente con FA sometido a CVE.
-
Manejo postoperatorio
El paciente debería estar monitorizado durante todo el período postoperatorio, hasta que el dispositivo haya sido interrogado y estemos seguros de su buen funcionamiento, o se hallan restablecido las funciones previamente inhabilitadas por efecto de interferencias electro-magnéticas, reprogramación o uso del imán.
REFERENCIAS
- Hayes DL, Lloyel MA, Friedman PA. Cardiac Pacing and Defibrillation: a Clinical approach. Futura Publishing Co. 2000
- Asenjo R. Dispositivos Cardiacos. Capítulo del libro Enfermedades del Corazón y los Vasos (Rojas Villegas). Editores. M. Oyonarte, R. Corbalán, E. Escobar y O. Román, Editorial Mediterráneo, 2012.
- Sweeney MO, Hellkamp AS, Ellenbogen KA, et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation 2003; 107: 2932-2937.
- Epstein AE, DiMarco JP, Ellenbogen KA, et al. ACC/AHA/HRS 2008 guidelines for device-based therapy of cardiac rhythm abnormalities: a report of the American Collage of Cardiology/America Herat Association Task Force on Practice Guidelines (Writing Comité to Revise the ACC/AHA/NASPE 2002 Guileline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices). J Am Coll Cardiol 2008; 51: e1-62.
- Asenjo R, Fajuri A, González R. Indicaciones del Implante de Marcapasos Definitivos y Desfibrilador Automático. Recomendaciones del Comité de Educación Continua de la Sociedad Chilena de Cardiología y Cirugía Cardiovascular. Rev. Chil Cardiol 2004; 23: 375-391.
- Asenjo R, Cereceda M. Rol de la Terapia de Resincronización Ventricular en el Tratamiento de pacientes con Insuficiencia Cardiaca Avanzada. Rev. Cardiología Clínica 2006; 22: 88-93.
- Cleland JG, Daubert J, Erdmann E, et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352: 1539-1549.
- Bristow MR, Saxon LA, Boehmer J, et al. Cardiac resinchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004; 350: 2140-2150.
- Abraham WT, Young J, León A, et al. Effects of cardiac resynchronization on disease progression in patients with left ventricular systolic dysfunction, an indication for an implantable cardioverter-defibrillator, and mildly symptomatic heart failure. Circulation 2004; 110: 2864-2868.
- Montagna R, Asenjo R, Morris R, Shumacher E, et al. Terapia de Resincronización Ventricular en pacientes portadores de marcapasos definitivo e insuficiencia cardíaca avanzada. Rev. Chil Cardiol 2005; 24: 48-59.
- Moss AJ, Hall WJ, Cannom DS, et al. Improved survival with an implanted defibrillator in patiensts with coronary disease at high risk for ventricular arrhythmia. N Engl J Med 1996; 335(26): 1933-1940.
- The Antiarrhythmics Versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. N Engl J Med 1997; 337: 1576-1580.
- Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002; 346: 877-883.
- Bardy GH, Lee KL, Mark DB, et al. for the Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005; 352: 225-237.
- Asenjo R, Vidaillet H Jr, Hayes JJ. Avances en el tratamiento de las taquiarritmias. Rol de los métodos no farmacológicos. Rev Med Chile 1995; 123: 1137-1149.
- Practice Advisory for the Perioperative Management of Patients with Cardiac Implantable Electronic Devices: Pacemakers and Implantable Cardioverter-Defibrillators An Updated Report by the American Society of Anesthesiologists Task Force on Perioperative Management of Patients with Cardiac Implantable Electronic Devices: Anesthesiology 2011; 114: 247-261.
- Rozner M. The patient with a cardiac pacemaker or implanted defibrillator and management during anaesthesia: Current Opinion in Anaesthesiology 2007; 20: 261-268.
- Sager DP. Current facts on pacemaker electromagnetic interference and their application to clinical care. Heart Lung 1987; 16: 211-221.
- Betra YK, Bali IM. Effect of coagulating current and cutting current on a demand pacemaker during transurethral resection of the prostate. A case report. Can Anaesth Soc J 1978; 25: 65-66.
- Madigan JD, Choudhri AF, Chen J, et al. Surgical management of the patient with an implanted cardiac device: implications of electromagnetic interference. Ann Surg 1999; 230: 639-647.
- Kazatsker M, Kusniek J, Hasdai D, et al. Two pacemakers in one patient: a stimulating case. J Cardiovasc Electrophysiol 2002; 13: 522.
- Rozner M. Pacemakers and implantable cardioverter defibrillators. Crit Care Med 2004; 32: 1809-1812.
- Bailey AG, Lacey SR. Intraoperative pacemaker failure in an infant. Can J Anaesth 1991; 38: 912-913.
- Wong DT, Middleton W. Electrocautery-induced tachycardiain a rate-responsive pacemaker. Anesthesiology 2001; 94: 710-711.
- Chang AC, McAreavey D, Tripodi D, Fananapazir L. Radiofrequency catheter atrioventricular node ablation in patients with permanent cardiac pacing systems. Pacing Clin Electrophysiol 1994; 17: 65-69.
- Trohman RG, Simmons TW, Moore SL, Firstenberg MS, Williams D, Maloney JD. Catheter ablation of atrioventricular junction using radiofrequency energy and a bilateral cardiac approach. Am J Cardiol 1992; 70: 1438-1443.
- Achenbach S, Moshage W, Diem B, Bieberle T, Schibgilla V, Bachmann K. Effects of magnetic resonance imaging on cardiac pacemakers and electrodes. Am Heart J 1997; 134: 467-473.
- Vahlhaus C, Sommer T, Lewalter T, Schimpf R, Schumacher B, Jung W, Lüderitz B. Interference with cardiac pacemakers by magnetic resonance imaging: Are there irreversible changes at 0.5 Tesla? Pacing Clin Electrophysiol 2001; 24: 489-495.
- American Society of Anesthesiologists: Standards for basic anesthetic monitoring. In ASA Standards, Guidelines and Statements, American Society of Anesthesiologists Publication, October 5-6, 1999.
- Southorn PA, Kamath GS, Vasdev GM, Hayes DL. Monitoring equipment induced tachycardia in patients with minute ventilation rate-responsive pacemakers. Br J Anaesth 2000; 84: 508-509.


 Creative Commons Attribution
Creative Commons Attribution