Paulina Lagos R.*
Reve Chil Anest Vol. 41 Número 1 pp. 28-35|doi:
PDF|ePub|RIS
Introducción
La desfibrilación es una de las pocas intervenciones que han demostrado mejorar el resultado de los pacientes que sufren un paro cardiorrespiratorio (PCR) por fibrilación ventricular (FV) o taquicardia ventricular (TV) 1 , 2 . La probabilidad de desfibrilación exitosa y sobrevida al alta hospitalaria disminuye rápidamente con el tiempo 3 , 4 y la capacidad para entregar una temprana desfibrilación es uno de los factores más importantes en determinar la sobrevida desde un paro. Por cada minuto que pasa entre colapso y desfibrilación, la mortalidad se incrementa en un 7 a 10% en ausencia de reanimación cardiopulmonar básica 3 . Esta es la razón por la cual se ha incorporado masivamente el uso de desfibriladores automáticos externos (DAE) por personas entrenadas en el ambiente extrahospitalario e incluso dentro de los hospitales, donde personal no médico entrenado para desfibrilar, usa el DAE antes de la llegada del equipo de reanimación 5 . Cuando los testigos realizan reanimación cardiopulmonar (RCP) básica inmediata, el aumento de mortalidad por cada minuto que pasa entre paro y desfibrilación es más gradual, del orden de un 3 a 4% 3 , 4 , 6 , 7 .
La desfibrilación consiste en el paso de corriente eléctrica de una magnitud suficiente a través del miocardio, a fin de despolarizar una masa crítica de éste y así restablecer la actividad eléctrica coordinada. El término desfibrilación se define como la ausencia de fibrilación o taquicardia ventricular durante los 5 segundos que siguen a la administración del choque 8 , 9 ; sin embargo, el objetivo final de esta terapia es restablecer la circulación espontánea 10 .
En el siguiente artículo nos referiremos al uso de los desfibriladores tanto en su modo automático como manual en el ambiente intrahospitalario, con énfasis en los siguientes aspectos:
-
Integración RCP y desfibrilación.
-
Tipos de onda, niveles de energía y estrategias de desfibrilación.
-
Interfase electrodos-paciente.
-
Circunstancias especiales.
-
Otros temas relevantes.
Integración RCP y desfibrilación
-
¿Primero choque o RCP básica?
El personal de salud que asiste un paro intrahospitalario o en otros escenarios donde hay un desfibrilador automático in situ, debe iniciar las maniobras de reanimación cardiopulmonar básica y usar el desfibrilador tan pronto como esté disponible. Esta recomendación tiene el objetivo de apoyar la pronta RCP y la desfibrilación temprana.
Cuando la fibrilación está presente por más de unos minutos, el miocardio es depletado de oxígeno y sustratos metabólicos, por lo que un corto periodo de compresiones torácicas puede entregar oxígeno y sustratos energéticos que incrementan la posibilidad de que un choque acabe con la FV y retorne a la circulación espontánea 11 .
La evidencia es contradictoria en apoyar o rebatir un retraso en la desfibrilación para proporcionar un periodo de reanimación cardiopulmonar (90 segundos a 3 minutos) a pacientes en paro por FV o TV sin pulso no presenciado por el equipo de salud 12 .
En la práctica, frente a un PCR la RCP debe ser iniciada inmediatamente y el desfibrilador debe utilizarse en cuanto se encuentre listo.
El tiempo transcurrido entre el cese de las compresiones torácicas y la entrega del choque debe ser mínimo, aún 5 ó 10 segundos de retraso puede reducir la posibilidad de que el choque sea exitoso. La pausa prechoque puede ser fácilmente reducida a menos de 5 segundos continuando las compresiones durante la carga del desfibrilador y teniendo un equipo eficientemente coordinado. La pausa postchoque es minimizada reanudando las compresiones torácicas inmediatamente después del choque. De esta manera, el proceso de desfibrilación debería ser realizado en no más de 5 segundos de interrupción de las compresiones torácicas 10 .
-
Protocolo de 1 choque vs 3 choques
La evidencia generada hasta el último consenso sugiere que hay beneficio significativo en la sobrevida con el protocolo de un choque comparado con la antigua recomendación de 3 choques seguidos 13 , 14 . Si un choque falla en revertir una FV, el beneficio adicional de otro choque es bajo, por lo tanto, el reinicio de la RCP probablemente sea de mayor rendimiento que otro choque.
Luego de entregado el choque, el rescatista no debe demorar el reinicio de las compresiones torácicas para chequear ritmo o pulso; sólo después de 5 ciclos de RCP, que idealmente terminen con compresiones torácicas, debería analizar el ritmo cardiaco y entregar otro choque si está indicado. Si el ritmo detectado es no desfibrilable, entonces debe iniciar inmediatamente RCP con compresiones torácicas. La evidencia demuestra que la interrupción de las compresiones torácicas se asocia con una baja probabilidad de conversión exitosa de FV a un ritmo que perfunda tras el choque 15 .
La disminución del intervalo entre la última compresión y el choque, aunque sea por pocos segundos, mejora el éxito del choque 11 , 15 , 16 . Por lo tanto, resulta razonable practicar una coordinación eficiente entre RCP y desfibrilación con el fin de minimizar el intervalo en el cual las compresiones se detienen.
Tipos de Onda de desfibrilación y niveles de energía
Un choque exitoso, según la definición típica de desfibrilación, no debería ser confundido con resultados de resucitación, como restauración a un ritmo de perfusión, sobrevida a la admisión del hospital, o sobrevida al alta hospitalaria 8 , 17 . El resultado de la resucitación, incluyendo la sobrevida, depende de muchas variables además de la entrega del choque, por lo tanto, los programas de entrenamiento deben esforzarse por mejorar la sobrevida del paciente, y no sólo enfocarse en el éxito de la desfibrilación.
Los desfibriladores modernos se clasifican en 2 tipos según la forma de onda: monofásicos y bifásicos. La forma de onda monofásica fue usada en los primeros desfibriladores, pero hoy en día la forma de onda bifásica es usada en casi todos los DAE y manuales del mercado. Los niveles de energía varían según el tipo de dispositivo y fabricante.
-
Desfibriladores monofásicos
Estos entregan corriente de una polaridad, vale decir, que fluye sólo en una dirección (Figura 1). Tienen la desventaja que la cantidad de energía entregada varía con la impedancia transtorácica y el tamaño de los pacientes. Se pueden categorizar por la tasa a la cual la corriente disminuye a cero, si la corriente cae a cero gradualmente se llama monofásica sinusoidal amortiguada (MSA), en cambio, si la corriente retorna abruptamente a cero se llama monofásica exponencial truncada (MET).
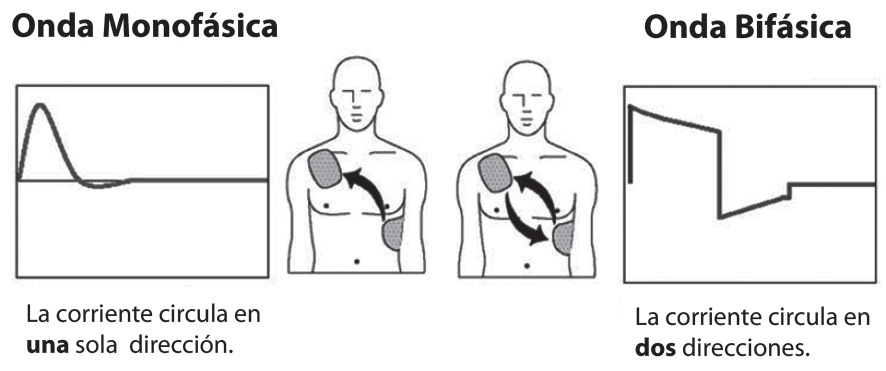
Figura 1 Forma de onda monofásica versus bifásica (Cortesía de Philips Medical Systems, Seattle, WA).
Actualmente se fabrican pocos desfibriladores de onda monofásica, pero muchos se encuentran todavía en uso y la mayoría usan onda MSA. De cualquier manera, ninguna forma de onda específica es asociada con mayor incidencia de retorno a la circulación espontánea o mayor sobrevida al alta hospitalaria después de un PCR.
-
Desfibriladores bifásicos
La forma de onda bifásica entrega la corriente en dos fases (Figura 1). En el momento inicial de la onda, la corriente fluye en dirección positiva durante un intervalo de tiempo determinado; posteriormente, la corriente abruptamente invierte la dirección y fluye en un sentido negativo por el tiempo restante del choque. Típicamente, la duración de la primera fase es cerca de dos tercios del curso total del choque. Además, los desfibriladores bifásicos modernos incorporan un ajuste de impedancia, de modo que la energía entregada, la duración de la onda y las duraciones relativas de los dos segmentos pueden variar 18 .
La evidencia a partir de estudios extra e intrahospitalarios, indica que choques de onda bifásica de baja energía tienen igual o mayor éxito para terminar una FV que choques de onda MSA o MET 19 , 21 –24 . Sin embargo, la energía óptima para el primer choque de una desfibrilación con onda bifásica no ha sido determinada. Varios estudios aleatorizados 19 –21 y observacionales 9 ,25,26 han mostrado que la desfibrilación con forma de onda bifásica de relativamente baja energía (≤ 200 J) es segura y tiene equivalente o mayor eficacia para terminar con una FV que un choque monofásico de equivalente o mayor energía 9 ,27–31 . La evidencia sugiere que la desfibrilación con onda bifásica tiene mejor resultado a corto plazo en el término de una FV 9 ,19–21,25,26 , pero ningún estudio individual ha demostrado mejora de sobrevida al alta hospitalaria usando onda bifásica cuando se compara con uso de onda monofásica. Por lo tanto, en ausencia de desfibriladores bifásicos, los desfibriladores monofásicos son aceptables. La eficacia de diferentes formas de ondas bifásicas no ha sido comparada en humanos.
-
Nivel de energía
La desfibrilación requiere la entrega de energía eléctrica suficiente para desfibrilar una masa crítica de miocardio, abolir la FV y restaurar una actividad eléctrica espontánea sincronizada en la forma de un ritmo organizado. La energía óptima para desfibrilación es la que consigue la desfibrilación causando el mínimo daño miocárdico 32 . La selección de un apropiado nivel de energía reduce el número de choques repetitivos, lo que a su vez limita el daño miocárdico 33 . Los niveles óptimos de energía para las formas de onda monofásica y bifásica son desconocidos. Las recomendaciones de los niveles de energía son sobre la base de un consenso luego de una cuidadosa revisión de la literatura actual.
-
Primer choque
No hay estudios nuevos que determinen los niveles óptimos de energía para onda monofásica desde la publicación de las guías 2005. Debido a la menor eficacia de esta forma de onda, el nivel de energía inicial recomendada para el primer choque con un desfibrilador monofásico es de 360 J. Aunque con niveles más altos de energía se arriesga a un mayor grado de lesión miocárdica, los beneficios de la pronta conversión a un ritmo de perfusión son más importantes. El bloqueo auriculoventricular es más común con niveles más altos de energía monofásicos, pero generalmente es transitorio y se ha demostrado que no afecta la sobrevida al alta hospitalaria 34 .
Para los desfibriladores bifásicos, los reanimadores deberían usar la dosis de energía recomendada por el fabricante, normalmente de 120 a 200 J que suele estar resaltada en la cara frontal del aparato. Si la dosis recomendada por el fabricante es desconocida, entonces se debe considerar una desfibrilación a dosis máxima.
-
Siguientes choques; energía fija o en escalada
Los DAE bifásicos disponibles comercialmente proporcionan niveles de energía fijos o en escalada. Múltiples estudios clínicos prospectivos en humanos 20 , 30 , 31 y estudios retrospectivos 19 ,21,25,35–37 han fallado en identificar un nivel de energía bifásica óptima para el primer o subsiguiente choque. Estudios realizados en seres humanos no han demostrado daño miocárdico por desfibrilación con onda bifásica con energía de hasta 360 J 28 ,30 , daño que se define con niveles elevados de biomarcadores, hallazgos electrocardiográficos y fracción de eyección reducida. Varios estudios en animales han demostrado daño miocárdico potencial con niveles mucho mayores de energía. De este modo, no es posible hacer una recomendación definitiva para seleccionar el nivel de energía de los choques subsiguientes. Sin embargo, basado en la evidencia disponible, se recomienda que el segundo y subsiguiente choque sea al menos de un nivel de energía equivalente o mayor.
Interfase electrodos-paciente
-
Electrodos
En relación a la colocación de los electrodos, los datos demuestran que 4 posiciones son equivalentemente efectivas para tratar arritmias auriculares o ventriculares: anterolateral, anteroposterior, anterior infraescapular izquierda y anterior infraescapular derecha. Estas 4 posiciones son igualmente efectivas en el éxito de la desfibrilación 38 –48 . Con el fin de facilitar la colocación y el aprendizaje, es razonable utilizar por defecto la posición anterolateral de los parches para colocar los electrodos. Sin embargo, se puede considerar cualquiera de las otras tres alternativas posibles en función de las características individuales del paciente. Palas o electrodos laterales debieran ubicarse bajo tejido mamario 49 y en el caso de hombres velludos, debiera afeitarse el tórax previo a la ubicación de las palas o electrodos, siempre que esto sea posible 50 ,51 . No importa cuál de los electrodos (ápice/esternón) se coloca en cualquiera de las posiciones.
Diez estudios 47 , 52 –60 indican que el uso de paletas de gran tamaño, de 8 a 12 cm de diámetro, disminuye la impedancia transtorácica.
-
Impedancia transtorácica
La impedancia transtorácica promedio de un adulto es aproximadamente 70 a 80 Ω 53 , 61 , 62 . Cuando la impedancia transtorácica es demasiado alta, un choque de baja energía no generará suficiente corriente para alcanzar la desfibrilación 62 –64 . Para reducir la impedancia transtorácica, el operador del desfibrilador debe utilizar materiales conductores. Esto se logra con el uso de parches de gel o pasta de electrodo con paletas o mediante el uso de almohadillas autoadhesivas. No hay datos existentes que sugieran que una de estas modalidades es mejor que las demás en la disminución de la impedancia.
En el caso que se usen paletas, éstas deben aplicarse firmemente a la pared torácica. Esto reduce la impedancia transtorácica porque mejora el contacto del electrodo con la piel y reduce el volumen torácico 65 . El operador debiera presionar firmemente las paletas con una fuerza óptima de 8 kg en adultos y 5 kg en niños de 1 a 8 años usando palas de adulto 66 .
Circunstancias especiales
-
Usuarios de marcapasos y desfibrilador cardioversor implantable
Si el paciente tiene un desfibrilador cardioversor implantable (DCI) que está entregando choques, es decir, los músculos del paciente se contraen en forma similar a la observada durante la desfibrilación externa, entonces, se debe permitir que el DCI complete un ciclo de 30 a 60 segundos de tratamiento antes de efectuar una desfibrilación. Ocasionalmente, los ciclos de análisis y choque de los DCI y DAE se conflictúan 67 . Potencialmente existe riesgo de mal funcionamiento de marcapasos o DCI después de una desfibrilación, sobre todo cuando las paletas o electrodos están en estrecha relación con el aparato 68 , 69 . Un estudio en pacientes sometidos a cardioversión eléctrica demostró que posicionar las paletas al menos a 8 cm de distancia de la caja del marcapaso no produce cambios en las mediciones de los umbrales de estimulación o sensibilidad 68 . Las espigas de marcapasos con estimulación unipolar pueden confundir el software del DAE e impedir la detección de una FV 67 . La ubicación de los electrodos en posición anteroposterior y anterolateral son aceptables en pacientes con estos dispositivos. En pacientes con DCI o marcapasos, la colocación de las palas no debe retrasar la desfibrilación. Parece razonable evitar colocar las almohadillas o palas sobre el dispositivo. Del mismo modo, no es recomendable ubicar electrodos o paletas directamente encima de un parche transdérmico de medicamentos (nitroglicerina, nicotina, analgésicos, sustitutos de hormonas, antihipertensivos), porque el parche puede bloquear la entrega de energía desde la paleta al corazón y causar pequeñas quemaduras en la piel 70 .
Otros temas relevantes
-
Uso de desfibriladores automáticos externos (DAE) en el intrahospitalario
Al momento de la Conferencia de Consenso 2010, no hubo ningún ensayo aleatorio publicado comparando los desfibriladores automáticos versus los manuales en el medio intrahospitalario. La evidencia a partir de un estudio con controles históricos 71 , una serie de casos 72 y estudios retrospectivos 73 –75 , indica mayores tasas de supervivencia al alta hospitalaria cuando se utiliza DAE para tratar adultos con FV o TV sin pulso en el hospital. Sin embargo, un estudio antes y después no mostró una mejoría en la sobrevida al alta o retorno a la circulación espontánea cuando se implementó el DAE en áreas no críticas del hospital 76 y un estudio observacional con controles históricos, no encontraron ninguna mejoría en la sobrevida al alta cuando se compara DAE bifásico con desfibriladores monofásicos estándar 77 . Los estudios de Gombotz y Hanefeld observaron una disminución en el intervalo de tiempo desde el colapso a la primera entrega de choque, así como también mayor retorno a la circulación espontánea y sobrevida 74 ,75 .
La desfibrilación puede retrasarse cuando los pacientes desarrollan un PCR en camas hospitalarias no monitorizadas, en consulta ambulatoria y servicios de diagnóstico. En estas zonas, pueden transcurrir varios minutos antes de que la respuesta centralizada llegue con el desfibrilador, lo prepare y entregue los choques 78 . A pesar de la escasa evidencia, los DAEs pueden ser considerados para el medio hospitalario como una forma de facilitar la desfibrilación temprana (de menos de 3 minutos desde el colapso), especialmente en áreas donde el personal no tiene habilidades para reconocer el ritmo o los desfibriladores son usados en forma muy infrecuente.
Cuando los hospitales implementan el uso de DAE, el personal de primera respuesta también debe recibir autorización y la capacitación para utilizar un DAE, con el objetivo de proporcionar el primer choque a cualquier PCR dentro de los 3 primeros minutos desde el colapso. La desfibrilación temprana debería estar disponible en los centros de atención ambulatoria, así como en las áreas de pacientes hospitalizados. Los hospitales deben monitorizar los intervalos de tiempo desde el colapso al primer choque y los resultados de la reanimación.
-
Asistolía falsa versus asistolía oculta
En ciertos casos de paro cardiaco, es difícil estar seguro si el ritmo es una FV fina o una asistolía. En 1989, Losek 79 publicó una revisión retrospectiva de la entrega de choque inicial a 49 niños en asistolía en comparación con la no entrega de choque para 41 niños en asistolía y no encontró ninguna mejoría en el cambio de ritmo, retorno a la circulación espontánea o sobrevida en el grupo que recibió los choques. En 1993, el Nine City High Dose Epinefrine Study Group publicó un análisis de 77 pacientes en asistolía que recibieron un choque inicial en comparación con 117 que recibieron terapia estándar 80 . Hubo un peor resultado de retorno a la circulación espontánea y sobrevida para quienes recibieron choques. Por lo tanto, el choque no es útil para pacientes en asistolía.
-
Peligro de quemaduras
Varios informes de casos han descrito fuego encendido por las chispas de paletas mal aplicadas en presencia de una atmósfera rica en oxígeno 81 –86 . Se han reportado incendios cuando la manguera del ventilador se desconecta desde el tubo endotraqueal y se deja adyacente a la cabeza del paciente, liberando oxígeno en el pecho durante el intento de defibrilación 82 , 84 , 86 . Puede ser razonable para los rescatadores tomar precauciones a fin de minimizar la aparición de chispas durante los intentos de desfibrilación, e incluso evitar realizar una desfibrilación en una atmósfera enriquecida de oxígeno.
El uso de parches autoadhesivos de desfibrilación y asegurar un buen contacto entre pared torácica y almohadilla, probablemente reducirá al mínimo el riesgo de chispas encendidas durante la desfibrilación. Si se utilizan palas manuales, las almohadillas de gel son preferibles a las pastas de electrodo y geles, porque las pastas y geles pueden extenderse entre las 2 paletas, creando la posibilidad de generar una chispa.
El riesgo de fuego durante la desfibrilación puede disminuirse tomando las siguientes precauciones:
-
Retirar máscaras de oxígeno o cánulas nasales y ubicarlas al menos a 1 metro de distancia del tórax del paciente.
-
Dejar la bolsa de ventilación o Ambu®, o el circuito del ventilador mecánico conectado al tubo endotraqueal o retirarlos al menos a 1 metro de distancia del tórax del paciente.
Conclusiones
En suma, las guías publicadas en el 2010, han querido enfatizar:
-
La importancia de las compresiones torácicas precoces e ininterrumpidas.
-
Minimizar la duración de las pausas antes y después de los choques, continuando las maniobras mientras el desfibrilador se carga.
-
Inmediato reinicio de las compresiones torácicas luego de la desfibrilación.
-
No se recomienda realizar un ciclo de RCP de regla antes de desfibrilar, sino más bien desfibrilar en cuanto sea posible.
-
Las ventajas de realizar un solo choque versus 3, con el objeto de minimizar la interrupción de las compresiones torácicas.
-
El uso cada vez más expandido de los DAE en los distintos escenarios.
REFERENCIAS
-
Deakin CD, Nolan JP. European Resuscitation Council guidelines for resuscitation 2005. Section 3. Electrical therapies: automated external defibrillators, defibrillation, cardioversion and pacing. Resuscitation 2005; 67 (Suppl.1): S25-S37.
-
Proceedings of the 2005 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Resuscitation 2005; 67: 157-341.
-
Larsen MP, Eisenberg MS, Cummins RO, Hallstrom AP. Predicting survival from out-of-hospital cardiac arrest: a graphic model. Ann Emerg Med 1993; 22: 1652-1658.
-
Valenzuela TD, Roe DJ, Cretin S, et al. Estimating effectiveness of cardiac arrest interventions: a logistic regression survival model. Circulation 1997; 96: 3308-3313.
-
Spearpoint KG, Gruber PC, Brett SJ. Impact of the Immediate Life Support course on the incidence and outcome of in-hospital cardiac arrest calls: an observational study over 6 years. Resuscitation 2009; 80: 638-643.
-
Chan PS, Krumholz HM, Nichol G, Nallamothu BK. Delayed time to defibrillation after in-hospital cardiac arrest. N Engl J Med 2008; 358: 9-17.
-
Stiell IG, Wells GA, Field B, et al. Advanced cardiac life support in out-of-hospital cardiac arrest. N Engl J Med 2004; 351: 647-656.
-
White RD. External defibrillation: the need for uniformity in analyzing and reporting results [editorial]. Ann Emerg Med 1998; 32: 234-236.
-
Gliner BE, White RD. Electrocardiographic evaluation of defibrillation shocks delivered to out-of-hospital sudden cardiac arrest patients. Resuscitation 1999; 41: 133-144.
-
Deakin CD, Nolan JP, et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 3. Electrical therapies: Automated external defibrillators, defibrillation, cardioversion and pacing. Resuscitation 2010; 81: 1293-1304.
-
Eftestol T, Wik L, Sunde K, Steen PA. Effects of cardiopulmonary resuscitation on predictors of ventricular fibrillation defibrillation success during out-of-hospital cardiac arrest. Circulation 2004; 110: 10-15.
-
Jacobs I, Sunde K, Deakin CD, et al. On behalf of Defibrillation Chapter Collaborators. Part 6: defibrillation: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations. Circulation 2010; 122 (suppl 2): S325-S337.
-
Bobrow BJ, Clark LL, Ewy GA, et al. Minimally interrupted cardiac resuscitation by emergency medical services for out-of-hospital cardiac arrest. JAMA 2008; 299: 1158-1165.
-
Rea TD, Helbock M, Perry S, et al. Increasing use of cardiopulmonary resuscitation during out of hospital ventricular fibrillation arrest: survival implications of guideline changes. Circulation 2006; 114: 2760-2765.
-
Eftestol T, Sunde K, Steen PA. Effects of interrupting precordial compressions on the calculated probability of defibrillation success during out-of-hospital cardiac arrest. Circulation 2002; 105: 2270-2273.
-
Eftestol T, Sunde K, Aase SO, et al. Predicting outcome of defibrillation by spectral characterization and nonparametric classification of ventricular fibrillation in patients with out-of-hospital cardiac arrest. Circulation 2000; 102: 1523-1529.
-
Cummins RO, Chamberlain DA, Abra mson NS, et al. Recommended guidelines for uniform reporting of data from out-of-hospital cardiac arrest: the Utstein Style. A statement for health professionals from a task force of the American Heart Association, the European Resuscitation Council, the Heart and Stroke Foundation of Canada, and the Australian Resuscitation Council. Circulation 1991; 84: 960-975.
-
Atkins DL, Kenney MA. Automated external defibrillators: safety andefficacy in children and adolescents/Pediatr Clin N Am 2004; 51: 1443-1462.
-
van Alem AP, Chapman FW, Lank P, et al. A prospective, randomised and blinded comparison of first shock success of monophasic and biphasic waveforms in out-of-hospital cardiac arrest. Resuscitation 2003; 58: 17-24.
-
Morrison LJ, Dorian P, Long J, et al. Out-of-hospital cardiac arrest rectilinear biphasic to monophasic damped sine defibrillation waveforms with advanced life support intervention trial (ORBIT). Resuscitation 2005; 66: 149-157.
-
Schneider T, Martens PR, Paschen H, et al. Multicenter, randomized, controlled trial of 150-J biphasic shocks compared with 200- to 360-J monophasic shocks in the resuscitation of out-of-hospital cardiac arrest victims. Optimized Response to Cardiac Arrest (ORCA) Investigators. Circulation 2000; 102: 1780-1787.
-
White RD, Hankins DG, Bugliosi TF. Seven years’ experience with early defibrillation by police and paramedics in an emergency medical services system. Resuscitation 1998; 39: 145-151.
-
Cummins RO, Eisenberg MS, Bergner L, et al. Automatic external defibrillation: evaluations of its role in the home and in emergency medical services. Ann Emerg Med 1984; 13: 798-801.
-
White RD, Vukov LF, Bugliosi TF. Early defibrillation by police: initial experience with measurement of critical time intervals and patient outcome. Ann Emerg Med 1994; 23: 1009-1013.
-
Carpenter J, Rea TD, Murray JA, et al. Defibrillation waveform and post-shock rhythm in out-of-hospital ventricular fibrillation cardiac arrest. Resuscitation 2003; 59: 189-196.
-
Freeman K, Hendey GW, Shalit M, Stroh G. Biphasic defibrillation does not improve outcomes compared to monophasic defibrillation in out-ofhospital cardiac arrest. Prehosp Emerg Care 2008; 12: 152-156.
-
Schwarz B, Bowdle TA, Jett GK, et al. Biphasic shocks compared with monophasic damped sine wave shocks for direct ventricular defibrillation during open heart surgery. Anesthesiology 2003; 98: 1063-1069.
-
Higgins SL, Herre JM, Epstein AE, et al. A comparison of biphasic and monophasic shocks for external defibrillation. Physio-Control Biphasic Investigators. Prehosp Emerg Care 2000; 4: 305-313.
-
Martens PR, Russell JK, Wolcke B, et al. Optimal Response to Cardiac Arrest study: defibrillation waveform effects. Resuscitation 2001; 49: 233-243.
-
Stiell IG, Walker RG, Nesbitt LP, et al. BIPHASIC Trial: a randomized comparison of fixed lower versus escalating higher energy levels for defibrillation in out-of-hospital cardiac arrest. Circulation 2007; 115: 1511-1517.
-
Walsh SJ, McClelland AJ, Owens CG, et al. Efficacy of distinct energy delivery protocols comparing two biphasic defibrillators for cardiac arrest. Am J Cardiol 2004; 94: 378-380.
-
Kerber RE. External defibrillation: new technologies. Ann Emerg Med 1984; 13: 794-797.
-
Joglar JA, Kessler DJ, Welch PJ, et al. Effects of repeated electrical defibrillations on cardiac troponin I levels. Am J Cardiol 1999; 83: 270-272.
-
Weaver WD, Cobb LA, Copass MK, Hallstrom AP. Ventricular defibrillation: a comparative trial using 175-J and 320-J shocks. N Engl J Med 1982; 307: 1101-1106.
-
Stothert JC, Hatcher TS, Gupton CL, et al. Rectilinear biphasic waveform defibrillation of out-of-hospital cardiac arrest. Prehosp Emerg Care 2004; 8: 388-392.
-
Gliner BE, Jorgenson DB, Poole JE, et al. Treatment of out-of-hospital cardiac arrest with a low-energy impedance-compensating biphasic waveform automatic external defibrillator. The LIFE Investigators. Biomed Instrum Technol 1998; 32: 631-644.
-
White RD, Russell JK. Refibrillation, resuscitation and survival in outof-hospital sudden cardiac arrest victims treated with biphasic automated external defibrillators. Resuscitation 2002; 55: 17-23.
-
Boodhoo L, Mitchell AR, Bordoli G, et al. DC cardioversion of persistent atrial fibrillation: a comparison of two protocols. Int J Cardiol 2007; 114: 16-21.
-
Brazdzionyte J, Babarskiene RM, Stanaitiene G. Anterior-posterior versus anterior-lateral electrode position for biphasic cardioversion of atrial fibrillation. Medicina (Kaunas) 2006; 42: 994-998.
-
Chen CJ, Guo GB. External cardioversion in patients with persistent atrial fibrillation: a reappraisal of the effects of electrode pad position and transthoracic impedance on cardioversion success. Jpn Heart J 2003; 44: 921-932.
-
Stanaitiene G, Babarskiene RM. Impact of electrical shock waveform and paddle positions on efficacy of direct current cardioversion for atrial fibrillation. Medicina (Kaunas) 2008; 44: 665-672.
-
Kerber RE, Martins JB, Ferguson DW, et al. Experimental evaluation and initial clinical application of new self-adhesive defibrillation electrodes. Int J Cardiol 1985; 8: 57-66.
-
García LA, Kerber RE. Transthoracic defibrillation: does electrode adhesive pad position alter transthoracic impedance? Resuscitation 1998; 37: 139-143.
-
Dodd TE, Deakin CD, Petley GW, Clewlow F. External defibrillation in the left lateral position-a comparison of manual paddles with selfadhesive pads. Resuscitation 2004; 63: 283-286.
-
Kerber RE, Jensen SR, Grayzel J, et al. Elective cardioversion: influence of paddle-electrode location and size on success rates and energy requirements. N Engl J Med 1981; 305: 658-662.
-
Mathew TP, Moore A, McIntyre M, et al. Randomised comparison of electrode positions for cardioversion of atrial fibrillation. Heart 1999; 81: 576-579.
-
Camacho MA, Lehr JL, Eisenberg SR. A three-dimensional finite element model of human transthoracic defibrillation: paddle placement and size. IEEE Trans Biomed Eng 1995; 42: 572-578.
-
Lateef F, Lim SH, Anantharaman V, Lim CS. Changes in chest electrode impedance. Am J Emerg Med 2000; 18: 381-384.
-
Pagan-Carlo LA, Spencer KT, Robertson CE, et al. Transthoracic defibrillation: importance of avoiding electrode placement directly on the female breast. J Am Coll Cardiol 1996; 27: 449-452.
-
Bissing JW, Kerber RE. Effect of shaving the chest of hirsute subjects on transthoracic impedance to self-adhesive defibrillation electrode pads. Am J Cardiol 2000; 86: 587-589.
-
Sado DM, Deakin CD, Petley GW, Clewlow F. Comparison of the effects of removal of chest hair with not doing so before external defibrillation on transthoracic impedance. Am J Cardiol 2004; 93: 98-100.
-
Killingsworth CR, Melnick SB, Chapman FW, et al. Defibrillation threshold and cardiac responses using an external biphasic defibrillator with pediatric and adult adhesive patches in pediatric-sized piglets. Resuscitation 2002; 55: 177-185.
-
Kerber RE, Grayzel J, Hoyt R, et al. Transthoracic resistance in human defibrillation. Influence of body weight, chest size, serial shocks, paddle size and paddle contact pressure. Circulation 1981; 63: 676-682.
-
Connell PN, Ewy GA, Dahl CF, Ewy MD. Transthoracic impedance to defibrillator discharge. Effect of electrode size and electrode-chest wall interface. J Electrocardiol 1973; 6: 313-317.
-
Dahl CF, Ewy GA, Warner ED, Thomas ED. Myocardial necrosis from direct current countershock: effect of paddle electrode size and time interval between discharges. Circulation 1974; 50: 956-961.
-
Hoyt R, Grayzel J, Kerber RE. Determinants of intracardiac current in defibrillation. Experimental studies in dogs. Circulation 1981; 64: 818-823.
-
Thomas ED, Ewy GA, Dahl CF, Ewy MD. Effectiveness of direct current defibrillation: role of paddle electrode size. Am Heart J 1977; 93: 463-467.
-
Atkins DL, Kerber RE. Pediatric defibrillation: current flow is improved by using “adult” electrode paddles. Pediatrics 1994; 94: 90-93.
-
Atkins DL, Sirna S, Kieso R, et al. Pediatric defibrillation: importance of paddle size in determining transthoracic impedance. Pediatrics 1988; 82: 914-918.
-
Samson RA, Atkins DL, Kerber RE. Optimal size of self-adhesive preapplied electrode pads in pediatric defibrillation. Am J Cardiol 1995; 75: 544-545.
-
Lerman BB, DiMarco JP, Haines DE. Current-based versus energy-based ventricular defibrillation: a prospective study. J Am Coll Cardiol 1988; 12: 1259-1264.
-
Kerber RE, Kouba C, Martins J, et al. Advance prediction of transthoracic impedance in human defibrillation and cardioversion: importance of impedance in determining the success of low-energy shocks. Circulation 1984; 70: 303-308.
-
Kerber RE, Martins JB, Kienzle MG, et al. Energy, current, and success in defibrillation and cardioversion: clinical studies using an automated impedance-based method of energy adjustment. Circulation 1988; 77: 1038-1046.
-
Dalzell GW, Cunningham SR, Anderson J, Adgey AA. Electrode pad size, transthoracic impedance and success of external ventricular defibrillation. Am J Cardiol 1989; 64: 741-744.
-
Deakin CD, Sado DM, Petley GW, Clewlow F. Differential contribution of skin impedance and thoracic volume to transthoracic impedance during external defibrillation. Resuscitation 2004; 60: 171-174.
-
Deakin C, Sado D, Petley G, Clewlow F. Determining the optimal paddle force for external defibrillation. Am J Cardiol 2002; 90: 812-813.
-
Monsieurs KG, Conraads VM, Goethals MP, et al. Semi-automatic external defibrillation and implanted cardiac pacemakers: understanding the interactions during resuscitation. Resuscitation 1995; 30: 127-131.
-
Manegold JC, Israel CW, Ehrlich JR, et al. External cardioversion of atrial fibrillation in patients with implanted pacemaker or cardioverter-defibrillator systems: a randomized comparison of monophasic and biphasic shock energy application. Eur Heart J 2007; 28: 1731-1738.
-
Alferness CA. Pacemaker damage due to external countershock in patients with implanted cardiac pacemakers. Pacing Clin Electrophysiol 1982; 5: 457-458.
-
Panacek EA, Munger MA, Rutherford WF, Gardner SF. Report of nitropatch explosions complicating defibrillation. Am J Emerg Med 1992; 10: 128-129.
-
Zafari AM, Zarter SK, Heggen V, et al. A program encouraging early defibrillation results in improved in-hospital resuscitation efficacy. J Am Coll Cardiol 2004; 44: 846-852.
-
Destro A, Marzaloni M, Sermasi S, Rossi F. Automatic external defibrillators in the hospital as well? Resuscitation 1996; 31: 39-43.
-
Rea TD, Olsufka M, Bemis B, et al. A population based investigation of public Access defibrillation: Rose of emergency medical services care. Resuscitation. 2010; 81: 163-167.
-
Gombotz H, Weh B, Mitterndorfer W, Rehak P. In-hospital cardiac resuscitation outside the ICU by nursing staff equipped with automated external defibrillators-the first 500 cases. Resuscitation 2006; 70: 416-422.
-
Hanefeld C, Lichte C, Mentges-Schroter I, et al. Hospital-wide first-responder automated external defibrillator programme: 1 year experience. Resuscitation 2005; 66: 167-170.
-
Smith M. Service is improving everywhere… but what about EMS? EMS Mag 2009; 38: 26.
-
Forcina MS, Farhat AY, O’Neil WW, Haines DE. Cardiac arrest survival after implementation of automated external defibrillator technology in the in-hospital setting. Crit Care Med 2009; 37: 1229-1236.
-
Kaye W, Mancini ME, Richards N. Organizing and implementing a hospital-wide first-responder automated external defibrillation program: strengthening the in-hospital chain of survival. Resuscitation 1995; 30: 151-156.
-
Losek JD, Hennes H, Glaeser PW, et al. Prehospital ountershock treatment of pediatric asystole. Am J Emerg Med 1989; 7: 571-575.
-
Martin DR, Gavin T, Bianco J, et al. Initial countershock in the treatment of asystole. Resuscitation 1993; 26: 63-68.
-
Miller PH. Potential fire hazard in defibrillation. JAMA 1972; 221: 192.
-
Hummel RS III, Ornato JP, Weinberg SM, Clarke AM. Spark generating properties of electrode gels used during defibrillation. A potential fire hazard. JAMA 1988; 260: 3021-3024.
-
Fires from defibrillation during oxygen administration. Health Devices 1994; 23: 307-309.
-
Lefever J, Smith A. Risk of fire when using defibrillation in an oxygen enriched atmosphere. Medical Devices Agency Safety Notices 1995; 3: 1-3.
-
Ward ME. Risk of fires when using defibrillators in an oxygen enriched atmosphere. Resuscitation 1996; 31: 173.
-
Theodorou AA, Gutiérrez JA, Berg RA. Fire attributable to a defibrillation attempt in a neonate. Pediatrics 2003; 112: 677-679.


 Creative Commons Attribution
Creative Commons Attribution