Rafael Dalmau 1
Recibido: 12-04-2018
Aceptado: 10-05-2018
©2018 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 47 Núm. 3 pp. 176-188|https://doi.org/10.25237/revchilanestv47n03.04
PDF|ePub|RIS
Functional hemodynamics: “Be responsive, what does this mean”?
Abstract
The conventional analysis and approach to the physiology of the fluid responsiveness has traditionally been focused mainly on the physiology of heart-lung interactions, and on reviews of the technical, methodological, and epidemiological aspects of the dynamic parameters, which are translated into simple algorithms to assess fluid responsiveness and to guide fluid therapy.However, fundamental features of the dynamics of the peripheral circulation, heart-vasculature interaction, and blood volume distribution, are overlooked and sometimes not accounted for, motivating misconceptions about the cardiovascular system’s response to fluid administration and fluid management, such as equating fluid loading with cardiac preload, a predictable interpretation whenever Starling’s ventricular function curve is analyzed in isolation. This paper reexamines fluid responsiveness’ rationale offering a broadened perspective on the circulatory phenomena involved in the physiological interaction between BV, cardiac preload and output, and stroke volume variation. Finally, implications relevant in physiological and clinical terms are discussed.
Resumen
El análisis convencional y abordaje actual de la fisiología de la “respuesta a fluidos” (RF) ha estado focalizada principalmente sobre la fisiología de la interacción cardiopulmonar, y sobre aspectos técnicos, metodológicos y, epidemiológicos de los parámetros dinámicos, los cuales son traducidos en algoritmos simplificados para evaluar la RF y guiar la fluidoterapia. Sin embargo, aspectos fundamentales de la dinámica de la circulación periférica, el acoplamiento entre el corazón y la vasculatura, y la distribución del volumen sanguíneo son frecuentemente omitidos, motivando mal interpretaciones sobre la respuesta del sistema cardiovascular a la administración de fluidos, tal como equiparar la carga de fluidos con la precarga ventricular, una consecuencia predecible al interpretar la curva de función ventricular (Starling) de forma aislada. Así, esta revisión reexamina la rationale de la RF, ofreciendo una perspectiva ampliada sobre aquellos fenómenos circulatorios implicados en la interacción entre el volumen sanguíneo, la precarga ventricular, el gasto cardíaco y la variación del volumen sistólico. Finalmente, se analizarán las implicancias prácticas y conceptuales.
-
Introducción
Los parámetros dinámicos como subrogados de la variación del volumen sistólico.
La Hemodinámica Funcionala ciertamente ha significado un progreso en el manejo y monitoreo hemodinámicos en aquellas especialidades médicas en las que el soporte hemodinámico está en la base de su ejercicio, como la medicina intensiva, la anestesiología, la cardiología y la nefrología. Este progreso se encuentra expresado en la apuesta a un abordaje racional y fisiológico del manejo hemodinámico; un mejor entendimiento de la fisiopatología cardiovascular, el medio interno y la función microcirculatoria; y también, en el advenimiento de tecnologías mínimamente invasivas para recoger e integrar señales provenientes de la circulación y de la mecánica cardiopulmonar. Pero sobre todo, este progreso ha sido, en esencia, de índole conceptual y paradigmática: el gasto cardíaco (Q) ha dejado de ser una variable aislada y absoluta -hasta ha dejado de ser el clásico- “Santo Grial” del monitoreo hemodinámico. El Q es ahora analizado en cuanto a su efectividad, optimización, contexto y en condiciones dinámicas.
En particular, una nueva variable fue incorporada al arsenal para el monitoreo hemodinámico funcional: la variación del volumen sistólico (∆VS). La misma constituye un índice de variación -expresado en porcentaje (Ecuación 1)- la cual es determinada indirectamente en la cabecera del paciente a través de un grupo de parámetros derivados del análisis del contorno del pulso arterial (pulse contour analysis) -sistemas “calibrados” y “no-calibrados”[13]-[14]-; de la presión del pulso (pulse pressure analysis) -como la variación de la presión del pulso, arterial[15] y venoso, y de la presión arterial sistólica[16], (“delta-up” y “delta-down”)-; de la fotopletismografía[17} -la variación de la amplitud pletismográfica pulsioximétrica[18] y el índice de variación pletismográfica[19]-; la ultrasonografía[20]-[22] -variación del área ventricular izquierda telediastólica[23], del volumen sistólico[23], el diámetro y colapso de las venas cavas[24],[25], y la variación del flujo pico aórtico[26], carotídeo[27] o braquial[28], entre otros-; la electrocardiografía -variación del período pre-eyectivo[29], y de la amplitud de la onda R del complejo “QRS”[30]-; entre otros métodos, como la bioimpedancia y la biorreactancia cardiográficas[31].
Este grupo heterogéneo de parámetros -conocido como “parámetros dinámicos”b (PD)- ofician de subrogados de la ∆VS, y si bien son recogidos en diferentes sitios de la circulación y a través de diferentes tecnologías, todos se originan en el epicentro hemodinámico del subsistema cardiotorácico: la interacción cardiopulmonar[10]; esto es, la interacción mecánica entre los ciclos cardíacos y ventilatorios, y en términos de la relación presión-volumen (P–V) de los órganos involucrados, como será aclarado.
-
La respuesta a fluidos como “caja negra”
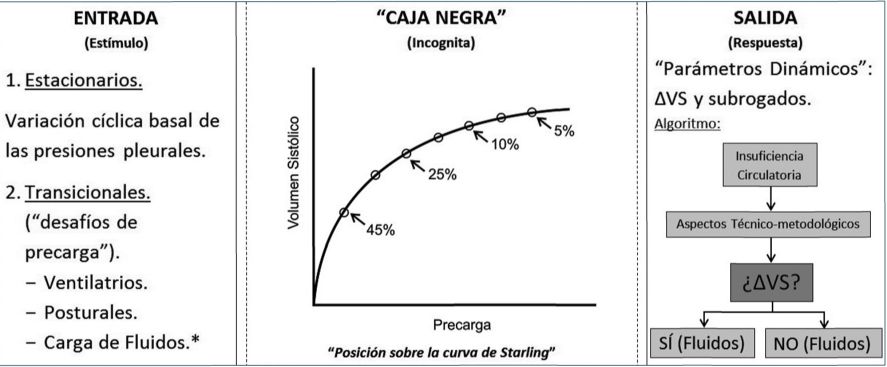
La correspondiente dinámica puede ser caracterizada como del tipo “excitación-respuesta” de un sistema (el cardiopulmonar), representando el mismo una “caja negra”[32]. De este modo, se evalúa la respuesta, en la forma de la misma ∆VS, o sus parámetros subrogados, a una serie de estímulos excitatorios a través de intervenciones conocidas como “desafíos de precarga” (preload challanges), como maniobras ventilatorias (presión positiva teleespiratoria; prueba de oclusión teleespiratoria[33]; “desafío” de volumen corriente[34]); cambios posturales (la sobreelevación pasiva de las piernas[35]-[37], o bien, la carga de fluidos (fluid challange)[38]-[40] (Figura 1).
Sobre esta base, el objetivo final de esta metodología consiste en determinar la respuesta a fluidos -esto es, la posibilidad de aumentar el VS (y el Q) con la fluido terapia- a través del concepto de la “precarga-dependencia” del VS. Dado que este fenómeno relaciona cambios en la precarga ventricular (relación P–V de fin de diástole) con cambios del VS (∆VS), el mismo es analizado mediante la curva de función ventricular de Starling: el paciente es “respondedor” (a fluidos) si se encuentra sobre la pendiente lineal de la curva, y “no-respondedor” si se encuentra sobre la meseta (plateau) (Figura 1).
 |
|
Figura 1 Rationale y algoritmo de la metodología de la “respuesta a fluidos” (RF) representado dentro de la estructura de una “caja negra”. El elemento a inferir es la “posición en la curva de Starling” (panel central), a través del análisis del comportamiento de las entradas (estímulos excitatorios), los cuales puede clasificarse en “estacionarios” y “transicionales” (los “desafíos de precarga”), y las salidas (respuesta), como “parámetros dinámicos”. Este abordaje es práctico y novedoso ya que ayuda a distinguir esquemáticamente los diversos componentes de la RF, en concordancia con su dinámica de “excitación-respuesta”. Nótese que el algoritmo de la RF se reduce a la decisión binaria de administrar o no fluidos, de acuerdo a un valor de corte preestablecido de variación del volumen sistólico (∆VS). (*) La carga o “desafío” de fluidos suele incluirse como un “desafío de precarga”, pero la diferencia entre ambos es esencial y el tema central de esta revisión. |
Así, el PD es un indicador de la posición sobre la curva de Starling según un valor de corte preestablecido de fluctuación frente al estímulo excitatorio; más aún, dada esta función, el PD es un predictor de la respuesta a la administración de fluidos. En esto consiste resumidamente la rationale de la hemodinámica funcional: el estado volémico (volume status) del paciente es clasificado en “respondedor” y “no-respondedor”, según la posición en la curva de Starling y por lo tanto, la decisión binaria de administrar o no fluidos, tal como lo ilustran los típicos algoritmos de esta metodología encontrados en la literatura (Figura 1)[11],[41].
La función vascular como determinante de la “posición” sobre la curva de Starling. La distribución del volumen sanguíneo.
Pero, ¿qué significa, efectivamente, “ser respondedor”? Este interrogante puede ser oportunamente desglosado: siendo el volumen sanguíneo (B) o volemia, y la precarga ventricular (relación P–V -o, más precisamente, el estrés parietal- de fin de diástole) variables de diferente naturaleza, ¿cómo se vincularían legítimamente y cuál es la naturaleza de su interacción? ¿De qué depende, en definitiva, la “posición sobre la curva de Starling”? ¿Qué indican realmente
los parámetros dinámicos? Y finalmente, ¿es correcto relacionar la variable sobre la cual recae toda fluido- terapia (el volumen sanguíneo, junto a su compleja homeostasis, cinética y reología) con el Q, a través de la ∆VS?
La respuesta a esta serie de preguntas puede comenzar a aclararse preguntándonos por aquello que se quiere decir por “estado volémico”. Sabemos, por un lado, que la volemia se distribuye dentro de la compleja arquitectura del árbol vascular, sistémico y pulmonar, y que a la vez esta distribución adquiere una variedad de “patrones”, según la compliancia de los lechos vasculares predominantemente perfundidos (distribución periférica intercompartimental), así como de la tasa de Q (distribución central versus periférica)[42]-[45].
Dado que la vasculatura es globalmente complaciente, la distribución del B está gobernada por dos factores principales: el Q (o distribución flujo-dependiente) y la hidrostática (esto es, la distribución que acompaña a la acción de la fuerza gravitacional sobre la sangre – su “peso”), determinando en conjunto el perfil de presiones y volúmenes sanguíneos a lo largo del circuito[45].
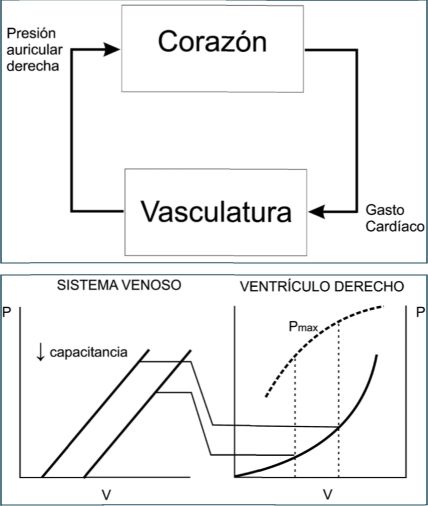
Por otro lado, también sabemos que la precarga es un mayor determinante del rendimiento ventricular y del VS, a través del mecanismo de Frank-Starling. Al mismo tiempo, el simple hecho de que el sistema cardiovascular es un circuito cerrado y que el Q depende en gran medida de la precarga cardíaca (Figura 2A), establece que la interacción entre ambos subsistemas (bomba y circuito) a este nivel (tracto de salida del circuito y tracto de entrada de la bomba) es de algún modo crucial.
Para comprender mejor este concepto, observemos la gráfica de la Figura 2B. El acoplamiento entre la vasculatura y el corazón a nivel de su tracto de entrada (de baja presión) o acoplamiento veno-ventricular[46], demuestra cómo el “estado” del B d determina la precarga ventricular. Es decir, que no es el volumen en sí mismo el determinante de la precarga, sino el volumen en relación a la capacitancia vascular. A su vez, la gráfica enseña que el “lenguaje” idóneo para describir este fenómeno es la relación P-V de ambos subsistemas, ya que es la capacitancia la variable que domina la dinámica de ambos y de su interacción; o, coloquialmente: cuando la vasculatura tiende a contraerse, el corazón tiende a expandirse y viceversa[46].
Este concepto es fundamental para comprender que la ley de Starling no opera “aisladamente”: la “posición” en la curva de Starling depende del estado de las propiedades físicas de la vasculatura (volumen, resistencias, capacitancias) y de la distribución del B – o, si se quiere, del “estado volémico”c.
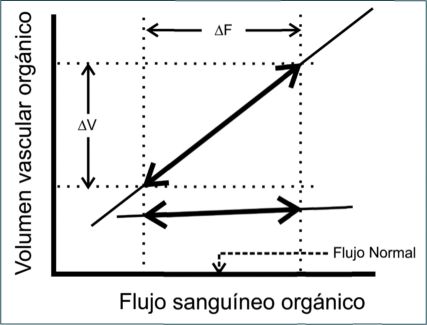
Por otro lado, mientras el tono venoso determina directamente el llenado ventricular, el “llenado venoso” está regulado a su vez por el tono arteriolar. Si bien las arteriolas son bien reconocidas como “vasos de resistencia” (y como determinantes de la poscarga ventricular izquierda), es interesante notar -especialmente en el contexto de la presente sección- que junto con su rol sobre la distribución del Q, las arteriolas regulan del mismo modo la distribución del B ya que el volumen de un lecho vascular depende de su compliancia, pero fundamentalmente de su perfusión (Figura 3)[48].
Así, la vasodilatación y constricción condicionarán la conductancia total de la vasculatura periférica junto con la acumulación de B en los segmentos postcapilares y, por lo tanto, el B disponible para el corazón como precarga (o “volumen vascular central”):
 |
|
Figura 2 Formas alternativas de analizar la interacción entre la bomba y el circuito. A. Diagrama de bloques simplificado del circuito cardiovascular. En el circuito o asa cerrada, la “entrada” de un subsistema representa la “salida” del otro, estabilizándose entre sí mediante retroalimentación negativa. (Modificado de Ref. 45). B. Acoplamiento veno-ventricular. Interacción mecánica entre el sistema vascular venoso agrupado bajo una gráfica P-V idealizada (panel izquierdo) y el ventrículo derecho (panel derecho), en donde se aprecian la curva P-V de fin de diástole (inferior) y de volumen sistólico (superior). Nótese que la naturaleza de esta interacción es en términos de relaciones de P-V entre ambos subsistemas y de intercambios recíprocos de volumen sanguíneo (∆B). “Pmax”: P máxima, o “pico” alcanzada durante la contracción ventricular isovolumétrica para cada valor de precarga (índice de rendimiento ventricular). (Modificado de Ref. 46). |
– Vasoconstricción: ↓ Q–V–P vascular; ↑ Precarga ventricular.
− Vasodilatación: ↑ Q–V–P vascular; ↓ Precarga ventricular.
 |
|
Figura 3 Relación V-Q para lechos vasculares orgánicos de diferente compliancia (C). El volumen de un órgano es dinámico y está determinado por su perfusión y compliancia. Esta característica de los lechos vasculares orgánicos es fundamental ya que determina el patrón de distribución del B, y el V vascular central disponible como precarga (es decir, determina la “posición sobre la curva de Starling”). Dado que la perfusión orgánica está comandada por la conductancia de los segmentos arteriolares del circuito, igual énfasis debiera hacerse en la función venosa y arteriolar sobre la distribución del B. (Modificado de Ref. 48). |
Formas alternativas de analizar la interacción entre el volumen sanguíneo y el gasto cardíaco.
En la sección anterior hemos desplegado el marco conceptual básico para abordar la interacción entre la función vascular y cardíaca, y enfocarnos ahora en el efecto de los cambios agudos en la volemia, los cuales conciernen a toda fluidoterapia. Un abordaje clásico como el presentado a través de las “curvas de función vascular”, en donde ∆B son trazados como desplazamientos paralelos de la curva (Figura 4A), no contempla aquellas situaciones en las que ∆B no generan ∆Q (Figura 4B); y, al mismo tiempo, recordemos que ∆B y variaciones en la capacitancia vascular son indistinguibles en aquella gráfica, ya que ambas modifican la “presión sistémica media”, en sentido opuesto.
Es decir, que la gráfica de la Figura 4A supone una relación lineal entre ∆B y ∆Q independientemente de la intersección de esta curva con la curva de función ventricular de Starling (o sea, independientemente de la “precarga-dependencia”, para cada caso); cuando en realidad esta relación es predominantemente sigmoidea[46],[49] (Figura 4B). Esto significa que la vasculatura amortigua pasivamente aumentos y disminuciones del B ajustando su capacidad, a presión transmural relativamente constante, en un amplio rango en el cual estas variaciones no repercuten sobre la precarga ventricular y por lo tanto, en el Q. Esta función amortiguadora es llevada a cabo, lógicamente, por los lechos vasculares de mayor compliancia como el esplácnico y el cutáneo, y ha sido testeada experimentalmenet[49]
|
Figura 4 Formas alternativas de analizar la interacción entre el B y el Q. A. Curvas de función vascular. Para diferentes estados de volemia. B. Relación entre ∆Q inducidas por cambios agudos del B. Nótese la forma sigmoidea de la curva, en donde ∆Q son amortiguados por ajustes pasivos de la capacitancia vascular (meseta de la curva), a expensas de los lechos de elevada compliancia. En el paciente “respondedor”, el algoritmo de la RF debería predecir una función lineal (línea discontinua) entre ambas variables cuando, en realidad la capacidad amortiguadora de la vasculatura y la precarga-dependencia de los ventrículos no son dependientes una de la otra. (Modificado de Ref. 46). |
De modo inverso, la vasculatura amortigua cambios en el Q, nuevamente ajustando su capacitancia; y también, cambios activos en las capacitancias vasculares afectarán la tasa de flujo, redistribuyendo B, siempre y cuando el equilibrio veno-ventricular resulte afectado. Es decir, que el gasto cardíaco, el volumen sanguíneo y las presiones vasculares están funcionalmente interconectados en el sistema cardiovascular[45] -así como también en cualquier segmento vascular aislado[1]- proporcionando un mecanismo hidráulico pasivo para la regulación del Q.
En otras palabras, la carga de fluidos aumentará el B, pero su repercusión sobre la precarga ventricular -y, por lo tanto, el Q– será en cierta medida impredecible simplemente porque la vasculatura no es rígida, caso en el cual B y Q mantendrían una relación lineal hasta alcanzarse, lógicamente, la meseta de la curva de función ventricular de Starling. Esta propiedad amortiguadora tal vez explique por qué cerca del 50% de los pacientes en diversos ensayos clínicos y meta-análisis sobre RF son “no-respondedores” al momento de la carga de fluidos[50].
-
¿Son los parámetros dinámicos tan diferentes de los “estáticos”?
El progreso en el manejo de fluidos es continuamente atribuido a la metodología de la RF en los términos de una “superación” de los parámetros hemodinámicos “estáticos” (esto es, las clásicas presiones y volúmenes cardíacos)[41],[51], sobre la base de que un valor basal “estático” de precarga es insuficiente para determinar la precarga-dependencia y reproducir, al menos estimativamente, la curva de Starling en tiempo real. Sin embargo, este principio también rige -en parte- para los PD dado que parámetros estáticos y dinámicos no son esencialmente diferentes.
En primer lugar, si bien algunos PD se relacionan con la pulsatilidad de las variables involucradas (Q, P, V) la dinámica del flujo pulsátil no forma parte del análisis de los mismos; es decir, ambos parámetros, dinámicos y estáticos, conciernen al análisis del flujo directo (esto es, variables promediadas sobre múltiples ciclos cardíacos). En este sentido, el PD es simplemente la variación u oscilación cíclica, o tiempo-dependiente, sobre un valor “basal”, o tiempo-pro
mediado, que corresponde al parámetro estáticod, del mismo modo que una onda es la oscilación cíclica de un campo subyacente. De hecho, el PD es, por definición, la diferencia entre máximos y mínimos sobre el promedio de ambos, según la Ecuación 1 (para el VS)[32]:
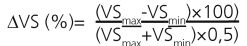 |
| Ecuación 1 |
En segundo lugar, y dado lo expuesto en el parágrafo anterior, ambos tipos de parámetros varían siempre del mismo modo; cualquier intervención que altere el equilibrio veno-ventricular se reflejará en un cambio en el parámetro “dinámico” y “estático” en el mismo sentido: a mayor precarga (como parámetro “estático”), menor será la amplitud de la oscilación del PD, y viceversa. Esto no debería ser novedoso, ya que puede evidenciarse en cualquier gráfica de función ventricular (como la de la Figura 1) en donde se muestra que cuanto más se asciende en la curva (mayor precarga y VS), menor es la ∆(PD).
Una forma práctica de visualizar esta distinción, es “descomponiendo” los PD y analizando sus determinantes: 1) la función ventricular diastólica (dada por la curva P–V diastólica); 2) la “reserva” de precarga ventricular (dada por el acoplamiento veno-ventricular – la “posición” en la curva de Starling); 3) la función ventricular sistólica (dada por la relación P–V telesistólica). Mientras que los tres componentes determinan la amplitud del latido y fracción de eyección, el segundo componente (Figura 2B) determina la magnitud de la variación (es decir, como PD).
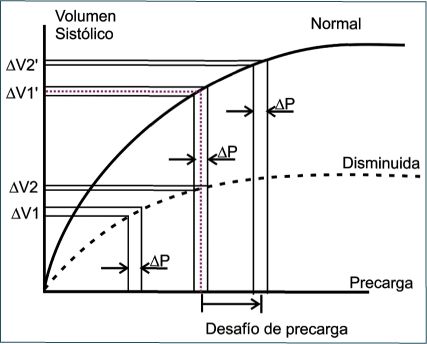
Por último, la afirmación de que un valor aislado de un PD permite reproducir la curva de Starling debe ser tomada con cautela. Si bien el nivel de variación de los PD indica la “precarga-dependencia” (en el sentido estricto del término: la dependencia del VS de la precarga ventricular, latido-a-latido) un registro basal y aislado como en inducido por la variación cíclica estable de las presiones pleurales (“∆P”, en la Figura 5), podrá corresponderse a un segmento determinado en la curva, pero desconociendo en cada caso el resto su trayectoria; es decir, la curva dentro de las posibilidades de la “familia” de curvas (Figura 5).
Para ello, los “desafíos de precarga” permiten, más que predecir la RF, reproducir la curva de función ventricular, al menos estimativamente, ya que se cuenta con dos valores de marcadores de precarga (pre y posintervención), y el cambio en la precarga ventricular inducido por la maniobra es más significativo que aquel generado por la ventilación. Pero esta estrategia es igualmente válida para los parámetros “estáticos”, ya que, contando con al menos dos valores, podría trazarse del mismo modo la pendiente de la curva de Starling. En definitiva, aquello que se persigue es evaluar el cambio del VS y el Q frente a una maniobra que resulta en un cambio súbito en la precarga ventricular.
-
Guiando la terapia vasoactiva con los parámetros dinámicos.
Esta revisión no puede omitir un PD incorporado al “arsenal” de la hemodinámica funcional en el último tiempo: la “elastancia arterial dinámica”, la cual representa la relación entre dos PD “prototipo”, la ∆PP/∆VS[52]-[54]. Este PD, está destinado al escenario de hipotensión arterial ya que evalúa, y predice, la respuesta a la terapia vasopresora, del mismo modo que los PD clásicos lo hacen sobre la RF (que, en realidad, es una “respuesta a la precarga”), sobre la base que la presión arterial (como parámetro “estático”) no puede ser predictor de la misma. Es decir, que mientras el PD clásico está centrado en el acoplamiento veno-ventricular (el cual, como se ha visto, es el determinante de la “posición sobre la curva de Starling”), la elastancia arterial dinámica lo está sobre el acoplamiento ventrículo-arterial.
Sin embargo, al hablar de terapia vasoactiva esta distinción entre segmentos del circuito cardiovascular se torna arbitraria y difícil de definir; ya que la constricción y relajación de las arteriolas y de las venas mediada por sustancias vasoactivas no son predeciblemente selectivas y, de serlo, cualquiera de ellas repercutirá sobre la distribución del B, lo cual se verá reflejado en todas las presiones vasculares, aparejado con los cambios en el Q. Es decir, que modificaciones del tono arteriolar repercutirán sobre la presión arterial pero también -como hemos visto- sobre las presiones de llenado ventricular; mientras que las modificaciones del tono venoso afectarán la precarga, el Q, y por lo tanto, la presión arterial.
Por ello, los PD destinados a evaluar y predecir la RF podrían emplearse, quizás con mayor rigor fisiológico, para guiar la terapia vasoactiva sobre el sistema vascular de baja presión, y así optimizar su acoplamiento con la bomba cardíaca, es decir, como un “desafío de precarga”, si se quiere. Sin embargo, dada la asociación tradicional entre los PD y la RF (y, por lo tanto, la fluido terapia) los ensayos clínicos y experimentales sobre la relación entre los PD y la farmacología vasoactiva son escasos[55]-[58] y no suficientes como para ampliar la rationale convencional de la RF.
 |
|
Figura 5 Comparación entre valores “aislados” de variación del volumen sistólico (∆V) y de la variación de la presión de lleno ventricular (∆P) para una curva de función ventricular “normal” y “disminuida”. Los tres ∆P indicados tienen la misma longitud, ya que se asume que las presiones intra-torácicas inducidas por la ventilación no cambian para cada caso. “∆V1” y “∆V1’” poseen la misma longitud, pero la función ventricular (pendiente y forma de la curva) es diferente para cada caso; lo mismo sucede con “∆V2” y “∆V2’” (luego del “desafío de precarga”), resaltando el hecho de que los PD por sí solos no informan sobre la pendiente de la curva de Starling. A su vez, se indica que el parámetro “estático” -como cualquier valor instantáneo de V- no es diferente en ese mismo sentido (línea discontinua color rojo). |
-
Consideraciones sobre la homeostasis del volumen sanguíneo.
Analizando la rationale de la RF bajo la luz del presente análisis, comienza a revelarse la “brecha” entre lo que es B y fluido-terapia, y el tema de la optimización del Q. Todos sabemos que la sangre no es un fluido simple, homogéneo, e inerte, y por lo tanto su terapéutica debiera estar enfocada sobre esta variable, abarcando lo mejor posible todos los aspectos que hacen a su homeostasis[59]-[61].
En este sentido, consideremos brevemente dos tecnologías, relativamente simples, que fueron destinadas a la evaluación y análisis integral en la práctica clínica de dos aspectos fundamentales de la sangre como órgano: la tromboelastografía, y el análisis del volumen sanguíneo (blood volume analysis)[62]. Ambas evalúan no un aspecto aislado sino la función integral de aquella variable que se desea conocer, lo cual significa la posibilidad de guiar la terapéutica racional y directamente. Parámetros como el volumen sanguíneo total, plasmático, globular, y sobre todo, el hematocrito normalizado, son fundamentales para guiar la terapéutica de aquella variable sobre la cual recae toda fluido y hemoterapia: el volumen sanguíneo.
| Tabla 1 | ||
|
“Respuesta a fluidos” |
“Volumen sanguíneo estresado” |
|
|
Modelo |
Starling (1914) |
Guyton (1955-57) |
|
Rationale |
La RF es determinada a través de los PD, como la “posición sobre la curva de Starling” |
El V “estresado” (V que distiende la vasculatura, a p > 0) representa la fracción “circulante efectiva” -y responsable del “retorno venoso” sistémico-, y es estimada a través de la “presión sistémica media” |
|
Subsistema |
Corazón |
Circulación sistémica |
|
Abordaje al B |
El estado volémico es clasificado en “respondedor” y “no-respondedor”, sin la necesidad de contar con información real sobre el B |
El B total no es tenido en cuenta, dado que es la fracción “estresada” la que hace a la circulación, mientras que la “no-estresada” solo es “reclutable” a B estresado |
|
Crítica a la Rationale |
La rationale de la RF está basada en una interpretación aislada de la curva de Starling. No contempla factores vasculares y la interacción entre vasculatura y corazón, la cual determina la “posición” sobre la curva de Starling (es decir, la precarga-dependencia) |
– Los volúmenes “estresado” y “no-estrasado” no coexisten, ni poseen “propiedades hemodinámicas” diferentes. Esta noción es respaldada por una interpretación abstracta de la curva P-V de un sistema compliante – La presión sistémica media es, por definición, el cociente entre el B y la compliancia total agregada. Es una P significativa solo cuando Q = 0; no la P de retorno venoso. Además, nunca puede ser una variable de relevancia ya que depende de las variables que la componen, las cuales son desconocidas – El B “no-estresado” solo se encuentra realmente en el segmento final del perfil, donde la P se aproxima a 0, pudiendo comprometer la precarga ventricular al generarse el colapso de aquellos vasos |
|
Implicancias sobre la homeostasis del B, y su terapéutica |
Ambas metodologías motivan un abordaje abstracto al B, en donde el mismo no es interpretado como una variable hemodinámica efectiva (en el sentido que déficits y excesos son demostrablemente deletéreos (Figura 6) y analizable en la práctica clínica |
|
|
Lo que los modelos realmente enseñan, y… |
– El mecanismo de Frank-Starling: la dependencia del VS de la precarga ventricular – Como sistema abierto: la presión auricular derecha como entrada y el Q como salida |
– La distribución flujo-dependiente del B, en el preparado experimental arrefléxico (donde la presión arterial no es regulada) – Como sistema abierto: el Q como entrada, y la presión auricular derecha como salida |
|
Cómo interactúan |
La contraposición de ambos subsistemas conforma un asa cerrada de retroalimentación negativa, en donde el sistema cardiovascular exhibe un punto de equilibrio simultáneamente consistente con las propiedades físicas de cada uno |
|
Esto no quiere decir que un aumento del Q no pueda o deba realizarse mediante la administración de fluidos. En el primer caso –poder– la curva en la Figura 3B demuestra que el aumento progresivo del B secundario a la infusión de fluidos provocará un aumento del Q independientemente de las demandas metabólicas tisulares, cuando la precarga ventricular resulte afectada; en el segundo caso –deber– la cuestión se encamina hacia la mirada sobre la homeostasis circulatoria: el desacoplamiento veno-ventricular ¿ha sido la consecuencia de un desbalance en el B que debiera corregirse o de una alteración del tono vasomotor de la vasculatura?
Por otro lado, si bien los algoritmos existentes para el manejo de fluidos guiado por los PD son claros y consistentes en sí mismos, no hay actualmente unanimidad ni consenso evidentes en la práctica sobre otras cuestiones fundamentales, tales como: 1) si la carga de fluidos es o no necesaria cada vez que el PD lo indica; 2) si la misma se relaciona efectivamente con un aumento del Q y, 3) si éste es o no requerido para mejorar la entrega sistémica de oxígeno[63].
-
Conclusión: el problema de los modelos clásicos.
Las metodologías vigentes destinadas al manejo hemodinámico en general, están basadas en ciertas interpretaciones de dos modelos clásicos de la fisiología cardiovascular moderna: Starling (1914) y Guyton (1955-57)[1]. Mientras que en la presente investigación nos hemos enfocado en el primero, a continuación realizaremos un breve análisis comparativo (Tabla 1) relacionado con el tratamiento que ambas interpretaciones hacen sobre el B.
Como se observa en la Tabla 1, si bien ambas “vertientes” de la hemodinámica clínica moderna
(Starling y Guyton) abordan distintas subdivisiones del sistema cardiovascular (corazón y vasculatura, respectivamente), ambas convergen en la interpretación y tratamiento que hacen del B como variable hemodinámica. En otras palabras, ambas pretenden resolver aquella “brecha” entre dos grandes problemas: la volemia y la perfusión. Así, la vertiente Guytoniana postula que solo parte del B hace a la circulación (V circulante “efectivo” o “estresado”), mientras que la doctrina de la RF (Starling) clasifica el “estado volémico” en “respondedor” o no; ninguna de las dos concibe el B como variable real y efectiva en sí misma.
La superación de este esquema, entonces, implicaría a un nivel conceptual, incorporar el concepto analizado en el presente trabajo de la “distribución del B”, ya que elimina la brecha mencionada: el patrón de distribución del B determina la precarga ventricular y el Q; es decir, que determina, simultáneamente, la “efectividad” del B (Guyton) y la “posición sobre la curva de función ventricular” (Starling). Mientras que a un nivel práctico, implica tratar el B “por lo que es”, teniendo en cuenta su homeostasis, cinética y fisioplatología.
“Respondemos”, finalmente, el interrogante inicial: “¿qué significa ‘ser respondedor’?” No la posibilidad de aumentar el Q mediante la fluido terapia, sino mediante la optimización del acoplamiento veno-ventricular, lo cual es una consecuencia predecible de un flujo optimizado.
a La hemodinámica funcional (a veces referida como “monitoreo hemodinámico funcional”) es una estrategia y metodología de abordaje del monitoreo y manejo hemodinámico que conforma un pilar principal del paradigma contemporáneo de la “terapia guiada por objetivos” dentro de la medicina perioperatoria[3] e intensiva[4]. Esta vertiente de la hemodinámica clínica se ha consolidado hacia principios de este milenio (de la mano de autores como Pinsky, Michard, Teboul, Monnet, Marik, Perel, Cannesson, entre otros, quienes más contribuyeron a definir sus fundamentos y técnicas), y se remonta a los estudios pioneros sobre los efectos hemodinámicos de la ventilación mecánica a lo largo de la segunda mitad del siglo XX[5]-[9].
La hemodinámica funcional básicamente consiste en la evaluación de la respuesta hemodinámica frente a una perturbación transitoria y reversible del sistema cardiopulmonar para predecir la “respuesta a fluidos”[10]-[12] (ver texto). No obstante, hay que diferenciar aquí lo que es la medición del volumen sistólico y el gasto cardíaco por métodos mínimamente o no-invasivos, del cómputo de su variación a través de estas mismas tecnologías, es decir, como parámetro dinámico. Asimismo, no es el objetivo de este artículo analizar aspectos técnico-metodológicos y epidemiológicos de los diversos parámetros dinámicos, así como tampoco revisar la vasta bibliografía. Solo trataremos con la rationale de esta metodología.
b Es importante mencionar que las variables conocidas tradicionalmente como “parámetros dinámicos” no son “parámetros”, en el sentido estricto del término, sino “variables”; ya que la diferencia es fundamental: mientras la variable es una entidad, generalmente mensurable, cuyo valor puede cambiar dentro de un sistema, el parámetro representa una entidad que es utilizada para conectar dos o más variables dentro de una ecuación. No obstante, usaremos aquí los términos “parámetro” y “variable” intercambiablemente –pero en el sentido del término “variable”- para no generar mayor confusión.
c La necesidad de aclarar el sentido del término “estado” al referirse al B surge únicamente para distinguirlo del B como una cantidad absoluta. Asimismo, aquí se lo diferencia del “estado de estrés” ya que esta terminología (B “estresado” y “no-estresado”) como habitualmente se la concibe[47] presenta una serie de inconsistencias físico-fisiológicas[1] (ver Tabla 1), genera confusiones acerca de la función vascular sobre la regulación del gasto cardíaco, y no explica el modo cómo este “estado” realmente interactúa con la bomba cardíaca. De hecho, no se encuentra en la literatura una definición concisa de lo que “estado volémico” (volume status) supuestamente significa.
d En verdad, lo que llamamos “parámetro estático” corresponde a cualquier valor instantáneo de la variable en cuestión (el VS, por ejemplo), el cual puede o no coincidir con el promedio de los valores instantáneos de esa misma variable en cierto intervalo de tiempo. En este sentido, los valores máximos y mínimos de la Ecuación 1 también se tratan de valores instantáneos de la variable “VS”.
Agradecimientos: A George L. Brengelmann, PhD, del Departamento de Fisiología y Biofísica de la Universidad de Washington, por la confección de las gráficas de las figuras y por aportar valiosas críticas sobre las ideas desarrolladas en este trabajo.
Abreviaciones
∆: Diferencia; Variación.
B: Volumen Sanguíneo; Volemia.
P: Presión.
PP: Presión del Pulso (arterial).
Q: Flujo; Flujo Sistémico; Gasto Cardíaco.
RF: Respuesta a Fluidos.
V: Volumen.
VS: Volumen Sistólico.
-
Referencias
- Dalmau R. Hemodinámica: the Big Picture. Un análisis y modelo integrador de la circulación humana relevante para la hemodinámica clínica. Revista Argentina de Anestesiología. 2017;75(3):85–92. https://doi.org/10.1016/j.raa.2017.09.003.
- Heidegger M. Lección II, Parte II. En ¿Qué Significa Pensar?1ed., Madrid, España, Editorial Trotta, 2005, pp.123.
- Gan TJ, Soppitt A, Maroof M, el-Moalem H, Robertson KM, Moretti E, et al. Goal-directed intraoperative fluid administration reduces length of hospital stay after major surgery. Anesthesiology. 2002 Oct;97(4):820–6. https://doi.org/10.1097/00000542-200210000-00012 PMID:12357146
- Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al.; Early Goal-Directed Therapy Collaborative Group. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001 Nov;345(19):1368–77. https://doi.org/10.1056/NEJMoa010307 PMID:11794169
- Morgan BC, Martin WE, Hornbein TF, Crawford EW, Guntheroth WG. Hemodynamic effects of intermittent positive pressure respiration. Anesthesiology. 1966 Sep-Oct;27(5):584–90. https://doi.org/10.1097/00000542-196609000-00009 PMID:5331459
- Pinsky MR, Summer WR, Wise RA, Permutt S, Bromberger-Barnea B. Augmentation of cardiac function by elevation of intrathoracic pressure. J Appl Physiol. 1983 Apr;54(4):950–5. https://doi.org/10.1152/jappl.1983.54.4.950 PMID:6853301
- Robotham JL, Cherry D, Mitzner W, Rabson JL, Lixfeld W, Bromberger-Barnea B. A re-evaluation of the hemodynamic consequences of intermittent positive pressure ventilation. Crit Care Med. 1983 Oct;11(10):783–93. https://doi.org/10.1097/00003246-198310000-00005 PMID:6352172
- Pinsky MR. The hemodynamic consequences of mechanical ventilation: an evolving story. Intensive Care Med. 1997 May;23(5):493–503. https://doi.org/10.1007/s001340050364 PMID:9201520
- Michard F, Chemla D, Richard C, Wysocki M, Pinsky MR, Lecarpentier Y, et al. Clinical use of respiratory changes in arterial pulse pressure to monitor the hemodynamic effects of PEEP. Am J Respir Crit Care Med. 1999 Mar;159(3):935–9. https://doi.org/10.1164/ajrccm.159.3.9805077 PMID:10051276
- Michard F, Teboul JL. Using heart-lung interactions to assess fluid responsiveness during mechanical ventilation. Crit Care. 2000;4(5):282–9. https://doi.org/10.1186/cc710 PMID:11094507
- Michard F. Changes in arterial pressure during mechanical ventilation. Anesthesiology. 2005 Aug;103(2):419–28. https://doi.org/10.1097/00000542-200508000-00026 PMID:16052125
- Pinsky MR, Payen D. Functional hemodynamic monitoring. Crit Care. 2005;9(6):566–72. https://doi.org/10.1186/cc3927 PMID:16356240
- Marik PE, Cavallazzi R, Vasu T, Hirani A. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: a systematic review of the literature. Crit Care Med. 2009 Sep;37(9):2642–7. https://doi.org/10.1097/CCM.0b013e3181a590da PMID:19602972
- Mehta Y, Arora D. Newer methods of cardiac output monitoring. World J Cardiol. 2014 Sep;6(9):1022–9. https://doi.org/10.4330/wjc.v6.i9.1022 PMID:25276302
- Magder S. Clinical usefulness of respiratory variations in arterial pressure. Am J Respir Crit Care Med. 2004 Jan;169(2):151–5. https://doi.org/10.1164/rccm.200211-1360CC PMID:14718237
- Tavernier B, Robin E, Granet F. Inspiratory increases in systolic blood pressure (“Delta-up”) and pulse pressure are not equivalent. Anesthesiology. 2008 Nov;109(5):934–5. https://doi.org/10.1097/ALN.0b013e3181895de1 PMID:18946313
- Sandroni C, Cavallaro F, Marano C, Falcone C, De Santis P, Antonelli M. Accuracy of plethysmographic indices as predictors of fluid responsiveness in mechanically ventilated adults: a systematic review and meta-analysis. Intensive Care Med. 2012 Sep;38(9):1429–37. https://doi.org/10.1007/s00134-012-2621-1 PMID:22732902
- Cannesson M, Attof Y, Rosamel P, Desebbe O, Joseph P, Metton O, et al. Respiratory variations in pulse oximetry plethysmographic waveform amplitude to predict fluid responsiveness in the operating room. Anesthesiology. 2007 Jun;106(6):1105–11. https://doi.org/10.1097/01.anes.0000267593.72744.20 PMID:17525584
- Cannesson M, Desebbe O, Rosamel P, Delannoy B, Robin J, Bastien O, et al. Pleth variability index to monitor the respiratory variations in the pulse oximeter plethysmographic waveform amplitude and predict fluid responsiveness in the operating theatre. Br J Anaesth. 2008 Aug;101(2):200–6. https://doi.org/10.1093/bja/aen133 PMID:18522935
- De Backer D, Fagnoul D. Intensive care ultrasound: VI. Fluid responsiveness and shock assessment. Ann Am Thorac Soc. 2014 Jan;11(1):129–36. https://doi.org/10.1513/AnnalsATS.201309-320OT PMID:24460447
- Miller A, Mandeville J. Predicting and measuring fluid responsiveness with echocardiography. Echo Res Pract. 2016 Jun;3(2):G1–12. https://doi.org/10.1530/ERP-16-0008 PMID:27249550
- Monnet X, Rienzo M, Osman D, Anguel N, Richard C, Pinsky MR, et al. Esophageal Doppler monitoring predicts fluid responsiveness in critically ill ventilated patients. Intensive Care Med. 2005 Sep;31(9):1195–201. https://doi.org/10.1007/s00134-005-2731-0 PMID:16059723
- Cannesson M, Slieker J, Desebbe O, Farhat F, Bastien O, Lehot JJ. Prediction of fluid responsiveness using respiratory variations in left ventricular stroke area by transoesophageal echocardiographic automated border detection in mechanically ventilated patients. Crit Care. 2006;10(6):R171. https://doi.org/10.1186/cc5123 PMID:17163985
- Feissel M, Michard F, Faller JP, Teboul JL. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy. Intensive Care Med. 2004 Sep;30(9):1834–7. https://doi.org/10.1007/s00134-004-2233-5 PMID:15045170
- Charbonneau H, Riu B, Faron M, Mari A, Kurrek MM, Ruiz J, et al. Predicting preload responsiveness using simultaneous recordings of inferior and superior vena cavae diameters. Crit Care. 2014 Sep;18(5):473. https://doi.org/10.1186/s13054-014-0473-5 PMID:25189403
- Pinsky MR. Using ventilation-induced aortic pressure and flow variation to diagnose preload responsiveness. Intensive Care Med. 2004 Jun;30(6):1008–10. https://doi.org/10.1007/s00134-004-2208-6 PMID:15007547
- Song Y, Kwak YL, Song JW, Kim YJ, Shim JK. Respirophasic carotid artery peak velocity variation as a predictor of fluid responsiveness in mechanically ventilated patients with coronary artery disease. Br J Anaesth. 2014 Jul;113(1):61–6. https://doi.org/10.1093/bja/aeu057 PMID:24722322
- Monge García MI, Gil Cano A, Díaz Monrové JC. Brachial artery peak velocity variation to predict fluid responsiveness in mechanically ventilated patients. Crit Care. 2009;13(5):R142. https://doi.org/10.1186/cc8027 PMID:19728876
- Bendjelid K, Suter PM, Romand JA. The respiratory change in preejection period: a new method to predict fluid responsiveness. J Appl Physiol (1985). 2004 Jan;96(1):337–42. https://doi.org/10.1152/japplphysiol.00435.2003 PMID:14660495
- Cannesson M, Keller G, Desebbe O, Lehot JJ. Relations between respiratory changes in R-wave amplitude and arterial pulse pressure in mechanically ventilated patients. J Clin Monit Comput. 2010 Jun;24(3):203–7. https://doi.org/10.1007/s10877-010-9235-3 PMID:20458612
- Vergnaud E, Vidal C, Verchère J, Miatello J, Meyer P, Carli P, et al. Stroke volume variation and indexed stroke volume measured using bioreactance predict fluid responsiveness in postoperative children. Br J Anaesth. 2015 Jan;114(1):103–9. https://doi.org/10.1093/bja/aeu361 PMID:25315146
- Sondergaard S. Pavane for a pulse pressure variation defunct. Crit Care. 2013 Nov;17(6):327. https://doi.org/10.1186/cc13109 PMID:24229428
- Monnet X, Osman D, Ridel C, Lamia B, Richard C, Teboul JL. Predicting volume responsiveness by using the end-expiratory occlusion in mechanically ventilated intensive care unit patients. Crit Care Med. 2009 Mar;37(3):951–6. https://doi.org/10.1097/CCM.0b013e3181968fe1 PMID:19237902
- Myatra SN, Monnet X, Teboul JL. Use of ‘tidal volume challenge’ to improve the reliability of pulse pressure variation. Crit Care. 2017 Mar;21(1):60. https://doi.org/10.1186/s13054-017-1637-x PMID:28320434
- Monnet X, Rienzo M, Osman D, Anguel N, Richard C, Pinsky MR, et al. Passive leg raising predicts fluid responsiveness in the critically ill. Crit Care Med. 2006 May;34(5):1402–7. https://doi.org/10.1097/01.CCM.0000215453.11735.06 PMID:16540963
- Monnet X, Teboul JL. Passive leg raising. Intensive Care Med. 2008 Apr;34(4):659–63. https://doi.org/10.1007/s00134-008-0994-y PMID:18214429
- Monnet X, Teboul JL. Passive leg raising: five rules, not a drop of fluid! Crit Care. 2015 Jan;19(1):18. https://doi.org/10.1186/s13054-014-0708-5 PMID:25658678
- Vincent JL, Weil MH. Fluid challenge revisited. Crit Care Med. 2006 May;34(5):1333–7. https://doi.org/10.1097/01.CCM.0000214677.76535.A5 PMID:16557164
- Lakhal K, Ehrmann S, Perrotin D, Wolff M, Boulain T. Fluid challenge: tracking changes in cardiac output with blood pressure monitoring (invasive or non-invasive). Intensive Care Medicine [Internet]. Springer Nature; 2013 Sep 6;39(11):1953–62. Available from: http://dx.doi.org/10.1007/s00134-013-3086-6
- Guinot PG, Bernard E, Defrancq F, Petiot S, Majoub Y, Dupont H, et al. Mini-fluid challenge predicts fluid responsiveness during spontaneous breathing under spinal anaesthesia: an observational study. Eur J Anaesthesiol. 2015 Sep;32(9):645–9. https://doi.org/10.1097/EJA.0000000000000175 PMID:25329455
- Monnet X, Marik PE, Teboul JL. Prediction of fluid responsiveness: an update. Ann Intensive Care. 2016 Dec;6(1):111. https://doi.org/10.1186/s13613-016-0216-7 PMID:27858374
- Rowell LB, Murray JA, Brengelmann GL, Kraning KK 2nd. Human cardiovascular adjustments to rapid changes in skin temperature during exercise. Circ Res. 1969 May;24(5):711–24. https://doi.org/10.1161/01.RES.24.5.711 PMID:5770258
- Rowell LB, Brengelmann GL, Blackmon JR, Murray JA. Redistribution of blood flow during sustained high skin temperature in resting man. J Appl Physiol. 1970 Apr;28(4):415–20. https://doi.org/10.1152/jappl.1970.28.4.415 PMID:5437428
- Flamm SD, Taki J, Moore R, Lewis SF, Keech F, Maltais F, et al. Redistribution of regional and organ blood volume and effect on cardiac function in relation to upright exercise intensity in healthy human subjects. Circulation. 1990 May;81(5):1550–9. https://doi.org/10.1161/01.CIR.81.5.1550 PMID:2331767
- Brengelmann GL. A critical analysis of the view that right atrial pressure determines venous return. J Appl Physiol (1985). 2003 Mar;94(3):849–59. https://doi.org/10.1152/japplphysiol.00868.2002 PMID:12391065
- Tyberg JV. How changes in venous capacitance modulate cardiac output. Pflugers Arch. 2002 Oct;445(1):10–7. https://doi.org/10.1007/s00424-002-0922-x PMID:12397381
- Gelman S. Venous function and central venous pressure: a physiologic story. Anesthesiology. 2008 Apr;108(4):735–48. https://doi.org/10.1097/ALN.0b013e3181672607 PMID:18362606
- Rowell LB. The Venous System. Human Circulation. Regulation During Physical Stress. New York: Oxford Univ. Press; 1986. p. 60.
- Scott-Douglas NW, Robinson VJ, Smiseth OA, Wright CI, Manyari DE, Smith ER, et al. Effects of acute volume loading and hemorrhage on intestinal vascular capacitance: a mechanism whereby capacitance modulates cardiac output. Can J Cardiol. 2002 May;18(5):515–22. PMID:12032578
- Takala J. Volume responsive, but does the patient need volume? Intensive Care Med. 2016 Sep;42(9):1461–3. https://doi.org/10.1007/s00134-015-4172-8 PMID:26825955
- Guerin L, Monnet X, Teboul JL. Monitoring volume and fluid responsiveness: from static to dynamic indicators. Best Pract Res Clin Anaesthesiol. 2013 Jun;27(2):177–85. https://doi.org/10.1016/j.bpa.2013.06.002 PMID:24012230
- Monge García MI, Gil Cano A, Gracia Romero M. Dynamic arterial elastance to predict arterial pressure response to volume loading in preload-dependent patients. Crit Care. 2011;15(1):R15. https://doi.org/10.1186/cc9420 PMID:21226909
- Cecconi M, Monge García MI, Gracia Romero M, Mellinghoff J, Caliandro F, Grounds RM, et al. The use of pulse pressure variation and stroke volume variation in spontaneously breathing patients to assess dynamic arterial elastance and to predict arterial pressure response to fluid administration. Anesth Analg. 2015 Jan;120(1):76–84. https://doi.org/10.1213/ANE.0000000000000442 PMID:25230102
- Jozwiak M, Monnet X, Teboul JL, Monge García MI, Pinsky MR, Cecconi M. The dynamic arterial elastance: a call for a cautious interpretation : Discussion on “Predicting vasopressor needs using dynamic parameters”. Intensive Care Med. 2017 Sep;43(9):1438–9. https://doi.org/10.1007/s00134-017-4836-7 PMID:28497270
- Nouira S, Elatrous S, Dimassi S, Besbes L, Boukef R, Mohamed B, et al. Effects of norepinephrine on static and dynamic preload indicators in experimental hemorrhagic shock. Crit Care Med. 2005 Oct;33(10):2339–43. https://doi.org/10.1097/01.CCM.0000182801.48137.13 PMID:16215390
- Monnet X, Jabot J, Maizel J, Richard C, Teboul JL. Norepinephrine increases cardiac preload and reduces preload dependency assessed by passive leg raising in septic shock patients. Crit Care Med. 2011 Apr;39(4):689–94. https://doi.org/10.1097/CCM.0b013e318206d2a3 PMID:21263328
- Biais M, Cottenceau V, Petit L, Masson F, Cochard JF, Sztark F. Impact of norepinephrine on the relationship between pleth variability index and pulse pressure variations in ICU adult patients. Crit Care. 2011 Jul;15(4):R168. https://doi.org/10.1186/cc10310 PMID:21749695
- Hadian M, Severyn DA, Pinsky MR. The effects of vasoactive drugs on pulse pressure and stroke volume variation in postoperative ventilated patients. Journal of Critical Care [Internet]. Elsevier BV; 2011 Jun;26(3):328.e1–328.e8. Available from: http://dx.doi.org/10.1016/j.jcrc.2010.08.018
- Bellamy MC. Wet, dry or something else? Br J Anaesth. 2006 Dec;97(6):755–7. https://doi.org/10.1093/bja/ael290 PMID:17098724
- Peng ZY, Kellum JA. Perioperative fluids: a clear road ahead? Curr Opin Crit Care. 2013 Aug;19(4):353–8. https://doi.org/10.1097/MCC.0b013e3283632f1f PMID:23817030
- Ospina-Tascon G, Neves AP, Occhipinti G, Donadello K, Büchele G, Simion D, et al. Effects of fluids on microvascular perfusion in patients with severe sepsis. Intensive Care Med. 2010 Jun;36(6):949–55. https://doi.org/10.1007/s00134-010-1843-3 PMID:20221744
- Manzone TA, Dam HQ, Soltis D, Sagar VV. Blood volume analysis: a new technique and new clinical interest reinvigorate a classic study. J Nucl Med Technol. 2007 Jun;35(2):55–63. https://doi.org/10.2967/jnmt.106.035972 PMID:17496003
- Le Manach Y, Hofer C, Vallet B, Tavernier B, Cannesson M. In reply. Anesthesiology. 2013 Sep;119(3):726–7. https://doi.org/10.1097/ALN.0b013e31829e094e PMID:23962932
Functional hemodynamics: “Be responsive, what does this mean”?Functional hemodynamics: “Be responsive, what does this mean”?

 ORCID
ORCID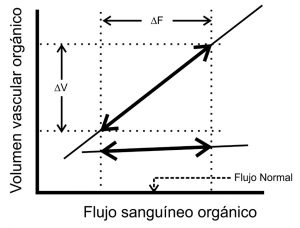

 Creative Commons Attribution
Creative Commons Attribution