Carlos Lagos A. 1 , Sergio Quezada E. 1
Rev Chil Anest Vol. 38 Núm. 1 pp. 24-33|doi:
PDF|ePub|RIS
Introducción
Las náuseas y los vómitos postoperatorios (NVPO) son una complicación frecuente de la anestesia y la cirugía, estimándose su incidencia en un 25-30% de los pacientes. Más aún, en pacientes de alto riesgo, su incidencia alcanza un 70-80% 1 –3 . Su presencia no sólo determina incomodidad e insatisfacción en los pacientes, sino que además se asocia a morbilidad postoperatoria, como alteraciones electrolíticas, deshidratación y aspiración pulmonar. Por otra parte, al aumentar la tensión en la línea de sutura, puede favorecer la formación de un hematoma o la dehiscencia del sitio quirúrgico. Consecuencia de lo anterior, conlleva a una prolongación de la estada en la sala de recuperación, y a una elevación de los costos en salud. En el caso de la cirugía ambulatoria, puede retrasar el alta de los pacientes 1 , 4 .
El objetivo del presente artículo es revisar los conceptos sobre su fisiopatología, factores de riesgo y estratificación, reducción del riesgo basal, profilaxis y tratamiento de las NVPO.
Fisiopatología
El centro del vómito se localiza en la formación reticular ascendente. Se relaciona estrechamente con el núcleo del tracto solitario (NTS) y el área postrema. Dentro de esta última destaca la zona de quimiorreceptores gatillo (ZQG). El centro del vómito recibe estímulos centrales y periféricos, ya sea directamente o indirectamente a través de la ZQG. Los estímulos periféricos provienen de la orofaringe (nervio glosofaríngeo), de las vísceras abdominales (estímulos químicos y mecánicos conducidos por el vago), del mediastino, del peritoneo y de la pelvis renal, entre otros. Los estímulos centrales, por su parte, provienen de la corteza cerebral, la ZQG, los núcleos del tallo cerebral, el aparato vestibular del oído interno y del centro visual. El área postrema carece de una barrera hematoencefálica efectiva, por lo que recibe estímulos químicos presentes en la sangre o el líquido cefalorraquídeo, los que transmite a la ZQG 5 , 6 .
Múltiples tipos de receptores participan en la generación de náuseas y vómitos, destacando los receptores de dopamina tipo 2 (D2), los receptores de serotonina tipo 3 (5-HT3), los receptores de histamina tipo 1 (H1) y los receptores colinérgicos muscarínicos tipo 1 (M1). La mayor parte de los fármacos antieméticos ejercen su acción por bloqueo de uno o más de estos receptores. La ZQG es rica en receptores D2 y 5-HT3. El NTS posee múltiples receptores: D2, H1, M1, receptores μ del sistema opioide endógeno y receptores del sistema neurokinina. Al ser estimulados estos receptores, reenvían la señal al centro del vómito, en donde se origina el estímulo eferente, que es conducido a través de vías eferentes vegetativas (pares craneales V, VII, IX, X y XII) y somáticas (nervios frénicos, intercostales y abdominogenitales), para finalmente dar lugar al reflejo del vómito 5 , 6 . Los receptores D2 se localizan también en el estómago y parecen mediar la inhibición de la motilidad gástrica que ocurre durante las náuseas y vómitos, retardando el vaciamiento gástrico 7 .
Así como existen múltiples receptores y vías aferentes involucradas, igualmente existe gran variedad de estímulos que pueden producir náuseas y vómitos. Por ejemplo, la hipotensión arterial, la hipovolemia, la estimulación vagal (tracción sobre el mesenterio, dilatación del cuello uterino, etc.), dolor, hipoxemia y ciertos fármacos (opiáceos, etomidato, neostigmina, óxido nitroso) 6 . Esta naturaleza multifactorial del vómito determina y explica la necesidad de un abordaje combinado para la prevención y tratamiento de las NVPO.
Identificación de los factores de riesgo
La etiología de la NVPO es multifactorial e involucra factores relacionados con el paciente, la cirugía y la anestesia 8 .
-
Factores de riesgo dependientes del paciente
Los factores de riesgo más prevalentes e identificados como predictores independientes de NVPO son: el sexo femenino, el status de no fumador y la historia de NVPO o de cinetosis 2 , 9 . Se estima que las mujeres tienen tres veces más riesgo de sufrir NVPO que los hombres 10 . En el caso de los no fumadores, se estima que tienen dos veces más riesgo que los fumadores 11 . El mecanismo fisiopatológico de este efecto protector del tabaquismo no está claro.
Debemos considerar además algunas condiciones médicas coexistentes, que igualmente predisponen a NVPO, tales como patologías gastrointestinales (hernia hiatal, reflujo gastroesofágico) 12 ,15 , metabólicas (diabetes mellitus, uremia, desequilibrios hidroelectrolíticos) 13 ,15 , tumores cerebrales (por aumento de la presión intracraneana) 14 ,15 , el abdomen agudo o la obstrucción intestinal 15 .
-
Factores de riesgo relacionados con la intervención quirúrgica
Al igual que los anteriores, tampoco son modificables, pero se deben tener en cuenta para el manejo profiláctico y terapéutico. La incidencia de NVPO varía según el tipo y la duración de la cirugía. Las cirugías que se asocian a mayor incidencia de NVPO son: la cirugía otorrinolaringológica, maxilofacial, ginecológica, ortopédica (cirugía de hombros y artroplastía total de rodilla), oftalmológica (cirugía de estrabismo), neurocirugía, la cirugía laparoscópica y abdominal, la cirugía de mamas (mamoplastía de aumento) y la varicosafenectomía 10 , 16 . Sin embargo, existe controversia de si el tipo de cirugía constituye un factor de riesgo independiente o no 10 . En cambio, sí se ha establecido como un predictor independiente de NVPO la duración de la cirugía. Se estima que cada 30 minutos de incremento del tiempo quirúrgico, aumenta el riesgo de NVPO en un 60%, a partir de un riesgo basal del 10%. Por tanto, pasados 30 minutos, el riesgo aumentaría de un 10% a un 16% 17 , 18 .
-
Factores de riesgo relacionados con la técnica anestésica
A diferencia de los anteriores, los factores relacionados con la anestesia sí se pueden controlar. Los factores de riesgo más importantes son el uso de anestesia general con anestésicos volátiles, el uso de óxido nitroso y el uso de opioides intra y postoperatorios.
Si bien la anestesia espinal puede asociarse a vómitos secundarios al estímulo vagal, en términos globales hay una menor incidencia de NVPO cuando se emplean técnicas de anestesia regional en comparación con la anestesia general 10 , 19 . Dentro de la anestesia general, la anestesia general inhalatoria presenta un riesgo de NVPO dos veces mayor, comparada con la anestesia intravenosa total con propofol 19 . Apfel por su parte, en un estudio randomizado concluyó que los anestésicos volátiles fueron la principal causa de vómitos en el postoperatorio precoz (0-2 h), siendo este efecto dosis-dependiente (tiempo de exposición) y similar para los distintos halogenados (isoflurano, enflurano y sevoflurano). En el período postoperatorio tardío (2-24 h), su efecto no fue significativo 20 .
Respecto al óxido nitroso, dos meta-análisis concluyeron que la omisión del óxido nitroso reduce el riesgo de NVPO en un 28% 21 , 22 .
La acción emetizante de los opioides se debe a estimulación directa de la ZQG, prolongación del vaciamiento gástrico, reducción de la motilidad gastrointestinal y sensibilización del sistema vestibular 23 ,24 . La incidencia de NVPO tiene una clara relación con las dosis de opioides pre y postoperatorios utilizados 25 . Sin embargo, dosis en la inducción anestésica de fentanilo 1,5 μg/kg, sufentanilo 0,15 μg/kg o alfentanilo 15 μg/kg no producen un aumento significativo de la incidencia de NVPO 20 . Este último es el que tiene menos riesgo de NVPO de los tres, comparado con dosis equipotentes de fentanilo y sufentanilo 26 .
Recomendaciones de manejo
Las recomendaciones generales sugeridas actualmente para el manejo de las NVPO son 17 , 18 :
-
Estratificación del riesgo de sufrir NVPO.
-
Reducción de los factores de riesgo basal de NVPO.
-
Realizar profilaxis sólo en pacientes de alto riesgo para NVPO y considerarla en pacientes de moderado riesgo.
-
Terapia de rescate en aquellos pacientes en que la profilaxis no ha sido efectiva, así como en aquellos pacientes con NVPO que no recibieron profilaxis.
-
Estratificación del riesgo de NVPO
Consiste en valorar la probabilidad de que un determinado paciente, sometido a una determinada intervención quirúrgica, presente NVPO. Varios modelos han sido desarrollados para evaluar el riesgo de NVPO. Dentro de éstos, destaca el score simplificado de Apfel y colaboradores 2 (Figura 1). Este modelo se validó en un grupo de pacientes sometidos a una gran variedad de cirugías, todos ellos bajo anestesia balanceada inhalatoria, identificándose cuatro factores predictores independientes: sexo femenino, no fumadores, historia de NVPO y uso de opioides postoperatorios. Según este modelo, el riesgo basal se estima en un 10%, la presencia de un factor de riesgo se correlaciona con un 20% de riesgo de NVPO, y cada factor de riesgo adicional incrementa este riesgo un 20%, resultando en un riesgo de un 80% cuando los cuatro factores están presentes. Posteriormente, el modelo de Apfel y colaboradores fue validado en pacientes hospitalizados, presentando un mayor poder de discriminación y capacidad predictiva que otros scores de riesgo más complejos 27 , 28 .
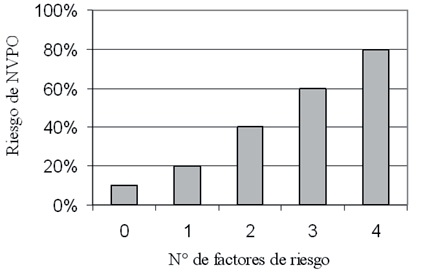
Figura 1 Score simplificado de Apfel et al, para predecir el riesgo de NVPO (2). Cuando 0, 1, 2, 3 ó 4 de los factores de riesgo independientes descritos están presentes, el riesgo de NVPO es aproximadamente de 10%, 20%, 40%, 60% ó 80%, respectivamente. Factores de Riesgo: sexo femenino; no fumador; historia de NVPO; uso de opioides en postoperatorio.
-
Reducción del riesgo basal de NVPO
Una forma de disminuir la incidencia de NVPO es reducir los factores de riesgo basales, siempre que sea factible clínicamente. Las principales estrategias para reducir el riesgo basal, respaldadas por ensayos controlados randomizados o revisiones sistemáticas, se exponen a continuación.
Como primer paso, se recomienda realizar anestesia regional en vez de anestesia general, siempre que sea posible. La incidencia de NVPO es menor tanto en niños como en adultos con anestesia regional, estimándose esta reducción en un 9% 16 , 29 . Cuando la anestesia general es necesaria, la recomendación es usar propofol para la inducción y mantención de la anestesia, idealmente sin halogenados ni óxido nitroso (anestesia total endovenosa, TIVA). Esta medida disminuye significativamente la incidencia de NVPO, especialmente dentro de las primeras 6 horas 22 , 30 ,31 . Debe minimizarse además el uso de opioides intra y postoperatorios 20 , 25 , de neostigmina y procurar una hidratación adecuada 32 ,33 . Una estrategia para restringir el uso de opioides es la aplicación de una analgesia multimodal 34 . Respecto a la neostigmina, si bien revisiones iniciales concluían que dosis altas (> 2,5 mg) incrementan el riesgo de NVPO 35 , un meta-análisis reciente no encontró evidencia de que el uso de neostigmina incrementara las NVPO 36 . Aunque 2 estudios iniciales observaron una disminución de la incidencia de NVPO con empleo de oxígeno suplementario en altas concentraciones (FiO2 = 80%) durante el intra y/o postoperatorio 37 , 38 , esto no ha sido confirmado en estudios posteriores 39 .
Otro elemento a considerar es evitar los movimientos súbitos o los cambios de posición durante el transporte de los pacientes, ya que pueden precipitar NVPO, en especial en pacientes que han recibido opioides 15 .
-
Profilaxis antiemética farmacológica
Múltiples fármacos se han utilizadazo para la prevención y tratamiento de las NVPO. Para valorar la eficacia de los distintos fármacos antieméticos, los metaanálisis emplean el concepto “number need to treat” (NNT) o “número que es necesario tratar”. Dicho de otra manera, el número de pacientes que debieran tratarse con un determinado antiemético para prevenir la aparición de un episodio emético, el cual hubiera ocurrido en caso de que no se administrara. En consecuencia, mientras mayor es el NNT, menor es la eficacia del fármaco. A continuación se describen los más utilizados.
-
Antagonistas del receptor 5-HT3 (ondansetron, dolasetron, granisetron y tropisetron)
Ejercen su acción antiemética a nivel de la ZQG y secundariamente a nivel de las aferencias vagales del tracto gastrointestinal 40 . Si bien los 4 antagonistas del receptor 5-HT3 del sistema serotoninérgico son considerados igual de efectivos y seguros en la profilaxis de las NVPO, el más estudiado y utilizado es el ondansetrón. La dosis profiláctica de ondansetrón recomendada es de 4 mg, administrado en forma endovenosa lenta. Al igual que el resto de los setrones, se recomienda administrarlo 30 minutos antes del final de la cirugía, ya que su efectividad es mayor 40 –44 . Su efecto antiemético es mayor que su efecto antinauseoso, con un NNT aproximado de 6 para la prevención de los vómitos y de 7 para la prevención de las náuseas, en las primeras 24 horas 40 . Las dosis recomendadas de dolasetron, granisetron y tropisetron son 12,5 mg 44 –46 , 0,35-1 mg 47 –49 y 2 mg 50 , respectivamente. Sus efectos secundarios más frecuentes son la cefalea, elevación de las enzimas hepáticas, constipación e hipotensión. Aunque raros, pueden ocurrir alteraciones electrocardiográficas (como prolongación del intervalo QT); este efecto es dosis dependiente y pudiera ser significativo en cierto grupo de pacientes 40 .
-
Dexametasona
Su mecanismo de acción no está claro, pero parece relacionarse con la inhibición de la síntesis de prostaglandinas y la estimulación en la producción de endorfinas, resultando en una mejoría en el estado de ánimo, sensación de bienestar y estimulación del apetito 51 . Una revisión sistemática cuantitativa demostró su eficacia antiemética en comparación con placebo, con un NNT en la prevención de náuseas y vómitos de alrededor de 4, dentro de las primeras 24 h del postoperatorio. Esta eficacia fue similar en niños y en adultos 51 . Dos meta-análisis sugieren que la profilaxis con dexametasona es particularmente efectiva en las mujeres con historia de vértigo 52 y en NVPO inducidos por opioides 53 . A diferencia de la mayoría de los antieméticos, su efectividad es mayor si se administra inmediatamente antes de la inducción anestésica, ya que el inicio de su acción antiemética es a las 2 horas, aproximadamente 54 . Sin embargo, se ha descrito la aparición de prurito perineal inmediatamente después de su administración i.v., por lo que algunos autores sugieren administrarla inmediatamente después de la inducción o bien administrarla lentamente (5 a 10 minutos), diluida en 50 ml de solución fisiológica 55 , 56 . Su vida media es de 36 a 72 horas y su acción clínica persiste por 24 horas. Aunque potencialmente los corticoides pueden presentar efectos adversos graves, no hay evidencia de que una dosis única de dexametasona incremente la incidencia de insuficiencia adrenal o infección del sitio quirúrgico 51 . Si bien los estudios iniciales se realizaron con 8 mg, estudios más recientes encontraron que dosis menores (2,5 y 5 mg) son igualmente efectivas 57 ,58 , siendo la dosis recomendada actualmente para la profilaxis de NVPO de 4 mg i.v. 59 .
-
Droperidol
Es un neuroléptico de la familia de las butirofenonas. Ejerce su acción antiemética bloqueando los receptores dopaminérgicos D2 en la ZQG y en el área postrema 60 . Fue considerado por más de 30 años el antiemético de primera línea 61 , hasta que en diciembre de 2001 la FDA emitió un “black box warning” 62 . Esta advertencia se basaba en reportes que relacionaban el uso de droperidol en dosis habituales con prolongación del QT, Torsade de Pointes y muerte súbita, aún en pacientes sin factores de riesgo conocido. Como consecuencia de esta advertencia, su utilización cayó drásticamente, siendo incluso prohibida en algunos países. Sin embargo, el droperidol había sido usado en forma segura por varias décadas, sin evidencias de toxicidad o inducción de arritmias 58 . Esto motivó múltiples estudios. Jackson et al, solicitaron un reporte a la FDA de todos los eventos adversos cardiovasculares relacionados al uso del droperidol y analizaron cada caso, concluyendo que la advertencia de la FDA se basaba en reportes anecdóticos, no encontrándose evidencia de una relación causa-efecto en los eventos adversos supuestamente relacionados al uso de droperidol 63 . Con anterioridad, un estudio multicéntrico, aleatorio y doble ciego había concluido que el droperidol en dosis de 1,25 mg pareciera ser más eficaz que una dosis de 4 mg de ondansetron sin diferencias en efectos adversos y a un costo mucho menor 64 . Por otra parte, al comparar el efecto del droperidol y de los antagonistas del receptor 5-HT3 sobre el intervalo QT, se vio que estos últimos se asocian a prolongación del QT con igual o mayor frecuencia que el droperidol 65 . Otro estudio aleatorio y doble ciego concluyó que dosis bajas de droperidol administrados por vía endovenosa durante anestesia general, no estaban asociadas con aumentos estadísticamente significativos del intervalo QT comparado con placebo 66 . No obstante lo anterior, se aconseja su uso con precaución en pacientes que presenten factores de riesgo para prolongación del intervalo QT, destacando entre estos la hipokalemia, la hipotermia, el bloqueo AV y la bradicardia, no olvidando tampoco la interacción con otros fármacos que prolongan el intervalo QT 65 . La dosis antiemética recomendada para asegurar una eficacia antiemética óptima es de 1,25 mg i.v., administrada al final de la cirugía 64 . Si bien su eficacia es similar al ondansetron, a la inversa de éste, es más efectivo en disminuir las náuseas que los vómitos, con un NNT de 5 y 7, respectivamente 67 . Aunque el droperidol puede causar sedación, este efecto es dosis dependiente y sólo es significativo a dosis > 2,5 mg; los síntomas extrapiramidales son raros 67 ,68 .
Una alternativa al droperidol es el haloperidol, también perteneciente a la familia de las butirofenonas. Un meta-análisis concluyó que una dosis única de 1-2 mg de haloperidol (i.m. o i.v.) posee una eficacia similar al droperidol. Estas dosis son mucho menores que las usadas para el manejo de la psicosis y la agitación y no producen sedación ni alteraciones electrocardiográficas 69 . Un reciente ensayo clínico randomizado, que incluyó 244 pacientes sometidos a distintos procedimientos quirúrgicos con anestesia general, no encontró diferencias estadísticamente significativas en la eficacia y efectos adversos de la profilaxis de NVPO entre haloperidol 1 mg y ondansetron 4 mg 70 .
-
Metoclopramida
Pertenece a la familia de las benzamidas. Ejerce su acción antiemética en 3 niveles: bloquea los receptores dopaminérgicos D2 centrales y periféricos; bloquea los receptores 5-HT3 serotoninérgicos centrales y periféricos y; bloquea los receptores 5-HT4 serotoninérgicos periféricos. Este último mecanismo explica su efecto prokinético 71 . Si bien ha sido ampliamente usado por décadas, ha caído en desuso por su débil efecto antiemético en las dosis utilizadas habitualmente. Una revisión sistemática, que incluyó 66 estudios, concluyó que la metoclopramida en las dosis usadas habitualmente (0,25 mg/kg en niños y 10 mg en adultos), carece de un efecto antiemético significativo, con un NNT = 9,1, comparable con placebo 71 . Si bien es factible que la metoclopramida aumente su efectividad al aumentar las dosis, puede asociarse igualmente a una mayor incidencia de síntomas extrapiramidales 6 .
-
Fenotiazinas (tietilperazina, prometazina, clorpromazina)
Aunque en algunos estudios han demostrado ser efectivas, no se recomiendan como terapia de primera línea, dado la escasa evidencia existente y la alta incidencia de efectos adversos extrapiramidales, en especial acatisia y distonía 72 . No obstante lo anterior, son particularmente efectivas en la profilaxis de NVPO en la cirugía de oído medio 73 y en la cirugía de reemplazo total de cadera o rodillas 74 , por lo que en estos subgrupos de pacientes podrían utilizarse con precaución.
-
Terapia combinada
Considerando la naturaleza multifactorial de las NVPO, con la participación de múltiples vías y receptores, parece lógico suponer que la administración combinada de fármacos antieméticos con distinto mecanismo de acción es más efectiva que la monoterapia para la profilaxis de NVPO. La mayor eficacia de la terapia combinada comparada con la monoterapia ha sido demostrada en ensayos clínicos y meta-análisis 59 , 75 –77 . Las terapias combinadas más estudiadas y validadas son droperidol más dexametasona, antagonista del receptor 5HT3 más dexametasona y antagonista del receptor 5HT3 más droperidol, no encontrándose diferencias significativas entre ellas al compararlas 59 , 78 .
-
¿Cuándo está indicada la profilaxis antiemética farmacológica?
En un ensayo clínico aleatorio multicéntrico, en el que se utilizaron distintas terapias antieméticas solas y combinadas, se observó que cada una por separado redujo el riesgo relativo de NVPO en un 26%, independiente de las otras intervenciones y del riesgo basal del paciente. Sin embargo, la reducción absoluta del riesgo que se consigue con la aplicación de una determinada terapia antiemética depende del riesgo basal de sufrir NVPO que presente el paciente. Por consiguiente, en pacientes con riesgo bajo para NVPO, la mínima reducción absoluta del riesgo que se conseguiría con la profilaxis antiemética no justificaría ni el costo ni la posibilidad de efectos adversos farmacológicos. La politerapia por su parte, sólo estaría indicada en pacientes con alto riesgo de NVPO, en quienes la reducción absoluta del riesgo sería significativa 59 . En vista de lo anterior, se recomienda 17 , 18 (Figura 2):
-
Realizar profilaxis farmacológica de las NVPO en pacientes con elevado riesgo de NVPO (3-4 puntos en la escala de Apfel), idealmente con terapia combinada.
-
Considerar profilaxis con monoterapia en pacientes de riesgo moderado (2 puntos de la escala de Apfel).
-
No realizarla en pacientes de bajo riesgo (0-1 punto de la escala de Apfel).
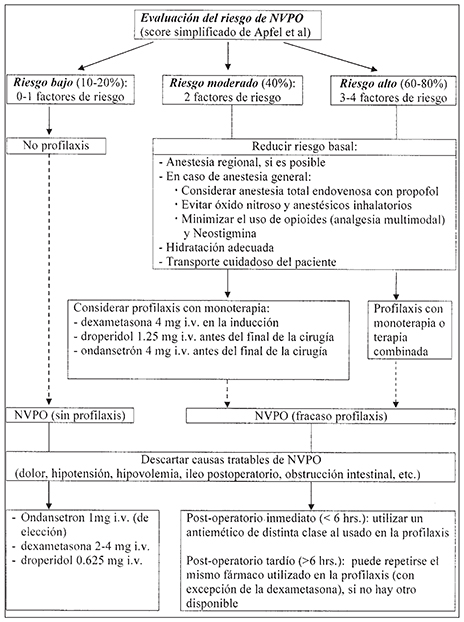
Figura 2 Recomendaciones para la profilaxis y tratamiento de NVPO. Adaptado de Bel IM, Gambús PC. Risk assessment, prophylaxis and treatment for postoperative nausea and vomiting. Rev Esp Anestesiol Reanim 2006; 53: 301-11.
-
Técnicas no farmacológicas
Lee y Done, realizaron una revisión sistemática para evaluar la efectividad de distintas técnicas no farmacológicas para prevenir las NVPO (acupuntura, electroacupuntura, estimulación eléctrica transcutánea del nervio, estimulación de puntos de acupuntura y acupresión). Concluyeron que estas técnicas tienen una eficacia similar a los fármacos antieméticos en la prevención de las NVPO precoces del adulto, no así en niños, en quienes no mostraron beneficios. El mecanismo por el cual la acupuntura previene las NVPO no ha sido establecido, aunque se cree que está mediado por la liberación de β-endorfinas en el líquido cerebroespinal (potenciando la acción antiemética del receptor μ) y la activación de fibras serotoninérgicas y noradrenérgicas. Estas técnicas tienen en común la estimulación del punto de acupuntura pericardio 6 (P6, Nei-Gun), localizado en la cara anterior de la muñeca (5 cm hacia proximal), entre los músculos flexores radiales de los carpos y los tendones del palmar largo 79 . Una nueva revisión, llevada a cabo por la Colaboración Cochrane, mostró que la estimulación de P6 puede reducir el riesgo de NVPO, con efectos secundarios mínimos. En comparación con la profilaxis con antieméticos, la estimulación de P6 parece reducir el riesgo de náuseas, pero no de vómitos 80 .
-
Terapia antiemética en caso de profilaxis fallida o no realización de profilaxis y aparición de NVPO
A diferencia de la profilaxis de NVPO, escasa información y evidencia existe sobre la eficacia de la terapia antiemética en pacientes con NVPO establecidos, siendo los fármacos más estudiados los antagonistas del receptor 5-HT3. Destacan dos revisiones sistemáticas cuantitativas, cuyas conclusiones son similares 81 , 82 :
-
Si bien los antagonistas del receptor 5-HT3 son relativamente efectivos para tratar los vómitos postoperatorios, son menos efectivos para tratar las náuseas postoperatorias (NNT para frenar los vómitos alrededor de 4).
-
No hubo evidencia de una respuesta dosis-dependiente clínicamente relevante para los setrones; en el caso del ondansetron, no hubo diferencia significativa entre 1,4 y 8 mg; por lo tanto, pueden ser necesarias dosis menores de ondansetron para tratar NVPO que para prevenirlas (más costo efectiva y menos efectos adversos, para una eficacia similar).
-
A pesar del extendido uso de los antieméticos tradicionales (droperidol, metoclopramida, prometazina), existe escasa evidencia que sustente su eficacia terapéutica.
Las recomendaciones actuales para el tratamiento de NVPO establecidos van a depender de si el paciente recibió o no profilaxis (Figura 2).
Si un paciente no ha recibido profilaxis, se recomienda como terapia de primera línea una dosis baja de un antagonista del receptor 5-HT3 (ondansetron 1 mg, granisetron 0,1 mg o tropisetron 0,5 mg i.v.). Una alternativa, en pacientes que presentan NVPO inducidos por opioides, es la adición de 2,5 mg de droperidol a 100 mg de morfina administrados por analgesia controlada por el paciente 83 .
En el caso de que el paciente haya recibido profilaxis y ésta haya fallado, se recomienda utilizar un fármaco de distinta clase al utilizado como profiláctico, si las NVPO ocurren en el postoperatorio inmediato (primeras 6 horas). Si han trascurrido más de 6 horas, y no hay otra alternativa disponible para terapia de rescate, puede repetirse el mismo fármaco usado en la profilaxis. Esta recomendación se basa en un ensayo clínico aleatorio que mostró que en aquellos pacientes en que no fue exitosa la profilaxis con ondansetron 4 mg i.v., una dosis repetida de ondansetron no parece ofrecer control adicional de las NVPO 84 . En el caso de la dexametasona, considerando su larga vida media, no se recomienda repetir hasta pasado 24 horas.
Finalmente, no olvidar descartar causas tratables de NVPO, como dolor, hipotensión arterial, hipovolemia, disminución postoperatoria de la motilidad gastrointestinal y complicaciones quirúrgicas.
Conclusión
El riesgo de NVPO debe ser estratificado, lo que permitirá el uso racional de la profilaxis farmacológica. Se recomienda no realizar profilaxis a pacientes con riesgo bajo de NVPO, considerarla en pacientes de riesgo moderado y realizar profilaxis en aquellos con riesgo elevado. Junto a lo anterior, debemos considerar distintas estrategias destinadas a disminuir el riesgo basal de NVPO. Los fármacos más utilizados en la profilaxis de las NVPO son los setrones, el droperidol y la dexametasona, los que podemos usar solos o combinados. Si bien los tres poseen una eficacia y seguridad similar, los dos últimos son de elección por su menor costo. La terapia combinada está indicada en pacientes de alto riesgo. Si la profilaxis ha fallado, se recomienda utilizar un antiemético de distinta clase. En el caso de presentarse NVPO en pacientes que no recibieron profilaxis, se recomienda como terapia de primera línea una dosis baja de un antagonista del receptor 5-HT3.
Bibliografía
-
Watcha MF, White PF. Postoperative nausea and vomiting: its etiology, treatment and prevention. Anesthesiology 1992; 77: 162-84.
-
Apfel CC, Laara E, Koivuranta M, et al. A simplified risk score for predicting postoperative nausea and vomiting. Anesthesiology 1999; 91: 693-700.
-
Apfel CC, Roewer N, Kortila K. How to study postoperative nausea and vomiting. Acta Anaesthesiol Scand 2002; 46: 921-8.
-
Kovac AL. Prevention and treatment of postoperative nausea and vomiting. Drugs 2000; 59: 213-43.
-
Ho KY, Chiu JW. Multimodal Antiemetic Therapy and Emetic Risk Profiling. Ann Acad Med Singapore 2005; 34: 195-205.
-
Bel IM, Gambús PC. Risk assessment, prophylaxis and treatment for postoperative nausea and vomiting. Rev Esp Anestesiol Reanim 2006; 53: 301-11.
-
Golembiewski J, Chernin E, Chopra T. Prevention and treatment of postoperative nausea and vomiting. Am J Health-Syst Pharm 2005; 62: 1247-60.
-
Gan TJ. Risk Factors for post-oerative nausea and vomiting. Anesth Analg 2006; 102: 1884-98.
-
Koivuranta M, Laara E, Snare L, et al. A survey of postoperative nausea and vomiting. Anaesthesia 1997; 52: 443-9.
-
Apfel CC, Roewer N. Risk Assessment of postoperative nausea and vomiting. Int Anaesthesiol Clin 2003; 41: 13-32.
-
Apfel CC, Stoecklein K, Lipfert P. PONV: A problem of inhalational anaesthesia? Best Pract Res Clin Anaesthesiol 2005; 19: 485-500.
-
Spiller RC. ABC of the upper gas-trointestinal tract: Anorexia, nausea, vomiting, and pain. BMJ 2001; 323: 1354-7
-
Bytzer P, Talley NJ, Leemon M, et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: a population-based survey of 15,000 adults. Arch Intern Med 2001; 161: 1989-96.
-
Chandana SR, Movva S, Arora M, et al. Primary brain tumors in adults. Am Fam Physician 2008; 77: 1423-30.
-
Rincón D, Valero J. Prevención de la náusea y el vómito postoperatorios. Rev Col Anest 2007; 35: 293-300.
-
Sinclair DR, Chung F, Mezei G. Can postoperative nausea and vomiting be predicted? Anesthesiology 1999; 91: 109-18.
-
Habib AS, Gan TJ. Evidence-based management of postoperative nausea and vomiting: a review. Can J Anesth 2004; 51: 326-41.
-
Gan TJ, Meyer T, Apfel CC, et al. Consensus Guidelines for Managing Postoperative Nausea and Vomiting. Anesth Analg 2003; 97: 62-71.
-
Sneyd JR, Carr A, Byrom WD, et al. A meta-analysis of nausea and vomiting following maintance of anaesthesia with propofol or inhalational agents. Eur J Anaesthesiol 1998; 15: 433-45.
-
Apfel CC, Kranke P, Katz MH, et al. Volatile anaesthetics may be the main cause of early but not delayed postoperative vomiting: a randomized controlled trial of factorial design. Br J Anaesth 2002; 88: 659-68.
-
Divatia JV, Vaidya, Badwe RA, et al. Omission of nitrous oxide during anesthesia reduces the incidence of postoperative nausea and vomiting. A meta-analysis. Anesthesiology 1996; 85: 1055-62.
-
Tramer MR, Moore A, McQuay H. Meta-analytic comparison of prophylactic antiemetic efficacy for postoperative nausea and vomiting: propofol anaesthesia vs omitting nitrous oxide vs total i.v. anaesthesia with propofol. Br J Anaesth 1997; 78: 256-9.
-
Bailey PL, Egan TD, Stanley TH. Intravenous opioid anesthetics. In: Miller RD, ed Anesthesia. 5th ed. Philadelphia: Churchill Livingstone; 2000: 273-376.
-
Watcha MF, White PF. Postope-rative nausea and vomiting. Anes-thesiology 1992; 77: 162-84.
-
Roberts GW, Bekker TB, Carlsen HH, et al. Postoperative nausea and vomiting are strongly influenced by postoperative opioid use in a dose-related manner. Anesth Analg 2005; 101: 1343-48.
-
Langevin S, Lessard MR, Trepanier CA, et al. Alfentanil causes less postoperative nausea and vomiting than equipotent doses of fentanyl or sufentanyl in outpatients. Anesthe-siology 1999; 91: 1666-73.
-
Apfel CC, Kranke P, Eberhart LH, et al. Comparison of predictive models for postopeative nausea and vomiting. Br J Anaesth 2002; 88: 234-40.
-
Pierre S, Benais H, Pouymayou J. Apfel’s simplified score may favourably predict the risk of postoperative nausea and vomiting. Can J Anaesth 2002; 49: 237-42.
-
Khalil SN, Farag A, Hann a E, et al. Regional analgesia combined with avoidance of narcotic may reduce the incidence of postoperative vomiting in children. Middle East J Anesthesiol 2005; 18: 123-32.
-
Visser K, Hassink EA, Bonsel GJ, et al. Randomized controlled trial of total intravenous anesthesia with propofol versus inhalational anesthesia with isoflurane-nitritus oxide: postoperative nausea and vomiting and economic analysis. Anesthesiology 2001; 95: 616-26.
-
Tramer M, Moore A, McQuay H. Propofol anaesthesia and postoperative nausea and vomiting: Quantitative systematic review of randomized controlled studies. Br J Anaesth 1997; 78: 247-55.
-
Scuderi PE, James RL, Harris L, et al. Multimodal antiemetic management prevents early postoperative vomiting after outpatient laparoscopy. Anesth Analg 2000; 91: 1408-14.
-
Yogendran S, Asokumar B, Cheng DC, et al. A prospective randomized double-blinded study of the effect of intravenous fluid therapy on adverse outcomes on outpatient surgery. Anesth Analg 1995; 80: 682-86.
-
Kehlet H, Dahl JB. The value of “multimodal” or “balanced analgesia” in postoperative pain treatment. Anesth Analg 1993; 77: 1048-56.
-
Tramer MR, Fuchs-Buder T. Omitting antagonism of neuromuscular block: effect on posoperative nausea and vomiting and risk of residual paralysis. A systematic review. Br J Anaesth 1999; 82: 379-86.
-
Cheng CR, Sessler DI, Apfel CC. Does Neostigmine administration produce a clinically important increase in postoperative nausea and vomiting? Anesth Analg 2005; 101: 1349-55.
-
Goll V, Akca O, Greif R, et al. Ondansetron is no more effective than supplemental intraoperative oxygen for prevention of postoperative nausea and vomiting. Anesth Analg 2001; 92: 112-7.
-
Greif R, Laciny S, Rapf B, et al. Supplemental oxygen reduces the incidence of postoperative nausea and vomiting. Anesthesiology 1999; 91: 1246-52.
-
Orhan-Sungur M, Kranke P, Sessler D, Apfel CC. Does supplemental oxygen reduce postoperative nausea and vomiting? A meta-analysis of randomized controlled trials. Anesth Analg 2008; 106: 1733-8.
-
Tramer M, Reynolds DJ, Moore RA, et al. Efficacy, dose-response, and safety of ondansetron in prevention of postoperative nausea and vomiting: a cuantitative systematic review of randomized placebo-controlled trials. Anesthesiology 1997; 87:1277-89.
-
Sun R, Klein KW, White PF. The effect of timing ondansetron administration in outpatients undergoing otolaryngologic surgery. Anesth Analg 1997; 84: 331-6.
-
Tang J, Wang B, White PF, et al. The effect of timing of ondansetron administration on its efficacy, cost-effectiveness, and cost-benefit as a prophylactic antiemetic in the ambulatory setting. Anesth Analg 1998; 86: 274-82.
-
D’Angelo R, Philip B, Gan TJ, et al. A randomized, double-blind, close-ranging, pilot study of intravenous granisetron in the prevention of postoperative nausea and vomiting in patients abdominal hysterectomy. Eur J Anaesthesiol 2005; 22: 774-9.
-
Graczyk SG, McKenzie R, Kallar S, et al. Intravenous dolasetron for the prevention of postoperative nausea and vomiting after outpatient laparoscopic gynecologic surgery. Anesth Analg 1997; 84: 325-330.
-
Zarate E, Watcha MF, White PF, et al. A comparison of the costs and efficacy of ondansetron versus dolasetron for antiemetic prophylaxis. Anesth Analg 2000; 90: 1352-8.
-
Walker JB. Efficacy of single-dose intravenous dolasetron versus ondansetron in the prevention of postoperative nausea and vomiting. Clin Ther 2001; 23: 932-8.
-
Mikawa K, Takao Y, Nishina K, et al. Optimal dosis of granisetron for profilaxis against postoperative emesis after gynecological surgery. Anesth Analg 1997; 85: 652-6.
-
Wilson AJ, Diemunsch P, Lindeque BG, et al. Single-dose i.v. granisetron in the prevention of postoperative nausea and vomiting. Br J Anaesth 1996; 76: 515-8.
-
Kranke P, Apfel CC, Eberhart LH, et al. The influence of a dominating centre on a quantitative systematic review of granisetron for preventing postoperative nausea and vomiting. Acta Anaesthesiol Scand 2001; 45: 659-70.
-
Kranke P, Eberhart LH, Apfel CC, et al. Tropisetron for prevention of postoperative nausea and vomiting: a quantitative systematic review. Anaesthesist 2002; 51: 805-14.
-
Henzi I, Walder B, Tramer MR. Dexamethasone for the prevention of postoperative nausea and vomiting: a quantitative systematic review. Anesth Analg 2000; 90: 186-94.
-
Lee L, Lai HY, Lin PC, et al. Dexamethasone prevents postoperative nausea and vomiting more effectively in women with motion sickness. Can J Anaesth 2003; 50: 232-7.
-
Hirayama T, Ishii F, Yago K, et al. Evaluation of the effective drugs for the prevention of nausea and vomiting induce by morphine used for postoperative pain: a quantitative systematic review. Yakugaku Zasshi 2001; 121: 179-85.
-
Wang JJ, Ho ST, Tseng JI, et al. The effect of timing of dexamethasone administration on its efficacy as a prophylactic antiemetic for postoperative nausea and vomiting. Anesth Analg 2000; 91: 136-9.
-
Perron G, Dolbec P, Germain J, et al. Perineal pruritus after iv dexamethasone administration. Can J Anesth 2003; 50: 749-50.
-
Crandell JT. Perineal pruritus after the administration of iv dexamethasone. Can J Anesth 2004; 51: 398-9.
-
Kiu K, Hsu CC, Chia YY. The effective dose of dexamethasone for antiemesis after major gyneco-logical surgery. Anesth Analg 1999; 89: 1316-8.
-
Ho ST, Wang JJ, Tzeng JI, et al. Dexamethasone for preventing nausea and vomiting associated with epidural morphine: a dose-ranging study. Anesth Analg 2001; 92: 745-8.
-
Apfe l CC, Korttila K, Abdalla M, et al. A factorial trial of six interventions for the prevention of postoperative nausea and vomiting. N Engl Med 2004; 350: 2441-51.
-
Golembiewski J, Chernin E, Chopra T. Prevention and treatment of postoperative nausea and vomiting. Am J Health-Syst Pharm 2005; 62: 1247-60.
-
Nuttall G, Eckerman K, Jacob K, et al. Does Low-dose Droperidol Administration Increase the Risk of Drug-induced QT Prolongation and Torsade de Pointes in the General Surgical Population? Anes-thesiology 2007; 107: 531-6.
-
Habib AS, Gan TJ. Food and Drug Administration black box warning on the perioperative use of droperidol: a review of the cases. Anesth Analg 2003; 96: 1377-9.
-
Jackson CW, Sheehan AH, Reddan JG. Evidence-based review of the black-box warning for droperidol. Am J Health Syst Pharm 2007; 64: 1174-86.
-
Hill RP, Lubarsky DA, Phillips-Bute B, et al. Cost-effectiveness of prophylactic antiemetic therapy with ondansetron, droperidol, or placebo. Anesthesiology 2000; 92: 958-67.
-
Charbit B, Albaladejo P, Funck-Brentano C, et al. Prolongation of QTc interval after postoperative nausea and vomiting treatment by droperidol or ondansetron. Anesthesiology 2005; 102: 1094-100.
-
White PF, Song D, Abrao J, et al. Effect of Low-dose Droperidol on the QT Interval during and after General Anesthesia. A Placebo-controlled Study Anesthesiology 2005; 102: 1101-5.
-
Henzi I, Sonderegger J, Tramer MR. Efficacy, dose-response, and adverse effects of droperidol for prevention of postoperative nausea and vomiting. Can J Anesth 2000; 47: 537-51.
-
Fortney JT, Gan TJ, Graczyk S, et al. A comparison of the effcacy, safety, and patient satisfaction of ondansetron versus droperidol as antiemetics for elective outpatient surgical procedures. Anesth Analg 1998; 86: 731-8.
-
Büttner M, Walder B, von Elm E, et al. Is low-dose haloperidol a useful antiemetic? A meta-analisis of published and unpublished randomized trials. Anesthesiology 2004; 101: 1454-63.
-
Rosow CE, Haspel KL, Smith SE, et al. Haloperidol versus ondansetron for prophylaxis of postoperative nausea and vomiting. Anesth Analg 2008; 106: 1407-9.
-
Henzi I, Walder B, Tramer MR. Metoclopramide in the prevention of postoperative nausea and vomiting: a quantitative systematic review of randomized, placebo-controlled studies. Br Journal Anaesth 1999; 83: 761-71.
-
Olsen JC, Keng JA, Clark JA. Frequency of adverse reactions to prochlorperazine in the ED. Am J Emerg Med 2000; 18: 609-11.
-
Khalil S, Philbrook L, Rabb M, et al. Ondansetron/promethazine combination or promethazine alone reduces nausea and vomiting after middle ear surgery. J Clinic Anesth 1999; 11: 596-600.
-
Chen JJ, Frame DG, White TJ. Efficacy of ondansetron and pro-chlorperazine for the prevention of postoperative nausea and vomiting after total hip replacement or total knee replacement procedures: a randomized, double-blind, comparative trial. Arch Intern Med 1998; 158: 2124-8.
-
Habib AS, Gan TJ. Combination therapy for postoperative nausea and vomiting, a more effective prophylaxis? Ambul Surg 2001; 9: 59-71.
-
Eberhart LH, Morin AM, Bothner U, et al. Droperidol and 5-HT3-receptor antagonists, alone or in combination, for prophylaxis of postoperative nausea and vomiting. A meta-analysis of randomized controlled trials. Acta Anaesthesiol Scand 2000; 44: 1252-7.
-
López-Olaondo L, Carrascosa F, Pueyo FJ, et al. Combination of ondansetron and dexamethasone in the prophylaxis of postoperative nausea and vomiting. Br J Anaesth 1996; 76: 835-40.
-
Habib AS, El-Moalem HE, Gan TJ. The efficacy of the 5-HT3-receptor antagonists combined with droperidol for NVPO prophylaxis is similar to their combination with dexamethasone. A meta-analysis of randomized controlled trials. Can J Anaesth 2004; 51: 311-9.
-
Lee A, Done ML. The use of nonpharmacologic techniques to prevent postoperative nausea and vomiting: a meta-analysis. Anesth Analg 1999; 88: 1362-69.
-
Lee A, Done ML. Stimulation of the wrist acupuncture point P6 for preventing postoperative nausea and vomiting. Cochrane Database of Systematic Reviews 2004, Issue 3. Art. N°: CD003281.
-
Kazemi-Kjellberg F, Henzi I, Tramer MR. Treatment of established postoperative nausea and vomiting: a quuantitative systematic review. BMC Anesthesiol 2001; 1: 2.
-
Tramer MR, Moore RA, Reynolds DJ, et al. A quantitative systematic review of ondansetron in treatment of established postoperative nausea and vomiting. BMJ 1997; 314: 1088-92.
-
Culebras X, Corpataux JB, Gaggero G, Tramèr MR. The antiemetic efficacy of droperidol added to morphine patient-controlled analgesia: a randomized, controlled multicenter dose-finding study. Anesth Analg 2003; 97: 816-21.
-
Kovac AL, O’Connor TA, Pearman MH, et al. Efficacy of repeat intravenous dosing of ondansetron in controlling postoperative nausea and vomiting: a randomized, double-blind, placebo-controlled multicenter trial. J Clin Anesth 1999; 11: 453-9.


 Creative Commons Attribution
Creative Commons Attribution