Sandra Benavides O.*, Magdalena Cruz O.** y Cristián Muñiz H.***
Rev Chil Anest Vol. 41 Número 1 pp. 57-79|doi:
PDF|ePub|RIS
Las guías de soporte vital avanzado pediátrico se basan en dos principios:
-
La incidencia de enfermedades graves y de paro cardiorrespiratorio (PCR) en el niño es mucho menos frecuente que en el adulto.
-
Las primeras maniobras de reanimación en el niño son efectuadas por personal no especialista en pediatría y con experiencia limitada en emergencias.
Por estas razones es que las guías incluyen la mejor evidencia científica disponible escrita en un lenguaje simple y dejan espacio para las modificaciones impuestas por la infraestructura local.
En forma didáctica se ha dividido el texto en reanimación cardiopulmonar (RCP) pediátrica (con excepción del recién nacido), y reanimación cardiopulmonar neonatal.
Reanimación cardiopulmonar pediátrica (con excepción del recién nacido)
El European Resuscitation Council (ERC) ha publicado guías para el soporte vital avanzado en 1994, 1998, 2000 y 2005. Las últimas dos se basan en el Internacional Consensus on Science publicado por la International Liaison Committee on Resuscitation (ILCoR). Este proceso fue repetido en 2009/2010 y el resultante Consensus on Science with Treatment Recommendations (CoSTR) fue publicado simultáneamente en las revistas Resuscitation, Circulation y Pediatrics.
Los cambios más importantes desde la publicación de ILCoR (Internacional Consensus on CPR and ECC Science with Treatment Recommendations) entre 2005 y 2010 se resumen en la siguiente lista 1 :
-
El mal resultado de la palpación del pulso como método diagnóstico de PCR en niños.
-
Rol relevante de la ventilación en la RCP infantil.
-
El masaje cardiaco externo eficiente es aquel que comprime el tórax en al menos un tercio de su diámetro anteroposterior: aproximadamente 4 cm en los lactantes y 5 cm en los niños.
-
La energía inicial necesaria para la desfibrilación en el caso de FV o TV sin pulsos es 2-4 J·Kg-1. Energías mayores, especialmente con un desfibrilador bifásico, también podrían ser seguras y efectivas.
-
Uso de tubos endotraqueales con cuff.
-
La presión cricoídea durante la intubación de emergencia no ha demostrado ser segura o efectiva.
-
Se recomienda el uso de capnografía para confirmar la posición correcta del tubo traqueal y la efectividad del masaje cardiaco mediante la medición del ETCO2.
-
La restricción al uso de concentraciones altas de oxígeno durante la reanimación. La FiO2 debe titularse, especialmente luego de la recuperación de la circulación espontánea.
-
La organización de equipos de emergencia médica (METs) y de equipos de respuesta rápida (RRTs) han logrado disminuir la incidencia y la mortalidad del PCR intrahospitalario.
-
Nuevos tópicos: incluyen el PCR en la enfermedad de canales iónicos y otras situaciones especiales, como el trauma, ventrículo único, la circulación posterior a un Fontan y la hipertensión pulmonar. Idealmente, en todo caso de un PCR inesperado debe tratar de hacerse una autopsia, especialmente dirigida a buscar condiciones que predispongan a arritmias fatales. Debe considerarse la conservación adecuada de tejido para análisis genéticos posteriores.
-
Terminología
El término recién nacido se refiere a los neonatos inmediatamente después de nacidos. El PCR de este grupo tiene una fisiopatología diferente al resto de la población pediátrica y por lo tanto un algoritmo de reanimación adaptado a estas diferencias.
El neonato es el niño de hasta 4 semanas de edad. El lactante es el menor de 1 año y el niño es el paciente mayor de 1 año hasta la pubertad.
-
Epidemiología
La verdadera incidencia del paro cardiorrespiratorio es difícil de estimar debido a la confusión en la terminología usada en la literatura y la dificultad en determinar la presencia o ausencia de pulso palpable.
El PCR intrahospitalario se ha reportado hasta en un 3% de los niños hospitalizados, en un 1,8% de todos los niños ingresados a unidades de tratamiento intensivo en USA y en un 4% de los ingresados a unidades de tratamiento intensivo cardiovascular.
La sobrevida a un año es 10-44% superior al outcome del PCR extrahospitalario y bastante mejor que las estadísticas de los adultos. El 65% de los niños reanimados tiene un desempeño neurológico bastante aceptable definido con la Pediatric Cerebral Perfomance Category.
El outcome del PCR extrahospitalario en el niño es mucho peor que el PCR intrahospitalario, especialmente el outcome neurológico. En el caso del PCR extrahospitalario la sobrevida no ha variado significativamente en los últimos 20 años y se mantiene en un 6% (3% para los lactantes, 9% para los adolescentes).
Especialmente son dos los contextos que se relacionan con el peor outcome en el PCR extrahospitalario: trauma y el síndrome de muerte súbita. En el caso del trauma es típicamente por exanguinación, terminando en un profundo shock circulatorio donde el masaje cardiaco externo en un corazón vacío no es capaz de dar perfusión adecuada ni a las coronarias ni al cerebro. En el caso de los pacientes con síndrome de muerte súbita suelen tener tiempos prolongados de paro antes de ser reanimados. De las series de PCR extrahospitalario, entre un tercio y la mitad de los niños corresponden a muerte súbita. Es así que el outcome del PCR extrahospitalario del niño suele ser tan malo como el extrahospitalario no FV del adulto.
La incidencia de PCR durante la anestesia es mayor en niños que en adultos. En el registro POCA (Pediatric Perioperative Cardiac Arrest), los niños menores de 1 mes son los de mayor riesgo, atribuyéndose el 24% de todos los PCR ocurridos y con un 72% de mortalidad. Otro factor involucrado en la mayor incidencia de PCR es el tipo de cirugía, donde la cirugía cardiaca, vascular e intraabdominal son las de mayor riesgo, especialmente en los recién nacidos.
-
Pronóstico
No existen predictores fiables de éxito o sobrevida en niños con PCR (nivel de evidencia 1, 2, 3 y 4) 2 –5 . Es difícil establecer la predicción de la sobrevida y el outcome a largo plazo luego de un paro cardiorrespiratorio en un niño. No es posible identificar un solo marcador de outcome, pero la combinación de historia del evento, el progreso de la RCP y la respuesta al tratamiento, junto con otros marcadores tales como el cambio de ritmo y el nivel de ETCO2 apoyan la toma de decisiones sobre una base más informada que intuitiva.
La información sobre predictores del outcome neurológico es limitada, especialmente en pediatría. La predicción del desempeño neurosicológico es compleja en cualquier niño, especialmente los más pequeños. También es difícil establecer cuál era el potencial de desarrollo neurológico considerando que además muchos de los pacientes que sufren un PCR tenían cierto grado de problemas neurológicos previos. En el estudio del National Registry of Cardiopulmonary Resuscitation Investigators (NRCPR) un 17% de los niños que sufrieron PCR intrahospitalario eran neurológicamente anormales antes.
Hay poca información sobre el valor predictivo del examen neurológico clínico, de los estudios diagnósticos neurofisiológicos (EEG, potenciales evocados somatosensoriales), biomarcadores y de las imágenes (TAC, RNM o PET) en la evaluación de outcome neurológico luego de un PCR u otro daño hipóxico-isquémico global en el niño. El scanner no es sensible en la detección de lesiones neurológicas agudas. El valor de la RNM todavía no está claro. La RNM con difusión podría entregar información de valor en relación a las lesiones isquémicas en la fase subaguda y de recuperación.
Dos estudios norteamericanos entregan información de valor: el Resuscitation Outcomes Consortium y el NRCPR. El primero recoge datos de los PCR extrahospitalarios y demuestra que afortunadamente el PCR extrahospitalario en niños es un evento poco frecuente, con una estadística similar a la del adulto y con un outcome malo, influenciado porque la mayoría corresponde a síndromes de muerte súbita; la sobrevida general es de 6,4%, pero en el grupo de los lactantes es de sólo 3,3% y los niños mayores de 1 año y los adolescentes tienen tasas de sobrevida más altas (9,1% y 8,9% respectivamente). El segundo estudio, examinó la información de 253 PCR intrahospitalarios, concluyendo que en esta población el outcome es mejor que el del adulto y que la reanimación va seguida de una mejor sobrevida: 27% comparada con 18% del adulto. Aunque frecuentemente se asume que los niños que han sufrido un PCR tienen que haber sufrido un daño neurológico, este estudio muestra que el 65% de los sobrevivientes tienen un buen outcome neurológico.
La sobrevida luego de un PCR en pabellón, relacionado a la cirugía o la anestesia, tiene mejor pronóstico aún. En un estudio multicéntrico que reúne datos de 79 hospitales norteamericanos y que incluye 193 paros cardiorrespiratorios relacionados a la anestesia en un período de 6 años, hubo un 61% de recuperación absoluta sin daño, 5% tuvo una secuela temporal y sólo 5% tuvo consecuencias permanentes.
Tanto para el PCR intra como extrahospitalario, la etiología es el primer punto relevante que permite establecer un pronóstico de outcome. Tanto en adultos como en niños, el paro cardiaco por una arritmia generalmente tiene mejor pronóstico que el secundario a hipoxia o isquemia. Hay una excepción que es un grupo pequeño de pacientes con hipoxia límite en quienes pequeños períodos de RCP bastan para reestablecer la circulación espontánea con un pronóstico bastante bueno. En condiciones particulares como es trauma, sepsis, pacientes oncológicos, desórdenes inmunológicos o metabólicos, la sobrevida es menor que en el grupo de las enfermedades cardiacas.
El ritmo inicial también es importante, siendo la FV, la TV sin pulso y la bradicardia severa de mejor pronóstico que la asistolía y la actividad eléctrica sin pulso. Cuando la FV es el ritmo inicial del PCR, la sobrevida es bastante buena (35% en el PCR intrahospitalario) mientras que la FV/TV que ocurre en el transcurso del PCR tiene peor pronóstico (11% de sobrevida). Esto se debe probablemente a que estos últimos son manifestación de toxicidad de las catecolaminas usadas durante la reanimación y de un desequilibrio metabólico severo.
La calidad de la reanimación cardiopulmonar es extremadamente importante. El PCR en presencia de un reanimador duplica las probabilidades de sobrevida. La mejoría de la calidad de la reanimación (especialmente evitar las pausas de las compresiones torácicas) ha sido, quizás, el responsable de la mejoría en la sobrevida vista en los últimos 20 años. Estudios en niños, luego de la incorporación de la ECLS (Extracorporeal Life Support) mientras se continúa con el masaje cardiaco, demuestran sobrevivencia con recuperación neurológica completa hasta después de 95 minutos de RCP.
La duración de la RCP también es un indicador pronóstico importante porque refleja la ausencia de respuesta cardiaca a las maniobras de reanimación. Varios estudios han reportado bajísimas tasas de sobrevida luego de 20-30 minutos de reanimación o 3 dosis de epinefrina. Algunas excepciones son el paro cardiaco en hipotermia, la toxicidad por anestésicos locales y la FV/TV continua, ya que ésta refleja que el corazón aún tiene algo de irrigación. También la administración de bicarbonato y calcio se ha asociado a peor outcome.
Aunque varios factores determinan el outcome luego del PCR y la RCP, no existen guías simples que determinen cuándo la reanimación es un ejercicio estéril.
Luego de 20 minutos de resucitación el equipo puede decidir si continuar o no. Dentro de las consideraciones relevantes de continuar o detenerse están la causa del PCR, la condición médica preexistente, la edad, el lugar donde ocurre el PCR, la presencia o ausencia de testigos, duración de la etapa de no flujo, número de dosis de adrenalina recibidas, el valor del ETCO2, la presencia de algún ritmo desfibrilable como ritmo primario o secundario, la instalación de ECLS en forma oportuna para resolver una causa reversible y circunstancias especiales, como la asfixia por inmersión y exposición a drogas tóxicas.
Luego de recuperada la circulación espontánea, las medidas estándar de función cardiovascular y neurológica tales como la escala de Glasgow > 7, ritmo sinusal normal, frecuencia cardiaca, presión arterial y débito urinario > 1 ml·kg-1·hora-1 son buenos predictores de sobrevida.
-
Diagnóstico
El paro cardiaco sin pulso se define típicamente como el cese de la actividad cardiaca mecánica, determinada por la ausencia de pulsos centrales palpables, ausencia de respuesta y apnea.
Aunque esta definición es muy simple, la separación entre shock hipóxico-isquémico severo y el paro cardiaco sin pulso no es sencilla. Esta diferencia puede ser aún más difícil en los lactantes por sus diferencias anatómicas y fisiológicas.
Los signos de PCR son:
-
Ausencia de respuesta al dolor (coma).
-
Apnea o gasping.
-
Ausencia de circulación.
-
Palidez o cianosis intensa.
Como la palpación del pulso es engañosa, la ausencia de pulso no es el único determinante de la necesidad de iniciar o no el masaje cardiaco externo. Si se sospecha el paro cardiorrespiratorio y existen los signos antes señalados, se deben iniciar las maniobras de reanimación a no ser que exista la certeza de que se palpa el pulso central: braquial o femoral en los lactantes, y carotídeo o femoral en los niños. Toda esa maniobra no debe tomar más de 10 segundos. Si existe alguna duda se debe comenzar con las maniobras de reanimación. Si existe un ecógrafo disponible y el personal preparado para interpretarlo, puede ser de ayuda para detectar actividad cardiaca y algunas causas tratables causantes del PCR siempre y cuando no interrumpa el masaje cardiaco externo.
-
Fisiopatología del PCR
A diferencia de los adultos, el PCR del niño no es de causa cardiaca. Frecuentemente es el resultado terminal de una falla respiratoria progresiva o shock circulatorio, lo que se denomina paro por asfixia. La asfixia comienza con un período variable de hipoxemia, hipercapnia y acidosis sistémica que progresa a la bradicardia y a la hipotensión y culmina con el PCR.
La fibrilación ventricular o la taquicardia ventricular sin pulso suelen ser el ritmo inicial del paro en el 5-15% de los paros cardiacos intra o extrahospitalarios. Incluso se ha reportado estos ritmos hasta en un 27% de los PCR intrahospitalarios en algún momento de la reanimación.
Existen al menos cuatro fases del PCR: 1) Pre paro; 2) Sin flujo; 3) Bajo flujo (RCP) y 4) Post resucitación.
En la fase pre paro las estrategias de prevención son las que tienen el mayor impacto. En el caso del PCR intrahospitalario son especialmente efectivas aquellas destinadas al reconocimiento y tratamiento precoz de la falla respiratoria y el shock. Este ha sido el foco principal de preocupación de los equipos de emergencia médica y de respuesta rápida.
La fase de no flujo es la del PCR no tratado. La estrategia es iniciar rápidamente las maniobras básicas de reanimación. El objetivo es optimizar la presión de perfusión coronaria y el flujo sanguíneo a órganos críticos durante la fase de bajo flujo. La RCP básica con masaje cardiaco externo continuo y efectivo es lo más relevante en esta etapa.
La fase post resucitación es un período de alto riesgo para el daño cerebral, las arritmias ventriculares y otros daños por reperfusión. Las células dañadas pueden hibernar, morir o recuperar completamente la función. La hipotermia sistémica durante la fase inmediata post resucitación podría minimizar este daño.
-
Ventilación
Durante la fase de no flujo y de bajo flujo del PCR, el gasto cardiaco y el flujo pulmonar son aproximadamente el 10-25% de lo que son durante el ritmo sinusal normal.
Durante la reanimación la ventilación adecuada y la oxigenación son la prioridad, pero se requiere mucho menos ventilación para producir el intercambio gaseoso adecuado.
En un paro en FV súbita como en el adulto, las concentraciones de O2 y CO2 aórticas no son significativamente diferentes a las de la fase pre paro, porque como no hay flujo aórtico el consumo de oxígeno es mínimo. Los pulmones funcionan como un reservorio de alto contenido de O2 y bajo CO2. Así, cuando se inicia el masaje cardiaco externo sin ventilación inicial, la sangre que fluye desde la aorta hacia las coronarias y la circulación cerebral entrega oxígeno suficiente a un pH aceptable, haciendo que la entrega de oxígeno miocárdico dependa más del flujo obtenido durante el masaje cardiaco externo efectuado que del contenido total de oxígeno. En síntesis, la pO2 y el pH arterial pueden ser aceptables sólo con el masaje cardiaco externo en la reanimación del paro en FV.
En el PCR por asfixia en cambio, durante la fase pre paro la sangre continúa fluyendo a los tejidos por lo que la saturación de oxígeno arterial y venosa disminuyen y el CO2 y el lactato aumentan progresivamente antes de terminar en el paro. Aún más, el flujo pulmonar continuo de esta fase sólo agota el reservorio pulmonar de oxígeno. Conociendo estas diferencias con el PCR en FV, el PCR por asfixia resulta en una hipoxemia y acidemia arterial significativa antes de la resucitación. En estas circunstancias, en el paciente pediátrico no parece prudente pasar por alto la ventilación.
-
Circulación
El masaje cardiaco externo depende de la elasticidad natural del tórax para generar un período transitorio de presión negativa intratorácica inmediatamente después del período de compresión máxima. Este período de presión negativa, o fase de relajación, mejora el retorno venoso hacia la aurícula derecha.
La gradiente de presión entre la aurícula derecha y la aorta es la presión de perfusión coronaria que se obtiene durante la reanimación. Esta gradiente se genera en la fase de relajación de las compresiones torácicas y se correlaciona en forma positiva con la recuperación de la circulación espontánea.
Lo básico es comprimir fuerte y rápido y evitar las interrupciones. Para permitir el buen retorno venoso es necesario que el masaje permita la recuperación elástica completa de la caja torácica y que se evite el aumento de la presión intratorácica por la hiperventilación.
-
Relación compresión/ventilación
La relación ideal es desconocida en los niños. Las sugerencias se basan en la tradición y en reglas fáciles de memorizar. Hay algunos hallazgos fisiológicos que sugieren que la cantidad de ventilación necesaria durante la RCP es mucho menos que la necesaria durante un ritmo con perfusión normal, ya que al gasto cardiaco durante el PCR es sólo 10-25% de lo normal. Los beneficios de la ventilación a presión positiva deben ser balanceados frente a las consecuencias adversas de la disminución de la circulación.
El valor óptimo de relación de compresiones y ventilaciones probablemente dependa de factores como la frecuencia de las compresiones, el volumen corriente, el flujo sanguíneo generado durante el masaje, el número de interrupciones de las compresiones torácicas, etc.
En un modelo de maniquí pediátrico una relación 15:2 entrega la misma ventilación minuto que una relación 5:1, pero el número de compresiones torácicas es 48% más rápido en el modelo de relación 15:2.
-
Reanimación cardiopulmonar avanzada
La secuencia de acciones enumeradas a continuación está descrita en el algoritmo de la Figura 1.
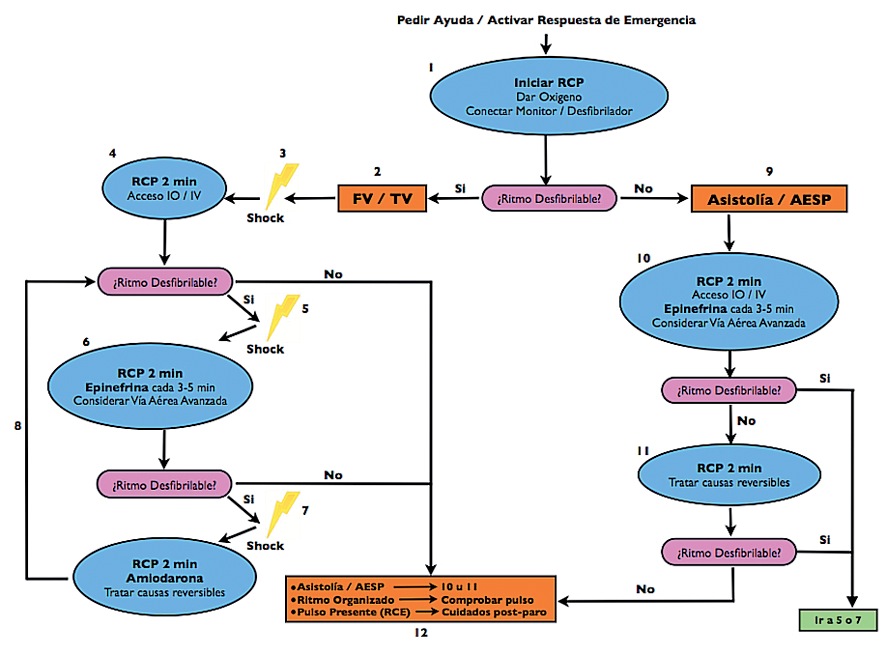
Figura 1 Paro Cardiorrespiratorio pediátrico, secuencia de acciones.
-
Comience y continúe con la reanimación básica. Oxigene y ventile.
-
Ventile a presión positiva con una concentración alta de oxígeno.
-
De 5 ventilaciones y luego siga con masaje cardiaco externo (MCE)/ventilación en una relación 15:2.
-
Instale monitor cardiaco.
-
Identifique un ritmo cardiaco (no desfibrilable o desfifrilable) y signos de vida (chequee el pulso central por no más de 10 segundos).
-
Ritmo no desfibrilable: asistolía, actividad eléctrica sin pulso, bradicardia < 60 sin signos de circulación
La mayoría de los PCR en niños y adolescentes en asistolía y actividad eléctrica sin pulso son de origen respiratorio, de manera que es mandatario comenzar con la RCP antes de pedir un desfibrilador. La actividad eléctrica sin pulso se caracteriza por una actividad eléctrica de complejo angosto usualmente de frecuencia lenta y con pulsos ausentes.
Las drogas indicadas son:
-
Adrenalina IV o IO (10 μ·kg-1) y repita cada 3-5 minutos.
-
Identifique y trate cualquier causa reversible.
La secuencia de acciones que deben llevarse a cabo en un niño con PCR con ritmo no desfibrilable se describe con detalles en el algoritmo de la Figura 2.
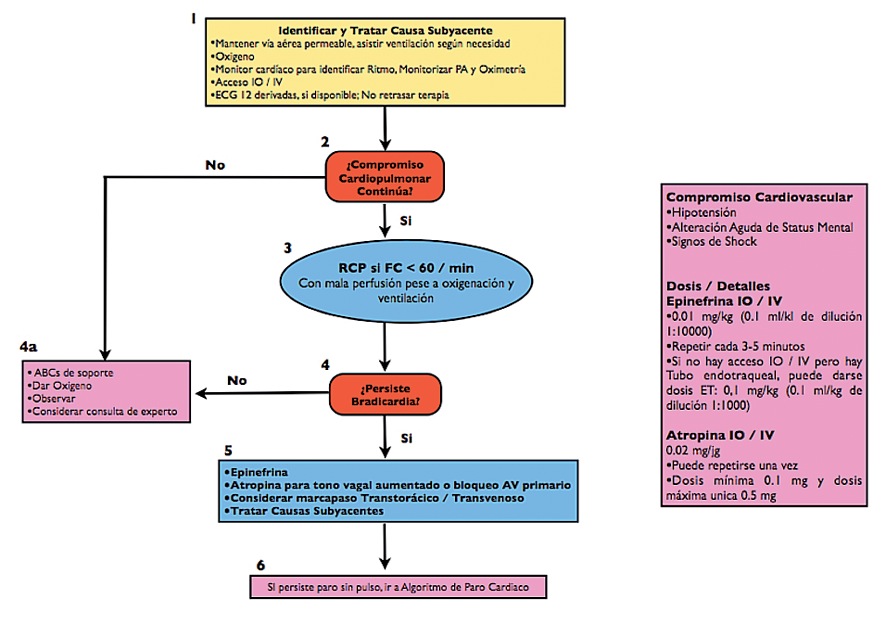
Figura 2 Algoritmo de manejo del PCR con ritmo no desfibrilable.
-
Ritmo desfibrilable: FV, TV sin pulso
La FV primaria ocurre sólo en el 3,8-19% de los PCR de los niños. La incidencia aumenta con la edad. El primer determinante de la sobrevida es la desfibrilación precoz. El éxito de la desfibrilación disminuye dramáticamente a medida que pasa el tiempo: por cada minuto que se posterga la desfibrilación (sin RCP), la sobrevida disminuye un 7-10%.
La FV secundaria aparece en algún momento de la reanimación del PCR intrahospitalario hasta un 27%. Es de peor pronóstico que la FV primaria.
La secuencia de acciones enumeradas a continuación está descrita en el algoritmo de la Figura 3.
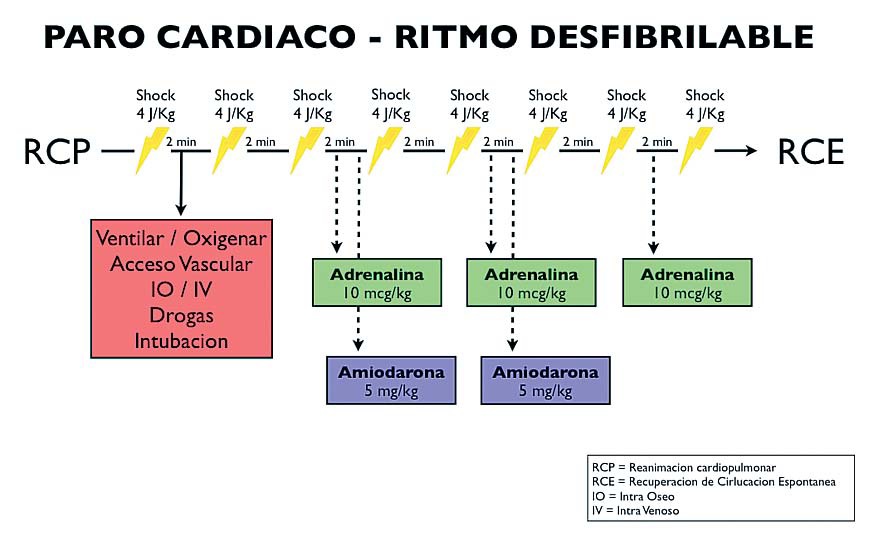
Figura 3 Algoritmo de manejo del PCR con ritmo desfibrilable.
-
Desfibrile inmediatamente con 4 J·Kg-1.
-
Cargue el desfibrilador mientras el otro reanimador continúa con el MCE.
-
Interrumpa el MCE por no más de 5-10 segundos para desfibrilar.
-
Descargue.
-
Reinicie la RCP lo antes posible sin chequear el ritmo.
-
Luego de 2 minutos de RCP post desfibrilación, chequee rápidamente el ritmo en el monitor.
-
Dé una segunda descarga de 4 J·Kg-1 si continúa en FV/TV sin pulso.
-
Continúe con RCP por 2 minutos más.
-
Chequee el ritmo brevemente; si continúa en FV/TV sin pulso, dé una tercera descarga de 4 J·Kg-1.
-
Administre adrenalina 10 μ/kg y amiodarona 5 mg·Kg-1 luego de la tercera descarga una vez que reinicie la RCP.
-
Continúe administrando adrenalina en alternancia con cada ciclo, o sea cada 3-5 minutos.
-
Administre una segunda dosis de amiodarona 5 mg·Kg-1 si continúa en FV/TV sin pulso luego de la quinta descarga.
Si el niño todavía permanece en FV/TV sin pulso, continúe alternando descargas de 4 J·Kg-1 con 2 minutos de RCP. Si aparecen signos de vida, confirme en el monitor la presencia de actividad eléctrica organizada. Si existe, confirme la presencia de pulso central y evalúe la hemodinamia (presión arterial, pulso periférico, llene capilar).
Identifique y trate cualquier causa reversible recordando que la hipoxia y la hipovolemia son las que tienen mayor prevalencia en el niño críticamente enfermo.
Si la desfibrilación fue exitosa pero la FV/TV sin pulso reaparece, reinicie la RCP, administre amiodarona y desfibrile nuevamente con 4 Kg-1. Continúe con una infusión continua de amiodarona.
-
Modificaciones desde el año 2005
-
Sistemas de Rescate
Los equipos de emergencia médica (METs) y los equipos de respuesta rápida (RRTs) han demostrado ser efectivos en prevenir el paro respiratorio y cardiaco en pacientes pediátricos hospitalizados (nivel de evidencia 3) 6 ,7 .
A su vez, la presencia de la familia durante la reanimación ha demostrado ser beneficiosa para el proceso de duelo y no ha demostrado ser dañina (nivel de evidencia 2 y 4) 8 –10 .
-
Evaluación
El equipo de consenso (task force) ha decidido quitarle importancia, pero no eliminar, la revisión del pulso como parte de la evaluación. El tiempo promedio para detectar un pulso presente es de aproximadamente 15 segundos, mientras que el tiempo promedio para confirmar la ausencia de pulso es de 30 segundos. En infantes y niños que no respondan o no respiren normalmente, los reanimadores deberán iniciar maniobras de RCP a menos que puedan palpar definitivamente un pulso en menos de 10 segundos (nivel de evidencia 3 y 5) 11 ,12 .
En relación al uso de ecocardiografía para detectar causas reversibles de PCR, el consenso es que pudiera ser útil ya que los hallazgos ecográficos tienen buena correlación con la presencia o ausencia de actividad cardiaca (nivel de evidencia 5) 13 –15 . Sin embargo, no existe suficiente información que avale su uso rutinario. Este debe ser considerado cuando se encuentre disponible el personal capacitado, sopesando los beneficios contra los efectos deletéreos de la interrupción de las compresiones de la RCP.
La medición de CO2 espirado como indicador de calidad de la reanimación se correlaciona fuertemente con intervenciones que aumentan el gasto cardiaco durante la resucitación en el shock y el paro cardiaco (nivel de evidencia 5) 16 –18 . La recomendación es que la medición de CO2 espirado sea utilizada de estar disponible, ya que puede ser beneficiosa en proveer información sobre la efectividad de las compresiones torácicas. Aun no se define un valor específico como objetivo ni un umbral claro para el cese o término de maniobras de resucitación, pero sería razonable mantener el ETCO2 consistentemente por sobre valores superiores de 15 mmHg. El ETCO2 debe ser interpretado con cautela en los 1-2 minutos posteriores a la administración de adrenalina u otras drogas vasoactivas, debido a que éstas pueden disminuirlo.
-
Vía aérea y Ventilación
No hay nuevos datos para cambiar las recomendaciones de ILCOR 2005 para niños que requieran control de la vía aérea y ventilación a presión positiva por periodos cortos en el prehospitalario.
a) Dispositivos de Vía Aérea: Ventilación con Ambu, LMA, elección del TOT con cuff, inducción de secuencia rápida.
b) Oxigenación: No hay estudios que comparen ventilación con diferentes concentraciones de oxígeno inspirado. El inicio de la resucitación con fracciones inspiradas de oxígeno de 100% versus 21% pareciera mejorar la sobrevida (nivel de evidencia 5) 19 ,20 . La ventilación con oxígeno al 100% durante e inmediatamente posterior a la resucitación contribuye a la injuria cerebral por reperfusión y radicales libres en el cerebro (nivel de evidencia 5) 21 –23 . No existe evidencia suficiente para recomendar alguna concentración inspirada de oxígeno específica durante la reanimación del paro en infantes o niños. Una vez restablecida la circulación espontánea, es razonable titular el oxígeno para evitar la hiperoxemia.
Inicie la reanimación con una concentración alta de O2 (100%) y una vez restablecida la circulación espontánea, titule la FiO2 para mantener saturaciones de O2 entre 94-98%. Mantenga FiO2 altas cuando sospeche intoxicación con monóxido de carbono y anemia severa con el fin de optimizar el transporte de oxígeno.
c) Ventilación: En relación a la ventilación, en el prehospitalario existen resultados contradictorios en mortalidad y outcome neurológico (nivel de evidencia 2) 24 . La recomendación de tratamiento actual es que la ventilación con máscara y bolsa continúa siendo la técnica preferida durante los pasos iniciales de la resucitación pediátrica y ésta debe realizarse por sobre la intubación en el contexto pre hospitalario cuando el tiempo de transporte es corto. En infantes y niños en quienes la ventilación con bolsa y máscara es inefectiva, el uso de dispositivos supraglóticos (en especial máscara laríngea) por personal apropiadamente capacitado, puede ser considerado tanto para el rescate de la vía aérea como para el soporte de la ventilación.
No existen datos para identificar la ventilación minuto óptima (volumen corriente o frecuencia respiratoria). La evidencia muestra que la hiperventilación es frecuente durante la reanimación y que tiene efectos deletéreos. El aumento de la frecuencia respiratoria durante condiciones de bajo gasto cardiaco mejora la ventilación alveolar pero no la oxigenación y reduce la presión de perfusión coronaria (nivel de evidencia 5) 25 . La recomendación actual es que tras obtener una vía aérea segura, se debe evitar la hiperventilación durante la reanimación, independiente de la causa del paro. Use una relación de 2 ventilaciones seguidas de 15 compresiones torácicas (a 100-120 por minuto). Una vez que el tubo traqueal esté instalado, ventile a una frecuencia de 10-12 ventilaciones por minuto sin interrumpir las compresiones torácicas.
En relación a la intubación no existe evidencia que apoye el uso de tubos con o sin cuff, por lo que ambos son aceptables en infantes o niños que requieran intubación de emergencia (nivel de evidencia 5) 26 ,27 . En cuanto al tamaño del tubo endotraqueal a usar, el consenso actual respalda el uso de la fórmula de Khine para el cálculo del diámetro del tubo (DI: (diámetro interno del tubo en mm) = (edad en años/4) + 3 (nivel de evidencia 2) 26 . Existe evidencia que avala el que se sume 3,5 a la fórmula en vez de 3, por lo que ambas fórmulas son recomendables (nivel de evidencia 2) 28 ,29 .
No existe un método único para confirmar en forma precisa y consistente la correcta colocación del tubo traqueal y por ende la obtención de una vía aérea segura, pero se recomienda el uso de CO2 espirado (detección colorimétrica o capnografia) tanto en infantes como niños cuando existe un ritmo cardiaco con perfusión efectiva, en todos los escenarios (prehospitalario, sala de emergencias, UCI, hospitalización, quirófano, etc.) (nivel de evidencia 4).
En relación a la inducción-intubación en secuencia rápida, no hay información que avale que la presión cricoídea prevenga la aspiración en infantes o niños. Adicionalmente la presión cricoídea puede deformar la vía aérea y dificultar la ventilación con bolsa y máscara o la intubación (nivel de evidencia 5) 30 ,31 .
-
Compresiones Torácicas
El concepto de reanimación con sólo compresiones torácicas es atractivo por ser más simple y fácil que la reanimación con compresiones y ventilación. En base a la información disponible, la reanimación con solamente compresiones resulta en mejor outcome que el no reanimar, pero no tan efectiva como la reanimación estándar.
La recomendación es efectuar RCP convencional (compresiones más respiraciones de rescate) para los paros cardiacos pediátricos tanto prehospitalarios como hospitalarios (nivel de evidencia 5) 32 ,33 . Los reanimadores que no puedan administrar respiraciones de rescate, deben al menos administrar compresiones a niños o infantes en paro. Tanto las compresiones con una mano como con dos manos pueden ser utilizadas en niños. No hay evidencia suficiente en contra o a favor de la compresión circunferencial cuando se realiza la técnica de compresiones a dos pulgares en infantes. De la forma que sea como se realicen las compresiones, éstas deben comprimir al menos un tercio del diámetro antero posterior del tórax o aproximadamente 4 cm (nivel de evidencia 4 y 5) 34 ,35 .
La recomendación internacional para los infantes, es de una relación de 15 compresiones por 2 ventilaciones (para 2 reanimadores), con pausa para ventilación cuando no hay control de vía aérea avanzada, y en forma continua si la hay. A la fecha, la evidencia para establecer una relación entre compresiones y ventilaciones en infantes y niños es insuficiente. Cuando existe sólo un reanimador, se recomienda una relación de 30:1 igual que en adultos, para los infantes y niños.
-
Accesos Vasculares y Drogas
No hay mayor cambio en la evidencia respecto a las guías del año 2005. Se enfatiza en el acceso intraóseo precoz ante la imposibilidad de lograr un acceso venoso en infantes y niños, y se disminuye el énfasis en la vía traqueal para administrar drogas (nivel de evidencia 4 y 5) 36 . Si s e ha de usar la vía traqueal, para lograr el mismo efecto biológico que con drogas intravenosas se deben usar dosis hasta 10 veces mayores (nivel de evidencia 5) 37 diluidas en 5 ml de suero fisiológico y seguidas de 5 ventilaciones. No se deben administrar medicamentos no liposolubles (glucosa, bicarbonato, calcio). Se desconoce cuál es la dosis óptima de naloxona administrada por el tubo traqueal.
-
Desfibrilación
Seleccione las paletas más grandes para tener buen contacto con la pared torácica. Se desconoce el tamaño ideal, pero debe quedar cierta separación entre las paletas. El tamaño recomendado es:
-
4,5 cm de diámetro para infantes y niños menores de 10 Kg.
-
8-12 cm de diámetro para niños mayores de 10 Kg (mayores de 1 año).
El éxito de la descarga aumentaría de 31% a 82% si se aumenta el diámetro de las paletas de 8 x 8 cm a 12 x 12 cm ya que la impedancia transtorácica disminuye si se aumenta el tamaño de las paletas (nivel de evidencia 5) 38 .
Posición de las paletas: aplique las paletas firmemente sobre el tórax en una posición antero-lateral. Una paleta bajo la clavícula derecha y otra en la axila izquierda. Si las paletas son demasiado anchas y existe el riesgo de que por el contacto se forme un arco eléctrico, entonces deben ubicarse en posición antero posterior, una en el dorso por debajo de la clavícula izquierda y otra por el frente a la izquierda del esternón. La impedancia transtorácica no parece depender de la posición de las paletas sino más bien de la superficie que abarcan, aunque un estudio sugirió que colocar la paleta apical en posición horizontal si la disminuiría (nivel de evidencia 2 y 5) 39 , 40 .
Fuerza óptima: para disminuir la impedancia transtorácica durante la desfibrilación aplique una fuerza de aproximadamente 3 Kg para los niños que pesan < 10 Kg y 5 Kg para los niños mayores. Esto significa que en la práctica las paletas deben estar apoyadas firmemente.
Energía: la energía ideal se desconoce. La dosis inicial pediátrica recomendada para desfibrilación es de 2-4 J·Kg-1 , y aumentos sucesivos de energía podrían ser seguros y efectivos (nivel de evid encia 4) 41 .
Actualmente se mantiene la recomendación de usar las paletas más grandes posibles sobre el pecho del niño sin que éstas se toquen una con otra (nivel de evidencia 5) 42 . En cuanto al tipo de paletas, tanto las adhesivas como las tradicionales pueden ser usadas en la reanimación del paro cardiaco pediátrico sin inconvenientes.
Se recomienda usar una descarga única seguida de compresiones por cada ciclo, en vez de descargas sucesivas o acumulativas, ya que estas interrumpen y disminuyen el tiempo de masaje cardiaco efectivo (nivel de evidencia 5) 43 , 44 .
En cuanto al uso de amiodarona o lidocaína, no existe evidencia sobre su efectividad en pediatría para FV refractaria a desfibrilación o para TV sin pulso, sin embargo, ambas pueden ser utilizadas en estas situaciones tanto en infantes como en niños (nivel de evidencia 5) 45 .
Sobre el uso del desfibrilador automático externo (DEA) en infantes, muchos de estos aparatos han demostrado distinguir en forma adecuada entre los ritmos desfibrilables y los no-desfibrilables en infantes y niños. Adicionalmente el miocardio joven podría ser tolerante a altas dosis de energía, por lo que estos dispositivos podrían ser usados en la población pediátrica. Si no hay un desfibrilador manual disponible, use un DEA que pueda reconocer ritmos pediátricos y con atenuador de dosis para los niños entre 1 y 8 años. Si no existe un DEA con atenuador de dosis, use un DEA estándar con la energía usada en los adultos. Sobre los 8 años, use el DEA de adultos con las paletas de adultos.
Para el tratamiento de la FV o TV sin pulso extrahospitalaria en infantes, el orden de preferencia de los equipos de desfibrilación a usar es:
-
Desfibrilador manual.
-
DEA con atenuador de dosis.
-
DEA sin atenuador de dosis.
En la taquicardia ventricular inestable no existe evidencia suficiente que establezca como superior el tratamiento mediante descarga eléctrica o mediante drogas, ni tampoco entre las diferentes drogas, en la población pediátrica (nivel de evidencia 5) 46 . Actualmente la recomendación es la cardioversión sincronizada como primera opción, siendo la segunda alternativa el uso de amiodarona (nivel de evidencia 4) 47 , 48 .
En la taquicardia supraventricular, el tratamiento de elección es la adenosina tanto en infantes como en niños (nivel de evidencia 4) 49 , 50 . El verapamilo es una segunda opción válida para niños mayores, pero no debe ser utilizado de rutina en infantes (nivel de evidencia 2 y 5) 51 , 52 . La procainamida o la amiodarona, pueden ser administradas en infusiones lentas como una alternativa pa ra la taquicardia supraventricular refractaria (nivel de evidencia 2) 53 .
No existen nuevas evidencias, y por lo tanto nuevas recomendaciones sobre el uso de drogas durante el PCR.
-
Uso de fármacos y otras terapias durante la reanimación
-
Adrenalina: ocupa un lugar en los algoritmos de manejo del PCR con ritmos desfibrilables y no desfibrilables. Produce vasoconstricción, aumenta la presión diastólica y aumenta la presión de perfusión coronaria, la contractilidad miocárdica, e stimula la contracción espontánea y aumenta la frecuencia de FV aumentando la posibilidad de una desfibrilación exitosa. La dosis habitual es de 10 µg·Kg -1 IV, tanto para la primera dosis como para dosis subsecuentes. La dosis máxima total es de 1 mg (nive l de evidencia 1, 2, 3 y 5) 54 – 56 . El uso de dosis más altas de adrenalina no está recomendada ya que no mejora la sobrevida ni el outcome neurológico luego del PCR.
-
Amiodarona: es un inhibidor n o competitivo de los receptores adrenérgicos. Deprime la conducción en el miocardio, enlentece la conducción AV, prolonga el intervalo QT y el período refractario. Debe inyectarse en 10-20 minutos excepto cuando se usa en el tratamiento de la FV/TV sin pul so refractaria. Los efectos adversos son hipotensión, bradicardia y TV polimórfica.
-
Vasopresina: el uso de vasopresina (o su análogo terlipresina) no se recomiendan en el paro pediátrico por carecer de evidencia que lo avale en este contexto (nivel de evid encia 1, 3, 4 y 5) 57 – 59 .
-
Calcio: tampoco hay evidencia que demuestre mejor sobrevida o mejor outcome neurológico ante el uso rutinario de calcio. Se reserva su uso en los casos de hipocalcemia d ocumentada, hipermagnesemia/hiperkalemia o sobredosis de bloqueadores de canales de calcio (nivel de evidencia 2 y 5) 60 , 61 .
-
Glucosa: los datos extraídos de estudios en neonatos, niños y adultos indican que tanto la hipoglicemia como la hiperglicemia se asocian con mal outcome luego de un PCR. Es incierto si es meramente una asociación o si existe causalidad. Se recomienda: chequear el nivel plasmático de glucosa en todo niño en PCR y post resucitación, no administrar soluciones glucosadas a menos que exista una hipoglicemia documentada. No se recomienda el manejo estricto de la glicemia ya que no ha mejorado la sobrevida y sí ha aumentado la incidencia de hipoglicemia en RN, niños y adultos.
-
Magnesio: no existe evidencia que recomiende su uso en forma rutinaria en el PCR. Sólo está indicado en el manejo de la torsade de pointes y en la hipomagnesemia documentada.
-
Bicarbonato de sodio: no existe evidencia que apoye el uso rutinario de bicarbonato durante la reanimación y la recuperación de la circulación espontánea. La cantidad excesiva de bicarbonato altera la oxigenación tisular, produce hipokalemia, hipernatremia, hiperosmolaridad e inactiva las catecolaminas. Su uso está reservado en los casos de PCR prolongado con acidosis metabólica severa, inestabilidad hemodinámica e hiperkalemia persistente o en el caso de intoxicación por antidepresivos tricíclicos.
-
Lidocaína: menos efectiva que la amiodarona en el tratamiento de la FV refractaria y la TV sin pulso en el niño y por lo tanto no es el tratamiento de primera línea.
-
Procainamida: enlentece la conducción intrauricular y prolonga el intervalo QRS y QT. Puede usarse en la taquicardia supraventricular o TV resistente a otro tratamiento en niño hemodinámicamente estable. Debe ser usada con cautela ya que es potente vasodilatador.
-
Atropina: el uso de atropina en el PCR intrahospitalario pediátrico tiene evidencia controversial. Se recomienda s u uso en aquellos cuadros de bradicardia por aumento en el tono vagal o en toxicidad por drogas colinérgicas. No hay evidencia que apoye su uso rutinario (nivel de evidencia 3, 4 y 5) 62 , 63 . El c álculo de la dosis inicial sigue siendo motivo de debate. En niños no obesos el cálculo se hace mediante el peso real, y en aquellos obesos mediante el peso ideal. Cuando no se tiene peso real, los métodos de determinación de peso mediante sistemas basados en la talla son más precisos que aquellos basados en la edad o en la mera observación. Las dosis subsecuentes se realizan tomando en cuenta los efectos clínicos observados y la toxicidad (Nivel de evidencia 5) 64 . La dosis re comendada de atropina es de 0,01 mg·kg -1. Dosis menores pueden causar bradicardia paradojal. Para el manejo de la bradicardia con baja perfusión que no responde a la ventilación y oxigenación, la droga de primera línea es la adrenalina y no la atropina.
-
So porte Cardiaco Extracorpóreo (Extracorporeal Life Support): la evidencia que respalda el uso de otras terapias, como el soporte cardiaco extracorpóreo, ha ido en aumento. Al igual que en los adultos, se reserva esta alternativa para aquellos casos autolimi tados o tratables, o aquellos pacientes candidatos a trasplante. Se recomienda el apoyo extracorpóreo sólo en casos reservados, en ambientes altamente supervisados, con protocolos y equipos capacitados (nivel de evidencia 2 y 4) 65 , 66 .
-
Cuidados post-resucitación
La hipotermia central 32-34ºC puede ser beneficiosa. La hipotermia leve es aceptablemente segura en los adultos y los neonatos. (nivel de evidencia 5) 67 ,68 . El niño que recupera circulación espontánea pero que sigue comatoso luego del PCR puede beneficiarse de la hipotermia a 32-34ºC por al menos 24 horas. El niño reanimado no debe ser calentado en forma activa a menos que la temperatura central llegue a 32ºC. Luego del período de hipotermia, recaliente al niño en forma gradual a 0,25-0,5ºC por hora.
No hay estudios que evalúen el rol de las drogas vasoactivas en la post reanimación. Estudios en animales y estudios aislados en niños post cirugía cardiaca que presentan bajo gasto cardiaco, muestran una mejoría hemodinámica con algunos vasoactivos (dobutamina, milrinona, levosimendan) por lo que sería razonable administrarlos en el período posterior a la reanimación (nivel de evidencia 5) 69 , 70 .
No hay evidencia que apoye o refute alguna estrategia específica sobre el manejo de la glucosa en la post reanimación, aunque existe asociación entre hiper e hipoglicemia y peor outcome a largo plazo. No hay evidencia que muestre que el tratamiento de estas dos situaciones mejore el outcome. La asociación de hipoglicemia con hipoxia e isquemia, sin embargo, ha mostrado mayor mortalidad en niños críticamente enfermos (nivel de evidencia 1 y 5) 70 ,71 .
-
Situaciones especiales
-
Trauma: el PCR en el contexto de trauma mayor presenta una elevada mortalidad en niños, sin embargo no es posible con la evidencia actual recomendar alguna modificación a la reanimación estándar que eleve la sobrevida (nivel de evidencia 2, 4 y 5) 72 –74 .
-
Hipertensión pulmonar: se recomienda seguir los protocolos estándar de manejo del PCR con énfasis en el uso de FiO2 altas, alcalosis/hiperventilación, uso de óxido nítrico (NO) inhalado, prostaciclina en aerosol, que han mostrado una efectiva disminución en la resistencia vascular pulmonar (nivel de evidencia 5) 75 .
Reanimación cardiopulmonar neonatal
La mayoría de los recién nacidos (RN) no requiere soporte alguno durante la transición de la vida intrauterina a la extrauterina. Aproximadamente un 10% de ellos necesitará algún tipo de asistencia y solo un 1% de maniobras de resucitación; 8 de 1.000 requerirán ventilaciones a presión positiva y sólo 2 de 1.000 intubación traqueal. (Nivel de evidencia 4) 76 ,77 .
La RCP del RN normalmente es llevada a cabo por el neonatólogo en la sala de partos.
-
Fisiología de la asfixia in útero y de la resucitación 78
Frente a la falta de O2, inicialmente hay un aumento de la frecuencia cardiaca que progresa a bradicardia frente a la hipoxia prolongada. La vasoconstricción mantiene la presión arterial y optimiza el flujo hacia el cerebro y el corazón.
La hipoxia deprime los centros respiratorios altos llevando a una fase inicial de apnea. Luego aparecen los reflejos respiratorios espinales que se traducen en esfuerzo inspiratorio tipo gasping. Sin O2 estos movimientos cesan, con la consecuente apnea terminal. El corazón sigue latiendo inicialmente, pero se enlentece hasta el paro con la anoxia persistente y la acidosis progresiva. Este proceso tarda alrededor de 20 minutos sin oxígeno.
La respuesta frente a las maniobras de resucitación dependerá del tiempo de hipoxia. Si el RN es entregado al neonatólogo en la fase de apnea primaria o gasping, el aporte de oxígeno y los esfuerzos inspiratorios sucesivos propios del RN, el corazón que aún late responde a este aumento de O2 con un aumento de la frecuencia cardiaca. La perfusión sistémica mejora, el centro respiratorio previamente suprimido se recupera y el RN comienza a ventilar por sí mismo en forma más eficiente.
Si el neonatólogo inicia la reanimación del RN en la etapa de la apnea terminal, es esencial ventilar a presión positiva. Si el corazón todavía late, la frecuencia cardiaca aumentará y la perfusión mejorará. Los centros respiratorios se recuperarán iniciando una ventilación tipo gasping para luego recuperar un patrón ventilatorio más regular. Si el corazón está muy deprimido, la ventilación eficiente no será eficaz en aumentar la frecuencia cardiaca y se necesitará masaje cardiaco para bombear oxígeno desde los pulmones al corazón que, si no está afectado por la acidosis, va a responder. Ocasionalmente se requieren drogas para estimular el corazón (adrenalina), aportar energía (glucosa), o modificar el pH (bicarbonato) antes de obtener una respuesta.
La mayoría de los RN que no respiran luego de la estimulación está en la fase de apnea primaria y se recuperan rápidamente con maniobras de reanimación básica, con o sin ventilación a presión positiva.
Puesto que luego del parto es imposible hacer la diferenciación entre apnea primaria o secundaria, se debe asumir que el RN está en apnea secundaria y comenzar la resucitación inmediatamente. Si la respiración tipo gasping precede la recuperación de la respiración normal por un período prolongado, es probable que el RN haya estado en la apnea terminal.
El primer signo de una resucitación efectiva es siempre el aumento de la frecuencia cardiaca.
-
Consecuencias de la hipoxia perinatal
La anoxia perinatal tiene consecuencias hemodinámicas, metabólicas y cerebrales.
En relación a las consecuencias hemodinámicas, los débitos locales se mantienen o aumentan a nivel cerebral y miocárdico, pero disminuyen el renal, mesentérico, hepático, muscular y cutáneo. Si la anoxia se prolonga, las reservas miocárdicas se agotan y la acidosis láctica creciente altera la función miocárdica: disminuye la frecuencia cardiaca y el débito cardiaco. El ductus arterioso, abierto durante todo el período fetal, corre el riesgo de quedarse abierto. Existe entonces un shunt de derecha a izquierda a través del ductus y del foramen oval. La resistencia pulmonar se mantiene alta impidiendo la vasodilatación del territorio vascular pulmonar durante el nacimiento. Todos los mecanismos de adaptación circulatoria y respiratoria habituales propios del nacimiento se ven alterados y tienen como consecuencia la hipertensión pulmonar persistente.
En relación a las consecuencias metabólicas, la hipoxia tisular lleva a la formación de ácido láctico y a acidosis metabólica.
En relación a las consecuencias cerebrales, en el RN de término las regiones más sensibles a la anoxia son la corteza, la sustancia blanca subcortical y los núcleos grises centrales. Las lesiones celulares ocurren en dos fases: una muerte celular precoz y una muerte neuronal tardía relacionada con la cascada metabólica excitotóxica deletérea. Así, a la fase anóxica le sucede una fase de depresión del metabolismo energético cerebral. Paralelamente, los fenómenos de isquemia-reperfusión generan un stress oxidativo con radicales libres y síntesis de óxido nítrico. La prevención de la anoxia perinatal es difícil ya que las anomalías del ritmo cardiaco fetal no son de sensibilidad y especificidad satisfactoria. Los procesos deletéreos no pueden ser detectados sino en el periparto.
-
Principios básicos de resucitación neonatal
La mayoría sólo necesita estar tibio y por lo tanto sólo basta con el secado y con las medidas de mantención de temperatura. El frío (cold stress) disminuye la tensión arterial de oxígeno y aumenta la acidosis, de manera que para aquellos que necesitan un poco más de ayuda al nacer, la mantención de la temperatura es vital.
Si se necesita soporte, la prioridad son las maniobras de despeje de la vía aérea seguidas de ventilación a presión positiva y finalmente masaje cardiaco externo, si fuera necesario. Sin aire en los pulmones, el masaje cardiaco externo no es efectivo. Rara vez se requieren drogas.
Por lo tanto, la asistencia de todo RN incluye la siguiente secuencia de estrategias, que permitan determinar este subgrupo de neonatos que requieren de apoyo extendido:
-
Pasos de estabilización inicial (proporcionar calor y secado, valoración de vía aérea, estimulación para respirar).
-
Ventilación.
-
Compresiones torácicas.
-
Medicación.
La progresión de un paso a otro dentro de la secuencia, se basa en la evaluación de dos características vitales: la frecuencia cardiaca y las respiraciones. Tanto la secuencia de estabilización inicial como la ventilación deben evaluarse en conjunto por un período de 30 segundos, de manera de decidir si se progresa a la secuencia siguiente o no. La secuencia de acciones que deben llevarse a cabo en la reanimación del RN se describe con detalles en el algoritmo de la Figura 4.
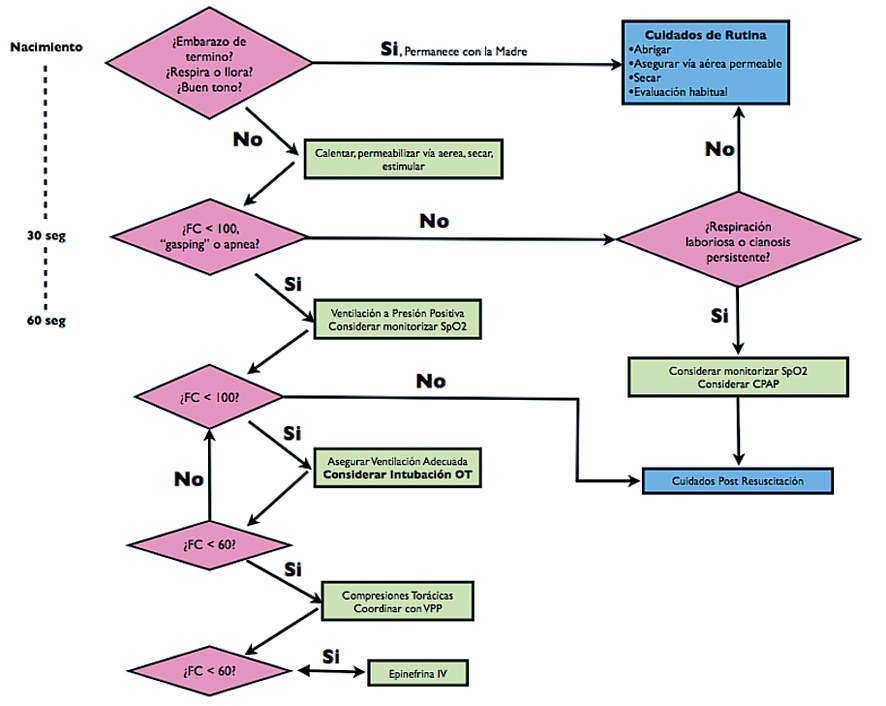
Figura 4 Algoritmo de reanimación del recién nacido.
Desde la publicación del Consenso Internacional de Resucitación Cardiopulmonar el año 2005 79 , se han identificado numerosos temas controversiales a los que se ha llegado a un nuevo consenso. Estos son en resumen:
-
Rol del aporte de O2 suplementario.
-
Manejo del meconio.
-
Estrategias de ventilación.
-
Dispositivos de confirmación de la posición correcta de LMA, TOT.
-
Fármacos.
-
Mantención de la temperatura corporal.
-
Manejo post resucitación.
-
Consideraciones para discontinuar las maniobras de resucitación.
Las recomendaciones más importantes son las siguientes:
-
-
El inicio de la reanimación, luego de la evaluación inicial, se basa en la frecuencia cardiaca y en la evaluación de la respiración. La oximetría debe ser usada porque la evaluación del color es poco específica.
-
Los RN de término deben ser reanimados inicialmente con aire y no con O2 100%.
-
El O2 suplementario debe administrarse como mezcla de O2 + aire y la concentración guiada por oximetría de pulso.
-
No existe evidencia que apoye o contraindique la aspiración traqueal de rutina en los RN con meconio, incluso si el RN nace deprimido.
-
La relación compresiones:ventilación sigue siendo 3:1; si el PCR es de etiología cardiaca, las compresiones deben ser más frecuentes.
-
La hipotermia terapéutica se reserva para los RN de término o cercanos a término que evolucionan con encefalopatía hipóxico-isquémica.
-
Las maniobras de resucitación pueden detenerse si luego de 10 minutos de reanimación no hay frecuencia cardiaca detectable.
-
En los RN que no requieren resucitación, el pinzamiento del cordón debe realizarse luego de 1 minuto.
-
-
Evaluación inicial e intervención
La frecuencia cardiaca debe ser el primer signo vital evaluado, a través de la auscultación del precordio, ya que un rápido aumento en los valores sigue siendo el indicador más sensible de resucitación eficaz (nivel de evidencia 5) 80 , aunque es una medida poco sensible (nivel de evidencia 2) 81 , igual que la palpación del cordón umbilical, que subestima los valores (nivel de evidencia 4) 82 . Los cambios en la coloración de la piel, aún en RN sin alteraciones, demoran en alcanzarse, por lo que no son una medida fidedigna de necesidad de oxigenación.
El oxímetro de pulso mide en forma bastante precisa la frecuencia cardiaca, por lo que está recomendado especialmente para la monitorización de niños que requieran maniobras de soporte, aunque su impacto en los resultados de una reanimación no han podido establecerse (nivel de evidencia 4) 6 ,83 . La oximetría de pulso y la frecuencia cardiaca pueden ser medidos con una mayor precisión a los 90 segundos desde el nacimiento, con un sensor neonatal o uno diseñado para reducir el artefacto por movimiento (nivel de evidencia 4) 84 ,85 . Valores pre-ductales, obtenidos de la mano o muñeca derecha, son mayores que aquellos post-ductales 7 ,86 .
El soporte ventilatorio inicial que se efectúa mediante ventilación a presión positiva intermitente en niños de término debe siempre realizarse con aire, ya que el O2 suplementario en este grupo, incrementa el tiempo a la primera respiración/llanto (nivel de evidencia 2) 87 ,88 , y aumenta la mortalidad 89 ,90 .
En relación al uso de oxígeno suplementario, existe evidencia en modelos de animales recién nacidos sometidos a asfixia, expuestos a altas concentraciones de oxígeno durante las maniobras de resucitación, que no confiere ventajas clínicas y sería potencialmente dañino a nivel celular 91 ,92 , generando cambios bioquímicos a nivel cerebral (nivel de evidencia 5) 93 ,94 .
En RN de pretérmino (< 32 semanas de gestación) se recomienda iniciar maniobras de resucitación con fracciones inspiradas de oxígeno entre 30% a 90% e ir titulando según oximetría de pulso, ya que la utilización de aire u oxígeno puros se asocian a mayor riesgo de hipoxemia e hiperoxemia respectivamente (nivel de evidencia 2) 10 ,95 . Si no hay disponibilidad de gases mixtos, se debe usar aire. No existe evidencia que avale una conducta u otra en niños nacidos entre las 32 a 37 semanas.
En cuanto a la succión de la boca o nariz en neonatos deprimidos para mantener la permeabilidad de la vía aérea, no existe evidencia que avale su práctica, tanto en presencia de líquido amniótico claro como con meconio. En RN sanos ésta se asocia a mayor incidencia de complicaciones cardiorrespiratorias (nivel de evidencia 1) 96 ,97 y en aquellos intubados, sedados o paralizados se asocia a reducción en la oxigenación y aumentos en el flujo cerebral, con el consiguiente aumento en la presión intracraneana (nivel de evidencia 5) 98 . No hay reducción en la incidencia o mortalidad por síndrome de aspiración meconial con esta práctica en aquellos RN deprimidos en presencia de líquido amniótico con meconio (nivel de evidencia 499; nivel de evidencia 5 100 , respectivamente).
-
Estrategias de ventilación
Tanto tiempo inspiratorios largos como cortos se usan en la práctica clínica para ventilar de forma inicial a los RN de término, pero no existen estudios que comparen ambas técnicas. En algunas series de casos en niños de término, una ventilación inicial de 5 segundos aumenta en dos veces la capacidad residual funcional comparada a controles históricos (Nivel de evidencia 4) 101 . En niños de pretérmino, un estudio prospectivo randomizado demostró que una ventilación inicial de 10 segundos seguida por CPAP, versus ventilación con máscara facial, disminuyó la necesidad de intubación en las primeras 72 horas, el tiempo de soporte ventilatorio y la aparición de displasia broncopulmonar (nivel de evidencia 1) 102 . Otros estudios no han logrado demostrar este hecho 103 ,104 .
Durante el soporte ventilatorio inicial, la adecuada presión de inflado es aquella que resulta suficiente para mejorar la frecuencia cardiaca o la expansión torácica. Esto se alcanza con presiones de 30 cmH2O en niños de término (nivel de evidencia 4) 25 ,105 , y 20-25 cmH2O en niños de pretérmino (nivel de evidencia 4) 106 . En estudios con animales inmaduros, la ventilación a presiones mayores durante el nacimiento se asocia a daño pulmonar y alteración en el intercambio de gases (nivel de evidencia 5) 107 .
En cuanto al rol de la presión positiva al final de la espiración (PEEP) durante la resucitación en RN de término, no hay evidencia que avale o refute su valor. En niños de pretérmino no habría beneficio al usar PEEP durante la fase de estabilización (nivel de evidencia 1) 108 . En estudios animales, el uso de PEEP < 8-12 cmH2O mejora la capacidad residual funcional, la compliance pulmonar y disminuye el daño pulmonar (nivel de evidencia 5) 109 ,110 , aunque valores mayores disminuyen el flujo sanguíneo pulmonar y aumentan el riesgo de neumotórax (nivel de evidencia 5) 111 ,112 .
Al comparar las maniobras ventilatorias en niños prematuros (entre 25 y 28 semanas) que requieren soporte avanzado para manejo de distress respiratorio, el uso de presión positiva continua (CPAP) versus intubación asociado a ventilación mecánica, no presenta diferencias en mortalidad o requerimientos de oxígeno a largo plazo; el uso de CPAP sin embargo, reduciría los requerimientos de ventilación mecánica (de 100 a 46%) y el uso de surfactante (de 77 a 38%) en este grupo de pacientes, pero aumenta la incidencia de neumotórax (de 3 a 9%) (nivel de evidencia 1) 113 . Se recomienda utilizar la estrategia en la que se tenga experiencia y equipos disponibles. En RN muy prematuros es recomendable el uso de CPAP inicial, ya que disminuye la incidencia de intubación y la incidencia de displasia broncopulmonar cuando se compara en relación al uso de ventilación a presión positiva vía máscara facial (nivel de evidencia 1) 26 .
En cuanto a los dispositivos utilizados en la asistencia ventilatoria durante maniobras de resucitación, no existen estudios que demuestren la superioridad del resucitador en pieza T (Neopuff®) por sobre la ventilación con máscara. En modelos mecánicos sin embargo, este dispositivo entrega presiones de inflado más constantes (nivel de evidencia 5) 114 ,115 .
La máscara laríngea, ha demostrado ser exitosa en entregar una ventilación efectiva como aquella a través de máscara facial en recién nacidos (Nivel de evidencia 2) 116 , pero no existe literatura que avale su uso en recién nacidos < 2.000 g o < 34 semanas de gestación, en presencia de líquido amniótico meconial, o para uso de medicamentos intratraqueales. Otras interfaces como la máscara nasal, han mostrado incluso superioridad ante la máscara facial convencional en la asistencia inicial del recién nacido (nivel de evidencia 2) 117 . La recomendación es usar la interfaz en la cual se está entrenado, más que usar algún tipo específico.
-
Monitorización durante y post intubación
La ventilación durante la resucitación neonatal tiene como objetivo inflar adecuadamente el pulmón, evitando el sobreinflado. Estudios en maniquíes y animales sugieren que los proveedores de ventilación no logran mantener presiones o volúmenes constantes durante la ventilación manual (nivel de evidencia 5) 118 ,119 lo que pudiese mejorarse con una adecuada posición de la máscara facial, para disminuir el grado de fuga, y con el uso de monitores de volumen (nivel de evidencia 5) 120 .
La monitorización a través del CO2 espirado es la forma más eficiente y precoz para confirmar la intubación traqueal en neonatos con circulación espontánea, siendo más preciso que la evaluación clínica (nivel de evidencia 2) 121 ,122 , aunque se ha reportado falsos negativos en casos de paro cardiorrespiratorio (nivel de evidencia 4) 123 .
No existe suficiente evidencia que indique mayor beneficio con el uso de detectores colorimétricos de CO2 exhalado durante la ventilación, a través de máscara facial u otra interfaz, versus la evaluación clínica por sí sola. No hay reportes de riesgos atribuidos a su uso, y en series de niños de pretérmino en unidades de pacientes críticos ha mostrado ser útil para el diagnóstico de obstrucción de la vía aérea (nivel de evidencia 4) 124 .
-
Soporte Circulatorio
En modelos de asfixia con cerdos la asociación de compresiones más ventilación durante la reanimación mostró mejores resultados comparado con resucitación efectuada con compresiones o ventilación por sí solas (nivel de evidencia 5) 125 ,126 . Estudios en modelos fisiológicos matemáticos sugieren que utilizar una relación compresión/ventilación elevada genera hipoventilación en niños asfixiados, y que una relación de 3 a 5 compresiones por 1 ventilación es el modelo de reanimación más eficiente en RN (nivel de evidencia 5) 127 .
Numerosos estudios en maniquíes confirman que una relación compresión/ventilación de 3:1 entrega más ventilaciones por minuto que otras técnicas y es físicamente menos extenuante (nivel de evidencia 5) 128 ,129 . Sin embargo, relaciones compresión/ventilación de 5:1 proveen compresiones de mejor calidad en maniquíes adultos cuando se realiza resucitación con dos rescatistas (nivel de evidencia 5) 130 y la relación 15:2 es la que genera mayor cantidad de compresiones por minuto (nivel de evidencia 5) 131 . En estudios con maniquíes pediátricos se evidenció que la relación 30:2 obtiene más compresiones por ciclo comparado con la relación compresión/ventilación 15:2 sin alteración aparente en la calidad de las compresiones realizadas (nivel de evidencia 5) 132 .
La técnica de compresión adecuada consiste en compresiones en el tercio inferior del esternón con los pulgares y el resto de las manos envolviendo el tórax (compresión circunferencial) (nivel de evidencia 5) 133 ,134 . La profundidad de la compresión debe ser de un tercio del diámetro antero-posterior del tórax (nivel de evidencia 5) 135 . Esta técnica produce presiones arteriales más elevadas y permite mantener una adecuada calidad de las compresiones por más tiempo, como ha sido demostrado en estudios con cerdos 136 , maniquíes 56 , series de casos 137 y cadáveres 138 .
-
Administración de fluidos y fármacos
A pesar del amplio uso de adrenalina durante la resucitación, no existen estudios clínicos controlados en neonatos que evalúen la dosis ideal de esta droga cuando la frecuencia cardiaca es menor a 60 latidos por minuto a pesar de adecuadas ventilaciones y compresiones torácicas. La evidencia es extrapolada desde estudios pediátricos, que incorporan niños menores de 1 año de edad, y que no muestran beneficios con dosis intravenosas de adrenalina mayores a 0,03 mg·Kg-1 (nivel de evidencia 5) 139 ,140 . Un meta- análisis que incluye 5 ensayos en adultos, indica que dosis mayores de adrenalina intravenosa (0,03 a 0,05 mg·Kg-1) resultan en un posible retorno de la circulación espontánea pero no ofrece beneficio en la sobrevida ni en el alta hospitalaria (nivel de evidencia 5) 141 e incluso aumentaría el riesgo de mortalidad en estudios con niños si se usan dosis elevadas (0,1 mg·Kg-1) (nivel de evidencia 5) 63 .
En cuanto al uso de adrenalina por vía traqueal, la evidencia en neonatos está limitada a algunos reportes, con uso de un amplio rango de dosis (de 0,003 a 0,25 mg·Kg-1), que muestran un posible retorno a circulación espontánea o aumento en la frecuencia cardiaca cuando no está disponible un acceso venoso (nivel de evidencia 4) 142 ,143 . Sin embargo, algunas series de casos indican que esta vía resultaría menos efectiva que la misma dosis administrada en forma intravenosa (nivel de evidencia 4) 2 . Esto se condice con estudios en modelos animales neonatales que muestran que se requieren mayores dosis de adrenalina intratraqueal para alcanzar la misma concentración plasmática y respuesta hemodinámica que una dosis intravenosa determinada (nivel de evidencia 5) 66 ,144,145 .
En cuanto a la evidencia sobre la expansión con volumen durante maniobras de resucitación, se acota a series de casos que la avalan en niños con historia de pérdidas sanguíneas que no responden a compresiones torácicas (nivel de evidencia 4) 146 . De no existir historia de sangrado, el beneficio del aporte de volumen carece de evidencia e incluso pudiese ser dañino como muestran estudios con animales (nivel de evidencia 5) 147 ,148 . Como las pérdidas pueden ser ocultas, se aconseja una prueba de volumen en recién nacidos que no responden a maniobras adecuadas de resucitación. De no ser factible la administración intravenosa, la recomendación es la vía intraósea en manos expertas como medida temporal (nivel de evidencia 4) 149 ,150 .
Otras drogas, como la naloxona, no se recomiendan en cuadros de depresión neonatal. Cuando es administrada en RN vigorosos sólo aumentaría transitoriamente la ventilación alveolar, lo que clínicamente tiene utilidad cuestionable (nivel de evidencia 4) 151 . En el caso de RN hijos de madres adictas a opioides, su uso se asocia a convulsiones (nivel de evidencia 5) 152 .
-
Terapia de soporte
Existe numerosa evidencia que avala la envoltura con mantas de polietileno en RN menores a 28 semanas de gestación, de manera de reducir las pérdidas de calor (nivel de evidencia 1) 153 ,154 . De no contar con mantas, la evidencia avala el uso de matraces de suero tibios, siendo la combinación de ambas estrategias la más eficiente para evitar esta complicación, aunque aumentaría el riesgo de hipertermia (nivel de evidencia 3) 155 . Las salas de atención del RN deben encontrarse al menos a 26°C para recibir niños prematuros menores a 28 semanas ya que el riesgo de hipotermia en ellos es considerable, asociando siempre que sea posible el uso de mantas y/o matraces de suero tibio para aumentar la eficiencia (nivel de evidencia 3) 156 . El objetivo es lograr normotermia y evitar la hipertermia iatrogénica.
RN de madres febriles tienen mayor incidencia de depresión respiratoria perinatal, convulsiones, parálisis cerebral y un mayor riesgo de mortalidad (nivel de evidencia 4) 157 . Estudios en animales adultos muestran una menor injuria del sistema nervioso central cuando se administra terapia antipirética para tratar la hipertermia (nivel de evidencia 5) 158 lo que se desconoce en RN. En estudios relacionados con el uso de corticoides en altas dosis para manejo de hipertermia materna se obtuvo un aumento de casos de bacteremia asintomática en los RN (nivel de evidencia 2) 159 .
-
Manejo post resucitación
Numerosos estudios randomizados han demostrado que la hipotermia inducida (33,5 a 34,5°C) implementada durante las primeras 6 horas de nacimiento en RN de término con riesgo elevado de daño cerebral, y con el posterior manejo en unidades de cuidados intensivos neonatal, se asocia a disminución significativa de muerte y retardo del desarrollo neurológico a los 18 meses de seguimiento (nivel de evidencia 1) 160 –162 . La maniobra es igualmente exitosa mediante enfriamiento de todo el cuerpo, como selectivamente de la cabeza, aunque no existen trabajos que comparen una técnica con otra. La terapia debe mantenerse durante 72 horas para luego recalentar de forma progresiva por 4 horas. Potenciales complicaciones a monitorizar son la hipotensión y trombocitopenia.
La infusión de soluciones glucosadas debiesen considerarse lo antes posible durante la reanimación ya que la hipoglicemia se asocia a injuria cerebral en pacientes que sufren episodios hipóxico-isquémicos (nivel de evidencia 3) 163 . Niveles elevados de glicemia en este contexto no parecieran generar efectos adversos, lo que ha sido demostrado en estudios en niños (nivel de evidencia 5) 164 y animales (nivel de evidencia 5) 165 , existiendo incluso modelos en ratas que mostrarían un potencial efecto protector (nivel de evidencia 5) 166 .
En niños nacidos a término sin incidentes, existe literatura que muestra beneficio en la demora del pinzado del cordón umbilical en al menos 1 minuto o hasta la pérdida del pulso del cordón. Esto mejora la cinética de fierro durante la infancia, aunque podría asociarse a mayor requerimiento de fototerapia (nivel de evidencia 1) 167 , además disminuiría la incidencia de hemorragia intraventricular en niños de pretérmino (nivel de evidencia 1) 168 .
-
Fin de resucitación
En neonatos con viabilidad límite o aquéllos con condiciones que predicen un alto riesgo de mortalidad o morbilidad, la práctica en cuanto al no inicio de maniobras de resucitación varía de acuerdo a cada lugar y recursos (nivel de evidencia 4) 169 .
En aquellos RN que no presenten actividad cardiaca al nacer y que a pesar de las maniobras no las presenten a los 10 minutos de vida, sería apropiado suspender las maniobras de resucitación, ya que la probabilidad de fallecer o sufrir discapacidad neurológica severa es elevada (nivel de evidencia 4) 170 ,171 .
REFERENCIAS
-
European Resuscitation Council Guidelines for Resuscitation 2010. Resuscitation 2010; 81: 1364-1388.
-
Meaney PA, Nadkarni VM, Cook EF, et al. Higher survival rates among younger patients after pediatric intensive care unit cardiac arrests. Pediatrics 2006; 118: 2424-2433.
-
Nadkarni VM, Larkin GL, Peberdy MA, et al. First documented rhythm and clinical outcome from in-hospital cardiac arrest among children and adults. JAMA 2006; 295: 50-57.
-
Atkins DL, Everson-Stewart S, Sears GK, et al. Epidemiology and outcomes from out-of-hospital cardiac arrest in children: the Resuscitation Outcomes Consortium Epistry-Cardiac Arrest. Circulation 2009; 119: 1484-1491.
-
Li G, Tang N, DiScala C, et al. Cardiopulmonary resuscitation in pediatric trauma patients: survival and functional outcome. J Trauma 1999; 47: 1-7.
-
Chan PS, Jain R, Nallmothu BK, Berg RA, Sasson C. Rapid response teams: a systematic review and meta-analysis. Arch Intern Med 2010; 170: 18-26.
-
Sharek PJ, Parast LM, Leong K, et al. Effect of a rapid response team on hospitalwide mortality and code rates outside the ICU in a Children’s Hospital. JAMA 2007; 298: 2267-2274.
-
Mangurten J, Scott SH, Guzzetta CE, et al. Effects of family presence during resuscitation and invasive procedures in a pediatric emergency department. J Emerg Nurs 2006; 32: 225-233.
-
McGahey-Oakland PR, Lieder HS, Young A, et al. Family experiences during resuscitation at a children’s hospital emergency department. J Pediatr Health Care 2007; 21: 217-225.
-
van der Woning M. Relatives in the resuscitation area: a phenomenological study. Nurs Crit Care 1999; 4: 186-192.
-
Dick WF, Eberle B, Wisser G, Schneider T. The carotid pulse check revisited: what if there is no pulse? Crit Care Med 2000; 28: 183-185.
-
Eberle B, Dick WF, Schneider T, et al. Checking the carotid pulse check: diagnostic accuracy of first responders in patients with and without a pulse. Resuscitation 1996; 33: 107-116.
-
Blaivas M, Fox JC. Outcome in cardiac arrest patients found to have cardiac standstill on the bedside emergency department echocardiogram. Acad Emerg Med 2001; 8: 616-621.
-
Menaker J, Cushman J, Vermillion JM, et al. Ultrasound diagnosed cardiac tamponade after blunt abdominal trauma-treated with emergent thoracotomy. J Emerg Med 2007; 32: 99-103.
-
Niendorff DF, Rassias AJ, Palac R, et al. Rapid cardiac ultrasound of inpatients suffering PEA arrest performed by nonexpert sonographers. Resuscitation 2005; 67: 81-87.
-
Li Y, Ristagno G, Bisera J, et al. Electrocardiogram waveforms for monitoring effectiveness of chest compression during cardiopulmonary resuscitation. Crit Care Med 2008; 36: 211-215.
-
Ristagno G, Tang W, Chang YT, et al. The quality of chest compressions during cardiopulmonary resuscitation overrides importance of timing of defibrillation. Chest 2007; 132: 70-75.
-
Rubertsson S, Karlsten R. Increased cortical cerebral blood flow with LUCAS: a new device for mechanical chest compressions compared to standard external compressions during experimental cardiopulmonary resuscitation. Resuscitation 2005; 65: 357-363.
-
Davis PG, Tan A, O’Donnell CP, Schulze A. Resuscitation of newborn infants with 100% oxygen or air: a systematic review and meta-analysis. Lancet 2004; 364: 1329-1333.
-
Rabi Y, Rabi D, Yee W. Room air resuscitation of the depressed newborn: a systematic review and meta-analysis. Resuscitation 2007; 72: 353-363.
-
Liu Y, Rosenthal RE, Haywood Y, et al. Normoxic ventilation after cardiac arrest reduces oxidation of brain lipids and improves neurological outcome. Stroke 1998; 29: 1679-1686.
-
Richards EM, Fiskum G, Rosenthal RE, et al. Hyperoxic reperfusion after global ischemia decreases hippocampal energy metabolism. Stroke 2007; 38: 1578-1584.
-
Zwemer CF, Whitesall SE, D’Alecy LG. Cardiopulmonary-cerebral resuscitation with 100% oxygen exacerbates neurological dysfunction following nine minutes of normothermic cardiac arrest in dogs. Resuscitation 1994; 27: 159-170.
-
DiRusso SM, Sullivan T, Risucci D, Nealon P, Slim M. Intubation of pediatric trauma patients in the field: predictor of negative outcome despite risk stratification. J Trauma 2005; 59: 84-90, discussion 1.
-
Idris AH, Becker LB, Fuerst RS, et al. Effect of ventilation on resuscitation in an animal model of cardiac arrest. Circulation 1994; 90: 3063-3069.
-
Khine HH, Corddry DH, Kettrick RG, et al. Comparison of cuffed and uncuffed endotracheal tubes in young children during general anesthesia. Anesthesiology 1997; 86: 627-631, discussion 27A.
-
Weiss M, Dullenkopf A, Fischer JE, Keller C, Gerber AC. Prospective randomized controlled multi-centre trial of cuffed or uncuffed endotracheal tubes in small children. Br J Anaesth 2009; 103: 867-873.
-
Duracher C, Schmautz E, Martinon C, Faivre J, Carli P, Orliaguet G. Evaluation of cuffed tracheal tube size predicted using the Khine formula in children. Paediatr Anaesth 2008; 18: 113-118.
-
Dullenkopf A, Gerber AC, Weiss M. Fit and seal characteristics of a new paediatric tracheal tube with high volume-low pressure polyurethane cuff. Acta Anaesthesiol Scand 2005; 49: 232-237.
-
Moynihan RJ, Brock-Utne JG, Archer JH, Feld LH, Kreitzman TR. The effect of cricoid pressure on preventing gastric insufflation in infants and children. Anesthesiology 1993; 78: 652-656.
-
Ellis DY, Harris T, Zideman D. Cricoid pressure in emergency department rapid sequence tracheal intubations: a risk-benefit analysis. Ann Emerg Med 2007; 50: 653-665.
-
Berg RA, Hilwig RW, Kern KB, Ewy GA. Bystander” chest compressions and assisted ventilation independently improve outcome from piglet asphyxia pulseless “cardiac arrest”. Circulation 2000; 101: 1743-1748.
-
Iwami T, Kawamura T, Hiraide A, et al. Effectiveness of bystander-initiated cardiac-only resuscitation for patients with out-of-hospital cardiac arrest. Circulation 2007; 116: 2900-2907.
-
Wik L, Kramer-Johansen J, Myklebust H, et al. Quality of cardiopulmonary resuscitation during out-of-hospital cardiac arrest. JAMA 2005; 293: 299-304.
-
Braga MS, Domínguez TE, Pollock AN, et al. Estimation of optimal CPR chest compression depth in children by using computer tomography. Pediatrics 2009; 124: e69-74.
-
Horton MA, Beamer C. Powered intraosseous insertion provides safe and effective vascular access for pediatric emergency patients. Pediatr Emerg Care 2008; 24: 347-350.
-
Yang LY, He CQ, Zhang ZG. Endotracheal administration of epinephrine during cardiopulmonary resuscitation. Chin Med J (Engl) 1991; 104: 986-991.
-
Samson RA, Atkins DL, Kerber RE. Optimal size of self-adhesive preapplied electrode pads in pediatric defibrillation. Am J Cardiol 1995; 75: 544-545.
-
Atkins DL, Sirna S, Kieso R, Charbonnier F, Kerber RE. Pediatric defibrillation: importance of paddle size in determining transthoracic impedance. Pediatrics 1988; 82: 914-918.
-
Tibballs J, Carter B, Kiraly NJ, Ragg P, Clifford M. External and internal biphasic direct current shock doses for pediatric ventricular fibrillation and pulseless ventricular tachycardia. Pediatr Crit Care Med 2010, doi: 10.1097/PCC.0b013e3181dbb4fc.
-
Kerber RE, Grayzel J, Hoyt R, Marcus M, Kennedy J. Transthoracic resistance in human defibrillation. Influence of body weight, chest size, serial shocks, paddle size and paddle contact pressure. Circulation 1981; 63: 676-682.
-
Caterine MR, Yoerger DM, Spencer KT, Miller SG, Kerber RE. Effect of electrode position and gel-application technique on predicted transcardiac current during transthoracic defibrillation. Ann Emerg Med 1997; 29: 588-595.
-
Eftestol T, Sunde K, Steen PA. Effects of interrupting precordial compressions on the calculated probability of defibrillation success during out-of-hospital cardiac arrest. Circulation 2002; 105: 2270-2273.
-
Rea TD, Helbock M, Perry S, et al. Increasing use of cardiopulmonary resuscitation during out-of-hospital ventricular fibrillation arrest: survival implications of guideline changes. Circulation 2006; 114: 2760-2765.
-
Dorian P, Cass D, Schwartz B, Cooper R, Gelaznikas R, Barr A. Amiodarone as compared with lidocaine for shock-resistant ventricular fibrillation. N Engl J Med 2002; 346: 884-890.
-
Domanovits H, Paulis M, Nikfardjam M, et al. Sustained ventricular tachycardia in the emergency department. Resuscitation 1999; 42: 19-25.
-
Burri S, Hug MI, Bauersfeld U. Efficacy and safety of intravenous amiodarone for incessant tachycardias in infants. Eur J Pediatr 2003; 162: 880-884.
-
Perry JC, Fenrich AL, Hulse JE, Triedman JK, Friedman RA, Lamberti JJ. Pediatric use of intravenous amiodarone: efficacy and safety in critically ill patients from a multicenter protocol. J Am Coll Cardiol 1996; 27: 1246-1250.
-
Balaguer Gargallo M, Jordan Garcia I, Caritg Bosch J, Cambra Lasaosa FJ, Prada Hermogenes F, Palomaque Rico A. Supraventricular tachycardia in infants and children. An Pediatr (Barc) 2007; 67: 133-138.
-
Ralston MA, Knilans TK, Hannon DW, Daniels SR. Use of adenosine for diagnosis and treatment of tachyarrhythmias in pediatric patients. J Pediatr 1994; 124: 139-143.
-
Greco R, Musto B, Arienzo V, Alborino A, Garofalo S, Marsico F. Treatment of paroxysmal supraventricular tachycardia in infancy with digitalis, adenosine-5 triphosphate, and verapamil: a comparative study. Circulation 1982; 66: 504-508.
-
Lim SH, Anantharaman V, Teo WS, Chan YH. Slow infusion of calcium channel blockers compared with intravenous adenosine in the emergency treatment of supraventricular tachycardia. Resuscitation 2009; 80: 523-528.
-
Chang PM, Silka MJ, Moromisato DY, Bar-Cohen Y. Amiodarone versus procainamide for the acute treatment of recurrent supraventricular tachycardia in pediatric patients. Circ Arrhythm Electrophysiol 2010; 3: 134-140.
-
Olasveengen TM, Sunde K, Brunborg C, Thowsen J, Steen PA, Wik L. Intravenous drug administration during out-of-hospital cardiac arrest: a randomized trial. JAMA 2009; 302: 2222-2229.
-
Patterson MD, Boenning DA, Klein BL, et al. The use of high-dose epinephrine for patients with out-of-hospital cardiopulmonary arrest refractory to prehospital interventions. Pediatr Emerg Care 2005; 21: 227-237.
-
Vandycke C, Martens P. High dose versus standard dose epinephrine in cardiac arrest-a meta-analysis. Resuscitation 2000; 45: 161-166.
-
Duncan JM, Meaney P, Simpson P, Berg RA, Nadkarni V, Schexnayder S. Vasopressin for in-hospital pediatric cardiac arrest: results from the American Heart Association National Registry of Cardiopulmonary Resuscitation. Pediatr Crit Care Med 2009; 10: 191-195.
-
Mukoyama T, Kinoshita K, Nagao K, Tanjoh K. Reduced effectiveness of vasopressin in repeated doses for patients undergoing prolonged cardiopulmonary resuscitation. Resuscitation 2009; 80: 755-761.
-
Wenzel V, Krismer AC, Arntz HR, Sitter H, Stadlbauer KH, Lindner KH. A comparison of vasopressin and epinephrine for out-of-hospital cardiopulmonary resuscitation. N Engl J Med 2004; 350: 105-113.
-
Meert KL, Donaldson A, Nadkarni V, et al. Multicenter cohort study of inhospital pediatric cardiac arrest. Pediatr Crit Care Med 2009; 10: 544-553.
-
de Mos N, van Litsenburg RR, McCrindle B, Bohn DJ, Parshuram CS. Pediatric inintensive- care-unit cardiac arrest: incidence, survival, and predictive factors. Crit Care Med 2006; 34: 1209-1215.
-
Brady WJ, Swart G, DeBehnke DJ, Ma OJ, Aufderheide TP. The efficacy of atropine in the treatment of hemodynamically unstable bradycardia and atrioventricular block: prehospital and emergency department considerations. Resuscitation 1999; 41: 47-55.
-
Meaney PA, Nadkarni VM, Cook EF, et al. Higher survival rates among younger patients after pediatric intensive care unit cardiac arrests. Pediatrics 2006; 118: 2424-2433.
-
Parra DA, Totapally BR, Zahn E, et al. Outcome of cardiopulmonary resuscitation in a pediatric cardiac intensive care unit. Crit Care Med 2000; 28: 3296-3300.
-
Morris MC, Wernovsky G, Nadkarni VM. Survival outcomes after extracorporeal cardiopulmonary resuscitation instituted during active chest compressions following refractory in-hospital pediatric cardiac arrest. Pediatr Crit Care Med 2004; 5: 440-446.
-
Cochran JB, Tecklenburg FW, Lau YR, Habib DM. Emergency cardiopulmonary bypass for cardiac arrest refractory to pediatric advanced life support. Pediatr Emerg Care 1999; 15: 30-32.
-
Bernard SA, Gray TW, Buist MD, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med 2002; 346: 557-563.
-
Doherty DR, Parshuram CS, Gaboury I, et al. Hypothermia therapy after pediatric cardiac arrest. Circulation 2009; 119: 1492-1500.
-
Álvarez J, Bouzada M, Fernández AL, et al. Hemodynamic effects of levosimendan compared with dobutamine in patients with low cardiac output after cardiac surgery. Rev Esp Cardiol 2006; 59: 338-345.
-
Oksanen T, Skrifvars MB, Varpula T, et al. Strict versus moderate glucose control after resuscitation from ventricular fibrillation. Intensive Care Med 2007; 33: 2093-2100.
-
Park WS, Chang YS, Lee M. Effects of hyperglycemia or hypoglycemia on brain cell membrane function and energy metabolism during the immediate reoxygenation-reperfusion period after acute transient global hypoxia-ischemia in the newborn piglet. Brain Res 2001; 901: 102-108.
-
Lecky F, Bryden D, Little R, Tong N, Moulton C. Emergency intubation for acutely ill and injured patients. Cochrane Database Syst Rev 2008: CD001429.
-
Calkins CM, Bensard DD, Partrick DA, Karrer FM. A critical analysis of outcome for children sustaining cardiac arrest after blunt trauma. J Pediatr Surg 2002; 37: 180-184.
-
Perron AD, Sing RF, Branas CC, Huynh T. Predicting survival in pediatric trauma patients receiving cardiopulmonary resuscitation in the prehospital setting. Prehosp Emerg Care 2001; 5: 6-9.
-
Khan TA, Schnickel G, Ross D, et al. A prospective, randomized, crossover pilot study of inhaled nitric oxide versus inhaled prostacyclin in heart transplant and lung transplant recipients. J Thorac Cardiovasc Surg 2009; 138: 1417-1424.
-
Perlman JM, Risser R. Cardiopulmonary resuscitation in the delivery room: associated clinical events. Arch Pediatr Adolesc Med 1995; 149: 20-25.
-
Barber CA, Wyckoff MH. Use and efficacy of endotracheal versus intravenous epinephrine during neonatal cardiopulmonary resuscitation in the delivery room. Pediatrics 2006; 118: 1028-1034.
-
Madar J. Resuscitation of the newborn. Anaesthesia & Intensive Care Medicine 2011; 12 (4): 135-140.
-
2005 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Part 7: Neonatal resuscitation. Resuscitation 2005; 67: 293-303.
-
Dawes GS. Foetal and Neonatal Physiology, vol. 149. Chicago: Year Book Medical Publishers; 1968.
-
Owen CJ, Wyllie JP. Determination of heart rate in the baby at birth. Resuscitation 2004; 60: 213-217.
-
Kamlin CO, Dawson JA, O’Donnell CP, et al. Accuracy of pulse oximetry measurement of heart rate of newborn infants in the delivery room. J Pediatr 2008; 152: 756-760.
-
Dawson JA, Kamlin CO, Wong C, et al. Oxygen saturation and heart rate during delivery room resuscitation of infants < 30 weeks’ gestation with air or 100% oxygen. Arch Dis Child Fetal Neonatal Ed 2009; 94: F87-91.
-
Altuncu E, Ozek E, Bilgen H, Topuzoglu A, Kavuncuoglu S. Percentiles of oxygen saturations in healthy term newborns in the first minutes of life. Eur J Pediatr 2008; 167: 687-688.
-
O’Donnell CP, Kamlin CO, Davis PG, Morley CJ. Obtaining pulse oximetry data in neonates: a randomised crossover study of sensor application techniques. Arch Dis Child Fetal Neonatal Ed 2005; 90: F84-85.
-
Wang CL, Anderson C, Leone TA, Rich W, Govindaswami B, Finer NN. Resuscitation of preterm neonates by using room air or 100% oxygen. Pediatrics 2008; 121: 1083-1089.
-
Vento M, Asensi M, Sastre J, Garcia-Sala F, Pallardo FV, Vina J. Resuscitation with room air instead of 100% oxygen prevents oxidative stress in moderately asphyxiated term neonates. Pediatrics 2001; 107: 642-647.
-
Saugstad OD, Rootwelt T, Aalen O. Resuscitation of asphyxiated newborn infants with room air or oxygen: an international controlled trial: the Resair 2 study. Pediatrics 1998; 102: e1.
-
Davis PG, Tan A, O’Donnell CP, Schulze A. Resuscitation of newborn infants with 100% oxygen or air: a systematic review and meta-analysis. Lancet 2004; 364: 1329-1333.
-
Rabi Y, Rabi D, Yee W. Room air resuscitation of the depressed newborn: a systematic review and meta-analysis. Resuscitation 2007; 72: 353-363.
-
Lakshminrusimha S, Russell JA, Steinhorn RH, et al. Pulmonary hemodynamics in neonatal lambs resuscitated with 21%, 50%, and 100% oxygen. Pediatr Res 2007; 62: 313-318.
-
Solberg R, Andresen JH, Escrig R, Vento M, Saugstad OD. Resuscitation of hypoxic newborn piglets with oxygen induces a dose-dependent increase in markers of oxidation. Pediatr Res 2007; 62: 559-563.
-
Solas AB, Kutzsche S, Vinje M, Saugstad OD. Cerebral hypoxemia-ischemia and reoxygenation with 21% or 100% oxygen in newborn piglets: effects on extracellular levels of excitatory amino acids and microcirculation. Pediatr Crit Care Med 2001; 2: 340-345.
-
Presti AL, Kishkurno SV, Slinko SK, et al. Reoxygenation with 100% oxygen versus room air: late neuroanatomical and neurofunctional outcome in neonatal mice with hypoxic-ischemic brain injury. Pediatr Res 2006; 60: 55-59.
-
Escrig R, Arruza L, Izquierdo I, et al. Achievement of targeted saturation values in extremely low gestational age neonates resuscitated with low or high oxygen concentrations: a prospective, randomized trial. Pediatrics 2008; 121: 875-881.
-
Gungor S, Kurt E, Teksoz E, Goktolga U, Ceyhan T, Baser I. Oronasopharyngeal suction versus no suction in normal and term infants delivered by elective cesarean section: a prospective randomized controlled trial. Gynecol Obstet Invest 2006; 61: 9-14.
-
Waltman PA, Brewer JM, Rogers BP, May WL. Building evidence for practice: a pilot study of newborn bulb suctioning at birth. J Midwifery Womens Health 2004; 49: 32-38.
-
Simbruner G, Coradello H, Fodor M, Havelec L, Lubec G, Pollak A. Effect of tracheal suction on oxygenation, circulation, and lung mechanics in newborn infants. Arch Dis Child 1981; 56: 326-330.
-
Al Takroni AM, Parvathi CK, Mendis KB, Hassan S, Reddy I, Kudair HA. Selective tracheal suctioning to prevent meconium aspiration syndrome. Int J Gynaecol Obstet 1998; 63: 259-263.
-
Gupta V, Bhatia BD, Mishra OP. Meconium stained amniotic fluid: antenatal, intrapartum and neonatal attributes. Indian Pediatr 1996; 33: 293-297.
-
Vyas H, Milner AD, Hopkin IE, Boon AW. Physiologic responses to prolonged and low-rise inflation in the resuscitation of the asphyxiated newborn infant. J Pediatr 981; 99: 635-639.
-
te Pas AB, Walther FJ. A randomized, controlled trial of delivery-room respiratory management in very preterm infants. Pediatrics 2007; 120: 322-329.
-
Lindner W, Hogel J, Pohlandt F. Sustained pressure-controlled inflation or intermittent mandatory ventilation in preterm infants in the delivery room? A randomized, controlled trial on initial respiratory support via nasopharyngeal tube. Acta Paediatr 2005; 94: 303-309.
-
Harling AE, Beresford MW, Vince GS, Bates M, Yoxall CW. Does sustained lung inflation at resuscitation reduce lung injury in the preterm infant? Arch Dis Child Fetal Neonatal Ed 2005; 90: F406-410.
-
Boon AW, Milner AD, Hopkin IE. Lung expansion, tidal exchange, and formation of the functional residual capacity during resuscitation of asphyxiated neonates. J Pediatr 1979; 95: 1031-1036.
-
Lindner W, Vossbeck S, Hummler H, Pohlandt F. Delivery room management of extremely low birth weight infants: spontaneous breathing or intubation? Pediatrics 1999; 103: 961-967.
-
Hillman NH, Moss TJ, Kallapur SG, et al. Brief, large tidal volume ventilation initiates lung injury and a systemic response in fetal sheep. Am J Respir Crit Care Med 2007; 176: 575-581.
-
Finer NN, Carlo WA, Duara S, et al. Delivery room continuous positive airway pressure/positive end-expiratory pressure in extremely low birth weight infants: a feasibility trial. Pediatrics 2004; 114: 651-657.
-
Siew ML, Te Pas AB, Wallace MJ, et al. Positive end-expiratory pressure enhances development of a functional residual capacity in preterm rabbits ventilated from birth. J Appl Physiol 2009; 106: 1487-1493.
-
te Pas AB, Siew M, Wallace MJ, et al. Establishing functional residual capacity at birth: the effect of sustained inflation and positive end-expiratory pressure in a preterm rabbit model. Pediatr Res 2009; 65: 537-541.
-
Polglase GR, Hooper SB, Gill AW, et al. Cardiovascular and pulmonary consequences of airway recruitment in preterm lambs. J Appl Physiol 2009; 106: 1347-1355.
-
Probyn ME, Hooper SB, Dargaville PA, et al. Positive end expiratory pressure during resuscitation of premature lambs rapidly improves blood gases without adversely affecting arterial pressure. Pediatr Res 2004; 56: 198-204.
-
Morley CJ, Davis PG, Doyle LW, Brion LP, Hascoet JM, Carlin JB. Nasal CPAP or intubation at birth for very preterm infants. N Engl J Med 2008; 358: 700-708.
-
Oddie S, Wyllie J, Scally A. Use of self-inflating bags for neonatal resuscitation. Resuscitation 2005; 67: 109-112.
-
Hussey SG, Ryan CA, Murphy BP. Comparison of three manual ventilation devices using an intubated mannequin. Arch Dis Child Fetal Neonatal Ed 2004; 89: F490-493.
-
Trevisanuto D, Micaglio M, Pitton M, Magarotto M, Piva D, Zanardo V. Laryngeal mask airway: is the management of neonates requiring positive pressure ventilation at birth changing? Resuscitation 2004; 62: 151-157.
-
Capasso L, Capasso A, Raimondi F. A randomized trial comparing oxygen delivery on intermittent positive pressure with nasal cannulae versus facial mask in neonatal primary resuscitation. Acta Paediatr 2005; 94: 197-200.
-
Kattwinkel J, Stewart C, Walsh B, Gurka M, Paget-Brown A. Responding to compliance changes in a lung model during manual ventilation: perhaps volume, rather than pressure, should be displayed. Pediatrics 2009; 123: e465-470.
-
Resende JG, Zaconeta CA, Ferreira AC, et al. Evaluation of peak inspiratory pressure, tidal volume and respiratory rate during ventilation of premature lambs using a self-inflating bag. J Pediatr (Rio J) 2006; 82: 279-283.
-
Wood FE, Morley CJ, Dawson JA, et al. Improved techniques reduce face mask leak during simulated neonatal resuscitation: study 2. Arch Dis Child Fetal Neonatal Ed 2008; 93: F230-234.
-
Repetto JE, Donohue P-CP, Baker SF, Kelly L, Nogee LM. Use of capnography in the delivery room for assessment of endotracheal tube placement. J Perinatol 2001; 21: 284-287.
-
Roberts WA, Maniscalco WM, Cohen AR, Litman RS, Chhibber A. The use of capnography for recognition of esophageal intubation in the neonatal intensive care unit. Pediatr Pulmonol 1995; 19: 262-268.
-
Aziz HF, Martin JB, Moore JJ. The pediatric disposable end-tidal carbon dioxide detector role in endotracheal intubation in newborns. J Perinatol 1999; 19: 110-113.
-
Leone TA, Lange A, Rich W, Finer NN. Disposable colorimetric carbon dioxide detector use as an indicator of a patent airway during noninvasive mask ventilation. Pediatrics 2006; 118: 202-204.
-
Berg RA, Hilwig RW, Kern KB, Babar I, Ewy GA. Simulated mouth-to-mouth ventilation and chest compressions (bystander cardiopulmonary resuscitation) improves outcome in a swine model of prehospital pediatric asphyxia cardiac arrest. Crit Care Med 1999; 27: 1893-1899.
-
Berg RA, Hilwig RW, Kern KB, Ewy GA. “Bystander” chest compressions and assisted ventilation independently improve outcome from piglet asphyxia pulseless “cardiac arrest”. Circulation 2000; 101: 1743-1748.
-
Babbs CF, Nadkarni V. Optimizing chest compression to rescue ventilation ratios during one-rescuer CPR by professionals and lay persons: children are not just little adults. Resuscitation 2004; 61: 173-181.
-
Srikantan SK, Berg RA, Cox T, Tice L, Nadkarni VM. Effect of one-rescuer compression/ventilation ratios on cardiopulmonary resuscitation in infant, pediatric, and adult manikins. Pediatr Crit Care Med 2005; 6: 293-297.
-
Whyte SD, Sinha AK, Wyllie JP. Neonatal resuscitation-a practical assessment. Resuscitation 1999; 40: 21-25.
-
Greingor JL. Quality of cardiac massage with ratio compression-ventilation 5/1 and 15/2. Resuscitation 2002; 55: 263-267.
-
Dorph E, Wik L, Steen PA. Effectiveness of ventilation-compression ratios 1:5 and 2:15 in simulated single rescuer paediatric resuscitation. Resuscitation 2002; 54: 259-264.
-
Haque IU, Udassi JP, Udassi S, Theriaque DW, Shuster JJ, Zaritsky AL. Chest compression quality and rescuer fatigue with increased compression to ventilation ratio during single rescuer pediatric CPR. Resuscitation 2008; 79: 82-89.
-
Orlowski JP. Optimum position for external cardiac compression in infants and young children. Ann Emerg Med 1986; 15: 667-673.
-
Phillips GW, Zideman DA. Relation of infant heart to sternum: its significance in cardiopulmonary resuscitation. Lancet 1986; 1: 1024-1025.
-
Braga MS, Domínguez TE, Pollock AN, et al. Estimation of optimal CPR chest compression depth in children by using computer tomography. Pediatrics 2009; 124: e69-74.
-
Houri PK, Frank LR, Menegazzi JJ, Taylor R. A randomized, controlled trial of two-thumb vs two-finger chest compression in a swine infant model of cardiac arrest. Prehosp Emerg Care 1997; 1: 65-67.
-
David R. Closed chest cardiac massage in the newborn infant. Pediatrics 1988; 81: 552-554.
-
Thaler MM, Stobie GH. An improved technique of external caridac compression in infants and young children. N Engl J Med 1963; 269: 606-610.
-
Perondi MB, Reis AG, Paiva EF, Nadkarni VM, Berg RA. A comparison of highdose and standard-dose epinephrine in children with cardiac arrest. N Engl J Med 2004; 350: 1722-1730.
-
Patterson MD, Boenning DA, Klein BL, et al. The use of high-dose epinephrine for patients with out-of-hospital cardiopulmonary arrest refractory to prehospital interventions. Pediatr Emerg Care 2005; 21: 227-237.
-
Vandycke C, Martens P. High dose versus standard dose epinephrine in cardiac arrest-a meta-analysis. Resuscitation 2000; 45: 161-166.
-
Jankov RP, Asztalos EV, Skidmore MB. Favourable neurological outcomes following delivery room cardiopulmonary resuscitation of infants < or = 750 g at birth. J Paediatr Child Health 2000; 36: 19-22.
-
O’Donnell AI, Gray PH, Rogers YM. Mortality and neurodevelopmental outcome for infants receiving adrenaline in neonatal resuscitation. J Paediatr Child Health 1998; 34: 551-556.
-
Crespo SG, Schoffstall JM, Fuhs LR, Spivey WH. Comparison of two doses of endotracheal epinephrine in a cardiac arrest model. Ann Emerg Med 1991; 20: 230-234.
-
Jasani MS, Nadkarni VM, Finkelstein MS, Mandell GA, Salzman SK, Norman ME. Effects of different techniques of endotracheal epinephrine administration in pediatric porcine hypoxic-hypercarbic cardiopulmonary arrest. Crit Care Med 1994; 22: 1174-1180.
-
Kirkman HN, Riley Jr HD. Posthemorrhagic anemia and shock in the newborn due to hemorrhage during delivery; report of 8 cases. Pediatrics 1959; 24: 92-96.
-
Wyckoff M, Garcia D, Margraf L, Perlman J, Laptook A. Randomized trial of volume infusion during resuscitation of asphyxiated neonatal piglets. Pediatr Res 2007; 61: 415-420.
-
Mayock DE, Gleason CA. Cerebrovascular effects of rapid volume expansion in preterm fetal sheep. Pediatr Res 2004; 55: 395-399.
-
Ellemunter H, Simma B, Trawoger R, Maurer H. Intraosseous lines in preterm and full term neonates. Arch Dis Child Fetal Neonatal Ed 1999; 80: F74-75.
-
Glaeser PW, Hellmich TR, Szewczuga D, Losek JD, Smith DS. Five-year experience in prehospital intraosseous infusions in children and adults. Ann Emerg Med 1993; 22: 1119-1124.
-
Box D, Cochran D. Safe reduction in administration of naloxone to newborn infants: an observational study. Acta Paediatr 2006; 95: 1083-1086.
-
Gibbs J, Newson T, Williams J, Davidson DC. Naloxone hazard in infant of opioid abuser. Lancet 1989; 2: 159-160.
-
Cramer K, Wiebe N, Hartling L, Crumley E, Vohra S. Heat loss prevention: a systematic review of occlusive skin wrap for premature neonates. J Perinatol 2005; 25: 763-769.
-
Vohra S, Roberts RS, Zhang B, Janes M, Schmidt B. Heat loss prevention (HeLP) in the delivery room: a randomized controlled trial of polyethylene occlusive skin wrapping in very preterm infants. J Pediatr 2004; 145: 750-753.
-
Singh A, Duckett J, Newton T, Watkinson M. Improving neonatal unit admission temperatures in preterm babies: exothermic mattresses, polythene bags or a traditional approach? J Perinatol 2010; 30: 45-49.
-
Kent AL, Williams J. Increasing ambient operating theatre temperature and wrapping in polyethylene improves admission temperature in premature infants. J Paediatr Child Health 2008; 44: 325-331.
-
Petrova A, Demissie K, Rhoads GG, Smulian JC, Marcella S, Ananth CV. Association of maternal fever during labor with neonatal and infant morbidity and mortality. Obstet Gynecol 2001; 98: 20-27.
-
Coimbra C, Boris-Moller F, Drake M, Wieloch T. Diminished neuronal damage in the rat brain by late treatment with the antipyretic drug dipyrone or cooling following cerebral ischemia. Acta Neuropathol 1996; 92: 447-453.
-
Goetzl L, Zighelboim I, Badell M, et al. Maternal corticosteroids to prevent intrauterine exposure to hyperthermia and inflammation: a randomized, double-blind, placebo-controlled trial. Am J Obstet Gynecol 2006; 195: 1031-1037.
-
Gluckman PD, Wyatt JS, Azzopardi D, et al. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomized trial. Lancet 2005; 365: 663-670.
-
Shankaran S, Laptook AR, Ehrenkranz RA, et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med 2005; 353: 1574-1584.
-
Azzopardi DV, Strohm B, Edwards AD, et al. Moderate hypothermia to treat perinatal asphyxial encephalopathy. N Engl J Med 2009; 361: 1349-1358.
-
Ondoa-Onama C, Tumwine JK. Immediate outcome of babies with low Apgar score in Mulago Hospital, Uganda. East Afr Med J 2003; 80: 22-29.
-
Klein GW, Hojsak JM, Schmeidler J, Rapaport R. Hyperglycemia and outcome in the pediatric intensive care unit. J Pediatr 2008; 153: 379-384.
-
LeBlanc MH, Huang M, Patel D, Smith EE, Devidas M. Glucose given after hypoxic ischemia does not affect brain injury in piglets. Stroke 1994; 25: 1443-1447 [discussion 8].
-
Hattori H, Wasterlain CG. Posthypoxic glucose supplement reduces hypoxicischemic brain damage in the neonatal rat. Ann Neurol 1990; 28: 122-128.
-
McDonald SJ, Middleton P. Effect of timing of umbilical cord clamping of term infants on maternal and neonatal outcomes. Cochrane Database Syst Rev 2008:CD004074.
-
Rabe H, Reynolds G, Díaz-Rossello J. A systematic review and meta-analysis of a brief delay in clamping the umbilical cord of preterm infants. Neonatology 2008; 93: 138-144.
-
De Leeuw R, Cuttini M, Nadai M, et al. Treatment choices for extremely preterm infants: an international perspective. J Pediatr 2000; 137: 608-616.
-
Casalaz DM, Marlow N, Speidel BD. Outcome of resuscitation following unexpected apparent stillbirth. Arch Dis Child Fetal Neonatal Ed 1998; 78: F112-115.
-
Jain L, Ferre C, Vidyasagar D, Nath S, Sheftel D. Cardiopulmonary resuscitation of apparently stillborn infants: survival and long-term outcome. J Pediatr 1991; 118: 778-782.


 Creative Commons Attribution
Creative Commons Attribution