Carolina Pelayo Varela1, Prudencio Lozano Iragüen1, Evelyn Benavides Simon2
Recibido: 25-01-2018
Aceptado: 04-03-2018
©2018 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 47 Núm. 2 pp. 102-109|https://doi.org/10.25237/revchilanestv47n02.07
PDF|ePub|RIS
Preoperative evaluation of Obstructve sleep apnea (OSA) as a perioperative risk factor
Abstract
Obstructive sleep apnea (OSA) is a common sleep related breathing disorder in the general population and polysomnography is the gold standard method for the diagnosis. It has a higher prevalence among elective surgical patients, however it remains as an underdiagnosed condition that is associated with significant morbidity and mortality in the perioperative setting. The aim of this review article is to highlight the role of the anesthesiologist in the preoperative assessment, based on current available evidence and suggest some strategies to identify patients at higher risk.
Resumen
El síndrome de apnea obstructive es un desorden frecuente de la respiración durante el sueño. La polisomnografía es su método diagnostico. Si bien tiene una alta prevalencia en pacientes quirúrgicos electivos, están subdiagnósticados y su presencia a morbimortalidad perioperatoria. El objetivo de esta revisión es validar el rol del anestesiólogo en la evaluación preoperatoria y sugerir estrategias para identificar a pacientes de alto riesgo.
Introducción
El síndrome de apnea-hipoapnea obstructiva del sueño (SAHOS) es un trastorno respiratorio que se produce durante el sueño y tiene una alta prevalencia en la población general de un 2 a 7%[1],[2],[3]. Se caracteriza por episodios intermitentes y recurrentes de obstrucción parcial o completa de la vía aérea superior durante el sueño, lo que resulta en un flujo reducido o ausente de aire, produciendo despertares o micro-despertares para restablecer el flujo en la vía aérea. Estos episodios alteran la arquitectura del sueño, causando la fragmentación de éste y, en consecuencia, provocando somnolencia diurna[1],[2]. La presencia de SAHOS se ha asociado a múltiples comorbilidades; hipertensión arterial, diabetes mellitus, mayor incidencia de accidentes cerebrovasculares, insuficiencia cardiaca congestiva, entre otras. Además se ha visto que los pacientes con SAHOS tienen mayor mortalidad que la población general[2].
El diagnóstico de SAHOS requiere la demostración objetiva de respiración anormal durante el sueño, mediante la medición de eventos respiratorios (apnea, hipoapnea y despertares relacionados al esfuerzo respiratorio) por hora de sueño[1]. El SAHOS se define por la combinación de síntomas y un índice de eventos/ hora mayor o igual a 5 o un índice de eventos/hora mayor o igual 15 en ausencia de síntomas[1]. La prevalencia de SAHOS en pacientes que se van a someter a cirugía es notoriamente mayor que en la población general y varía según el tipo de procedimiento. Algunas series han documentado una prevalencia cercana al 20% en cirugías de todo tipo, llegando a una prevalencia mayor al 70% en pacientes candidatos a cirugía bariátrica[2],[4]. No obstante la alta prevalencia de SAHOS en estos pacientes, sigue siendo un trastorno sub diagnosticado. Un estudio prospectivo incluyó 2.877 pacientes que se iban a someter a cirugía electiva de diversos tipos, demostró que de ellos un 23,7% tenían alto riesgo de SAHOS y en aquellos en que se pudo realizar estudio de confirmación, un 82% de los individuos padecían la enfermedad[5]. Cabe destacar que un 82% a 93% de pacientes en que se hizo el diagnóstico de SAHOS, no tenían el diagnóstico previo a la cirugía. De esta forma, el anestesiólogo es con frecuencia el primer médico en enfrentarse a pacientes no diagnosticados[6].
En relación al riesgo peri-operatorio en pacientes con SAHOS, un número creciente de estudios observacionales han reportado una asociación contundente entre SAHOS y múltiples complicaciones peri operatorias graves[5]-[10] (Tabla 1) (Anexo 1. Complicaciones Peri operatorias relacionadas a pacientes portadores de SAHOS. Adaptado de Fassbender et al[6].
Existe evidencia para suponer que el diagnóstico previo de SAHOS en los pacientes que se van a someter a cirugía electiva, se asocia a menores complicaciones peri-operatorias. Un estudio retrospectivo multicéntrico comparó la tasa de complicaciones peri-operatorias en pacientes con SAHOS confirmado y pacientes con sospecha de SAHOS al momento de la cirugía. Se encontró que los pacientes con SAHOS diagnosticado previamente tenían la misma tasa de complicaciones respiratorias que los pacientes con sospecha de SAHOS, sin embargo, los últimos presentaron mayor tasa de ingreso a la unidad de cuidados intensivos; mayor estadía hospitalaria y mayor tasa de mortalidad post-operatoria a 30 días[11]. En opinión de los autores, los pacientes con SAHOS diagnosticados motivan una mayor atención y optimización en los cuidados anestésicos respiratorios que aquellos pacientes sin SAHOS confirmado, lo que explicaría estos hallazgos[11].
A la luz de lo descrito, resulta necesario que el médico anestesiólogo tenga un alto nivel de sospecha de SAHOS previo a la cirugía y disponer los cuidados necesarios para evitar complicaciones. Esta revisión pretende enfatizar la importancia de la pesquisa pre-quirúrgica de SAHOS.
Identificación del paciente con SAHOS
Como se ha revisado, los pacientes con SAHOS que se van a someter a cirugía tienen riesgo mayor de complicaciones peri-operatorias que la población general. Además, existe evidencia para suponer que el diagnóstico previo de SAHOS, protege al paciente frente a ciertas complicaciones. Lo anterior hace ver con preocupación de que un número considerable de pacientes con SAHOS que se van a someter a cirugía no han sido diagnosticados previamente. Dadas las potenciales complicaciones peri-operatorias en este grupo de pacientes, la sociedad americana de Anestesiología además de múltiples revisiones de la literatura, recomiendan el tamizaje pre-operatorio de SAHOS[9],[12]. Anestesiólogos deben trabajar en conjunto con cirujanos para desarrollar un protocolo para aquellos pacientes en que existe sospecha de SAHOS.
Una evaluación pre-quirúrgica debe incluir una revisión de los antecedentes médicos del paciente, eventuales complicaciones peri-quirúrgicas previas, entrevista al paciente y a familiares, en particular aquellos que han sido testigos del sueño. En la literatura se han propuesto dos modelos principales de tamizaje preoperatorio en pacientes con sospecha de SAHOS, resumidos en la Figura 1 y 2[34]. La identificación de un paciente con SAHOS se inicia con la historia, examen físico y luego la aplicación, si corresponde, de las pruebas de tamizaje.
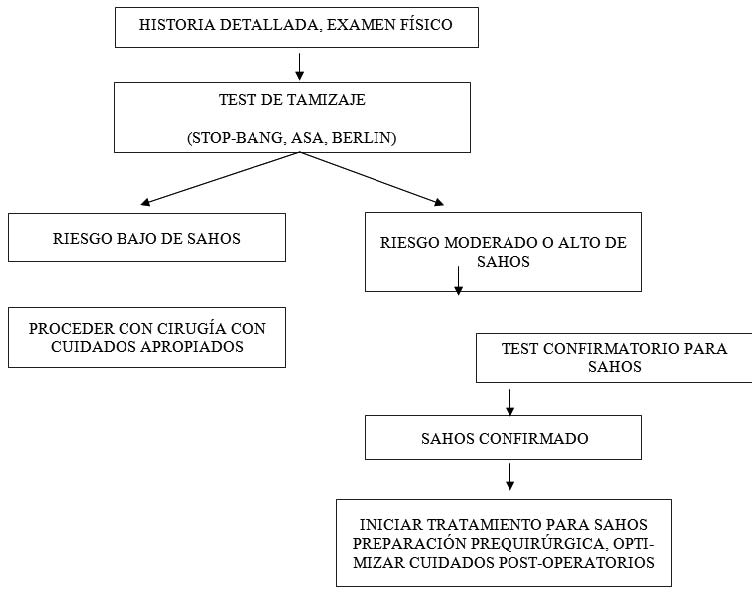
Figura 1 Algoritmo “en dos bloques” propuesto para manejo de pacientes portadores de SAHOS que se van a someter a cirugía[34]. Adaptado de Verbraecken J, Hedner J, Penzel T. Pre-operative screening for obstructive sleep apnoea. Eur Respir Rev 2017; 26:160012.
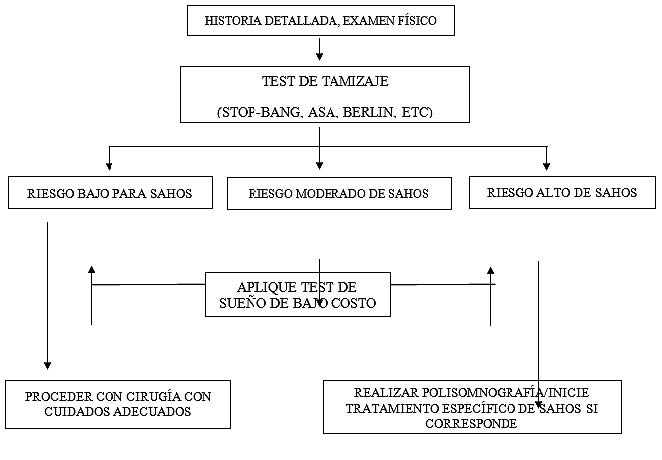
Figura 2 Algoritmo “en tres bloques” propuesto para manejo de pacientes portadores de SAHOS que se van a someter a cirugía(34) Adaptado de Verbraecken J, Hedner J, Penzel T. Pre-operative screening for obstructive sleep apnoea. Eur Respir Rev 2017; 26: 160012
Historia y examen físico
La identificación de esta patología puede con frecuencia ser un desafío para el equipo de salud un paciente que se va a someter a cirugía. Aún en poblaciones en las que el SAHOS tiene una alta prevalencia, como lo son los pacientes con patología cardiovascular, pudieras estar ausentes signos cardinales de la enfermedad. Es importante siempre obtener además la anamnesis aportada por un tercero para recabar la información necesaria, en particular en casos de testigos de los momentos en que el paciente duerme[12]. Deben hacerse preguntas dirigidas sobre los síntomas y signos cardinales de la enfermedad (vide infra).
Factores de riesgo
En primer lugar, se debe tener en consideración los factores de riesgo para desarrollar la patología para su exploración dirigida.
1) Sobrepeso, obesidad, síndrome metabólico y alteraciones en el metabolismo de la glucosa, siendo la obesidad es el principal factor de riesgo para SAHOS[1].
2) Edad: la prevalencia y morbimortalidad de SAHOS aumentan con la edad y tienen un pico a los 55 años. Sin embargo, la severidad disminuye en los pacientes más añosos[13],[14].
3) Género: mayor frecuencia en hombres, en una relación de hombre: mujer de 2 – 4: 1. Estudios sugieren que una relación relativamente alta de la relación progesterona/estrógeno y niveles bajos de testosterona podrían tener un rol protector. Varios estudios han mostrado que la administración intramuscular de testosterona podría predisponer a SAHOS y que la administración de testosterona podría tener un rol en la modulación central de la respiración[15].
4) Menopausia y Síndrome de Ovario Poliquístico: la incidencia aumenta en mujeres post menopáusicas. Algunos estudios han reportado que la terapia de reemplazo hormonal podría disminuir la severidad del SAHOS. Por su parte, la prevalencia de SAHOS ha sido reportada hasta en un 60% de mujeres con SOP[16],[17].
5) Tabaco: la exposición pasiva diaria al humo del cigarro en sujetos que nunca habían fumado se asoció a 1,6 veces mayor riesgo de ser roncadores[18],[19]. En un estudio de cohorte se vio que fumadores activos tenían 4,4 veces mayor riesgo de tener un SAHOS moderado o de empeoramiento de un SAHOS versus individuos que nunca han fumado[20]. Sin embargo, existen discrepancias en la literatura al respecto.
6) Predisposición genética y hereditaria: familiares de primer grado de pacientes con SAHOS tienen el doble de riesgo que aquellos sin la patología y la susceptibilidad a presentar la patología aumenta directamente con el número de familiares afectados[21],[22].
Síntomas y signos cardinales
Somnolencia diurna excesiva: definida por la Academia Americana de Medicina del Sueño como somnolencia que ocurre en una situación en la que un individuo esperaría estar despierto y alerta. Existen varias escalas que evalúan la percepción subjetiva de somnolencia y los grados de alerta. En los pacientes con SAHOS el síntoma cardinal es la somnolencia diurna excesiva. Sin embargo, muchos pacientes pueden no reportarlo y minimizar el síntoma. La híper-somnolencia puede ser provocada por el mismo SAHOS o por las comorbilidades asociadas y/o fármacos[1].
El estándar de oro para la medición objetiva y subjetiva de somnolencia son el test de latencias múltiples de sueño y el test de mantención de vigilia, respectivamente. El test de latencias múltiples de sueño se realiza entre una hora y media y tres horas posteriores al polisomnograma y evalúa la latencia de sueño y las etapas del sueño alcanzadas en 4 o 5 siestas separadas por intervalos de dos horas. Su indicación no es de rutina; debe realizarse en pacientes con SAHOS con sospecha de narcolepsia[23],[24].
El segundo test es una medida validada y objetiva de la capacidad de permanecer despierto por un período de tiempo definido. El paciente se sienta en la cama y debe mantenerse despierto por el mayor tiempo posible. Una latencia promedio menor a 15 – 20 minutos en el test de 40 minutos se considera anormal[24],[25].
Sin embargo, se debe tomar en consideración la clínica, hábitos de sueño, fármacos y adherencia a tratamientos en la evaluación de estos pacientes y el diagnóstico y decisiones clínicas no deben basarse sólo en el resultado de estas pruebas.
Fatiga: definida como la sensación abrumadora de cansancio, falta de energía y sensación de estar exhausto, asociada a una alteración en el funcionamiento físico y/o cognitivo. La fatiga es un síntoma ampliamente reportado en pacientes con SAHOS y puede ser más molesto que la somnolencia excesiva[26]. Mayores niveles de fatiga se han asociado con una mayor severidad de síntomas depresivos en estos pacientes[27].
Ronquidos, apneas y asfixias nocturnas: la prevalencia de ronquido en la población general es de un 15 a 47% en hombres y un 6 a 33% en mujeres[28]. El ronquido es un síntoma predominante en los pacientes con SAHOS y se asocia a la posición al dormir. Habitualmente es el compañero de habitación o cama quien lo reporta. En hasta un 75% de los pacientes que niegan roncar se logra comprobar que sí lo hacen mediante mediciones objetivas. Las apneas y asfixias nocturnas también son habitualmente reportadas por un tercero y existen hasta en un 6% de la población sana[1].
Nicturia: definida por la Sociedad Internacional de Continencia por despertar una o más veces en la noche a orinar. En general se considera nicturia si el paciente se levanta dos o más veces en la noche [29]. El número de veces que se levanta a orinar en la noche se ha correlacionado con la severidad del SAHOS [30].
Los mecanismos propuestos incluyen un aumento de los niveles de péptido natriurético atrial. Por otro lado, los eventos respiratorios obstructivos combinados con un esfuerzo ventilatorio sostenido generan una presión negativa intra-torácica, haciendo que el corazón reciba una “falsa” señal de sobrecarga de volumen y, por lo tanto, una mayor secreción de péptido natriurético atrial y una mayor producción de orina (1).
Depresión, ansiedad, hipocondrías, síntomas conversivos; delirium y conductas homicidas : hasta un 50% de pacientes con SAHOS presentan síntomas depresivos y serían más frecuentes en mujeres. Sin embargo, no está claro que exista una asociación independiente entre depresión y SAHOS[1].
Alteraciones cognitivas: un meta-análisis mostró que la vigilancia, coordinación motora y funciones ejecutivas pueden estar alteradas en adultos con apnea del sueño no tratada, mientras que la inteligencia y habilidades de percepción auditiva y visual no se afectarían[31]. Se describe que estos pacientes presentan alteraciones de memoria, incluyendo memoria episódica verbal, visual y memoria procedural. Se ha visto que la memoria mejora, el menos parcialmente, con tratamiento efectivo del SAHOS. El mecanismo sería la fragmentación del sueño e hipoxia nocturna intermitente[32],[33].
Examen físico
En general, el examen físico de un paciente con SAHOS mostrará signos de condiciones relacionadas con la enfermedad[12]. Algunos signos que pueden sugerir la presencia de un SAHOS incluyen: aumento en la circunferencia del cuello (mayor a 43 cm en hombres y mayor a 41 cm en mujeres); IMC mayor o igual a 30; score de Mallampati de 3 o 4 y la presencia de retrognatia. Estrechamiento lateral peri-tonsilar, macroglosia, hipertrofia tonsilar, úvula elongada, paladar hendido y anormalidades nasales (pólipos, desviación, hipertrofia de cornetes)[1].
Las alteraciones en la anatomía craneofacial son un factor de riesgo establecido para desarrollo de SAHOS. Anormalidades en los tejidos óseos y blandos de la vía aérea superior pueden comprometer el espacio faríngeo y aumentar el riesgo de eventos respiratorios obstructivos durante el sueño. Estas alteraciones incluyen: disminución del tamaño del cuerpo mandibular, posición inferior del hueso hioides, retro-posición del maxilar. Un meta-análisis mostró que la longitud del cuerpo mandibular tenía una fuerte asociación con el desarrollo de SAHOS[18]. Respecto a las alteraciones de tejidos blandos se han descrito la hipertrofia tonsilar, edema submucoso y exceso de grasa en las paredes laterales faríngea[18].
Cuestionarios de tamizaje
La polisomnografía se considera el estándar de oro para el diagnóstico de SAHOS, mediante el cálculo del número promedio de episodios de apnea – hipoapnea por hora[1]. No obstante, en el escenario peri-operatorio es un test difícil de implementar por sus costos, aumento de estadía hospitalaria y, muchas veces, poco accesible.
Existen múltiples cuestionarios disponibles con el fin de identificar pacientes con riesgo de tener SAHOS que han demostrado ser eficientes, económicos y fáciles de aplicar. Estos incluyen variables como factores de riesgo, síntomas clínicos y elementos del examen físico. Tres cuestionarios han sido validados en población quirúrgica; El Cuestionario de Berlín, “ASA checklist” y el cuestionario STOP-BANG[4].
El cuestionario de Berlín fue ideado el año 1996 en Berlín, Alemania. Este cuestionario tiene alta sensibilidad para identificar pacientes con riesgo moderado o alto de SAHOS, aunque con discreta especificidad[34].Consiste en una encuesta auto-administrada de diez preguntas agrupadas en tres categorías de síntomas (ronquido, somnolencia diurna y comorbilidades). Se considera un alto riesgo si los síntomas fueron positivos en dos o más de las tres categorías[4]. Fue validado en población quirúrgica, encontrando una sensibilidad de 74,3% a 79,5% y un valor predictivo negativo de 76% a 89,3% para identificar pacientes con riesgo moderado o alto[35]. La principal crítica a este test radica en su aplicación lenta y lo engorroso del cálculo del puntaje total. En la actualidad, es la herramienta de mayor uso en la evaluación de pacientes sometidos a cirugía[2].
Otro test de tamizaje difundido es el “checklist” de la Sociedad Americana de Anestesiología. La versión de adultos incluye 12 ítems. Ha mostrado tener una sensibilidad de 78,6% a 87,2% y un valor predictivo negativo de 72,7 a 90,9% en identificar a pacientes quirúrgicos con SAHOS moderado a severo[2].
El cuestionario STOP-BANG (acrónimo de las palabras en inglés Snoring, Tiredness during day- time, Observed apnea, high blood Pressure, Body mass index, Age, Neck circumference, Gender) es un cuestionario sencillo, fácil de contestar y auto-administrado que ha sido validado en sujetos que se van a someter a cirugía. Consiste en ocho preguntas de respuestas “sí / no” que abarcan signos, síntomas y medidas antropométricas. Cada ítem recibe un punto si está presente y el puntaje final permite estratificar el riesgo de SAHOS en leve (0 a 2), moderado (3 a 4) o alto (5 a 8)[4].
En la Tabla 2 se muestran los parámetros estadísticos para los principales cuestionarios de Tamizaje (Ver Anexo 2. Adaptado de Lyons et al.[9].
Existe evidencia contundente para confiar en el rendimiento que tienen las pruebas de tamizaje para el diagnóstico de SAHOS[4], un análisis más acabado de cada prueba por separado no es el objetivo de esta revisión. Tal como se mencionó al inicio de esta revisión, el SAHOS se ha asociado a mayor incidencia de múltiples complicaciones perioperatorias. En consecuencia, una interrogante que se ha planteado, es si la aplicación de estos test serían capaces de predecir la mayor frecuencia de complicaciones que se observa en pacientes con SAHOS ya confirmado.
Un estudio multicéntrico demostró que los adultos que ingresaban en forma electiva para cirugía y que eran clasificados como alto riesgo de SAHOS (STOP-Bang mayor o igual a 5) tenían una mayor frecuencia de dificultades en el proceso de intubación en comparación con aquellos con bajo riesgo (20% versus 9%, OR 1,86) y mayores dificultades en ventilación con máscara (23% versus 7%; OR 2,06)[36]. También se vio que el índice de masa corporal y un ASA mayor o igual 3 se asociaban en forma independiente a dificultades en ventilación con máscara y complicaciones post operatorias.
Otro estudio evaluó la dificultad en el manejo de la vía aérea en tres grupos de pacientes con obesidad mórbida sometidos a cirugía bariátrica (un grupo de pacientes con SAHOS previamente diagnosticado; pacientes con STOP-Bang mayor o igual a 3 y otro grupo de pacientes con STOP-Bang < 3)[37]. Aquellos pacientes con SAHOS confirmado, en conjunto con los pacientes sin diagnóstico confirmado, pero con puntajes de STOP-Bang mayor o igual a 3, tenían mayor riesgo de presentar dificultades en el manejo de la vía aérea versus aquellos con bajo riesgo para SAHOS (p < 0,001)[37].
En relación a otras complicaciones, el estudio de Corso et al.[36] mostró que los pacientes con alto riesgo de SAHOS tenían mayor riesgo de complicaciones respiratorias y cardiacas en el post operatorio (OR 3,98, IC 1,69 – 9,37) versus aquellos con puntajes menores a 5 en el cuestionario de STOP-Bang.
En el estudio de Vasu et al. Los pacientes con puntajes mayores o iguales a 3 tenían mayores complicaciones cardiacas y respiratorias (19,6% versus 1,3%, p < 0,001). Además, aquellos pacientes obesos mórbidos sometidos a cirugía bariátrica con puntajes mayores o iguales a 3 tuvieron mayor estadía post-operatoria (4,1 vs 2,5, p < 0,0001) y mayor tasa de neumonía y necesidad de re-intubación post cirugía[4].
Un meta-análisis reciente comparó la incidencia de complicaciones post operatorias entre pacientes con alto riesgo de SAHOS versus los de bajo riesgo en pacientes que se iban a someter a procedimientos quirúrgicos. Las complicaciones post operatorias fueron casi 4 veces más altas en el grupo de alto riesgo y la duración de hospitalización fue de dos días más en este grupo[38].
En resumen, existe evidencia que tanto el ASA checklist, el Cuestionario de Berlín y el cuestionario STOP-Bang pueden ser capaces de predecir complicaciones post operatorias[4]. Los distintos protocolos de manejo que se plantean en la literatura consideran la aplicación de estos test como parte de la estratificación del riesgo del paciente a padecer SAHOS[9],[12],[34].
Sin embargo, esta evidencia se ve limitada por la heterogeneidad entre las poblaciones incluidas en los diferentes estudios; los resultados medidos y los criterios de inclusión. Se requieren mayores estudios sobre estos cuestionarios, con énfasis en los tipos específicos de cirugías y mayor profundidad en el análisis estadístico de los resultados, considerando los subgrupos de pacientes y ajustando los posibles factores confundentes[4].
Conclusión
El síndrome de apnea-hipoapnea obstructiva del sueño (SAHOS) es un trastorno respiratorio que se produce durante el sueño y tiene una alta prevalencia en la población general. La prevalencia de SAHOS en pacientes que se van a someter a cirugía es mayor y depende del tipo de cirugía.
Múltiples estudios han establecido de forma consistente que pacientes con SAHOS presentan un mayor riesgo peri-operatorio dados por hipoxemia postoperatoria, cardiopatía isquémica, inestabilidad hemodinámica y arritmias, entre otras. En todo paciente con factores de riesgo para SAHOS que se vaya a someter a una cirugía electiva es necesaria la pesquisa meticulosa de los síntomas y signos, y si corresponde, la aplicación de test que permitan estratificar el riesgo del paciente. Actualmente existen varios cuestionarios disponibles para identificar un alto riesgo de SAHOS, los cuales han demostrado ser eficientes, económicos y fáciles de aplicar.
La realización de estudios confirmatorios de SAHOS tiene alto costo, demanda tiempo y es poco disponible. Teniendo en cuenta la utilidad de los test de tamizaje descritos previamente, en su capacidad de predecir complicaciones perioperatorias, se ha puesto en duda la necesidad de confirmar el diagnóstico de SAHOS y de esta forma considerar en la práctica a los pacientes de moderado y alto grado como pacientes “confirmados”. La evidencia actual no es suficiente para plantear que la terapia a presión positiva pre-operatoria disminuya la morbilidad perioperatoria del paciente.
Con el propósito de promover la búsqueda dirigida de potenciales portadores de SAHOS en la evaluación pre-quirúrgica, la Sociedad Americana de Anestesiología y otras múltiples revisiones de la literatura, han propuesto recomendaciones de enfrentamiento y algoritmos de manejo. Para su correcta aplicabilidad es condición sine qua non el trabajo conjunto del cirujano y el anestesiólogo.
Referencias
1. Lurie A. Obstructive sleep apnea in adults: epidemiology, clinical presentation, and treatment options. Adv Cardiol. 2011;46:1–42. https://doi.org/10.1159/isbn.978-3-8055-9646-6 PMID:22005188
2. Vasu TS, Grewal R, Doghramji K. Obstructive sleep apnea syndrome and perioperative complications: a systematic review of the literature. J Clin Sleep Med. 2012 Apr;8(2):199–207. PMID:22505868
3. Punjabi NM. The epidemiology of adult obstructive sleep apnea. Proc Am Thorac Soc. 2008 Feb;5(2):136–43. https://doi.org/10.1513/pats.200709-155MG PMID:18250205
4. Dimitrov L, Macavei V. Can Screening Tools for Obstructive Sleep Apnea Predict Postoperative Complications? A Systematic Review of the Literature. J Clin Sleep Med. 2016 Sep;12(9):1293–300. https://doi.org/10.5664/jcsm.6136 PMID:27448417
5. Finkel KJ, Searleman AC, Tymkew H, Tanaka CY, Saager L, Safer-Zadeh E, et al. Prevalence of undiagnosed obstructive sleep apnea among adult surgical patients in an academic medical center. Sleep Med. 2009 Aug;10(7):753–8. https://doi.org/10.1016/j.sleep.2008.08.007 PMID:19186102
6. Fassbender P, Herbstreit F, Eikermann M, Teschler H, Peters J. Obstructive sleep apnea—a perioperative risk factor. Dtsch Arztebl Int. 2016 Jul;113(27-28):463–9. PMID:27476705
7. Kaw R, Chung F, Pasupuleti V, Mehta J, Gay PC, Hernandez AV. Meta-analysis of the association between obstructive sleep apnoea and postoperative outcome. Br J Anaesth. 2012 Dec;109(6):897–906. https://doi.org/10.1093/bja/aes308 PMID:22956642
8. Kaw R, Pasupuleti V, Walker E, Ramaswamy A, Foldvary-Schafer N. Postoperative complications in patients with obstructive sleep apnea. Chest. 2012 Feb;141(2):436–41. https://doi.org/10.1378/chest.11-0283 PMID:21868464
9. Lyons PG, Mokhlesi B. Diagnosis and management of obstructive sleep apnea in the perioperative setting. Semin Respir Crit Care Med. 2014 Oct;35(5):571–81. https://doi.org/10.1055/s-0034-1390079 PMID:25353102
10. Poorna Madhusudan, Jean Wong, Arun Prasad, Elena Sadeghian, and Frances F. Chung. An update on preoperative assessment and preparation of surgical patients with obstructive sleep apnea. Curr Opin Anesthesiol 2017, 30:000 – 000. https://doi.org/10.1097/ACO.0000000000000539.
11. Fernandez-Bustamante A, Bartels K, Clavijo C, Scott BK, Kacmar R, Bullard K, et al. Preoperatively Screened Obstructive Sleep Apnea Is Associated With Worse Postoperative Outcomes Than Previously Diagnosed Obstructive Sleep Apnea. Anesthesia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2017 Aug;125(2):593–602. Available from: http://dx.doi.org/10.1213/ane.0000000000002241
12. American Society of Anesthesiologists Task Force on Perioperative Management of patients with obstructive sleep apnea. Practice guide- lines for the perioperative management of patients with obstructive sleep apnea: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Management of patients with obstructive sleep apnea. Anesthesiology. 2014;120(2):268–86. https://doi.org/10.1097/ALN.0000000000000053 PMID:24346178
13. Young T, Peppard PE, Gottlieb DJ. Epidemiology of obstructive sleep apnea: a population health perspective. Am J Respir Crit Care Med. 2002 May;165(9):1217–39. https://doi.org/10.1164/rccm.2109080 PMID:11991871
14. Durán J, Esnaola S, Rubio R, Iztueta A. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 yr. Am J Respir Crit Care Med. 2001 Mar;163(3 Pt 1):685–9. https://doi.org/10.1164/ajrccm.163.3.2005065 PMID:11254524
15. Lin CM, Davidson TM, Ancoli-Israel S. Gender differences in obstructive sleep apnea and treatment implications. Sleep Med Rev. 2008 Dec;12(6):481–96. https://doi.org/10.1016/j.smrv.2007.11.003 PMID:18951050
16. Shahar E, Redline S, Young T, Boland LL, Baldwin CM, Nieto FJ, et al. Hormone replacement therapy and sleep-disordered breathing. Am J Respir Crit Care Med. 2003 May;167(9):1186–92. https://doi.org/10.1164/rccm.200210-1238OC PMID:12531779
17. Young T, Finn L, Austin D, Peterson A. Menopausal status and sleep-disordered breathing in the Wisconsin Sleep Cohort Study. Am J Respir Crit Care Med. 2003 May;167(9):1181–5. https://doi.org/10.1164/rccm.200209-1055OC PMID:12615621
18. Watanabe T, Isono S, Tanaka A, Tanzawa H, Nishino T. Contribution of body habitus and craniofacial characteristics to segmental closing pressures of the passive pharynx in patients with sleep-disordered breathing. Am J Respir Crit Care Med. 2002 Jan;165(2):260–5. https://doi.org/10.1164/ajrccm.165.2.2009032 PMID:11790665
19. Franklin KA, Gíslason T, Omenaas E, Jõgi R, Jensen EJ, Lindberg E, et al. The influence of active and passive smoking on habitual snoring. Am J Respir Crit Care Med. 2004 Oct;170(7):799–803. https://doi.org/10.1164/rccm.200404-474OC PMID:15242843
20. Wetter DW, Young TB, Bidwell TR, Badr MS, Palta M. Smoking as a risk factor for sleep-disordered breathing. Arch Intern Med. 1994 Oct;154(19):2219–24. https://doi.org/10.1001/archinte.1994.00420190121014 PMID:7944843
21. Schwab RJ. Genetic determinants of upper airway structures that predispose to obstructive sleep apnea. Respir Physiol Neurobiol. 2005 Jul;147(2-3):289–98. https://doi.org/10.1016/j.resp.2005.06.006 PMID:16043425
22. Riha RL. Genetic aspects of the obstructive sleep apnoea/hypopnoea syndrome—is there a common link with obesity? Respiration. 2009;78(1):5–17. https://doi.org/10.1159/000221903 PMID:19590259
23. Littner MR, Kushida C, Wise M, Davila DG, Morgenthaler T, Lee-Chiong T, et al.; Standards of Practice Committee of the American Academy of Sleep Medicine. Practice parameters for clinical use of the multiple sleep latency test and the maintenance of wakefulness test. Sleep. 2005 Jan;28(1):113–21. https://doi.org/10.1093/sleep/28.1.113 PMID:15700727
24. Arand D, Bonnet M, Hurwitz T, Mitler M, Rosa R, Sangal RB. The clinical use of the MSLT and MWT. Sleep. 2005 Jan;28(1):123–44. https://doi.org/10.1093/sleep/28.1.123 PMID:15700728
25. Sullivan SS, Kushida CA. Multiple sleep latency test and maintenance of wakefulness test. Chest. 2008 Oct;134(4):854–61. https://doi.org/10.1378/chest.08-0822 PMID:18842919
26. Chervin RD. Sleepiness, fatigue, tiredness, and lack of energy in obstructive sleep apnea. Chest. 2000 Aug;118(2):372–9. https://doi.org/10.1378/chest.118.2.372 PMID:10936127
27. Jackson ML, Stough C, Howard ME, Spong J, Downey LA, Thompson B. The contribution of fatigue and sleepiness to depression in patients attending the sleep laboratory for evaluation of obstructive sleep apnea. Sleep Breath. 2010. PMID:20446116
28. Larsson LG, Lindberg A, Franklin KA, Lundbäck B. Gender differences in symptoms related to sleep apnea in a general population and in relation to referral to sleep clinic. Chest. 2003 Jul;124(1):204–11. https://doi.org/10.1378/chest.124.1.204 PMID:12853524
29. Guilleminault C, Lin CM, Gonçalves MA, Ramos E. A prospective study of nocturia and the quality of life of elderly patients with obstructive sleep apnea or sleep onset insomnia. J Psychosom Res. 2004 May;56(5):511–5. https://doi.org/10.1016/S0022-3999(04)00021-2 PMID:15172207
30. Margel D, Shochat T, Getzler O, Livne PM, Pillar G. Continuous positive airway pressure reduces nocturia in patients with obstructive sleep apnea. Urology. 2006 May;67(5):974–7. https://doi.org/10.1016/j.urology.2005.11.054 PMID:16635510
31. Beebe DW, Groesz L, Wells C, Nichols A, McGee K. The neuropsychological effects of obstructive sleep apnea: a meta-analysis of norm-referenced and case-controlled data. Sleep. 2003 May;26(3):298–307. https://doi.org/10.1093/sleep/26.3.298 PMID:12749549
32. Valencia-Flores M, Bliwise DL, Guilleminault C, Cilveti R, Clerk A. Cognitive function in patients with sleep apnea after acute nocturnal nasal continuous positive airway pressure (CPAP) treatment: sleepiness and hypoxemia effects. J Clin Exp Neuropsychol. 1996 Apr;18(2):197–210. https://doi.org/10.1080/01688639608408275 PMID:8780955
33. Ferini-Strambi L, Baietto C, Di Gioia MR, Castaldi P, Castronovo C, Zucconi M, et al. Cognitive dysfunction in patients with obstructive sleep apnea (OSA): partial reversibility after continuous positive airway pressure (CPAP). Brain Res Bull. 2003 Jun;61(1):87–92. https://doi.org/10.1016/S0361-9230(03)00068-6 PMID:12788211
34. Verbraecken J, Hedner J, Penzel T. Pre-operative screening for obstructive sleep apnoea [https://doi.org/10.1183/16000617.0012-2016]. Eur Respir Rev. 2017 Jan;26(143):160012. https://doi.org/10.1183/16000617.0012-2016 PMID:28049125
35. Chung F, Yegneswaran B. LiaoP,etal.ValidationoftheBerlinquestionnaireand American Society of Anesthesiologists checklist as screening tools for obstructive sleep apnea in surgical patients. Anesthesiology. 2008;108:822–30. https://doi.org/10.1097/ALN.0b013e31816d91b5 PMID:18431117
36. Corso RM, Petrini F, Buccioli M, Nanni O, Carretta E, Trolio A, et al. Clinical utility of preoperative screening with STOP-Bang questionnaire in elective surgery. Minerva Anestesiol. 2014 Aug;80(8):877–84. PMID:24280812
37. Toshniwal G, McKelvey GM, Wang H. STOP-Bang and prediction of difficult airway in obese patients. J Clin Anesth. 2014 Aug;26(5):360–7. https://doi.org/10.1016/j.jclinane.2014.01.010 PMID:25081584
38. Mahesh Nagappa et al. Association of STOP-Bang Questionnaire as a Screening Tool for Sleep Apnea and Postoperative Complications: A Systematic Review and Bayesian Meta-analysis of Prospective and Retrospective Cohort Studies. International Anesthesia Research Society; 2017.
Preoperative evaluation of Obstructve sleep apnea (OSA) as a perioperative risk factorPreoperative evaluation of Obstructve sleep apnea (OSA) as a perioperative risk factor

 ORCID
ORCID



 Creative Commons Attribution
Creative Commons Attribution