Luis Azócar 1
Rev Chil Anest Vol. 46 Núm. 3 pp. 157-166|https://10.25237/revchilanestv46n03.06
PDF|ePub|RIS
Ultrasound in Anesthesia: Point of Care Ultrasound (POCUS)
The ultrasound has become a very useful tool for the anesthesiologist because it complements and deepens the physical examination, ameliorating the clinical decision process. Among its many advantages are that is a bedside, abreviated exam, that avoids unnecesary transfers to other services, (of note in hemodinamically unstable Patients), besides is a radiation free method, repeatable as many times as needed. Its effectiveness for procedures is described, highlighting the central venous catheters and arterial lines placement. Also its diagnostic benefits, with accent on answering some specific questions. The full range of uses is described, incluiding: echocardiography, lung and pleura ultrasound, gastric ultrasound, extended FAST, airway, optic nerve sheath and the practical utility of each one.
El ultrasonido se ha convertido en una herramienta cada vez más útil para el anestesiólogo porque complementa y profundiza el examen físico, aportando información que facilita las decisiones clínicas. Sus principales ventajas son: ser un examen portátil que por lo tanto evita traslados innecesarios a otros servicios, lo que es importante en el caso de pacientes hemodinámicamente inestables, no invasivo, sin costos adicionales, libre de radiaciones, repetible las veces que sean necesarias y de rápida ejecución. Se describe su uso para procedimientos, en donde destaca el uso en instalación de catéteres venosos centrales y líneas arteriales, así como su uso con fines diagnósticos, en donde el énfasis es contestar preguntas específicas. Se describe en forma sucinta el uso de ecocardiografía, eco de pleura y pulmón, de estómago, FAST extendido, vía aérea, nervio óptico y la utilidad práctica de cada uno.
El uso de la ecografía se ha ido extendiendo en la práctica médica gracias a la evolución de grandes y aparatosos ecógrafos a equipos más portátiles, de menor costo y mejor resolución. El uso de Ultrasonido (US) para la anestesia regional ya es considerado estándar de tratamiento y aquí no nos referiremos al tema. El objetivo de la presente revisión es dar a conocer al lector los usos más relevantes del US en la práctica anestesiológica actual y la importancia de su aplicación.
El primer concepto fundamental a comprender es que se trata de una herramienta que permite complementar el examen clínico del paciente, profundizando la información que entrega el examen físico. Si bien el US tiene utilidad en casos específicos como se verá más adelante, en rigor se puede utilizar para evaluar a cualquier paciente, puesto que no es un método invasivo, no implica costos adicionales, salvo el costo del equipo y la capacitación en su uso, se realiza junto a la cama del paciente, repetible las veces que sean necesarias, además disminuye traslados a servicios radiológicos, especialmente en caso de inestabilidad hemodinámica. Se evita la exposición a los rayos X y no presenta contraindicaciones. Igualmente, no requiere de ambiente silenciosos: se puede utilizar en un helicóptero o una ambulancia en el contexto de medicina pre-hospitalaria.
Ocasionalmente puede haber hallazgos de patologías por medio de este examen (ejemplo nódulo tiroideo, hidronefrosis, litiasis vesical, etc.), pero éste no es su objetivo.
Sus principales limitaciones son: acceso restringido a la zona a examinar por apósitos, campos quirúrgicos, enfisema subcutáneo y poca colaboración del paciente.
La utilidad que presta la ecografía para el anestesiólogo se puede resumir en dos grandes puntos:
a.- procedimientos guiados por ecografías.
b.- examen asistido por ecografía1.
a.- Procedimientos eco guiados
Accesos vasculares: Principalmente para la instalación de catéteres venosos centrales. Se ha descrito disminución en el tiempo de realización del procedimiento, menor número de punciones, menor tasa de fallas, de complicaciones precoces y de infecciones2,3 (Figura 1).
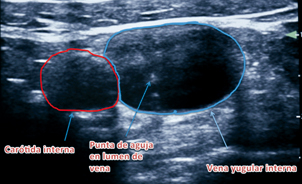
Figura 1. Punción de vena yugular interna en eje corto (fuera de plano).
La incidencia reportada de complicaciones por punción venosa central bajo eco es de 4,6%, mientras que con la técnica tradicional de marcación es del 10,5%, lo que significa una reducción del riesgo absoluto del 59%3,4.
Hoy en día el uso de US para cateterización central está considerado como estándar de cuidado5.
Es recomendable hacer un mapeo ecográfico en busca de las venas susceptibles de albergar un CVC antes de instalar el campo estéril para poder anticipar alguna dificultad para el procedimiento (hematomas por punciones anteriores o presencia de trombos intravasculares) así como alteraciones anatómicas no sospechadas (vasos aberrantes).
La recomendación actual es efectuar la punción en tiempo real (en vez de solamente marcar con US y luego puncionar sin ir viendo imágenes) y en eje corto.
También se ha usado con éxito para punciones venosas periféricas, especialmente para pacientes obesos, deshidratados y en niños.
En la instalación de líneas arteriales también se ha descrito una mayor tasa de éxito al primer intento, menor tiempo de realización y menor incidencia de hematomas6. En un metaanálisis de Wan-Jie Gu y cols7 se recomienda el uso de US en tiempo real para realizar cateterizaciones arteriales. Dicho estudio no muestran diferencia entre realizarlo en eje corto (fuera de plano ) o eje largo (en plano).
La recomendación actual enfatiza el uso del US desde el inicio del procedimiento y no como rescate ante la falla de la técnica tradicional por palpación.
b.- Examen asistido por ecografía
Ecocardiografía (Focus Oriented Cardiac Ultrasound)
En esta área es importante dejar en claro que el US focalizado se utiliza para profundizar y complementar la información obtenida mediante la evaluación clínica y que no es un método que deba usarse para efectuar un diagnóstico morfo-funcional detallado, lo que requiere de una ecocardiografía practicada formalmente por un cardiólogo. En el caso del Focus se describirá la manera de obtener ventanas básicas8:
Paraesternal
Izquierda en eje largo y corto, apical, subcostal en eje transversal (cardíaco) y eje longitudinal (vena cava inferior) (Figura 2).
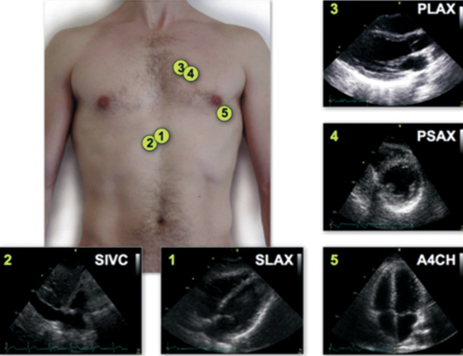
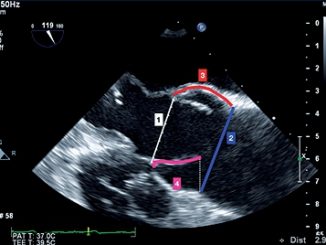
Figura 2. Imágenes estándar de FoCUS: (1) subcostal; (2) vena cava inferior subcostal; (3) paraesternal eje largo; (4) paraesternal eje corto; (5) apical 4 cámaras (con autorización, ref 10).
Habitualmente se obtienen estas imágenes con un transductor de baja frecuencia y alta penetración (llamado phased array). Los equipos portátiles tienen una menor resolución que los equipos de alta gama por lo que están en desventaja para evaluar detalles puntuales como son algunas alteraciones valvulares menores. Por lo tanto, como ya fue dicho, el Focus no reemplaza a una ecocardiografía formal y ésta debiese solicitarse cuando se encuentre alguna alteración que amerite manejo cardiológico9.
Se recomienda el Focus para evaluar10:
– Tamaño del ventrículo izquierdo (VI), función sistólica, esto es, su contractilidad.
– Función sistólica del ventrículo derecho (VD). Normalmente el tamaño del VD es de aproximadamente 2/3 del tamaño del VI. Un VD disfuncional suele estar dilatado y por ende se altera la relación de tamaño respecto del VI.
– Volemia: evaluando el vaciamiento de cámara del fin de sístole ventricular y también midiendo la colapsabilidad de la vena cava inferior.
– Derrame pericárdico, taponamiento.
– También se utiliza la ventana subcostal (igualmente llamada subxifoídea) en el contexto de la reanimación cardiopulmonar para poder evaluar directamente si el corazón tiene o no actividad. Se realiza una observación que no debiera tomar más de 5 segundos para no retardar innecesariamente el masaje cardíaco.
En el Focus estas apreciaciones son visuales, sin mediciones ni uso de Doppler, por lo que se requiere de práctica continuada para obtener un mínimo de destreza, a lo menos 20 a 30 exámenes. Al respecto no hay acuerdo generalizado en la literatura11.
US pleural
A diferencia de otros abordajes, en el US pleural normal no se aprecian estructuras anatómicas más allá de la línea de pleura, solamente artefactos. El pulmón se puede ver solamente cuando pierde aire, ejemplo: condensaciones, atelectasias. Así los artefactos básicos a reconocer son12:
1.- Líneas A: que corresponden a una imagen reiterada de la línea pleural provocada por una reverberación de las ondas de US entre el transductor y las pleuras (Figura 3).
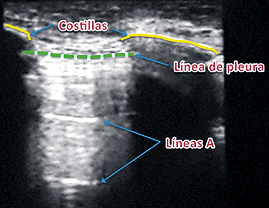
Figura 3. Líneas A.
2.- Líneas B: se trata de líneas hiperecogénicas que aparecen a partir de la línea pleural hasta el extremo inferior de la pantalla, con forma de líneas de cometa que se mueven por el deslizamiento pleural y obstruyen la visibilidad de las líneas A (Figura 4). Corresponden a acumulación de fluido en el intersticio pulmonar. En forma normal pueden verse entre 0 y 3 por espacio pleural en las zonas de declive del pulmón. Si se visualizan más de tres, ya sea que se puedan identificar por separado o sean confluentes, dando imagen de pulmón blanco, constituyen una acumulación patológica, lo que se conoce como síndrome alveolo-intersticial. Pueden ser causadas por edema pulmonar y distréss respiratorio.
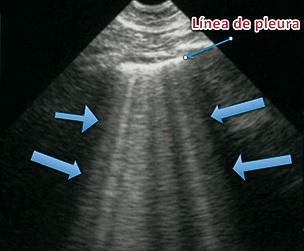
Figura 4. Ejemplo de líneas B. En este caso corresponde a un síndrome alveolo-intersticial.
3.- Deslizamiento pleural: (lung sliding) corresponde a un artefacto producido por el desplazamiento de la pleura visceral bajo la parietal. Se trata de pequeños puntos o líneas blancas que, a diferencia de las líneas B, recorren solo escasos milímetros bajo la línea de pleura.
4.- Pulso pleural (lung pulse): es un artefacto producido por la vibración transmitida por el latido cardíaco hacia el pulmón, lo que provoca un movimiento breve, rítmico, a nivel de la línea pleural. Es más fácil de ver en modo M durante un período de apnea.
5.- Derrame pleural: inmediatamente bajo la línea de pleura se observará un espacio anecoico de tamaño variable, bajo el cual se moverá el pulmón, el cual se visualizará con un parénquima de tamaño disminuido, de densidad tisular aumentada y broncogramas aéreos estáticos (espacios hiperecogénicos en el parénquima que no sufren modificaciones con los movimientos respiratorios)13. El US permite detectar líquido pleural con volúmenes tan pequeños como 5 a 20 cc, en contraste con la Rx de tórax que requiere al menos 100-150 ml para ser visualizado14.
6.- Patrón de consolidación: Es un patrón de imagen de tejido (hepatización) con mínima perdida de tamaño y la presencia de broncograma dinámico (espacios hiperecogénicos que sufren modificaciones visibles con los movimientos respiratorios.
Con estos elementos podemos contestar las siguientes preguntas15:
¿Hay neumotórax?: Para su diagnostico hay que considerar diversos hallazgos: (Figura 5).
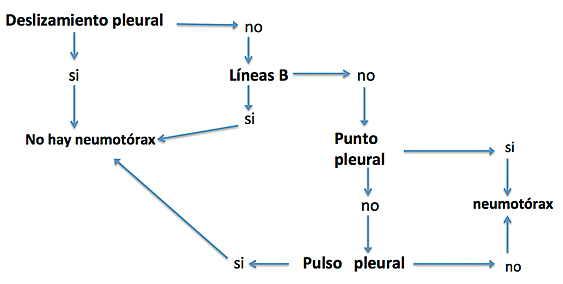
Figura 5. Algoritmo para diagnóstico de neumotórax.
– La presencia de lung sliding, lung pulse y de líneas B lo descartan en el área examinada.
– La ausencia de lung sliding lo hace sospechar pero por si solo no confirma el diagnostico pues existen otras causas como son: intubación mono-bronquial, adherencias pleurales y presencia de bulas.
– Las líneas A pueden observarse en presencia de un neumotórax.
– El punto pleural (lung point) es un signo especifico, no tan fácil de encontrar pero que confirma el diagnostico. Consiste en un espacio intercostal en el cual el lung sliding aparece y desaparece en forma intermitente de acuerdo al movimiento respiratorio.
– Uso de modo M: Sobre un espacio intercostal se van a buscar los artefactos producidos por el movimiento (o ausencia) de la pleura. Hay dos signos fundamentales:
– * orilla de playa (sea shore sign) que se produce por el deslizamiento del pulmón con los movimientos respiratorios, semejando granos de arena (Figura 6).
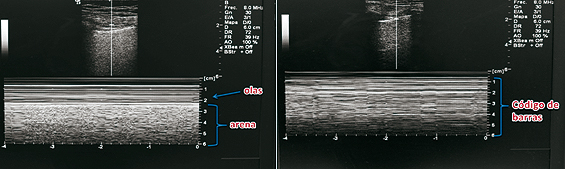
Figura 6. Signo de la playa (izquierda), y signo del código de barras (derecha).
– **Signo de la estratósfera: La ausencia de movimiento respiratorio da un aspecto de código barras en toda la pantalla, signo característico, (pero no exclusivo), de neumotórax.
Cabe destacar que la radiografía de tórax tiene sólo un 70% de sensibilidad para la detección del neumotórax en contraste con un valor sobre el 90% del US16. Un metaanálisis de Alrajab y cols., muestra una sensibilidad global de 39,8% para la radiografía de tórax y de 78,6% para el US17. Por ello, tras realizar una punción venosa central dificultosa, o cuando hay sospecha de haber tenido un barotrauma, el uso del ecógrafo permite rápidamente diagnosticar el problema sin tener que esperar una radiografía portátil o un traslado a rayos.
¿Hay derrame pleural?: si existe, el US permite al operador hacer una estimación aproximada de su volumen en ml, midiendo, (en un derrame no tabicado), la distancia intrapleural máxima (en cm) y multiplicándola por 200 ml/cm18. Asimismo el US permite guiar la mejor zona para drenaje, minimizando el riesgo de puncionar el pulmón.
¿Hay atelectasias?: su detección con US es más sensible que con la radiografía de tórax19 y así permitiría modificar conductas, por ejemplo: kinesioterapia pre y/o post operatoria, maniobras de reclutamiento durante la VM o modificación de valor de PEEP en pabellón o en UCI.
¿Hay síndrome alveolo-intersticial? El hallazgo de líneas B abundantes o confluentes en distintas zonas pulmonares sirve, por ejemplo, para restringir los volúmenes infundidos, aportar diuréticos o postergar una extubación hasta que mejoren las condiciones del paciente.
Por todo lo anterior el US en la sala de recuperación es muy útil para el diagnóstico diferencial de disnea post operatoria.
Para los anestesiólogos que trabajen en unidades de cuidado intensivo es de gran utilidad para monitorizar la evolución de la patología pulmonar y determinar el nivel óptimo de PEEP.
US gástrico 20
Tiene como objetivo evaluar la calidad y magnitud del contenido gástrico para determinar el riesgo de bronco-aspiración. Se realiza con el transductor curvo, aunque también se puede utilizar el transductor lineal en pacientes muy delgados o en niños menores de 8 años. Se aplica el transductor sobre el epigastrio en eje longitudinal, buscando como referencia el lóbulo hepático izquierdo, la aorta o la vena cava inferior, la arteria mesentérica superior y el páncreas. Teniendo estas referencias a la vista (o por lo menos algunas de ellas) se examina el antro gástrico. Primero en decúbito dorsal y luego se examina con el paciente en decúbito lateral derecho, esto con el objeto que el contenido que pudiese haber en el fondo gástrico se desplace hacia el antro. Se examina el aspecto del antro gástrico para determinar si está vacío, si tiene contenido líquido (el que se puede cuantificar) o sólido, lo que se ve como una mezcla de ecos de distintas densidades que usualmente proyectan una sombra acústica que dificulta o impide la visión de la aorta o la VCI. Perlas y cols21 elaboraron un modelo de regresión lineal en pacientes de diferentes edades en los que se midió mediante US el contenido antral en decúbito dorsal (DD) y luego en decúbito lateral derecho (DLD) y posteriormente se comparó con el volumen aspirado del estómago por endoscopía. Luego de esto se realizó la medición ecográfica del área de corte a nivel antral. Estos parámetros se llevaron a una tabla derivada de la formula:
Volumen Gástrico = 27 + 14,6 • (Área Sección DLD cm 2) – 1,28 • edad (años)
Según el volumen calculado se determina el riesgo de bronco-aspiración ajustado por edad, teniendo como valor de referencia a un volumen menor de 1,5 ml·kg-1, (que se considera la cantidad de secreción basal) y de alto riesgo cuando es mayor de 1,5 ml·kg-1. (Figuras 7, 8).
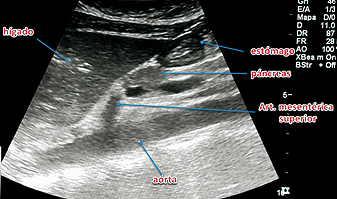
Figura 7. Estómago vacío.
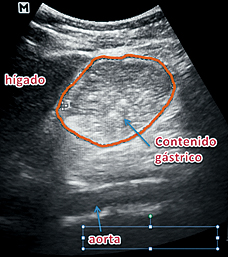
Figura 8. Contenido sólido.
Spencer y cols.22, han desarrollado otro modelo de regresión en población pediátrica siguiendo una metodología similar, con bastante buena correlación entre lo medido por US y el contenido aspirado durante el examen. La fórmula en este caso se basa en la edad en meses:
Volumen Gástrico = -7,8 + 3,5 • (Área Sección DLD cm 2) + 0,127 • edad (meses)
Puede ser de gran utilidad cuando no se tiene clara la data del ayuno o en un paciente incapaz de dar información confiable. Por otra parte, se dan casos en que el ayuno no está cumplido a cabalidad pero al comprobar por US que el estomago está vacío, se podría proceder con la cirugía.
Se estima que se requiere realizar 33 evaluaciones para obtener un mínimo de pericia.
Limitantes: El US de estómago no es adecuado para pacientes con anatomía alterada como gastrectomía previa o bypass, banda gástrica in situ, gran hernia hiatal o fundoplicatura previa.
FAST extendido 23
Es un examen realizado principalmente por médicos de Urgencias en pacientes con trauma tóracoabdominal. Va dirigidamente a buscar hemoperitoneo, hemotórax, neumotórax y derrame pericárdico con o sin taponamiento cardíaco.
Se realiza habitualmente con transductor curvo de baja frecuencia en 4 ventanas abdominales y 2 torácicas:
– Cuadrante superior derecho: en la línea axilar media derecha, partiendo el examen aproximadamente a la altura de la 8ª costilla, con el transductor en el eje longitudinal del cuerpo, deslizándolo desde arriba hacia abajo y viceversa. Se busca visualizar el hígado, diafragma, riñón derecho y el espacio hepatorrenal de Morrison. Permite detectar un hemoperitoneo cuando se acumulan al menos 500 cc de sangre en la cavidad peritoneal o con 350 cc si se realiza con el paciente en posición de Trendelenburg. Esta misma ventana se usa para detectar un hemotórax, mirando por encima de la línea del diafragma.
– Cuadrante superior izquierdo: también se inicia el examen a la altura de la 8ª costilla pero a nivel de la línea axilar posterior (los nudillos pegados a la cama), identificando el diafragma, bazo y riñón izquierdo. Las consideraciones de búsqueda son similares que al lado derecho.
– Subcostal: se coloca el transductor en forma transversal, prácticamente acostado sobre el abdomen del paciente, apuntando hacia el corazón. Permite la detección de derrame pericárdico.
– Suprapúbico: se realiza en 2 planos, longitudinal y transversal. Se busca identificar la indemnidad (o rotura) de la vejiga y la presencia de sangre entre las asas intestinales.
– Pulmonares: se instala el transductor entre el 2º y tercer espacio intercostal línea medioclavicular bilateral en busca de neumotórax.
Este examen permite vigilar la evolución del paciente traumatizado, especialmente de aquellos hemodinámicamente inestables. Un examen eco fast inicialmente negativo en la urgencia puede hacerse positivo al ingresar a pabellón. Esto permitiría tratar una condición no detectada en un principio, por ejemplo un neumotórax, el que podría ser tratado con un drenaje pleural antes de inducir la anestesia.
Otra situación donde podría ser muy útil es en la unidad de recuperación. Un paciente que se torna hemodinámicamente inestable tras una cirugía abdominal pudiera, entre otras posibilidades, tener un sangrado peritoneal, lo que es detectable por este método sin tener que trasladar al paciente a otra unidad.
US en vía aérea (VA)
Kristensen y cols.24, estudiaron el uso de US para VA. Ellos demostraron que es posible visualizar imágenes desde la base de la lengua hasta los anillos traqueales, permitiendo así identificar las diferentes estructuras, el funcionamiento de las cuerdas vocales y las estructuras anatómicas adyacentes a la VA. En este contexto cabe destacar la identificación de la membrana cricotiroídea como paso previo al manejo de la VA difícil, la que podría ser necesario puncionar para obtener un acceso de emergencia. Esta estructura puede ser difícil de identificar, especialmente en cuellos edematosos, desviaciones de la tráquea por compresión tumoral, abscesos, secuelas de radioterapia, quemaduras, columna cervical inestable, etc. Se usa el transductor lineal, apoyándolo en forma transversal sobre la escotadura esternal para identificar los anillos traqueales, buscando la línea media y luego se rota en 90º, ascendiendo por el cuello, reconociendo los cartílagos traqueales que muestran una configuración como de “cuentas de rosario”, apareciendo luego el cartílago cricoides con características sonográficas similares a los cartílagos traqueales pero de mayor tamaño y de ubicación más anterior. Siguiendo en dirección cefálica aparece la membrana cricotiroidea24. (Figura 9).
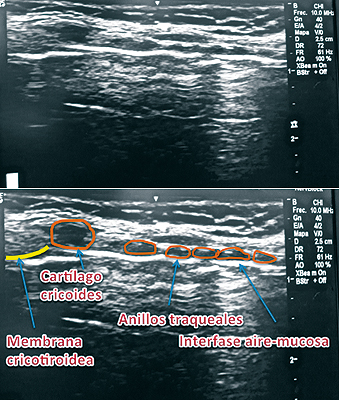
Figura 9. US de vía aérea: anillos traqueales y cartílago cricoides.
Al identificar la membrana se aconseja dejar una marca sobre la piel y así, en caso de emergencia, se evita perder un tiempo precioso en identificarla.
El transductor puesto en forma transversal sobre la laringe permite ver el movimiento de las cuerdas vocales. Se le pide al paciente que respire tranquilamente y luego que vocalice “aaaaaaa”. Si esta maniobra se realiza antes y después de una tiroidectomía podría mostrar parálisis de cuerda(s) vocal(es) por lesión de nervio(s) laríngeo(s), lo que es menos invasivo que hacer una laringoscopía postoperatoria en el paciente ya extubado.
El uso de US en la VA también sirve para confirmar la correcta intubación de la tráquea en forma directa e indirecta25. La indirecta es comprobando el lung sliding bilateral tras la intubación. La manera directa es con el transductor puesto en forma transversal a los anillos traqueales. Si no hay cambios en la anatomía al intubar quiere decir que se está en tráquea (como ésta contiene aire no deja ver el tubo en su interior). Si la intubación se produce en esófago, se vera la aparición de un segundo lumen al lado y un poco más atrás de la tráquea, lo que se conoce como signo del ganso (goose sign) (Figura 10). Para poder verlo es necesario hacer esta observación en tiempo real, porque si se realiza después de la intubación esofágica, el reconocimiento es más difícil y la sensibilidad diagnóstica disminuye en forma ostensible. Este reconocimiento en forma oportuna permite evitar la insuflación del estómago, lo que aumentaría el riesgo de broncoaspiración.
R. Ramsingh y cols.26, demostaron que el US es superior a la auscultación en determinar la correcta localización del TOT (si es traqueal, monobronquial derecha o izquierda). En este trabajo, la identificación correcta de la intubación traqueal versus intubación bronquial fue de 62% para el grupo auscultación y 95% para el grupo de ultrasonido. Teniendo en cuenta este hecho, el US ayuda a identificar la adecuada ubicación de un tubo doble lumen, especialmente cuando no se cuenta con fibrobroncoscopio (que constituye el gold estándar para la comprobación de una correcta instalación de un tubo de doble lumen).
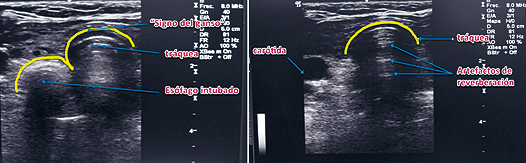
Figura 10. Intubación esofágica (izquierda) y traqueal (derecha).
Hay que reconocer algunas limitaciones: La presencia de un collar cervical impide la observación de la VA alta (a menos que se pueda remover), patología pulmonar que impida ver el lung sliding (neumonía, consolidación pulmonar, adherencias pleurales) y presencia de enfisema subcutáneo que impida la visión ecográfica.
Algunos otros usos descritos:
– Bloqueos nerviosos relacionados a VA, especialmente bloqueo del nervio laríngeo superior27,28.
– Para decidir el tamaño correcto del TOT, cánulas de traqueotomía, tubos de doble lumen. Respecto a esto último, Brodsky ha correlacionado el diámetro traqueal medido radiológicamente a nivel clavicular29 y luego por TAC de tórax30, estableciéndose una predicción del tamaño adecuado del tubo doble lumen respecto a la medición obtenida del diámetro externo de la tráquea por US:
≥ 18 mm: 41 Fr (tubo doble lumen izquierdo)
≥ 16 mm: 39 Fr
≥ 15 mm: 37 Fr
≥ 14 mm: 35 Fr
– Como guía para instalar traqueostomía percutánea31 en pacientes de UCI. En tiempo real, con uso de alambre guía verificado con broncoscopía. Permite ver la profundidad de los anillos traqueales, el nivel adecuado de punción, la presencia de elementos anatómicos que pudieran provocar dificultades si la punción se hiciese sólo por reparos anatómicos y clínicos (palpación).
US en nervio óptico
Se ha propuesto la medición del diámetro de la vaina del nervio óptico como un método de evaluación no invasiva y precoz de hipertensión intracraneana (HIC). Consiste en el uso de un transductor lineal puesto sobre el globo ocular, (previamente protegido con un parche adhesivo transparente sobre el que se esparce abundante gel) (Figura 11). El nervio óptico es hipoecoico, de trayecto regular y como está rodeado por la duramadre, un aumento de la presión intracraneana, (PIC), se transmite a través del espacio subaracnoídeo hacia su vaina, aumentando su diámetro32. La medición se realiza a 3 mm tras el globo ocular. En general se usa un punto de corte de 5 mm. Sin embargo, otros estudios no han concordado con este valor, sugiriendo números que oscilan entre 5 y 5,9 mm. Este examen ayudaría a decidir el traslado del paciente afectado a un centro neuro-quirúrgico33.
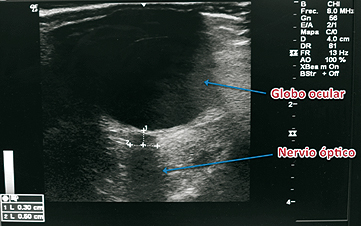
Figura 11. Obtención de US del nervio óptico. El valor medido en forma transversal a 3 mm. Por detrás del globo ocular está en rango normal. En este caso 5 mm.
En resumen el US utilizado por el anestesiólogo permite guiar múltiples procedimientos así como responder preguntas que incidirán en la conducta de manejo del paciente. Se hace necesaria la práctica frecuente de los procedimientos para optimizar resultados.
Por último recordar que los transductores se contaminan fácilmente con sangre y secreciones, por lo que deben limpiarse y desinfectarse después de su uso y evitar que se conviertan en vectores de infección34.
Conflicto de interés a declarar: Ninguno
Referencias
1. Royse CF, Canty DJ, Faris J, Haji DL, Veltman M, Royse A. Core review: physician-performed ultrasound: the time has come for routine use in acute care medicine. Anesth Analg. 2012 Nov;115(5):1007–28. https://doi.org/10.1213/ANE.0b013e31826a79c1 PMID:23011559
2. Peris A, Zagli G, Bonizzoli M, Cianchi G, Ciapetti M, Spina R et al. Implantation of 3951 long-term central venous catheters: performances, risk analysis, and patient comfort after ultrasound-guidance introduction. Anesth Analg. 2010 Nov;111(5):1194–201. https://doi.org/10.1213/ANE.0b013e3181f333c1 PMID:20829559
3. Wigmore TJ, Smythe JF, Hacking MB, Raobaikady R, MacCallum NS. Effect of the implementation of NICE guidelines for ultrasound guidance on the complication rates associated with central venous catheter placement in patients presenting for routine surgery in a tertiary referral centre. Br J Anaesth. 2007 Nov;99(5):662–5. https://doi.org/10.1093/bja/aem262 PMID:17872936
4. AbdullahS Terkawi, et al. Ultrasound for the Anesthesiologist: Present and Future, Hindawi Publishing Corporation The Scientific World Journal Vol 2013 Article ID 683685, 15 pages http://dx.doi.org/ https://doi.org/10.1155/2013/683685.
5. Troianos CA, Hartman GS, Glas KE, Skubas NJ, Eberhardt RT, Walker JD et al.; Councils on Intraoperative Echocardiography and Vascular Ultrasound of the American Society of Echocardiography; Society of Cardiovascular Anesthesiologists. Special articles: guidelines for performing ultrasound guided vascular cannulation: recommendations of the American Society of Echocardiography and the Society Of Cardiovascular Anesthesiologists. Anesth Analg. 2012 Jan;114(1):46–72. https://doi.org/10.1213/ANE.0b013e3182407cd8 PMID:22127816
6. Shiloh AL, Savel RH, Paulin LM, Eisen LA. Ultrasound-guided catheterization of the radial artery: a systematic review and meta-analysis of randomized controlled trials. Chest. 2011 Mar;139(3):524–9. https://doi.org/10.1378/chest.10-0919 PMID:20724734
7. Gu WJ, Wu XD, Wang F, Ma ZL, Gu XP. Ultrasound Guidance Facilitates Radial Artery Catheterization: A Meta-analysis With Trial Sequential Analysis of Randomized Controlled Trials. Chest. 2016 Jan;149(1):166–79. https://doi.org/10.1378/chest.15-1784 PMID:26426094
8. Coker BJ, Zimmerman JM, Why Anesthesiologists Must Incorporate Focused Cardiac Ultrasound Into Daily Practice, Anesth Analg 2017 Mar,124(3):761-765.
9. Spencer KT, Kimura BJ, Korcarz CE, Pellikka PA, Rahko PS, Siegel RJ. Focused cardiac ultrasound: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2013 Jun;26(6):567–81. https://doi.org/10.1016/j.echo.2013.04.001 PMID:23711341
10. Gabriele Via, et al International Evidence-Based Recommendations for Focused Cardias Ultrasound Journal of the American Society of Echocardiography 2014, vol 27 Nª 7 683e1-e33.
11. Arntfield RT, Millington SJ. Point of care cardiac ultrasound applications in the emergency department and intensive care unit—a review. Curr Cardiol Rev. 2012 May;8(2):98–108. https://doi.org/10.2174/157340312801784952 PMID:22894759
12. Eric Piette, et al. Basic concepts in the use of thoracic and lung ultrasound Curr Opin Anesthesiol 2013;26:20-30.
13. Lichtenstein D, Mezière G, Seitz J. The Dynamic Air Bronchogram. A Lung Ultrasound Sign of Alveolar Consolidation Ruling out Atelectasis Chest 2009;135:1425-1425.
14. Mayo PH, Doelken P. Pleural ultrasonography. Clin Chest Med. 2006 Jun;27(2):215–27. https://doi.org/10.1016/j.ccm.2006.01.003 PMID:16716814
15. Volpicelli G, Elbarbary M, Blaivas M, Lichtenstein DA, Mathis G, Kirkpatrick AW et al.; International Liaison Committee on Lung Ultrasound (ILC-LUS) for International Consensus Conference on Lung Ultrasound (ICC-LUS). International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med. 2012 Apr;38(4):577–91. https://doi.org/10.1007/s00134-012-2513-4 PMID:22392031
16. Stefanidis K, Dimopoulos S, Nanas S. Basic principles and current applications of lung ultrasonography in the intensive care unit. Respirology. 2011 Feb;16(2):249–56. https://doi.org/10.1111/j.1440-1843.2010.01885.x PMID:20969673
17. Alrajab S, Youssef AM, Akkus NI, Caldito G. Pleural ultrasonography versus chest radiography for the diagnosis of pneumothorax: review of the literature and meta-analysis. Crit Care. 2013 Sep;17(5):R208. https://doi.org/10.1186/cc13016 PMID:24060427
18. Vignon P, Chastagner C, Berkane V, Chardac E, François B, Normand S et al. Quantitative assessment of pleural effusion in critically ill patients by means of ultrasonography. Crit Care Med. 2005 Aug;33(8):1757–63. https://doi.org/10.1097/01.CCM.0000171532.02639.08 PMID:16096453
19. Ford JW, Heiberg J, Brennan AP, et al. A Pilot Assessment of 3 Point -of-Care Strategies for Diagnosis of Perioperative Lung Pathology Anesth Analg March 2017, vol 124, Nº 3:734-42.
20. Perlas A, Van de Putte P, Van Houwe P, Chan VW. I-AIM framework for point-of-care gastric ultrasound. Br J Anaesth. 2016 Jan;116(1):7–11. https://doi.org/10.1093/bja/aev113 PMID:25951832
21. Perlas A, Mitsakakis N, Liu L, Cino M, Haldipur N, Davis L et al. Validation of a mathematical model for ultrasound assessment of gastric volume by gastroscopic examination. Anesth Analg. 2013 Feb;116(2):357–63. https://doi.org/10.1213/ANE.0b013e318274fc19 PMID:23302981
22. Spencer, et al. Ultrasound assessment of gastric volumen the fasted pediatric patient undergoing upper gastrointestinal endoscopy: development of a predictive model using endoscopocally suctioned volumes Pediatric Anesthesia 25(2015) 301-308.
23. Scalea TM, Rodríguez A, Chiu WC, Brenneman FD, Fallon WF Jr, Kato K et al. Focused Assessment with Sonography for Trauma (FAST): results from an international consensus conference. J Trauma. 1999 Mar;46(3):466–72. https://doi.org/10.1097/00005373-199903000-00022 PMID:10088853
24. Kristensen MS. Ultrasonography in the management of the airway. Acta Anaesthesiol Scand. 2011 Nov;55(10):1155–73. https://doi.org/10.1111/j.1399-6576.2011.02518.x PMID:22092121
25. Rudraraju P, Eisen LA. Confirmation of endotracheal tube position: a narrative review. J Intensive Care Med. 2009 Sep-Oct;24(5):283–92. https://doi.org/10.1177/0885066609340501 PMID:19654121
26. Ramsingh D, Frank E, Haughton R, Schilling J, Gimenez KM, Banh E et al. Auscultation versus Point-of-care Ultrasound to Determine Endotracheal versus Bronchial Intubation: A Diagnostic Accuracy Study. Anesthesiology. 2016 May;124(5):1012–20. https://doi.org/10.1097/ALN.0000000000001073 PMID:26950708
27. Green JS, Tsui BC. Applications of ultrasonography in ENT: airway assessment and nerve blockade. Anesthesiol Clin. 2010 Sep;28(3):541–53. https://doi.org/10.1016/j.anclin.2010.07.012 PMID:20850084
28. Kaur B, Tang R, Sawka A, Krebs C, Vaghadia H. A method for ultrasonographic visualization and injection of the superior laryngeal nerve: volunteer study and cadaver simulation. Anesth Analg. 2012 Nov;115(5):1242–5. https://doi.org/10.1213/ANE.0b013e318265f75d PMID:22822197
29. Brodsky JB, Macario A, Mark JB. Tracheal diameter predicts double-lumen tube size: a method for selecting left double-lumen tubes. Anesth Analg. 1996 Apr;82(4):861–4. PMID:8615510
30. Brodsky JB, Malott K, Angst M, Fitzmaurice BG, Kee SP, Logan L. The relationship between tracheal width and left bronchial width: implications for left-sided double-lumen tube selection. J Cardiothorac Vasc Anesth. 2001 Apr;15(2):216–7. https://doi.org/10.1053/jcan.2001.21970 PMID:11312482
31. Rajajee V, Fletcher JJ, Rochlen LR, Jacobs TL. Real-time ultrasound-guided percutaneous dilatational tracheostomy: a feasibility study. Crit Care. 2011;15(1):R67. https://doi.org/10.1186/cc10047 PMID:21342494
32. Ochoa-Pérez L, Cardozo-Ocampo A. Aplicaciones de la ultrasonografía en el sistema nervioso central para neuroanestesia y cuidado crítico. Rev. Colomb. Anestesiol. 2015;43(4):314–20. https://doi.org/10.1016/j.rca.2015.03.009.
33. Dubost C, Geeraerts T. Possible pitfalls when measuring the optic nerve sheath with sonography. J Surg Res. 2012 Mar;173(1):e43–4. https://doi.org/10.1016/j.jss.2011.08.027 PMID:22221601
34. Ursprung E, Oren-Grinberg A. Point-of-Care Ultrasound in the Perioperative Period. Int Anesthesiol Clin. 2016;54(1):1–21. https://doi.org/10.1097/AIA.0000000000000084 PMID:26655506


 Creative Commons Attribution
Creative Commons Attribution