Juan Hernández1, Emiliano Landín2, Ana Schwartzmann3,*
Recibido: 24-08-2023
Aceptado: 02-10-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 716-722|https://doi.org/10.25237/revchilanestv52n8-04
PDF|ePub|RIS
Interventional procedures in oncologic pain treatment
Abstract
Introduction: Cancer is one of the main causes of death worldwide and its incidence has reached over the years. Pain is a frequent symptom in oncological pathology. It is usually controlled by systemic drugs, adjusted according to their intensity using the WHO analgesic ladder. However, a percentage of patients do not achieve adequate pain control due to an insufficient response to systemic drugs or their adverse effects. Interventional techniques play an important role in managing cancer pain that is difficult to treat. The objective of this paper is to review the main interventional techniques used in the treatment of cancer pain. Methodology: A non-systematized bibliographic search was carried out in PubMed, Medline, Portal Timbó and Scielo databases. The reference keywords “Cancer-related pain”, “Pain interventional techniques”, “Peripheral nerve blocks”, “Neurolytic blocks” and “Intrathecal pumping” were used. Results: A bibliographic review of interventional management of cancer pain was carried out, with emphasis on those techniques that have scientific support for their application. Parameters were used to compare their efficacy, such as decrease in pain scores and reduction in opioid consumption. Conclusion: We currently have a variety of interventional techniques for the control of cancer pain. For patients with good life expectancy, procedures and sympathetic blocks are preferred. Chemical or radiofrequency neurolysis and other more invasive procedures are used when life expectancy is not favorable.
Resumen
Introducción: El cáncer es una de las principales causas de muerte a nivel mundial y su incidencia ha aumentado a través de los años. El dolor es un síntoma frecuente en la patología oncológica. Habitualmente, es controlado mediante fármacos sistémicos, ajustados según su intensidad mediante la escalera analgésica de la OMS. Sin embargo, un porcentaje de pacientes no logra un adecuado control del dolor debido a respuesta insuficiente a fármacos sistémicos o a sus efectos adversos. Las técnicas intervencionistas juegan un rol importante para el manejo del dolor oncológico de difícil tratamiento. El objetivo de este trabajo es revisar las principales técnicas intervencionistas utilizadas en el tratamiento del dolor oncológico. Metodología: Se realizó una búsqueda bibliográfica no sistematizada en bases de datos PubMed, Medline, Portal Timbó y Scielo. Se utilizaron palabras clave de referencia “Cancer-related pain”, “Interventional pain techniques”, “Peripheral nerve blocks”, “Neurolytic blocks” e “Intrathecal pump”. Resultados: Se realizó una revisión bibliográfica del manejo intervensionista del dolor oncológico, con énfasis en aquellas técnicas que tienen sustento cientifico para su aplicación. Se utilizaron parámetros para comparar su eficacia como disminución de los escores de dolor y reducción de consumo de opioides. Conclusión: Actualmente, disponemos de una variedad de técnicas intervencionistas para el control del dolor oncológico. Para pacientes con buena expectativa de vida, se prefieren procedimientos conservadores y bloqueos simpáticos. La neuro- lísis química o por radiofrecuencia y otros procedimientos más invasivos se utiliza cuando la expectativa de vida no es favorable.
-
Introducción
El cáncer representa una de las principales causas de muerte a nivel mundial. Según estima la Organización Mundial de la Salud (OMS) en 2019, es la primer o segunda causa de muerte en pacientes menores de 70 años, en al menos 183 países. Tanto la incidencia como su mortalidad describe un ascenso rápido en todo el mundo, probablemente debido al envejecimiento poblacional, así como el aumento y distribución de los factores de riesgos implicados en su patogenia. Se estimaron 19,3 millones de casos nuevos de cáncer, así como 10 millones de muertes por cáncer en 2020 y se espera que ocurran 28,4 millones de nuevos casos de cáncer en 2040[1]. Por lo antedicho, seguirá siendo frecuente para el médico anestesiólogo, el contacto con pacientes oncológicos en su práctica clínica cotidiana. No solamente en procedimientos diagnósticos e intervenciones quirúrgicas, sino involucrados de manera estrecha en el tratamiento del dolor por cáncer. El dolor es uno de los síntomas más comunes dentro de la patología oncológica, así como en enfermedades no oncológicas pasibles de cuidados paliativos. El 38% de todos los pacientes oncológicos referirá dolor moderado o severo. En la mayoría de los casos, el dolor oncológico es tratado con analgésicos comunes y opioides, basándose en la Escalera Analgésica de la OMS (EAO).
Sin embargo, en cerca de 10% de estos pacientes no se logrará un control adecuado del dolor ya sea por la intensidad del mismo o por presentar severos efectos adversos a los fármacos utilizados, afectando esto de manera negativa su calidad de vida. Las técnicas intervencionistas han sido probadas como efectivas en el manejo del dolor de estos últimos pacientes, no obstante, muchas veces son referidos para procedimientos intervencionistas en estadios muy avanzados de la enfermedad, pudiendo no encontrarse en oportunidad para realizar determinados procedimientos o hacerlo bajo riesgos muy elevados[2].
El objetivo de este trabajo es revisar las principales técnicas intervencionistas utilizadas en el tratamiento del dolor oncológico.
-
Metodología
Se realizó una revisión de la bibliografía en base a una búsqueda no sistematizada en las bases de datos Pubmed, Medline, Portal Timbó y Scielo. Se utilizaron palabras clave de referencia “Cancer-related pain”, “Interventional pain techniques”, “Peripheral nerve blocks”, “Neurolytic blocks” e “Intrathecal pump”. Se incluyeron artículos de revisión y estudios clínicos actualizados referentes al tema. Así como conceptos clásicos que fueron extraídos de capítulos de libros de referencia.
-
Resultados
El dolor es uno de los síntomas más frecuentes referidos en pacientes con cáncer. Alrededor del 55% de los mismos, sufren dolor en el transcurso de su tratamiento, el 39,3% lo hacen luego de un tratamiento curativo y cerca de 66,4% durante los estadios avanzados de la enfermedad. Puede deberse a distintas causas, frecuentemente es debido al propio cáncer, por
invasión directa de tejidos contiguos, compresión o infiltración de estructuras nerviosas, metástasis óseas, fracturas patológicas o procesos isquémicos. El tratamiento del cáncer puede originar dolor, secundario a cirugías, radioterapia o quimioterapia. También coexisten otras causas de dolor no oncológico, como polineuroptías, dolor miofacial y radiculopatía degenerativa. Es por esto que el paciente debe someterse a una evaluación integral por parte de un equipo multidisciplinario, que incluya los servicios de oncología, cuidados paliativos, medicina del dolor, medicina interna y radiología, en continua participación de otros equipos de salud tales como fisiatría, fisioterapia, psicología médica etc.[2],[3].
Cerca de 38% de los pacientes con dolor oncológico, lo clasifican como moderado o severo. El abordaje farmacológico inicial se realiza mediante analgésicos comunes y opioides, determinando la elección de los fármacos según la EAO. El 90% de los pacientes que reciben tratamiento con fármacos sistémicos lograrán controlar la mayor parte del tiempo su dolor, sin embargo, el 10% restante presentará un dolor intratable, definido como aquel que no se logra aliviar con opiáceos mayores y adyuvantes o el tratamiento se ve limitado por severos efectos adversos secundarios a la medicación, derivando incluso en sedaciones paliativas por mal control de síntomas[2].
En una revisión retrospectiva de pacientes que se sometieron a procedimientos intervencionistas para el dolor por cáncer, se observó como resultado una tasa de respuesta de 42,6%, con una reducción del dolor en más de 50%. Así mismo se observó un efecto ahorrador de opioides, donde el consumo diario se redujo 60%. Otros beneficios descritos en este estudio fueron reducción de fatiga, ansiedad, depresión y somnolencia, así como un incremento en la sensación de bienestar. Los autores en esta revisión se cuestionan el momento adecuado para realizar procedimientos intervencionistas en pacientes con dolor oncológico. Frecuentemente, estas técnicas se utilizan como último paso en el control del dolor.
Se han propuesto cambios en el esquema de la EAO. Uno de ellos recomienda la implementación de un modelo de ascensor o elevador analgésico, en donde la intensidad inicial del dolor determina en qué nivel de la escalera iniciar el tratamiento[5]. Otros proponen las técnicas intervencionistas como cuarto escalón en la escalera analgésica debido a sus beneficios[6].
Restringir los procedimientos invasivos a una etapa en la cual se han agotado todos los esfuerzos en tratamientos, donde el paciente puede encontrarse con un estado de fragilidad severo o demasiado sintomático, puede disminuir la eficacia de estos[4].
La elección del tratamiento se basa en la experiencia de cada profesional y en la condición clínica de cada paciente, teniendo en cuenta las indicaciones y contraindicaciones para procedimientos invasivos[3].
-
Indicaciones para técnicas intervencionistas
Dolor a pesar de tratamiento médico optimizado.
Efectos adversos de medicación oral que limite un aumento de dosis.
Diferencia significativa entre dolor en reposo y en movimiento.
Dolor localizado que requiera dosis elevadas de fármacos sistémicos.
Enfermedad avanzada con tiempo limitado para titular fármacos sistémicos.
Dolor somático confinado a pocos dermatomas.
Cordotomía para dolor unilateral de torso o miembro inferior en estadio avanzado.
-
Contraindicaciones para técnicas intervencionistas
Negativa del paciente.
Incapacidad de consentir.
Fragilidad extrema.
Dolor con gran componente psicoemocional no tratado.
Incapacidad para la colocación correcta del paciente para el procedimiento.
Coagulopatía no corregida que suponga más riesgos que beneficios.
Infección sistémica no tratada o infección en el sitio de punción.
Insuficiencia respiratoria o parálisis hemidiafragmática (para cordotomía).
Hipertensión endocraneana (para procedimientos neuroaxiales).
Es importante ofrecer y obtener el consentimiento informado, donde se explique al paciente y familiares los riesgos y beneficios de someterse a técnicas intervencionistas para el control del dolor.
-
Realización de Procedimientos invasivos
Los procedimientos invasivos en el dolor oncológico se clasifican en: Diagnósticos, pronósticos y terapéuticos.
Los bloqueos diagnósticos son aquellos en los que se utilizan anestésicos locales con el fin de determinar si la estructura a bloquear es la responsable principal del dolor que sufre el paciente.
Los procedimientos pronósticos se realizan para determinar si serán pasibles de realizar técnicas neurablativas, para esto se utilizan dosis mínimas de anestésicos locales preestablecidas y es de buena práctica realizarlos previo a los procedimientos neurolíticos.
En cuanto a los procedimientos terapéuticos neurolíticos. Estos podrán ser químicos (fenolización o alcoholización) o térmicos (radiofrecuencia).
Las técnicas químicas se reservan para los enfermos con expectativa de vida menor a tres meses ya que el dolor puede recidivar por reinervación y la neurolísis química puede provocar otras lesiones. La neuroablación por radiofrecuencia es mucho más controlable que la inyección de soluciones neurolíticas y mucho menos invasivas que las ablaciones quirúrgicas. Hay reportes preliminares que apoyan esta hipótesis pero el rol exacto de la radiofrecuencia versus los bloqueos tradicionales están aún por definirse.
Los agentes neurolíticos más usados son alcohol (33%- 100%) y Fenol (2% a 12% con o sin el agregado de glicerol). El alcohol etílico se utiliza entre el 50% y el 100%, este sería el alcohol absoluto. Provoca destrucción de las fibras nerviosas y degeneración walleriana. La lámina basal de las células de Schwan puede permanecer intacta esto permitiría la regeneración celular y provee un marco para la regeneración de nuevas
fibras nerviosas[11]. Es hipobárico con respecto al líquido cefalorraquídeo, causa dolor y sensación quemante al inyectarse. Asciende rápidamente al ser inyectado. El paciente deberá posicionarse con el lado doloroso hacia arriba. La denervación y el alivio del dolor ocurren a los pocos días y se completan a la semana. La dispersión en tejidos subyacentes produce daño y eventualmente puede ocasionar vasoespasmo arterial, esto se puede relacionar con isquemia y potencial paraplejía luego de bloqueo de plexo celíaco.
El fenol coagula proteínas como mecanismo de lesión, produce destrucción no selectiva de axones y vasos adyacentes. A concentraciones bajas actúa como anestésico local. El fenol con glicerina se fija rápidamente en el espacio subaracnoideo, la regeneración nerviosa ocurre más rápido que con el alcohol. Este es hiperbárico por lo que la zona dolorosa deberá colocarse hacia abajo[14]. Glicerol: es un agente neurolítico intermedio. Su inyección cerca del nervio produce daño perineural local[14].
Neuroablación por radiofrecuencia: La ablación por radiofrecuencia consiste en la termocoagulación de las fibras nerviosas generada por radiofrecuencia continua. Esta técnica eleva la temperatura tisular entre 80° y 90° C. Puede utilizarse también la radiofrecuencia pulsada que no causará lesiones destructivas[15].
Bloqueos nerviosos
Bloqueos perisféricos
Dentro de los bloqueos nerviosos se incluyen procedimientos sencillos, como bloqueo de puntos gatillo mediante inyección única, hasta procedimientos complejos como neurolísis. La infiltración de puntos gatillo y la acupuntura han demostrado efectividad para el tratamiento del dolor con componente miofacial[2]. Los bloqueos de nervios periféricos no están aconsejados a largo plazo, debido al bloqueo motor y/o autonómico que pudiese generar. Por otro lado, la infusión continua prolongada de anestésicos locales mediante catéter de nervio periférico puede general taquifilaxia a largo plazo. Éstos pueden ser una herramienta útil en cortos períodos de tiempo para calmar un dolor agudo sobreagregado y para titular analgesia sistémica. Varios estudios demostraron que algunos de ellos pueden servir para evitar el desarrollo de dolor posquirúrgico persistente (DPP), definido como dolor luego de 2 meses ocurrida la cirugía. Un ejemplo, es el bloqueo paravertebral para reducir la incidencia de DPP luego de mastectomía o toracotomía[3].
-
Bloqueos perisféricos más utilizados en el dolor oncológico
El bloqueo del ganglio del nervio Trigémino (quinto par craneal) o ganglio de Gasser se puede utilizar en pacientes con dolor facial persistente, originado por tumores de cabeza o cuello. La evidencia de su uso en pacientes con dolor oncológico es escasa, sin embargo, está bien establecido para tratamiento del dolor facial neuropático, que permite extrapolar su indicación para pacientes con dolor por cáncer[12].
En cabeza y cara se pueden realizar bloqueos perisféricos de las ramas terminales del trigémino, bloqueo del ganglio esfeno- palatino y del nervio hipogloso para dolor oncológico orofacial.
Los pacientes con dolor en la pared torácica pueden tratarse mediante bloqueos de nervios intercostales, bloqueo paravertebral o ablación por radiofrecuencia de la raíz dorsal torácica[8].
Bloqueos fasciales para el tratamiento del dolor oncológico
Recientemente, con el advenimiento del ultrasonido han ganado gran popularidad los bloqueos a nivel de las fascias. Algunos de ellos han sido publicados utilizando fenol o alcohol para el tratamiento del dolor oncológico. Existen reportes de estos a nivel del Plano transverso del abdomen. Bloqueo TAP neurolítico[16] y a nivel del plano del Erector de la Espina tanto a nivel torácico como abdominal[17],[18]. Estos procedimientos requieren aún de mayor número de publicaciones para evaluar su verdadera efectividad y seguridad.
Bloqueos del eje simpático
Los bloqueos simpáticos son efectivos para el tratamiento del dolor visceral de difícil control. La inyección de anestésicos locales en combinación con corticoides puede ser útil para confirmar el origen del dolor localizado y diferenciar el dolor visceral del somático. Técnicas imagenológicas como fluoroscopía, ultrasonografía y tomografía axial computada pueden utilizarse para determinar el target.
Cadena simpática
El sistema nervioso autónomo (SNA) está compuesto por el Sistema simpático (SNS) y el sistema parasimpático (PNS). Los cuerpos celulares se localizan anterolaterales a la columna de T2 a L2. El SNS está implicado en las situaciones que requieren la activación del organismo y juega un rol importante en determinadas patologías. Aquellos síndromes dolorosos que tienen un componente simpático pueden responder al bloqueo de las correspondientes fibras simpáticas[19].
Bloqueo del ganglio estrellado
Este bloqueo fue utilizado por primera vez por Leriche para el tratamiento de la angina de pecho. Hoy en día es utilizado para el diagnóstico y tratamiento de varios síndromes dolorosos mediados por el simpático así como disfunciones vasculares del miembro superior. Aunque no existen revisiones sistemáticas si contamos con un extensos reportes de casos sobre el éxito de este procedimiento. Actualmente, este procedimiento se realiza bajo ultrasonido siendo Kapral en 1995 el primero en describir esta técnica[19].
Para dolor en miembro superior, cabeza y cuello, se pude recurrir a bloquear el ganglio estrellado o nervios simpáticos torácicos altos, así como el bloqueo simpático lumbar para dolor en miembros inferiores. En aquellos casos en que el tumor a infiltrado el plexo nervioso, utilizarlo como target puede ser inefectivo. En su lugar podría dirigirse el bloqueo al ganglio de la raíz dorsal, una raíz sensitiva, analgesia epidural o intratecal[2]. El fenol en glicerol intratecal se puede utilizar como bloqueo en silla de montar para dolor por masa tumoral pélvica[10].
Bloqueo del plexo celíaco
Esta estructura se origina de las fibras simpáticas derivadas de los nervios: esplácnico mayor (T5 a T9), esplácnico menor (T10 y T11) y esplácnico mínimo (T12), se encuentra en el re- troperitoneo en la cara anterolateral de la aorta próximo al origen del tronco celíaco y la arteria mesentérica superior. Este plexo sirve como estación de relevo para las fibras simpáticas que traeb información de las vísceras abdominales: Páncreas, hígado, árbol biliar, vesícula biliar, estómago, bazo, glándulas suprerrrenales, riñones, mesenterio colon anscendente y parte del colon transverso[19].
El bloqueo del plexo celíaco ha sido utilizado con éxito para el dolor abdominal por cáncer de páncreas. También puede emplearse para tratar dolor que se origine en estructuras localizadas en todo el hemiabdomen superior[9]. Un metaanálisis mostró que 70% a 90% de los pacientes con dolor por cáncer en hemiabdomen superior respondían bien al bloqueo del plexo celíaco[19].
Las complicaciones más frecuentes descritas son diarrea e hipotensión ortostática, que puede reducirse realizando un bloqueo unilateral. Otras complicaciones, aunque poco frecuentes, son neumotórax, hematuria y hematoma retroperitoneal[9].
Una complicación muy poco frecuente pero grave, deriva de lesión directa o embolización de la arteria de Adamkiewicz, provocando paraplejia. Para reducir el riesgo, se puede optar por fluoroscopía con flujo de contraste y angiografía por sustracción digital para identificar la captación vascular[7].
Plexo hipogástrico superior
El plexo hipogástrico superior es la continuación caudal de la cadena simpática paraveretbral. Se encuentra por delante del a articulación L5-S1. Se accede a él por delante de esta articulación. Plancarte realizó un estudio prospectivo en 1997 en 227 pacientes que recibieron fenol al 10% luego de un bloqueo pronóstico positivo. El 73% de estos pacientes respondieron exitosamente a este procedimiento[19].
El bloqueo del plexo hipogástrico superior está indicado para el tratamiento del dolor por cáncer localizados en hemiabdomen inferior y pelvis como por ejemplo vejiga, próstata, testículos, colon descendente, sigmoides, útero, ovarios, vagina y recto.
Las complicaciones más frecuentes son: inyección intravascular por la proximidad con los vasos ilíacos, alivio incompleto del dolor, lesión de vejiga o recto, disfunciones sexuales o hematoma retroperitoneal. Si se utiliza el abordaje transdiscal, la discitis puede ser una complicación[19].
Ganglio impar
El bloqueo del ganglio impar puede emplearse para control del dolor por cáncer anorrectal, tercio distal de vagina y vulva[11]. Es el último ganglio de la cadena simpática y está formado por la fusión del final de la cadena para sacra. Anterior al ganglio se encuentra la ampolla rectal por lo que se recomienda su realización con fluoroscopía para evitar la punción rectal. La evidencia de su efectividad se limita a serie y reporte de casos. Se habla de 50% de efectividad con la técnica realizada con fluoroscopía[19].
-
Sistemas de administración intratecal de fármacos
Es la administración de fármacos directamente sobre el líquido cefalorraquídeo y receptores localizados en el sistema nervioso central, mediante un catéter a nivel subaracnoideo. Es una opción terapéutica cuando el control del dolor está limitado por aumentos inefectivos de analgésicos sistémicos y desarrollo de efectos adversos indeseables. Se colocará un catéter intratecal y los fármacos se administrarán mediante una bomba intratecal de fármacos o a través de sistemas externos. Los sistemas externos de infusión analgésica intratecal, tienen la ventaja
de que son de coste bajo, sin embargo, tienen alta incidencia de retiro de catéter accidental e infecciones potenciales. Por otro lado, requiere de una institución con personal entrenado, para evitar errores de manipulación y dosificación[11].
Los sistemas de administración de fármacos intratecales completamente implantados sortean la dificultad de las técnicas epidurales y los sistemas de infusión externos, brindando mejor analgesia. Son costo efectivos cuando la expectativa de vida es mayor a 3 meses. Se han utilizado opioides, anestésicos locales, clonidina y ziconotide en este tipo de sistemas. La punta del catéter de los sistemas de administración intratecal, debe ser congruente con el dermatoma afectado o situarse ligeramente por encima. Las complicaciones descritas están asociadas a los fármacos utilizados, infecciones, formación de granuloma en el catéter, hematomas, errores en programación de bomba etc. [2],[7].
-
Cifoplastia y ablación por radiofrecuencia
Cerca de 30% de los pacientes con cáncer se presentan con metástasis a nivel de la columna vertebral y hasta 70% de éstos presentan dolo severo localizado con o sin patrón radicular o déficit neurológico. El tratamiento habitual de estas lesiones incluye: radioterapia, analgésicos y bifosfonatos. Sin embargo, muchos pacientes presentan manejo inadecuado del dolor. Se debe considerar, con fuerte nivel de evidencia, el aumento vertebral (cifoplastia o vertebroplastia) para pacientes con dolor intenso secundario a fracturas vertebrales patológicas por compresión. Estos procedimientos se realizan de manera percutánea a nivel del cuerpo vertebral con el objetivo de direccionar un flujo de cemento óseo. Existe evidencia que demuestra mejoría en los escores de dolor y reducción del uso de opioides. Este procedimiento puede realizarse concomitantemente con ablación percutánea por radiofrecuencia aplicada en las lesiones óseas, con buenos resultados[7].
-
Procedimientos neuroquirúrgicos
En pacientes con cáncer con expectativa de vida mayor a 3 meses que sufren dolor somático unilateral, se pueden utilizar procedimientos sobre el sistema nervioso central para el control del dolor. Un ejemplo de estos es la cordotomía percutánea, donde se realiza una lesión a nivel del tracto espinotalámico lateral, mediante radiofrecuencia, guiado por tomografía computada y fluoroscopía. Recientemente, se han desarrollado métodos endoscópicos bajo visión directa. Produce analgesia en el lado contralateral del cuerpo. Ha sido utilizado para alivio del dolor torácico, dolor a nivel del plexo braquial, miembro inferior y pelvis[2].
Dentro de las complicaciones descritas se encuentra disestesia, dolor en espejo, debilidad motora, retención urinaria y ataxia. Se ha reportado una eficacia de 80%-100% para el control del dolor y reducción de uso de opioides. La mielotomía abierta o percutánea se ha utilizado para el dolor visceral abdominal o perineal. En este procedimiento se genera una lesión de 5 mm de profundidad a nivel de T3-T4 para dolor abdominal alto y T6-T8 para dolor abdominal bajo y pelvis.
Una lesión en la zona de entrada de la raíz dorsal puede emplearse para dolor limitado a extremidades o a la pared torácica. La indicación más común es en el tumor Pancoast. Finalmente, si todas las herramientas para el control del dolor han fallado, se puede optar por cingulotomia anterior estereotáxica[7],[8].
-
Neuromodulación
Son procedimientos conservadores para pacientes con buena expectativa de vida. Es una opción para tratar dolor localizado de tipo neuropático o isquémico difícil de controlar. Implica estimulación mediante dispositivos implantados sobre la médula espinal, ganglio de la raíz dorsal o nervios periféricos. Las indicaciones más frecuentes para estimulación sobre la médula espinal son el síndrome doloroso regional complejo, el síndrome poslaminectomía, radiculopatía crónica, neuropatía crónica inducida por quimioterapia, dolor neuropático intratable y dolor visceral. Muchas veces se utiliza para tratar un dolor de origen no oncológico que coexiste frecuentemente en estos pacientes, y que contribuye de forma negativa en su calidad de vida o para las polineuropatías como consecuencia de los tratamientos recibidos, especialmente post quimioterápicos[7].
Barreras en el tratamiento intervencionista en dolor oncológico
El gran desconocimiento en la mayoría de facultativos involucrados en el manejo del proceso oncológico respecto a qué tratamientos intervencionistas se pueden llevar a cabo desde las unidades del dolor y cómo pueden éstos ayudar a los pacientes es una de las principales barreras para que los pacientes accedan al tratamiento intervencionista en solor oncológico. En muchas unidades del dolor no se llevan a cabo dichos procedimientos a pesar de que muchos de ellos están descritos desde hace décadas. Por ello, hay que hacer una amplia labor de formación en las propias unidades del dolor y en los servicios implicados en el manejo del paciente oncológico.
El dolor es una consecuencia inevitable del proceso de la patología oncológica y sus tratamientos. Este hecho se hace más evidente en el momento actual en el que la supervivencia de muchos tumores es mayor y los pacientes no jerarquizan la importancia de contar con una consulta con expertos en dolor para poder disminuir el mismo ya que muchas veces lo consideran como “inevitable”.
Se debería extender la monitorización sistemática de escalas de dolor a todo paciente con un proceso oncológico. De esta manera se situaría como un factor importante a tener en cuenta y se priorizaría su tratamiento.
Durante mucho tiempo se ha entendido que las técnicas intervencionistas estaban relegadas al último escalón terapéutico y que, para poder emplearlas, el tratamiento farmacológico previo debía haber resultado ineficaz. Esto hacía que los pacientes oncológicos recibieran muy tarde estos tratamientos, siendo incluso a veces imposible aplicarlos debido al estado funcional deteriorado en el que se encontraban. Por ello, estudios recientes apoyan la necesidad de tratamiento intervencionista incluso desde el momento de inicio de los opioides. Es en esos estadios iniciales cuando se puede lograr mayor efectividad y mejoras en la calidad de vida con los procedimientos intervencionistas.
Hay que entender el manejo del dolor oncológico como un “proceso asistencial” que involucra múltiples especialistas. Los terapeutas del dolor que manejan procedimientos intervencionistas deben formar parte de estos equipos para proponerlos cuando estén indicados.
Otra dificultad en el tratamiento intervenciosita del dolor es la falta de evidencia de muchos procedimientos debido a la escasez de ensayos clínicos randomizados en dichos pacientes y a la dificultad de evaluaciones a largo plazo, condicionadas por la supervivencia de los pacientes. No obstante si contamos con recomendaciones basadas en la evidencia existente que avalan el uso de estos procedimientos[20].
-
Conclusiones
Actualmente, disponemos de una variedad importante de técnicas intervencionistas para el manejo del dolor oncológico. En líneas generales, en todos los estadios de la patología oncológica diferentes procedimientos intervencionistas pueden ser ofrecidos a los pacientes para mejorar su calidad de vida. Los procedimientos neuroablativos usualmente se reservan para pacientes con una expectativa de vida menor, e incluyen técnicas que utilizan alcohol, fenol o lesiones por radiofrecuencia. Es importante, incluso en estadios avanzados de la enfermedad, asegurar que no se vea afectada la función motora o autonómica, que pueda repercutir de manera negativa en su calidad de vida. Los sistemas de liberación de fármacos intratecales tienen el beneficio de brindar buena calidad analgésica, sin los efectos adversos de la analgesia sistémica. Cómo anestesiólogos debemos trabajar en divulgar la información sobre los beneficios de los procedimientos invasivos en la patología oncológica formando parte de equipos interdisciplinarios que abordan esta compleja patología de manera integral (Figura 1).
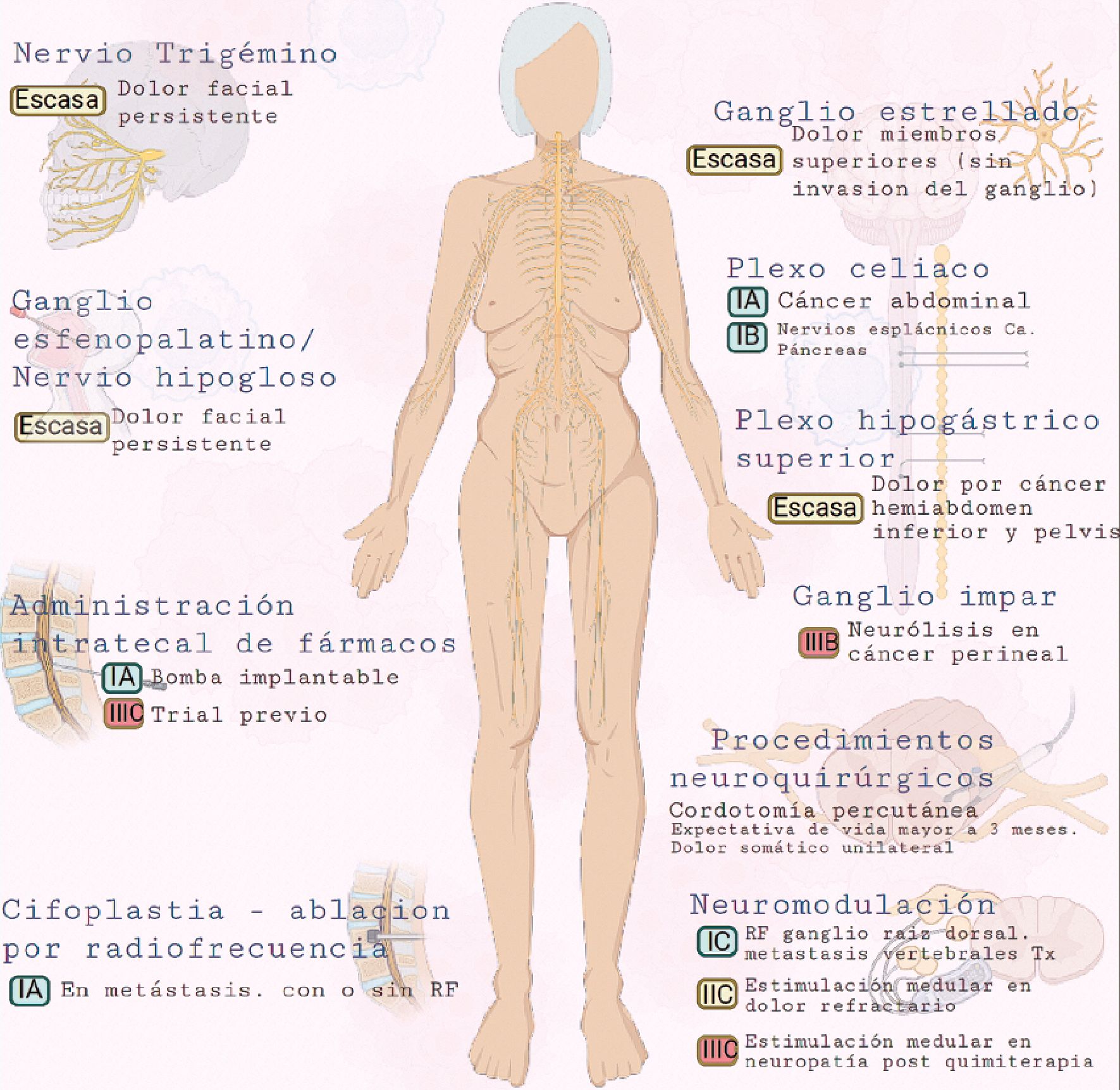
Figura 1.
-
Referencias
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209–49. https://doi.org/10.3322/caac.21660 PMID:33538338
2. Bhaskar A, Simpson K. “Interventional management of pain in cancer and palliative care ”. Medicina 48:1. UK: Elsevier; 2019.
3. Liu WC, Zheng ZX, Tan KH, Meredith GJ. Multidimensional Treatment of Cancer Pain. Curr Oncol Rep. 2017 Feb;19(2):10. https://doi.org/10.1007/s11912-017-0570-0 PMID:28220448
4. Hochberg U, Minerbi A, Boucher LM, Perez J. Interventional Pain Management for Cancer Pain: An Analysis of Outcomes and Predictors of Clinical Response. Pain Physician. 2020 Sep;23(5):E451–60. https://doi.org/10.36076/ppj.2020/23/E451 PMID:32967396
5. Torres LM, Calderón E, Pernia A, Martínez-Vázquez J, Micó JA. From the stairs to the escalator. Rev Soc Esp Dolor. 2002;9:289–90.
6. Miguel R. Interventional treatment of cancer pain: the fourth step in the World Health Organization analgesic ladder? Cancer Control. 2000;7(2):149–56. https://doi.org/10.1177/107327480000700205 PMID:10783819
7. Aman MM, Mahmoud A, Deer T, Sayed D, Hagedorn JM, Brogan SE, et al. The American Society of Pain and Neuroscience (ASPN) Best Practices and Guidelines for the Interventional Management of Cancer-Associated Pain. J Pain Res. 2021 Jul;14:2139–64. https://doi.org/10.2147/JPR.S315585 PMID:34295184
8. Gulati A, Shah R, Puttanniah V, Hung JC, Malhotra V. A retrospective review and treatment paradigm of interventional therapies for patients suffering from intractable thoracic chest wall pain in the oncologic population. Pain Med. 2015 Apr;16(4):802–10. https://doi.org/10.1111/pme.12558 PMID:25236160
9. Bhaskar A. Interventional pain management in patients with cancer-related pain. Postgrad Med. 2020 Nov;132 sup3:13–6. https://doi.org/10.1080/00325481.2020.1807796 PMID:32799614
10. Candido K, Stevens RA. Intrathecal neurolytic blocks for the relief of cancer pain. Best Pract Res Clin Anaesthesiol. 2003 Sep;17(3):407–28. https://doi.org/10.1016/S1521-6896(03)00016-8 PMID:14529011
11. Sindt JE, Brogan SE. Interventional Treatments of Cancer Pain. Anesthesiol Clin. 2016 Jun;34(2):317–39. https://doi.org/10.1016/j.anclin.2016.01.004 PMID:27208713
12. Candido KD, Kusper TM, Knezevic NN. New Cancer Pain Treatment Options. Curr Pain Headache Rep. 2017 Feb;21(2):12. https://doi.org/10.1007/s11916-017-0613-0 PMID:28265859
13. Essentials of pain medicine. 3rd ed. Bezon, Raja, Liu Fishhman, Cohen. Editorial Elseiver; 2011.
14. De Leon-Casasola O. Capítulo 50: Neurolysis of the Sympathetic Axis for Cancer Pain Management. RAJ’S PRACTICAL MANAGEMENT OF PAIN. Elsevier; 2009.
15. Leung JW, Bowen-Wright M, Aveling W, Shorvon PJ, Cotton PB. Coeliac plexus block for pain in pancreatic cancer and chronic pancreatitis. Br J Surg. 1983 Dec;70(12):730–2. https://doi.org/10.1002/bjs.1800701212 PMID:6640255
16. Restrepo-Garces C, Asenjo J, et al. Pain Pract. 2013;•••: https://doi.org/10.1111/papr.12065 PMID:23560547
17. Ramos, J., Peng, P. & Forero, M. Long-term continuous erector spinae plane block for palliative pain control in a patient with pleural mesothelioma. Can J Anesth/J Can Anesth 65, 852–853 (2018). https://doi.org/10.1007/s12630-018-1097-z.
18. Rocha-Romero A, Juárez-Lemus ÁM, Hernández-Porras BC. A safer step-by-step approach for erector spinae plane phenol neurolytic blocks. Can J Anaesth. 2021 Apr;68(4):585–6. https://doi.org/10.1007/s12630-020-01901-3 PMID:33420676
19. Baig S, Moon JY, Shankar H. Review of Sympathetic Blocks: Anatomy, Sonoanatomy, Evidence, and Techniques. Reg Anesth Pain Med. 2017;42(3):377–91. https://doi.org/10.1097/AAP.0000000000000591 PMID:28272291
20. Ferrer Albiach C.: Sociedad Española de oncología radioterápica. Sociedad Español Multidisciplinar del Dolor: Diagnóstico y tratamiento del Dolor asociado al Cáncer.

 ORCID
ORCID