Jesús H. Tovar MD.1,3, Jorman H. Tejada PhD.3,5, José M. Quintero MD.6, María C. Bonilla MD.7,1 Valentina Gutiérrez MD.6
Recibido: 14-07-2023
Aceptado: 01-09-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 4 pp. 440-443|https://doi.org/10.25237/revchilanestv53n4-22
PDF|ePub|RIS
Abstract
Systemic sclerosis is an orphan disease characterized by tissue fibrosis and organ dysfunction, mainly lung and heart. Its pathogenesis is still not clearly determined, although indications of genetic predisposition and alteration of immune function have been found. This pathology represents a challenge for the anesthesiologist from the approach of airway as well as the anesthetic technique, and other key aspects (venous access, monitoring of vital signs, protective pulmonary ventilation). A clinical case of a 12-year-old female with a history of diffuse systemic sclerosis and a history of 3 previous surgical procedures is presented; she arrives for a scheduled cosmetic procedure. Difficult airway predictors, without pre- surgical tests.
Resumen
La esclerosis sistémica es una enfermedad huérfana caracterizada por fibrosis de los tejidos y disfunción orgánica, principalmente, de pulmón y corazón. Su etiopatogenia aún no está claramente determinada aunque se han encontrado indicios de predisposición genética y alteración de la función inmunológica. Esta patología representa un desafío para el anestesiólogo desde el abordaje de la vía aérea así como la técnica anestésica, y otros aspectos claves (los accesos venosos, la monitorización de signos vitales, la ventilación pulmonar protectora). Se presenta un caso clínico de una femenina de 12 años con antecedente de esclerosis sistémica difusa, y antecedente de 3 procedimientos quirúrgicos previos. Llega para procedimiento estético programado. Predictores de vía aérea difícil, sin exámenes prequirúrgicos.
-
Introducción
La esclerosis sistémica (ES) o esclerodermia es una enfermedad autoinmunitaria crónica, que se caracteriza por la fibrosis y el engrosamiento de la piel, así como a órganos internos como los vasos sanguíneos, pulmones, riñones, tracto gastrointestinal, corazón, y disfunción progresiva. Con un amplio espectro de presentación clínica, está clasificada en una forma cutánea limitada y una enfermedad sistémica difusa más agresiva[1]. La incidencia global es de 1 por cada 10.000 personas; considerándose una enfermedad huérfana, con una proporción mujer a hombre de 4:1. Presenta una tasa de supervivencia a diez años del 66%[2], y su mortalidad está relacionada principalmente con fibrosis pulmonar (19%), hipertensión arterial pulmonar (14%) y enfermedad miocárdica (14%)[1]. La amplitud de complicaciones de la enfermedad representa un desafío perioperatorio para los anestesiólogos quienes deben adecuar las escalas de riesgo y las guías de manejo individualizado en el proceso anestésico. A continuación se presenta un caso clínico con un diagnóstico de ES y se discuten puntos clave en el abordaje perioperatorio.
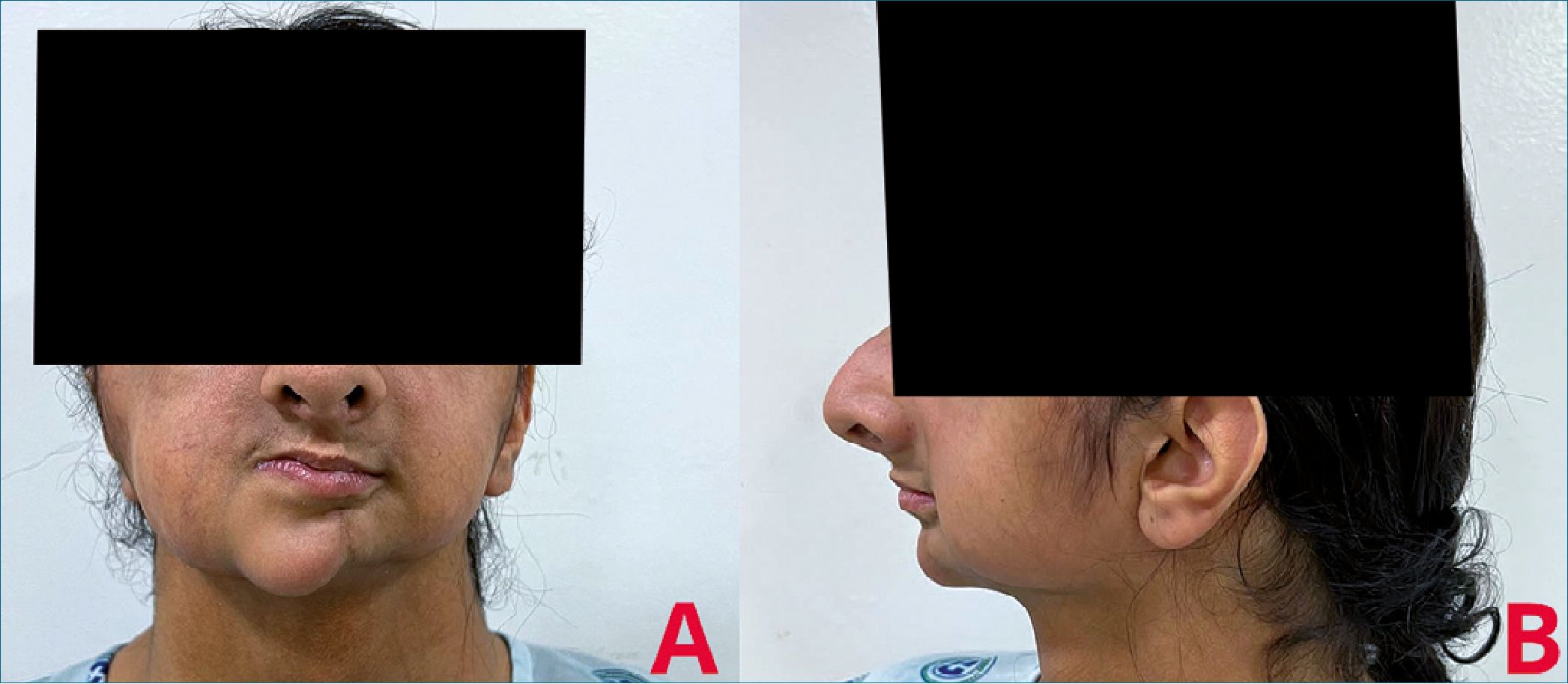
Figura 1.
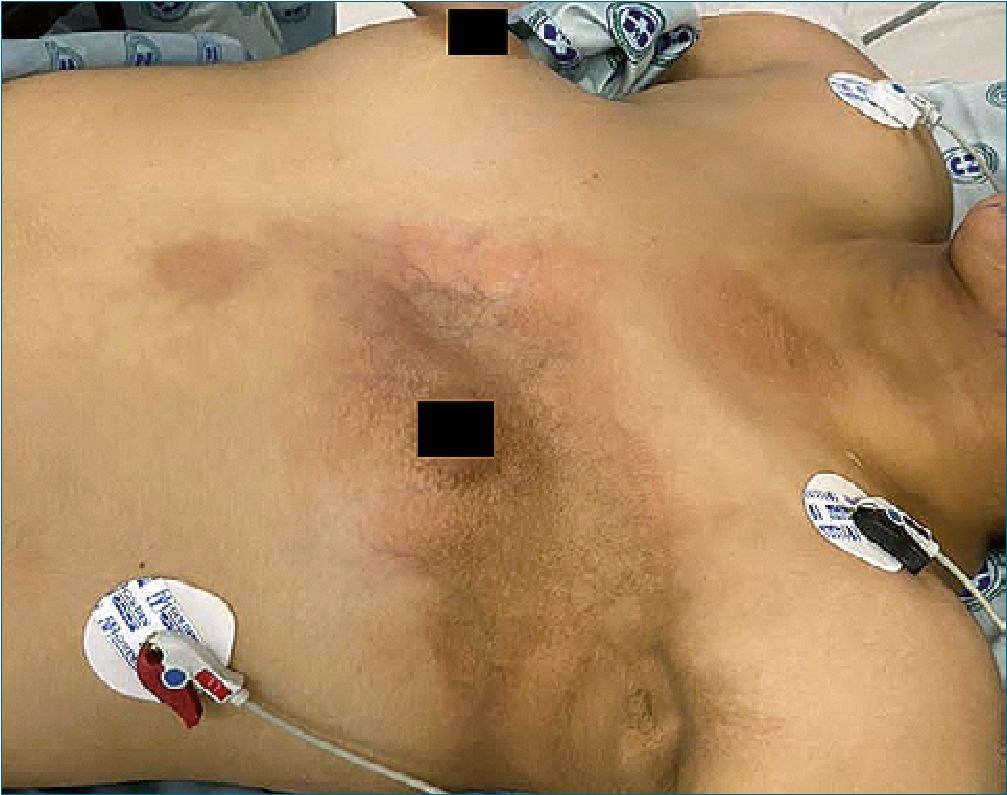
Figura 2. Glándulas mamarias asimétricas, retracción costal e hiperpigmentación izquierda. Fuente: Autor.
-
Caso clínico
Se trató de una niña de 13 años de edad con antecedente de esclerosis sistémica con componente mixto, aparentemente diagnosticado desde los 6 meses de vida. Tiene antecedentes de 3 procedimientos quirúrgicos relacionados con reconstrucción facial por dismorfias múltiples. A la valoración pre anestésica: ASA III, talla 166 cm, peso 60 kg, perímetro cefálico 55 cm, asimetría facial, frente prominente, nariz grande con puente nasal alto y delgado, hipoplasia de rama mandibular izquierda, orejas de implantación baja, rigidez cervical (Figura 1A y 1B). Glándulas mamarias asimétricas con hiperpigmentación, retracción de rejilla costal izquierda e hipoplasia pectoral izquierda (Figura 2). No se auscultaron soplos cardíacos. Extremidades con aracnodactilia, mano izquierda con retracción de muñeca y acortamiento de quinto dedo. Vía aérea: apertura oral de 2 cm, extensión cervical < 35a, distancia tiromentoniana < 6,5 cm, mallampati III, test de mordida del labio superior clase 3.
La paciente fue programada para nueva cirugía de reconstrucción facial con lipoinjerto de pared abdominal. El día del procedimiento se administró midazolam a dosis de 0,5 mg/kg. Monitoría no invasiva de signos vitales (PA, SO2, EEG). Preoxigenación con máscara facial difícil por sello inadecuado, con flujo de 10 L/min, durante 5 minutos; hasta obtener un end tidal O2 mayor al 90%. Para la inducción anestésica se utilizó lidocaína 1 mg/kg, propofol 2 mg/kg, y remifentanil 2 mcg/kg. Se intentó ventilación sin relajación neuromuscular, la cual se consider difícil; por ende se decidió no usar relajante.
En conjunto con dos anestesiólogos se definió inducción anestésica completa para manejo de la vía aérea; planteando los siguientes planes: a. Laringoscopia directa (con un grado de Cormack-Lehane IV); b. Videolaringoscopia con hoja angulada N°3 (con visualización parcial de la glotis); se prosiguió al plan; c. Fibrobroncoscopia con inserción de tubo anillado. Esta última exitosa en segundo intento. Durante los primeros dos procedimientos, se otorgó a la paciente oxigenación apneica mediante cánula nasal, y entre cada uno se ventilaba nuevamente la paciente, por lo que nunca presentó disminución en los valores de oximetría. El mantenimiento anestésico se realizó con técnica de TIVA (propofol/remifentanilo), a dosis guiadas.Ventilación pulmonar en modo SIMV (ventilación mandatoria intermitente sincronizada), con un volumen tidal de 6 ml/kg, y FiO2 0,4.
Al finalizar el procedimiento se extubó 10 minutos posteriores al cierre de los anestésicos; bajo inspiración profunda. Se lleva a sala de recuperación postanestésica con Aldrete 9/10, respiración espontánea con adecuado patrón ventilatorio; sin dolor y signos vitales estables.
-
Discusión
La esclerosis sistémica es una enfermedad huérfana en la que se produce fibrosis de la piel y otros órganos[1]. La prevalencia de enfermedad cardiaca y pulmonar, deben ser un objetivo de análisis durante la valoración perioperatoria. No existen lineamientos específicos de la enfermedad, por lo que se deben tener en cuenta consensos generales preoperatorios. La guía de valoración cardiovascular preoperatoria propone la realización de estudios complementarios previo a llevar el paciente a cirugía electiva de acuerdo a los hallazgos clínicos. En un paciente clasificado de alto riesgo se deben considerar toma de exámenes si es mayor de 45 años; y de riesgo intermedio si es mayor a 65 años: EEG de 12 derivaciones, ecocardiograma, medición de niveles de troponina y pro-BNP; teniendo en cuenta un enfoque multidisciplinario con el objetivo de optimizar el paciente. En el paciente con enfermedad cardíaca establecida y adherencia al tratamiento médico; se debe considerar llevar el tipo de procedimiento y la técnica anestésica, según los consensos de cirugía cardiaca[3]. La ecocardiografía debe ir dirigida a la evaluación estructural y dinámica cardiaca, y la arteria pulmonar, evaluando el riesgo de hipertensión pulmonar durante la ventilación controlada[4].
Una particularidad de la ES es la predisposición inmunológica a trombosis secundaria a daño vascular periférico, que se presenta como fenómeno de Raynaud y úlceras digitales. Este riesgo debe abordarse según el antecedente de manejo anti- trombótico[5]. Otro punto clave en este sentido, es la precaución con el uso de brazaletes para la toma de presión arterial, los accesos venosos periféricos en miembros superiores, y el control de la temperatura. Ante una emergencia médica debe realizarse ecocardiografía transoperatoria y monitoría invasiva según el grado de compromiso clínico[1].
En la valoración pulmonar debe incluirse la espirometría, capacidad de difusión del monóxido de carbono, y el test de caminata de 6 minutos en terreno plano; para evaluar la heterogeneidad de la ventilación pulmonar, y la capacidad muscular de la misma[6].
En cualquier escenario, el algoritmo conlleva a programar la cirugía del paciente una vez esté completamente estudiado, por lo cual, el día del procedimiento realizar una valoración preanestésica en sala, con la finalidad de hallar descompensaciones de la enfermedad subyacente es mandatoria. La inducción de anestesia general en un paciente con compromiso cardiovascular debe ser guiada por metas y bajo monitoría invasiva; se recomienda dos accesos venosos periféricos o un acceso venoso central, de acuerdo a la estimación del tiempo quirúrgico y el procedimiento. Se deben preferir inductores con menores efectos sobre el sistema cardiovascular y la presión arterial; o realizar una inducción prolongada; evitando la hipotensión[4],[7].
La prevalencia de enfermedad cardiaca es relevante en el paciente con esclerosis sistémica, por el riesgo infarto agudo de miocardio perioperatorio, secundario a fibrosis miocárdica[1]. Sin embargo; es importante tener en cuenta que se expresa generalmente con insuficiencia cardíaca congestiva progresiva, disfunción diastólica, afectación del nodo sinoauricular y arritmias (taquicardias supraventriculares y taquiarritmias ventricu- lares) con una prevalencia de 4% – 51%[8].
Un aspecto clave es el abordaje de la vía aérea en la paciente: la rigidez facial y cervical, limitaban la hiperextensión cervical, añadido a los múltiples predictores de vía aérea difícil para ventilar con máscara facial, colocación de dispositivo supraglótico y la laringoscopia directa. De acuerdo, a la estrategia Vortex aplicada se propone la co-oxigenación del paciente durante al menos 10 minutos. Las maniobras de Han y la triple maniobra de Safar, para nuestro caso no fueron posibles. Durante la valoración preanestésica, la evaluación de la vía aérea debe ir dirigida no sólo al diagnóstico de una vía aérea difícil predicha, sino también a establecer un plan de vía aérea según el paciente. En este sentido, además se tienen en cuenta los dispositivos disponibles en la institución; y siempre solicitar ayuda de otro anestesiólogo. Si está disponible, realizar evaluación ecográfica de la vía aérea y marcación de la membrana cricotiroidea. En nuestro caso, existía un riesgo elevado de CICO (Can’t Intubation, Can’t Oxygenation); por lo cual, se consideró en primera instancia laringoscopia directa; segundo videolaringoscopia; y en tercer lugar, la fibrobroncoscopia con paciente bajo inducción completa sin relajación neuromuscular. Una recomendación adicional es el uso de lubricantes con vasoconstrictores y uso de dispositivos de material suave, por riesgo de sangrado debido a la prevalencia de telangiectasias en la mucosa nasal y oral. Estos pacientes deben considerarse como “estómago lleno” dada la hipomotilidad del esfínter esofágico inferior que predispone a broncoaspiración[1],[4].
Al iniciar la ventilación pulmonar controlada, los parámetros ventilatorios deben ir ajustados a la dinámica del paciente. Los pacientes con esclerosis sistémica tienen una prevalencia de disfunción pulmonar del 75%, principalmente relacionada con la difusión de monóxido de carbono[9] Además, una dis- tensibilidad pulmonar disminuida, por lo que son susceptibles a elevación de las presiones PICO y Plateau. La ventilación pulmonar con presión positiva puede desencadenar una crisis de hipertensión pulmonar[4],[10].
La ES es una enfermedad huérfana con alta mortalidad relacionada principalmente al compromiso vascular, pulmonar y cardíaco, las investigaciones actuales apuntan a la optimización de la condición del paciente y el manejo integral. El anestesió- logo debe conocer esta patología y adecuar el abordaje perio-
peratorio, mediante el planteamiento de estrategias individualizadas según el compromiso y gravedad orgánica/sistémica de cada paciente.
Fuente de Financiamiento: Ninguno.
Conflicto de Intereses: Ninguno.
Este caso clínico cuenta con aprobación del comité de ética, bioética e investigación del Hospital Universitario Hernando Monca- leano Perdomo de Neiva, Colombia según del Acta de aprobación N° 05-05 de mayo de 2023.
-
Referencias
1. Carr ZJ, Klick J, McDowell BJ, Charchaflieh JG, Karamchandani K. An Update on Systemic Sclerosis and its Perioperative Management [Internet]. Curr Anesthesiol Rep. 2020;10(4):512–21. Available from: https://link.springer.com/10.1007/s40140-020-00411-8https://doi.org/10.1007/s40140-020-00411-8 https://doi.org/10.1007/s40140-020-00411-8 PMID:32904358
2. Efrimescu CI, Donnelly S, Buggy DJ. Systemic sclerosis. Part I: epidemiology, diagnosis and therapy [Internet]. BJA Educ. 2023 Feb;23(2):66–75. [cited 2023 Mar 11] Available from: https://linkinghub.elsevier.com/retrieve/pii/S2058534922001482 https://doi.org/10.1016/j.bjae.2022.10.004 PMID:36686888
3. Halvorsen S, Mehilli J, Cassese S, Hall TS, Abdelhamid M, Barbato E, et al.; ESC Scientific Document Group. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J. 2022 Oct;43(39):3826–924. https://doi.org/10.1093/eurheartj/ehac270 PMID:36017553
4. Roberta L. Hines KM. Stoeltings Anesthesia and Co-Existing Disease. 7th ed. Philadelphia (PA): Elsevier – Health Sciences Division; 2018. 744 pp.
5. Hughes M, Allanore Y, Chung L, Pauling JD, Denton CP, Matucci-Cerinic M. Raynaud phenomenon and digital ulcers in systemic sclerosis [Internet]. Nat Rev Rheumatol. 2020 Apr;16(4):208–21. https://doi.org/10.1038/s41584-020-0386-4 PMID:32099191
6. Andrade FM, Oliveira AD, Lopes AJ. Ventilation distribution as a contributor to the functional exercise capacity in patients with systemic sclerosis-associated interstitial lung disease without pulmonary hypertension. Braz J Med Biol Res. 2019;52(8):e8513. https://doi.org/10.1590/1414-431×20198513 PMID:31365695
7. Elizabeth S, Ramírez L, Martín E, Pérez R, Rojas RG, Ramírez IA, et al. Efecto de la inducción anestésica en el poder cardiaco en pacientes sometidos a cirugía cardiaca. 2012;(3):124-8.
8. Bissell LA, Anderson M, Burgess M, Chakravarty K, Coghlan G, Dumitru RB, et al. Consensus best practice pathway of the UK Systemic Sclerosis Study group: management of cardiac disease in systemic sclerosis. Rheumatology (Oxford). 2017 Jun;56(6):912–21. https://doi.org/10.1093/rheumatology/kew488 PMID:28160468
9. Efrimescu CI, Donnelly S, Buggy DJ. Systemic sclerosis. Part II: perioperative considerations [Internet]. BJA Educ. 2023 Mar;23(3):101–9. [cited 2023 Mar 11] Available from: http://www.bjaed.org/article/S2058534922001469/fulltext https://doi.org/10.1016/j.bjae.2022.10.003 PMID:36844439
10. Young CC, Harris EM, Vacchiano C, Bodnar S, Bukowy B, Elliott RR, et al. Lung-protective ventilation for the surgical patient: international expert panel-based consensus recommendations [Internet]. Br J Anaesth. 2019 Dec;123(6):898–913. https://doi.org/10.1016/j.bja.2019.08.017 PMID:31587835

 ORCID
ORCID