Juan Alberto Lira-Lucio1,2, Guillermo Ochoa Gaitán1,3, Christian Iván Padilla-Rivera1,3, Ramón Tomás Martínez-Segura4
Recibido: 31-05-2024
Aceptado: 09-09-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 6 pp. 572-580|https://doi.org/10.25237/revchilanestv53n6-05
PDF|ePub|RIS
Abstract
Cardiovascular diseases during pregnancy are one of the leading causes of maternal-fetal morbidity and mortality. Their incidence has increased due to the higher survival rates of women with congenital heart diseases and pregnancies at older ages accompanied by comorbidities. The pregnant woman with heart disease undergoes a series of physiological changes that can decompensate previously unknown asymptomatic heart conditions, modify the course of repaired congenital heart disease, or significantly exacerbate a known heart disease. Anesthetic management for obstetric surgery requires proper planning and referral to specialized centers based on the pathology, recognition of cardiovascular changes during the puerperium, and specific considerations for each group. The objective of this literature review is to emphasize the most common obstetric pathologies and the principles in their evaluation and intraoperative management.
Resumen
Las enfermedades cardiovasculares en el embarazo son una de las principales causas de morbimortalidad maternofetal. Su incidencia ha aumentado debido a la mayor supervivencia de mujeres con cardiopatías congénitas y a embarazos a edades mayores acompañados de comor- bilidades. La mujer embarazada con cardiopatía presenta una serie de cambios fisiológicos que pueden descompensar patologías cardíacas no conocidas y asintomáticas, modificar el curso de la enfermedad cardíaca congénita reparada o exacerbar de forma importante una cardiopatía conocida. La atención anestésica para cirugía obstétrica requiere de una adecuada planificación y referencia a centros especializados según la patología, reconocimiento de los cambios cardiovasculares propios del puerperio, así como consideraciones específicas para cada grupo. El objetivo de la revisión de la literatura es hacer énfasis en las patologías obstétricas más comunes y los principios en su evaluación y manejo transoperatorio.
Las causas de morbimortalidad materna se han modificado a través del tiempo. El incremento de manejos efectivos de comorbilidades (diabetes mellitus, hipertensión arterial, obesidad entre otros), edad materna avanzada, técnicas de reproducción asistida entre otros factores han incrementado la incidencia de embarazos en poblaciones de riesgo donde hace décadas no se reconocía como un proceso factible. En Estados Unidos las enfermedades cardiovasculares es una de las principales causas de mortalidad materna, siendo ésta aproximadamente responsable del 25% de las causas[1]. La Sociedad Europea de Cardiología (ESC) ha registrado 5.700 casos de embarazos en mujeres con enfermedad cardiovascular, el 57% tiene antecedente de cardiopatía congénita, el incremento de manejos efectivos de este grupo de enfermedades congénitas hace que cada vez sea más frecuente la atención de embarazadas con algún defecto cardíaco, y en contraste, el incremento el mayor riesgo cardiovascular. El embarazo per se modifica la fisiología cardíaca en la mujer embarazada, que sumado al estrés del trabajo de parto pueden desencadenar complicaciones sí este se desencadena. Existen pocas guías sobre la guía en la evaluación anestésico – quirúrgica de este grupo de pacientes, actualizaciones en el abordaje diagnóstico y manejo transanes- tesica hasta nuestro conocimiento[2],3].
El embarazo representa un desafío importante para el paciente con cardiopatías debido al aumento fisiológico exigencias del embarazo, el trabajo de parto y el alumbramiento. El embarazo es un período con múltiples adaptaciones, que pueden presentar cardiopatías de novo, acelerar el más pronóstico de enfermedades ya conocidas, o desencadenar enfermedades presentes no diagnosticadas[4]. Históricamente, la cardiopatía reumática era la forma más común de enfermedad cardíaca entre las mujeres embarazadas, particularmente, en países en desarrollo. Sin embargo, en tiempos más recientes, la cardiopatía congénita (CHD) ha superado a la cardiopatía reumática como la enfermedad cardíaca más común durante el embarazo, tanto en el mundo en desarrollo como en los Estados Unidos. La tasa de mortalidad materna ha ido en aumento a lo largo de los años, alcanzando aproximadamente del 1% al 2% de los embarazos. Se ha observado un aumento constante en las tasas de mortalidad, pasando de 9,1 muertes por cada 100.000 nacidos vivos en 1987-1990 a 16,0 muertes por cada 100.000 nacidos vivos en 2006-2010. Las enfermedades cardiovasculares y la miocardiopatía son responsables de un porcentaje significativo de estas muertes[5]-[8]. La mortalidad materna ha seguido aumentando, llegando a aproximadamente 17,0 muertes por cada 100.000 nacidos vivos entre 2011 y 2013. Las tasas de mortalidad varían según el grupo étnico, siendo más altas en mujeres negras. Las complicaciones del embarazo relacionadas con enfermedades cardíacas incluyen restricción del crecimiento fetal, desprendimiento placentario y parto prematuro. Para mujeres con miocardiopatía, se han observado eventos adversos, como fetos pequeños para la edad gestacional y muerte fetal. En el mundo desarrollado, la enfermedad cardíaca afecta aproximadamente al 1% al 4% de todos los embarazos, siendo una causa importante de morbimortalidad no obstétrica. Aunque los avances en la atención médica han permitido a más mujeres con enfermedades cardíacas concebir y dar a luz de manera segura, la enfermedad cardíaca sigue siendo una preocupación significativa durante el embarazo. En particular, la cardiopatía reumática sigue siendo un contribuyente importante a la morbilidad y mortalidad materna en los países en desarrollo. Las lesiones cardíacas simples incluyen estenosis valvular leve, defectos septales y comunicaciones anormales entre las cavidades cardíacas, mientras que las lesiones complejas incluyen anomalías anatómicas o fisiológicas más graves. Algunas mujeres con lesiones cardíacas simples aún pueden tener un riesgo elevado durante el embarazo debido a condiciones concomitantes[9].
-
Cambios cardiovasculares en el embarazo
El embarazo conlleva una serie de cambios significativos en el sistema cardiovascular, que se consideran un estado de alto flujo y baja resistencia[10],[11]. Estos cambios incluyen alteraciones en el volumen sanguíneo, la frecuencia cardíaca, el volumen sistólico, el gasto cardíaco, la resistencia vascular y la presión arterial, todos los cuales afectan el transporte de oxígeno tanto para la madre como para el feto. Además, la presencia de trastornos médicos puede alterar estos parámetros[12],[13].
Durante el embarazo, el volumen de sangre materna puede aumentar hasta en 1.600 ml en gestaciones únicas y hasta 2.000 ml en gestaciones múltiples. Este aumento comienza a observarse alrededor de las 12 semanas de gestación y alcanza su punto máximo entre las 32 y 34 semanas. En ese momento, el volumen de sangre puede estar entre 40% y 50% por encima de los niveles no relacionados con el embarazo, y se mantiene elevado hasta el parto. Este aumento se debe, principalmente, a un incremento en el volumen de plasma, que puede aumentar en 1.300 ml, mientras que la masa de glóbulos rojos aumenta en 400 ml. Este desequilibrio entre el plasma y los glóbulos rojos resulta en una anemia fisiológica durante el embarazo[11].
El hematocrito durante el segundo y tercer trimestre del embarazo suele mantenerse alrededor del 33,4% y 33,8% respectivamente, con una concentración promedio de hemoglobina de aproximadamente 12,5 g/dL al término del embarazo. Después del parto, el volumen del compartimento de sodio disminuye en 2 litros, principalmente debido a la diuresis que ocurre entre el segundo y quinto día posparto.
El mecanismo fisiológico detrás de esta hipervolemia durante el embarazo es complejo y está relacionado principalmente con el aumento en la producción de aldosterona debido a los estrógenos. La aldosterona aumentada provoca una retención de sodio y agua corporal total, lo que resulta en una hemo- dilución. Este efecto puede ser beneficioso para la circulación úteroplacentaria al reducir la viscosidad de la sangre y se ha relacionado con el crecimiento fetal. Sin embargo, niveles bajos de volumen plasmático se han asociado con condiciones patológicas como la preeclampsia.
-
Valoración preanestésica
En el caso de una resolución del embarazo programado en una mujer con enfermedad cardiovascular conocida, se deberá referir a un centro con adecuado equipo, recursos y personal con experiencia (anestesiólogo, obstetra e intensivista). La estratificación de riesgo materna cardíaca es una evaluación para la identificación de riesgo de eventos cardiovasculares acordes a la patología cardiovascular. Es importante categorizar en un riesgo para permitir una planeación temprana de la mujer con factores de riesgo. Un ejemplo de estas clasificaciones de riesgo materno es la clasificación modificada de la Organización Mundial de la Salud para enfermedades cardiovasculares (Tabla 1). La identificación y estadificación de las lesiones cardiovasculares pueden ayudar a la referencia según las necesidades de la paciente a centros especializados. El Colegio Americano de Ginecólogos y Obstetras (ACOG, por sus siglas en inglés) ha dividido los centros de atención sanitaria según la capacidad de atención[14].
La evaluación de riesgos para mujeres embarazadas con enfermedades cardíacas implica una historia clínica detallada y un examen físico, así como pruebas como un electrocardiograma de 12 derivaciones (ECG) y un ecocardiograma transtorácico. Además, pruebas avanzadas como la tomografía computarizada cardíaca y la resonancia magnética pueden proporcionar detalles adicionales valiosos, especialmente, en casos de patologías valvulares, miocardiopatías y enfermedades coronarias complejas, para las cuales pueden ser necesarias pruebas de esfuerzo o cardiopulmonares. Para estimar el riesgo, se han desarrollado diferentes puntuaciones y algoritmos basados en grandes estudios poblacionales[9].
La puntuación de riesgo CARPREG, que incluye cuatro predictores, se utiliza para determinar el riesgo durante el embarazo. Las mujeres con una puntuación de 0 se consideran de bajo riesgo, mientras que aquellas con una puntuación de 1 o más requieren una evaluación más exhaustiva. El índice de riesgo CARPREG II, que incorpora más predictores, ofrece una evaluación adicional[15],[16].
Además, la puntuación de riesgo ZAHARA, que utiliza ocho predictores ponderados, clasifica a las mujeres en diferentes categorías de riesgo. Las mujeres con puntuaciones más altas tienen tasas de eventos más altas durante el embarazo.
Aunque estas herramientas son útiles, se ha demostrado que subestiman el riesgo en comparación con la clasificación de la Organización Mundial de la Salud (OMS). Las mujeres con enfermedades cardíacas también tienen un mayor riesgo de complicaciones obstétricas, como aborto espontáneo, parto prematuro y hemorragia posparto, así como un mayor riesgo de resultados neonatales adversos[17],[18].
Basándose en la evaluación de riesgos, se determina la frecuencia de las visitas prenatales y se establece el lugar y el modo de parto. Se recomienda el parto vaginal en la mayoría de los casos, pero las mujeres de alto riesgo deben ser atendidas en centros especializados por equipos multidiscipli- narios. Todas las mujeres con enfermedades cardíacas en edad reproductiva deben recibir asesoramiento sobre el embarazo, idealmente, durante la adolescencia, por un proveedor con experiencia en el cuidado de pacientes con enfermedades cardíacas. La planificación previa a la concepción es crucial para mujeres con enfermedades cardíacas complejas, y el asesora- miento debe incluir discusiones sobre anticoncepción efectiva y las implicaciones del embarazo en la salud cardíaca materna y fetal[17],[19]-[21].
Tabla 1
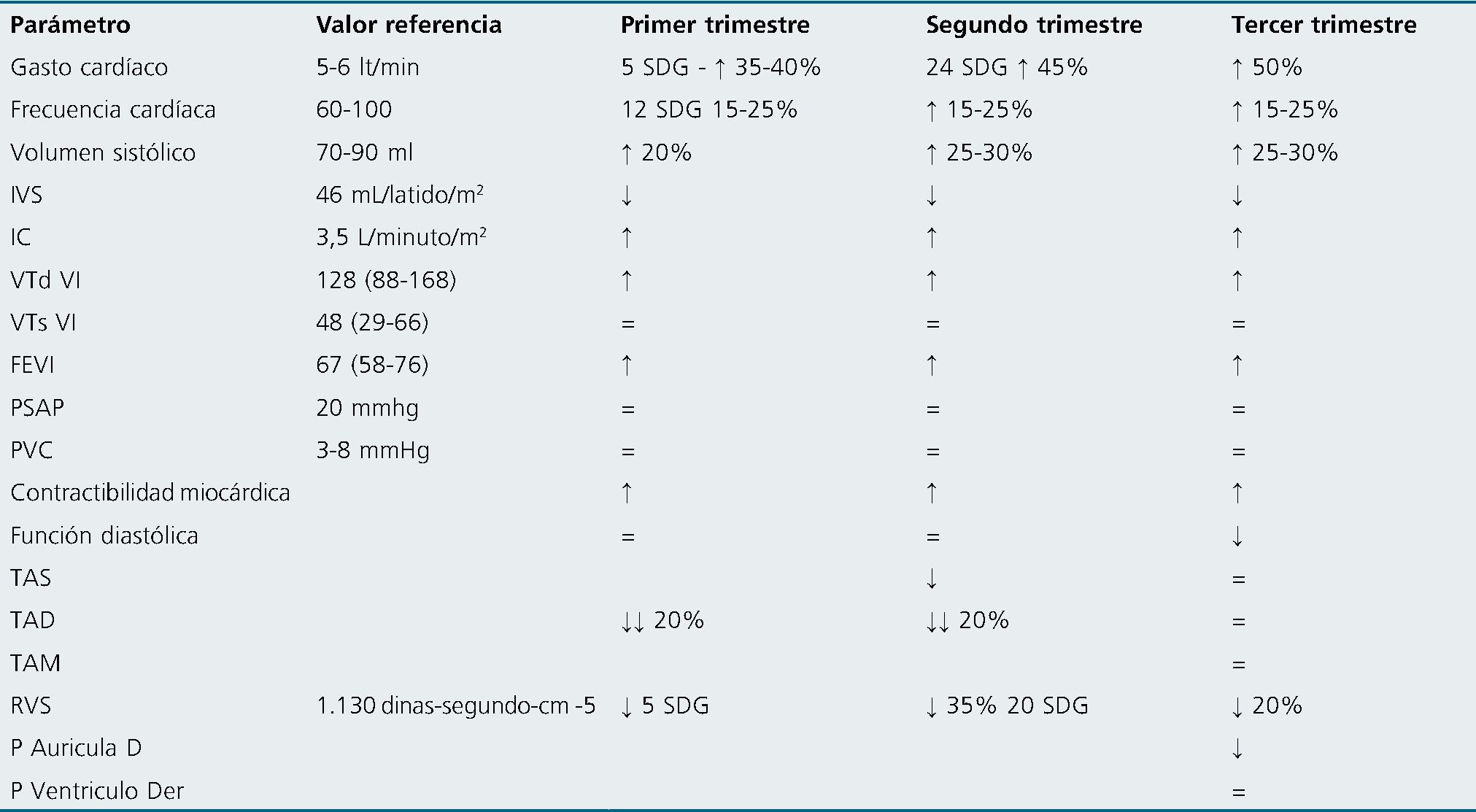
IVS = Índice de volumen sistólico, Índice Cardíaco, IC = Índice Cardíaco, VTd Volumen telediastolico; PVD: Presión de llenado VD.
-
Ecocardiografía
Recientemente, se ha destacado la utilidad de la ecografía perioperatoria en el punto de atención para la monitorización hemodinámica en pacientes sometidas a cesárea. La ecocardio- grafía transtorácica (ETT) ha surgido como una técnica alternativa no invasiva a la termodilución para este propósito y se ha utilizado, exitosamente, en mujeres embarazadas. Sin embargo, la ETT tradicional tiene limitaciones, incluida la falta de seguimiento continuo y la variabilidad entre operadores. Para abordar estas preocupaciones, se ha desarrollado la ecocar- diografía transtorácica continua (cTTE), que utiliza un soporte de transductor personalizado para permitir una monitorización continua en una vista fija. Se ha demostrado que la cTTE es beneficiosa en pacientes críticamente enfermos después de la cirugía cardíaca. Sin embargo, su validez en pacientes conscientes con respiración espontánea aún no se ha establecido[22]. El uso de ecocardiograma ha demostrado que después de la anestesia neuroaxial, la frecuencia cardíaca materna disminuye 11,18%, el gasto cardíaco disminuye 7,82%, pero el volumen sistólico se mantiene estable. Después de la obtención del recién nacido y la placenta, el volumen sistólico y el gasto cardíaco aumentaran 21,09% y 22,33%, respectivamente. El volumen telediastólico también aumentó, significativamente, después del parto del recién nacido, pero el volumen tele sistólico se mantuvo sin cambios. Después del parto del neonato, el acortamiento fraccional aumentó hasta el final de la cesárea mientras que la resistencia periférica total disminuye. Estos datos sugieren que el uso de ecocardiograma en pacientes con factores de riesgo puede aportar información clave y efectiva en el manejo transoperatorio. Sin embargo, su uso no se ha estandarizado o evaluado en la toma de decisiones transanestesicas[23].
Tabla 2
| Clasificación de riesgo | Descripción | Lesiones cardíacas | Nivel de atención |
| Clase I | Riesgo de morbimortalidad materna no aumentado o mínimamente incrementado | • Estenosis pulmonar leve no complicada
• Defecto septal ventricular • Conducto arterioso persistente • Prolapso de la válvula mitral sin más que una insuficiencia mitral trivial • Lesiones simples reparadas con éxito (comunicación interauricular o interventricular, conducto permeable arterioso, drenaje pulmonar y venoso anómalo) • Extrasístoles ventriculares aisladas y latidos ectópicos auriculares |
I: Cuidado básico
II: Cuidado especializado |
| Clase II | Incremento leve de mortalidad materna o morbididad moderada | • Defecto del tabique auricular o ventricular no reparado
• Tetralogía de Fallot reparada • La mayoría de las arritmias |
I: Cuidado básico
II: Cuidado especializado |
| Clase II-III | Riesgo de morbimortalidad incrementado moderadamente | • Miocardiopatía hipertrófica
• Enfermedad valvular cardíaca nativa o tisular no considerada Modificada por la Organización Mundial de la Salud I o IV • Coartación reparada • Síndrome de Marfan sin dilatación aórtica • Válvula bicúspide con aorta < 45 mm • Insuficiencia ventricular leve • Trasplante de corazón |
II: Cuidado especializado |
| Clase III | Riesgos significativamente incrementados de morbilidad, severo de morbilidad que requieren cuidados cardiacos y obstétricos pre-embarazo antenatales y post natales | • Válvula mecánica
• Ventrículo derecho sistémico • Circulación Fontán • Enfermedad cardíaca cianótica no reparada • Otras cardiopatías congénitas complejas • Síndrome de Marfan con aorta de 40 a 45 mm • Válvula aórtica bicúspide con aorta de 45 a 50 mm |
III: Cuidado subespecializado
IV: Centro de cuidados de la salud perinatal regional |
| Clase IV | El embarazo está altamente desaconsejado | • Hipertensión pulmonar
• Síndrome de Eisenmenger • Fracción de eyección ventricular sistémica < 30% • Disfunción ventricular sistémica con clase III-IV de la New York Heart Association • Estenosis mitral grave o estenosis aórtica sintomática • Síndrome de Marfan con aorta > 45 mm • Válvula aórtica bicúspide con aorta > 50 mm • Coartación severa nativa • Miocardiopatía periparto previa con cualquier deterioro residual de la función ventricular |
III: Cuidado subespecialidad
Se sugiere contar con ECMO IV: Centro de cuidados de la salud perinatal regional. Atención en centro con capacidad de cirugía cardiovascular ** Anestesiólogo con entrenamiento en obstetricia certificado 24 h |
-
Consideraciones trans anestésicas
En pacientes con lesiones que dependen de la poscarga, los anestesiólogos deben ser capaces de identificar, rápidamente la isquemia del miocardio. Puede ser necesario administrar vaso- presores de forma inmediata, y los medicamentos que pueden reducir la resistencia vascular sistémica deben administrarse con precaución. Durante el inicio de la anestesia neuroaxial, es importante monitorear, estrechamente, la presión arterial y algunos pacientes pueden requerir una monitorización continua de la presión arterial. Se deben utilizar monitores con alarmas dedicadas para detectar bradicardia, taquicardia y desaturación de oxígeno. Aquellos con antecedentes de taquiarritmia, alto riesgo de arritmias cardíacas o isquemia miocárdica deben ser monitoreados con electrocardiografía y/o telemetría, lo que podría requerir una planificación cuidadosa del perso- nal[1],[19],[21],[24],[25].
Para la mayoría de los pacientes con enfermedad cardíaca, se prefiere el parto vaginal con analgesia neuroaxial, como la epidural o la combinación epidural-espinal, cada una con sus propios beneficios. En casos donde se requiere una cesárea, se puede utilizar el catéter epidural para convertir a la anestesia quirúrgica, pero se deben tener precauciones adicionales para evitar el hematoma epidural espinal en pacientes anticoagulados. La prueba del catéter epidural puede realizarse con fentanilo en lugar de epinefrina, y se puede utilizar una titulación lenta de la analgesia epidural diluida para verificar la colocación intratecal.
Aunque el parto por cesárea, generalmente no es necesario, puede ser apropiado en ciertos casos, como grandes expansiones o aneurismas aórticos disecantes, estenosis valvular crítica, hipertensión pulmonar grave, necesidad de intubación traqueal para insuficiencia cardíaca aguda o pacientes anticoagulados. Para pacientes con enfermedades cardíacas que se someten a cesárea, se prefiere la anestesia neuroaxial. La técnica epiduralespinal combinada secuencial, que utiliza opioides e bupivacaí- na intratecal seguida de lidocaína epidural, suele ser preferida ya que ofrece una simpatectomía más gradual y confiable. La anestesia general puede ser apropiada en casos de descompensación cardiopulmonar, anticoagulación actual, trombocitope- nia grave o rechazo de la anestesia neuroaxial.
-
Arritmias cardíacas
La incidencia del bloqueo auriculoventricular congénito. (CAVB) está entre 1 de cada 15.000 y 1 de cada 20.000 nacimientos. El bloqueo cardíaco completo congénito es un fenómeno raro, ocurre en 1 de cada 22.000 nacidos vivos. Exhibe una amplia gama de fenotipos clínicos, y tiene tres etiologías principales: defectos estructurales, mediada por anticuerpos conferida por transferencia pasiva de autoinmunidad e idiopá- tico. Mientras que la conducción bloqueo que se origina en el nodo auriculoventricular puede generar un ritmo de escape complejo estrecho, infra nodal bloqueo que se origina en o debajo del haz que este asociado con un escape más lento y complejo. Según el Colegio Americano de Cardiología/Asociación Americana del Corazón/Sociedad del Ritmo Cardíaco (ACC/ AHA/HRS). Recomendaciones 2018, se recomienda el implante de marcapasos permanente[1]. El BAV completo congénito si se asocia con bradicardia sintomática, un ritmo de escape QRS ancho, una media diurna frecuencia cardíaca < 50 lpm, ectopia ventricular compleja, o disfunción ventricular[26],[4]. Los efectos perjudiciales de la estimulación crónica del VD incluyen la manifestación de insuficiencia cardíaca, adverso ventricular izquierdo remodelación e insuficiencia mitral funcional. Sin embargo, en una perspectiva de por vida, CAVB es una potencial enfermedad, potencialmente, mortal con morbilidad significativa. Existe riesgo de ataques de síncope y muerte súbita a cualquier edad, incluso en ausencia de signos pronósticos[27]. Existen diferentes opiniones sobre la necesidad de un marca- pasos temporal durante el embarazo, autores sugieren que no se requiere un marcapasos de forma rutinaria durante trabajo de parto en pacientes con bloqueo auriculoventricular, favoreciendo gestión con sólo disposiciones de emergencia para los pacientes. disponible. La estimulación temporal durante el parto debe estar reservado para mujeres seleccionadas con todo el corazón bloqueo y síntomas debido al riesgo de bradicardia y síncope[27].
-
Síndrome de Brugada
El síndrome de Brugada (SBr) es una canalopatía rara. Se identificó por primera vez en 1992 y es responsable del 4% del total de muertes súbitas. El diagnóstico incluye cambios elec- trocardiográficos típicos (elevación del segmento ST tipo coved seguida de una onda T invertida en las derivaciones derechas), posiblemente asociados con otras arritmias supraventriculares o bloqueo de rama derecha. Suelen desencadenarse por desequilibrios fisiológicos, como actividad física intensa, fiebre o cualquier otra situación provocada por una estimulación simpática. Si es sintomático, el síndrome puede manifestarse con síncope, palpitaciones, convulsiones o incluso paro cardíaco. La mayoría de los diagnósticos se alcanzan durante la investigación clínica de los familiares de las víctimas de muerte súbita, ya que existe transmisión familiar del SBr, con un patrón autosómico dominante, pero de penetrancia variable. Los pacientes suelen manifestar defectos en los canales de sodio cardíacos, que afectan la entrada de sodio durante la despolarización. En otros casos, los defectos de los canales de potasio y calcio también pueden comprometer la repolarización. El paro cardíaco ocurre con fibrilación ventricular, por tanto, el tratamiento para pacientes sintomáticos o de alto riesgo es un cardiodesfibrilador implantable (DAI). Durante el manejo anestésico, en ocsaiones se han reportado el uso de anestesia general, por considerar a anestésicos locales fármacos antiarrítmicos (clase Ib). Sin embargo, en pacientes con mutación SCN5A, como BrS, de hecho son potencialmente arritmogénicos. Por lo tanto, en estos pacientes se prefiere el abordaje subaracnoideo, debido a la mínima absorción sistémica y la necesidad de pequeñas dosis para lograr el bloqueo. En términos de elección del anestésico local, la ropivacaína es menos cardiotóxica que la bupivacaína, que presenta un efecto de “entrada lenta, desaceleración”, debido a una mayor afinidad del canal de sodio cardíaco[28].
-
Síndrome de Eisenmenger
El Síndrome de Eisenmenger (SE), es caracterizado por una derivación bidireccional de derecha a izquierda con o sin hipetensión pulmonar. La hipertensión pulmonar es una rara complicación de la cardiopatía congénita durante el embarazo, con una elevada tasa materna mortalidad del 30%-50%. Las mujeres diagnosticadas con ES se les aconseja poner fin a su embarazo. Aún el manejo exitoso del ES durante el embarazo es complicado e implica sólo un estrecho margen de seguridad materno. Con desafíos secundarios a la dificultad de comunicación con el paciente. El desarrollo de la enfermedad de Eisenmenger (ES) afecta, aproximadamente, al 11% de los pacientes con derivaciones de izquierda a derecha, quienes han experimentado una infancia asintomática y han desarrollado una disminución en la tolerancia al ejercicio debido a la aclimatación. Esta condición es el resultado de un proceso patológico complejo que conduce a cambios estructurales y histológicos en los vasos sanguíneos pulmonares, provocando una progresiva obstrucción pulmonar y una disminución en la presión en la vasculatura pulmonar. La ES, generalmente, se manifiesta en la tercera década de la vida, con un aumento en la resistencia vascular pulmonar en relación con la resistencia vascular sistémica, lo que, finalmente, conduce a la imposibilidad de revertir la derivación. En el caso de nuestro paciente, este proceso se aceleró debido a factores adicionales como el aumento del volumen sanguíneo durante el embarazo, el aumento del gasto cardíaco y el estrés durante el parto[29]. La disminución repentina en el volumen sanguíneo durante un parto cesárea puede ser mortal, aumentando, significativamente, la mortalidad materna. Por lo tanto, se prefiere el parto vaginal con una segunda etapa de trabajo de parto acortada. Durante la anestesia, el objetivo es mantener el gasto cardíaco y reducir la resistencia vascular pulmonar para minimizar la inversión de la derivación. La anestesia espinal puede disminuir la resistencia vascular sistémica, lo que puede provocar un aumento en el shunt y la hipoxemia. Por otro lado, la anestesia epidural disminuye la resistencia vascular pulmonar y sistémica, lo que la hace segura para su uso. El oxígeno y los vasodilatadores pulmonares pueden mejorar la oxigenación al reducir la derivación de derecha a izquierda. Se debe tener precaución al administrar grandes dosis de oxito- cina debido a su efecto vasodilatador. Sin embargo, se evitan medicamentos como la metilergometrina y las prostaglandinas debido a su efecto en el aumento de la resistencia vascular pulmonar[12].
-
Cardiomiopatía no compactada
La miocardiopatía no compactada del ventrículo izquierdo (NCVI) es un tipo raro de miocardiopatía que ocurre cuando el ventrículo izquierdo no logra compactarse durante la em- briogénesis. Esto da como resultado una pared ventricular de dos capas, con una capa epicárdica compacta más delgada y una capa endocárdica interna no compactada con grandes trabeculaciones. Su etiología suele ser genética. Una diferencia clave en comparación con otras miocardiopatías es el mayor riesgo de arritmias. Las arritmias se asocian con mal pronóstico debido a insuficiencia ventricular, eventos tromboembólicos y muerte súbita[30]. La atención anestésica de los pacientes con miocardiopatías está bien descrita, pero la miocardiopatía del VINC plantea desafíos adicionales, en particular el mayor riesgo de arritmias. La anestesia neuroaxial es ventajosa ya que el bloqueo simpático asociado reduce el riesgo de taquicardia y otras arritmias. Sin embargo, puede ser aconsejable evitar la epinefrina si se opta por la anestesia subaracnoidea, ya que puede provocar taquicardia y arritmias. La oxitocina debe administrarse, lentamente, para evitar taquicardia e hipotensión. El uso de ergometrina debe sopesarse frente al riesgo asociado de infarto de miocardio y edema pulmonar[16],[23],[31].
-
Tetralogía de Fallot
La tetralogía de Fallot (TOF) es la cardiopatía cianótica con- génita más común, con una incidencia de 35 por 100.000 nacidos vivos. Se caracteriza por un defecto del tabique ventricular (VSD), aorta predominante y obstrucción del tracto de salida del ventrículo derecho (VD) con hipertrofia secundaria del VD. Se enmarca como una pentalogía de Fallot (FOP) cuando se asocia con una comunicación interauricular (CIA) o un foramen oval permeable. La esperanza de vida sin reparación quirúrgica es corta y los pacientes cuya afección no se corrige rara vez sobreviven hasta la edad adulta. La TOF no corregida se asocia con un riesgo de mortalidad materna del 5% al 15% y una alta tasa de pérdida fetal. No hay datos suficientes sobre el riesgo de mortalidad en la POF, probablemente, debido a la escasez de casos. Los cambios fisiológicos del sistema cardiovascular durante el embarazo pueden conducir a una insuficiencia cardíaca descompensada en estas pacientes. La reducción de la resistencia vascular sistémica (RVS) en presencia de una obstrucción grave del tracto de salida del VD puede empeorar el cortocircuito de derecha a izquierda y la hipoxemia, mientras que el aumento de la carga de volumen en el período periparto puede precipitar la insuficiencia cardíaca derecha. Estas pacientes que se presentan para una cesárea plantean desafíos adicionales para el aneste- sista[32].
-
Situaciones de emergencia
-
Hipotensión
La hipotensión es común durante el bloqueo neuroaxial para parto o cesárea (CD). Si no se trata rápidamente, una disminución de la presión arterial (BP) puede tener efectos nocivos, que incluyen náuseas, vómitos, mareos y enfermedades cardiovasculares maternas. Inestabilidad y disminución úteroplacentaria. flujo sanguíneo con acidosis fetal resultante, hipoxia y bradicardia. En la última década, el agonista a fenilefrina (PE). Ha sido el vasopresor de elección para la prevención y el tratamiento. de hipotensión inducida por la columna. Aunque muestra un perfil de efectos secundarios favorable en comparación con la efedrina, La EP se asocia con una bradicardia mediada por baro-
receptores, y por lo tanto, causa una reducción posterior en el corazón producción (CO). Con una incidencia de hasta el 30% reportada en la literatura, la bradicardia y, por tanto, la reducción del CO son depreocupación particular para el anestesiólo- go obstétrico. Cuando esto ocurre en una parturienta y un feto sanos, parece haber ser efectos insignificantes, sin embargo, la preservación de la frecuencia cardíaca (HR) y CO pueden ser de particular importancia en pacientes de alto riesgo, situaciones como enfermedad cardíaca materna, insuficiencia placentaria, y sufrimiento fetal[33]. El uso de un régimen de bolo intermitente entre NE 6 mcg y PE 100 mcg para mantener la PA durante la anestesia espinal para la EC, pero la NE preservó la FC materna de manera más efectiva que la PE[33]. En un ensayo clínico, se comparó la infusión fija de norepinefrina de 0,05 pg-kg 1-min 1 vs la dosis en bolo de 0,10 pg/kg. El bolo inicial fue más eficaz para reducir la incidencia de hipotensión espinal en comparación con la perfusión de 0,05 pg/kg/min[34]. Si la bradicardia asociada con la anestesia espinal se debe por bloqueo simpático alto, es posible que empeorar la hemodinámica. Además, cualquier caída de CO puede causar acidosis fetal porque el flujo sanguíneo uterino es dependiente del CO materno, sin embargo, el uso de glicopirrolato no ha demostrado disminuir la incidencia de hipotensión[35].
Otro fármaco que se ha empleado para la disminución de la hipotensión posterior al bloqueo simpatico es el ondansetron. El mecanismo del ondansetrón para reducir la hipotensión y bradicardia no está clara, se postula que el bloqueo de La unión de la serotonina a los receptores 5-HT3 en el ventrículo izquierdo explica la eficacia del ondansetrón. La simpatectomía inducida por anestesia local y la compresión aortocava estimula los receptores en el ventrículo izquierdo para causar el reflejo de Bezold-Jarisch.
Ondansetrón antagoniza el reflejo de Bezold-Jarisch, lo que puede explicar su eficacia en la prevención bradicardia y SIH durante la anestesia espinal[36].
-
Paro cardiorrespiratorio
El paro cardíaco en una paciente obstétrica es un evento raro con una incidencia estimada en 2,78 por 100.000 pacientes 514 a 1 de cada 12.000 hospitalizaciones. Su manejo requiere modificaciones específicas a la reanimación genérica de adultos protocolo, incluido el desplazamiento uterino izquierdo y el inicio temprano histerotomía de reanimación o cesárea perimortem, para optimizar las posibilidades de una maternidad exitosa resucitación. Las complicaciones asociadas a la anestesia incluyen toxicidad por anestésicos locales y alto bloqueo neuroaxial. Las causas no asociadas a anestesia más comunes de paro cardíaco materno fueron: hemorragia; insuficiencia cardíaca, embolia de líquido amniótico y sepsis[5].
-
Tromboembolia pulmonar
Se estima que durante el embarazo aumenta el riesgo de tromboembolismo venoso, aproximadamente, cinco veces. De todos modos, eso es poco frecuente entre mujeres sanas. La incidencia de tromboembolismo venoso (TEV) se reporta de 0,4 por 1.000 embarazos, de los cuales el 83,3% fueron trombosis venosa profunda y el 16,7% fueron embolia pulmonar en embarazadas La PE puede ocurrir antes del parto, durante el
parto y en el período posparto. En el caso de una parturienta con signos de inestabilidad pulmonar durante la cesárea, el diagnóstico diferencial inicial es entre una anafilaxia y embolia pulmonar (TEP) y coagulopatía aguda, e incluso hemorragia cerebral, debida a embolia de líquido amniótica, hemorragia cerebral o preeclampsia severa. Clínicamente, la manifestación catastrófica de la TEP y AFE es similar. En el caso actual. Se han estudiado los criterios de diagnóstico en AFE[47]. Según la Sociedad de Medicina Materno Fetal (SMFM) y la Fundación para la Embolismo del Líquido Amniótico, Los cuatro criterios de diagnóstico propuestos para AFE incluyen: 1) paro cardíaco repentino o tanto respiratorio como hemocolapso dinámico; 2) coagulación intravascular diseminada (CID); 3) ausencia de fiebre y 4) inicio clínico durante el trabajo de parto o dentro de los 30 minutos posteriores al parto. Un dímero D aumentado es un marcador predictivo valioso para TEP. El valor de corte del dí- mero D de 800 ng/mL garantiza una alta sensibilidad y aumenta la especificidad en comparación con el umbral convencional de 500 ng/mL. Considerar este umbral más alto puede reducir el número de número de tomografías computarizadas innecesarias y, posteriormente, exposición a la radiación en mujeres después de un parto por cesárea[26].
-
Referencias
1. Meng ML, Arendt KW. Obstetric Anesthesia and Heart Disease: Practical Clinical Considerations. Anesthesiology. 2021 Jul;135(1):164–83. https://doi.org/10.1097/ALN.0000000000003833 PMID:34046669
2. El Hossieny KM. Ultrasound-guided nerve block for pediatric inguinal herniorrhaphy. Egypt J Anaesth. 2020 Jan;36(1):56–60. https://doi.org/10.1080/11101849.2020.1753399.
3. Czernicki M, Kunnumpurath S, Park W, Kunnumpurath A, Kodumudi G, Tao J, et al. Perioperative Pain Management in the Critically Ill Patient. Vol. 23, Current Pain and Headache Reports. Current Medicine Group. 2019;LLC:1.
4. Preston D, Klucsarits S, Moon T, Nasir D. Congenital complete heart block in the setting of severe pre-eclampsia requiring urgent cesarean section. Int J Obstet Anesth. 2020 Nov;44:74–6. https://doi.org/10.1016/j.ijoa.2020.07.012 PMID:32805470
5. Lucas DN, Kursumovic E, Cook TM, Kane AD, Armstrong RA, Plaat F, et al. Cardiac arrest in obstetric patients receiving anaesthetic care: results from the 7th National Audit Project of the Royal College of Anaesthetists. Anaesthesia. 2024 May;79(5):514–23. https://doi.org/10.1111/anae.16204 PMID:38214067
6. Yu J, Nishi C, Adly E, Cordovani D. Rethinking spinal anesthetic with bupivacaine for cesarean delivery in parturient with Brugada syndrome [English Edition]. Braz J Anesthesiol. 2023;73(2):236–7. https://doi.org/10.1016/j.bjane.2022.08.006 PMID:36096235
7. Kang T, Tao J, Wang X, Liu Y, Jin D. Epidural ropivacaine versus bupivacaine for cesarean sections: a system review and meta-analysis. J Matern Fetal Neonatal Med. 2024 Dec;37(1):2313356. https://doi.org/10.1080/14767058.2024.2313356 PMID:38342577
8. Yellin S, Wiener S, Kankaria R, Vorawandthanachai T, Hsu D, Haberer K, et al. Characteristics and outcomes of socioeconomically disadvantaged pregnant individuals with adult congenital heart disease presenting to a Cardio-Obstetrics Program. Am J Obstet Gynecol MFM. 2023 Nov;5(11):101146. https://doi.org/10.1016/j.ajogmf.2023.101146 PMID:37659603
9. Chan A, Wolfe DS, Zaidi AN. Pregnancy and Congenital Heart Disease: A Brief Review of Risk Assessment and Management. Clin Obstet Gynecol. 2020 Dec;63(4):836–51. https://doi.org/10.1097/GRF.0000000000000579 PMID:33074980
10. Gould C, Bhatia K. Remifentanil labor analgesia in a parturient with Brugada syndrome. Korean J Anesthesiol. 2021 Feb;74(1):76–8. https://doi.org/10.4097/kja.20272 PMID:32536043
11. Wang P, Chen X, Zhang J, Ma Y. Continuous epidural anesthesia with double catheters for cesarean section in a patient with severe pulmonary hypertension A case report. Medicine (United States). 2021 Nov 24;100(47).
12. Gangakhedkar GR, Chhabria RD, Gour SD, Palani Y. Emergency caesarean section of a patient with eisenmenger’s syndrome: A tight-rope walk. Ann Card Anaesth. 2020;23(1):95–7. https://doi.org/10.4103/aca.ACA_175_18 PMID:31929258
13. Sheng Z min, Shen Y ping, Pan Z bin, Zhu M, Sun H tian, Liu J ping, et al. Comparative study on the manually-controlled variable-rate versus fixed-rate infusion of norepinephrine for preventing hypotension during spinal anesthesia for cesarean delivery. J Clin Anesth. 2022 Nov 1;82.
14. McCabe M, An N, Aboulhosn J, Schwarzenberger J, Canobbio M, Vallera C, et al. Anesthetic management for the peripartum care of women with Fontan physiology. Int J Obstet Anesth. 2021 Nov;48:103210. https://doi.org/10.1016/j.ijoa.2021.103210 PMID:34425324
15. Tsukinaga A, Yoshitani K, Kubota Y, Kanemaru E, Nishimura K, Ogata S, et al. Anesthesia for Cesarean Section and Postpartum Cardiovascular Events in Congenital Heart Disease: A Retrospective Cohort Study. J Cardiothorac Vasc Anesth. 2021 Jul;35(7):2108–14. https://doi.org/10.1053/j.jvca.2020.11.042 PMID:33309496
16. Prior CH, Burlinson CE, Chau A. Emergencies in obstetric anaesthesia: a narrative review. Anaesthesia. 2022 Dec;77(12):1416–29. https://doi.org/10.1111/anae.15839 PMID:36089883
17. Palanisamy S, Rudingwa P, Panneerselvam S, Satyaprakash MV, Kuberan A, Amala R. Effect of low dose phenylephrine infusion on shivering and hypothermia in patients undergoing cesarean section under spinal anesthesia: a randomized clinical trial. Int J Obstet Anesth. 2022 May;50:103542. https://doi.org/10.1016/j.ijoa.2022.103542 PMID:35381421
18. Fischer C, Bonnet MP, Girault A, Le Ray C. Update: focus in-hospital maternal cardiac arrest. J Gynecol Obstet Hum Reprod. 2019 May;48(5):309–14. https://doi.org/10.1016/j.jogoh.2019.02.007 PMID:30796984
19. Xue X, Lv X, Ma X, Zhou Y, Yu N, Yang Z. Prevention of spinal hypotension during cesarean section: A systematic review and Bayesian network meta-analysis based on ephedrine, phenylephrine, and norepinephrine. J Obstet Gynaecol Res. 2023 Jul;49(7):1651–62. https://doi.org/10.1111/jog.15671 PMID:37170779
20. Weinstein J, Shinfeld A, Simchen M, Cahan T, Frogel J, Arad M, et al. Anesthesia in parturients presenting with marfan syndrome. Isr Med Assoc J. 2021 Jul;23(7):437–40. PMID:34251127
21. Hartono R, Ramadhani DD, Isngadi I. Combination of low-dose spinal anesthesia and epidural anesthesia as anesthetic management in patient with uncorrected Double Outlet Right Ventricle (DORV) underwent cesarean section. Ann Card Anaesth. 2022;25(4):518–21. https://doi.org/10.4103/aca.aca_315_20 PMID:36254920
22. Liao Z, Feng S, Song H, Huang H. Continuous transthoracic echocardiographic monitoring for changes in maternal cardiac hemodynamics during cesarean section under combined epidural-spinal anesthesia: a prospective, observational study. J Clin Monit Comput. 2022 Oct;36(5):1387–96. https://doi.org/10.1007/s10877-021-00777-y PMID:34743260
23. Rex S, Devroe S. Cardiac disease in pregnancy. Best Pract Res Clin Anaesthesiol. 2022 May;36(1):191–208. https://doi.org/10.1016/j.bpa.2022.02.005 PMID:35659955
24. Wiseman D, Simard C, Yang SS, Koolian M, Abenhaim HA, Lipes J. Echocardiography findings in amniotic fluid embolism: a systematic review of the literature. Can J Anaesth. 2023 Jan;70(1):151–60. https://doi.org/10.1007/s12630-022-02343-9 PMID:36307749
25. Abbas MS, Hassan SA, Abbas AM, Thabet AM, Thabet AM, Mahdy MM. Hemodynamic and antiemetic effects of prophylactic hyoscine butyl-bromide during cesarean section under spinal anesthesia: a randomized controlled trial. BMC Anesthesiol. 2022 Apr;22(1):112. https://doi.org/10.1186/s12871-022-01659-9 PMID:35448942
26. Vuong AD, Pham TH, Bui VH, Nguyen XT, Trinh NB, Nguyen YO, et al. Successfully conservative management of the uterus in acute pulmonary embolism during cesarean section for placenta previa: a case report from Tu Du Hospital, Vietnam and literature review [Internet]. Int J Emerg Med. 2024 Jan;17(1):14. [cited 2024 Apr 10] Available from: http://www.ncbi.nlm.nih.gov/pubmed/38287235 https://doi.org/10.1186/s12245-024-00587-4 PMID:38287235
27. Crea P, Dattilo G, Giordano A, Luzza F, Oreto G. How to ‘safely’ manage delivery of a pregnant woman with congenital atrioventricular block? J Cardiovasc Med (Hagerstown). 2020 Jun;21(6):460–2. https://doi.org/10.2459/JCM.0000000000000913 PMID:31789715
28. Marques da Costa F, Luís M, Lança F. Anaesthetic management of C-section in Brugada syndrome: when less is more. Rev Esp Anestesiol Reanim (Engl Ed). 2019;66(6):338–41. https://doi.org/10.1016/j.redare.2019.05.001 PMID:30862400
29. Habib AS. What’s new in obstetric anesthesia in 2017? Int J Obstet Anesth. 2019 May;38:119–26. https://doi.org/10.1016/j.ijoa.2019.03.005 PMID:31003728
30. Nelson SC, Lamb SC, Montague IA, Drake EJ. Anaesthetic management of a parturient with left ventricular noncompaction cardiomyopathy. Int J Obstet Anesth. 2020 May;42:124–5. https://doi.org/10.1016/j.ijoa.2020.02.003 PMID:32169260
31. Mofatteh M, Mashayekhi MS, Arfaie S, Wei H, Kazerouni A, Skandalakis GP, et al. Awake craniotomy during pregnancy: A systematic review of the published literature. Neurosurg Rev. 2023 Nov;46(1):290. https://doi.org/10.1007/s10143-023-02187-x PMID:37910275
32. Leong RW, Chen J, Mathews AM, Kothandan H. Anaesthesia of a parturient with uncorrected pentalogy of Fallot undergoing caesarean section and postpartum sterilisation. BMJ Case Rep. 2023 Oct;16(10):e251598. https://doi.org/10.1136/bcr-2022-251598 PMID:37802594
33. Sharkey AM, Siddiqui N, Downey K, Ye XY, Guevara J, Carvalho JC. Comparison of Intermittent Intravenous Boluses of Phenylephrine and Norepinephrine to Prevent and Treat Spinal-Induced Hypotension in Cesarean Deliveries: Randomized Controlled Trial. Anesth Analg. 2019 Nov;129(5):1312–8. https://doi.org/10.1213/ANE.0000000000003704 PMID:30113395
34. Lyu W, Wei P, Tang W, Ma X, Zheng Q, Zhou H, et al. Preventing Spinal Hypotension During Cesarean Birth With Two Initial Boluses of Norepinephrine in Chinese Parturients: A Randomized, Double-Blind, Controlled Trial. Anesth Analg. 2023 Jan;136(1):94–100. PMID:35687059
35. Deshar R, Subedi A, Pokharel K, Sah BP, Prasad JN. Effect of glycopyrrolate on vasopressor requirements for non-elective cesarean section under spinal anesthesia: a randomized, double-blind, placebo-controlled trial. BMC Anesthesiol. 2022 Oct;22(1):327. https://doi.org/10.1186/s12871-022-01882-4 PMID:36284288
36. D Tubog T, S Bramble R. Ondansetron reduces the incidence of hypotension after spinal anaesthesia in non-caesarean delivery: A systematic review and meta-analysis. J Perioper Pract. 2022 Mar;32(3):29–40. https://doi.org/10.1177/1750458920964157 PMID:33599544

 ORCID
ORCID