Roberto González1,2,*, Javier Sánchez3, Paula De la Maza3, Nicolás Villablanca1, Nicolás Valls1
Recibido: 20-09-2023
Aceptado: 19-11-2023
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 1 pp. 91-95|https://doi.org/10.25237/revchilanestv54n1-11
PDF|ePub|RIS
Abstract
Restrictive lung disease is characterized by a reduction in vital capacity and varying degrees of lung parenchymal compliance. Managing mechanical ventilation in these patients poses a challenge as it requires maintaining protective ventilation parameters to prevent ventilator-induced lung injury. The literature offers various ventilatory strategies, and we present a case study involving a patient with severe restrictive lung disease resulting from a right pneumonectomy. This patient required general anesthesia and mechanical ventilation during a lumboscopy for a partial nephrectomy. Our approach involved implementing a ‘lung rest’ strategy, which yielded a favorable intraoperative and postoperative response. Notably, the patient experienced no pulmonary complications and was discharged on the fourth day following the surgery.
Resumen
La patología pulmonar restrictiva se caracteriza por una reducción en la capacidad vital y una disminución variable en la distensibilidad del parénquima pulmonar. La ventilación mecánica en estos pacientes plantea un desafío, ya que es crucial mantener parámetros de ventilación protectora y, de esta manera, prevenir el daño inducido por la ventilación mecánica. En la literatura médica, se han descrito diversas estrategias ventilatorias destinadas al manejo de esta patología. Presentamos el caso clínico de un paciente con patología pulmonar restrictiva severa, secundaria a una neumonectomía derecha, que requirió anestesia general y ventilación mecánica para someterse a una nefrectomía parcial mediante lumboscopía. En este caso, se optó por una estrategia de «reposo pulmonar», la cual mostró una respuesta positiva tanto intraoperatoriamente como en el período posoperatorio. Es importante destacar que el paciente no experimentó complicaciones pulmonares y pudo ser dado de alta al cuarto día después de la cirugía.
-
Introducción
La ventilación mecánica (VM), es una herramienta esencial en el soporte respiratorio, ha sido fundamental en el manejo de pacientes que presentan diversas afecciones pulmonares. Entre estas, la patología pulmonar restrictiva emerge como un desafío clínico significativo, caracterizado por una limitación en los volúmenes pulmonares que puede ser originada por diversas condiciones médicas. Estas condiciones incluyen enfermedades intersticiales pulmonares, como la fibrosis pulmonar idiopática (FPI) y las colagenopatías, así como alteraciones neuromusculares, entre otras[1].
La patología pulmonar restrictiva conlleva una reducción en la capacidad vital y en la capacidad de difusión del oxígeno, lo que puede resultar en hipoxemia y disnea, a menudo afectando negativamente la calidad de vida de los pacientes. A pesar de la amplia gama de afecciones que contribuyen a esta presentación, el enfoque en la optimización de la función pulmonar y la selección adecuada de estrategias de ventilación son cruciales para el manejo clínico efectivo.
En este contexto, en el presente reporte de caso presentamos la experiencia clínica de un paciente neumonectomiza- do con patología pulmonar restrictiva severa que requirió VM durante una nefrectomía parcial. Exploramos las decisiones terapéuticas y estrategias anestésicas específicas que se imple- mentaron para garantizar la seguridad y la eficacia del procedimiento, así como los resultados obtenidos. Este caso resalta la necesidad de una aproximación individualizada y multidisci- plinaria en el manejo de pacientes con patología pulmonar restrictiva sometidos a procedimientos quirúrgicos y la importancia de la VM como herramienta crucial en situaciones anestésicas desafiantes.
El paciente de este reporte proporcionó su consentimiento informado por escrito para la publicación. Nos adherimos a las pautas “Care”[2] para la notificación de reportes de casos.
-
Descripción del caso
Paciente de 76 años con antecedentes de hipertensión arterial, cáncer de próstata tratado con radioterapia más terapia de deprivación androgénica y neumonectomía derecha el año 2018 (Figura 1). Datos antropométricos; peso 69 kg , estatura 1,65 m, peso predicho 61 kg. En seguimiento imagenológico de su patología oncológica se observa tumor renal derecho de 35 x 29 mm, con indicación quirúrgica. Destaca en sus exámenes preoperatorios espirometría, realizada en junio de 2023, con una capacidad vital forzada (CVF) correspondiente al 38%, volumen espiratorio primer segundo (VEF1) de 42% y VEF1/CVF 85% del valor predicho. Configurando una limitación ventila- toria restrictiva severa. Capacidad de difusión de monóxido de carbono de 55% equivalente a una disminución moderada. El paciente fue programado para nefrectomía parcial vía laparos- cópica. Luego de un análisis multidisciplinario que incluyó al equipo de anestesia, urólogos e intensivistas se decidió como mejor alternativa de abordaje la vía lumboscópica, con la idea de disminuir injuria asociada a la lumbotomía por un lado, así como la dificultad y posible daño asociado a la VM durante la insuflación de la cavidad peritoneal con CO2 y la consecuente alteración de la mecánica ventilatoria asociada a la laparoscopia. Se concordó precoz conversión a cirugía abierta en caso de parámetros de VM y oxigenación inadecuados.
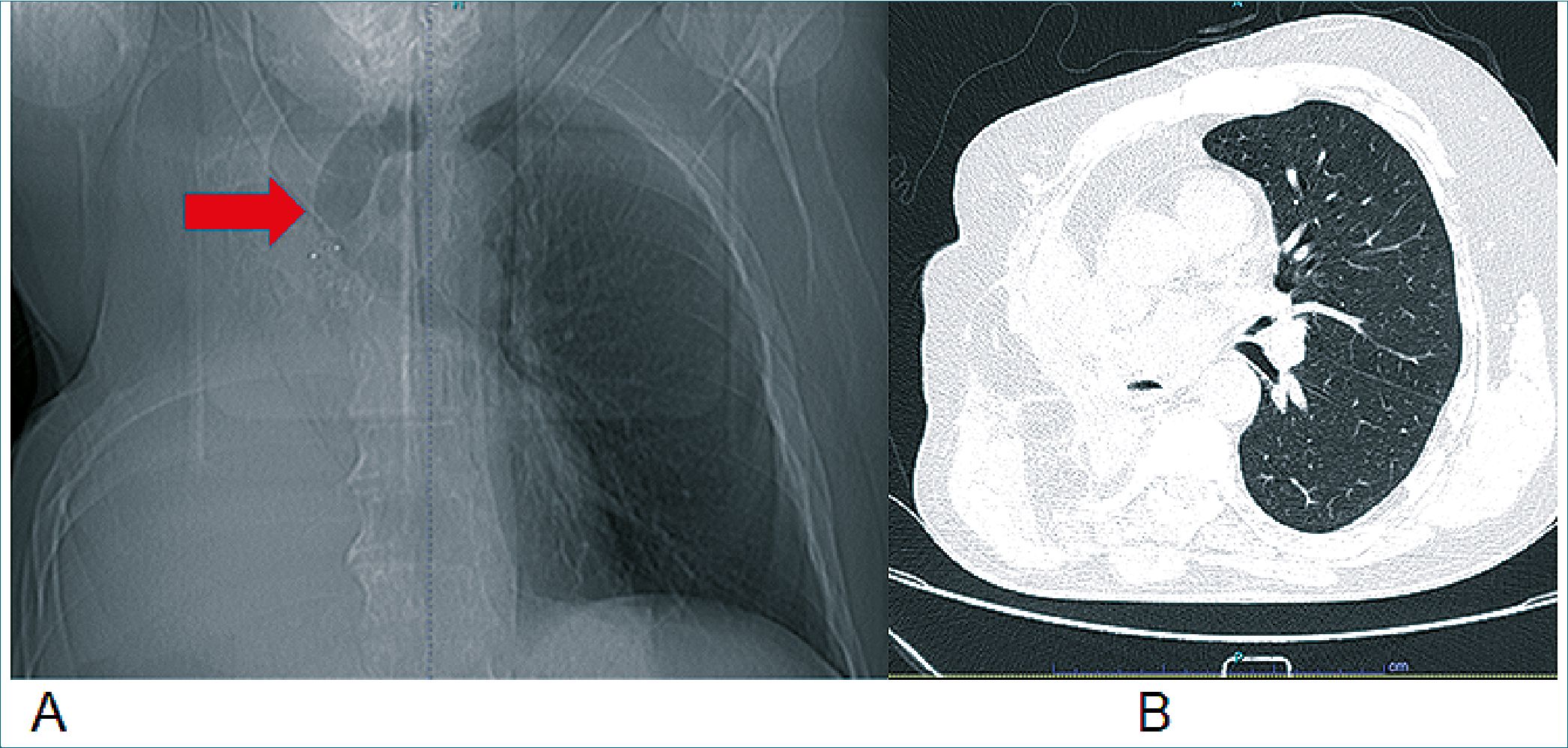
Figura 1. A: Topograma de tórax, donde se observa severa desviación del mediastino y tráquea hacia la derecha (flecha roja); B: Tomografía computada de tórax. Se observa neumonectomía derecha y desplazamiento de mediastino hacia ipsilateral.
Se instaló un catéter peridural torácico en espacio T5-T6 previo a inducción anestésica. Se realizó preoxigenación con fracción inspirada de oxígeno (FiO2) 100%, inducción anestésica con fentanil 200 mcg, lidocaína 80 mg, propofol 80 mg y rocuronio 50 mg. En la laringoscopía se observó un cormack II con claro desplazamiento de glotis a derecha, se intentó intubación inicial frustrada debida a angulación importante de la tráquea. Se mantuvo adecuada ventilación y oxigenación con máscara facial y se decidió instalar máscara laríngea N° 4 para realizar fibrobroncoscopia diagnóstica, en la que se observó un importante desplazamiento de la tráquea que hacía difícil el avance de tubo orotraqueal. Se decidió finalmente, intubación guiada por fibrobroncoscopía con resultado exitoso. Se mantuvo la anestesia con sevoflurano para MAC 0.7 y la analgesia con remifentanilo TCI (modelo de Minto) según requerimientos.
Se inició VM en modalidad volúmen control, volumen corriente (Vt) inicial de 5 ml/kg/peso predicho[3], presión positiva de fin de espiración (PEEP) 5 cmH2O, relación inspiración espiración (I/E) = 1:1, FiO2 30%. Previo al inicio de lumboscopía se logran parámetros protectores (presión de distensión (DP) = 15 cmH2O, presión meseta 20 cmH2O). Con el inicio de la lumboscopía se observó un deterioro de la mecánica ventila- toria, caracterizado por disminución de la compliance estática del sistema respiratorio y una DP mayor a 15 cmH2O. En este momento se tituló a la baja el volumen corriente hasta 3,6 ml/ kg/peso predicho (220 ml) y la presión de insuflación de CO2 de 15 hasta 10 mmHg, logrando una DP de 15 cmH2O (Figura 2). Se aumentó la frecuencia respiratoria hasta 24 rpm y se realizó una estrategia de hipercapnia permisiva objetivando una PaCO2 de 57 mmHg, PaO2 de 79 mmHg y un Ph mínimo de 7,27. La nefrectomía se realizó sin incidentes, sangrado estimado menor a 200 cc. Al término de la cirugía el paciente fue extubado en pabellón y trasladado a una unidad de paciente crítico bajo ventilación espontánea apoyado con máscara venturi, FIO2 50%. Fue destetado precozmente del aporte de oxígeno, presentó una buena evolución, sin complicaciones pulmonares y fue dado de alta al cuarto día postoperatorio.
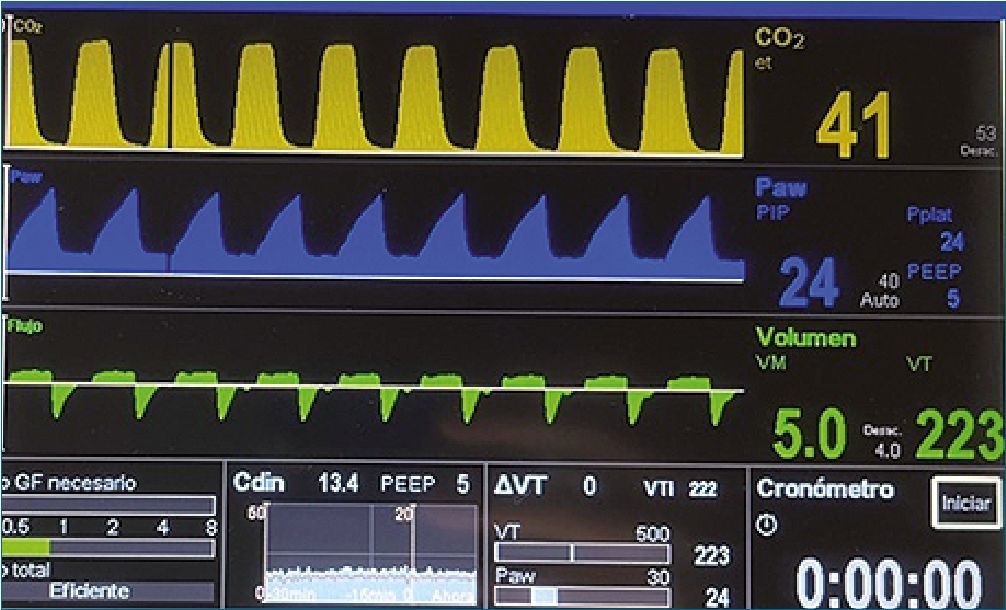
Figura 2. Parámetros de ventilación mecánica durante la nefrectomía por lumboscopia.

Figura 3. Imagen de “squishy ball” (pelota de estrés), que representa el comportamiento del pulmón fibrótico frente al aumento de presión de vía aérea. Recuperado de: The Training Shop. (2023). Captura de pantalla de la página de producto [Imagen de producto en el sitio web]. https://thetrainingshop.co.uk/index.php?route=product/product&product_id=835.
-
Discusión
La lesión pulmonar inducida por la ventilación mecánica, conocida como VILI (Ventilator-Induced Lung Injury por sus siglas en inglés) se caracteriza por la lesión de los pulmones debido a las fuerzas físicas generadas durante la VM[4]. Se puede atribuir a 4 mecanismos básicos; volutrauma, barotrauma, atelectrauma y biotrauma[5]. VILI puede manifestarse como un aumento de la permeabilidad de la membrana alveolar-capilar, inflamación y liberación de citoquinas proinflamatorias, lo que puede conducir a disfunción pulmonar e insuficiencia respiratoria[6].
Estos conceptos destacan la importancia de minimizar la respuesta inflamatoria excesiva durante la VM. Esto se puede lograr mediante estrategias de ventilación protectora que limiten la presión y el volumen aplicados al tejido pulmonar, así como el uso de técnicas que reduzcan la liberación de mediadores inflamatorios. Las estrategias de ventilación protectora descritas para minimizar la lesión pulmonar incluyen: ventilar con Vt bajos (6 – 8 ml/kg de peso predicho), uso PEEP, para prevenir lesiones por apertura y cierre cíclico alveolar (atelectrauma) y maniobras de reclutamiento alveolar (MRA), procedimientos utilizados para “recuperar” unidades pulmonares colapsadas y minimizar la heterogeneidad en la ventilación[4]. En un metaa- nálisis publicado en el British Journal of Anestesia el año 2020,
se encontró que la ventilación con Vt bajo (< 8 ml x kg peso predicho) y PEEP moderada a alta (> 5 cmH2O) reduce significativamente el riesgo de complicaciones pulmonares, atelectasia y neumonía en comparación con la ventilación mecánica convencional (VT > 9 ml x kg peso predicho y PEEP < 5 cmH2O)[7].
La fisiopatología de las enfermedades restrictivas, tiene como principal factor el desbalance de la relación habitual entre las proteínas que componen la matriz extracelular, afectando la capacidad de retroceso elástico pulmonar. Destaca el rol de la elastina, proteína elástica con gran capacidad de estiramiento, y del colágeno, proteína mucho más rígida, que habitualmente se encuentra plegada y que puede estirarse hasta 1%-2% antes de romperse. Esta diferencia de elasticidad, tiene como consecuencia que al sobrepasar el volumen pulmonar máximo inspiratorio (dado por la capacidad de estiramiento de las fibras de elastina) existe el riesgo de barotrauma y volutrauma debido a la rotura de las fibras de colágeno, las cuales se tienden a organizar alrededor de los miofibroblastos, generando una disminución de la capacidad de estiramiento y de relajación en sectores heterogéneos, propio de la entidad fisiopatológica[8].
En un estudio realizado por Nava y Rubini[9], centrado en pacientes con FPI en etapa terminal que estaban siendo sometidos a VM por insuficiencia respiratoria, demostraron que existe un aumento significativo en la elastancia pulmonar, tanto en sus componentes dinámico como estático, así como también un aumento en la resistencia respiratoria; siendo probable que éstos cambios sean resultado de la descrita reorganización de la arquitectura pulmonar. Ésta organización en red de tejido de colágeno poco elástico, da pie a la teoría del pulmón tipo “squishy ball” (del inglés en relación a las pelotas de estrés envueltas en una malla) (Figura 3) en donde al comprimir la bola blanda existe una estrangulación de la parte elástica del cuerpo a través de la red inelástica que envuelve la bola; similar a lo que ocurre en pacientes con pulmones fibróticos, donde el efecto del PEEP, junto a la ventilación con presiones elevadas de vía aérea, puede dar origen a este efecto, provocando un aumento de la rigidez y facilitando la ruptura del tejido, principalmente en las áreas de mayor potencial de reclutamiento[8].
Gattinoni et al.[6], hacen énfasis en considerar la falta de homogeneidad pulmonar al momento de ajustar parámetros de VM, considerando la existencia de “zonas generadoras de estrés”. Estas zonas se localizan dentro del tejido pulmonar y muestran una mayor predisposición a sufrir un incremento en el estrés y deformación en comparación con el tejido circundante. Al aplicar fuerzas mecánicas durante la ventilación, estas zonas pueden amplificar tanto la tensión como la deformación en su entorno, lo que conlleva un aumento significativo en el riesgo de VILI.
La implicancia de la fisiopatología, en el marco también de la teoría del pulmón tipo “squishy ball”, es que los pacientes con alteraciones restrictivas están en mayor riesgo de desarrollar VILI. Y la aplicación de estrategias de ventilación protectora es de mayor importancia en este escenario.
Rush et al.[10], investigaron la mortalidad de pacientes con FPI en los Estados Unidos entre 2006 y 2012, en la cohorte más grande publicada a la fecha, incluyendo a 17.770 pacientes hospitalizados con el diagnóstico de FPI, de éstos 1.703 (9,5%) requirieron ventilación mecánica invasiva. La mortalidad hospitalaria de los pacientes con FPI fue de 11,3% global, en contraste con los pacientes ventilados mecánicamente, en quienes encontraron una mortalidad aproximadamente de 50%, destacando una mayor mortalidad en los pacientes que requirieron VM secundario a sepsis.
Este resultado que concuerda con el estudio de Fernández- Pérez et al.[11], quienes revisaron una cohorte de 100 pacientes ventilados con enfermedad pulmonar intersticial ingresados a UCI, en donde el outcome primario fue la sobrevida hasta el alta y al año de vida. Destaca la sobrevida de 47% y 41% respectivamente y encontraron como factor de riesgo independiente de mortalidad el uso de PEEP alto, la relación PaO2/FiO2 baja y los pacientes no quirúrgicos. Se describe de igual forma que pacientes a los que se realizaron incrementos de PEEP progresivos, resultaron con peor compliance y aumento de presiones de vía aérea, compatible con sobredistensión.
La incidencia de FPI es de 5,6/100.000 personas-año y una prevalencia de 18,2/100.000. La sobrevida ha mejorado en el tiempo por el avance en la terapia farmacológica, con el advenimiento de los fármacos antifibróticos o modificadores de enfermedad y el manejo multidisciplinario. Esto genera mayor probabilidad de enfrentarnos como anestesiólogos a pacientes con patologías restrictivas en etapas avanzadas[12].
Para prevenir el VILI en estos pacientes, Marchioni y col., proponen una estrategia de VM específica para pacientes con enfermedades pulmonares restrictivas. En lugar de utilizar MRA y altos niveles de PEEP, estrategia conocida como “open lung aproach”(OLA)[13] abogan por una «estrategia de reposo pulmonar». En esta estrategia, se toleran atelectasias moderadas y se ajusta la PEEP sólo lo necesario para mantener una oxigenación mínima aceptable. Se sugiere apuntar a un Vt de 6 ml por kg de peso predicho, considerando reducciones adicionales si las presiones máximas y/o meseta son elevadas. La frecuencia respiratoria debe ajustarse para evitar la acidosis respiratoria, permitiendo niveles moderados de hipercapnia mientras el pH en sangre arterial se mantenga por encima de 7,25. Además, se enfatiza la importancia de verificar la presencia de PEEP intrínseco, lo que requiere una inspección cuidadosa de la curva flujo-tiempo[8].
-
Conclusión
A pesar de que el OLA[12] es una estrategia de ventilación mecánica útil en ciertos escenarios clínicos, puede no ser el enfoque más adecuado para todos los pacientes, en especial en los pacientes con patología restrictiva, en quienes una estrategia de “reposo pulmonar” podría ser la mejor elección. Esto refuerza la necesidad de una individualización de la estrategia de ventilación mecánica según las características específicas de la mecánica ventilatoria del paciente.
También, es importante considerar las implicancias del acto quirúrgico y su abordaje ya sea abierto, laparoscópico o, como el presente caso, lumboscópico. Realizando una análisis multi- disciplinario para escoger la mejor alternativa.
Existe una clara necesidad de investigaciones adicionales que puedan proporcionar una comprensión más profunda y detallada sobre la mejor estrategia de VM para este tipo de pacientes.
En el presente trabajo se describe el abordaje exitoso de un paciente con patología pulmonar restrictiva severa, mediante la estrategia de ventilación de “reposo pulmonar”.
Financiamiento: No.
Conflicto de intereses: No.
-
Referencias
1. Martinez-Pitre PJ, Sabbula BR, Cascella M. Restrictive Lung Disease. StatPearls Publishing; 2023.
2. Gagnier JJ, Kienle G, Altman DG, Moher D, Sox H, Riley D, et al. The CARE guidelines: consensus-based clinical case reporting guideline development. Case Reports. 23 de octubre de 2013;2013(oct23 1):bcr 2013201554-bcr2013201554.
3. Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, Wheeler A; Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000 May;342(18):1301–8. https://doi.org/10.1056/NEJM200005043421801 PMID:10793162
4. Slutsky AS, Ranieri VM. Ventilator-induced lung injury [Internet]. N Engl J Med. 2013 Nov;369(22):2126–36. https://doi.org/10.1056/NEJMra1208707 PMID:24283226
5. Modesto I Alapont V, Aguar Carrascosa M, Medina Villanueva A. Stress, strain y potencia mecánica. ¿Es la ingeniería de materiales la respuesta para prevenir la lesión inducida por el ventilador? [Internet]. Med Intensiva (Engl Ed). 2019 Apr;43(3):165–75. https://doi.org/10.1016/j.medine.2018.06.004 PMID:30409677
6. Gattinoni L, Carlesso E, Caironi P. Stress and strain within the lung [Internet]. Curr Opin Crit Care. 2012 Feb;18(1):42–7. https://doi.org/10.1097/MCC.0b013e32834f17d9 PMID:22157254
7. Deng QW, Tan WC, Zhao BC, Wen SH, Shen JT, Xu M. Intraoperative ventilation strategies to prevent postoperative pulmonary complications: a network meta-analysis of randomised controlled trials [Internet]. Br J Anaesth. 2020 Mar;124(3):324–35. https://doi.org/10.1016/j.bja.2019.10.024 PMID:32007240
8. Marchioni A, Tonelli R, Rossi G, Spagnolo P, Luppi F, Cerri S, et al. Ventilatory support and mechanical properties of the fibrotic lung acting as a “squishy ball”. Ann Intensive Care. 2020 Feb;10(1):13. https://doi.org/10.1186/s13613-020-0632-6 PMID:32020548
9. Nava S, Rubini F. Lung and chest wall mechanics in ventilated patients with end stage idiopathic pulmonary fibrosis [Internet]. Thorax. 1999 May;54(5):390–5. https://doi.org/10.1136/thx.54.5.390 PMID:10212101
10. Rush B, Wiskar K, Berger L, Griesdale D. The use of mechanical ventilation in patients with idiopathic pulmonary fibrosis in the United States: A nationwide retrospective cohort analysis [Internet]. Respir Med. 2016 Feb;111:72–6. https://doi.org/10.1016/j.rmed.2015.12.005 PMID:26733227
11. Fernández-Pérez ER, Yilmaz M, Jenad H, Daniels CE, Ryu JH, Hubmayr RD, et al. Ventilator settings and outcome of respiratory failure in chronic interstitial lung disease [Internet]. Chest. 2008 May;133(5):1113–9. https://doi.org/10.1378/chest.07-1481 PMID:17989156
12. Carr ZJ, Yan L, Chavez-Duarte J, Zafar J, Oprea A. Perioperative Management of Patients with Idiopathic Pulmonary Fibrosis Undergoing Noncardiac Surgery: A Narrative Review. Int J Gen Med. 2022 Feb;15:2087–100. https://doi.org/10.2147/IJGM.S266217 PMID:35237071
13. Lachmann B. Open up the lung and keep the lung open [Internet]. Intensive Care Med. 1992;18(6):319–21. https://doi.org/10.1007/BF01694358 PMID:1469157

 ORCID
ORCID