Eddisson Reynaldo Quispe Pilco1,2*, Jhoscy Landy Quispe Pilco3
Recibido: 03-03-2025
Aceptado: 27-03-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 6 pp. 836-845|https://doi.org/10.25237/revchilanestv54n6-08
PDF|ePub|RIS
Risk factors for severe hypotension after spinal anesthesia in cesarean sections: a prospective study
Abstract
Introduction: Spinal anesthesia is the most used neuraxial technique in cesarean sections. Severe post-anesthetic hypotension is an adverse event that can increase maternal-fetal morbidity. Multiple risk factors for hypotension have been reported, but there is no consensus about the most important ones due to the great variability of results in the multiple studies performed. Objectives: Identify the incidence of severe hypotension and its risk factors in cesarean sections with spinal anesthesia. Methods: Prospective observational study in cesarean sections with spinal anesthesia, carried out at the National Maternal Perinatal Institute of Lima (INMP). Data were collected in cesarean sections that met inclusion criteria over a 6-month period. Results: In a sample of 207 pregnant women, incidence of severe hypotension was 26.6%. The risk factors with a significant statistical association were age ≥ 35 years OR 2.135 (95% CI 1.016-4.486 p = 0.045); baseline systolic blood pressure > 110 mmHg OR 2.459 (95% CI 1.034-5.849 p = 0.042); newborn weight < 4,000 g OR 7.081 (95% CI 1.806-27.756 p = 0.005) and anesthesiologist experience < 5 years OR 3.318 (95% CI 1.318-7.969 p = 0.007). Conclusions: The incidence of severe hypotension after spinal anesthesia in cesarean sections is considerable. Maternal age > 35 years, baseline systolic pressure >110 mmHg, newborn weight < 4,000 g and anesthesiologist experience < 5 years were identified as risk factors for severe hypotension.
Resumen
Introducción: La anestesia raquídea es la técnica neuroaxial más utilizada en cesáreas. La hipotensión arterial severa posanestesia es un evento adverso que puede aumentar la morbilidad materno-fetal. Se han reportado múltiples factores de riesgo de hipotensión, pero no hay un consenso acerca de los más importantes debido a la gran variabilidad de resultados en los múltiples estudios realizados. Objetivos: Identificar la incidencia de hipotensión severa y sus factores de riesgo en cesáreas con anestesia raquídea. Métodos: Estudio observacional prospectivo en cesáreas con anestesia raquídea, realizado en el Instituto Nacional Materno Perinatal de Lima (INMP), se recolectaron datos en cesáreas que cumplieron criterios de inclusión en un periodo de 6 meses. Resultados: En una muestra de 207 cesáreas, la incidencia de hipotensión severa post anestesia fue de 26,6%. Los factores de riesgo con asociación estadística significativa fueron: edad ≥ 35 años OR 2.135 (IC95% 1.016-4.486 p = 0,045); presión arterial sistólica basal > 110 mmHg OR 2.459 (IC95% 1.034-5.849 p = 0,042); peso de recién nacido < 4.000 g OR 7.081 (IC95% 1.806-27.756 p = 0,005) y experiencia del anestesiólogo < 5 años OR 3.318 (IC95% 1.318-7.969 p = 0.007). Conclusiones: La incidencia de hipotensión severa posanestesia raquídea en cesáreas es considerable. La edad materna > 35 años, la presión sistólica basal > 110 mmHg, el peso del recién nacido < 4.000 g y una experiencia del anestesiólogo < 5 años, fueron identificados como factores de riesgo de hipotensión severa.
-
Introducción
La anestesia raquídea es la técnica neuroaxial más utilizada en cesáreas[1],[2], ha desplazado a la técnica epidural debido a varias ventajas como menor curva de aprendizaje, rápido inicio de acción, menor incidencia de anestesia fallida o incompleta, menor toxicidad por anestésicos locales y menor costo. La hipotensión arterial es un evento adverso frecuente posanestésia raquídea[2],[3],[4], con una incidencia de 7% a 80%[3],[5],[6]. Puede progresar a un cuadro de hipotensión severa en 7% a 40% de casos[7], asociándose con bloqueo raquídeo alto y mayor morbimortalidad materno fetal[8],[9],[10]. Dependiendo de su duración y severidad, la hipotensión puede ocasionar náuseas, vómitos, disnea, trastorno de conciencia, bradicardia y paro cardio respiratorio[4],[7],[11]. La hipotensión también disminuye el flujo útero placentario causando hipoxia, acidosis fetal y bajas puntuaciones de APGAR en el recién nacido[12],[13],[14].
Antes de administrar anestesia raquídea en cesáreas se debe determinar la presión arterial sistólica (PAS) basal, promediando un mínimo de tres medidas de PAS con la gestante en una misma posición[15],[16],[17]. Se debe evitar el control de presión durante las contracciones uterinas para evitar errores de medición[9]. Posterior a la anestesia se recomienda realizar mediciones de presión arterial en intervalos de 1-2 minutos hasta el nacimiento. Existe una gran variabilidad de la definición de hipotensión post anestesia[1]. El año 2018, un consenso internacional recomendó que luego de la anestesia neuroaxial en cesáreas la PAS debe mantenerse > 90% respecto a la PAS basal[9],[12], definiéndose hipotensión posanestésica como una PAS < 90% respecto a la PAS basal[11], reemplazando la anterior definición de PAS < 80%. Este cambio tuvo como objetivo un temprano diagnóstico y tratamiento de la hipotensión. Se considera que la hipotensión es severa cuando se registra una PAS < 70% respecto a la basal[3],[7],[12],[17]. Otra definición de hipotension severa posanestésica es una PAS < 80 mmHg[9],[15].
Debido a que la cesárea necesita idealmente un bloqueo anestésico a nivel metamérico torácico T4, el bloqueo simpático es inevitable lo que ocasiona una rápida disminución sistémica del tono venoso y arterial[1], alterando el principal mecanismo de compensación del tono vascular materno[11],[14],[15]. Este bloqueo simpático es la principal causa de la hipotensión posanestesia[18]. El desequilibrio con el sistema parasimpático puede exacerbar el reflejo de Bezold-Jarisch activando los receptores cardiacos 5-HT3 generando bradicardia y vasodilatación arterial profunda que podría llevar a un paro cardíaco[13],[18],[14]. Todos estos efectos son potenciados por una mayor sensibilidad a la acción de los anestésicos locales en las gestantes[14],[18],[19].
Se han descrito múltiples factores maternos asociados a la hipotensión posanestesia como la edad, talla, obesidad, paridad, anemia, horas de ayuno, variabilidad de la frecuencia cardíaca y presión arterial asociada a cambios de posición de la gestante[2],[9],[20],[21]. El peso del recién nacido también se ha mencionado como factor de riesgo[1],[20]. Entre los factores anestésicos se han mencionado la dosis y baricidad del anestésico local, la posición de la gestante durante y después de la anestesia, nivel de punción lumbar, velocidad de administración del anestésico, uso de barbotage, nivel de dermatoma bloqueado y el tiempo entre la anestesia y el nacimiento[3],[11],[20],[22]. También se han descrito otros factores de riesgo como la temperatura de sala de operaciones, grado de ansiedad materna y factores genéticos maternos que influyen en la incidencia de hipotensión[6],[9],[20].
La administración endovenosa de cristaloides como cocarga a un volumen de 10-15 ml/kg y el uso de vasopresores profilácticos son la base actual de la prevención de la hipotensión posanestesia neuroaxial en cesáreas[9],[16],[23]. La fenilefrina sigue siendo el vasopresor de elección versus la efedrina por su menor incidencia de acidosis fetal[12],[15]. Se está investigando la utilidad de otros vasopresores como la norepinefrina como vasopresor en anestesia obstétrica, pero aún no hay estudios concluyentes que muestren superioridad y seguridad frente a la fenilefrina[15]. Se han usado diferentes medidas para prevenir la hipotensión posanestésica como el desplazamiento uterino lateral izquierdo, uso de medias compresivas en miembros inferiores, menores dosis anestésicas y el uso de fármacos como el ondansetrón y la atropina. Sin embargo, ninguna ha dado resultados satisfactorios[3],[9],[12],[15].
Para esta investigación se eligió la hipotensión severa como variable dependiente de estudio debido a su mayor impacto en la morbimortalidad materno-fetal y porque su tratamiento es mas dificultoso. El objetivo principal fue determinar su incidencia y los principales factores de riesgo maternos y anestésicos. Los resultados ayudarán a la identificación de las cesáreas con mayor riesgo de hipotensión severa y así poder optimizar las medidas de prevención y tratamiento.
-
Métodos
-
Diseño de estudio y participantes
Este fue un estudio observacional prospectivo, realizado en el Instituto Nacional Materno Perinatal de Lima (INMP). Se utilizó una muestra de 209 gestantes con indicación de cesárea con anestesia raquídea durante el período de julio a diciembre de 2023. La técnica de muestreo fue por conveniencia, se incluyeron las gestantes que cumplieron los criterios de inclusión du
rante el período de recolección de datos. Se incluyeron cesáreas electivas y de emergencia, edades entre 18 a 45 años, riesgo anestésico ASA 2, se excluyeron anestesias con bloqueo incompleto o fallido, técnica anestésica combinada con epidural, trastornos hipertensivos del embarazo, PAS basal < 90 mmHg o > 140 mmHg, gestaciones pre y postérmino.
-
Recolección de datos
El instrumento que se empleó en el estudio fue validado mediante juicio de expertos con un índice de kappa de 0,84. Se realizó una prueba piloto con 20 cesáreas. Los encargados de la recolección se entrenaron para un correcto llenado del formato de recolección de datos. Luego de explicar la naturaleza del estudio y garantizar anonimato y confidencialidad de datos, las pacientes firmaron el consentimiento informado voluntario para recoger información del estudio.
Se registraron datos maternos y anestésicos como variables independientes y el registro de hipotensión severa posanestesia fue la variable dependiente. Cada formato de recolección fue codificado con números y solo los investigadores tuvieron acceso a los datos transcritos al programa estadístico. La recolección de datos fue supervisada por el investigador principal.
-
Procedimientos
Todas las gestantes tuvieron monitoreo básico ASA de funciones vitales, electrocardiografía de tres derivadas para frecuencia cardíaca, pulsoximetria para saturación de oxígeno de hemoglobina y presión intermitente no invasiva para medir la presión arterial. La PAS fue medida tres veces antes de la anestesia raquídea y se realizaron sin coincidir con las contracciones uterinas, luego se promediaron para obtener una PAS basal, luego de la anestesia raquídea, se controló la PAS cada minuto hasta el nacimiento. Tanto el manejo anestésico como la prevención y tratamiento de la hipotensión arterial fue a criterio del anestesiólogo responsable de la cesárea de acuerdo a protocolo institucional.
En las cesáreas se utilizó dosis anestésica de bupivacaina 0,5% hiperbárica en un rango de 8 a 11 mg con fentanilo en un rango de 20-25 mcg y morfina 100 mcg. Los niveles de punción fueron entre los espacios interespinosos L3-L4 y L4-L5, en todas se utilizó aguja raquídea Whitacre calibre 27G. A los 10 minutos de colocada la anestesia se midió el nivel de dermatoma bloqueado con prueba de perdida de sensibilidad al frío utilizando algodones empapados en alcohol. Se utilizaron etilefrina y norepinefrina en bolos o infusión continua como en la profilaxis y tratamiento de la hipotensión de acuerdo a protocolo institucional. Todo episodio de hipotensión con PAS < 70% respecto a la basal en al menos una oportunidad entre la colocación de la anestesia y el nacimiento se definió como hipotensión severa.
-
Análisis estadístico
Para el análisis de datos se utilizó el programa estadístico SPSS (Versión 29; IBM Corp, NY), las características de las gestantes se describieron usando medias, desviación estándar (DE) y proporciones. Se calculo incidencias utilizando porcentajes. La asociación entre variables independientes con la variable dependiente fue determinada con la prueba de chi cuadrado (x2) o prueba exacta de Fisher al 95% de intervalo de confianza (IC). Las variables que alcanzaron un p < 0,2 fueron elegidas para realizar el análisis binario bivariable y multivariado donde todo valor de p < 0,05 fue considerado como asociación significativa, se utilizaron Odds Ratio crudos (ORc) y Odds Ratio ajustados (ORa) ajustados para determinar la fuerza de asociación de variables y ver cuáles fueron los factores de riesgo con un valor de p < 0,05% al IC95%.
Tabla 1. Variables sociodemográficas maternas de cesáreas con anestesia raquídea (n = 207)
| Variable | Valor mínimo | Valor máximo | Media +/- DE |
| Edad (años) | 18 | 43 | 29,77 ± 6,305 |
| Talla (metros) | 1,40 | 1,76 | 1,55 ± 0,059 |
| Peso (kilos) | 49 | 107 | 76,40 ± 11,918 |
| IMC | 22 | 45 | 31,58 ± 4,552 |
| Hemoglobina (g/dL) | 8,4 | 14,9 | 11,56 ± 1,143 |
| Semana gestacional | 37 | 41 | 38,75 ± 1,283 |
| Ayuno de líquidos claros (horas) | 1 | 24 | 9,33 ± 5,024 |
| Frecuencia cardíaca basal (lat/min) | 59 | 112 | 82,79 ± 11,634 |
| Presión arterial sistólica basal (mmHg) | 91 | 139 | 116,65 ± 11,436 |
DE = Desviación estándar; IMC = Índice de masa corporal. Fuente: Autores.
-
Resultados
Luego del flujo de elección de pacientes la muestra total fue de 207 gestantes (Figura 1). Con una edad media de 29 años DE ± 6,30, talla media de 1,55 metros DE ± 0,059, índice de masa corporal (IMC) con media de 31 DE ± 4,55, hemoglobina media de 11,5 g/dL DE ± 1,14, edad gestacional media de 38,7 semanas ± 1.283 y una media de 9 h de ayuno preoperatorio de líquidos claros DE ± 5,02 (Tabla 1).
-
Incidencia de hipotensión postanestesia
La incidencia de hipotensión total posanestesia con PAS <
90% respecto a la PAS basal fue 82,6%, la disminución de la PAS entre 90%-70% fue 56% y la incidencia de hipotensión severa con PAS < 70% fue 26,6%, se contabilizó toda hipotensión severa como al menos un episodio registrado (Figura 2).
-
Variables maternas
Los resultados fueron: edad > 35 años (27,5%), hemoglobina < 11g/dL (30%), el IMC > 30 (66,7%), talla < 1,55 m (41,5%), ayuno > 12 h (24,2%), frecuencia cardíaca basal de 60-100 latidos/min (89,3%), PAS basal > 110 mmHg (68,6%), multíparas (42%), no trabajo de parto (76%), ruptura prematura de membranas (15%), recién nacidos con peso > 4.000 g (17,4%) y el principal diagnóstico de indicación de cesárea fue por cesárea anterior (41%).
-
Variables anestésicas
Los resultados fueron: cesáreas de emergencia (63%), experiencia del anestesiólogo > 5 años (81,2%), cocarga > 10 ml/kg de ClNa 0,9% (41,5%), administración de anestesia con gestante en decúbito lateral (52,2%), anestesia con única punción (65,7%), dosis de bupivacaina de 10 a 11 mg (79,7%), tiempo de administración del anestésico al espacio raquídeo > 20 segundos (69,6%), pausa durante la administración de anestesia para aspirar líquido cefalorraquídeo (LCR) (30%), decúbito dorsal con inclinación lateral izquierda de 15 grados po-
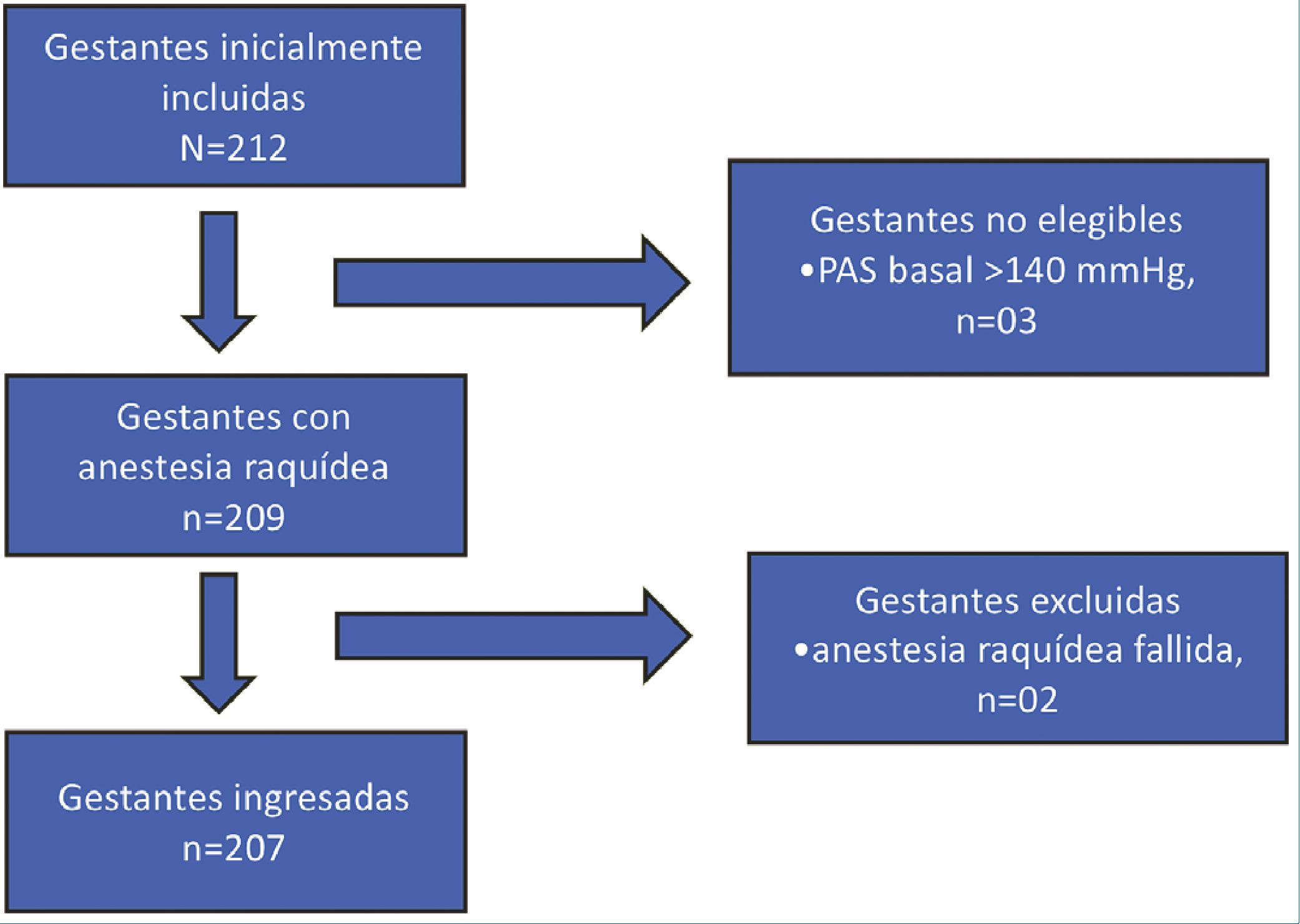
Figura 1. Diagrama de flujo de inclusión y exclusión de pacientes. N = número de muestra inicial; n = número de muestra. Fuente: Autores.
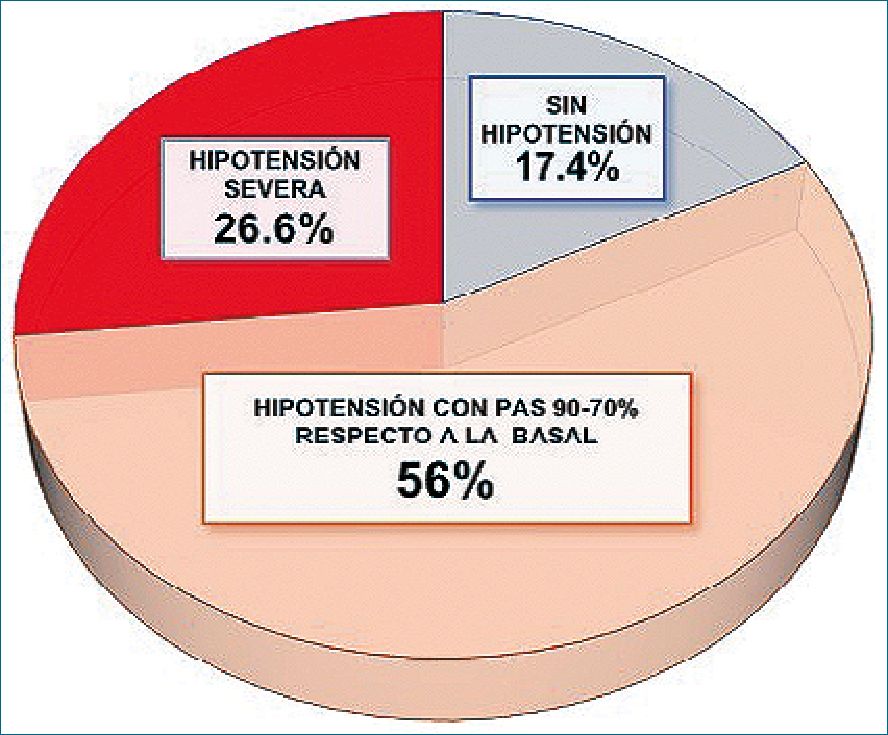
Figura 2. Porcentajes de hipotensión posanestesia raquídea. n = 207 (100%) PAS = presión arterial sistólica. Fuente: Autores.
sanestesia hasta el inicio de la cirugía (44%), nivel de dermatoma bloqueado < T4 (79,2%), uso de vasopresores profilácticos (31,9%), uso de ondansetrón EV antes del nacimiento (65,2%) y tiempo entre la anestesia raquídea y el nacimiento < 20 minutos (58,9%).
-
Análisis estadístico bivariable y multivariable
Se realizó prueba x2 para detectar p < 0,2 en las variables maternas (Tabla 2) y anestésicas (Tabla 3). En las variables seleccionadas se realizó análisis bivariable y multivariable calculándose Odds Ratio crudos (ORc) y ajustados (ORa), registrán dose diferencia estadísticamente significativa en las siguientes variables: edad > 35 años ORa 2.135 (IC95% 1.016-4.486 p = 0,045); presión arterial sistólica basal > 110 mmHg ORa 2.459 (IC95% 1.034-5.849 p = 0,042); peso de recién nacido < 4.000 g ORa 7.081 (IC95% 1.806-27.756 p = 0,005) y experiencia del anestesiólogo < 5 años ORa 3.318 (IC95% 1.318-7.969 p = 0,007). En el análisis bivariable las variables de realizar pausa para aspirar LCR durante administración de anestesia raquídea ORc 2.169 (IC95% 1.132-4.156 p = 0,020) y no utilizar vaso- presor profiláctico ORc 1.909 (IC95% 0.927-3.931 p = 0,079) tuvieron p < 0,2 pero en el análisis multivariable no obtuvieron diferencia significativa (Tabla 4).
Tabla 2. Análisis de variables maternas
| Variables | Hipotensión severa | X2 | p alfa | |
| Si % | No % | |||
| Edad ≥ 35 años | 21 (36,8%) | 36 (63,2%) | 4.719 | 0,030 |
| < 35 años | 33 (22%) | 117 (78%) | ||
| Talla < 1,55 metros | 24 (27,9%) | 62 (72,1%) | 0,253 | 0,615 |
| IMC ≥30 | 40 (29%) | 98 (71%) | 1.804 | 0,179 |
| < 30 | 14 (20,3%) | 55 (79,7%) | ||
| Hemoglobina < 11 g/dL | 12 (19,4%) | 50 (80,6%) | 2.080 | 0,149 |
| ≥11 g/dL | 42 (29%) | 103 (71%) | ||
| Ayuno > 2 horas | 53 (27,6%) | 139 (72,4%) | 1.452 | 0,228 |
| Ayuno > 6 horas | 34 (23,9%) | 108 (76,1%) | 1.599 | 0,206 |
| Ayuno > 12 horas | 17 (34%) | 33 (66%) | 1.865 | 0,172 |
| Frecuencia cardíaca basal | ||||
| ≥ 90 latidos por minuto | 3 (5,8%) | 16 (94,2%) | 0,790 | 0,374 |
| ≤60 latidos por minuto | 0 (0%) | 3 (100%) | 1.074 | 0,300 |
| Presión arterial sistólica basal | ||||
| ≤110 mmHg | 11 (16,9%) | 54 (83,1%) | 4.127 | 0,042 |
| > 110 mmHg | 44 (31,0%) | 98 (69,0%) | ||
| Diagnósticos principales: | ||||
| – Cesareada anterior | 24 (28,2%) | 61 (71,8%) | 0,205 | 0,651 |
| – Estado fetal no tranquilizador | 5 (20,0%) | 20 (80%) | 0,629 | 0,428 |
| – Incompatibilidad cefalopélvica | 4 (23,5%) | 13 (76,5%) | 0,088 | 0,767 |
| – Oligohidramnios | 5 (37,5%) | 9 (62,5%) | 0,644 | 0,422 |
| Paridad Nulípara | 18 (26,1%) | 51 (73,9%) | 0,012 | 0,911 |
| Primípara | 14 (27,5%) | 37 (72,5%) | 0,027 | 0,870 |
| Multípara | 23 (26,4%) | 64 (73,6%) | 0,001 | 0,971 |
| Trabajo de parto Si | 11 (22,4%) | 38 (77,6%) | 0,441 | 0,507 |
| No | 43 (27,8%) | 115 (72,2%) | ||
| – Ruptura de membranas amnióticas | 05 (19,4%) | 26 (80,6%) | 1.875 | 0,171 |
| – Membranas amnióticas íntegras | 49 (27,8%) | 127 (72,2%) | ||
| Peso de recién nacido < 4.000 g | 52 (30,4%) | 119 (69,6%) | 7.124 | 0,008 |
| ≥ 4.000 g | 3 (8.3%) | 33 (91,7%) | ||
IMC = Índice de masa corporal. Fuente: Autores.
Tabla 3. Análisis de variables anestésicas
| Variables | Hipotensión severa | X2 | p alfa | |
| Si % | No % | |||
| Cesárea – emergencia | 35 (27,5%) | 96 (72,5%) | 0,074 | 0,786 |
| – electiva | 19 (25,0%) | 57 (75%) | ||
| Experiencia de anestesiólogo | ||||
| s 5 años | 20 (51,3%) | 19 (48,7%) | 12.764 | < 0,001 |
| > 5 años | 35 (20,8%) | 133 (79,2%) | ||
| Cocarga hidratación endovenosa | ||||
| > 10 ml/kg | 23 (26,7%) | 63 (73,3%) | 0,033 | 0,856 |
| < 10 ml/kg | 31 (25,6%) | 90 (74,4%) | ||
| Posición de paciente en anestesia | ||||
| Sentada | 25 (25,3%) | 74 (74,7%) | 0,335 | 0,563 |
| Decúbito lateral | 30 (27,8%) | 78 (72,2%) | ||
| Número de punciones lumbares | ||||
| 01 punción | 34 (25%) | 102 (75%) | 0,683 | 0,409 |
| ≥ 2 punciones | 21 (29,6%) | 50 (70,4%) | ||
| Dosis de bupivacaina 10-11 mg | 44 (26,7%) | 121 (73,3%) | 0,000 | 0,986 |
| 08-09 mg | 11 (26,2%) | 31 (73,8%) | ||
| Tiempo de administración anestésica intraraquídea | ||||
| s 20 segundos | 12 (19%) | 51 (81%) | 2.327 | 0,127 |
| > 20 segundos | 43 (29,9%) | 101 (70,1%) | ||
| Pausa para aspirar LCR durante administración de anestesia | ||||
| Si | 23 (37,1%) | 39 (62,9%) | 5.564 | 0,018 |
| No | 31 (21,4%) | 114 (78,6%) | ||
| Posición entre termino de anestesia y comienzo de cesárea | ||||
| Neutral | 19 (24,7%) | 58 (75,3%) | 4.036 | 0,250 |
| Neutral + lateral izquierdo | 23 (25,3%) | 68 (74,7%) | ||
| Antitrendelenburg | 13 (39,4%) | 20 (60,6%) | ||
| Trendelenburg | 0 (0%) | 6 (100%) | ||
| Uso de vasopresores profilácticos | ||||
| Si | 12 (18,2%) | 54 (81,8%) | 3.140 | 0,076 |
| No | 42 (29,8%) | 99 (70,2%) | ||
| Nivel de bloqueo sensitivo | ||||
| > T4 | 8 (18,6%) | 35 (81,4%) | 1.576 | 0,209 |
| s T4 | 47 (28,7%) | 117 (71,3%) | ||
| Ondansetrón antes de nacimiento | ||||
| No | 21 (29,2%) | 51 (70,8%) | 0,543 | 0,461 |
| Si | 34 (25,2%) | 101 (74,8%) | ||
| Tiempo entre anestesia y parto | ||||
| > 20 minutos | 27 (31,8%) | 58 (68,2%) | 1.516 | 0,208 |
| s 20 minutos | 28 (23%) | 94 (77%) | ||
LCR = Líquido cefalorraquídeo; T4 = cuarto dermatoma torácico. Fuente: Autores.
Tabla 4. Análisis bivariable y multivariable
| Variables | Beta | Error estandar | OR crudos IC 95% | P | OR ajustados IC 95% | P |
| Edad > 35 años | 1.359 | 1.007 | 2.068 (1.066-4.011) | 0,032 | 2.135 (1.016-4.486) | 0,045 |
| IMC > 30 | 0,472 | 0,353 | 1.603 (0.802-3.205) | 0,181 | 1.244 (0.567-2.731) | 0,586 |
| Hemoglobina > 11 g/dL | 0,530 | 0,370 | 1.699 (0.823-3.508) | 0,152 | 1.330 (0.581-3.041) | 0,500 |
| Ayuno >12 horas | 0,388 | 0,356 | 1.474 (0.734-2.960) | 0,276 | 1.199 (0.546-2.634) | 0,652 |
| Presion arterial sistólica basal >110 mmHg | 0,757 | 0,378 | 2.132 (1.017-4.472) | 0,045 | 2.459 (1.034-5.849) | 0,042 |
| Membranas amnioticas integras | 0,696 | 0,516 | 2.006 (0.729-5.521) | 0,178 | 2.916 (0.926-9.184) | 0,068 |
| Peso de recien nacido < 4.000 g | 1.542 | 0,626 | 4.675 (1.371-15.938) | 0,014 | 7.081 (1.806-27.756) | 0,005 |
| Experiencia de anestesiologo < 5 años | 1.284 | 0,372 | 3.610 (1.740-7.491) | < 0,001 | 3.318 (1.318-7.969) | 0,007 |
| Administración anestesia intraraquídea > 20 seg | 0,560 | 0,370 | 1.750 (0.848-3.611) | 0,130 | 1.350 (0.662-2.755) | 0,409 |
| Pausa para aspirar LCR durante administración de anestesia | 0,774 | 0,332 | 2.169 (1.132-4.156) | 0,020 | 2.126 (0.977-4.627) | 0,057 |
| Uso de vasopresor profiláctico | -0,647 | 0,368 | 0,544 (0.254-1.078) | 0,079 | 0.510 (0.226-1.152) | 0,105 |
IMC = Índice de masa corporal; LCR = líquido cefalorraquídeo; OR = Odds ratio; IC = Intervalo de confianza. Fuente: Autores.
-
Discusión
En este estudio se encontró una incidencia de hipotensión severa del 26,6%, la cual es considerable a pesar de todas las medidas de prevención y tratamiento. Estudios que utilizaron la misma definición de hipotensión severa reportaron similares in- cidencias[3],[24]. Otros reportaron incidencias incluso más altas de hasta 40%[7],[17]. Este resultado muestra la real magnitud de este evento adverso y del porque es importante su estudio.
Se identifico como factor de riesgo de hipotensión severa la edad > 35 años con ORa 2.135 (IC95% 1.016-4.486 p = 0,045); otros estudios también encontraron esta asociación[17],[25]. La gestante > 35 años se considera añosa y de alto riesgo obstétrico, a mayor edad materna existe mayor disminución fisiológica de la PAS en el último trimestre del embarazo[1]. Esto debido a alteraciones del sistema simpático, baroreceptores y del gasto cardíaco[17]. Se produce vasodilatación sistémica por una mayor actividad del sistema parasimpático reduciendo el retorno venoso, favoreciendo la hipotensión posanestésica[26]. Todos estos cambios podrían explicar esta asociación de la edad con el riesgo de presentar hipotensión severa posanestesia.
Se ha reportado asociación de hipotensión posanestésica con valores bajos de PAS basal[17],[27],[28]. Li et al.[1], reportó asociación de hipotensión basal con hipotensión arterial severa al igual que otros estudios[3],[7],[20]. El aumento de la presión arterial indica mayor actividad del sistema simpático y se ha relacionado como factor protector contra la hipotensión po- sanestesica[12],[21]. Sin embargo, en este estudio se encontró como factor de riesgo una PAS basal > 110 mmHg con ORa 2.459 (IC95% 1.034-5.849 p = 0,042). Existen reportes similares de asociación entre la hipertensión basal y la hipotensión posanestesia raquídea[2],[19],[20]. Este resultado amerita una mayor investigación en poblaciones más grandes debido a la gran variabilidad de la actividad del sistema simpático en las gestantes[19].
Se ha descrito asociación entre la macrosomía fetal y/o
peso del recién nacido con mayor riesgo de hipotensión posanestésica, debido a un mayor riesgo de compresión aorto- cava[1],[20],[29]. Por el contrario en este estudio se encontró que el peso de recién nacidos < 4.000 g se asoció significativamente con mayor riesgo de hipotensión severa con ORa 7.081 (IC95% 1.806-27.756 p = 0,005), Shitemaw et al.[27], también encontró asociación de hipotensión posanestesia raquídea con pesos de recién nacido < 4.000 g. Otros estudios no encontraron asociación entre el peso del recién nacido y la incidencia de hipotensión[30]. A mayor peso fetal intraútero hay mayor compresión mecánica en la vena cava ocasionando una mayor circulación colateral como un mecanismo protector compensa- torio[1],[14],[19] esto podría generar una mayor tolerancia a la hipotensión arterial en comparación con las gestantes con fetos de menor peso. Sin embargo, la circulación colateral se manifiesta de diferentes formas e intensidad entre las gestantes lo que podría explicar los diversos resultados de asociación entre el peso del recién nacido y la hipotensión arterial.
La experiencia del anestesiólogo es una variable muy importante relacionada a la prevención y tratamiento de los eventos adversos anestésicos. Se ha descrito que a mayor experiencia del anestesiólogo hay menor riesgo de hipotensión posanesté- sica[20]. El anestesiólogo experimentado generalmente toma mayores medidas de prevención como el uso de hidratación endovenosa y un uso racional de vasopresores. La ventaja de este estudio es que se realizó en una institución de salud de atención materna donde los anestesiólogos están familiarizados con la práctica diaria de la anestesia obstétrica, a diferencia de otras instituciones donde no todos los anestesiólogos tienen una experiencia uniforme con esta rama de la anestesia y con la atención de gestantes. Se encontró que la experiencia del anestesiólogo < 5 años mostró asociación significativa como factor de riesgo de hipotensión severa posanestesia, con ORa 3.318 (IC95% 1.318-7.969 p = 0,007). Shitemaw et al.[27], encontró un resultado similar al encontrar que una experiencia del anestesiólogo < 5 años se asociaba a mayor riesgo de hipotensión. En forma similar Benjhawaleemas et al.[10], reportó que los residentes de primer año de anestesiología tenían más riesgo de registrar hipotensión severa con bloqueo alto frente a los residentes de segundo y tercer año.
Realizar pausa para aspirar LCR durante la administración de anestesia raquídea obtuvo diferencia significativa en el análisis bivariable con ORc 2.169 (IC95% 1.132-4.156 p = 0,020), pero no logró una diferencia significativa en el análisis multivariable con ORa 2.126 (IC95% 0.977-4.627 p = 0,057). Se debe tener en cuenta esta variable para futuras investigaciones debido a que es una práctica común la aspiración de LCR para comprobar que la aguja siga conectada al espacio raquídeo. Esta pausa para aspirar LCR es similar a la técnica del barbotage donde se aspira un determinado volumen de LCR para diluir el anestésico local con el objetivo de disminuir su baricidad y así obtener un mayor nivel de bloqueo anestésico[31]. La hipobaricidad de la solución anestésica favorece un mayor bloqueo cefálico, lo que podría explicar un mayor riesgo de hipotensión severa.
El uso de vasopresor profiláctico al análisis bivariado obtuvo ORc 0.544 (IC95% 0.254-1.078 p = 0,079) y al análisis multivariable ORa 0.510 (0.226-1.152 p = 0,105) sin diferencia significativa. Este resultado sugiere un probable papel protector frente a la hipotensión severa que se debería investigar en muestras poblacionales más grandes. La presencia de membranas am- nióticas integras podría ser un factor de riesgo de hipotensión, debido a que al preservar el volumen amniótico causan mayor efecto compresivo aorto-cava, al análisis multivariado se obtuvo un ORa 2.916 (IC95% 0.926-9.184 p = 0,068) sin diferencia significativa, pero a tener en cuenta en futuras investigaciones.
Como limitantes del estudio realizado están el tamaño pequeño de la muestra y la probable intervención de otras variables asociadas con hipotensión posanestésica no incluidas en este estudio como: focos ocultos de infección materna, trastornos del estado ácido-base y/o hidroelectrolítico, niveles de glucemia alterados, volumen endovenoso pre-operatorio, deshidratación, datos neonatales como apgar o pH de cordón umbilical, estado de ansiedad y estrés maternos[30]. Incluso ya se han reportado factores genéticos individuales que predisponen a la hipotensión arterial postanestesica (variaciones en el adrenoreceptores Beta-2AR)[1],[6],[28]. Es importante recordar que factores ambientales de sala de operaciones como la temperatura, luminosidad y sonoridad, también podrían exacerbar o disminuir la actividad del sistema simpático influyendo en la frecuencia de hipotensión postanestesia[25].
-
Conclusiones
La incidencia de hipotensión severa posanestesia raquídea en cesáreas aún es un problema significativo. Se identificaron como factores de riesgo de hipotensión severa la edad > 35 años, PAS basal > 110 mmHg, peso del neonato < 4.000 g y la experiencia del anestesiólogo < 5 años. Ante la presencia de estos factores se debe tener mayor vigilancia para la prevención y tratamiento temprano de este evento adverso.
-
Recomendaciones
Realizar futuras investigaciones en muestras más grandes y agregar más variables que no se consideraron en esta investigación. Los estudios prospectivos son de elección debido a que los episodios de hipotensión arterial posanestésica frecuentemente no son registrados en su real magnitud en el monitoreo anestésico subestimando el real impacto de este evento adverso.
Responsabilidades éticas
Aprobación por el comité de ética
Este estudio fue aprobado por el comité de ética del Instituto Nacional Materno Perinatal (INMP) con número de acta: 130-2023-DG-N°015-OEAIDE-INMP.
Se realizó en conformidad con la Declaración de Helsinki de 1964 y sus modificaciones posteriores.
Protección de sujetos humanos y animales
Los autores declaran que no se realizaron experimentos en humanos ni en animales para el presente estudio.
Confidencialidad de los datos
Se garantizó la confidencialidad de la identificación personal de los sujetos de estudio y se mantuvo toda la información bajo custodia de los investigadores.
Derecho a la privacidad y consentimiento informado
No se divulgo ningún dato personal de los sujetos de investigación. Se obtuvo el consentimiento informado por escrito de las participantes del estudio.
Contribución de los autores
ERQP, JLQP: ambos autores contribuyeron por igual en el diseño, recolección de datos, análisis estadístico, interpretación, discusión y conclusiones del artículo. Se aprobó en forma conjunta la versión definitiva para publicación.
Agradecimientos: Se agradece a todo los anestesiólogos y pacientes que aceptaron la participación en el estudio.
Conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses.
Financiación: El estudio fue financiado por los autores, no financiación externa.
Presentaciones: Ninguna declarada.
Asistencia del estudio: Ninguna declarada.
-
Referencias
1. Li YS, Lin SP, Horng HC, Tsai SW, Chang WK. Risk factors of more severe hypotension after spinal anesthesia for cesarean section. J Chin Med Assoc. 2024 Apr;87(4):442–7. https://doi.org/10.1097/JCMA.0000000000001056 PMID:38252496
2. Essam Elfeil Y, Alattar AM, Ghoneim TA, Abd Elaziz AR, Deghidy EA. The effectiveness of non invasive hemodynamic parameters in detection of spinal anesthesia induced hypotension during cesarean section. Alex J Med. 2021;57(1):121–9. https://doi.org/10.1080/20905068.2021.1885953.
3. Chekol WB, Melesse DY, Mersha AT. Incidence and factors associated with hypotension in emergency patients that underwent cesarean section with spinal anaesthesia: prospective observational study. Int J Surg Open. 2021;35(100378):100378. https://doi.org/10.1016/j.ijso.2021.100378.
4. Fitzgerald JP, Fedoruk KA, Jadin SM, Carvalho B, Halpern SH. Prevention of hypotension after spinal anaesthesia for caesarean section: a systematic review and network meta-analysis of randomised controlled trials. Anaesthesia. 2020 Jan;75(1):109–21. https://doi.org/10.1111/anae.14841 PMID:31531852
5. Xue X, Lv X, Ma X, Zhou Y, Yu N, Yang Z. Prevention of spinal hypotension during cesarean section: A systematic review and Bayesian network meta-analysis based on ephedrine, phenylephrine, and norepinephrine. J Obstet Gynaecol Res. 2023 Jul;49(7):1651–62. https://doi.org/10.1111/jog.15671 PMID:37170779
6. Yu C, Gu J, Liao Z, Feng S. Prediction of spinal anesthesia-induced hypotension during elective cesarean section: a systematic review of prospective observational studies. Int J Obstet Anesth. 2021 Aug;47(103175):103175. https://doi.org/10.1016/j.ijoa.2021.103175 PMID:34034957
7. Munyanziza T. Incidence of spinal anesthesia induced severe hypotension among the pregnant women undergoing cesarean section at Muhima hospital. Rwanda J Med Health Sci. 2022 Apr;5(1):62–70. https://doi.org/10.4314/rjmhs.v5i1.8 PMID:40641469
8. Huang Q, Wen G, Hai C, Zheng Z, Li Y, Huang Z, et al. A height-based dosing algorithm of bupivacaine in spinal anesthesia for decreasing maternal hypotension in cesarean section without prophylactic fluid preloading and vasopressors: A randomized-controlled non-inferiority trial. Front Med (Lausanne). 2022 Jun;9:858115. https://doi.org/10.3389/fmed.2022.858115 PMID:35755061
9. Kinsella SM, Carvalho B, Dyer RA, Fernando R, McDonnell N, Mercier FJ, et al.; Consensus Statement Collaborators. International consensus statement on the management of hypotension with vasopressors during caesarean section under spinal anaesthesia. Anaesthesia. 2018 Jan;73(1):71–92. https://doi.org/10.1111/anae.14080 PMID:29090733
10. Benjhawaleemas P, Sakolnagara BB, Tanasansuttiporn J, Chatmongkolchart S, Oofuvong M. Risk prediction score for high spinal block in patients undergoing cesarean delivery: a retrospective cohort study. BMC Anesthesiol. 2024 Nov;24(1):406. https://doi.org/10.1186/s12871-024-02799-w PMID:39528929
11. Bhat AD, Singh PM, Palanisamy A. Neuraxial anaesthesia-induced hypotension during Caesarean section. BJA Educ. 2024 Apr;24(4):113–20. https://doi.org/10.1016/j.bjae.2024.01.003 PMID:38481416
12. Šklebar I, Bujas T, Habek D. Spinal anaesthesia-induced hypotension in obstetrics: prevention and therapy. Acta Clin Croat. 2019 Jun;58 Suppl 1:90–5. https://doi.org/10.20471/acc.2019.58.s1.13 PMID:31741565
13. Neumann C, Velten M, Heik-Guth C, Strizek B, Wittmann M, Hilbert T, et al. 5-HT3 blockade does not attenuate postspinal blood pressure change in cesarean section: A case-control study. Medicine (Baltimore). 2020 Sep;99(36):e21864. https://doi.org/10.1097/MD.0000000000021864 PMID:32899016
14. Massoth C, Töpel L, Wenk M. Hypotension after spinal anesthesia for cesarean section: how to approach the iatrogenic sympathectomy. Curr Opin Anaesthesiol. 2020 Jun;33(3):291–8. https://doi.org/10.1097/ACO.0000000000000848 PMID:32371631
15. van Dyk D, Dyer RA, Bishop DG. Spinal hypotension in obstetrics: context-sensitive prevention and management. Best Pract Res Clin Anaesthesiol. 2022 May;36(1):69–82. https://doi.org/10.1016/j.bpa.2022.04.001 PMID:35659961
16. Huang B, Huang Q, Hai C, Zheng Z, Li Y, Zhang Z. Height-based dosing algorithm of bupivacaine in spinal anaesthesia for decreasing maternal hypotension in caesarean section without prophylactic fluid preloading and vasopressors: study protocol for a randomised controlled non-inferiority trial. BMJ Open. 2019 May;9(5):e024912. https://doi.org/10.1136/bmjopen-2018-024912 PMID:31101694
17. Fakherpour A, Ghaem H, Fattahi Z, Zaree S. Maternal and anaesthesia-related risk factors and incidence of spinal anaesthesia-induced hypotension in elective caesarean section: A multinomial logistic regression. Indian J Anaesth. 2018 Jan;62(1):36–46. https://doi.org/10.4103/ija.IJA_416_17 PMID:29416149
18. Massoth C, Töpel L, Wenk M. Hypotension after spinal anesthesia for cesarean section: how to approach the iatrogenic sympathectomy. Curr Opin Anaesthesiol. 2020 Jun;33(3):291–8. https://doi.org/10.1097/ACO.0000000000000848 PMID:32371631
19. Tadesse Y, Moges K, Tarekegn F. Assessment of the magnitude and risk factors of post spinal relevant hemodynamics associated with caesarean section in Bahirdar university hospital, northwest Ethiopia, 2020. Journal of Anesthesia & Pain Medicine. 2022;7(1): https://doi.org/10.33140/JAPM.07.01.09.
20. Patel S, Ninave S. Postspinal anesthesia hypotension in Caesarean delivery: A narrative review. Cureus. 2024 Apr;16(4):e59232. https://doi.org/10.7759/cureus.59232 PMID:38813325
21. Erango M, Frigessi A, Rosseland LA. A three minutes supine position test reveals higher risk of spinal anesthesia induced hypotension during cesarean delivery. An observational study. F1000 Res. 2018 Jul;7:1028. https://doi.org/10.12688/f1000research.15142.1 PMID:30135733
22. Héctor Lacassie Q. HLQ, Altermatt C. F, Irarrázaval M. MJ, Kychenthal L. C, De La Cuadra F. JC. Anestesia espinal parte III. Mecanismos de acción. Rev Chil Anest. 2021;50(3):526–32. https://doi.org/10.25237/revchilanestv50n03-16.
23. Kaufner L, Karekla A, Henkelmann A, Welfle S, von Weizsäcker K, Hellmeyer L, et al. Crystalloid coloading vs. colloid coloading in elective Caesarean section: postspinal hypotension and vasopressor consumption, a prospective, observational clinical trial. J Anesth. 2019 Feb;33(1):40–9. https://doi.org/10.1007/s00540-018-2581-x PMID:30523408
24. Zwane SF, Bishop DG, Rodseth RN. Hypotension during spinal anaesthesia for Caesarean section in a resource- limited setting: towards a consensus definition. Southern African Journal of Anaesthesia and Analgesia. 2019;25(1):1–5. https://doi.org/10.1080/22201181.2018.1550872.
25. Bishop DG, Cairns C, Grobbelaar M, Rodseth RN. Obstetric spinal hypotension: preoperative risk factors and the development of a preliminary risk score – the PRAM score. S Afr Med J. 2017 Nov;107(12):1127–31. https://doi.org/10.7196/SAMJ.2017.v107i12.12390 PMID:29262969
26. Algarni RA, Albakri HY, Albakri LA, Alsharif RM, Alrajhi RK, Makki RM, et al. Incidence and risk factors of spinal anesthesia-related complications after an elective cesarean section: A retrospective cohort study. Cureus. 2023 Jan;15(1):e34198. https://doi.org/10.7759/cureus.34198 PMID:36843804
27. Shitemaw T, Jemal B, Mamo T, Akalu L. Incidence and associated factors for hypotension after spinal anesthesia during cesarean section at Gandhi Memorial Hospital Addis Ababa, Ethiopia. PLoS One. 2020 Aug;15(8):e0236755. https://doi.org/10.1371/journal.pone.0236755 PMID:32790681
28. Yoezer T, Tenzin K, Tshering J, Than YM, Wangmo KP. Pre-delivery hypotension after spinal anesthesia during cesarean section and its associated factors at Jigme Dorji Wangchuck National Referral Hospital, Bhutan. Bhutan Health J. 2021;7(1):16–23. https://doi.org/10.47811/bhj.115.
29. López Hernández MG, Meléndez Flórez HJ, Álvarez Robles S, Alvarado Arteaga JL. Alvarado Arteaga J de L. Risk factors for hypotension in regional spinal anesthesia for cesarean section. Role of the Waist-to-Hip Ratio and Body Mass Index. Rev Colomb Anestesiol. 2018;46(1):42–8. https://doi.org/10.1097/CJ9.0000000000000008.
30. Mahajan S, Karnik H, Bajpai Y. A prospective study to identify the risk factors for hypotension after spinal anaesthesia in patients undergoing caesarean section. J Evid Based Med Healthc. 2019;6(38):2598–602. https://doi.org/10.18410/jebmh/2019/535.
31. Daly MJ, Borg-Xuereb K, Mandour Y. Is barbotage in central neuraxial blockade a ritual habit or an evidence-based technique? Br J Hosp Med (Lond). 2024 Jan;85(1):1–2. https://doi.org/10.12968/hmed.2023.0329 PMID:38300685
32. Jendoubi A, Khalloufi A, Nasri O, Abbes A, Ghedira S, Houissa M. Analgesia nociception index as a tool to predict hypotension after spinal anaesthesia for elective caesarean section. J Obstet Gynaecol. 2021 Feb;41(2):193–9. https://doi.org/10.1080/01443615.2020.1718624 PMID:32148136
33. Gousheh MR, Akhondzade R, Asl Aghahoseini H, Olapour A, Rashidi M. The effects of pre-spinal anesthesia administration of crystalloid and colloid solutions on hypotension in elective cesarean section. Anesth Pain Med. 2018 Aug;8(4):e69446. https://doi.org/10.5812/aapm.69446 PMID:30250818
34. Yeh PH, Chang YJ, Tsai SE. Observation of hemodynamic parameters using a non-invasive cardiac output monitor system to identify predictive indicators for post-spinal anesthesia hypotension in parturients undergoing cesarean section. Exp Ther Med. 2020 Dec;20(6):168. https://doi.org/10.3892/etm.2020.9298 PMID:33093906
35. Rukewe A, Orlam I, Akande A, Fatiregun AA. Distribution of cesarean delivery by Robson classification and predictors of postspinal anesthesia hypotension in Windhoek referral hospitals: A cross-sectional study. Niger J Clin Pract. 2022 Feb;25(2):178–84. https://doi.org/10.4103/njcp.njcp_573_20 PMID:35170444
36. Chooi C, Cox JJ, Lumb RS, Middleton P, Chemali M, Emmett RS, et al. Techniques for preventing hypotension during spinal anaesthesia for caesarean section. Cochrane Database Syst Rev. 2020 Jul;7(7):CD002251. https://doi.org/10.1002/14651858.CD002251.pub4 PMID:32619039
37. Yokose M, Mihara T, Sugawara Y, Goto T. The predictive ability of non-invasive haemodynamic parameters for hypotension during caesarean section: a prospective observational study. Anaesthesia. 2015 May;70(5):555–62. https://doi.org/10.1111/anae.12992 PMID:25676817

 ORCID
ORCID