Ricardo Bañuelos-Huerta1*, Brenda L. Rivera-Eliosa1, María T. Sánchez-Sánchez1, Pablo Méndez-Hernández1
Recibido: 17-12-2024
Aceptado: 21-01-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 6 pp. 329-335|https://doi.org/10.25237/revchilanestv54n6-07
PDF|ePub|RIS
The importance of early detection of cardiac tamponade. Pathophysiology, diagnosis and treatment
Abstract
The pericardium is a membrane composed of two layers: the parietal and visceral. It normally contains approximately 50 mL of fluid, and pericardial effusion is diagnosed when the fluid volume exceeds this amount. Cardiac tamponade is a complication of pericardial effusion, occurring when the increased fluid volume elevates intrapericardial pressure, leading to the subsequent compression of cardiac structures, particularly the right-sided chambers, ultimately resulting in obstructive shock. Traditionally, Beck’s triad has been used to diagnose cardiac tamponade; however, it demonstrates low sensitivity and specificity. Diagnostic tools include chest X-ray, computed tomography (CT), and ultrasound, with ultrasound being the most sensitive for the early detection of cardiac tamponade. Pericardiocentesis can be performed electively to determine the etiology of the effusion or urgently if the effusion causes hemodynamic instability. According to the literature, there are three main approaches for pericardiocentesis: apical, subxiphoid, and parasternal. The drainage volume should be limited to 1 liter at a time, as exceeding this amount can result in right ventricular dysfunction. The rate of major complications for ultrasound-guided pericardiocentesis is 1.3%-1.6%, compared to 20.9% when performed without ultrasound guidance.
Resumen
El pericardio es una membrana compuesta por dos capas parietal y visceral, contiene aproximadamente 50 ml de líquido, se considera derrame pericárdico cuando el líquido excede esta cantidad, mientras que el taponamiento es una complicación del derrame pericárdico ya que el volumen genera un incremento de presión intrapericárdica con la subsecuente compresión de estructuras cardíacas, especialmente derechas, concluyendo en choque de tipo obstructivo. Clásicamente se ha diagnosticado el taponamiento con la Triada de Beck, sin embargo, cuenta con sensibilidad y especificidad muy baja. Los auxiliares diagnósticos utilizados son radiografía de tórax, tomografía computarizada y ultrasonido; siendo este último el más sensible para la detección temprana del taponamiento cardíaco. La pericardiocentesis puede tener indicación electiva para determinar la etiología del derrame y de tipo urgente en caso de que el derrame produzca inestabilidad hemodinámica. De acuerdo con la literatura, existen tres abordajes para realizar la pericardiocentesis: apical, subxifoidea y paraesternal. El drenaje debe limitarse a 1 litro al momento, ya que al exceder esta cantidad puede causar disfunción ventricular derecha. La tasa de complicaciones mayores de la pericardiocentesis guiada por ultrasonido es de 1,3%-1,6% comparada con 20,9% al no usar guía por medio de ultrasonido.
-
Introducción
El pericardio es una membrana compuesta por dos capas, parietal y visceral, que contiene aproximadamente 50 ml de líquido, se considera derrame pericárdico cuando el líquido excede esta cantidad[1], mientras que el taponamiento es una complicación del derrame pericárdico debido a que el volumen genera incremento de presión intrapericárdica con la subsecuente compresión de estructuras cardíacas, especialmente derechas, concluyendo en un choque de tipo obstructivo[2].
El taponamiento cardíaco es una emergencia potencialmente letal, que requiere un diagnóstico y tratamiento oportuno. La progresión del derrame pericárdico a inestabilidad puede ser rápida e impredecible, por esta razón no se debe esperar para realizar una intervención oportuna.
-
Fisiopatología
Este síndrome clínico y hemodinámico se caracteriza por la existencia de una compresión cardíaca secundaria a un aumento de la presión intrapericárdica (PIP) producida por una acumulación anormal de líquido dentro de la cavidad pericárdica. El pericardio se distiende adaptándose al aumento de volumen con aumento mínimo de la PIP, progresando a un punto en el cual ya no es posible mayor distensibilidad, por lo que aumenta abruptamente la presión (volumen de reserva pericárdica). Consecuentemente, la PIP supera a la presión de cavidades derechas, generando de manera inicial fluctuaciones de pared en la aurícula derecha por los cambios de presión intratorácica durante la ventilación, al continuar el incremento de presión intrapericárdica se supera la presión del ventrículo derecho, produciendo un incremento del gradiente retrógrado, por lo que incrementa la presión venosa central y clínicamente se expresa por la presencia de ingurgitación yugular. Al continuar con la progresión de PIP, se supera a la propia del ventrículo derecho (25 mmHg) y este se colapsa, generando obstrucción de entrada hacía las cavidades derechas y en consecuencia la disminución del llenado de cavidades izquierdas, que debido a los cambios de presión intratorácica durante la ventilación espontánea y subsecuente disminución del volumen sistólico, produce disminución del gasto cardíaco generando un choque de tipo obstructivo[3].
El desarrollo de la fisiopatología del taponamiento cardíaco depende de la tasa de acumulación de líquido pericárdico y de la distensibilidad pericárdica, produciéndose de manera aguda o crónica[4] (Figura 1).
Cuando existe un derrame pericárdico, el efecto dependerá de la presión y no del tamaño (determinantes de la curva de presión-volumen). En los derrames pericárdicos crónicos, existen mecanismos compensatorios los cuales permiten acumular mayor cantidad de líquido antes de producir taponamiento[5].
-
Etiología
El derrame pericárdico es multicausal y la frecuencia varía de acuerdo a las características de la población atendida. Oscar Orihuela Rodríguez y colaboradores, realizaron un estudio con 380 pacientes en Hospital de Especialidades del Centro Médico Nacional Siglo XXI del Instituto Mexicano del Seguro Social reportando las principales causas del derrame pericárdico (Tabla 1).
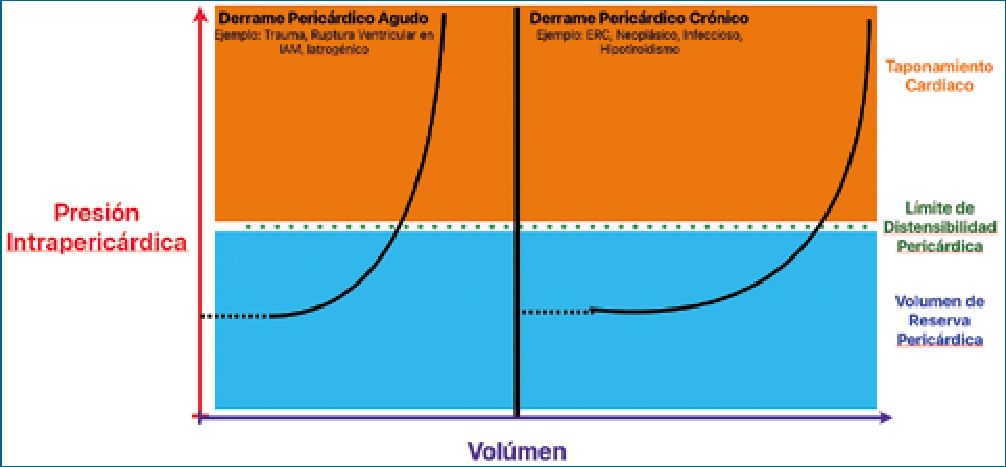
Figura 1. Relación presión-volumen en taponamiento cardíaco.
Imagen adaptada del original Martínez-Monzonis 2021, November. Pericardial effusion.
Tabla 1. Etiología más frecuente del derrame pericárdico
| Origen | n | % |
| Urémico | 227 | 59,7 |
| Disminución de drenaje linfático (insuficiencia cardiaca, cirrosis hepática) | 73 | 15,8 |
| Colagenopatía | 30 | 7,9 |
| Neoplásico | 26 | 6,8 |
| Infeccioso | 19 | 5,0 |
| Idiopático | 14 | 3,7 |
| Hipotiroidismo | 2 | 0,5 |
| Posinfarto | 1 | 0,3 |
| latrogénico | 1 | 0,3 |
| Total | 380 | 100 |
-
Métodos diagnósticos
-
Clínicos
Claude S. Beck (1894-1971), fue pionero de la cirugía cardíaca al obtener el primer título de profesor de cirugía cardíaca en Estados Unidos en 1952. Entre 1925 y 1935, inició a realizar estudios sobre fisiología y procedimientos quirúrgicos para la compresión cardíaca, identificando y describiendo la triada diagnóstica que hoy en día se conoce como la “Triada de Beck”[6].
Un estudio realizado en el servicio de urgencias en el año 2022, reveló que la sensibilidad de la ingurgitación yugular, hipotensión y disminución de los ruidos cardíacos fue del 37,5%, 12,5% y 37,5% respectivamente. La sensibilidad de un solo elemento de la triada de Beck para realizar el diagnóstico de taponamiento cardíaco fue del 50% y ningún paciente cumplía con los tres elementos[4].
-
Radiografía
En la radiografía de tórax con proyección postero-anterior se puede presentar cardiomegalia, que generalmente aparece cuando se acumulan más de 250 ml de líquido pericárdico, en algunos casos la silueta cardíaca adopta forma “en botella” al borrarse el contorno del borde cardíaco izquierdo. En la proyección lateral se puede encontrar el signo de la “galleta oreo” o “cojinete graso”, debido al líquido pericárdico delineado por la grasa radiolúcida del epicardio y el mediastino, este signo aparece cuando la separación de las capas grasas es mayor a 2 mm y tiene una especificidad alta (94%) y una sensibilidad muy baja (12%)[7],[8].
-
Tomografía computarizada
La TAC es útil para identificar el engrosamiento del pericardio y datos asociados a la constricción pericárdica, como la dilatación de las venas cavas. A diferencia de la radiografía, este estudio puede orientar hacía la etiología del derrame e incluso diferenciar entre el engrosamiento de la membrana pericárdica y una colección. Además, el incremento de la atenuación del líquido pericárdico puede indicar un proceso exudativo, hemorrágico o ambos[9].
-
Ultrasonido
En la ecografía el pericardio está representado por una capa hiperecoica, mientras que el líquido se observa anecoico. Podemos identificar dos tipos de derrame: homogéneos y heterogéneos; siendo estos probablemente de origen hemorrágico, purulento o incluso septados[10],[11].
En el taponamiento cardíaco hay diferentes marcadores como el colapso diastólico del ventrículo derecho que tiene una especificidad alta (75%-90%) y una sensibilidad relativamente baja (48%-60%), el colapso sistólico de la aurícula derecha es el signo más temprano con una especificidad variable (33%- 100%), mientras que la sensibilidad es alta y puede variar en la etapa inicial (50%); en la etapa de progresión (100%), la vena cava inferior pletórica con variación respiratoria mínima tiene una sensibilidad muy alta (95%-97%) y una especificidad más baja (40%); el pulso paradójico tiene una sensibilidad del 82% [12] (Figura 2).
-
Evaluación
De acuerdo a los criterios de Weitzman, para la cuantificación del derrame pericárdico se puede clasificar como leve (< 10
mm), moderado (10-19 mm) o severo (> 20 mm) al detectarse por medio de ecocardiografía en el momento de la diástole en la ventana paraesternal eje largo en modo M[11],[12].
Para la clasificación de Horowitz, se toma en cuenta la separación de las hojas de pericardio[13]: (Tabla 2).
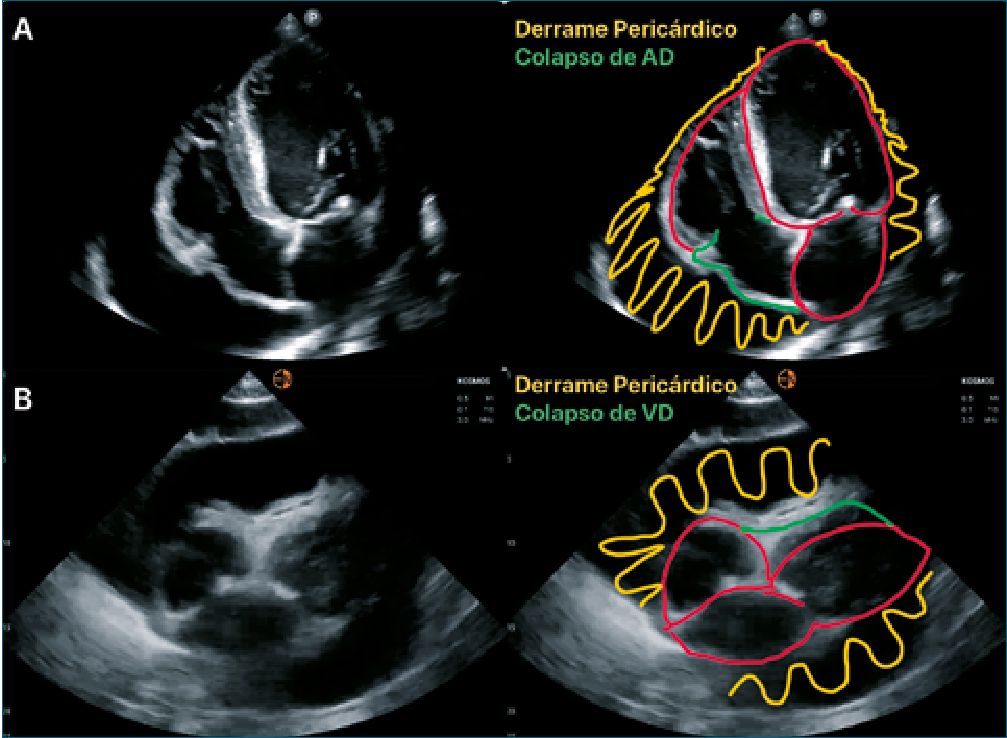
Figura 2. Datos ecográficos de taponamiento cardíaco.
Tabla 2. Clasificación de Horowitz del derrame pericárdico
| Tipo A | Sin derrame |
| Tipo B | Separación del pericardio y el epicardio (3-15 ml) |
| Tipo C1 | Separación del pericardio y epicardio sistólico y diastólico (>16 ml) |
| Tipo C2 | Separación diastólica y sistólica con disminución de la movilidad del pericardio |
| Tipo D | Separación pronunciada del epicardio y del pericardio con espacio grande libre de ecos |
| Tipo E | Engrasamiento del pericardio (> 4 mm) |
-
Diagnóstico diferencial
Para diferenciar entre derrame pericárdico y derrame pleural la aorta torácica descendente juega un papel importante, ya que el derrame pericárdico se observa anteriormente a ésta, mientras que el derrame pleural se extiende posteriormente a la misma[14].
-
Procedimiento ecoguiado
La sencillez y la posibilidad de realizar una ecocardiografía en la cama del paciente durante la pericardiocentesis es uno de los beneficios de esta. La probabilidad de que el procedimiento sea exitoso es del 93% cuando el derrame es anterior y con una cuantificación de 10 mm, a diferencia del derrame posterior y pequeño en donde la probabilidad se reduce a 53%[12].
La pericardiocentesis guiada por ecocardiografía mejoró la situación del taponamiento secundario a perforación cardíaca en el 99% de los pacientes y fue el tratamiento definitivo en el 88% de los pacientes[15].
La pericardiocentesis puede tener indicación electiva para determinar la etiología del derrame y de tipo urgente en caso de que el derrame produzca inestabilidad hemodinámica; además de tener indicación para realizarse en derrames mayores a 20 mm detectados por ecocardiograma[13],[15].
En pacientes que requieren hemodiálisis y que además presentan datos incipientes de taponamiento, al momento de iniciar la terapia sustitutiva renal existirá un secuestro de volumen en cavidades derechas, generando disminución de presiones y en consecuencia colapso de las cavidades, provocando choque obstructivo. Por lo que se requiere evaluar la prioridad de drenaje pericárdico previo a la sesión.
1. Selección de sitio de punción
Existen 3 abordajes descritos en la literatura (Figura 3)
1. Subxifoidea:
• Técnica: colocando el transductor en sentido transversal, realizando una ventana cardíaca subxifoidea, se identifican cavidades derechas en la parte más superior del haz de insonación. Debido a que por gravedad atmosférica el líquido tiene que estar en partes inferiores, es la ventana en donde puede identificarse con mayor facilidad el derrame y acceder a este. En ocasiones podemos observar la anteposición del lóbulo hepático izquierdo. La aguja se ubica lateral al transductor y en sentido al haz de insonación[16].
• Ventajas: menor riesgo de daño pleural o pulmonar como neumotórax[16],[17].
• Desventajas: se han reportado casos de lesión pleural, hepática y gástrica, además de irritación diafragmática y del nervio frénico que producen bradicardia y shock, por lo que dicho método está relacionado con una mayor mortalidad[7], [18]. Debe evitarse en pacientes con coagulopatía primaria
o secundaria (fármacos) o trombocitopenia.
2. Apical
• Técnica: se coloca el transductor en ventana A4C, identificando el mayor espacio entre pericardio y ápex. La aguja aborda lateral al transductor en sentido al haz de insonación[16].
• Ventajas: es la vía más corta entre la piel y el espacio pericárdico, debido a que las estructuras intermedias entre estos son mínimas, resulta una alternativa segura y eficaz preferible en pacientes con anatomía compleja[17].
• Desventajas: se asocia con perforación del ápex y consecuente fibrilación ventricular, no se recomienda realizar esta técnica en situaciones de emergencia[16].
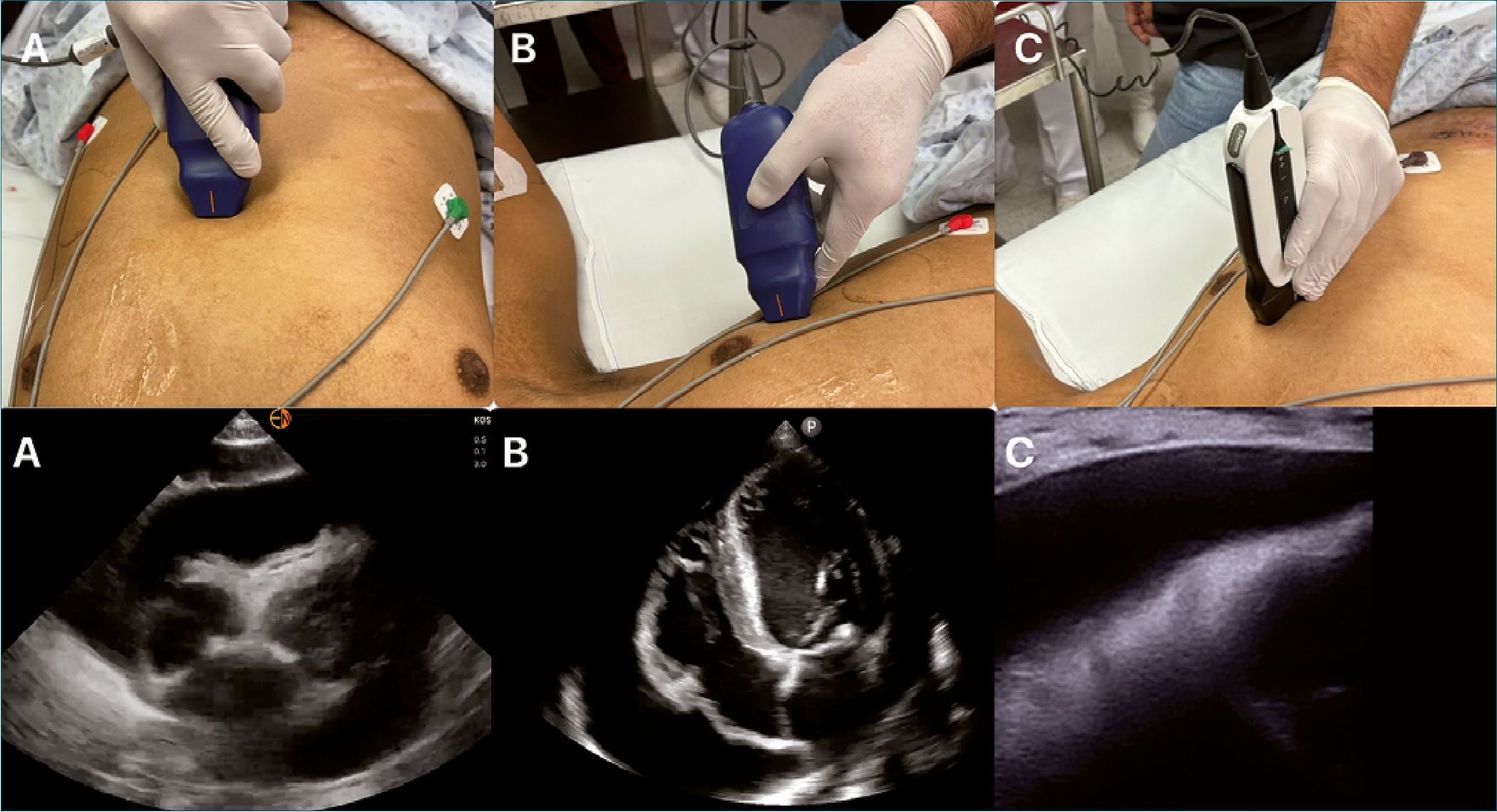
Figura 3. Ventanas para pericardiocentesis ecoguiada. A: subxifoidea; B: Apical; C: Intercostal o paraesternal.
3. Intercostal o paraesternal
• Técnica: se utiliza transductor lineal de alta frecuencia, sugerimos iniciar en abordaje longitudinal identificando el mayor espacio presente entre pericardio y miocardio, una vez identificado, se puede realizar abordaje “fuera de plano” o “dentro de plano” (sugerimos éste último) ya que podemos visualizar la dirección y profundidad de aguja al entrar en pericardio sin lesionar estructuras [16].
• Ventajas: proporciona una ruta más directa al espacio libre de eco más grande y una mayor seguridad que otros abordajes[16].
• Desventajas: se asocia mayormente con neumotórax y daño a la vasculatura torácica interna[16].
• Sugerimos evaluar las 3 ventanas e identificar la que cuenta con mayor colección de líquido, en caso que la ventana subxifoidea presente reverberación intermitente con los movimientos respiratorios, se debe evitar ya que podemos puncionar intestino o estómago.
• En caso de que en la ventana apical o intercostal se observe el “signo de la cortina”, refiriéndonos a la entrada y salida del pulmón durante la ventilación, se debe reubicar el transductor.
• Utilizar medidas de prevención estandarizadas en las unidades hospitalarias para procedimientos ecoguiados.
• Sedación y analgesia para paciente.
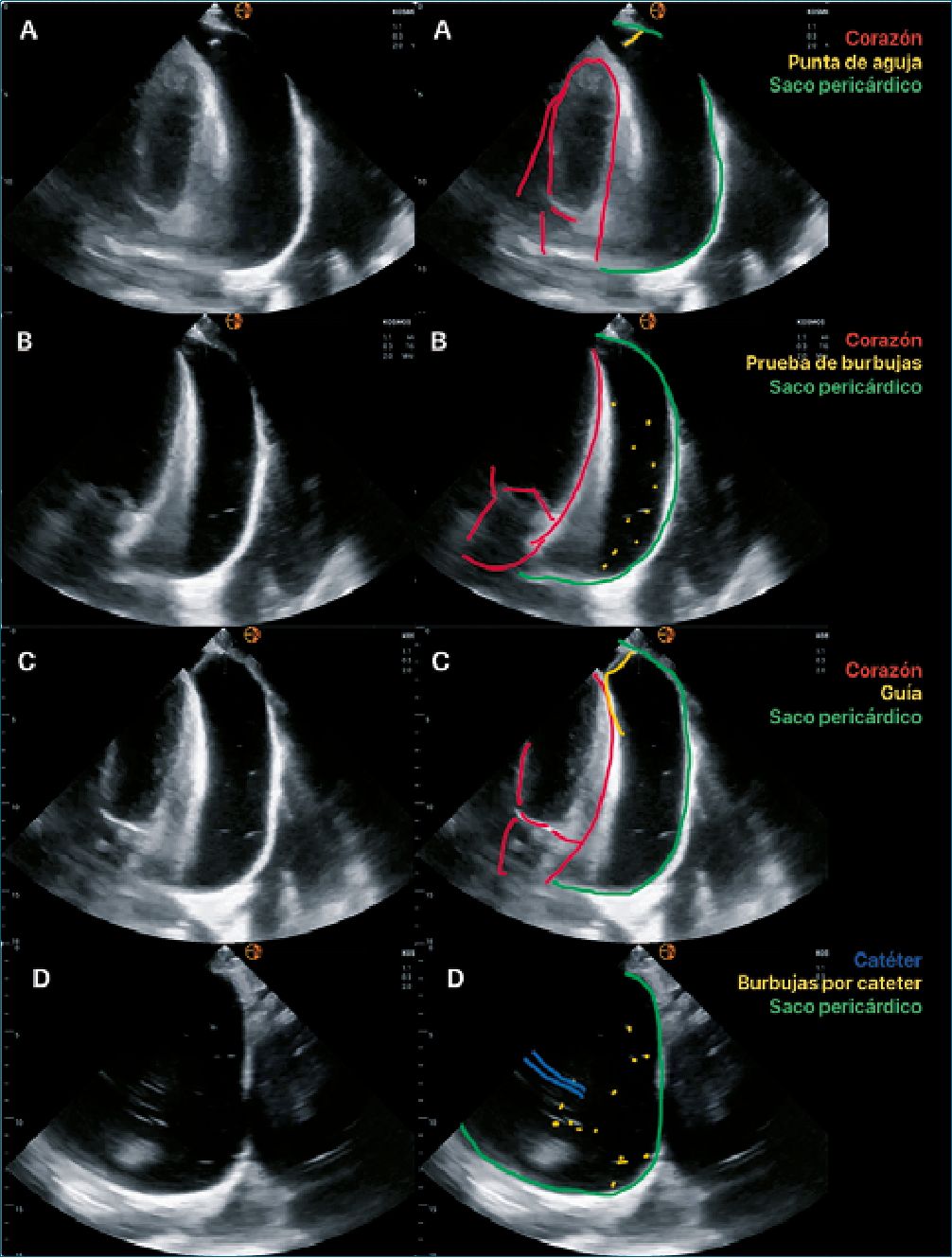
Figura 4. Técnica de pericardiocentesis. A: Introducción e identificación de punta de aguja; B: Prueba de burbujas verificación; C: Paso de guía; D: Catéter y burbujas, comprobación de ubicación.
2. Técnica (Figura 4)
• Una vez seleccionado el sitio de punción, realizando las medidas de prevención estándar, introducir la aguja paralela al haz de insonación, generando presión negativa con el émbolo de la jeringa, debemos ver en todo momento la punta de la aguja para disminuir la posibilidad de lesión de estructuras.
• Una vez obteniendo el líquido pericárdico en la jeringa, inyectar solución salina de tal manera que genere un contraste ecogénico con burbujas, las cuales deben ser visibles en el líquido pericárdico, comprobando la ubicación de la aguja[19].
• En parada cardíaca, no existe una recomendación fuerte
sobre la cantidad mínima o máxima a drenar, nosotros tomamos en consideración la recomendación ATLS[20] acerca de realizar el drenaje de 70-100 ml de líquido pericárdico, posteriormente retirar la aguja y continuar con las compresiones, de otra manera al no resolver el taponamiento cardiaco, las compresiones serán inefectivas a pesar de la buena calidad de compresión externa. En situaciones diferentes a parada cardíaca, sugerimos colocar catéter para drenaje pericárdico. Por lo que, una vez comprobada la ubicación de la aguja, pasaremos la guía de catéter hasta ser visible en la ventana ecográfica, se corrobora la ubicación dentro del saco pericárdico y se retira la jeringa.
• Colocar dilatador.
• Colocar catéter vascular.
• Realizar nuevamente la prueba de burbujas, corroborando que el catéter se encuentra dentro del saco pericárdico.
• Drenaje pericárdico.
• Preferimos mantener catéter pericárdico debido a que algunas patologías como pericarditis urémica, amiloidosis e incluso hemo pericardio, presentan reincidencia del derrame, por lo que al contar con el catéter puesto solo abrimos los puertos para realizar el drenaje. En el caso de hemo pericardio por trauma de tórax, no hemos presentado obstrucción del catéter por coágulos y en drenajes mayores a 200 cc en la primera hora se ha realizado exploración quirúrgica.
El drenaje debe limitarse a 1 litro al momento, ya que al exceder esta cantidad puede causar disfunción ventricular derecha[21].
Una vez realizado el drenaje pericárdico, cerramos el puerto y realizamos exploración ecográfica cada 4 h durante las primeras 24 h, o antes si las condiciones clínicas y hemodinámicas del paciente lo requiere. Generalmente, se vuelve a abrir el puerto a las 24 h y en promedio se retira el catéter entre las 48-72 h cuando el gasto es menor de 30 cc. Numerosos estudios han reportado que el drenaje prolongado reduce la tasa de recurrencia de 23% a 6%, en comparación con el 27% al 55% posterior a la pericardiocentesis simple, una de las hipótesis es por la obliteración del espacio pericárdico y como consecuencia una menor acumulación de líquido[21].
Pacientes con derrames reincidentes generan más de 50 cc en menos de 24 h, por lo que permanecerán con catéter hasta realizar ventana pericárdica.
Numerosas bibliografías mencionan realizar el retiro del catéter al contar con gastos menores a 30 cc en 24 h. Se retira con el paciente en decúbito dorsal y realizando espiración forzada, disminuyendo la posibilidad de la entrada de aire[22].
-
Complicaciones
Las complicaciones más frecuentes de la pericardiocentesis incluyen arritmias como la bradicardia vasovagal debido a la descompresión aguda del pericardio hasta en 25% de los pacientes, laceración o perforación del miocardio y/o arterias coronarias, hemotórax, neumotórax, neumopericardio y daño hepático; además de que el sitio de punción podría desencadenar complicaciones específicas como infecciones o hematomas[18].
La tasa de complicaciones mayores de la pericardiocentesis guiada por ultrasonido es de 1,3%-1,6% comparada con 20,9% al no usar guía por medio de ultrasonido[4].
En un estudio publicado en 2015, que incluyó 212 pacientes con cáncer, los cuales requirieron pericardiocentesis, se realizó abordaje subxifoideo y apical (63% y 37% respectivamente), la tasa general de éxito reportada fue del 99% y la tasa de complicaciones mayores fue del 2% (1 paciente con laceración de la arteria intercostal, 1 paciente con laceración hepática que requirió abordaje quirúrgico y 1 paciente con neumotórax), sin embargo, no se reporta la tasa de éxito o complicaciones de manera individualizada de un abordaje frente a otro[19].
-
Conclusiones
El taponamiento cardíaco es una emergencia potencialmente letal, que requiere un diagnóstico y tratamiento oportunos. La triada de Beck tiene baja sensibilidad en la detección del taponamiento, por lo que la identificación temprana y efectiva requiere de apoyo con ecografía para detectar los signos característicos, antes de presentarse con inestabilidad hemodinámica.
Además, la ecografía no solo permite confirmar el diagnóstico sino también guiar el procedimiento terapéutico como la pericardiocentesis y de esta manera disminuir riesgos de complicaciones.
Tener presente que en los derrames pericárdicos la progresión a inestabilidad puede ser rápida e impredecible, por lo que es crucial no esperar hasta el punto del choque obstructivo para intervenir, sobre todo en pacientes con hemodiálisis, ya que en ellos el simple hecho de iniciar una terapia generará cambios de presiones en cavidades derechas y en consecuencia compromiso hemodinámico. La realización oportuna de la pericardiocentesis en casos indicados mejora el pronóstico y reduce mortalidad, por lo que debemos retirar el concepto de intervenir hasta el punto final que es el choque obstructivo.
Conflicto de intereses
Los autores declaramos no tener conflicto de intereses.
Financiamiento
Los autores declaramos no recibir fuente de financiación provenientes de entidades públicas, privadas, de investigación o fundaciones.
Declaración de originalidad Los autores declaramos que el presente trabajo no ha sido previamente presentado en algún congreso o reunión científica.
-
Referencias
1. Orihuela-Rodríguez O, Carmona-Ruiz H. Prevalencia de derrame pericárdico en enfermedades sistémicas. Gac Med Mex. 2019;155(3):254–7. https://doi.org/10.24875/GMM.19004444 PMID:31219473
2. Appleton C, Gillam L, Koulogiannis K. Cardiac Tamponade. Cardiol Clin. 2017 Nov;35(4):525–37. https://doi.org/10.1016/j.ccl.2017.07.006 PMID:29025544
3. Stashko E, Meer JM. (2023, August 7). Cardiac Tamponade. StatPearls – NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK431090/#article-18905.s5
4. Stephen Alerhand MD. Robert James Adrian, MDa, Brit Long, MD, Jacob Avila, MD. (2022). Pericardial Tamponade: A Comprehensive Emergency Medicine and Echocardiography review. American Journal of Emergency Medicine. https://www.sciencedirect.com/science/article/abs/pii/S0735675722002923
5. Hidalgo VG. Taponamiento cardiaco: aproximación clínica, diagnóstico y manejo. Galicia Clin. 2022;83(1):22. https://doi.org/10.22546/64/2563.
6. Theruvath TP, Ikonomidis JS. Historical perspectives of The American Association for Thoracic Surgery: claude S. Beck (1894-1971). J Thorac Cardiovasc Surg. 2015 Mar;149(3):655–60. https://doi.org/10.1016/j.jtcvs.2014.06.032 PMID:25063024
7. Battistoni I, Marini M, Angelini L, Francioni M, Gili A, Moretti S, et al. Safety and efficacy of non-continuous echocardiography-guided pericardiocentesis: a single-center study of 478 patients. Minerva Cardioangiol. 2017 Oct;65(5):451–7. https://doi.org/10.23736/S0026-4725.16.04190-6 PMID:27901332
8. Muñoz Durán J. (2023). Signo de la galleta OREO: revisión de la anatomía de un signo radiológico clásico a través de un caso clínico Oreo Cookie Sign: Revisión anatómica de un signo radiológico clásico a través del reporte de un caso. In ScienceDirect. https://www.sciencedirect.com/science/article/pii/S0716864023000445
9. Sauleda JS. Diagnóstico y guía terapéutica del paciente con taponamiento cardíaco o constricción pericárdica. Rev Esp Cardiol. 2003;56(02):195–205. https://doi.org/10.1016/S0300-8932(03)76845-6.
10. Vakamudi S, Ho N, Cremer PC. Pericardial Effusions: Causes, Diagnosis, and Management. Prog Cardiovasc Dis. 2017;59(4):380–8. https://doi.org/10.1016/j.pcad.2016.12.009 PMID:28062268
11. Goodman A, Perera P, Mailhot T, Mandavia D. The role of bedside ultrasound in the diagnosis of pericardial effusion and cardiac tamponade. J Emerg Trauma Shock. 2012 Jan;5(1):72–5. https://doi.org/10.4103/0974-2700.93118 PMID:22416160
12. Alerhand, S., & Carter, J. (2018). What echocardiographic findings suggest a pericardial effusion is causing tamponade? En https://doi.org/10.1016/j.ajem.2018.11.004..
13. Maisch B, Seferović PM, Ristić AD, Erbel R, Rienmüller R, Adler Y, et al.; Grupo de Trabajo para el Diagnóstico y Tratamiento de las Enfermedades del Pericardio de la Sociedad Europea de Cardiología. Guía de Práctica Clínica para el diagnóstico y tratamiento de las enfermedades del pericardio. Versión resumida. Rev Esp Cardiol. 2004 Nov;57(11):1090–114. https://doi.org/10.1016/S0300-8932(04)77245-0 PMID:15544758
14. Pérez-Casares A, Cesar S, Brunet-Garcia L, Sanchez-de-Toledo J. Echocardiographic Evaluation of Pericardial Effusion and Cardiac Tamponade. Front Pediatr. 2017 Apr;5:79. https://doi.org/10.3389/fped.2017.00079 PMID:28484689
15. Flint N, Siegel RJ. Echo-Guided Pericardiocentesis: When and How Should It Be Performed? Curr Cardiol Rep. 2020 Jun;22(8):71. https://doi.org/10.1007/s11886-020-01320-2 PMID:32572594
16. Jung HO. Pericardial effusion and pericardiocentesis: role of echocardiography. Korean Circ J. 2012 Nov;42(11):725–34. https://doi.org/10.4070/kcj.2012.42.11.725 PMID:23236323
17. Alaiwah M, Hassanin A, Abbasi D, Rayes H, Hassan Z, Albadaineh M, et al. Percutaneous pericardiocentesis using the apical approach: case series and review of the literature. Egypt Heart J. 2024 Aug;76(1):106. https://doi.org/10.1186/s43044-024-00537-8 PMID:39150585
18. Willner DA, Grossman SA. (2023, July 19). Pericardiocentesis. StatPearls – NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK470347
19. Alaiwah M, Hassanin A, Abbasi D, Rayes H, Hassan Z, Albadaineh M, et al. Percutaneous pericardiocentesis using the apical approach: case series and review of the literature. Egypt Heart J. 2024 Aug;76(1):106. https://doi.org/10.1186/s43044-024-00537-8 PMID:39150585
20. Henry, S., Brasel, K., & Stewart, R. (2018). ATLS. Soporte Vital Avanzado en Trauma.
21. Gluer R, Murdoch D, Haqqani HM, Scalia GM, Walters DL. Pericardiocentesis – How to do it. Heart Lung Circ. 2015 Jun;24(6):621–5. https://doi.org/10.1016/j.hlc.2014.11.009 PMID:25637941
22. Val E, Fuentes D, Vicente M, Miranda N, Martínez I, Bosque M. Actualización en el abordaje del drenaje torácico. Sanid Mil. 2023;78: https://doi.org/10.4321/s1887-857120220004000012.

 ORCID
ORCID