Elsy Sofía Calle1*, María Paula Campos1
Recibido: 12–2024
Aceptado: 26-01-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 6 pp. 803-810|https://doi.org/10.25237/revchilanestv54n6-04
PDF|ePub|RIS
Ketamine and dexmedetomidin in general anesthesia a systematic rewiev
Abstract
Introduction: The combination of dexmedetomidine and ketamine, known as “ketodex,” has emerged as a promising alternative for general anesthesia and sedation. This approach enhances the analgesic and anesthetic effects of both drugs, reducing their individual adverse effects. Methodology: This was a systematic review of studies on the use of ketodex in general anesthesia. Results: Seventeen relevant studies were identified, which included a variety of surgeries. These studies compared traditional anesthesia versus opioid-free anesthesia, highlighting variability in dosage and administration techniques. The combined use of dexmedetomidine and ketamine in general anesthesia is associated with reduced pain, reduced need for opioids, and decreased postoperative nausea and vomiting. The limited evidence and variability highlight the need for further research about the benefits and risks of ketodex in adults. Conclusion: The combined use of dexmedetomidine and ketamine in general anesthesia is associated with reduced pain, reduced need for opioids, and decreased postoperative nausea and vomiting. However, further studies are required to firmly support its use.
Resumen
Introducción: La combinación de dexmedetomidina y ketamina, conocida como “ketodex,” ha surgido como una alternativa prometedora en anestesia general y sedación. Este enfoque potencia los efectos analgésicos y anestésicos de ambos fármacos, reduciendo sus efectos adversos individuales. Metodología: Se trató de una revisión sistemática de estudios sobre el uso de ketodex en anestesia general. Resultados: Se identificaron 17 estudios relevantes, que incluyeron diversas cirugías. Estos estudios compararon anestesia tradicional versus anestesia libre de opioides, destacando la variabilidad en las dosis y técnicas de administración. El uso combinado de dexmedetomidina y ketamina en anestesia general se asocia con una reducción del dolor, menor necesidad de opioides, y una disminución de náuseas y vómitos postoperatorios. La evidencia limitada y la variabilidad subrayan la necesidad de más investigación sobre los beneficios y riesgos del ketodex en adultos. Conclusión: El uso combinado de dexmedetomidina y ketamina en anestesia general se asocia con una reducción del dolor, menor necesidad de opioides, y una disminución de náuseas y vómitos postoperatorios. Sin embargo, se requieren más estudios para respaldar firmemente su uso.
-
Introducción
En la actualidad, el creciente uso de diferentes técnicas anestésicas ha llevado al uso de combinaciones de medicamentos para potenciar sus efectos anestésicos y analgésicos, disminuyendo los efectos adversos. Tal es el caso de la asociación entre dexmedetomidina y ketamina para la sedación y para la anestesia general tanto en población pediátrica como población adulta.
La ketamina es un anestésico disociativo que actúa como antagonista competitivo del receptor excitatorio del Glutamato N-metil D-aspartato (NMDA) a nivel tálamo cortical y límbico. Su efecto clínico se debe casi por completo a este receptor, aunque también a su acción de tipo NMDA no glutamatérgica, colinérgico de tipo nicotínico y muscarínico, monoaminérgico y opioide, así como por su interacción con canales de calcio y de sodio[1]. De este modo estimula los sistemas cardiorrespirato- rios, provocando un aumento del flujo sanguíneo cerebral, la presión intracraneal y la tasa metabólica cerebral. Debe evitarse en pacientes con cardiopatía isquémica, hipertensión y presiones intraoculares elevadas. Por otro lado, la ketamina a ciertas dosis produce efectos psicológicos desagradables que incluyen alucinaciones, pesadillas y reacciones de emergencia[2],[3].
Por su parte, la dexmedetomidina es un agonista alfa 2-adrenérgico a nivel central principalmente en el locus coeruleus. Dentro de sus propiedades favorables se encuentran la sedación, la ansiolisis y la analgesia, así como la ausencia de depresión respiratoria[4]. Además, proporciona una sedación más despierta que otros sedantes[3]. Los pacientes están más despiertos y alertas cuando se les estimula. Se han reportado diferentes propiedades protectoras frente a diferentes sistemas como cardiovascular, neurológico, renal, pulmonar y gastrointestinal[4]-[6]. Los efectos adversos más comunes son la hipotensión y la bradicardia[4]. Pese a sus amplios beneficios, la dexmedetomidina como agente único no ha tenido cabida para algunos procedimientos invasivos.
El uso conjunto de la ketamina con dexmedetomidina (ketodex) parte de la premisa de que los efectos adversos de uno se atenúan con el mecanismo de acción del otro, por tal motivo esta combinación se ha utilizado con muchos fines, principalmente para procedimientos que se benefician de ventilación espontánea pero que no requieren inmovilidad total, para analgesia, para escenarios de pacientes con ventilación difícil o con contraindicación para otras técnicas anestésicas[3].
Aunque son menos frecuentes, se han descrito efectos adversos tales como falla en la sedación requiriendo dosis repetidas de ketodex, principalmente en procedimientos prolongados, en pacientes con fiebre, o con enfermedad cardíaca congénita. Otros efectos adversos reportados son falla ventilatoria en pacientes con criterios de vía aérea difícil y taquicardia auricular[3].
Existe escasa evidencia en la literatura que apoye el uso de estos medicamentos en conjunto como adyuvantes durante la anestesia general en la población adulta, por lo cual, el desconocimiento de sus efectos y de sus potenciales beneficios, lleva a un uso subóptimo del mismo, privando a una importante cantidad de pacientes de los beneficios que el ketodex ofrece.
-
Materiales y Métodos
Se realizó una búsqueda de la literatura publicada hasta el 30 de junio de 2023 en las bases de datos electrónicas PubMed, Embase, Scopus y Lilacs. Se incluyeron ensayos clínicos, estudios observacionales descriptivos y series de casos para proporcionar una visión integral de la eficacia y seguridad del ketodex, considerando tanto la evidencia de alta calidad como la experiencia clínica en diversos contextos y poblaciones. Esta revisión se estructuró en torno a la pregunta PICO: ¿Cuáles son los beneficios de usar ketamina y dexmedetomidina en conjun
to durante la anestesia general en comparación con otras técnicas anestésicas generales en población adulta?. Para responder dicha pregunta se utilizó los siguientes términos MeSH:
(Anesthesia, General OR Anesthesias, General OR General Anesthesia OR General Anesthesias) AND (((Ketamine OR CI- 581 OR CI 581 OR CI581 OR Ketalar OR Ketaset OR Ketanest OR Calipsol OR Kalipsol OR Calypsol OR Ketamine Hydrochloride) AND (Dexmedetomidine OR MPV-1440 OR MPV 1440 OR MPV1440 OR Precedex OR Dexmedetomidine Hydrochloride OR Hydrochloride, Dexmedetomidine)) OR ketodex) AND (Balanced Anesthesia OR Anesthesia, Balanced OR Anoci-Association OR Anoci Association OR Anocithesia OR Anociassociation OR Anesthesia, Intravenous OR Anesthesias, Intravenous OR Intravenous Anesthesia OR Intravenous Anesthesias).
-
Criterios de inclusión y exclusión
Para evaluar la elegibilidad de los estudios adquiridos para la revisión sistemática, adoptamos los siguientes criterios: adultos mayores de 18 años, ASA menor o igual a III, que fueron llevados a procedimiento quirúrgico bajo anestesia general y que en su intervención se utilizó ketamina en conjunto con dexmedetomidina. El comparador fue cualquier otra estrategia de anestesia general. Los desenlaces evaluados fueron la presencia de dolor, náuseas, vómito, escalofrío y agitación en el período posoperatorio.
Los criterios de exclusión fueron: estudios en mujeres embarazadas, procedimientos bajo sedación o anestesia neuroaxial, revisiones sistemáticas y metaanálisis. Adicionalmente, se excluyeron los estudios que no incluían datos sobre ninguna de las variables a estudiar.
-
Extracción de los datos
Siguiendo las guías PRISMA para revisión sistemática, se realizó la extracción de datos siguiendo los criterios predefinidos por dos autores (SC, MC). De los resultados obtenidos de todas las bases de datos, mediante el uso de la herramienta Rayyan[7], se realizó un cribado inicial excluyendo los artículos duplicados. Posteriormente, se realizó una lectura de los títulos y los abstracts teniendo en cuenta los que cumplieran los criterios de inclusión para así luego proceder a su lectura total e incluirlos en la revisión final.
-
Evaluación del riesgo de sesgos
El control del riesgo de sesgo se realizó mediante las herramientas RoB 2.0 para ensayos clínicos aleatorizados y ROBINS- I para estudios observacionales y series de casos, permitiendo una evaluación diferenciada según el diseño de cada estudio. Esta estrategia garantiza una valoración rigurosa de la validez interna, considerando la heterogeneidad metodológica y el riesgo de confusión inherente a los estudios no aleatorizados (Anexo 1 y 2).
-
Resultados
El proceso de selección de estudios se representa en la Figura 1. De los 622 registros potencialmente relevantes recupera-
dos de las bases de datos, se eliminaron 49 duplicados. Posteriormente, 533 artículos fueron excluidos tras la evaluación de títulos y resúmenes por no cumplir con los criterios de inclusión. Los principales motivos de exclusión fueron que se trataban de estudios en animales, en población pediátrica o en contextos de sedación. Finalmente, 17 estudios fueron sometidos a revisión de texto completo, de los cuales se incluyeron todos en el análisis final.
Se incluyó un total de 8 ensayos clínicos aleatorizados, 7 estudios observacionales y 2 reportes de caso. Cinco estudios fueron publicados en Estados Unidos, 5 estudios en Asia, 4 estudios en Europa, 1 estudio en Canadá, 1 estudio en Brasil y 1 estudio en Egipto. Las características de los estudios incluidos se encuentran en la Tabla 1.
Todos los estudios incluyeron participantes de ambos sexos. El tamaño de la muestra de los estudios incluidos varió entre 69 y 622, con dos reportes de caso de 8 y 2 pacientes cada uno. Los procedimientos quirúrgicos evaluados fueron cirugía bariátrica, cirugía abdominal mayor, cirugía urológica mayor, cirugía oncológica mayor (mama y cabeza y cuello), cirugía ginecológica, cirugía ortopédica (reemplazo total de cadera), procedimiento de otorrinolaringología y cirugía de columna.
La mayoría de los estudios comparó la anestesia general estándar (ej: TIVA, balanceada) versus la anestesia libre de opioides, grupo en el cual incluían el uso de diferentes medicamentos coadyuvantes, dentro de los cuales estaba la ketamina y la dexmedetomidina. Las dosis y las técnicas de administración de los medicamentos varió entre cada estudio (Tabla 1).
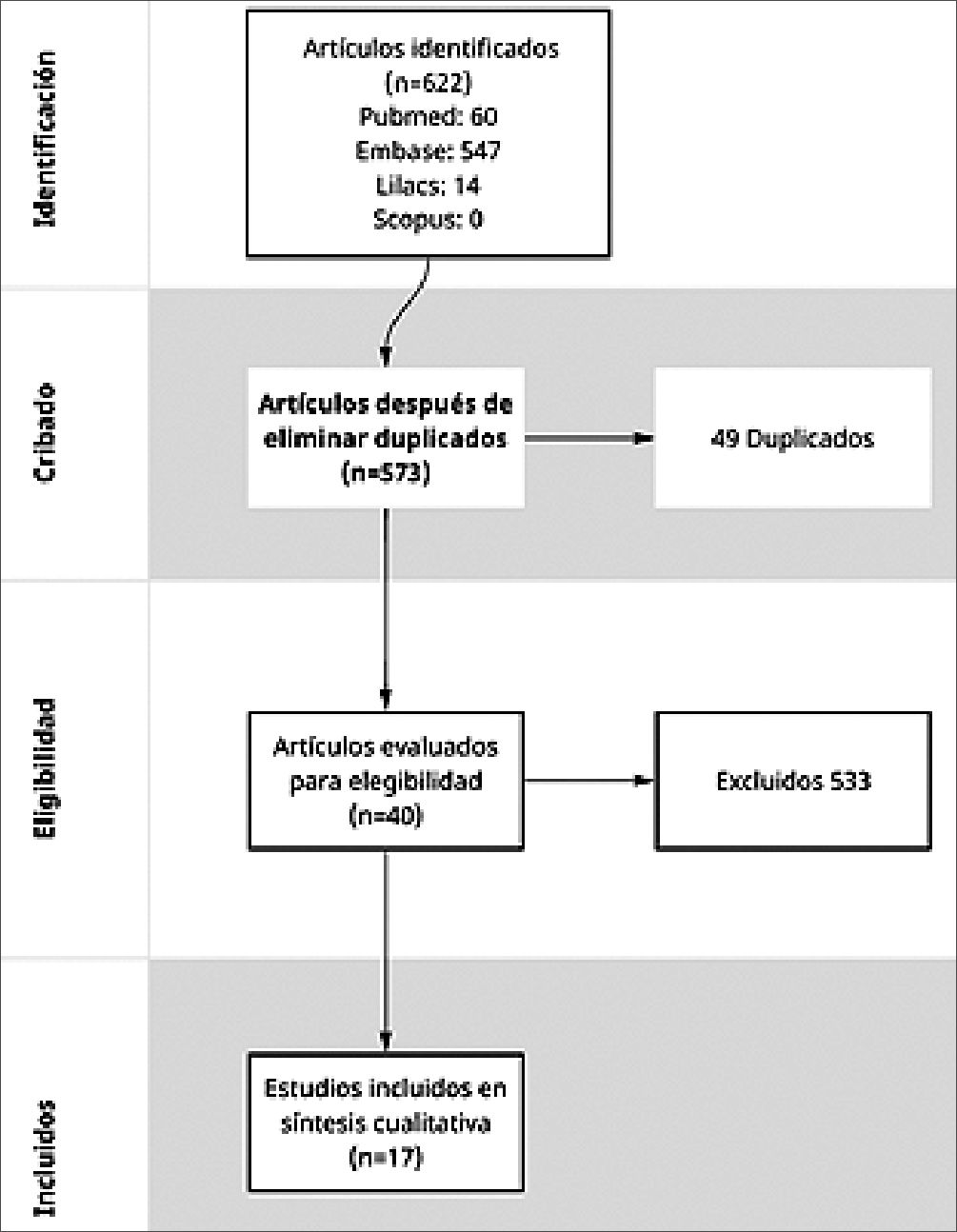
Figura 1. Resultados de búsqueda de información.
-
Desenlaces
1. Incidencia de dolor posoperatorio
Un total de 14 estudios (n = 2.826) reportaron el dolor con la escala verbal análoga (EVA), de los cuales 5 estudios (n = 830) encontraron menor dolor en el posoperatorio en el grupo de intervención en comparación con el grupo control, y esto fue estadísticamente significativo[14],[15],[22],[25],[27]. En el estudio de Este- be et al., (n = 622) no existía grupo comparador, sin embargo, el EVA medio reportado fue de 2,1 (21). En cinco estudios (n = 757) no se encontraron diferencias estadísticamente significativas. En el estudio de Shah et al., no hubo diferencia en la EVA a las 24 h, sin embargo, sí hubo diferencia post extubación, a la primera hora, a las 2 h, a las 4 h y a las 8 h (no reportan el valor de la P)[24]. En dos estudios se encontró mayor dolor en el grupo de la intervención, sin embargo, en el de Menck et al., no fue estadísticamente significativo (p = 0,127)[18] y en el de Kruthiventi et al., sí lo fue (p = 0,047)[26]. En los dos estudios de reporte de caso se evidencio un dolor de intensidad leve o ausencia de dolor (n = 10) (Tabla 2).
Un total de 14 estudios (n = 2.404) evaluaron el consumo de opioides en el posoperatorio, de los cuales 9 (n = 1.588) reportaron mayor consumo de equivalentes de morfina en el grupo comparador en comparación con el grupo de la intervención [14],[16],[17],[20],[22],[25],[27],[28],[29]. En el estudio de Shah et al., debido a que el grupo intervención la estrategia utilizada fue anestesia libre de opioides, el consumo fue de 0 versus 8,49 equivalentes de morfina en el grupo control[24]. Cuatro estudios (n = 746) no encontraron diferencia estadísticamente significativa en el consumo de opioides en el posoperatorio [13],[15],[18],[26]. Por último, en el reporte de casos publicado por Chin et al., se informó en el primer caso que no hubo requerimiento de administración de opioides en la unidad de cuidados postanestésicos y se administró 22 mg equivalentes de morfina en las primeras 24 h, y en el segundo caso se reportó un consumo de 5 mg equivalentes de morfina en la unidad de cuidados post anestésicos y de 24 mg equivalentes de morfina en las primeras 24 h[23] (Tabla 2).
2. Incidencia de náuseas y vómito en el posoperatorio
Un total de 14 estudios (n = 2.933) evaluaron la incidencia de náuseas y vómito en el posoperatorio (NyV), de los cuales 3 (n = 490) estudios reportaron mayor incidencia de náuseas y vómito en el grupo control en comparación con el grupo de intervención y fue estadísticamente significativo[13],[17],[22]. En 4 estudios (n = 626) la incidencia de náuseas y vómito posoperatorio fue mayor en el grupo comparador versus el grupo de intervención, sin embargo, no fue estadísticamente significativo[14],[25],[27],[28]. En dos estudios (n = 150) se reportó mayor incidencia de NyV en el posoperatorio en el grupo control, sin embargo, se desconoce si fue estadísticamente significativo[15],[24]. En el estudio de Estebe et al., la incidencia encontrada fue del 7%[21]. En 4 estudios (n = 1.045) hubo mayor incidencia de NyV posoperatorio en el grupo de intervención, no obstante, en ninguno fue estadísticamente significativo[16],[18],[20],[26]. En la serie de casos publicada por Dey et al., no se reportó ningún evento de náuseas y vómito pop en sus 8 pacientes incluidos (Tabla 3)[19].
3. Incidencia de escalofrío posoperatorio
En ninguno de los 17 estudios incluidos se reportó dicho evento adverso.
Tabla 1. Características de los estudios
| Estudio | Tipo | Procedimiento quirúrgico | n | # Grupo intervención | # Grupo control | Dexmedetomidina | Ketamina |
| Ziemann-Gimmel et al., 2014 | ECA | Cirugía bariátrica electiva | 119 | 60 | 59 | Bolo: 0,5 mcg kg por 10 min Infusión: 0,1-0,3 mcg/kg/h | 0,5 mg/kg |
| Zhang et al., 2023 | ECA | Resección intestinal | 120 | 60 | 60 | 0,5 mcg/kg/h | Bolo: 0,25 mg/kg Infusión: 0,12 mg/ kg/h |
| Lodhi et al., 2023 | ECA | Cirugía abdominal mayor | 80 | 40 | 40 | 0,5 mcg/kg/h | 0,5 mg/kg/h |
| Zorrilla-Vaca et al., 2022 | Retrospectivo | Cirugía ginecológica abierta mayor | 298 | 149 | 149 | 0,3-1,0 mcg/kg/h | 5,0-7,5 mcg/kg/min |
| Berlier et al., 2022 | ECA | Cirugía bariátrica | 167 | 90 | 77 | Bolo: 1,4 mcg/kg/h en 10 minutos
Infusión: 0,5-1 mcg/kg/h |
0,5 mg/kg |
| Menck et al., 2022 | ECA | Gastroplastia laparoscópica | 60 | 30 | 30 | Bolo: 0,5 mcg/kg Mantenimiento: 0,25 mcg/kg a necesidad | 25 mg |
| Dey et al., 2021 | Serie de casos | Excisión de costilla cervical | 8 | 8 | N/A | Bolo: 1 mcg/kg por 15 minutos Infusión: 0,5-0,7 mcg/kg/h | Bolo: 0,25 mg/kg (Múltiples dosis a discreción del anestesiólogo del caso) |
| Urvoy et al., 2021 | Prospectivo | Reemplazo total de cadera | 200 | 100 | 100 | Bolo: 0.7 mg kg durante 20 minutos Infusión: 1,5 mcg/kg/h, reducción a 0,5 mcg/kg/h | 0,5 mg/kg |
| Estebe et al., 2021 | Retrospectivo | Cirugía abdominal abierta mayor | 622 | 311 | 311 | Bolo: 0.1 mg/kg
Infusión: 1,0-1,4 mcg/kg/h, en caso de bradicardia 0,8-1,0 mcg/kg/h |
Bolo: 0,1-0,15 mg/kg Infusion: 0,1 mg/ kg/h |
| Mulier et al., 2020 | Retrospectivo | Cirugía de reconstrucción de
mama |
204 | 55 | 149 | Preinducción: 0,3 mcg/kg 15 min antes de la inducción
Inducción: 0,1 mcg/kg Mantenimiento: 0,1 mcg/kg/h |
Bolo: 0,1-0,7 mg/kg
Infusion: 0,1 mg/ kg/h Posoperatorio: 0,05 mg/kg/h |
| Chin et al., 2019 | Reporte de casos | Fusión espinal posterior | 2 | 1 | 1 | 0,2-0,4 mcg/kg/h | 0,5 mg/kg/h |
| Shah et al., 2020 | ECA | Mastectomía radical | 70 | 35 | 35 | Bolo: 1 mcg/kg durante 10 min Infusión: 0,6 mcg/kg/h | Preincisional: 0,5 mg/kg
Se administraron dos dosis más de ketamina (0,25 mg/ kg) a intervalos de 20 minutos |
| Smith et al., 2020 | Prospectivo
Retrospectivo |
Cirugía urológica mayor | 332 | 166 | 166 | Infusión: 0,5 mcg/kg/h
2 h después reduccion a 0,25 mcg/kg/h |
0,3 mg/kg |
| Kruthiventi et al., 2020 | Retrospectivo | Cirugia bariatrica laparoscopica | 487 | 174 | 313 | Bolo: 80 mcg inicial por 5-10 min Infusión: 0,7 mcg/kg/h | No reportado |
| Ibrahem et al., 2020 | ECA | Cirugía endoscópica senos paranasales | 94 | 47 | 47 | Bolo: 0,5 mcg/kg | 0,5 mg/kg |
| Bhardwaj et al., 2019 | ECA | Procedimientos urológicos laparoscópicos | 80 | 40 | 40 | Bolo: 0,5 mcg/kg por 10 min
Infusión: 0,1-0,3 mcg/kg/h |
0,5 mg/kg |
| Audenet et al., 2019 | Prospectivo | Cistectomía radical asistida por robot | 93 | 52 | 41 | Bolo: 1 mcg/kg por 20 min Infusión: 0,4 mcg/kg/h | Bolo: 0,5 mg/kg Infusión: 5-10 mcg/ kg/min
Dosis total: 150 mg |
ECA = ensayo clínico aleatorizado; NA = no aplica; % = incidencia.
4. Incidencia de agitación posoperatoria
Solo en un estudio, realizado por Zhang, et al., (n = 120) se reportó la incidencia de disforia en el período posoperatorio,
siendo mayor en el grupo de la intervención, sin embargo, no fue estadísticamente significativo (6,7% vs 1,7%, p = 0,182) [14].
Tabla 2. Desenlace: Dolor posoperatorio
| Estudio | EVA grupo intervención | EVA grupo control | Valor P | Consumo de equivalentes de morfina grupo intervención | Consumo de equivalentes de morfina grupo control | Valor p |
| Ziemann-Gimmel et al. | 4 | 4 | p = 0,66 | 10,4 | 11,45 | p = 0,40 |
| Zhang et al. | 3 | 4 | p < 0,001 | 16,4 | 23,9 | p < 0,050 |
| Lodhi et al. | EVA fue significativamente menor en el grupo D + K que en el grupo D + F a las 4 y 6 h POP | P < 0,001 | No hubo diferencias en el consumo de opioide POP | |||
| Zorrilla-Vaca et al. | No hubo diferencia | P = 0,99 | 2,5 | 5 | p = 0,005 | |
| Berlier et al. | 3 | 3 | p = 0,583 | 0 | 2 | p < 0,001 |
| Menck et al. | (ninguno/leve/ moderado) 2 (6,67%)/25 (83,3%)/3 (10%) | (ninguno/leve/ moderado) 8 (26,7%)/20 (66,7%)/2 (6,67%) | p = 0,127 | 4 | 5 | p = 0,726 |
| Urvoy et al. | – | – | – | 0 | 3 | p = 0,008 |
| Estebe et al. | 2,.1 | – | – | 1,9 | – | – |
| Mulier et al. | 1,87 | 4,94 | p < 0,001 | 1,95 | 10,34 | p < 0,001 |
| Shah et al. | 1,7 | 1,7 | – | 0 | 8,49 | |
| Smith et al. | 0 | 4 | p < 0,0001 | 7,7 | 11,7 | p = 0,001 |
| Kruthiventi et al. | Dolor severo (EVA >7) 29,3% | Dolor severo (EVA > 7) 21,4% | p = 0,047 | 9,6 | 10 | 0,768 |
| Ibrahem et al. | 1 | 3 | p < 0,001 | 8,64 | 22,87 | p < 0,001 |
| Bhardwaj et al. | 5 | 5 | p = 0,487 | 6,36 | 22,5 | p < 0,001 |
| Audenet et al. | 1,1 | 1,97 | p = 0,097 | 2,5 | 44 | p < 0,001 |
Tabla 3. Desenlace: Incidencia de náuseas y vómito posoperatorio
| Estudio | Incidencia de NyV en grupo intervención | Incidencia NyV grupo control | Valor p |
| Ziemann-Gimmel et al. | 12 (20,0%) | 22 (37,3%) | p = 0,04 |
| Zhang et al. | 3 (5%) | 6 (10%) | p = 0,245 |
| Lodhi et al. | 1/40 | 3/40 | – |
| Zorrilla-Vaca et al. | 17/149 (11%) | 11/149 (7%) | p = 0,23 |
| Berlier et al. | 4% | 17% | p = 0,001 |
| Menck et al. | 2 (6,67%) | 0 | p = 0,492 |
| Urvoy et al. | 7 | 3 | p = 0,19 |
| Estebe et al. | 23 (7%) | – | – |
| Mulier et al. | 12,7 | 43,6 | p < 0,001 |
| Shah et al. | 0 | 6 | – |
| Smith et al. | 19 (11,5%) | 28 (16,9%) | p = 0,1565 |
| Kruthiventi et al. | 45 (25,9%) | 75 (24%) | p = 0,640 |
| Ibrahem et al. | 1 (2,12%) | 3 (6,38%) | p = 0,3 |
| Bhardwaj et al. | 2 (5%) | 10 (25%) | p = 1 |
-
Discusión
La literatura actual sobre el uso conjunto de ketamina y dexmedetomidina, a pesar de aún ser escasa, ha venido en crecimiento, gracias al mayor uso de esta mezcla por parte de los anestesiólogos en su práctica clínica habitual. En el presente estudio se evidenció una tendencia a la disminución de requerimiento de opioides en el posoperatorio, de la disminución de las puntuaciones en las escalas de dolor posoperatorio y en la incidencia de náuseas y vómito posoperatorio.
Lo anterior es concordante con estudios publicados, como el de Elsaeidy et al., en el cual se realizó una revisión sistemática y metaanálisis que incluyó 22 estudios para un total de 1.429 pacientes que comparaban el ketodex con ketofol (combinación de ketamina + propofol), en pacientes llevados a sedación. Dentro de los hallazgos se encontró que en el grupo de ketodex había menores puntuaciones en la escala de dolor en el posoperatorio, sin embargo, los tiempos de recuperación fueron mayores. Por otro lado, la agitación fué mayor en el grupo de ketofol con un OR 0,48 (95% CI, 0,24, 0,98; I 2 = 36%). Cabe resaltar que en este estudio evidenciaron una mayor incidencia de náuseas y vómito posoperatorio en el grupo de ketodex en comparación con el grupo de ketofol, lo cual no es concordante con los hallazgos de nuestro estudio, ésto podría explicarse en primer lugar, debido a que los autores resaltan el efecto antiemético del propofol como causante de este descenlace en el grupo de ketofol. Por otro lado, en nuestro estudio el grupo de intervención en la mayoría de los casos fue anestesia libre de opioides versus el grupo control que consistió en anestesia basada en opioides[8].
En nuestro estudio encontramos una disminución en las escalas de dolor y de requerimiento de opioides en el posoperatorio en el grupo del uso combinado de ketamina y dexme- detomidina en comparación con el grupo control. Ya es bien conocido el efecto analgésico de cada uno de los medicamentos por su acción en diferentes receptores en las vías de dolor a nivel periférico y central, por lo cual tienen un efecto sinérgico. En primer lugar, la dexmedetomidina actúa a nivel del locus ceruleus y en el asta dorsal de la médula espinal y la ketamina por su parte actúa como antagonista en los receptores NMDA a nivel del sistema nervioso central[8].
Por otro lado, se ha registrado un impacto de la mezcla de ketamina con dexmedetomidina en la respuesta inmunológica y al estrés en el período posoperatorio. Esto fue descrito por Gao et al., en su estudio en el cual incluyeron un total de 136 pacientes que fueron llevados a cirugía de resección de cáncer cervical bajo anestesia general y los aleatorizaron en 4 grupos (grupo control, grupo ketamina, grupo dexmedetomidina y grupo combinado). Encontraron que los pacientes que recibieron ketodex tenían menores niveles séricos de noradrenalina, epinefrina, cortisol, insulina y péptido c en comparación con el grupo control. Durante el posoperatorio, la medición de cito- quinas proinflamatorias séricas como SP, PGE2, P-EP, NO, IL-4, IL-5 y IL-10 fueron significativamente menores en el grupo de ketodex que en el grupo control, sin embargo, los niveles de IL- 2, TNF-a y IFN-y fueron más elevados en el grupo de ketodex. Los autores concluyeron que las dosis pequeñas de la combinación de éstos dos medicamentos puede reducir de forma efectiva la respuesta al estrés durante el despertar de la anestesia, además contribuye al manejo analgésico evidenciándose menor liberación de mediadores del dolor, y puede mejorar la respuesta inmunitaria[9].
En la presente revisión sistemática no se encontró ningún estudio que incluyera información sobre delirium en el posoperatorio. En un metaanálisis publicado por Strickley et al., que incluyeron 10 estudios en total para 1.024 pacientes, encontraron que la dexmedetomidina es más efectiva para reducir la incidencia de delirium asociado a ketamina en comparación con el midazolam[10]. Lo anterior brinda evidencia a favor de su uso en conjunto, por el mecanismo de acción de la dexmedetomidina, en la cual en diferentes estudios se ha evidenciado su impacto en la reducción de delirium en pacientes en cuidados intensivos y en población pediátrica[11].
Con respecto al escalofrío posoperatorio, dentro de los estudios incluídos en la revisión ninguno lo evaluó. En un ensayo clínico aleatorizado publicado por Sahraei et al., el cual incluyó 90 pacientes llevados a colecistectomía laparoscópica, los participantes fueron asignados a tres grupos: dexmedetomidina, ketamina y placebo. Encontraron que en el grupo de dexmedeto- midina no se presentó ningún caso de escalofrío posoperatorio y la frecuencia fue significativamente menor en comparación con el grupo de ketamina y el grupo control (p < 0,001)[12].
Se cree que la dexmedetomidina tiene un efecto anti-escalofríos por su acción a nivel central sobre el centro de termorregulación en el hipotálamo. Por tal motivo, disminuye el umbral de vasoconstricción y de escalofrío. Por otro lado, por su acción sobre el receptor a2 adrenérgico tiene un efecto sobre la vasoconstricción[12].
Este es una de las primeras revisiones sistemáticas en describir el impacto del uso conjunto de ketamina y dexmedetomidina en población adulta. Además, contamos con una muestra robusta de pacientes, lo que fortalece la validez de los resultados y permite obtener conclusiones significativas y aplicables en la práctica clínica. Este trabajo aporta una perspectiva novedosa y evidencia útil que contribuirá al desarrollo de mejores prácticas y protocolos en el manejo anestésico.
Dentro de las limitaciones, encontramos una gran heterogeneidad en los estudios incluidos tanto en la forma de administración, la dosis y el momento de administración de la dexmedetomidina y la ketamina. Asimismo hubo heterogeneidad en cuanto al tipo de procedimientos a los que fueron llevados los pacientes. Esto puede dificultar la comparación directa y las conclusiones de los resultados. Por otro lado, existió una limitación importante en cuanto a la disponibilidad y el acceso de la información, ya que hubo estudios en los que no se pudo acceder a la totalidad de los datos de los desenlaces a estudiar. Se presentó también limitación en cuanto a la búsqueda de literatura dado a que solo se incluyó 4 bases de datos y no se incluyó Google Scholar en la cual se puede encontrar literatura gris. Por último, dependemos de la calidad y la exhaustividad del reporte en los estudios originales; por tanto los datos incompletos o mal reportados pudieron haber limitado la capacidad de extraer conclusiones sólidas.
En conclusión, el uso conjunto de la dexmedetomidina y ketamina en pacientes llevados a cirugía bajo anestesia general, se asocian a disminución en las escalas de intensidad de dolor, a la reducción del requerimiento de opioides y a la incidencia de náuseas y vómito posoperatorio. Faltan más estudios para poder tener conclusiones más sólidas que soporten su uso.
-
Referencias
1. López-Millán J. M1, Sánchez-Blanco, C2.Current use of ketamine for the treatment of acute and chronic pain. Rev. Soc. Esp. Dolor vol.14 no.1 Madrid ene. 2007
2. Keating GM. Dexmedetomidine: A Review of Its Use for Sedation in the Intensive Care Setting. Drugs. 2015 Jul;75(10):1119–30. https://doi.org/10.1007/s40265-015-0419-5 PMID:26063213
3. Ykeizumi LC, Correia da Silva R, Villar e Silva G. Combined Dexmedetomidine and Ketamine in Pediatric Anesthesia: A Brief Review. Anesth Pain Res. 2021; 5 (1): 1-8. Correspondence: Lilian Satie Ykeizumi MD. Anesthesiology Clinic, Marcílio Dias Naval Hospital, Brazilian Navy, Rio de Janeiro, Brazil. Received. 2021;(Jan):10.
4. Liaquat Z, Xu X, Zilundu PL, Fu R, Zhou L. The current role of dexmedetomidine as neuroprotective agent: an updated review. Brain Sci. 2021 Jun;11(7):846. https://doi.org/10.3390/brainsci11070846 PMID:34202110
5. Hou M, Chen F, He Y, Tan Z, Han X, Shi Y, et al. Dexmedetomidine against intestinal ischemia/reperfusion injury: A systematic review and meta-analysis of preclinical studies. Eur J Pharmacol. 2023 Nov;959:176090. https://doi.org/10.1016/j.ejphar.2023.176090 PMID:37778612
6. Takahashi K, Yoshikawa Y, Kanda M, Hirata N, Yamakage M. Dexmedetomidine as a cardioprotective drug: a narrative review. J Anesth. 2023 Dec;37(6):961–70. https://doi.org/10.1007/s00540-023-03261-w PMID:37750978
7. Rayyan – AI Powered Tool for Systematic Literature Reviews [Internet]. 2021 [citado 12 de marzo de 2023]. Disponible en: https://www.rayyan.ai/
8. Elsaeidy AS, Ahmad AH, Kohaf NA, Aboutaleb A, Kumar D, Elsaeidy KS, et al. Efficacy and Safety of Ketamine-Dexmedetomidine Versus Ketamine-Propofol Combination for Periprocedural Sedation: A Systematic Review and Meta-analysis. Curr Pain Headache Rep. 2024 Apr;28(4):211–27. https://doi.org/10.1007/s11916-023-01208-0 PMID:38214834
9. Gao JW, Lin MY, Zou QF, Huang JL, Cheng MX. Effect of small-dose ketamine combined with dexmedetomidine on emergence stress response as well as postoperative pain and Th cell deviation in patients with cervical cancer surgery under general anesthesian. Hainan Yixueyuan Xuebao. 2017;23(8):75–9.
10. Strickley T, Smith K, Ericksen AM. Dexmedetomidine – An Alternative to Midazolam in the Treatment of Ketamine-Induced Emergence Delirium: A Systematic Review. J Perianesth Nurs. 2024 Apr;39(2):311–8. https://doi.org/10.1016/j.jopan.2023.08.003 PMID:37943188
11. Duarte-Medrano G. Dexmedetomidina, tendencias y actuales aplicaciones. Revista Chilena de Anestesia. 2022;51(3):265–72.
12. Sahraei R, Ghaedi M, Haghbeen M, Jahromi MS. Comparison Of Ketamine And Dexmedetomidine In Reducing Complications After Laparoscopic Cholecystectomy Surgery. Int J Med Investig. 2023 Jul;12(2):154–64.
13. Ziemann-Gimmel P, Goldfarb AA, Koppman J, Marema RT. Opioid-free total intravenous anaesthesia reduces postoperative nausea and vomiting in bariatric surgery beyond triple prophylaxis. Br J Anaesth. 2014 May;112(5):906–11. https://doi.org/10.1093/bja/aet551 PMID:24554545
14. Zhang Z, Zhang WH, Lu YX, Lu BX, Wang YB, Cui LY, et al. Intraoperative Low-Dose S-Ketamine Reduces Depressive Symptoms in Patients with Crohn’s Disease Undergoing Bowel Resection: A Randomized Controlled Trial. J Clin Med. 2023 Feb;12(3):1152. https://doi.org/10.3390/jcm12031152 PMID:36769799
15. Lodhi M, Sulakshana S, Singh AP, Gupta BK. A comparative study of clinical effects and recovery characteristics of intraoperative dexmedetomidine infusion with ketamine versus fentanyl as adjuvants in general anaesthesia. Indian J Anaesth. 2023 Feb;67 Suppl 2:S126–32. https://doi.org/10.4103/ija.ija_294_22 PMID:37122940
16. Zorrilla-Vaca A, Ramirez PT, Iniesta-Donate M, Lasala JD, Wang XS, Williams LA, Meyer L, Mena GE. Opioid-sparing anesthesia and patient-reported outcomes after open gynecologic surgery: a historical cohort study. Canadian Journal of Anesthesia/Journal canadien d’anesthésie. 2022 Dec;69(12):1477-92. https://doi.org/10.1007/s12630-022-02336-8.
17. Berlier J, Carabalona JF, Tête H, Bouffard Y, Le-Goff MC, Cerro V, et al. Effects of opioid-free anesthesia on postoperative morphine consumption after bariatric surgery. J Clin Anesth. 2022 Oct;81:110906. https://doi.org/10.1016/j.jclinane.2022.110906 PMID:35716634
18. Menck JT, Tenório SB, de Oliveira RM, Strobel R, dos Santos BB, Junior AF, de Cesaro MP. Opioid-free Anesthesia for Laparoscopic Gastroplasty. A Prospective and Randomized Trial. The Open Anesthesia Journal. 2022 Sep 30;16(1).
19. Dey S, Kohli JK, Magoon R. ItiShri I, Kashav RC. Feasibility of opioid-free anesthesia for cervical rib excision: A case series and review of literature. Journal of Cardiac Critical Care TSS. 2021 Dec;5(03):208–13.
20. Urvoy B, Aveline C, Belot N, Catier C, Beloeil H. Opioid-free anaesthesia for anterior total hip replacement under general anaesthesia: the Observational Prospective Study of Opiate-free Anesthesia for Anterior Total Hip Replacement trial. Br J Anaesth. 2021 Apr;126(4):e136–9. https://doi.org/10.1016/j.bja.2021.01.001 PMID:33549323
21. Estebe JP, Morel M, Daouphars T, Ardant E, Rousseau C, Drouet A, et al. Lessons from the analysis of a retrospective cohort of patients who underwent large open abdominal surgery under total intravenous opioid-free anesthesia. Drugs Real World Outcomes. 2021 Mar;8(1):85–93. https://doi.org/10.1007/s40801-020-00218-3 PMID:33231842
22. Mulier H, De Frene B, Benmeridja L, Vanhoorebeeck F, Denis B, Casaer B, et al. Impact of opioid-free anesthesia on complications after deep inferior epigastric perforator flap surgery: A retrospective cohort study. J Plast Reconstr Aesthet Surg. 2021 Mar;74(3):504–11. https://doi.org/10.1016/j.bjps.2020.09.004 PMID:33268289
23. Chin KJ, Dinsmore MJ, Lewis S, Chan V. Opioid-sparing multimodal analgesia with bilateral bi-level erector spinae plane blocks in scoliosis surgery: a case report of two patients. Eur Spine J. 2020 Dec;29(S2 Suppl 2):138–44. https://doi.org/10.1007/s00586-019-06133-8 PMID:31482311
24. Shah SB, Chawla R, Pahade A, Mittal A, Bhargava AK, Kumar R. Comparison of pectoralis plane blocks with ketamine-dexmedetomidine adjuncts and opioid-based general anaesthesia in patients undergoing modified radical mastectomy. Indian J Anaesth. 2020 Dec;64(12):1038–46. https://doi.org/10.4103/ija.IJA_8_20 PMID:33542567
25. Smith SA, Ghabra H, Dhaifallah DG, Rahnema A, Evans BM, Nossaman BD, et al. Novel Opiate-Free Anesthetic Technique for Major Urologic Procedures. South Med J. 2020 Oct;113(10):499–504. https://doi.org/10.14423/SMJ.0000000000001159 PMID:33005965
26. Kruthiventi SC, Hofer RE, Warner ME, Sprung J, Kellogg TA, Weingarten TN. Postoperative nausea and vomiting after bariatric surgery and dexmedetomidine anesthetic: a propensity-weighted analysis. Surg Obes Relat Dis. 2020 Apr;16(4):545–53. https://doi.org/10.1016/j.soard.2020.01.007 PMID:32063491
27. Ibrahem Amin OA, Kamel AA. Effects of adding ketamine to dexmedetomidine on smooth recovery from isoflurane anesthesia in adults undergoing endoscopic sinus surgery. Egypt J Anaesth. 2020 Jan;36(1):50–5. https://doi.org/10.1080/11101849.2020.1761144.
28. Bhardwaj S, Garg K, Devgan S. Comparison of opioid-based and opioid-free TIVA for laparoscopic urological procedures in obese patients. J Anaesthesiol Clin Pharmacol. 2019;35(4):481–6. https://doi.org/10.4103/joacp.JOACP_382_18 PMID:31920231
29. Audenet F, Attalla K, Giordano M, Pfail J, Lubin MA, Waingankar N, Gainsburg D, Badani KK, Sim A, Sfakianos JP. Prospective implementation of a nonopioid protocol for patients undergoing robot-assisted radical cystectomy with extracorporeal urinary diversion. InUrologic Oncology: Seminars and Original Investigations 2019 May 1 (Vol. 37, No. 5, pp. 300-e17). Elsevier. https://doi.org/10.1016/j.urolonc.2019.02.002.
Anexo 1. Clasificación riesgo de sesgos con RoB2.0
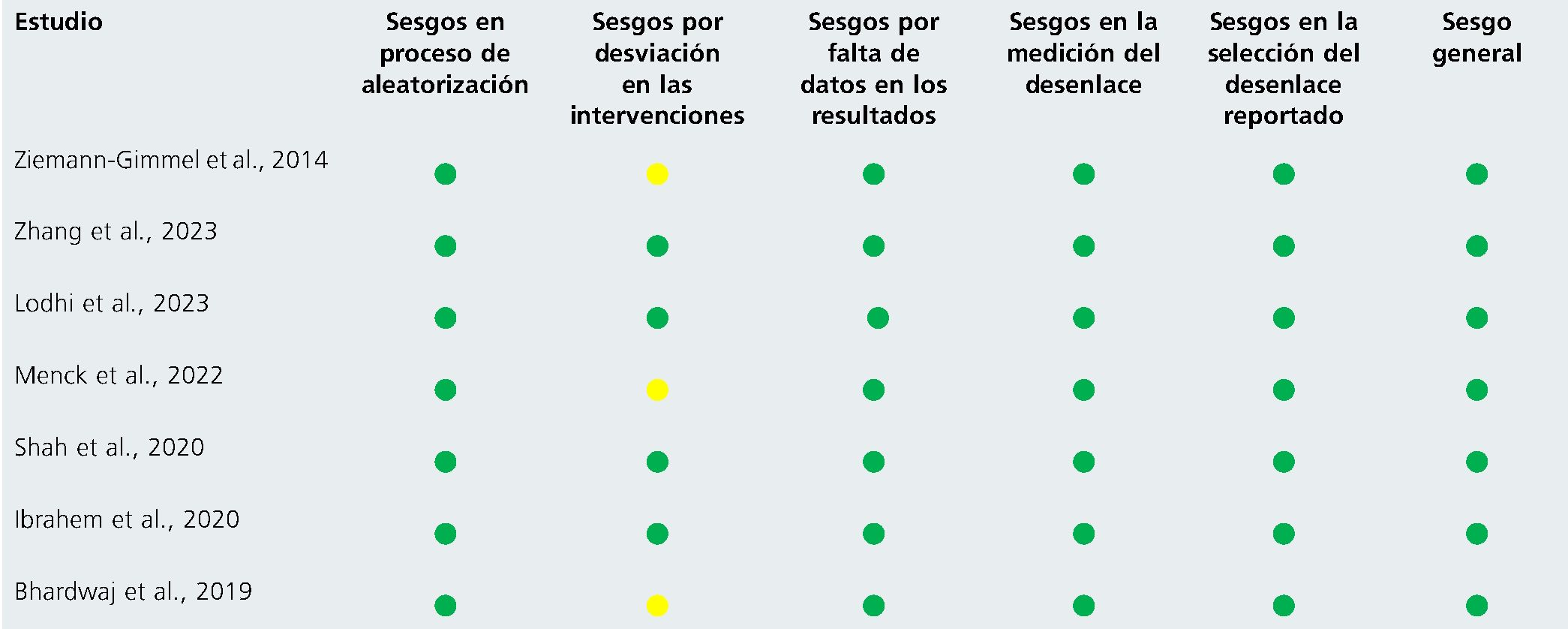
Anexo 2. Clasificación riesgo de sesgos con ROBINS-I (Risk of Bias in Non-randomized Studies of Interventions)


 ORCID
ORCID