María Alcañiz Muro1, Mario Del Cura Citoler1, Pablo Arco de la Torre1, Marta Sanjuán Fernández1, Cristina Lorente Álava1, Ana Fernández Martínez1
Recibido: 10-04-2025
Aceptado: 25-05-2025
©2026 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 55 Núm. 1 pp. 119-122|https://doi.org/10.25237/revchilanestv55n1-17
PDF|ePub|RIS
Anesthetic management of a patient with a defect in short-chain fatty acid p-oxidation: Case report
Abstract
Inborn errors of metabolism of fatty acids p-oxidation due to acetyl-CoA dehydrogenase deficiency constitute a group of rare diseases with a higher incidence in Caucasians and an estimated prevalence in Spain of one in every 35,000 live births. With the development of protocols for detecting enzyme deficiencies in newborns, this condition has been diagnosed more frequently in recent years, but despite this, clinical suspicion is important and necessary. It typically presents with a wide range of symptoms, from hypoketotic hypoglycemia to encephalopathy, coma and even premature death. At anesthetic level, these diseases pose important implications for fasting periods and the use of drugs such as propofol or neuromuscular blockers, so it is important to understand their pathophysiology.
Resumen
Los errores innatos del metabolismo de la p-oxidación de ácidos grasos por déficit de acetil-CoA deshidrogenasa constituyen un grupo de enfermedades raras con mayor incidencia en personas de raza caucásica y una prevalencia estimada en España de uno por cada 35.000 recién nacidos vivos. Con el desarrollo de protocolos para detecciones de déficits enzimáticos en el neonato, esta patología está siendo diagnosticada más frecuentemente en los últimos años, pero a pesar de ello, es importante y necesaria una sospecha clínica. Suele cursar con una sintomatologia muy diversa que va desde una hipoglucemia hipocetósica a estados de encefalopatía, coma e incluso la muerte prematura. A nivel anestésico, estas enfermedades plantean importantes implicaciones respecto a los períodos de ayuno y el uso de fármacos como el propofol o los relajantes neuromusculares por lo que es importante conocer su fisiopatología.
-
Introducción
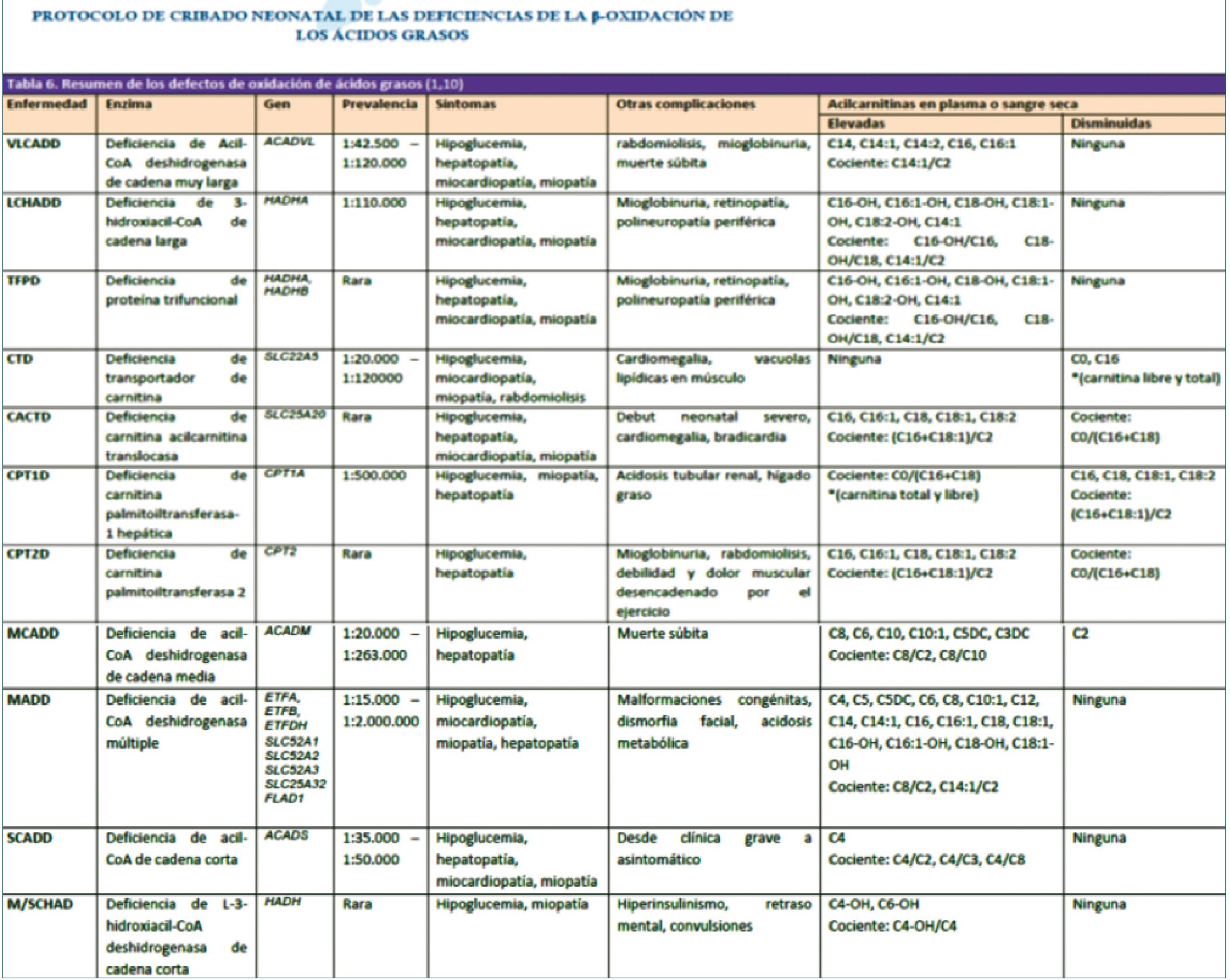
La p-oxidación es el proceso por el que los ácidos grasos son metabolizados a acetil-CoA, el cual entra en el ciclo de Krebs para producir ATP o bien servir de sustrato para la gluconeogénesis. Además, el acetil-CoA producido se convierte en cuerpos cetónicos en el hígado que son transportados a tejidos incapaces de realizar la beta-oxidación. Todo este proceso es muy importante cuando la reserva de carbohidratos está limitada, como ocurre en los períodos de ayuno[1],[2]. El defecto en la p-oxidación de ácidos grasos por déficit de acetil-CoA deshidrogenasa se encuentra englobado dentro del grupo de errores congénitos del metabolismo, es de herencia autosómica recesiva y tiene una prevalencia estimada en España de uno por cada 35.000 recién nacidos vivos[3] (Figura 1). Su incidencia es mayor en personas de raza caucásica y conlleva una situación de descompensación metabólica por acumulación de metabolitos tóxicos que puede desencadenar una sintomatología muy diversa que va desde estados de hipoglucemia hipocetósica, hipotonía, letargo, hepatopatías y cardiopatías hasta síntomas más graves como disfunciones hepáticas agudas, convulsiones, encefalopatía, coma e incluso la muerte prematura. La anestesia en estos pacientes supone un reto, especialmente en lo concerniente a los períodos de ayuno, el estrés quirúrgico y el uso de determinados fármacos como los hipnóticos o los relajantes musculares, de ahí la importancia de conocer su fisiopa- tología[4].
Figura 1.
-
Descripción
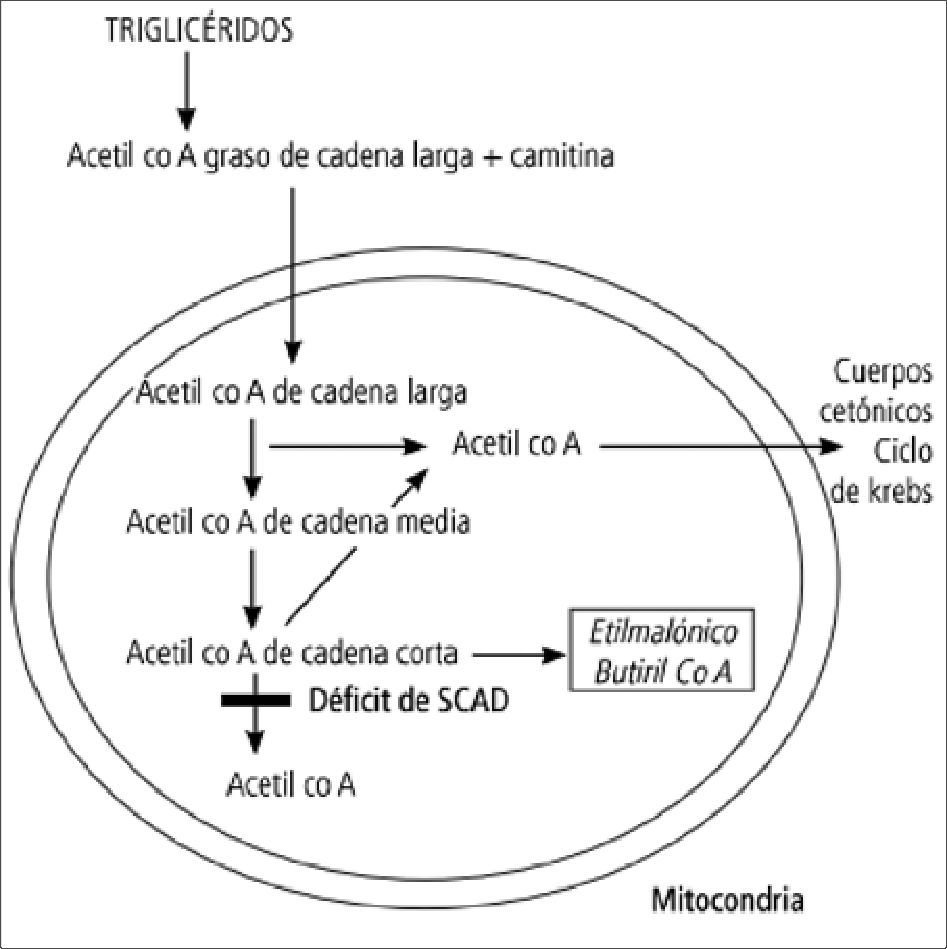
Presentamos el caso de un varón de 8 años y 20 kilos (kg) intervenido de urgencia de apendicectomía laparoscópica. Sin alergias medicamentosas conocidas, como único antecedente personal destaca un defecto en la p-oxidación de los ácidos grasos de cadena corta por déficit de la enzima acetil-coA deshidrogenasa de cadena corta (SCAD) (Figura 2) en seguimiento por la unidad de trastornos metabólicos de Pediatría. La única clínica que presentaba eran episodios puntuales de hipogluce- mia matutina tras el ayuno resueltos con el inicio de la ingesta, no había clínica neurológica ni debilidad muscular. La exploración prequirúrgica de la vía aérea fue normal (Mallampati I, distancia tiromentoniana superior a 3 centímetros, test de mordida 1 y buena apertura bucal y flexoextensión cervical), así como el cumplimiento de ayuno preoperatorio puesto que habían transcurrido 12 h desde la última ingesta.
Ya en el quirófano, se administró midazolam 1 miligramo (mg) endovenoso para reducir el estrés y favorecer la ansiolisis, se realizó una inducción inhalatoria con sevoflurano al 4% para evitar la administración de propofol, junto con fentanilo 60 microgramos (mcg) y rocuronio 25 mg y se intubó sin incidencias con un tubo endotraqueal con balón de baja presión
del número 6. Para la antiemésis se usó dexametasona 4 mg al inicio y ondansetrón 2 mg previo a finalizar y de analgesia se administraron paracetamol 300 mg e ibuprofeno 200 mg. Como fluidoterapia de mantenimiento se usó suero glucosado al 10% a 100 mililitros/h (ml/h) a razón de 8 mg/kg/min, se midió la glucemia en dos ocasiones con valores de 151 y 172 mg/dL respectivamente y el paciente se mantuvo normotérmico durante la intervención. Para la educción, se revirtió el bloqueo neuromuscular con 40 mg de sugammadex y se extubó sin incidencias (se comprobó previamente con el tren de cuatro la ausencia de bloqueo residual con 100% en las respuestas)[5].
En el período posoperatorio, se inició tolerancia oral a líquidos pasadas 6 h de la intervención con buena respuesta, por lo que se pudo avanzar hacia su dieta habitual normal. Fue dado de alta a su domicilio a las 48 h.
Figura 2. Mecanismos de acción de la resucitación lipídica.
-
Discusión
El manejo perioperatorio de estos pacientes supone un reto anestésico debido principalmente a los requerimientos de ayuno, el estrés quirúrgico y los efectos de determinados agentes anestésicos sobre el metabolismo mitocondrial[6].
Se aconseja que el período de ayuno sea lo más corto posible con el fin de evitar la producción de metabolitos tóxicos como el ácido etilmalónico, el metilsuccinil CoA y la butirilcarnitina que provocan la aciduria característica de esta patología. La fluidoterapia de mantenimiento se debe llevar a cabo con suero glucosado al 10% a razón de 7-10 mg/kg/min durante todo el perioperatorio[7] para mantener una buena hidratación y, en caso de intervenirse de forma programada, hacerlo el primero para no prolongar el tiempo de ayuno.
El déficit de acetil-CoA deshidrogenasa produce un aumento de la acilcarnitina encargada de la inhibición de la absorción renal de carnitina, lo que produce de forma secundaria un déficit de carnitina. Pese a ello, el uso preoperatorio de carnitina no
está recomendado en estos casos de problemas en su transporte o transformación (únicamente cuando el déficit de carnitina es primario)[8].
A nivel farmacológico, el uso del propofol está desaconsejado en estos pacientes por su formulación lipídica y su capacidad para inhibir la función mitocondrial que puede provocar el acúmulo de metabolitos. Si bien es cierto que hay más riesgo en aquellos casos que usan perfusiones a altas dosis con posibilidad de desarrollar un síndrome por infusión de propofol respecto a bajas dosis (2-4 mg/kg), no se recomienda su uso de forma rutinaria en estos pacientes[9]. Respecto a los agentes halogenados, como el sevoflurano, alteran el metabolismo mitocondrial de múltiples maneras y, pese a que no existe unanimidad en la literatura actual, su uso en estos pacientes no se ha contraindicado[10]. En cuanto a los relajantes musculares, se debe evitar el uso de succinilcolina por su potencial efecto miopático y riesgo de desarrollo de hipertermia maligna y respecto a los no despolarizantes, pueden tener aumentada la sensibilidad por lo que, en caso de usarlos, debe ser con prudencia y con monitorización neuromuscular[11]. El uso de antieméticos y opioides en estos pacientes se ha descrito como seguro, a excepción de la morfina, que sí se ha visto que tiene algún efecto sobre la membrana mitocondrial, pero con escasa importancia clínica[12]. Se debe favorecer la anestesia regional siempre que sea posible y realizar una monitorización estricta de los niveles de glucosa durante el perioperatorio[13].
-
Conclusiones
La elección de los fármacos anestésicos más seguros para pacientes con defectos en la p-oxidación de los ácidos grasos supone un reto para el anestesiólogo, dado que la mayoría de los anestésicos generales tienen múltiples efectos sobre las mitocondrias, el metabolismo de los ácidos grasos y los músculos estriados. Nuestro enfoque, con una combinación de sevoflurano inhalado, fentanilo y rocuronio con monitorización neuromuscular demostró ser seguro para esta cirugía urgente y sin efectos adversos. Se debe poner especial énfasis en una adecuada hidratación, monitorización de la glucosa y mantener un correcto estado metabólico del paciente. Siempre que sea posible, es recomendable realizar técnicas locorregionales. Dado que no existen pautas claras en la forma de anestesiar a estos pacientes, se recomienda que cada caso sea valorado de forma individual según sus riesgos y beneficios y la clínica que presente el paciente[14],[15]. Se espera que en los próximos años continuemos encontrándonos con un mayor número de pacientes con esta patología gracias a los programas de cribado neonatales, por ello es aconsejable seguir las recomendaciones descritas previamente para evitar complicaciones relacionadas con la anestesia en estos pacientes resultado de su déficit enzimático.
-
Referencias
1. Turpin B, Tobias JD. Perioperative management of a child with short-chain acyl-CoA dehydrogenase deficiency. Paediatr Anaesth. 2005 Sep;15(9):771–7. https://doi.org/10.1111/j.1460-9592.2005.01507.x PMID:16101709
2. Ames WA, de la Roza KJ, Hanson NA. Perioperative management of a pediatric patient with short-chain acyl-CoA dehydrogenase deficiency. J Clin Anesth. 2012 Jun;24(4):349. https://doi.org/10.1016/j.jclinane.2011.06.023 PMID:22608595
3. Protocolo de cribado neonatal de las deficiencias en la b-oxidación d ellos ácidos grasos. Grupo de trabajo de cribado neonatal. Ponencia de cribado Poblacional febrero 2023. Ministerio de Sanidad. Gobierno de España
4. Kloesel B, Holzman RS. Anesthetic management of patients with inborn errors of metabolism. Anesth Analg. 2017 Sep;125(3):822–36. https://doi.org/10.1213/ANE.0000000000001689 PMID:27984225
5. Kraus J, Oreadi D, Shastri K, Rosenberg M. Perioperative management of a patient with short chain acyl-CoA dehydrogenase deficiency: a case report. J Oral Maxillofac Surg. 2008 Oct;66(10):2164–5. https://doi.org/10.1016/j.joms.2008.04.007 PMID:18848120
6. Owaki-Nakano R, Higashi M, Iwashita K, Shigematsu K, Toyama E, Yamaura K. Anesthetic management of multiple acyl-coenzyme A dehydrogenase deficiency in a series of surgeries under general anesthesia: a case report. JA Clin Rep. 2021 Jul;7(1):54. https://doi.org/10.1186/s40981-021-00459-3 PMID:34245397
7. Jethva R, Bennett MJ, Vockley J. Short-chain acyl-coenzyme A dehydrogenase deficiency. Mol Genet Metab. 2008 Dec;95(4):195–200. https://doi.org/10.1016/j.ymgme.2008.09.007 PMID:18977676
8. Ho Kyung Yu. Seong-Ho Ok, Sunmin Kim, Ju-Tae Sohn. Anesthetic management of patients with carnitine deficiency or a defect of the fatty acid b-oxidation pathway: A narrative review. Medicine (Baltimore). 2022 Feb;101(7):e28853. https://doi.org/10.1097/MD.0000000000028853 PMID:35363184
9. Urban T, Waldauf P, Krajčová A, Jiroutková K, Halačová M, Džupa V, et al. Kinetic characteristics of propofol-induced inhibition of electron-transfer chain and fatty acid oxidation in human and rodent skeletal and cardiac muscles. Bai Y, editor. PLOS ONE [Internet]. 2019 Oct 4;14(10):e0217254. Available from: http://dx.doi.org/10.1371/journal.pone.0217254
10. Veyckemans F. Can inhalation agents be used in the presence of a child with myopathy? Curr Opin Anaesthesiol. 2010 Jun;23(3):348–55. https://doi.org/10.1097/ACO.0b013e3283393977 PMID:20421788
11. Rosenberg H, Pollock N, Schiemann A, Bulger T, Stowell K. Malignant hyperthermia: a review. Orphanet J Rare Dis. 2015 Aug;10(1):93. https://doi.org/10.1186/s13023-015-0310-1 PMID:26238698
12. Rafique MB, Cameron SD, Khan Q, Biliciler S, Zubair S. Anesthesia for children with mitochondrial disorders: a national survey and review. J Anesth. 2013 Apr;27(2):186–91. https://doi.org/10.1007/s00540-012-1488-1 PMID:23007905
13. Hidekazu I, Shoji M. Successful perioperative management of a pediatric patient with medium-chain acyl-CoA dehydrogenase deficiency using a continuous tissue glucose monitoring device: A case report. Saudi J Anaesth. 2021;15(2):213–5. https://doi.org/10.4103/sja.sja_1041_20 PMID:34188645
14. Puthenveetil N, Joseph N, Kottarathil VD, Paul J. Anaesthetic Management of a Patient with Multiple Acetyl CoA Dehydrogenase Deficiency: A Case Report. Turk J Anaesthesiol Reanim. 2022 Jun;50(3):235–7. https://doi.org/10.5152/TJAR.2021.816 PMID:35801333
15. Lilitsis E, Astyrakaki E, Blevrakis E, Xenaki S, Chalkiadakis G, Chrysos E. Anesthetic management of a pediatric patient with Electron Transfer Flavoprotein Dehydrogenase deficiency (ETFDH) and acute appendicitis: case report and review of the literature. BMC Anesthesiol. 2017 Aug;17(1):116. https://doi.org/10.1186/s12871-017-0400-9 PMID:28851284

 ORCID
ORCID