David Giraldo-Gutiérrez 1 , Crystian Borrero-Cortés 2 , Bibiana Escobar-Suárez 1 , José Navarro Vargas 3
Recibido: 07-10-2018
Aceptado: 12-12-2018
©2019 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 48 Núm. 3 pp. 214-222|https://doi.org/10.25237/revchilanestv48n03.04
PDF|ePub|RIS
Anemia in the oncological patient: a challenge in perioperative medicine
Abstract
Introduction: Perioperative anemia in patients with cancer is frequent and is associated with potential adverse outcomes. In association studies it was established that anemia changes the prognosis in some cases, being associated with a possible increase in the risk of disease progression and death. On the other hand, it has been proposed that immunomodulation secondary to transfusions favors metastasis and the disease`s recurrence. Objective: To describe the current evidence on anemia, transfusions and other perioperative strategies for the management of patients with anemia and cancer taken to surgery. Materials and Methods: A non-systematic review of the literature that included articles on the perioperative management of anemic patients candidates for oncological surgery was performed. The main findings are described and the evidence is presented in favor of and against some strategies (other than red blood cell transfusion) to correct anemia. Conclusion: Optimization of the erythrocyte mass before surgery and the use of blood-sparing strategies should be considered in a comprehensive perioperative management.
Resumen
Introducción: La anemia perioperatoria en el paciente con cáncer es frecuente y se asocia a potenciales desenlaces adversos. En estudios de asociación se estableció que la anemia cambia el pronóstico en algunos casos, asociándose a un posible incremento del riesgo de progresión de la enfermedad y muerte. Por otra parte, se ha propuesto que la inmunomodulación secundaria a las transfusiones, favorece las metástasis y la recidiva de la enfermedad. Objetivo: Describir la evidencia actual sobre la anemia, las transfusiones y otras estrategias perioperatorias para el manejo de los pacientes con anemia y cáncer llevados a cirugía. Materiales y Métodos: Se realizó una revisión no sistemática de la literatura que incluyó artículos sobre el manejo perioperatorio de pacientes anémicos candidatos a cirugía oncológica. Se describen los principales hallazgos y se presenta la evidencia a favor y en contra de algunas estrategias (diferentes a la transfusión de glóbulos rojos) para corregir la anemia. Conclusión: La optimización de la masa eritrocitaria antes de la cirugía y el uso de estrategias ahorradoras de sangre deben ser consideradas en un manejo perioperatorio integral.
-
Introducción
Entre el 30 y el 90% de los pacientes con cáncer presentan anemia[1],[2]. La progresión del tumor, su tratamiento y las comorbilidades pueden ser los causantes de ésta condición[3 ]. Existe evidencia experimental que asocia una baja masa eritrocitaria con la proliferación de células tumorales[4 ]. Por otra parte, el paciente oncológico presenta mayor riesgo de sangrado y coagulopatía en relación a los factores relacionados con la biología del tumor, las medidas terapéuticas, los aspectos anatómicos de la resección y otros factores como la hipotermia inadvertida. Por otra parte, una de las consecuencias infortunadas de la transfusión es la inmunosupresión posiblemente asociada a un impacto negativo en la progresión de la enfermedad[5 ].
-
Aspectos clínicos
La anemia del paciente oncológico es multifactorial[6], depende del componente inflamatorio, la infiltración medular, las pérdidas hemáticas crónicas o agudas, el estadio de la enfermedad y el tratamiento administrado[3],[7],[8]. La activación de la inmunidad celular altera la homeostasis del hierro a través del incremento de la hepcidina, la disminución de la producción y acción de la eritropoyetina (EPO), la reducción de la eritropoyesis y el acortamiento del tiempo de vida de los eritrocitos. Esto se sobrepone ocasionalmente a los efectos secundarios de la quimioterapia y radioterapia, y a carencias nutricionales[3],[9]. La prevalencia de la anemia varía según el tipo de tumor y el estadio de la enfermedad, reportándose las prevalencias más altas en cáncer colorrectal (70-80%), mama (41-82%), ovario (26-85%) y cérvix/útero (67-82%)[2],[10].
-
Diagnóstico
La posibilidad de anemia debe evaluarse en los pacientes con sangrado quirúrgico estimado superior a 500 ml[11 ]. La tamización preoperatoria debe basarse en los síntomas del paciente, la edad, las comorbilidades y el tipo de cirugía[12 ]. Siempre debe determinarse la etiología y realizar el diagnóstico con la mayor anticipación posible. Muñoz y cols., propusieron un modelo pragmático en cáncer colorrectal que sirve de guía para el diagnóstico de la anemia, sin embargo, el abordaje debe realizarse de forma individualizada y multidisciplinaria[13] (Figura 1).
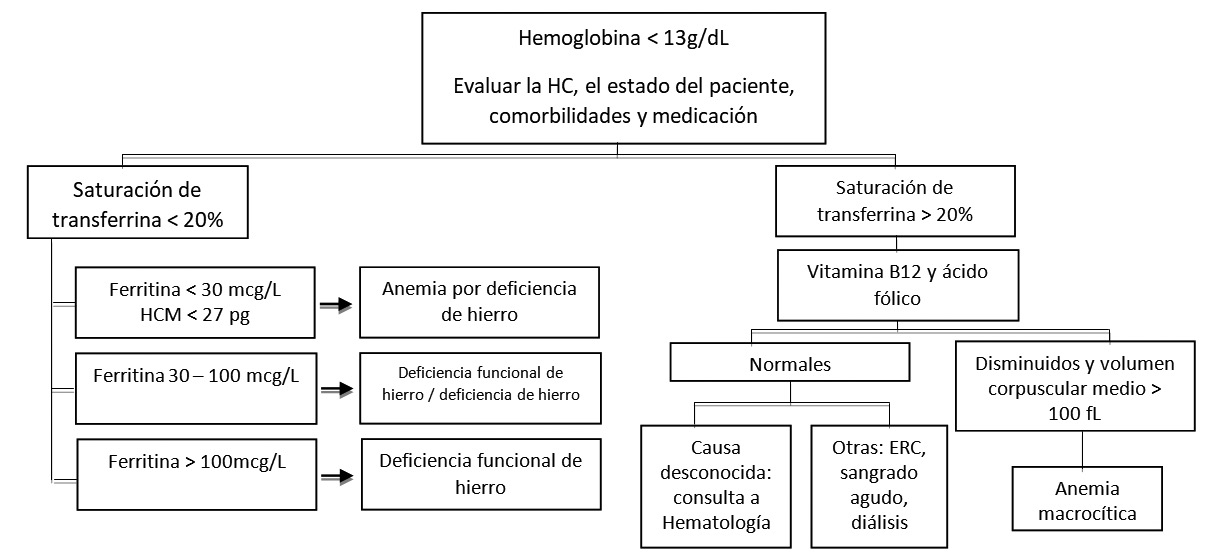
Figura 1. Algoritmo. Fuente: Muñoz M, Gómez-Ramírez S, Martín-Montañez E, Auerbach M. Perioperative anemia management in colorectal cancer patients: A pragmatic approach.
Ante la sospecha de anemia deben solicitarse hemograma, mediciones de hierro sérico, ferritina y saturación de transferrina (TSAT). Estos parámetros determinan la etiología de la anemia y orientan el manejo perioperatorio. Para el diagnóstico de anemia ferropénica no es apropiado confiar en la presencia de microcitosis[3],[13]. La TSAT es importante en la tipificación de la anemia debido a que el valor aislado de ferritina puede verse afectado directamente por la inflamación al ser esta un reactante de fase aguda. En caso de no contar con TSAT, la ferritina deberá interpretarse en el contexto de los niveles de PCR[3 ].
La ferritina y la TSAT se utilizan para evaluar el estado actual de las reservas y movilización del hierro. La ferritina refleja los depósitos (1 ng/ml de ferritina = 8 mg de hierro en depósitos) y valores inferiores 30 mcg/L indican deficiencia de hierro (siempre que el paciente no esté en un contexto inflamatorio); mientras que la TSAT indica la disponibilidad de hierro para la eritropoyesis. Valores inferiores a 20% reflejan una baja disponibilidad. En caso de PCR > 5 mg/L y TSAT < 20%, una ferritina < 100 mcg/L sugiere la presencia de ferropenia[11 ].
Por el contrario, si la TSAT es < 20% (lo cual indica pobre movilización de hierro) con una ferritina > 100 mcg/L, el diagnóstico dependerá del nivel de PCR:
• PCR > 5 mg/L: anemia de enfermedad crónica (secuestro de hierro).
• PCR < 5 mg/L: deficiencia funcional de hierro.
Diferenciar estas dos condiciones es relevante para establecer el tratamiento. Mientras que para la deficiencia funcional podría considerarse el uso de hierro, para el manejo del secuestro, lo indicado es considerar el uso de eritropoyetina.
Cuando no se encuentran hallazgos positivos de ferropenia o déficit funcional de hierro como causa de la anemia, se sugiere solicitar estudios complementarios para descartar otras etiologías (creatinina, nitrógeno ureico, lactato deshidrogenasa, vitamina B12, ácido fólico, etc.[12],[13],[14].
-
Déficit nutricional de vitamina B12 y folatos
Henry y cols., encontraron que sólo el 7% de los pacientes que se tamizaron para deficiencia de vitamina B12 o folato presentaron niveles bajos de vitamina B12, aún con volumen corpuscular normal, sin documentarse ningún de deficiencia de ácido fólico[15]. Gilreath[1 ] menciona un comportamiento similar, documentando suficiencia de folatos en los pacientes evaluados. Por su baja incidencia, no existe indicación expresa para solicitar estos parámetros de forma rutinaria.
-
Manejo perioperatorio
Uno de los problemas más comunes en el manejo perioperatorio de los pacientes con cáncer es la presunción de que no existe tiempo suficiente para tratar la anemia[3 ]. La valoración pre-operatoria debe programarse con suficiente antelación para poder abordar y tratar ésta condición. La estrategia “Patient Blood Management – PBM” resulta útil en éste escenario, pues uno de sus pilares es la optimización de la masa eritrocitaria[16 ]. En la PBM, la transfusión deja de ser la terapia principal en el manejo perioperatorio de la anemia y se hace énfasis en el desarrollo de tratamientos para gestionar o corregir sus causas.
-
Eritropoyetina en el paciente con cáncer
La eritropoyetina (EPO) fue inicialmente autorizada para el tratamiento de la anemia en la insuficiencia renal crónica[17 ]. Su uso en el paciente con cáncer se ha relacionado con disminución de la supervivencia y aumento del riesgo de eventos tromboembólicos[3], por lo que no tiene una indicación aprobada[3]. Se sugiere evitar su uso en pacientes que no se encuentran en quimioterapia mielosupresiva o en aquellos con una enfermedad oncológica curable[1 ].
La EPO en los pacientes oncológicos puede incrementar la incidencia de trombosis venosa y promover la progresión algunos tumores. En cuanto a la supervivencia su impacto es incierto. Por lo anterior, el balance riesgo/beneficio es menos claro que el descrito para otras medidas[18] y su uso sólo debe considerarse en casos muy específicos, ante la falla de otras alternativas más seguras[19].
En la Tabla 1 se especifican los esquemas de uso preoperatorio[12 ].
| Tabla 1. Optimización preoperatoria con eritropoyetina |
|
Candidatos: • Paciente en quimioterapia mielosupresiva con hemoglobina < 10 g/dl, sin deficiencia absoluta de hierro y sin posibilidad oncológica de curación • Paciente que rechaza el soporte transfusional • Falla de otras estrategias de optimización • Paciente con enfermedad renal crónica y cáncer. |
|
Consideraciones previas: Descartar la ferropenia y las deficiencias nutricionales |
|
Esquema 1: Eritropoyetina alfa 300 unidades/kg SC/día, así: • 10 días antes de la cirugía • 4 días tras el procedimiento quirúrgico |
|
Esquema 2: Eritropoyetina alfa 600 unidades/kg/SC los días 21, 14 y 7 antes de la cirugía |
|
Siempre use de forma concomitante tromboprofilaxis |
|
Contraindicaciones: • Hipertensión no controlada • Anemia aplásica • Reacciones de hipersensibilidad |
|
Fuente: Kansagra AJ, Stefan MS. Preoperative Anemia. Evaluation and Treatment. |
-
Corrección preoperatoria de la ferropenia
La optimización preoperatoria es la estrategia con mayor evidencia disponible, siendo el hierro una medida eficaz como medida ahorradora de hemoderivados[20 ]. El consenso internacional del manejo perioperatorio de la anemia y la deficiencia de hierro[11] sugiere la implementación del tratamiento de la anemia ferropénica y la ferropenia tan pronto como sea posible antes de la cirugía. La principal diferencia entre las vías de administración (oral o IV) se encuentra en el tiempo necesario para documentar incrementos de la masa eritrocitaria[11 ].
El uso concomitante de hierro parenteral con antraciclinas y derivados del platino aumenta el estrés oxidativo, el daño tisular y el riesgo de cardiotoxicidad, por lo que su concomitante con estos quimioterapéuticos no se aconseja. Debe también considerarse que el exceso de hierro es tóxico, por lo que es necesario monitorizar la ferrocinética antes y después de iniciado el tratamiento. Una revisión sistemática reciente[21] encontró un incremento significativo del riesgo de infección por todas las causas (RR 1,33, IC95% 1,10 – 1,64) con el uso de hierro intravenoso, aunque los estudios incluidos tuvieron alto riesgo de sesgo. Con esta evidencia se sugiere evitar el hierro parenteral durante una infección aguda o en los pacientes neutropénicos y ser muy prudentes en el caso de infecciones crónicas.
En la Tabla 2 se especifican las terapias de suplementación según la prioridad del procedimiento quirúrgico[11],[12],[22],[23].
| Tabla 2. Estrategia de optimización preoperatoria de la anemia ferropénica | |
| Esquema | Comentarios |
|
Procedimiento programado > 4-6 semanas: iniciar con reposición oral Administrar 40 a 60 mg diarios de FE u 80 a 100 mg interdiarios; • Sulfato ferroso 300 mg VO/día. Tomar 2 horas antes o después de la ingesta de alimentos • Ácido ascórbico 500 mg – VO/día |
Ascenso en la hemoglobina de hasta 2 g/dL en 3 semanas |
|
Procedimiento programado < 4-6 semanas: se sugiere iniciar con reposición parenteral • Sacarato de hierro – 200 mg IV/día, por 5 dosis. Dosis máxima por semana 600 mg • Carboximaltosa férrica: 20 mg/Kg con dosis máxima de 1.000 mg Precauciones: • No administrar cerca del uso de antraciclinas • Evitar en pacientes neutropénicos |
Considerar en caso de fallo de la terapia oral, intolerancia gastrointestinal o sangrado persistente
50% de la respuesta máxima observada en 5 días. Respuesta máxima en 3 semanas |
|
Fuente: Muñoz M, Acheson AG, Auerbach M, Besser M, Habler O, Kehlet H, et al. International consensus statement on the peri-operative management of anaemia and iron deficiency. |
|
El riesgo de reacciones adversas con las formulaciones modernas de hierro intravenoso es bajo. Se estima en 38/1.000.000 para las reacciones adversas serias y 0,4/1.000.000 para mortalidad. Esto contrasta con el riesgo de una transfusión alogénica donde se ha registrado hasta 1 muerte por cada 100.000 transfusiones[11 ].
-
Deficiencia de hierro sin anemia
La deficiencia de hierro sin anemia corresponde a una enfermedad por sí misma[11],[24]. Aún está por definirse con evidencia más contundente la vía de suplementación cuando el tiempo para la cirugía es inferior a 4 semanas.
-
Deficiencia de vitamina B12 y ácido fólico
Su corrección debe iniciarse desde el preoperatorio. En la Tabla 3 se indican los esquemas de corrección[1],[12],[25]-[27]. La sospecha del componente carencial debe sustentarse a partir de una excelente valoración perioperatoria así como en los parámetros del hemograma[27 ]. Aunque la suplementación requiere un tratamiento prolongado, no se justifica posponer la intervención quirúrgica hasta corregir totalmente la deficiencia.
| Tabla 3. Estrategia de optimización preoperatoria de la deficiencia de ácido fólico y de vitamina B12 | |
| Esquema | Comentarios |
|
Deficiencia de vitamina B12: Cianocobalamina ampollas 1 mg – 2 mg VO/día durante 3 meses. Diluir en un jugo de naranja para su consumo |
La vía tradicional de corrección es la intramuscular |
|
Deficiencia de ácido fólico: |
|
|
Ácido fólico 1 mg – VO/día, por 4 meses |
Deficiencia de muy rara ocurrencia |
|
Fuente: Kansagra AJ, Stefan MS. Preoperative Anemia. Evaluation and Treatment. |
|
-
Consideraciones específicasen el intraoperatorio
-
Impacto clínico de la administración de hemoderivados
Se ha sugerido una relación directa entre la transfusión de eritrocitos y la recurrencia del cáncer[5 ]. Acheson y cols., demostraron que en cáncer colorrectal, los pacientes trasfundidos presentaron mayor riesgo de mortalidad por todas las causas (OR 1,72), mayor mortalidad asociada al cáncer (OR 1,71) y mayor mortalidad asociada a metástasis (OR 1,66) en comparación con los no trasfundidos. Resultados similares se han replicado en otro tipo de tumores[29], [30],[31].
-
Umbral de transfusión en los pacientes con cáncer
La guía de práctica clínica de la American Association of Blood Banks[32] recomienda un umbral de 7 g/dL para los adultos hospitalizados hemodinámicamente estables y de 8 g/dL en los pacientes llevados a cirugía cardiovascular u ortopédica o en aquellos con enfermedad cardiovascular preexistente. Sin embargo, el uso de un umbral de transfusión ha sido ampliamente debatido.
El estudio TRICC (Transfusion Requirements in Critical Care) encontró una mortalidad menor en los pacientes sometidos a un abordaje restrictivo[33 ]. Los estudios TRACS[34] y CRIT[35] tuvieron conclusiones similares. No obstante, la mayoría de estos estudios no aborda a los pacientes oncológicos de forma específica. El estudio TRICOP (Transfusion Requirements in Critically Ill Oncologic Patient)[36 ], encontró resultados opuestos a los descritos previamente. Los pacientes del grupo liberal presentaron una mortalidad a 30 días del 45% en comparación con 56% en el grupo restrictivo (p = 0,08), diferencia que se mantuvo en el seguimiento a 90 días con mortalidades de 59% y 70% respectivamente (p = 0,03). De Almeida[37] documentó hallazgos similares en pacientes oncológicos llevados a cirugía abdominal, evidenciando una mortalidad a 30 días de 8,2% en los pacientes del grupo liberal (umbral de 9 g/dl) en contraste con 22,8% en el grupo restrictivo (umbral de 7 g/dl).
-
Estrategias ahorradoras de sangre
Termoregulación: La hipotermia contribuye a la coagulopatía e incrementa el sangrado[38],[39]. Afecta principalmente la función plaquetaria, aunque también compromete los factores de la coagulación y la actividad fibrinolítica[40 ]. Incluso la hipotermia leve incrementa las pérdidas sanguíneas hasta en un 26% e incrementa el riesgo de transfusión hasta en un 37%[41 ].
Antifibrinolíticos: En una revisión sistemática de Montroy y cols.[42 ] no se encontró aumento del riesgo de tromboembolismo con el uso de los análogos de lisina. Debido a la buena relación riesgo/beneficio debe considerarse su uso en el intraoperatorio[43],[44].
Desmopresina: Su eficacia en el perioperatorio es limitada, generando sólo reducciones de sangrado cercanas a los 100 ml[45 ]. Los estudios en cáncer son escasos[46],[47].
Otras estrategias : El cell-salvage o la hemodilución normovolémica no son opciones razonables. El cell-salvage supone el riesgo de llevar a la circulación sistémica células tumorales[7], si bien recientes investigaciones han dado un parte de tranquilidad sobre su utilización[48],[49]. Por su parte, la hemodilución normovolémica no es factible puesto que la mayoría de los pacientes con cáncer no cumple los criterios para su uso[50],[51].
-
Conclusiones
La anemia en el paciente con cáncer es frecuente, por tal razón, la optimización de la masa eritrocitaria y el uso de estrategias ahorradoras de sangre deben considerarse fundamentales durante el manejo perioperatorio.
Referencias
1. Gilreath JA, Stenehjem DD, Rodgers GM. Diagnosis and treatment of cancer-related anemia. Am J Hematol. 2014 Feb;89(2):203–12. https://doi.org/10.1002/ajh.23628 PMID:24532336
2. Knight K, Wade S, Balducci L. Prevalence and outcomes of anemia in cancer: a systematic review of the literature. Am J Med. 2004(5);116(S7):11S-26S. https://doi.org/10.1016/j.amjmed.2003.12.008.
3. Díaz-Cambronero O, Matoses-Jaén S, García-Claudio N, García-Gregorio N, Molins-Espinosa J. Manejo preoperatorio de la anemia en cirugía oncológica. Rev Esp Anestesiol Reanim. 2015 Jun;62 Suppl 1:45–51. https://doi.org/10.1016/S0034-9356(15)30007-4 PMID:26320344
4. Cata JP. Perioperative anemia and blood transfusions in patients with cancer: when the problem, the solution, and their combination are each associated with poor outcomes. Anesthesiology. 2015 Jan;122(1):3–4. https://doi.org/10.1097/ALN.0000000000000518 PMID:25405396
5. Cata JP, Gottumukkala V. Blood transfusion practices in cancer surgery. Indian J Anaesth. 2014 Sep;58(5):637–42. https://doi.org/10.4103/0019-5049.144675 PMID:25535428
6. Fraenkel PG. Anemia of Inflammation: A Review. Med Clin North Am. 2017 Mar;101(2):285–96. https://doi.org/10.1016/j.mcna.2016.09.005 PMID:28189171
7. Weber RS, Jabbour N, Martin RC 2nd. Anemia and transfusions in patients undergoing surgery for cancer. Ann Surg Oncol. 2008 Jan;15(1):34–45. https://doi.org/10.1245/s10434-007-9502-9 PMID:17943390
8. Fraenkel PG. Understanding anemia of chronic disease. Hematology (Am Soc Hematol Educ Program). 2015;2015(1):14–8. https://doi.org/10.1182/asheducation-2015.1.14 PMID:26637695
9. Ludwig H, Evstatiev R, Kornek G, Aapro M, Bauernhofer T, Buxhofer-Ausch V, et al. Iron metabolism and iron supplementation in cancer patients. Wien Klin Wochenschr. 2015 Dec;127(23-24):907–19. https://doi.org/10.1007/s00508-015-0842-3 PMID:26373748
10. Aapro M, Österborg A, Gascón P, Ludwig H, Beguin Y. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of i.v. iron. Ann Oncol. 2012 Aug;23(8):1954–62. https://doi.org/10.1093/annonc/mds112 PMID:22575608
11. Muñoz M, Acheson AG, Auerbach M, Besser M, Habler O, Kehlet H, et al. International consensus statement on the peri-operative management of anaemia and iron deficiency. Anaesthesia. 2017 Feb;72(2):233–47. https://doi.org/10.1111/anae.13773 PMID:27996086
12. Kansagra AJ, Stefan MS. Preoperative Anemia: evaluation and Treatment. Anesthesiol Clin. 2016 Mar;34(1):127–41. https://doi.org/10.1016/j.anclin.2015.10.011 PMID:26927743
13. Muñoz M, Gómez-Ramírez S, Martín-Montañez E, Auerbach M. Perioperative anemia management in colorectal cancer patients: a pragmatic approach. World J Gastroenterol. 2014 Feb;20(8):1972–85. https://doi.org/10.3748/wjg.v20.i8.1972 PMID:24587673
14. Aapro M, Jelkmann W, Constantinescu SN, Leyland-Jones B. Effects of erythropoietin receptors and erythropoiesis-stimulating agents on disease progression in cancer. Br J Cancer. 2012 Mar;106(7):1249–58. https://doi.org/10.1038/bjc.2012.42 PMID:22395661
15. Henry DH, Dahl NV. Iron or vitamin B12 deficiency in anemic cancer patients prior to erythropoiesis- stimulating agent therapy. Community Oncol. 2007;4(2):95–101. https://doi.org/10.1016/S1548-5315(11)70057-2.
16. Shander A, Bracey AW Jr, Goodnough LT, Gross I, Hassan NE, Ozawa S, et al. Patient Blood Management as Standard of Care. Anesth Analg. 2016 Oct;123(4):1051–3. https://doi.org/10.1213/ANE.0000000000001496 PMID:27644011
17. Leal-Noval SR, Muñoz M, Asuero M, Contreras E, García-Erce JA, Llau JV, et al.; Sociedades Españolas de Anestesiología y Reanimación (SEDAR), Hematología y Hemoterapia (SEHH), Farmacia Hospitalaria (SEFH), Medicina Intensiva y Unidades Coronarias (SEMICYUC), Trombosis y Hemostasia (SETH) y Transfusiones Sanguíneas (SETS). 2013. Documento Sevilla de Consenso sobre Alternativas a la Transfusión de Sangre Alogénica. Actualización del Documento Sevilla. Med Intensiva. 2013 May;37(4):259–83. https://doi.org/10.1016/j.medin.2012.12.013 PMID:23507335
18. Glaspy J. Current status of use of erythropoietic agents in cancer patients. Semin Thromb Hemost. 2014 Apr;40(3):306–12. https://doi.org/10.1055/s-0034-1370768 PMID:24676903
19. Zhao F, Wang Y, Liu L, Bian M. Erythropoietin for cancer-associated malignant anemia: A meta-analysis. Mol Clin Oncol. 2017 Jun;6(6):925–30. https://doi.org/10.3892/mco.2017.1254 PMID:28588792
20. Cybulska P, Goss C, Tew WP, Parameswaran R, Sonoda Y. Indications for and complications of transfusion and the management of gynecologic malignancies. Gynecol Oncol. 2017 Aug;146(2):416–26. https://doi.org/10.1016/j.ygyno.2017.05.010 PMID:28528916
21. Litton E, Xiao J, Ho KM. Safety and efficacy of intravenous iron therapy in reducing requirement for allogeneic blood transfusion: systematic review and meta-analysis of randomised clinical trials. BMJ. 2013 Aug;347 aug15 1:f4822. https://doi.org/10.1136/bmj.f4822 PMID:23950195
22. Stanley L Schrier, MD, Michael Auerbach, MD F. Treatment of iron deficiency anemia in adults. UpToDate. 2017;1–38.
23. Bisbe Vives E, Basora Macaya M. Algoritmo para el tratamiento de la anemia preoperatoria. Rev Esp Anestesiol Reanim. 2015 Jun;62 Suppl 1:27–34. https://doi.org/10.1016/S0034-9356(15)30004-9 PMID:26320341
24. Pratt JJ, Khan KS. Non-anaemic iron deficiency – a disease looking for recognition of diagnosis: a systematic review. Eur J Haematol. 2016 Jun;96(6):618–28. https://doi.org/10.1111/ejh.12645 PMID:26256281
25. Kuzminski AM, Del Giacco EJ, Allen RH, Stabler SP, Lindenbaum J. Effective treatment of cobalamin deficiency with oral cobalamin. Blood. 1998 Aug;92(4):1191–8. PMID:9694707
26. Gomollón F, Gargallo CJ, Muñoz JF, Vicente R, Lue A, Mir A, et al. Oral Cyanocobalamin is Effective in the Treatment of Vitamin B12 Deficiency in Crohn’s Disease. Nutrients. 2017 Mar;9(3):308–19. https://doi.org/10.3390/nu9030308 PMID:28335526
27. Langan RC, Zawistoski KJ, Luke S. Update on vitamin B12 deficiency. Am Fam Physician. 2011 Jun;83(12):1425–30. PMID:21671542
28. Acheson AG, Brookes MJ, Spahn DR. Effects of allogeneic red blood cell transfusions on clinical outcomes in patients undergoing colorectal cancer surgery: a systematic review and meta-analysis. Ann Surg. 2012 Aug;256(2):235–44. https://doi.org/10.1097/SLA.0b013e31825b35d5 PMID:22791100
29. Buchner A, Grimm T, Schneevoigt BS, Wittmann G, Kretschmer A, Jokisch F, et al. Dramatic impact of blood transfusion on cancer-specific survival after radical cystectomy irrespective of tumor stage. Scand J Urol. 2017 Apr;51(2):130–6. https://doi.org/10.1080/21681805.2017.1295399 PMID:28332428
30. Reeh M, Ghadban T, Dedow J, Vettorazzi E, Uzunoglu FG, Nentwich M, et al. Allogenic Blood Transfusion is Associated with Poor Perioperative and Long-Term Outcome in Esophageal Cancer. World J Surg. 2017 Jan;41(1):208–15. https://doi.org/10.1007/s00268-016-3730-8 PMID:27730355
31. Bennett S, Baker LK, Martel G, Shorr R, Pawlik TM, Tinmouth A, et al. The impact of perioperative red blood cell transfusions in patients undergoing liver resection: a systematic review. HPB (Oxford). 2017 Apr;19(4):321–30. https://doi.org/10.1016/j.hpb.2016.12.008 PMID:28161216
32. Carson JL, Guyatt G, Heddle NM, Grossman BJ, Cohn CS, Fung MK, et al. Clinical Practice Guidelines From the AABB: Red Blood Cell Transfusion Thresholds and Storage. JAMA. 2016 Nov;316(19):2025–35. https://doi.org/10.1001/jama.2016.9185 PMID:27732721
33. Hébert PC, Wells G, Blajchman MA, Marshall J, Martin C, Pagliarello G, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med. 1999 Feb;340(6):409–17. https://doi.org/10.1056/NEJM199902113400601 PMID:9971864
34. Hajjar LA, Vincent JL, Galas FR, Nakamura RE, Silva CM, Santos MH, et al. Transfusion requirements after cardiac surgery: the TRACS randomized controlled trial. JAMA. 2010 Oct;304(14):1559–67. https://doi.org/10.1001/jama.2010.1446 PMID:20940381
35. Corwin HL, Gettinger A, Pearl RG, Fink MP, Levy MM, Abraham E, et al. The CRIT Study: anemia and blood transfusion in the critically ill—current clinical practice in the United States. Crit Care Med. 2004 Jan;32(1):39–52. https://doi.org/10.1097/01.CCM.0000104112.34142.79 PMID:14707558
36. Bergamin FS, Almeida JP, Landoni G, Galas FR, Fukushima JT, Fominskiy E, et al. Liberal Versus Restrictive Transfusion Strategy in Critically Ill Oncologic Patients: The Transfusion Requirements in Critically Ill Oncologic Patients Randomized Controlled Trial. Crit Care Med. 2017 May;45(5):766–73. https://doi.org/10.1097/CCM.0000000000002283 PMID:28240687
37. de Almeida JP, Vincent JL, Galas FR, de Almeida EP, Fukushima JT, Osawa EA, et al. Transfusion requirements in surgical oncology patients: a prospective, randomized controlled trial. Anesthesiology. 2015 Jan;122(1):29–38. https://doi.org/10.1097/ALN.0000000000000511 PMID:25401417
38. García-Velasco DO, Mille-Loera JE, Alvarado-Pérez J, Cuellar-Guzmán LF, Fabela-Barragán JA. Sangrado transoperatorio en el paciente con cáncer: ¿Qué puedo y debo hacer? Rev Mex Anest. 2017;40 S1:115–9.
39. Gando S, Hayakawa M. Pathophysiology of Trauma-Induced Coagulopathy and Management of Critical Bleeding Requiring Massive Transfusion. Semin Thromb Hemost. 2016 Mar;42(2):155–65. PMID:26716498
40. Sessler DI. Complications and treatment of mild hypothermia. Anesthesiology. 2001 Aug;95(2):531–43. https://doi.org/10.1097/00000542-200108000-00040 PMID:11506130
41. Rajagopalan S, Mascha E, Na J, Sessler DI. The effects of mild perioperative hypothermia on blood loss and transfusion requirement. Anesthesiology. 2008 Jan;108(1):71–7. https://doi.org/10.1097/01.anes.0000296719.73450.52 PMID:18156884
42. Montroy J, Fergusson NA, Hutton B, Lavallée LT, Morash C, Cagiannos I, et al. The Safety and Efficacy of Lysine Analogues in Cancer Patients: A Systematic Review and Meta-Analysis. Transfus Med Rev. 2017 Jul;31(3):141–8. https://doi.org/10.1016/j.tmrv.2017.03.002 PMID:28366637
43. Henry DA, Carless PA, Moxey AJ, O’Connell D, Stokes BJ, Fergusson DA, et al. Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion. Cochrane Database Syst Rev. 2011 Jan;(1):CD001886. https://doi.org/10.1002/14651858.CD001886.pub3 PMID:21249650
44. Pinzón-Florez CE, Vélez Cañas KM, Díaz Quijano DM. Efectividad del ácido tranexámico en las pérdidas sanguíneas perioperatorias en la artroplastia de cadera: revisión sistemática de la literatura y metaanálisis. Rev Esp Anestesiol Reanim. 2015;62(5):253–64. https://doi.org/10.1016/j.redar.2014.10.002 PMID:25542068
45. Ghadimi K, Levy JH, Welsby IJ. Perioperative management of the bleeding patient. Br J Anaesth. 2016 Dec;117 suppl 3:iii18–30. https://doi.org/10.1093/bja/aew358 PMID:27940453
46. Desborough MJ, Oakland K, Brierley C, Bennett S, Doree C, Trivella M, et al. Desmopressin use for minimising perioperative blood transfusion. Cochrane Database Syst Rev. 2017 Jul;7:CD001884. https://doi.org/10.1002/14651858.CD001884.pub3 PMID:28691229
47. Weinberg RS, Grecco MO, Ferro GS, Seigelshifer DJ, Perroni NV, Terrier FJ, et al. A phase II dose-escalation trial of perioperative desmopressin (1-desamino-8-d-arginine vasopressin) in breast cancer patients. Springerplus. 2015 Aug;4(1):428. https://doi.org/10.1186/s40064-015-1217-y PMID:26306290
48. Kumar N, Ahmed Q, Lee VK, Zaw AS, Goy R, Wong HK. Are we ready for the use of intraoperative salvaged blood in metastatic spine tumour surgery? Eur Spine J. 2016 Dec;25(12):3997–4007. https://doi.org/10.1007/s00586-015-4112-x PMID:26188770
49. Marraccini C, Merolle L, Berni P, Boito K, Tamagnini I, Kuhn E, et al. Safety of leucodepleted salvaged blood in oncological surgery: an in vitro model. Vox Sang. 2017 Nov;112(8):803–5. https://doi.org/10.1111/vox.12565 PMID:28983930
50. Zhou J. A review of the application of autologous blood transfusion. Braz J Med Biol Res. 2016 Aug;49(9):e5493. https://doi.org/10.1590/1414-431×20165493 PMID:27533770
51. Grant MC, Resar LM, Frank SM. The efficacy and utility of acute normovolemic hemodilution. Anesth Analg. 2015 Dec;121(6):1412–4. https://doi.org/10.1213/ANE.0000000000000935 PMID:26579641

 ORCID
ORCID