Dr. Sebastián Córdova 1, Dr. Cristóbal Carrasco 2
©2020 El(los) Autor(es) – Este capítulo pertenece al libro Curso de anestesia regional para cirugía ambulatoria
https://doi.org/10.25237/carsach2020.07 | PDF
-
PUNTOS CLAVES
-
Se recomienda el uso de bloqueos nerviosos periféricos continuos en los pacientes que se espera que tengan un dolor postoperatorio al menos moderado con una duración superior a 24 horas y de difícil tratamiento.
-
Las ventajas del uso de bloqueos nerviosos periféricos continuos incluyen una mejor analgesia, recuperación funcional y alta hospitalaria precoz.
-
Los adyuvantes en bloqueos periféricos pueden prolongar la analgesia de forma significativa, sin riesgos importantes asociados.
-
La epinefrina puede incrementar el perfil de seguridad de los anestésicos locales en cuanto a absorción sistémica.
-
Dexametasona y dexmedetomidina prolongan la analgesia de los bloqueos nerviosos periféricos significativamente tanto perineural como a nivel sistémico, y al ser usadas en conjunto logran potenciar aún mas la duración y calidad del bloqueo nervioso.
-
RESUMEN:
En el contexto de la pandemia, la anestesia regional juega un rol especial al evitar la generación de aerosoles debido al control de la vía aérea. Favorece la recuperación rápida, la analgesia satisfactoria, disminución de la estancia hospitalaria por parte del paciente, siendo de gran utilidad en la cirugía ambulatoria. La prolongación de bloqueos de nervio periférico es de especial relevancia en aquellas cirugías dolorosas y en que se espera más de 24 horas de dolor. Los bloqueos continuos entregan un perfil de control del dolor prolongado, menor dolor de rebote, limitando el uso de opioides y otros analgésicos, así como sus efectos adversos. Se discutirán diversos métodos para bloqueos continuos, tanto sus materiales como conceptos técnicos y farmacológicos además de sus complicaciones. El uso de adyuvantes ha surgido como una alternativa válida para prolongar el efecto analgésico y reducir el potencial de absorción sistémico con un bajo perfil de neurotoxicidad, y reducción del inicio de acción del bloqueo nervioso.
-
ABSTRACT:
In the context of the pandemic, regional anesthesia plays a special role in preventing aerosol generation due to airway control. It favors rapid recovery, satisfactory analgesia, decreasing the patient length of stay, being very useful in outpatient surgery. The prolongation of peripheral nerve blocks takes on special relevance in those painful surgeries and in which more than 24 hours of pain is expected. Continuous blocks provide a long-term pain control profile, less rebound pain, limiting the use of opioids and other pain medication, as well as their adverse effects. Various methods for continuous blocks will be discussed, including both their material and their technical and pharmacological concepts, as well as their complications. The use of adjuvants has emerged as a valid alternative to prolong the analgesic effect, reduce the potential for systemic absorption with a low neurotoxicity profile, and reduce the onset of peripheral nerve block.
-
INTRODUCCIÓN
En la sala de cirugía, la anestesia regional tiene el potencial de evitar la generación de aerosoles asociados a la anestesia general, por tanto, la posibilidad de disminuir la propagación del SARSCoV-2 a los trabajadores de la salud, además de otros beneficios que ofrecen los bloqueos nerviosos periféricos a los pacientes quirúrgicos .1,2
En el contexto actual, la cirugía ambulatoria adquiere un rol preponderante tanto para cirugía de urgencia como electiva permitiendo resolver patologías quirúrgicas de urgencia en las cuales los pacientes pueden ser dados de alta antes de las 24 horas post cirugía evitando la sobrecarga de pacientes hospitalizados, disminuyendo el riesgo de infección nosocomial además de mantener estos beneficios al momento de reiniciar cirugías electivas.3
El alta temprana exige una recuperación rápida y una baja incidencia e intensidad de efectos secundarios relacionados a la cirugía y anestesia; como dolor, náuseas y fatiga.4
El enfoque multimodal se introdujo en la cirugía ambulatoria a mediados de los años noventa. Este enfoque consiste en combinar analgésicos que actúan mediante distintos mecanismos de acción y así lograr un efecto analgésico aditivo o preferentemente sinérgico, pero con un mínimo de efectos secundarios, reduciendo la necesidad de analgésicos opioides y adversos relacionados a estos últimos.5
El uso de bloqueos de nervios periféricos (BNP) como parte de una estrategia multimodal son altamente recomendados en la literatura.6 La principal limitación de los BNP dosis única es su tiempo limitado de acción dentro de las primeras 24 horas postoperatorias. Esto se puede optimizar extendiendo los BNP mediante el uso de coadyuvantes o catéteres perineurales.7
-
BLOQUEO NERVIOSO PERIFÉRICO CONTINUO:
Proporcionar un bloqueo nervioso periférico continuo (BNPC), también llamado “infusión de anestésico local perineural”, implica la inserción percutánea de un catéter adyacente a los nervios periféricos o en el plano donde transcurren dichos nervios (ej.: bloqueos interfasciales) en su trayecto hacia el sitio quirúrgico.8
La infusión continua de anestésico local mediante catéter no solo reduce el dolor postoperatorio y mejora la eficacia de la rehabilitación, sino que también limita el uso (y sus efectos secundarios) de opioides y otros fármacos prescritos tradicionalmente después de la cirugía. La infusión de anestésico local perineural es particularmente favorable en pacientes de alto riesgo; trastornos pulmonares, insuficiencia renal o hepática y edad avanzada.10 La evidencia disponible indica que el uso de BNPC en sí mismo, no tiene ninguna contribución en las tasas generales de complicaciones postoperatorias.9,10
Sun et al. señalan que los pacientes que nunca han recibido opioides tienen un mayor riesgo de uso crónico de opioides después de la cirugía.11 Por otro lado, 2 Meta- análisis confirman con evidencia de alto grado que los BNPC proporcionan una analgesia superior después de una cirugía ortopédica mayor en comparación con los BNP dosis única o analgesia endovenosa, sin aumentar los efectos secundarios. 12,13
A pesar del uso de estrategias de analgesia multimodal, con frecuencia se informan episodios de dolor de rebote, definido éste último como un dolor muy severo luego de acabado el efecto analgésico de un bloqueo nervioso periférico dosis única. Su incidencia sigue siendo desconocida, pero podría alcanzar hasta un 40%, por lo que prolongar el efecto analgésico luego del primer día post cirugía toma relevancia.14
Dentro de las ventajas de los BNPC en el contexto ambulatorio destacan: mejor satisfacción del paciente y alivio del dolor, ausencia de dolor de rebote, menor riesgo de infección nosocomial y menores costos relacionados con la atención médica9. El uso de BNPC permite iniciar de forma precoz y mejor tolerada la rehabilitación y fisioterapia9.
-
INDICACIONES PARA BLOQUEO NERVIOSO PERIFÉRICO CONTINUO
Se recomienda el uso de BNPC en los pacientes que se espera que tengan un dolor postoperatorio al menos moderado con una duración superior a 24 horas y de difícil tratamiento.
Debido a que no todos los pacientes desean, o son capaces de aceptar, la responsabilidad adicional que conlleva el catéter y el sistema de bomba de infusión, la selección adecuada del paciente es crucial para un BNPC seguro, particularmente en el entorno ambulatorio.
Aunque existen recomendaciones para el uso de varias ubicaciones de catéteres para procedimientos quirúrgicos específicos, hay pocos datos publicados que diluciden específicamente este tema (ver Tabla 1).
-
EQUIPOS E INSUMOS:
-
Monitorización: Electrocardiograma, Oximetría de pulso, Presión arterial no invasiva.
-
Acceso vascular periférico y oxigeno suplementario disponible.
-
Kit para manejo de intoxicación sistémica por anestésicos locales.
-
Equipo de ultrasonido, protector ultrasonido estéril (Figura 1.C) y
anestésicos locales para dosis de prueba, bolo inicial e infusión. -
Kit de catéter de nervio periférico:
Existe una amplia variedad de kits de catéteres para nervios periféricos disponibles. Está más allá del alcance de este artículo discutirlos en detalle. Se recomienda familiarizarse con ellos antes de intentar insertar un catéter de nervio periférico.
A modo de generalidad, existe don tipos de catéteres:
-
Catéter a través de la aguja (Figura 1.A) comúnmente usado:
El catéter es más fácil de avanzar a través de la aguja y posicionar después de inyectar un pequeño volumen (5 ml) de anestésico local para distender el espacio potencial. Sin embargo, las agujas son de calibres de 17 a 19 gauge lo que hace suponer que la colocación del catéter pudiese ser más doloroso en el paciente despierto, sin embargo, 7 estudios prospectivos informaron una puntuación media de dolor al insertar la aguja de 0 a 2 en una escala de calificación numérica de 0 a 10 luego de una pápula de lidocaína en el sitio de punción.18
-
Catéter sobre aguja:
El sistema de catéter sobre aguja generalmente involucra una aguja de menor calibre. En el pasado, los catéteres eran más difíciles de posicionar, pero más reciente, con el uso de ultrasonido, la aguja y el catéter pueden colocarse en la posición correcta y simplemente retirarse para dejar el catéter en la posición deseada. La aguja de menor calibre en este tipo de kit, puede ser demasiado flexible y ser más difícil de redirigir una vez que se atraviesa la piel.
-
Equipamiento para asegurar y fijar catéter (Figura1, B):
Adhesivo tisular de cianocrilato, spray adhesivo, apósitos adhesivos transparentes, vendaje blanco autoadhesivo, etc.
-
Dispositivos de infusión continua y/o bolos de anestésicos locales (Figura 1, D):
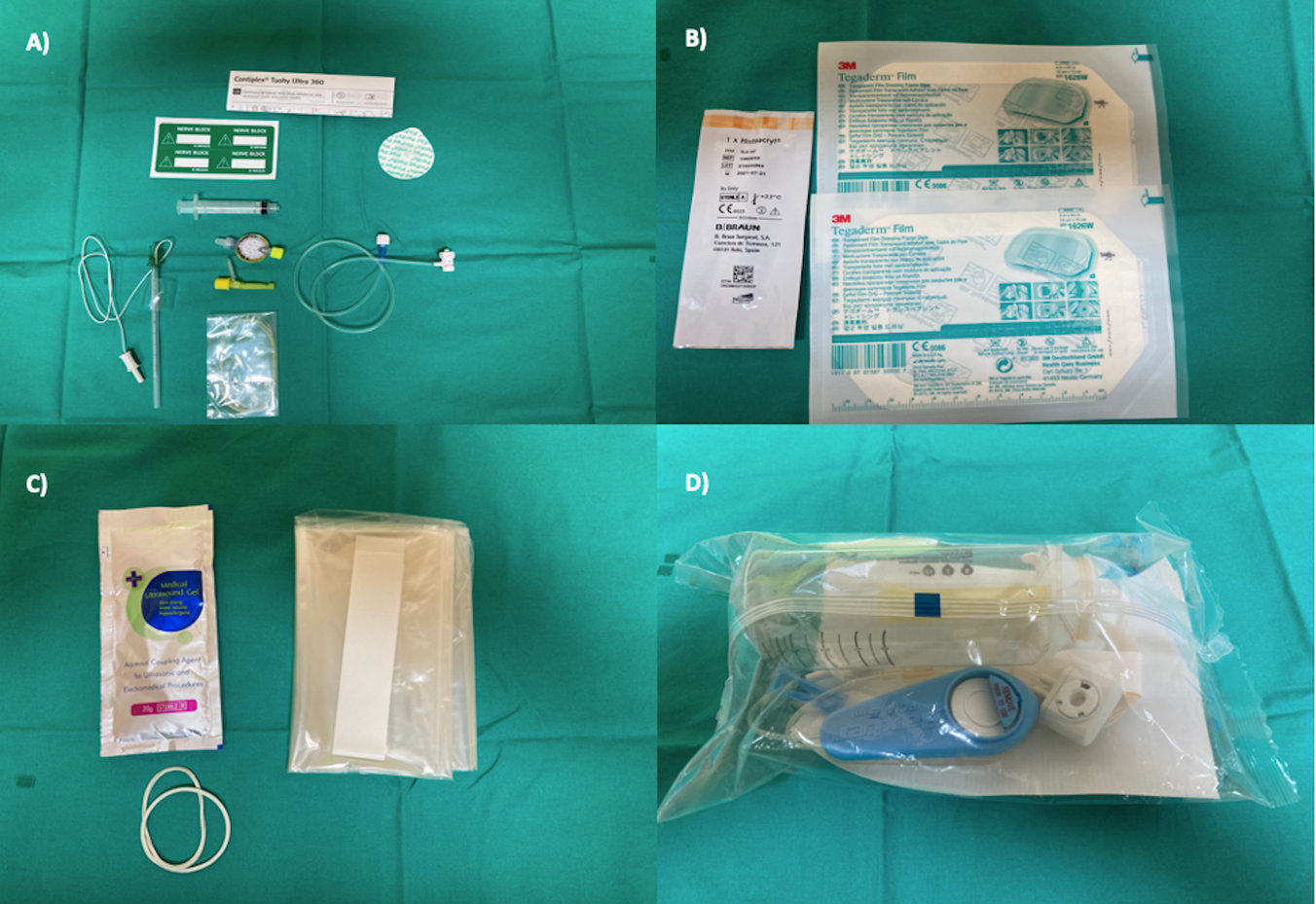
- Catéter Contiplex Tuohy Ultra 360 B. Braun (usado con autorización)
- Set de fijación con adhesivo tisular y apósitos transparentes
- Gel , manga y elásticos estériles para ecógrafo
-
Bomba elastomérica Baxter (usado con autorización)
Bombas elastoméricas desechables y Bombas electrónicas, estás últimas debiesen ser debidamente identificadas y no ser intercambiables con bombas electrónicas para epidurales.
-
TÉCNICA INSERCIÓN CATETER GUIADO POR ULTRASONIDO:
Para los procedimientos guiados por ultrasonido, el término “eje largo” se utiliza cuando la longitud de un nervio está dentro del haz de ultrasonido, en comparación con el “eje corto” cuando se ve en sección transversal. Si la aguja es insertada paralelo al haz de ultrasonido se describe “en plano”, si la aguja es insertada a través del haz de ultrasonido se describe “fuera de plano”.
18
-
Aguja en el plano, Abordaje del nervio en eje corto:
Esta es la orientación de bloqueo nervioso periférico de inyección única publicada con más frecuencia, dado que esta vista permite una identificación y diferenciación más fácil de las estructuras circundantes.
Cuando el eje largo de la aguja se inserta en plano, la ubicación de la punta de la aguja se puede identificar más fácilmente en relación al nervio objetivo. Sin embargo, cuando el catéter perineural se inserta más allá de la punta de la aguja, tiene la tendencia a sobrepasar el nervio dada la orientación perpendicular de la aguja en relación al nervio diana.8,18
De acuerdo a lo comentado por Ilfeld et al en su editorial18, algunos expertos prefieren pasar el catéter a una distancia mínima más allá de la punta de la aguja (1 cm) y otros hacer avanzar el catéter más al principio y luego, después de retirar la aguja, retraer el catéter bajo visión ecográfica de manera que sus orificios se encuentren a una distancia mínima (<2 cm) más allá de la posición original de la punta de la aguja.18
-
Aguja fuera de plano, abordaje del nervio en eje corto:
Hay ciertos beneficios potenciales de este enfoque. Destacan una trayectoria paralela de la aguja al nervio como las que se utilizaba con técnicas tradicionales de estimulación nerviosa (y también acceso vascular); y debido a que la aguja se encuentra paralela al nervio objetivo, el catéter teóricamente puede permanecer más cerca del nervio.18 Sin embargo, una desventaja de esta técnica es la relativa incapacidad para visualizar el avance de la punta de la aguja.18
Se ha sugerido que para catéteres superficiales (ej.: a nivel interescalénico y femoral), la orientación “longitudinal” de la aguja con el nervio hace que la visualización precisa de la punta de la aguja sea menos crítica, ya que la punta de ésta tiende a permanecer relativamente cerca del nervio si es que avanza más allá del haz de ultrasonido.18 En el caso de catéteres más profundos está técnica se hace más compleja y difícil de ejecutar.8,18
-
Aguja en plano, abordaje del nervio en eje largo:
Esta técnica parece tener los beneficios de ambos enfoques descritos anteriormente, con pocas limitaciones. El nervio se puede ver junto con la aguja, y el catéter a medida que sale de la aguja paralela al nervio a bloquear. La dificultad radica en mantener tres estructuras alineadas en el mismo plano ecográfico: aguja, nervio y catéter.8
-
MANEJO DE LA INFUSIÓN DE ANESTESICOS LOCALES:
Actualmente, no hay información suficiente para determinar si existe un anestésico local óptimo para el BNPC. La mayoría de las publicaciones sobre infusión perineural han involucrado bupivacaína (0.0625% –0.25%) o ropivacaína (0.1% –0.4%).19 El principal determinante de los efectos de BNPC, ya sea la concentración y/o el volumen del anestésico local, sigue siendo desconocido, aunque existe evidencia de que para los bloqueos continuos de nervio femoral y plexo lumbar posterior, la concentración y el volumen del anestésico local no influyen en las características del bloqueo nervioso8, lo que sugiere que la masa de droga es el principal determinante de los efectos de la infusión perineural.8
Probablemente muchas variables afecten el régimen óptimo (procedimiento quirúrgico, ubicación del catéter, anestésico local específico infundido, grado de movilidad postoperatorio).8 Para los procedimientos que provocan al menos un dolor postoperatorio moderado, una infusión basal optimiza beneficios como la analgesia y la calidad del sueño.20
Proporcionar a los pacientes la capacidad de auto administrarse dosis de anestésicos locales aumenta los beneficios perioperatorios; como minimizar consumo de opioides de rescate y permitir una disminución de la velocidad de infusión basal maximizando la duración de la infusión para pacientes ambulatorios.8,20
Hasta que se publiquen recomendaciones basadas en datos recopilados de forma prospectiva, investigadores han reportado planes de infusión existosos utilizando anestésicos locales de acción prolongada (ropivacaína y bupivacaína) con una infusión basal de 4 a 8 ml / h, volumen de bolo de 2 a 5 ml y duración del lockout de 20 a 60 minutos.21
-
POTENCIALES RIESGOS Y COMPLICACIONES:
Investigaciones prospectivas que incluyen un gran número de pacientes, sugieren que la incidencia de complicaciones relacionadas a BNPC es baja, comparables a técnicas de inyección única.22,23
La complicación reportada con mayor frecuencia es la “falla del bloqueo secundario” con un rango de 6% a 50%.24 Las técnicas heterogéneas de inserción de catéteres, el equipo, las ubicaciones anatómicas y las infusiones dificultan las generalizaciones.
Las complicaciones específicas de BNPC durante la inserción del catéter incluyen la colocación incorrecta de la punta del catéter en relación al nervio y/o espacio objetivo25 y excepcionalmente casos raros como inserción epidural, intratecal, intravascular o intraneural.2 Durante la infusión perineural, las complicaciones más comunes (y benignas) incluyen el desplazamiento y obstrucción del catéter además de fuga del anestésico local a través del sitio de inserción en la piel. Aunque no se ha investigado de forma prospectiva, la tunelización del catéter subcutáneo, aplicación de spray adhesivo, uso de dispositivos de anclaje del catéter y el uso de pegamento tisular de cianoacrilato pueden disminuir la incidencia de desplazamientos de catéter y/o fugas de anestésico local.2
Otras posibles complicaciones incluyen mal funcionamiento de la bomba de infusión, pausa no deseada o desconexión; irritación de la piel o reacciones alérgicas al spray adhesivo o adhesivos transparentes.2 Además, una extremidad insensible inducida por BNPC puede resultar desconcertante para los pacientes, impedir la terapia física y / o la deambulación.
Aunque las tasas de inflamación (3% – 4%) y colonización bacteriana del catéter (6% -57%) son aparentemente altas, la infección clínicamente relevante es relativamente rara (incidencia 0% – 3%; mayoría de informes < 1%).2
Quizás la complicación post-infusión más temida es la lesión neurológica. A menudo es difícil determinar cuánto de un déficit neurológico, si lo hay, es atribuible al BNPC porque todos los procedimientos quirúrgicos están asociados con una incidencia variable de lesión nerviosa, independientemente de la aplicación de una técnica regional. Considerando el punto anterior, la incidencia de síntomas neurológicos adversos transitorios asociados a BNPC es del 0% al 1,4% para bloqueo interescalénico, del 0,4% al 0,5% para bloqueo nervio femoral y del 0% al 1,0% para los catéteres ciáticos.2
Neuburger et al. reportaron una incidencia del 0,2% de déficits neurológicos que duran más de 6 semanas en casi 3500 catéteres de múltiples ubicaciones anatómicas.26 En base a lo descrito, el uso de BNPC es una técnica bastante segura cuando es realizada por personal capacitado para el procedimiento.
-
ADYUVANTES EN BLOQUEOS NERVIOSOS PERIFÉRICOS PARA CIRUGÍA AMBULATORIA:
El uso de adyuvantes en este escenario, va enfocado a acelerar el inicio del bloqueo, prolongar la analgesia, y reducir la toxicidad sistémica secundaria a anestésicos locales.27
En esta revisión nos enfocaremos a aquellos coadyuvantes que prolongan la duración del efecto analgésico, actualmente recomendados y que estén disponibles en nuestro medio.
-
EPINEFRINA:
Su adición en dosis de 2,5 a 5 mcg/cc ha demostrado prolongación del bloqueo sensitivo y motor de muchos anestésicos locales, con un mecanismo que involucraría, por un lado, la vasoconstricción local y la reducción de la disipación del anestésico local (washout), así mismo, actuaría directamente sobre el tejido neural. En un estudio aleatorio doble ciego, al realizar bloqueos intercostales con bupivacaína con y sin epinefrina 5 mcg/cc, se observó que las concentraciones plasmáticas de bupivacaína fueron significativamente menores que las observadas en el grupo sin epinefrina.28
En modelo animal se ha observado, que la presencia de epinefrina en la solución de lidocaína inyectada intraneural, no solamente alteraba el contenido neto de lidocaína en el nervio, sino que incrementaba la potencia de ésta de forma transitoria por un mecanismo farmacodinámico.29 Este mecanismo farmacodinámico no se observó al adicionar epinefrina a ropivacaína en bloqueo ciático, ya que no hubo un incremento significativo de la duración de la analgesia postoperatoria, ni tampoco de la potencia de ésta, debido probablemente a las propiedades vasoconstrictoras de la ropivacaína y a sesgos metodológicos del trabajo.30
El uso de epinefrina permite incrementar la dosis de lidocaína hasta 7 mg/kg y el de bupivacaína hasta 3 mg/kg.31
Existe un potencial de neurotoxicidad al presentarse reducción en el flujo sanguíneo neural32 particularmente en pacientes con riesgo alto de injuria neural, diabetes, hipertensión y tabaquismo33, situaciones en las cuales, es recomendable evitarla. Así mismo, altas dosis pueden producir taquicardia e hipertensión debido a absorción sistémica.34
-
DEXAMETASONA:
Inhibe la fosfolipasa A2 y activa el receptor de glucocorticoides, suprimiendo la transmisión en fibras tipo C, con un posible efecto directo sobre la membrana en la inhibición de los canales de potasio, y efectos anti inflamatorios locales.35
Ha demostrado ser un efectivo adyuvante en cuanto a prolongación de la duración de la analgesia, demostrado en varias revisiones sistemáticas de la literatura 36, así como reduciendo el tiempo de instalación del bloqueo tanto motor como sensitivo.35
Su efecto potenciador de la analgesia postoperatoria, parece no ser mediado por una prolongación del bloqueo sensitivo. En un trabajo en voluntarios sanos, se realizó bloqueo del nervio mediano comparando dexametasona perineural y endovenosa, contra placebo, no encontrando diferencias al prinprick test.37 Otro estudio con voluntarios sanos, el uso de dexametasona endovenosa no prolongó la anestesia frente a pinprick test independiente de la dosis, pero si prolongó el umbral a la detección del calor y frío dependiendo de la dosis, lo que mostraría que el mecanismo parece ser independiente de la prolongación de la actividad anestésica local luego de un bloqueo de nervio periférico.38
Si bien ambas vías han mostrado ser mejor que placebo39, existe una tendencia a mayor incremento de la analgesia en la vía perineural en comparación con la vía intravenosa40, la significancia clínica de esto parece no tener relevancia, dado que la calidad de la evidencia es baja, y más aún considerando que existe preocupación sobre el potencial de toxicidad local de la dexametasona, dado que no se conoce del todo su forma de acción, y que algunas presentaciones contienen vehículos y preservantes potencialmente dañinos.41
En cuanto a dosis, la evidencia apunta a que 4 mg de dexametasona representa la dosis techo que prolonga la analgesia por 6 a 8 horas en promedio al ser administrado por vía perineural42, y la dosis techo para la vía endovenosa, está cercana a los 8 mg con pequeñas diferencias al comparar con 10 mg.43
-
DEXMEDETOMIDINA:
Es un derivado de alfa2 – methylol, con afinidad por receptores alfa2 y alfa1 a razón 1620 :1. Existe evidencia de que 50 microgramos prolongan de forma significativa el bloqueo sensitivo y motor, con latencia más corta. Los eventos adversos transitorios (bradicardia intraoperatoria) los cuales son dosis dependientes, se observan con dosis mayores a 50 mcgr.44
Al ser comparado con dexametasona, esta última fue superior45, obteniéndose en promedio 2,5 horas más de analgesia.46 Tanto la vía endovenosa, como la perineural, presentan comportamientos similares en cuando a prolongación de la duración de la analgesia,47 y existen datos que muestran que la combinación bupivacaína más dexametasona y dexmedetomidina, prolongan significativamente la analgesia al compararse con ambos adyuvantes de forma separada.48,49
Es de señalar que ninguno de los adyuvantes mencionados está aprobado por FDA para su uso perineural.34 Dexametasona y dexmedetomidina no presentan un perfil neurotóxico, no así otros adyuvantes descritos en la literatura como midazolam, que sí lo presentan.50
-
CONCLUSIONES:
Los bloqueos de nervio periférico continuo con infusión perineural de anestésico local son una técnica aceptada y respaldada por la evidencia para el tratamiento seguro y eficaz del dolor post quirúrgico de moderada a severa intensidad en donde el uso de opioides puede ser perjudicial. Para obtener el beneficio de esta técnica, es de vital importancia el entrenamiento en anestesia regional, consentimiento por parte del paciente para la realización de la técnica y asumir la responsabilidad de llevar a su domicilio equipos asociado al catéter, así como también, un equipo de cirugía ambulatoria u hospitalización domiciliaria que realice el seguimiento y control del paciente de forma remota o presencial.
Los bloqueos nerviosos dosis única que contienen coadyuvantes como la dexametasona endovenosa / perineural y/o dexmedetomidina representan una alternativa valiosa cuando deseamos una analgesia efectiva por las primeras 24 post quirúrgicas como parte de una estrategia analgésica multimodal en donde el manejo del dolor luego del primer día puede tratado mediante el uso de medicamentos orales.
Dada la buena analgesia mediante bloqueos nerviosos periféricos ya sean continuos o asociados a coadyuvantes, estos pacientes pueden ser dados de alta el mismo día de la cirugía, acortando la estadía hospitalaria, riesgo de infección nosocomial y disminuyendo la exposición del personal de salud.
REFERENCIAS:
-
Lie, S. A., Wong, S. W., Wong, L. T., Wong, T., & Chong, S. Y. (2020). Practical considerations for performing regional anesthesia: lessons learned from the COVID-19 pandemic. Considérations pratiques pour laréalisation de l’anesthésie régionale: les leçons tirées de la pandémie de COVID-19. Canadian journal of anaesthesia = Journal canadien d’anesthesie, 67(7), 885–892. https://doi.org/10.1007/s12630-020-01637-0.
-
Ilfeld B. M. (2017). Continuous Peripheral Nerve Blocks: An Update of the Published Evidence and Comparison with Novel, Alternative Analgesic Modalities. Anesthesia and analgesia, 124(1), 308–335. https://doi.org/10.1213/ANE.0000000000001581.
-
Kaye, K., Paprottka, F., Escudero, R., Casabona, G., Montes, J., Fakin, R., Moke, L., Stasch, T., Richter, D., & Benito-Ruiz, J. (2020). Elective, Non-urgent Procedures and Aesthetic Surgery in the Wake of SARS-COVID-19: Considerations Regarding Safety, Feasibility and Impact on Clinical Management. Aesthetic plastic surgery, 44(3), 1014–1042. https://doi.org/10.1007/s00266-020-01752-9.
-
Jakobsson J. G. (2014). Pain management in ambulatory surgery-a review. Pharmaceuticals (Basel, Switzerland), 7(8), 850–865. https://doi.org/10.3390/ph7080850
-
Joshi, G., Gandhi, K., Shah, N., Gadsden, J., & Corman, S. L. (2016). Peripheral nerve blocks in the management of postoperative pain: challenges and opportunities. Journal of clinical anesthesia, 35, 524–529. https://doi.org/10.1016/j.jclinane.2016.08.041.
-
Chou, R., Gordon, D. B., de Leon-Casasola, O. A., Rosenberg, J. M., Bickler, S., Brennan, T., Carter, T., Cassidy, C. L., Chittenden, E. H., Degenhardt, E., Griffith, S., Manworren, R., McCarberg, B., Montgomery, R., Murphy, J., Perkal, M. F., Suresh, S., Sluka, K., Strassels, S., Thirlby, R., … Wu, C. L. (2016). Management of Postoperative Pain: A Clinical Practice Guideline from the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists’ Committee on Regional Anesthesia, Executive Committee, and Administrative Council. The journal of pain: official journal of the American Pain Society, 17(2), 131–157.
https://doi.org/10.1016/j.jpain.2015.12.008.
-
Jafra, A., & Mitra, S. (2018). Pain relief after ambulatory surgery: Progress over the last decade. Saudi journal of anaesthesia, 12(4), 618–625. https://doi.org/10.4103/sja.SJA_232_18
-
Brian M. Ilfeld, Edward R. Mariano, Chapter 16 – Continuous Peripheral Nerve Blocks, Essentials of Pain Medicine (Fourth Edition), Elsevier, 2018, Pages 135-140.e2, ISBN 9780323401968, https://doi.org/10.1016/B978-0-323-40196-8.00016-4.
-
Capdevila, X., Iohom, G., Choquet, O., Delaney, P., & Apan, A. (2019). Catheter use in regional anesthesia: pros and cons. Minerva anestesiologica, 85(12), 1357–1364. https://doi.org/10.23736/S0375-9393.19.13581-X.
-
Saporito A, Anselmi L, Sturini E, Borgeat A, Aguirre JA. Is outpatient continuous regional analgesia more effective and equally safe than single-shot peripheral nerve blocks after ambulatory orthopedic surgery? Minerva Anestesiologica. 2017 Sep;83(9):972-981. DOI: 10.23736/s0375-9393.17.11643-3.
-
Sun, E. C., Darnall, B. D., Baker, L. C., & Mackey, S. (2016). Incidence of and Risk Factors for Chronic Opioid Use Among Opioid-Naive Patients in the Postoperative Period. JAMA internal medicine, 176(9), 1286–1293. https://doi.org/10.1001/jamainternmed.2016.3298.
-
Bingham, A. E., Fu, R., Horn, J. L., & Abrahams, M. S. (2012). Continuous peripheral nerve block compared with single-injection peripheral nerve block: a systematic review and meta-analysis of randomized controlled trials. Regional anesthesia and pain medicine, 37(6), 583–594. https://doi.org/10.1097/AAP.0b013e31826c351b.
-
Vorobeichik, L., Brull, R., Bowry, R., Laffey, J. G., & Abdallah, F. W. (2018). Should continuous rather than single-injection interscalene block be routinely offered for major shoulder surgery? A meta-analysis of the analgesic and side-effects profiles. British journal of anaesthesia, 120(4), 679–692. https://doi.org/10.1016/j.bja.2017.11.104.
-
Lavand’homme P. (2018). Rebound pain after regional anesthesia in the ambulatory patient. Current opinion in anaesthesiology, 31(6), 679–684. https://doi.org/10.1097/ACO.0000000000000651.
-
Dhir, S., Brown, B., Mack, P., Bureau, Y., Yu, J., & Ross, D. (2018). Infraclavicular and supraclavicular approaches to brachial plexus for ambulatory elbow surgery: A randomized controlled observer-blinded trial. Journal of clinical anesthesia, 48, 67–72.
https://doi.org/10.1016/j.jclinane.2018.05.005.
-
Wong, S.S., Chan, W.S., Fang, C. et al. Infraclavicular nerve block reduces postoperative pain after distal radial fracture fixation: a randomized controlled trial. BMC Anesthesiol 20, 130 (2020). https://doi.org/10.1186/s12871-020-01044-4.
-
Kuang, M. J., Ma, J. X., Fu, L., He, W. W., Zhao, J., & Ma, X. L. (2017). Is Adductor Canal Block Better Than Femoral Nerve Block in Primary Total Knee Arthroplasty? A GRADE Analysis of the Evidence Through a Systematic Review and Meta-Analysis. The Journal of arthroplasty, 32(10), 3238–3248.e3. https://doi.org/10.1016/j.arth.2017.05.015.
-
Ilfeld, B. M., Fredrickson, M. J., & Mariano, E. R. (2010). Ultrasound-guided perineural catheter insertion: three approaches but few illuminating data. Regional anesthesia and pain medicine, 35(2), 123–126. https://doi.org/10.1097/AAP.0b013e3181d245a0.
-
Borgeat, A., Kalberer, F., Jacob, H., Ruetsch, Y. A., & Gerber, C. (2001). Patient-controlled interscalene analgesia with ropivacaine 0.2% versus bupivacaine 0.15% after major open shoulder surgery: the effects on hand motor function. Anesthesia and analgesia, 92(1), 218–223. https://doi.org/10.1097/00000539-200101000-00042.
-
lfeld, B. M., Morey, T. E., Wright, T. W., Chidgey, L. K., & Enneking, F. K. (2004). Interscalene perineural ropivacaine infusion:a comparison of two dosing regimens for postoperative analgesia. Regional anesthesia and pain medicine, 29(1), 9–16.
https://doi.org/10.1016/j.rapm.2003.08.016. -
Machi, A. T., & Ilfeld, B. M. (2015). Continuous peripheral nerve blocks in the ambulatory setting: an update of the published evidence. Current opinion in anaesthesiology, 28(6), 648–655. https://doi.org/10.1097/ACO.0000000000000254.
-
Wiegel, M., Gottschaldt, U., Hennebach, R., Hirschberg, T., & Reske, A. (2007). Complications and adverse effects associated with continuous peripheral nerve blocks in orthopedic patients. Anesthesia and analgesia, 104(6).
https://doi.org/10.1213/01.ane.0000261260.69083.f3. -
Borgeat, A., Ekatodramis, G., Kalberer, F., & Benz, C. (2001). Acute and nonacute complications associated with interscalene block and shoulder surgery: a prospective study. Anesthesiology, 95(4), 875–880. https://doi.org/10.1097/00000542-200110000-00015.
-
Picard, L., Belnou, P., Debes, C., Lapidus, N., Sung Tsai, E., Gaillard, J., Sautet, A., Bonnet, F., Lescot, T., & Verdonk, F. (2020). Impact of Regional Block Failure in Ambulatory Hand Surgery on Patient Management: A Cohort Study. Journal of clinical medicine, 9(8), E2453. https://doi.org/10.3390/jcm9082453.
-
Pham-Dang, C., Kick, O., Collet, T., Gouin, F., & Pinaud, M. (2003). Continuous peripheral nerve blocks with stimulating catheters. Regional anesthesia and pain medicine, 28(2), 83–88.
https://doi.org/10.1053/rapm.2003.50005. -
Neuburger, M., Breitbarth, J., Reisig, F., Lang, D., & Büttner, J. (2006). Komplikationen bei peripherer Katheterregionalanästhesie Untersuchungsergebnisse anhand von 3,491 Kathetern [Complications and adverse events in continuous peripheral regional anesthesia Results of investigations on 3,491 catheters]. Der Anaesthesist, 55(1), 33–40. https://doi.org/10.1007/s00101-005-0920-4.
-
Koyyalamudi, V., Sen, S., Patil, S., Creel, J. B., Cornett, E. M., Fox, C. J., & Kaye, A. D. (2017). Adjuvant Agents in Regional Anesthesia in the Ambulatory Setting. Current pain and headache reports, 21(1), 6. https://doi.org/10.1007/s11916-017-0604-1.
-
Johnson, M. D., Mickler, T., Arthur, G. R., Rosenburg, S., & Wilson, R. (1990). Bupivacaine with and without epinephrine for intercostal nerve block. Journal of cardiothoracic anesthesia, 4(2), 200–203. https://doi.org/10.1016/0888-6296(90)90238-b.
-
Sinnott, C. J., Cogswell III, L. P., Johnson, A., & Strichartz, G. R. (2003). On the mechanism by which epinephrine potentiates lidocaine’s peripheral nerve block. Anesthesiology, 98(1), 181–188. https://doi.org/10.1097/00000542-200301000-00028.
-
Schoenmakers, K.P., Fenten, M.G., Louwerens, J.W. et al. The effects of adding epinephrine to ropivacaine for popliteal nerve block on the duration of postoperative analgesia: a randomized controlled trial. BMC Anesthesiol 15, 100 (2015). https://doi.org/10.1186/s12871-015-0083-z.
-
Becker, D. E., & Reed, K. L. (2012). Local anesthetics: review of pharmacological considerations. Anesthesia progress, 59(2), 90–103. https://doi.org/10.2344/0003-3006-59.2.90.
-
Myers, R. R., & Heckman, H. M. (1989). Effects of local anesthesia on nerve blood flow: studies using lidocaine with and without epinephrine. Anesthesiology, 71(5), 757–762. https://doi.org/10.1097/00000542-198911000-00021.
-
Neal, J. M., Bernards, C. M., Hadzic, A., Hebl, J. R., Hogan, Q. H., Horlocker, T. T., Lee, L. A., Rathmell, J. P., Sorenson, E. J., Suresh, S., & Wedel, D. J. (2008). ASRA Practice Advisory on Neurologic Complications in Regional Anesthesia and Pain Medicine. Regional anesthesia and pain medicine, 33(5), 404–415. https://doi.org/10.1016/j.rapm.2008.07.527.
-
Kirksey, M. A., Haskins, S. C., Cheng, J., & Liu, S. S. (2015). Local Anesthetic Peripheral Nerve Block Adjuvants for Prolongation of Analgesia: A Systematic Qualitative Review. PloS one, 10(9), e0137312. https://doi.org/10.1371/journal.pone.0137312.
-
Albrecht, E., Kern, C., & Kirkham, K. R. (2015). A systematic review and meta-analysis of perineural dexamethasone for peripheral nerve blocks. Anaesthesia, 70(1), 71–83. https://doi.org/10.1111/anae.12823.
-
Pehora, C., Pearson, A. M., Kaushal, A., Crawford, M. W., & Johnston, B. (2017). Dexamethasone as an adjuvant to peripheral nerve block. The Cochrane database of systematic reviews, 11(11), CD011770. https://doi.org/10.1002/14651858.CD011770.pub2.
-
Marhofer, P., Columb, M., Hopkins, P. M., Greher, M., Marhofer, D., Bienzle, M., & Zeitlinger, M. (2019). Dexamethasone as an adjuvant for peripheral nerve blockade: a randomised, triple-blinded crossover study in volunteers. British journal of anaesthesia, 122(4), 525–531. https://doi.org/10.1016/j.bja.2019.01.004.
-
Short, A., El-Boghdadly, K., Clarke, H., Komaba, T., Jin, R., Chin, K. J., & Chan, V. (2020). Effect of intravenous dexamethasone on the anaesthetic characteristics of peripheral nerve block: a double-blind, randomised controlled, dose-response volunteer study. British journal of anaesthesia, 124(1), 92–100. https://doi.org/10.1016/j.bja.2019.08.029.
-
Abdallah, F. W., Johnson, J., Chan, V., Murgatroyd, H., Ghafari, M., Ami, N., Jin, R., & Brull, R. (2015). Intravenous dexamethasone and perineural dexamethasone similarly prolong the duration of analgesia after supraclavicular brachial plexus block: a randomized, triple-arm, double-blind, placebo-controlled trial. Regional anesthesia and pain medicine, 40(2), 125–132. https://doi.org/10.1097/AAP.0000000000000210.
-
Heesen, M., Klimek, M., Imberger, G., Hoeks, S. E., Rossaint, R., & Straube, S. (2018). Co-administration of dexamethasone with peripheral nerve block: intravenous vs perineural application: systematic review, meta-analysis, meta-regression and trial-sequential analysis. British journal of anaesthesia, 120(2), 212–227. https://doi.org/10.1016/j.bja.2017.11.062.
-
McHardy, P. G., Singer, O., Awad, I. T., Safa, B., Henry, P., Kiss, A., Au, S. K., Kaustov, L., & Choi, S. (2020). Comparison of the effects of perineural or intravenous dexamethasone on low volume interscalene brachial plexus block: a randomised equivalence trial. British journal of anaesthesia, 124(1), 84–91. https://doi.org/10.1016/j.bja.2019.08.025.
-
Kirkham, K. R., Jacot-Guillarmod, A., & Albrecht, E. (2018). Optimal Dose of Perineural Dexamethasone to Prolong Analgesia After Brachial Plexus Blockade: A Systematic Review and Meta-analysis. Anesthesia and analgesia, 126(1), 270–279. https://doi.org/10.1213/ANE.0000000000002488.
-
Chalifoux, F., Colin, F., St-Pierre, P., Godin, N., & Brulotte, V. (2017). Low dose intravenous dexamethasone (4 mg and 10 mg) significantly prolongs the analgesic duration of single-shot interscalene block after arthroscopic shoulder surgery: a prospective randomized placebo-controlled study. La dexaméthasone intraveineuse à des doses de 4 mg ou de 10 mg prolonge significativement la durée analgésique du bloc interscalénique simple suite à une chirurgie arthroscopique de l’épaule: une étude prospective, randomisée et contrôlée avec placebo. Canadian journal of anaesthesia = Journal canadien d’anesthesie, 64(3), 280–289. https://doi.org/10.1007/s12630-016-0796-6.
-
Hussain, N., Grzywacz, V. P., Ferreri, C. A., Atrey, A., Banfield, L., Shaparin, N., & Vydyanathan, A. (2017). Investigating the Efficacy of Dexmedetomidine as an Adjuvant to Local Anesthesia in Brachial Plexus Block: A Systematic Review and Meta-Analysis of 18 Randomized Controlled Trials. Regional anesthesia and pain medicine, 42(2), 184–196. https://doi.org/10.1097/AAP.0000000000000564.
-
Aliste, J., Layera, S., Bravo, D., Fernández, D., Jara, Á., García, A., Finlayson, R. J., & Tran, D. Q. (2019). Randomized comparison between perineural dexamethasone and dexmedetomidine for ultrasound-guided infraclavicular block. Regional anesthesia and pain medicine, rapm-2019-100680. Advance online publication. https://doi.org/10.1136/rapm-2019-100680.
-
Albrecht, E., Vorobeichik, L., Jacot-Guillarmod, A., Fournier, N., & Abdallah, F. W. (2019). Dexamethasone Is Superior to Dexmedetomidine as a Perineural Adjunct for Supraclavicular Brachial Plexus Block: Systematic Review and Indirect Meta-analysis. Anesthesia and analgesia, 128(3), 543–554. https://doi.org/10.1213/ANE.0000000000003860.
-
Abdallah, F. W., Dwyer, T., Chan, V. W., Niazi, A. U., Ogilvie-Harris, D. J., Oldfield, S., Patel, R., Oh, J., & Brull, R. (2016). IV and Perineural Dexmedetomidine Similarly Prolong the Duration of Analgesia after Interscalene Brachial Plexus Block: A Randomized, Three-arm, Triple-masked, Placebo-controlled Trial. Anesthesiology, 124(3), 683–695. https://doi.org/10.1097/ALN.0000000000000983.
-
Zhang, P., Liu, S., Zhu, J., Rao, Z., & Liu, C. (2019). Dexamethasone and dexmedetomidine as adjuvants to local anesthetic mixture in intercostal nerve block for thoracoscopic pneumonectomy: a prospective randomized study. Regional anesthesia and pain medicine, rapm-2018-100221. Advance online publication. https://doi.org/10.1136/rapm-2018-100221.
-
Rwei, A. Y., Sherburne, R. T., Zurakowski, D., Wang, B., & Kohane, D. S. (2018). Prolonged Duration Local Anesthesia Using Liposomal Bupivacaine Combined with Liposomal Dexamethasone and Dexmedetomidine. Anesthesia and analgesia, 126(4), 1170–1175. https://doi.org/10.1213/ANE.0000000000002719.
-
Knight, J. B., Schott, N. J., Kentor, M. L., & Williams, B. A. (2015). Neurotoxicity of common peripheral nerve block adjuvants. Current opinion in anaesthesiology, 28(5), 598–604. https://doi.org/10.1097/ACO.0000000000000222.
