Jaime Escobar D. 1
Rev Chil Anest Vol. 40 Núm. 3 pp. 283-291|doi:
PDF|ePub|RIS
INTRODUCCIÓN
En 1968, Melzack y Wall presentaron su “Teoría de la compuerta del dolor” en donde se propuso que la médula espinal es el sitio principal en donde se produce la modulación de las señales nociceptivas. Esto cambió nuestros conceptos sobre la transmisión del dolor y sentó las bases para las investigaciones de la farmacología de los opioides en el asta dorsal medular. En 1973 Pert y Snyder descubrieron los receptores opioides. En 1977 mediante técnicas de radioligando se identificaron dichos receptores en el asta dorsal medular. En 1976 Yaksh demostró que los opioides modulan los estímulos nociceptivos a través de una acción directa sobre la médula espinal 1 .
Wang fue el primero en describir la administración intratecal de morfina en un grupo de ocho pacientes con tumores genitourinarios en 1979. Desde entonces el uso de la vía intratecal para la administración de opioides se ha convertido en una técnica ampliamente aceptada para proporcionar alivio eficaz en el dolor postoperatorio.
Actualmente el uso de la vía intratecal para la obtención de analgesia con opioides está ampliamente difundida en el mundo, constituyéndose en una técnica que además se utiliza en muy diversos escenarios de la actuación anestésica.
Más de 2.000 publicaciones se encuentran en Pubmed relacionadas al uso de morfina intratecal para analgesia, lo que demuestra el interés que el tema despierta en nuestra especialidad. En esta época de contención de costos y aumento de la productividad en salud, resulta atractivo el poder contar con una técnica de punción única que produzca analgesia de alta calidad, larga duración, segura, con efectos adversos acotados.
En 2002 C. Bernards señala que se ha difundido ampliamente que la administración de opioides neuroaxiales (intratecales y epidurales) puede producir niveles de analgesia altamente efectivos, mediados selectivamente por acción espinal, eventualmente de calidad superior a otras técnicas analgésicas, y que esto no es necesariamente cierto. Es más, los opioides son ampliamente utilizados por vía espinal a pesar de que la evidencia clínica ha demostrado que la administración neuroaxial no produce analgesia con un mecanismo espinal selectivo o que la analgesia producida no es superior necesariamente a la producida por administración intravenosa 2 .
Se revisará a la luz de la evidencia actual qué tanto se acercan las técnicas analgésicas con administración de opioides intratecales al ideal esperado.
MECANISMO DE LA ANALGESIA OPIOIDE
Para percibir el dolor se requiere de una estructura periférica (en la piel, vísceras, músculos, etc.) que actúe como receptor; aquí se capta el estímulo nociceptivo y se inicia la transmisión de la información hacia las estructuras superiores. La primera sinapsis se realiza en el asta dorsal de la médula espinal. Luego están las vías de conducción desde la médula espinal hacia los centros superiores como bulbo, diencéfalo, tálamo y corteza. Existen además vías descendentes moduladoras desde los centros superiores como tálamo y núcleos reticulares hacia el asta dorsal de la médula espinal.
Cuando se percibe un estímulo nociceptivo, este es conducido por la primera neurona hasta el asta dorsal medular en donde recibe una gran modulación en la primera sinapsis; luego este estímulo nociceptivo continúa ascendiendo (segunda neurona) y sufriendo múltiples modulaciones en los distintos niveles por donde atraviesa (tálamo, sistema límbico, corteza, etc.). Desde los centros superiores se ejercen respuestas a lo percibido en la periferia lo que se traduce en nuevas modulaciones para la conducción del estímulo nociceptivo. Hay vías descendentes desde los núcleos encefálicos de la base, que a la vez están fuertemente regulados desde centros superiores, que van a inhibir la conducción del estímulo nociceptivo a nivel de la primera sinapsis en el asta dorsal medular. Lo anterior da como resultado una disminución de la conducción del estímulo nociceptivo desde la periferia (Figura 1).
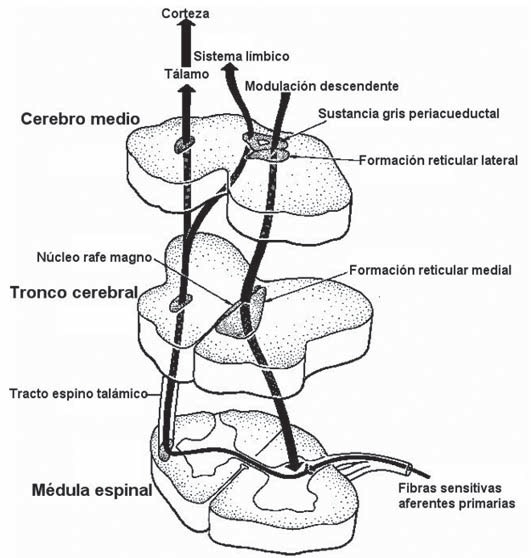
Figura 1 Vías del dolor (publicada con la autorización de Anestesiología Clínica, Herrera O, J. Rodríguez, Espinoza A, 3ªEdición año, 2008. Editorial Mediterráneo).
La analgesia opioide se produce a través de la activación de receptores específicos en la médula espinal (vías ascendentes y descendentes), estructuras encefálicas y sistema límbico.
El resultado de la activación de un receptor opioide resulta en la hiperpolarización de la neurona. Esta acción inhibitoria ocurre a través del mecanismo de inhibición de la adenilciclasa intracelular, con aumento de la conductancia al K+ e inactivación de los canales de Ca++. Lo anterior sugirió que pese a originarse a partir de diferentes genes, los receptores opioides pertenecen a la superfamilia de los receptores de membrana que transducen su señal por medio de Proteína G, principalmente PGi (Figura 2).
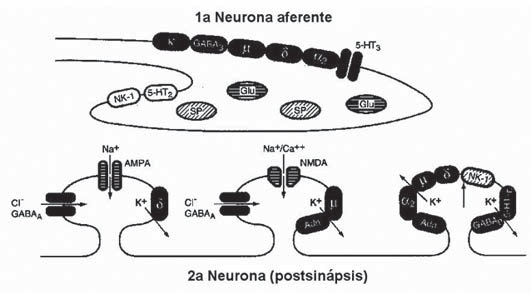
Figura 2 Primera sinapsis en asta dorsal medular (publicada con la autorización de Anestesiología Clínica, Herrera O, J. Rodríguez, Espinoza A, 3ª Edición año, 2008. Editorial Mediterráneo).
A nivel encefálico la acción más significativa de los agonistas de receptores opioides ocurre en los sitios que se relacionan con las vías descendentes de modulación de la nocicepción. Esta modulación ocurre principalmente en el asta dorsal medular lo que significa que el efecto de la acción opioide a nivel encefálico o supraespinal ocurre finalmente en el asta dorsal medular. Si se administra morfina por vía oral o intravenosa su efecto final ocurre en el asta dorsal medular.
La mayor concentración de receptores opioides y agonistas endógenos a nivel supraespinal se ubica en relación a la sustancia gris periacueductal, formación reticular y núcleo rafe magno. La activación de los receptores opioides a ese nivel, ya sea por opioides endógenos o aportados exógenamente, va a resultar en la inhibición de las neuronas que inhiben a la vía descendente; el efecto final es la liberación de la vía inhibitoria descendente con disminución de la conducción nociceptiva y desarrollo de analgesia.
La vía descendente inhibitoria de la nocicepción actúa a nivel de la primera sinapsis en el asta dorsal medular estimulando receptores a2 adrenérgicos y 5-HT3. Estos receptores se ubican a nivel pre y post sináptico en la primera sinapsis y el resultado de su estimulación implica hiperpolarización neuronal pre y postsináptica con disminución de liberación de neurotransmisores de las mismas. Esta vía descendente libera entonces a nivel del asta dorsal serotonina (receptor 5-HT3) e indirectamente norepinefrina (receptor 2 adrenérgicos), produciendo un efecto inhibitorio de la conducción de la nocicepción. Esta vía inhibitoria descendente normalmente se activa cuando la información de un estímulo nociceptivo llega a los centros superiores y sería un mecanismo analgésico endógeno muy potente y eficiente. Mientras no haya un estímulo nociceptivo estimulando los centros superiores, esta vía descendente se encontrará fuertemente inhibida en su paso a nivel de la sustancia reticular (bulbo-protuberancia) (Figura 2).
Así se entiende que existe un mecanismo analgésico endógeno natural que es activado por estímulos nociceptivos periféricos y que desde los centros superiores va a disminuir la conducción de dicha nocicepción en el asta dorsal medular. Este mecanismo es conocido como Sistema Inhibitorio Descendente. Los opioides endógenos estimulan los receptores a nivel de sustancia gris periacueductal y núcleo rafe magno para bloquear la inhibición de esta vía descendente. Al utilizar opioides por vía sistémica aprovechamos la existencia de este sistema analgésico endógeno. También al utilizar opioides por vía neuroaxial que tengan la propiedad de ascender en el líquido céfalo-raquídeo (LCR) se aprovecha este sistema. Una tercera manera de aprovecharlo es la aplicación en la anestesia de neuroeje de fármacos que estimulen directamente los receptores 5-HT3, Ach y 2 adrenérgicos.
Los opioides administrados a nivel epidural o intratecal actúan sobre receptores ubicados en el asta dorsal medular (láminas I, II y V) inhibiendo la liberación de neurotransmisores excitatorios de la nocicepción. Este efecto ocurre por inhibición de la conducción en la primera sinapsis, a través de la activación de receptores pre y postsinápticos.
Los neurotransmisores de la nocicepción en la primera sinapsis del asta dorsal, son la sustancia P y glutamato-aspartato que van a estimular los receptores AMPA, NMDA y NK 1 y 2 de la segunda neurona para conducir la nocicepción. Existen además múltiples receptores inhibitorios en esta primera sinapsis, ya sea pre o post sinápticos. Nos interesan especialmente los ya mencionados receptores 5-HT3, Ach y 2 adrenérgicos del sistema inhibitorio descendente y los receptores opioides espinales en sus distintos tipos: m, d y k. La estimulación de estos receptores pre y post sinápticos significa una modulación inhibitoria de la nocicepción (Figura 2) 3 .
FARMACOCINÉTICA OPIOIDE
Las propiedades fisicoquímicas de los fármacos opioides administrados por vía intratecal determinan su latencia, duración de acción y potencia. Alta solubilidad en lípidos y bajo pKa determinan un opioide muy potente, con un inicio rápido del efecto, y duración de acción limitado, mientras que la disminución de la lipofilicidad aumenta la duración de la acción.
Los opioides lipofílicos (fenilpiperidinas) se asemejan a los anestésicos locales en términos de su pKa, peso molecular y coeficiente de partición, lo que podría explicar algunos de los efectos analgésicos de los opioides en el LCR.
Los grupos hidroxilo en la molécula de morfina son responsables de su mayor solubilidad en agua, en comparación con otros opioides. El aumento de la hidrosolubilidad es responsable de la lenta aparición de los efectos y la larga duración de acción de la morfina administrada vía intratecal.
La potencia de los opioides intratecales se incrementa con el aumento de su hidrofobicidad. Por ejemplo, el fentanilo es sólo cuatro veces más potente que la morfina cuando se administra por vía intratecal, pero 100 veces más potente después de la administración sistémica. No se puede aplicar a los mismos fármacos opioides las mismas tasas de potencia sistémica después de la administración intratecal 4 .
La farmacocinética de los opioides intratecales es compleja, sigue un modelo multicompartimental, y está determinada por las propiedades físico-químicas de los opioides y la dinámica del LCR. En la circulación sistémica, el cálculo de los datos farmacocinéticos, tales como el volumen de distribución, supone una mezcla adecuada y el equilibrio de las drogas en todos los compartimentos. Sin embargo, el LCR es un compartimiento mal mezclado, estableciendo gradientes céfalo-caudales de opioides después de su administración en el LCR lumbar. El movimiento craneal de los opioides cuando se inyectan en el líquido cefalorraquídeo es el resultado de:
-
Flujo masivo de drogas en una dirección caudal-craneal.
-
Cambios fluctuantes de presión dentro del tórax, como resultado de la respiración, lo que facilita el flujo del LCR craneal.
-
Expansión y relajación del cerebro, como resultado del ciclo cardiaco. Esto ayuda a crear un retroceso y un movimiento hacia adelante del LCR, con una transferencia neta de los opioides en dirección cefálica 5 .
Los opioides también pueden acceder al tronco cerebral como consecuencia de su absorción en la arteria radicular posterior. Esto ha sido apoyado por estudios de autorradiografía en los primates con morfina radiomarcada (14C) que han demostrado amplia radiactividad en la médula espinal a los 15 minutos y en el centro respiratorio a los 60 minutos post-inyección en la región lumbar.
La farmacocinética de diferentes opioides intratecales lipofílicos e hidrofílicos también ha sido fuente de investigación con modelos animales. Esto ha permitido hacer mejores predicciones de los efectos farmacodinámicos de los opioides por vía intratecal, como la potencia, inicio de la analgesia, duración de la acción y efectos secundarios 5 .
-
Opioides lipofílicos
Utilizando un modelo de cerdo, el grupo de Ummenhoffer ha demostrado que el fentanilo rápidamente se distribuye en los tejidos de la médula espinal (grasa epidural, mielina y sustancia blanca). Esto ha sido atribuido a su alto coeficiente de partición octanol:agua (860), resultando en un alto volumen de distribución en la médula espinal. A pesar de su alta solubilidad en lípidos, sólo el 8% de la molécula queda disponible para su difusión a los receptores en la sustancia gris del asta dorsal medular. La porción restante ionizada está sujeta a “trampas de iones” en los lípidos que no contienen sitios de unión del receptor.
Después de la administración intratecal de fentanilo su concentración en el LCR disminuye rápidamente; aumenta la concentración en el espacio epidural, aumenta rápidamente la concentración plasmática, con los consiguientes efectos sistémicos, y hay una limitada extensión cefálica con analgesia segmentaria 6 .
-
Opioides hidrofílicos
La morfina es el opioide hidrofílico más utilizado y estudiado en la administración intratecal. Es 129-1.737 veces más hidrofílico que el fentanilo con un bajo coeficiente octanol: agua, lo que da lugar a una lenta difusión al espacio epidural. Se une a receptores de alta afinidad en el asta dorsal y tiene una capacidad mucho menor para difundir a sitios como mielina y sustancia blanca de la médula espinal, en comparación con el fentanilo. Esto se traduce en un “volumen de distribución” muy pequeño dentro de la médula espinal y una concentración sostenidamente alta en el LCR. Esto explica su utilidad clínica para analgesia sostenida y la posibilidad de aparición tardía de depresión respiratoria.
Después de la administración de morfina intratecal, la concentración en el LCR se mantiene por largo tiempo, seguido por una disminución gradual después de 12 horas; hay una lenta difusión en el espacio epidural con un retardado aumento de la concentración plasmática. La dispersión cefálica muestra concentraciones detectables a los 30 minutos en las cisternas de LCR; por el contrario, hay una pobre propagación circunferencial en el LCR, alrededor de la médula en relación al punto de inyección 6 .
Bernards y cols, han realizado recientemente una revisión sobre los estudios experimentales en animales desarrollados en los últimos años, en los cuales se obtenían medidas de las concentraciones de los opioides en el espacio epidural, intradural, en la médula espinal y en los tejidos perimedulares, siempre tras su administración espinal. Estos datos, ayudan a entender lo que múltiples ensayos clínicos apuntan sobre el efecto analgésico de los opioides lipofílicos: se debe en parte, si no exclusivamente, a reabsorción plasmática y redistribución hacia los receptores opioides cerebrales 2 , 6 .
Cualquier opioide inyectado vía intratecal, se presupone que producirá parte de su efecto analgésico por un mecanismo espinal directo. La principal diferencia, respecto a la administración epidural, reside en la duración del efecto clínico, la velocidad de redistribución hacia los centros cerebrales y el mecanismo por el cual el fármaco alcanza dichos centros.
En general, los opioides lipofílicos producen una analgesia de corta duración, de 1-3 horas, que los convierte en una mala opción para analgesia posoperatoria tras punción intratecal única, pero útiles en el tratamiento del dolor del trabajo del parto, especialmente en el primer estadio o en el expulsivo. Los efectos adversos supraespinales que producen, aparecen con mayor rapidez que con los opioides hidrofílicos, debido a que las dosis que se deben administrar son relativamente altas y su pico plasmático más precoz. Para intentar explicar las diferencias entre ambos grupos, qué parte de la analgesia observada es espinal o supraespinal, cuándo aparece esta última y si es necesaria para el efecto clínico final alcanzado, compararemos un representante de cada uno de ellos, la morfina y el sufentanilo.
La morfina es un opioide que depositado en el espacio intratecal, a dosis de 100-200 μg, produce una analgesia que puede durar hasta 24 h. Este dato no la convierte en una buena opción para su uso en anestesia espinal en pacientes de cirugía ambulatoria por la alta incidencia de efectos secundarios de duración prolongada, como la retención urinaria. Esta larga duración no es posible conseguirla por vía IV, ni por supuesto con las mismas dosis administradas, lo que demuestra su efecto espinal. Tampoco es fácilmente entendible su duración clínica, cuando la vida media de eliminación del LCR es del orden de 73-140 min, lo que supone un tiempo de estancia máximo de 6-12 horas. La explicación más racional es que el tiempo de persistencia en su biofase medular es mayor que el del LCR, aunque el hecho de ser un fármaco con una progresión rostral muy importante, produce un efecto supraespinal que podría ser el complemento a la analgesia observada de larga duración. Este efecto sinérgico, o aditivo espinal/supraespinal, ha sido comprobado en modelos animales pero es desconocido si ocurre de la misma manera en humanos. Este hecho podría hacer replantear la prohibición del uso sistemático de opioides por vía intravenosa en pacientes que los están recibiendo por vía espinal.
Otro aspecto muy importante es la potencia relativa según su vía de administración: en el compartimento intratecal los opioides lipofílicos se comportan con menor potencia relativa que la morfina, respecto a su administración intravenosa. Cuando se inyecta fentanilo por vía sistémica, es alrededor de 100 veces más potente que la morfina, y el sufentanilo alrededor de 1.000 veces. Cuando se utiliza morfina intratecal en dosis de 100 μg produce una calidad analgésica similar a 10 μg de sufentanilo, pero de mayor duración. Por ello, el sufentanilo intradural es tan sólo 10 veces más potente que la morfina por esta misma vía. La dosis eficaz intratecal de fentanilo es de 25-50 μg, tan sólo el 25-50% de la dosis utilizada de morfina, lo que implica una potencia de alrededor de 2-4 veces mayor. Esta menor potencia relativa de los opioides lipofílicos intratecales se debe probablemente a una baja biodisponibilidad en los receptores específicos medulares, debido a una mayor difusión en los tejidos lipofílicos de dicho compartimento, lo que hace que sean necesarias mayores dosis para conseguir una analgesia adecuada y por ello se detectan mayores picos plamáticos tras su administración por esta vía, que con los opioides hidrofílicos 4 .
La analgesia obtenida tras la administración neuroaxial de un opioide no necesariamente se consigue por un mecanismo medular selectivo. Y si así fuera, para establecerla como de primera línea clínica, debería superar en calidad analgésica a las otras vías de administración que nos podamos plantear como alternativa, o al menos igualarla con menor incidencia de efectos adversos, que son frecuentes a dosis terapéuticas 2 .
La farmacocinética espinal es muy compleja y todavía resta precisar el comportamiento de los opioides tras ser administrados vía neuroaxial, comprobar su lugar específico de acción y sus vías de aclaramiento, su posible efecto sinérgico tras su doble administración (espinal/IV), así como el mecanismo de producción de efectos adversos, su prevención y tratamiento 2 , 6 , 7 .
COMPLICACIONES Y EFECTOS ADVERSOS
Gehling y Tryba publicaron en 2009 un meta-análisis que investigaba los efectos secundarios de la morfina intratecal8. Se evaluaron 28 estudios. Se estratificaron los estudios en los que se utilizó morfina en una “dosis más baja” (< 300 g) y morfina en “dosis más alta” (> 300 g). Esta es una consideración importante, ya que estamos viendo cada vez más utilizar dosis más bajas de morfina con ventaja analgésica. Bajas dosis de morfina comparadas con placebo mostraron asociación con el aumento del riesgo de: náuseas (RR 1,4; 95% CI 1,1-1,7), vómitos (RR 3,1; 95% CI 1,5-6,4), prurito (RR 1,8; 95% CI 1,4-2,2). Altas dosis de morfina comparadas con placebo mostraron un aumento del riesgo sólo de prurito (RR 5,0; 95% CI 2,9-8,6). Náuseas y vómitos no mostraron diferencia comparando altas dosis de morfina y placebo. Curiosamente hubo menos náuseas y vómitos con dosis altas que bajas de morfina. Con relación a depresión respiratoria y dosis bajas de morfina no hubo mayores casos en comparación a placebo con opioides IV. Se hace notar que el poder estadístico de los estudios no era suficiente para estudiar complicaciones graves de baja ocurrencia. Se concluye que el uso de morfina intratecal no hace desaparecer el riesgo de depresión respiratoria aunque aparentemente éste no es mayor que el placebo con opioides IV.
También en 2009, Meylan publicó un meta-análisis sobre los beneficios y riesgos del uso de morfina intratecal como analgesia en cirugía 9 . Se analizaron 27 estudios de pacientes con morfina intratecal en cirugía mayor. Las dosis de morfina iban de 100 a 4.000 µg. El uso de morfina IT mostró una disminución en el consumo de morfina IV. La intensidad del dolor en reposo y en movimiento también se redujo. Este efecto se documentó sobre todo durante las primeras 24 horas después de la cirugía. El uso de morfina IT incrementó dramáticamente el riesgo de depresión respiratoria (OR: 7,86 [1,54-40,3]). Sorprendentemente, la incidencia de náuseas y vómitos no se vio afectada. Este meta-análisis demuestra claramente que la morfina proporciona una analgesia eficaz después de grandes procedimientos quirúrgicos. Sin embargo, existen varias limitaciones en relación con la heterogeneidad de los resultados por el diseño de los estudios. Los autores plantean que considerando el riesgo de efectos secundarios, la duración limitada del efecto analgésico y la posibilidad de utilizar alternativas como los anestésicos locales epidurales, la morfina intratecal no debe ser considerada como gold standard para el control del dolor postoperatorio.
DEPRESIÓN RESPIRATORIA Y OPIOIDES NEUROAXIALES
La gran complicación no deseada del uso de morfina intratecal es la depresión respiratoria. Parece claro que la incidencia de esta complicación es menor que con el uso de opioides IV, pero persiste y no es del todo predecible.
Dosis bajas de opioides intratecales lipofílicos como fentanilo pueden causar una depresión respiratoria precoz (0-1 hora), mientras que opioides hidrofílicos como morfina pueden producir depresión respiratoria de manera temprana o más retardada (hasta 24 h). La depresión respiratoria inducida por morfina aparece entre 3,5 y 12 horas después de la inyección, con un pico a las 6 h. Se han reportado casos demostrados de depresión respiratoria con dosis de 300 µg, sin embargo, hay casos de uso de 5 a 20 mg intratecales sin aparición de la complicación. Esto demuestra la naturaleza impredecible de esta complicación potencialmente grave.
La verdadera incidencia de la depresión respiratoria es desconocida; grandes estudios retrospectivos citan una incidencia de 0,03-7%. Por desgracia, hay una falta de definición correcta del término “depresión respiratoria” en la literatura. En una reciente revisión de 96 artículos publicados en más de 40 años, Ko y cols, encontraron que solo en el 46% se define la depresión respiratoria y en porcentajes mucho menores esta definición está objetivada con monitorización específica. Los factores de riesgo para el desarrollo de la “depresión respiratoria” incluyen la edad avanzada, el uso concomitante de sedantes de acción prolongada, ventilación con presión positiva y la coexistencia de enfermedades respiratorias 10 .
El año 2009 se publicó el resultado de la fuerza de trabajo en opioides neuroaxiales de la Sociedad Americana de Anestesiología: “Guías para la prevención, detección y manejo de la depresión respiratoria asociada a la administración de opioides neuraxiales” 11 . El objetivo del trabajo es mejorar la seguridad y potenciar la calidad de la atención anestésica disminuyendo la incidencia y gravedad de la depresión respiratoria e hipoxemia relacionadas con los opioides neuroaxiales. Además, las directrices están pensadas para reducir la incidencia y la gravedad de los resultados adversos relacionados con la disminución de la frecuencia respiratoria o de las concentraciones de oxígeno (por ej., paro cardiaco, daño cerebral, muerte). Las directrices se centran en el tratamiento de todos los pacientes que reciben opioides epidurales o intratecales en un entorno intrahospitalario (pabellones quirúrgicos, unidades de cuidados intensivos, salas de observación, salas de recuperación posquirúrgica, salas de hospitalización) o ambulatorio (centros de tratamiento ambulatorio). Las normas no son aplicables a los pacientes con dolor crónico o tumoral (excepto aquellos con dolor agudo posoperatorio), pacientes portadores de sistemas implantables de administración de fármacos o pacientes con contraindicaciones para el empleo de opioides epidurales o intratecales. Estas directrices de 2009 incluyen recomendaciones específicas en 4 áreas: 1) identificación de los pacientes con alto riesgo de depresión respiratoria (recomendaciones específicas para una anamnesis y exploración física dirigidas); 2) estrategias preventivas para la depresión respiratoria tras administración de opioides neuroaxiales (recomendaciones para la ventilación con presión positiva no invasiva, elección de fármacos y elección de dosis); 3) detección de la depresión respiratoria y su tratamiento (recomendaciones para la vigilancia de unos adecuados niveles de ventilación, oxigenación y estado de consciencia) y 4) tratamiento de la depresión respiratoria cuando esta ocurre (recomendaciones para el oxígeno suplementario, los fármacos para la reversión y la ventilación con presión positiva no invasiva).
Las recomendaciones se resumen de la siguiente forma 11 :
1. Identificación del paciente con riesgo aumentado de depresión respiratoria
El anestesiólogo debe realizar una evaluación preoperatoria que al menos incluya:
-
Identificar signos y síntomas o historia de apnea del sueño, enfermedades o condiciones coexistentes, uso de fármacos o historia de depresión respiratoria con opioides.
-
Examen físico que incluya signos vitales, evaluación de vía aérea, corazón, pulmones y función cognitiva.
2. Prevención de depresión respiratoria posterior a administración de opioides neuraxiales
Ventilación con presión positiva no invasiva:
-
El paciente con apnea del sueño que utiliza ventilación con presión positiva no invasiva, debe traer su equipo para la hospitalización.
Elección del fármaco:
-
La inyección única de un opioide neuroaxial puede ser utilizado con seguridad en lugar de opioides parenterales, sin alterar el riesgo de depresión respiratoria o hipoxemia.
-
La inyección única de fentanilo o sufentanilo puede ser una alternativa segura a la inyección única de morfina neuraxial.
-
Cuando sea clínicamente apropiado, la administración epidural de morfina de liberación prolongada, en vez de morfina de liberación inmediata, puede ser utilizada, aunque pueda significar una extensión en el periodo de monitorización.
-
La infusión continua de opioides epidurales es preferible al uso de opioides parenterales para disminuir el riesgo de depresión respiratoria.
-
Cuando sea clínicamente apropiado, la administración epidural de dosis adecuadas de fentanilo o sufentanilo puede ser utilizada en vez de morfina o hidromorfina epidural, sin aumentar el riesgo de depresión respiratoria.
-
La duración de la monitorización dependerá de las características farmacocinéticas del opioide utilizado.
-
Morfina o hidromorfina neuroaxial no se debe administrar a pacientes sometidos a cirugía ambulatoria.
Elección de la dosis:
-
Se debe administrar la dosis mínima efectiva de opioides neuroaxiales para minimizar el riesgo de depresión respiratoria.
-
Los opioides parenterales o fármacos sedantes deben darse con precaución a los pacientes que han recibido opioides neuroaxiales.
-
La administración concomitante de opioides neuroaxiales y opioides parenterales, sedantes, hipnóticos o magnesio requiere un mayor control (por ejemplo en intensidad, duración o necesidad de métodos adicionales de control).
3. Detección de la presión respiratoria
Todos los pacientes que reciben opioides neuroaxiales deben ser monitorizados en la ventilación (frecuencia respiratoria, profundidad de la respiración), oxigenación y nivel de conciencia.
Inyección única neuraxial de opioide lipofílico (fentanilo):
-
Monitorizar por un mínimo de 2 horas después de su administración.
-
La monitorización será continua en los primeros 20 minutos y luego cada una hora en las dos horas siguientes.
-
Después de las dos primeras horas la monitorización dependerá del estado clínico del paciente y el uso de otros fármacos.
Infusión continua o PCEA con opioides neuroaxiles lipofílicos:
-
La monitorización se realizará durante todo el tiempo que dure la infusión.
-
La monitorización será continua en los primeros 20 minutos y luego cada una hora en las doce horas siguientes.
-
Entre las 12 y 24 horas la monitorización se realizará al menos cada 2 horas.
-
Después de las 24 horas la monitorización se realizará al menos cada 4 horas.
-
Después de la suspensión de la infusión la duración de la monitorización dependerá del estado clínico del paciente y el uso de otros fármacos.
Inyección única neuroaxial de opioide hidrofílico (morfina):
-
Monitorizar por un mínimo de 24 horas después de su administración.
-
La monitorización será al menos cada una hora en las 12 primeras horas y luego cada dos horas hasta las 24 horas.
-
Después de las 24 horas la monitorización dependerá del estado clínico del paciente y el uso de otros fármacos.
Infusión continua o PCEA con opioides neuroaxiles hidrofílicos:
-
La monitorización se realizará durante todo el tiempo que dure la infusión.
-
La monitorización será cada una hora en las primeras doce horas y al menos cada 2 horas entre las 12 y 24 horas.
-
Después de las 24 horas la monitorización se realizará al menos cada 4 horas.
-
Después de la suspensión de la infusión la duración de la monitorización dependerá del estado clínico del paciente y el uso de otros fármacos.
El aumento de la vigilancia (intensidad, duración o métodos adicionales de control) puede estar justificada en pacientes con mayor riesgo de depresión respiratoria (estado de salud inestable, obesidad, apnea obstructiva del sueño, administración concomitante de opioides o hipnóticos por otras rutas, edad avanzada).
4. Manejo y tratamiento
Oxígeno suplementario:
-
El oxígeno suplementario debe estar disponible para los pacientes que reciben opioides neuroaxiales.
-
El oxígeno suplementario debe ser administrado a los pacientes con alteración del nivel de conciencia, depresión respiratoria o hipoxemia y debe ser continuo hasta que el paciente está alerta y la depresión respiratoria o hipoxemia no estén presentes.
-
El uso rutinario de oxígeno puede aumentar la duración de los episodios de apnea y puede dificultar la detección de atelectasia, apnea transitoria, e hipoventilación.
Fármacos antagonistas:
-
Se debe mantener un acceso vascular en los pacientes.
-
Los fármacos antagonistas deben estar disponibles para todos los pacientes que presenten una depresión respiratoria significativa tras la administración de opioides neuroaxiales.
-
En presencia de depresión respiratoria severa se deben iniciar las maniobras de reanimación apropiadas al caso.
Ventilación a presión positiva no invasiva:
-
La ventilación a presión positiva no invasiva puede ser considerada para mejorar la ventilación.
-
Se debe iniciar ventilación a presión positiva no invasiva frente a una frecuente o severa obstrucción de la vía aérea o hipoxemia.
CONCLUSIÓN
El uso de opioides neuroaxiales es eficaz para disminuir el dolor postquirúrgico al menos al mismo nivel que el uso de AINEs u opioides parenterales, a un costo significativamente menor. Existe evidencia que demuestra una disminución en el consumo de opioides parenterales de rescate, sin encontrarse una disminución en las complicaciones secundarias.
Pasados más de 30 años del uso de morfina intratecal aun no se ha podido establecer una dosis óptima o una curva dosis/respuesta que relacione efecto clínico y complicaciones no deseadas. Sin embargo, dosis bajas de morfina (< 300 µg en dosis única) se pueden considerar seguras si se siguen las indicaciones de monitorización y manejo establecidas.
REFERENCIAS
- Hindle A. Intrathecal opioids in the management of acute postoperative pain. Continuing Education in Anaesthesia. Critical Care & Pain. Volume 8, Number 3. 2008
- Bernards C. Understanding the physiology and farmacology of epidural and intrathecal opiods. Best Practice and Reseach Clinical Anaesthesiology 2002; 16: 489-505.
- Escobar J. Capítulo Opioides en anestesiología. Anestesiología Clínica. 3ª Ed. Edit Mediterráneo. 2008.
- Mugabure B, Echaniz E, Marín M. Fisiología y farmacología clínica de los opioides epidurales e intratecales. Rev Soc Es Dolor 2005; 12: 33-45.
- DiChiro G, Hammock M, Bleyer W. Spinal descent of cerebrospinal fluid in man. Neurology 1976; 26: 1-8.
- Bernards C. Recent insights into the pharmacokineticsof spinal opioids and the relevance to opoid selection. Curr Op Anaesth 2004; 17: 441-447.
- Gwirtz K. The Safety And Efficacy of Intrathecal Opioid Analgesia for Acute Postoperative Pain: Seven Years’ Experience with 5969 Surgical Patients at Indiana University Hospital. Anesth Analg 1999; 88: 599-604.
- Gehling M, Tryba M. Risks and side-effects of intrathecal morphine combined with spinal anaesthesia: a meta-analysis. Anaesthesia, 2009; 64: 643-651.
- Meylan N. Benefit and risk of intrathecal morphine without local anaesthetic in patients undergoing major surgery: meta-analysis of randomized trials. Br J Anaesth 2009; 102: 156-167.
- Ko S, Goldstein D, Van DenKerkhof E. Defnitions of “respiratory depression” with intrathecal morphine postoperative analgesia: a review of the literature Can J Anaesth 2003; 50: 679-688.
- Horlocker T. Practice Guidelines for the Prevention, Detection, and Management of Respiratory Depression Associated with Neuraxial Opioid Administration. An Updated Report by the American Society of Anesthesiologists Task Force on Neuraxial Opioids. Anesthesiology 209; 110: 218-230.