Rafael Lima Linares 1 ,*, Arturo Vazquez Peralta 2 , Edgar Garcia Cruz 3 , Marco Antonio Montes de Oca Sandoval 4 , Edgar Hernández Rendon 5 , Antonio Fernández Reyes 6
Recibido: 15-06-2021
Aceptado: 21-08-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 907-911|https://doi.org/10.25237/revchilanestv5007101530
PDF|ePub|RIS
Contralateral femoral arterial hypoperfusion on VA ECMO cannulation. An unusual complication
Abstract
Within the spectrum of thromboembolic venous diseases is pulmonary embolism (PE), which has been reported with an overall mortality of 68% for its massive variant and identified as the main origin of pulmonary hypertension and right ventricular failure as subsequent complications. For the treatment of massive PE only 3 support and therapeutic options had been described; Surgical pulmonary embolectomy, systemic thrombolysis and some endovascular techniques. In this case, we will report a fourth support option with the Veno-Arterial ECMO system in a 57-year-old female patient.
Resumen
Dentro del espectro de las enfermedades tromboembólicas venosas se encuentra el Embolismo pulmonar (EP) del cual se ha reportado una mortalidad global del alrededor del 68% para su variante masiva. Se encuentra identificando como el principal generador de hipertensión pulmonar y falla cardiaca derecha como efectos posteriores a su aparición. Para el tratamiento del EP masiva solo se habían descrito 3 opciones de soporte y terapéuticas con mayor evidencia científica; la Embolectomía pulmonar quirúrgica, trombolisis sistemica y algunas técnicas endovasculares. En este caso reportamos una cuarta opción de soporte con sistema de Oxigenación con Membrana Extracorpórea en su modalidad Veno-Arterial (ECMO V-A) en una paciente femenina de 57 años en México.
En 2019 la Sociedad Europea de Cardiología describió en la guía de diagnóstico y tratamiento del EP agudo una incidencia anual de 39-115 por cada 100.000 habitantes, causando hasta 300.000 muertes por año en Estados Unidos; 34% de estas muertes ocurren durante las primeras horas del evento agudo o previo al inicio del tratamiento y solo 7% son diagnosticados previo al desenlace de muerte, de aquí la importancia de la instalación de una terapéutica de soporte o terapia puente en fase temprana de la enfermedad[1].
Dentro de los factores de riesgo más importantes para desarrollar Embolismo pulmonar se encuentra el antecedente de cirugía laparoscópica y pancreatitis aguda[2]. Herath en el modelo hipercoagulable de la pancreatitis lo explica, caracterizado por un cuadro clínico con niveles elevados de fibrinógeno y dímero D, activación de la precalcitonina por medio de Tripsina que concluye en la activación del sistema de cininas y factor XII[3].
La oxigenación con membrana extracorpórea veno-arterial (ECMO VA) provee de un soporte cardiopulmonar para pacientes con choque cardiogénico multifactorial con falla uni o biventricular y/o disfunción pulmonar, choque poscardiotomía, como terapia puente de recuperación miocárdica, soporte mecánico circulatorio para trasplante cardiaco; en el contexto de los avances en tecnología de membranas, bombas, estrategias de canulación percutánea y la adecuada selección de pacientes[4].
A pesar de una implementación rápida de terapias de reperfusión finales algunos pacientes con TEP masiva con inestabilidad hemodinámica y de alto riesgo para recibir manejo quirúrgico no presentan mejoría clínicamente significativa. Restaurar la oxigenación tisular, mejorar el estado hemodinámico y disminuir la sobrecarga del ventrículo derecho en estos casos solo es posible con oxigenación extracorporea[5].
Paciente femenino de 52 años de edad sin enfermedades crónico degenerativas se presenta al departamento de urgencias con cuadro clínico sugestivo de pancreatitis y colecistitis aguda, TAC que destaca proceso inflamatorio pancreático clasificación Balthazar E, con imágenes sugestivas de necrosis de hasta 50% aproximadamente del cuerpo del páncreas, los niveles de Lipasa se encontraron en 295 U/L y los niveles de amilasa en 466 U/L, las enzimas hepáticas se encontraron también elevadas con un TGP 143 U/L, un GGT 205 U/L, y un DHL 1.520.
Se decide realizar Colecistectomía laparoscópica sin incidentes reportados, pasando a terapia intensiva para manejo médico de la pancreatitis, ingresando con tendencia a la alcalosis metabólica, manifestando un desequilibrio hidroelectrolítico y descontrol metabólico con pobre respuesta al tratamiento médico. Veinticuatro horas posteriores al ingreso a terapia intensiva era evidente la presencia de disnea, diaforesis e inestabilidad hemodinámica, existía elevación de troponina I 461 pg/ml, Dímero D 4.402 ng/ml, DHL 1.739, CPK 420, PNB 222 pg/ml, se realiza un rastreo ecocardiográfico con datos de TEP, signo de McConell positivo +, dilatación de AD y VD, PSAP 62 mmHg, FEVI 74%, TAPSE 15, tiempo de aceleración pulmonar 42 ms.
Dentro del soporte inicial se inicia apoyo mecánico ventilatorio con metas de protección pulmonar, uso de vasopresores tipo norepinefrina y vasopresina, inotrópico dobutamina más inodilatador tipo levosimendán a dosis respuesta, presentó dos eventos de taquicardia ventricular manejada con desfibrilación eléctrica saliendo a taquicardia sinusal, por lo que se decidió la colocación en ECMO en su modalidad veno-arterial de forma urgente con accesos venoso y arterial femorales.
Durante el proceso de canulación, la arteria femoral se encontró pequeña, con dificultad para colocar la cánula arterial situación que lleva a la colocación de catéter de perfusión distal de forma inmediata, ya con el soporte del equipo ECMO y con metas de pulsatilidad, se pasa a trombólisis pulmonar in situ con mejora significativa, logrando la disminución de vasopresores y se mantiene con dobutamina y levosimendán.
Veinticuatro horas posteriores al inicio de la terapia se presenta compromiso en perfusión de pierna contralateral a la que se encuentra canulada por lo que se pasa a exploración vascular encontrando trombos pequeños, se evidencia flujo lento arterial, por el tamaño de las arterias femorales se sospecha competencia de flujos entre el anterógrado aórtico y el retrogrado de ECMO por lo que se coloca un catéter de perfusión distal en la pierna contralateral con mejoría sustancial.
Tras 5 días de soporte hemodinámico, presenta mejoría hemodinámica y ecocardiográfica lográndose retiro exitoso de ECMO, con adecuada evolución de la patología abdominal, egresando de terapia intensiva 15 días después de retiro de ECMO con evolución cardiopulmonar y abdominal satisfactorias.
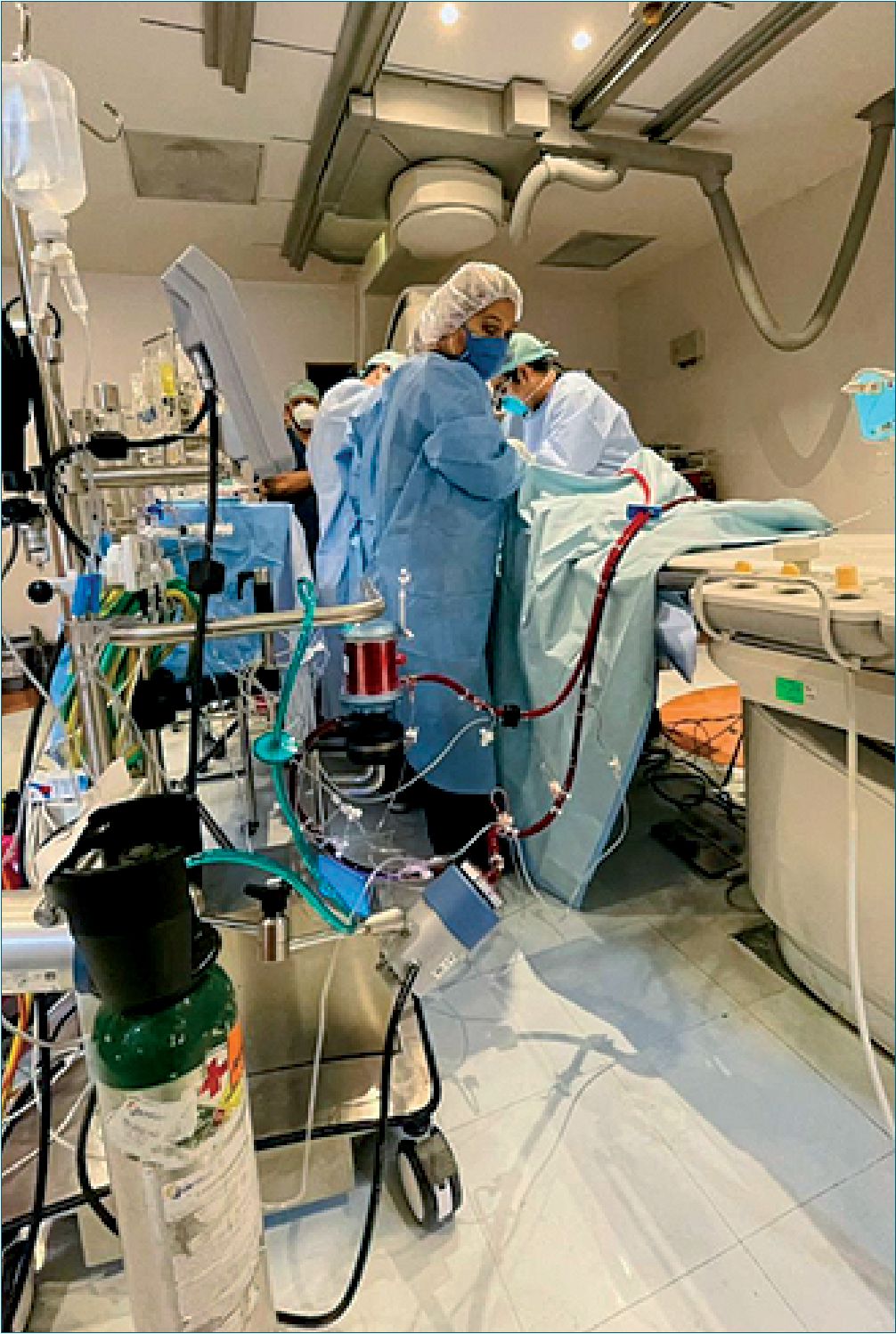
Figura 1. Trombólisis pulmonar con soporte ECMO venoarterial.
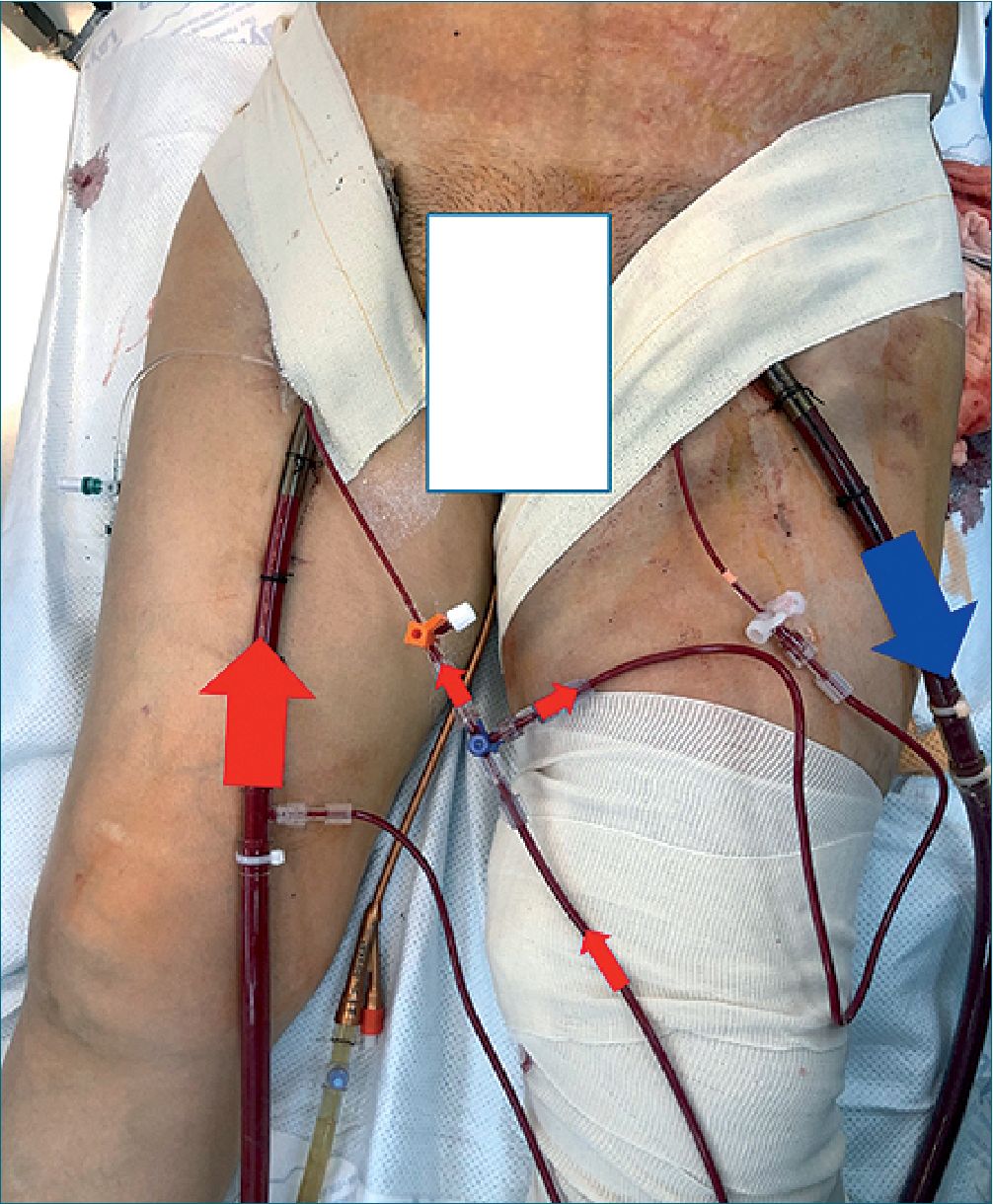
Figura 2. Accesos vasculares en soporte ECMO VA con catéteres de perfusión distal en ambas extremidades desde la cánula arterial.
Se trata de un paciente femenino de 52 años que presento una complicación considerada como rara en el posoperatorio de una cirugía abdominal además del cuadro grave derivado de la pancreatitis inicial, el uso de ECMO en el escenario de tromboembolia pulmonar es una herramienta sumamente útil. A diferencia del ventrículo izquierdo, el ventrículo derecho tiene un beneficio directo al retirar gran parte del drenaje venoso desde la aurícula derecha hacia el dispositivo, logrando con esto, la descompresión directa de dicho ventrículo y su recuperación posterior.
El soporte con ECMO se posiciona día con día como una herramienta útil, terapia puente segura y eficaz para los pacientes con choque cardiogénico por EP masivo en manos expertas. La implementación de este sistema extracorpóreo en fases tempranas de la patología nos concede un periodo de tiempo para que el ventrículo derecho se recupere paralelamente a la ejecución de terapias endovasculares, trombólisis sistémica o trombo embolectomía quirúrgica, disminuyendo la mortalidad de una entidad clínica que anteriormente podría considerársele letal de no contar con este soporte.

Video 1. Evolución Ecocardiográfica.
En la actualidad, el auge tecnológico de los dispositivos bio- médicos en el campo de ECMO VA y VV, ha tenido un gran impacto en la sobrevida de los pacientes críticamente enfermos y su manejo. El progreso de esta terapéutica en nuestro país se ha visto preso por cuestiones económicas, dado que sigue siendo una terapia de alto costo y por pobres políticas de salud pública, que limitan la expansión de uso de este tipo de terapia, en el sistema de salud privado en México, aun los seguros de gastos médicos suelen tener mucha resistencia a la cobertura de esta tecnología. Resulta vital la investigación, crecimiento y desarrollo de evidencia científica mexicana, para ofrecerle a nuestros pacientes una alternativa de tratamiento y esperanza de vida. El ECMO es una terapia de uso habitual para pacientes con falla cardiovascular o respiratoria grave, utilizada mayormente en Norteamérica y Europa, sin embargo, en México es relativamente nueva, con muy pocos centros especializados[14].
Como ya lo destaco la Sociedad Europea de Cardiología para EP los resultados en la aplicación de ECMO VA en pacientes de alto riesgo como soporte rápido a corto plazo son directamente proporcionales a la experiencia del centro ECMO y a la adecuada selección del paciente[1]. En el marco de esta guía otorga una clase de recomendación y nivel de evidencia IIB para considerar la asistencia de ECMO VA como tratamiento en fase aguda de la EP, en combinación con embolectomía quirúrgica o tratamiento dirigido por catéter, en colapso circulatorio refractario o paro cardíaco.
Durante el soporte con ECMO se presentó una complicación considerada sumamente rara: el compromiso vascular arterial de la pierna contralateral a la usada para la canulación. Este evento se asocia a que las arterias de la paciente son de tamaño muy pequeño, esto ya que tras realizar la exploración vascular sin obtener trombos que explicaran las manifestaciones clínicas de dicha complicación se concluyó por consenso del grupo, que la competencia de flujo retrogrado del ECMO (presión del flujo de aproximadamente 200 mmHg) contra el flujo anterógrado aórtico en el contexto de vasos femorales arteriales sumamente pequeños derivo en la perfusión inadecuada de la pierna contralateral a la usada para canular. La resolución, aunque sencilla, requierio de la pericia y experiencia que se obtiene de un Equipo de ECMO integrado por diversas disciplinas, teniendo un consenso de la colocación de un catéter de perfusión distal en la pierna no canulada directamente de la cánula de retorno del ECMO con lo que se presentó mejoría inmediata, una vez retirado el ECMO la perfusión distal se mantuvo normal como era esperado.
Tabla 1. Estudios en EP aguda con soporte ECMO
| Referencia | Población | Tiempo promedio de ECMO | Complicaciones | Supervivencia |
| Maggio y cois (2007)[7] | ECMO VA (n = 19) ECMO
VV (n = 2) |
5,4 dias | Hemorragia intracraneai (n = 4)
Extracción de cánuia arteriai (n = 1) |
62% |
| Munakata y cois (2012)[8] | ECMO VA (n = 10) | 23 h | Encefaiopatía hipóxico isquémica (n = 2)
Hemorragia aiveoiar (n = 1) |
70% |
| Maj y cois (2014)[9] | ECMO VA (n = 6) | 4,5 días | Sangrado en sitio de canuiación (n = 3) | 33% |
| Swol y cois (2016)[10] | ECMO VA (n = 5) | 48,6 h | Sangrado mayor (n = 2) | 40% |
| George y cois (2018)[11] | ECMO VA (n = 32) | No reportado | Hemorragia intracraneai (n = 1)
Sangrado mayor (n = 11) |
53% |
| Kmiec y cois (2020)[12] | ECMO VA (n = 46) ECMO
VV (n = 29) |
No reportado | No reportado | 47% |
| Guiiani y cois (2020)[13] | ECMO VA (n = 17) | 86 h | Sangrado mayor (n = 4) | 76% |
Abreviaciones: ECMO VA, ECMO veno-arterial, ECMO VV, ECMO veno-venoso.
La embolectomía quirúrgica o la terapia endovascular por cateterismo percutáneo debe considerarse como alternativa para la terapia trombolítica de rescate en pacientes que se deterioran hemo dinámicamente (Clase IIa). En una evaluación y revisión sistematizada de la literatura realizada por Corsi y cols en 2019 analizaron las complicaciones relacionadas con ECMO y la mortalidad a los 90 días para 17 pacientes con EP masiva tratados con ECMO en un centro de atención terciaria; donde el tiempo de duración de ECMO fue de 4 días, la supervivencia a 90 días fue del 47%, dentro de las complicaciones relacionadas con ECMO el 88% (n = 15) sufrieron en su estancia en UCI hemorragias moderadas-severas (escala de GUTO < 2), 76% (n = 13) recibieron terapia de reemplazo renal y 2 pacientes presentaron isquemia arterial en extremidades pélvicas que desenlazaron en amputaciones del miembro afectado[5].
Al-Bawardy y cols[6] reportaron su experiencia en una serie de 13 casos con diagnóstico de embolismo pulmonar sometidos a ECMO VA en 2012, todos los pacientes presentaron dilatación e hipocineacia de ventrículo derecho, la duración media del ECMO VA fue de 5,5 días, mortalidad a 30 días de 31% y al año de 54%.
En este paciente el monitoreo ecocardiográfico es esencial desde la valoración inicial, durante la evolución del paciente y el retiro del soporte. Enfocada principalmente sobre la estructura de las cavidades derechas, parámetros hemodinámicos como presión de la arteria pulmonar, TAPSE, fracción de acortamiento del ventrículo derecho y dimensiones de la aurícula derecha y del ventrículo derecho, así como el signo ecocardiográfico de McConell patognomónico del embolismo pulmonar. Durante los días que estuvo soportada, la paciente presento discinesia del septum interventricular con hiperrefringencia de esta zona aunada a deterioro hemodinámico, lo que hizo sospechar que hubiera un sustrato isquémico miocárdico lo cual se descartó por medio de una coronariografía realizada con el soporte hemodinámico con ECMO. La evolución posterior fue satisfactoria con recuperación miocárdica suficiente para permitir el retiro exitoso del dispositivo y el manejo posterior de la patología de base (pancreatitis isquémica) y sepsis abdominal.
La identificación rápida de fenómenos anormales por medio de ecocardiografía como dilatación del ventrículo derecho con radio VD/VI basal > 1 con zonas hipocinéticas, TAPSE < 16 y aplanamiento del septum interventricular asociado a elevación de NT pro-BNP, dímero D ajustado por edad, troponina I e índice de severidad de Embolismo pulmonar clase III o IV en el contexto de una TEP masiva con inestabilidad hemodinámica debería considerarse como indicadores para la colocación de ECMO VA de manera temprana como también lo observaron en el departamento de respuesta para EP del Hospital General de Boston[5].
Actualmente, nos encontramos ante la falta de evidencia científica que respalde el impacto positivo del empleo de ECMO VA en la supervivencia de estos pacientes.
ECMO venoarterial es como tal, un soporte ventricular para el ventrículo derecho, en el contexto de tromboembolia pulmonar es una herramienta de gran valor para el rescate de pacientes que presentan esta complicación potencialmente catastrófica, tanto como para puente a recuperación miocárdica como para la realización de procedimientos intervencionistas (trombolisis, aspiración del trombo, etc.) con mayor seguridad. Su uso no está exento de complicaciones que podrán ser manejadas y resueltas de mejor forma conforme el grupo que maneja este soporte tenga más experiencia en su uso. En este caso esta experiencia se encuentra avalada por ser un grupo de especialistas multidisciplinarios enfocados en el tratamiento con ECMO de diversas patologías y entrenado en diversas partes del Mundo, situación que aumenta significativamente la probabilidad de un desenlace satisfactorio sin compromiso a largo plazo relacionados con el uso de este soporte.
Referencias
1. Stavros V. Konstantinides, Guy Meyer, Cecilia Becattini, Hector Bueno, Geert-Jan Geersing. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). European Heart Journal. 2020. 41, 543-603
2. Blom JW, Doggen CJ, Osanto S, Rosendaal FR. Malignancies, prothrombotic mutations, and the risk of venous thrombosis. JAMA. 2005; 293:715-722 https://doi.org/10.1001/jama.293.6.715
3. B Herath. SP Pahalagamage. Pulmonary Embolism in Acute Pancreatitis: A Rare but Potentially Lethal Complication. Journal of vasculitis. 2016. 2:4 https://doi.org/10.4172/2471-9544.100118
4. Lima Linares R, Guerrero Gutiérrez M, Vázquez Peralta A, Pérez Nieto R, Zamarrón E. Oxigenación con membrana extracorpórea. Revista Chilena de Anestesia. 2021; 50: 314-329 https://doi.org/10.25237/revchilanestv50n02-07
5. F. Corsi, G. Lebreton, N. Bréchot, G. Hekimian. Life-threatening massive pulmonary embolism rescued by venoarterial-extracorporeal membrane oxygenation. Critical Care. 2017. 21, 76. https://doi.org/10.1186/s13054-017-1655-8
6. Rasha Al-Bawardy, K Rosenfield, J Borges, N. Young, M. Albaghdadi, R. Rosovsky. Extracorporeal membrane oxygenation in acute massive pulmonary embolism: a case series and review of the literature. Journal of Perfusion. 2018. 1-7. https://doi.org/10.1177/0267659118786830
7. Maggio P, Hemmila M, Haft J, Bartlett R. Extracorporeal life support for massive pulmonary embolism. J Trauma. 2007;62(3):570-6 https://doi.org/10.1097/TA.0b013e318031cd0c
8. Munakata R, Yamamoto T, Hosokawa Y, Tokita Y, Akutsu K, Sato N, Murata S, Tajima H, Mizuno K, Tanaka K. Massive pulmonary embolism requiring extracorporeal life support treated with catheter-based interventions. Int Heart J. 2012;53(6):370-4. https://doi.org/10.1536/ihj.53.370
9. Maj G, Melisurgo G, De Bonis M, Pappalardo F: ECLS management in pulmonary embolism with cardiac arrest: which strategy is better? Resuscitation 2014;85(10):e175-76. https://doi.org/10.1016/j.resuscitation.2014.03.309
10. Swol J, Buchwald D, Strauch J, Schildhauer TA. Extracorporeal life support (ECLS) for cardiopulmonary resuscitation (CPR) with pulmonary embolism in surgical patients – a case series. Perfusion. 2016;31(1):54-59 https://doi.org/10.1177/0267659115583682
11. George B, Parazino M, Omar HR, et al. A retrospective comparison of survivors and non-survivors of massive pulmonary embolism receiving venoarterial extracorporeal membrane oxygenation support. Resuscitation. 2018;122:1-5. https://doi.org/10.1016/j.resuscitation.2017.11.034
12. Kmiec L, Philipp A, Floerchinger B, et al. Extracorporeal membrane oxygenation for massive pulmonary embolism as bridge to therapy. ASAIO J. 2020;66(2):146-152. https://doi.org/10.1097/MAT.0000000000000953
13. Guliani S, Das Gupta J, Osofsky R, et al. Venoarterial extracorporeal membrane oxygenation is an effective management strategy for massive pulmonary embolism patients. J Vasc Surg Venous Lymphat Disord. 2020 https://doi.org/10.1016/j.jvsv.2020.04.033
14. Linares, R. L., Gutiérrez, M. A. G., Peralta, V., Nieto, A. P., Orlando, R., Zamarrón-López, E. I., … & Gutiérrez, R. D. G. (2021). Oxigenación con membrana extracorpórea. Rev Chil Anest, 50, 314-329. https://doi.org/10.25237/revchilanestv50n02-07

 ORCID
ORCID