Diego Fernando Rincón Flórez MD. 1 , Jorman Harvey Tejada Perdomo MD. 2 , Jhon Jairo Rodríguez MD. 3 , Jesús David Chaves Pineda MD. 4 ,*.
Recibido: 25-02-2021
Aceptado: 12-06-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 912-917|https://doi.org/10.25237/revchilanestv5008101043
PDF|ePub|RIS
Cerebral blood flow and cerebral metabolic activity. A look from anesthesiology
Abstract
The human brain constitutes only 2% of the total weight of the adult, however, given the large consumption of oxygen it demands, it requires more energy than any other organ to carry out its functions. The relationship between cerebral blood Flow (CBF) and cerebral metabolic rate (CMR) is complex and is controlled by several mechanisms that respond both to local intrinsic metabolic needs, as well as external factors such as blood pressure, carbon dioxide (CO) concentration, O tension, changes in temperature, neural factors, and medications. This article aims to present with precision the aspects related CBF and CMR, explain the factors that influence their regulation, illustrate the effects exerted by some of the main drugs in anesthesia and the impact on the relationship of CMR and CBF.
Resumen
El cerebro humano constituye solo el 2% del peso total del adulto, sin embargo, dado el gran consumo de oxígeno que demanda requiere más energía que cualquier otro órgano para llevar a cabo sus funciones. La relación del flujo sanguíneo cerebral (FSC) y la tasa metabólica cerebral (TMC) es compleja y está controlada por varios mecanismos que responden tanto a las necesidades metabólicas intrínsecas locales, así como a factores externos como la presión arterial, la concentración de dióxido de carbono (CO), la tensión de O, cambios de temperatura, factores neurales y medicamentos. Este artículo tiene como fin exponer con precisión los aspectos relacionados con el FSC y la TMC, explicar los factores que influyen en su regulación, ilustrar los efectos que ejercen algunos de los principales medicamentos en anestesia y el impacto sobre la relación de la TMC y el FSC.
El cerebro humano pesa en promedio 1.350 g representando sólo el 2% del peso de un adulto; sin embargo, consume el 15% del gasto cardiaco (750 ml/min) y mantiene un flujo sanguíneo cerebral (FSC) de 50 ml/100 g/minuto[1],[2],[3],[4]. En reposo el cerebro consume oxígeno (O2) a una tasa promedio de 3,5 ml/100 g/min, lo cual representa el 20% del consumo total del organismo. Necesita más energía que cualquier otro órgano, de hecho, el 60% de esta energía se usa como sustrato en las funciones electrofisiológicas (despolarización y repolarización celular, equilibrio electrolítico, transporte y recaptación de neurotransmisores), el resto se consume en actividades de homeostasis celular (soporte de membranas, almacenamiento de neurotransmisores, etc.)[2] (Tabla 1].
La irrigación cerebral depende de las carótidas internas que se ramifican y dan lugar a la circulación anterior, las arterias vertebrales forman la arteria basilar y sus ramificaciones para dar lugar a la circulación posterior; y éstas (arterias carótidas internas y arteria basilar) se conectan para conformar el polígono de Willis (Figura 1),[1] que permite la circulación colateral por medio de 3 pares de arterias (cerebral anterior, media y posterior), las arterias comunicantes anterior y posterior completan el polígono[2].
El drenaje venoso lo realizan tres conjuntos de venas, las venas corticales superficiales que llevan la sangre hacia las venas corticales profundas, de éstas pasa a los senos durales y finalmente drenan a las venas yugulares internas.[1],[2].
La glucosa es el principal recurso de la energía cerebral; ésta no atraviesa libremente la barrera hematoencefálica (BHE), entra al cerebro por un mecanismo de transporte activo vía transportador GLUT 1 y se distribuye en el sistema nervioso central (SNC) por varios transportadores (en los astrocitos GLUT 1, en las neuronas GLUT 3 y en las células microgliales GLUT 5), dichos transportadores sufren una regulación a la alta en condiciones de hipoxia[3].
Tabla 1. Valores fisiológicos normales
Valores fisiológicos normales
| FSC | 50 ml/100 g/min |
| TMC/CMRO2 | 3,5 ml/100 g/min |
| PO2 cerebral venosa | 32 – 44 mmHg |
| SO2 cerebral venosa | 55 – 70% |
FSC (Flujo sanguíneo cerebral); TMC (tasa metabólica cerebral) CMRO2 (consumo metabólico de oxígeno); PO2 (presión de oxígeno); SO2 (saturación de oxígeno). Fuente: Autores.
La producción de energía cerebral se hace por medio de glucólisis a partir de la fosforilación oxidativa de la creatinfosocinasa y de la adenilciclasa. La glucólisis es la vía más rápida para obtener la energía. Cuando hay niveles normales de O2 y de glucosa, ésta última es metabolizada a piruvato. El piruvato de esta reacción entra al ciclo del ácido cítrico y para la producción de energía primero se genera NADH a partir de NAD, la mitocondria utiliza O2 para acoplar la conversión de NADH nuevamente a NAD con la producción de ATP a partir de ADP y fosfatos inorgánicos. Este proceso llamado fosforilación oxidativa forma 3 moléculas de ATP por cada NADH y se obtiene un máximo de 38 moléculas de ATP por cada molécula de glucosa. Esta vía requiere O2 y si no hay O2 la mitocondria no puede regenerar NAD. En ausencia de O2, en los astrocitos se realiza el metabolismo anaerobio de la glucosa para formar lactato y se genera ATP para captar glutamato. El lactato es captado por las neuronas y transformado en piruvato que inicia el ciclo del ácido cítrico, en este proceso se liberan hidrogeniones que causan acidosis y daño cerebral. Por esta vía la producción de energía es más baja (sólo se producen 2 moléculas de ATP por cada molécula de glucosa), siendo insuficiente para las demandas cerebrales[5].
Por otra parte, durante el ayuno prolongado el cerebro usa cuerpos cetónicos que se descomponen en acetil coenzima A (Acetil CoA) para ser oxidada en el ciclo del ácido cítrico, por ello bajo condiciones extremas el cerebro puede producir bajas cantidades de energía a partir de la gluconeogénesis utilizando como sustrato glicerol, glutamina y glicina.3 Con niveles bajos de O2; cae entonces la producción de ATP y se utilizan los depósitos de fosfocreatina hasta agotar el metabolismo anaerobio ocurriendo el cese de la actividad eléctrica cerebral (Figura 2).
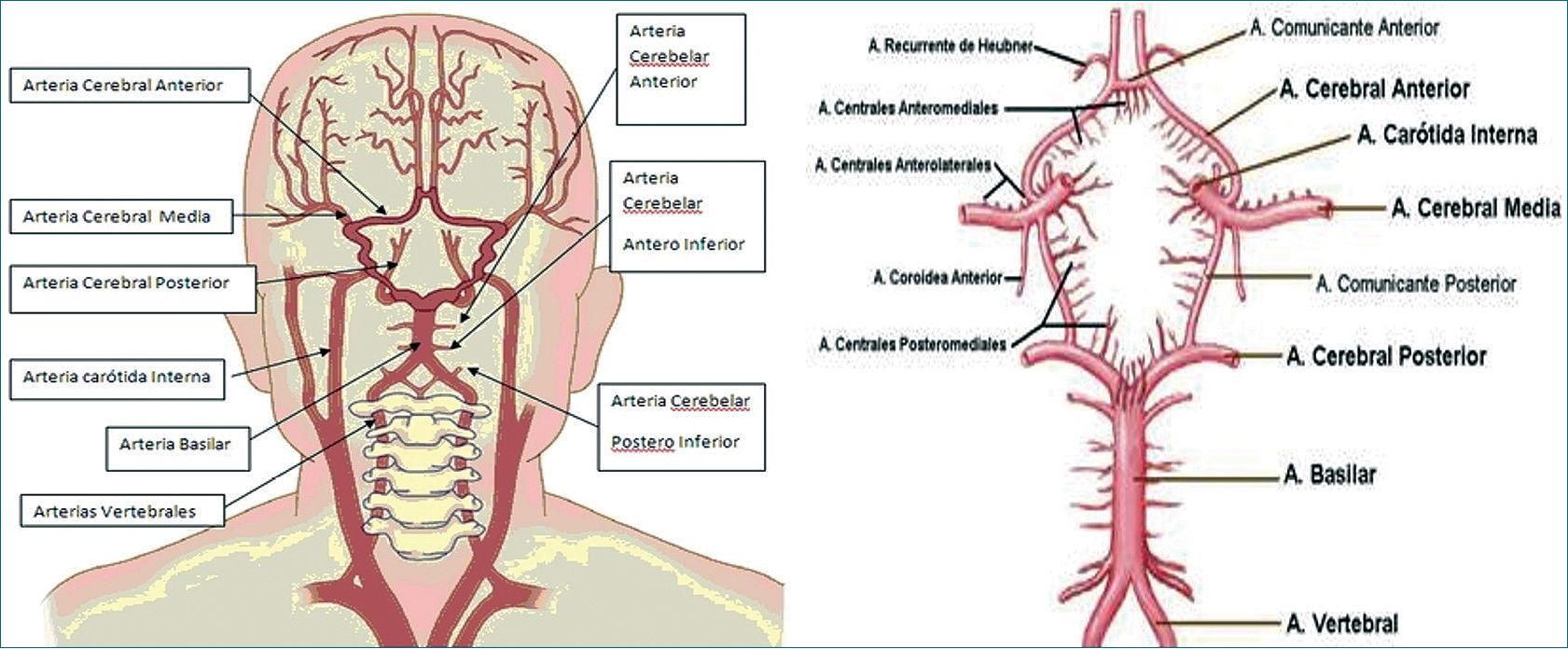
Figura 1. Irrigación cerebral. Modificado de imágenes libres portalesmedicos. com.
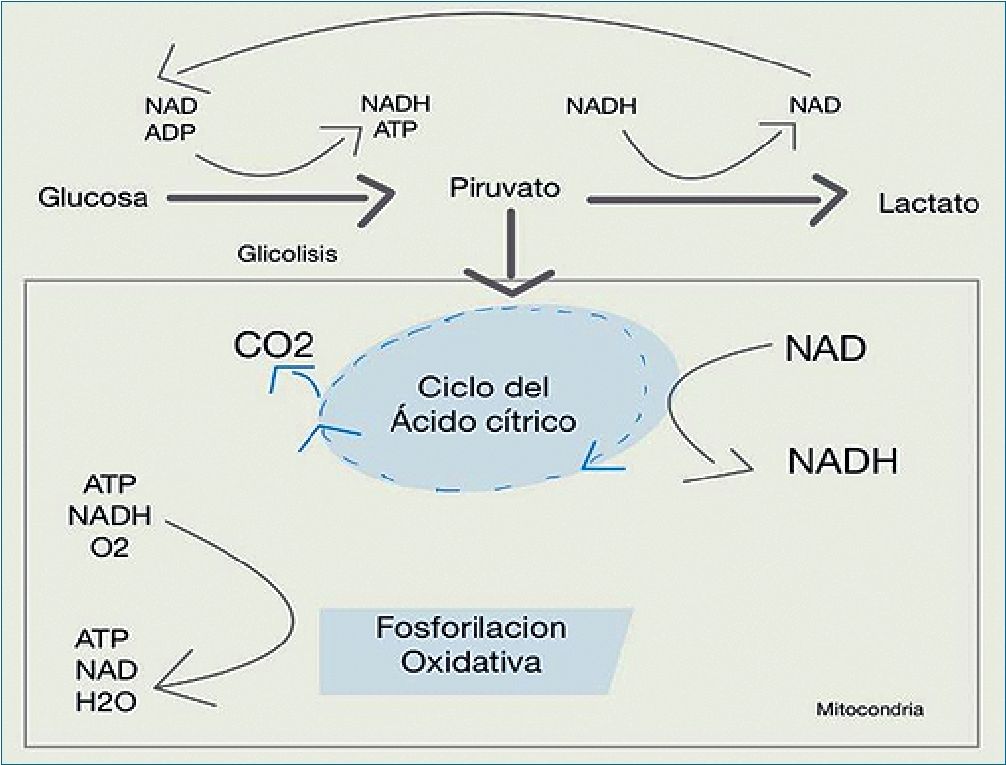
Figura 2. Glucólisis y fosforilación oxidativa. Modificado de Brain me- tabolism the pathophysiology of brain injury and potential benefical agents and technics, tomado de Cotrell and Young’s neuroanesthesia Fifth edition James E. Cottrell, William L. Young, by Mosby, Inc 2010.
En los niños la utilización de la glucosa por el cerebro varía según la edad. En recién nacidos el cerebro consume % partes de la glucosa del adulto, el cerebro en desarrollo también metaboliza lactato, cuerpos cetónicos y ácidos grasos libres. La TMC del adulto se logra a los 2 años de edad y se incrementa hasta el punto máximo a los 8 años, luego decrece para llegar a valores estables a los 20 años.6 Por su parte, el envejecimiento disminuye progresivamente la TMC y el FSC en 15%-20% a los 80 años.
El equilibrio del proceso energético es necesario para reparar las células y barrer moléculas de desecho que son resintetizadas y cumplen procesos anabólicos. Para una función cerebral normal es necesario tener niveles normales de glicemia, ya que el cerebro es especialmente sensible a la hipoglicemia porque no existen depósitos de glucógeno. Cuando se interrumpe el flujo sanguíneo más de 20 segundos hay pérdida de la conciencia, en menos de 3 minutos se consumen las reservas de ATP y sobreviene la lesión neuronal permanente; por ello, las estrategias de prevención del daño neuronal están basadas en el mantenimiento del FSC.
El acoplamiento del ATP y el aporte O2 permite que la TMC se pueda calcular a partir del consumo de O2: CMRO2 (Consumo metabólico regional de O2) = 3,5 ml/100 g/min[4],[6].
El CMRO2 se puede calcular por varias técnicas:
– Determinación de la presión tisular de O2 en la sustancia blanca cerebral o a través de un catéter intraparenquimatoso. Valores menores a 15 mmHg indican hipoxia tisular.
– Diferencia arteriovenosa de O2 y saturación de O2 venosa yugular. Se calcula mediante un catéter de fibra óptica en la vena yugular. Valor normal 65%-70%.
– Oximetría cerebral por espectrometría cercana al infrarrojo. – Doppler transcraneal.
– Tomografía por emisión de positrones (PET)[7].
– Resonancia magnética espectroscópica[3],[8],[9],[10].
La TMC disminuye durante el sueño o sedación y se incrementa durante la activación neuronal; ésta a su vez incrementa el FSC como mecanismo de retroalimentación positiva. La relación del FSC y la TMC es compleja y está controlada por varios mecanismos que responden tanto a las necesidades metabólicas intrínsecas locales, así como a factores externos como la presión arterial, la concentración de dióxido de carbono (CO2),[1],[11] la tensión de O2, cambios de temperatura, factores neurales y medicamentos. A continuación, se presentan los principales factores que modifican el FSC y la TMC.
Existen mecanismos de autorregulación que permiten mantener un FSC constante a pesar de cambios en la presión arterial sistémica, siempre y cuando estos cambios se presenten en un rango entre 50 – 150 mmHg de presión arterial media (PAM). Por debajo de este límite baja el FSC y disminuye la TMC, por tal motivo se debe ser cuidadoso al mantener los límites de la PAM cercanos al rango inferior en algunos pacientes, tales como son aquellos con disminución del gasto cardiaco por determinada patología o situación clínica, por ejemplo, pacientes con falla cardiaca, ya que se pueden presentar fácilmente signos de isquemia que pueden devenir en daño cerebral irreversible[12],[13]. Mientras que por encima de las metas mencionadas aumenta el riesgo de hemorragia y edema cerebral. Cuando se presenta modificación en la presión arterial dentro de las metas establecidas, se combina con los cambios en los vasos sanguíneos que poseen propiedad miogénica intrínseca y les permiten cambios de calibre según el volumen del flujo sanguíneo, garantizando así que los cambios en la presión de perfusión sanguínea sean amortiguados para así mantener un FSC constante[8],[14],[15].
En presencia de acidosis (trauma, hematomas, infecciones) se pierde la autorregulación y aumenta el FSC llevando a un aumento de la PIC por edema que empeora la acidosis.
El FSC se encuentra aumentado en las áreas cerebrales de mayor actividad y es dependiente de la concentración de O2, por ello cuando hay hipoxemia se reduce el FSC. Por otro lado, el aumento de la actividad sináptica hace que se libere glutamato y que concomitantemente lleve a la producción de sustancias que cambian el tono vascular; la activación de receptores metabolotrópicos de glutamato (m GluR) en los astrocitos conduce a la liberación de ácido araquidónico (AA) que posteriormente forma prostaglandinas y ácidos epoxieicosatrienoicos (EETs) que potencian aún más, el aumento del FSC y de la TMC. El óxido nítrico (NO) es un potente vasodilatador cerebral que resulta de éste proceso[16], otros productos locales del metabolismo como el potasio (K+), el hidrógeno (H+), el lactato, la adenosina y el ATP también tienen efecto directo sobre el tono vascular[3]. Los nervios liberan otra serie de sustancias como el péptido intestinal vasoactivo (VIP), sustancia P, colecistocinina, somatostatina y péptido relacionado con el gen de la calcitonina que también aumentan el FSC[2].
Los cambios en la presión arterial de dióxido de carbono (PaCO2) también provocan grandes cambios en el FSC por la alteración del pH (El FSC cambia 1 – 2 ml/100 g/min por cada
1 mmHg en el valor de la PaCO2 por fuera del rango normal (35 – 45 mmHg)[2], la hipocapnia causa vasoconstricción y por supuesto disminución del FSC, éste efecto se presenta en pocos minutos al inducir hiperventilación, pero no se debe corregir rápidamente hasta valores normales porque se puede presentar un efecto de rebote que simule un fenómeno de vasoespasmo. Por el contrario, la hipercapnia resulta en vasodilatación y aumento del FSC[17]; por ello, los efectos vasomotores de la hipocapnia y la hipercapnia son atenuados progresivamente por los cambios en los niveles de bicarbonato para intentar normalizar el pH. En la Figura 3 se puede apreciar el efecto de la concentración de PCO2 y la PO2 y su relación con el FSC.
La hipotermia disminuye la TMC y a su vez el FSC. Por cada grado Celsius por debajo de la temperatura normal disminuye 7% la TMC. La hipotermia puede causar supresión completa del electroencefalograma (EEG) entre 18 y 20 °C, a esta temperatura la TMC es menos del 10% comparándolo con la temperatura normal, de allí que la hipotermia controlada sea utilizada en cirugía cardiovascular, en casos de lesión cerebral y en los cuidados posteriores a un paro cardiorespiratorio como medida de neuroprotección en pacientes seleccionados. La hipertermia tiene los efectos opuestos incrementando la TMC y el FSC con efectos tóxicos que llevan a desnaturalización proteica, lo cual se asocia a disfunción cerebral permanente. 2
El hematocrito (Hto) es el principal factor determinante de la viscosidad sanguínea (Hto normal 33%-45%). En pacientes con anemia se disminuye la resistencia vascular (RV) y se incrementa el FSC como respuesta compensatoria por la reducción en la entrega de O2, por su parte el aumento del Hto por encima de 55% puede disminuir el FSC, aunque este efecto no es tan importante dada la presencia de vasodilatación como medida compensatoria[2].
Los vasos sanguíneos cerebrales reciben una rica inervación; en general, presentan inervación sensitiva y autonómica proveniente de las raíces del trigémino, del esfenopalatino y de los ganglios cervicales superiores[2]. El sistema nervioso autónomo influye principalmente sobre los vasos de gran calibre (arterias cerebrales anterior, media y posterior) y las neuronas dopaminérgicas regulan el FSC de manera directa; por ello, un tono simpático aumentado incrementa el FSC y un tono simpático disminuido reduce el FSC entre 5%-10%.
El efecto de los alfa (a) y beta (p) agonistas sistémicos sobre los vasos sanguíneos cerebrales es muy débil, excepto si hay altas concentraciones de catecolaminas o cuando se administran a2 agonistas con efecto central como la dexmetomidina. En el SNC el estímulo p2 adrenérgico causa vasodilatación, mientras que el estímulo a2 causa vasoconstricción.
6.1 Vasodilatadores sistémicos
El nitroprusiato de sodio, la nitroglicerina, la hidralazina, y la adenosina causan vasodilatación cerebral con el aumento consecuente del FSC y del volumen sanguíneo cerebral, por ello no se recomiendan en el paciente neuroquirúrgico pues aumentan la presión intracraneana. Los IECAs no tienen un impacto significativo sobre el FSC[2].
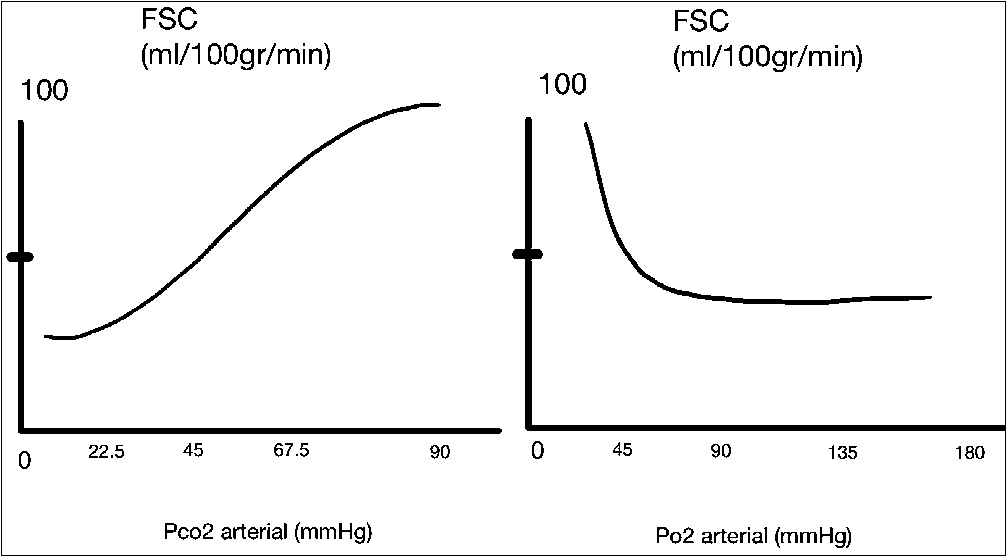
Figura 3. Cambio del FSC relacionado con la concentración de la PCO2 y la PaO2. Puede observarse la relación entre la hipocapnia y la disminución del FSC dado por vasoconstricción. Por otro lado, los niveles de PO2 en valores normales mantienen una influencia poco variable sobre el FSC, solo por debajo de 50 mmHg inducen vasodilatación para permitir un FSC que garantice un adecuado aporte de O2. Modificado de Traumatismo encefalocraneano en pediatría, Rev. chil. pediatr. vol.82 No.3. 2011.
6.2 Vasoconstrictores sistémicos.
El incremento de la PAM puede incrementar el FSC si está por fuera del rango de autorregulación, pero cuando la PAM está dentro del rango (50 – 150 mmHg) los cambios no son significativos. El uso de vasoconstrictores como fenilefrina, noradrenalina, efedrina y dopamina no tienen efecto directo sobre el FSC, su efecto depende de la modificación de la PAM[2].
6.3 Anestésicos, FSC y TMC.
La mayoría de los anestésicos intravenosos disminuyen la TMC y el FSC[2], mantienen la reactividad al CO2 y no tienen mayor efecto sobre la producción del liquido cefalorraquídeo. La ketamina, por su efecto colinérgico aumenta el FSC y tiene la propiedad de disminuir la absorción del líquido cefalorraquídeo (LCR), lo que aumenta la presión del LCR; por ello, es limitado su uso en el paciente con patología neurológica.
En casos de pacientes con aumento de la PIC se ha empleado el propofol en combinación con remifentanil con buenos resultados sobre la preservación de los mecanismos de autorregulación cerebral[18].
Los anestésicos inhalados son vasodilatadores directos y producen cambios del FSC según la dosis, en dosis menores a 1 MAC disminuyen el FSC y por acople deprimen la TMC, en dosis superiores a 1 MAC predomina su efecto vasodilatador aumentando el FSC[2],[4] (Figura 4). En modelos animales, tanto la autorregulación cerebral estática como la dinámica muestran un deterioro en la anestesia con isoflurano en dosis altas (> 1,5%), mientras que el isoflurano bajo (< 1%) en combinación con fentanilo mantiene la autorregulación cerebral[19].
6.4 Relajantes musculares y FSC.
Los relajantes musculares no despolarizantes pueden producir disminución de la PPC por aumento leve de la PIC, debido a la liberación secundaria de histamina que provoca vasodilatación cerebral con aumento del FSC, volumen sanguíneo cerebral y disminución de la PAM; por ello, es fundamental usar relajantes musculares no despolarizantes que no liberen histamina para el manejo del paciente neuroquirúrgico. Por otra parte, la succinilcolina se asocia a un aumento transitorio de la PIC mediado por efecto aferente de los músculos secundario a la producción de fasciculaciones; sin embargo, continúa siendo usada en la práctica habitual en el escenario de secuencia de intubación rápida donde dicho efecto es menor y sopesando riesgo/beneficio en las situaciones de emergencia en pacientes con hipertensión endocraneana se minimiza la posibilidad de broncoaspiración[2].
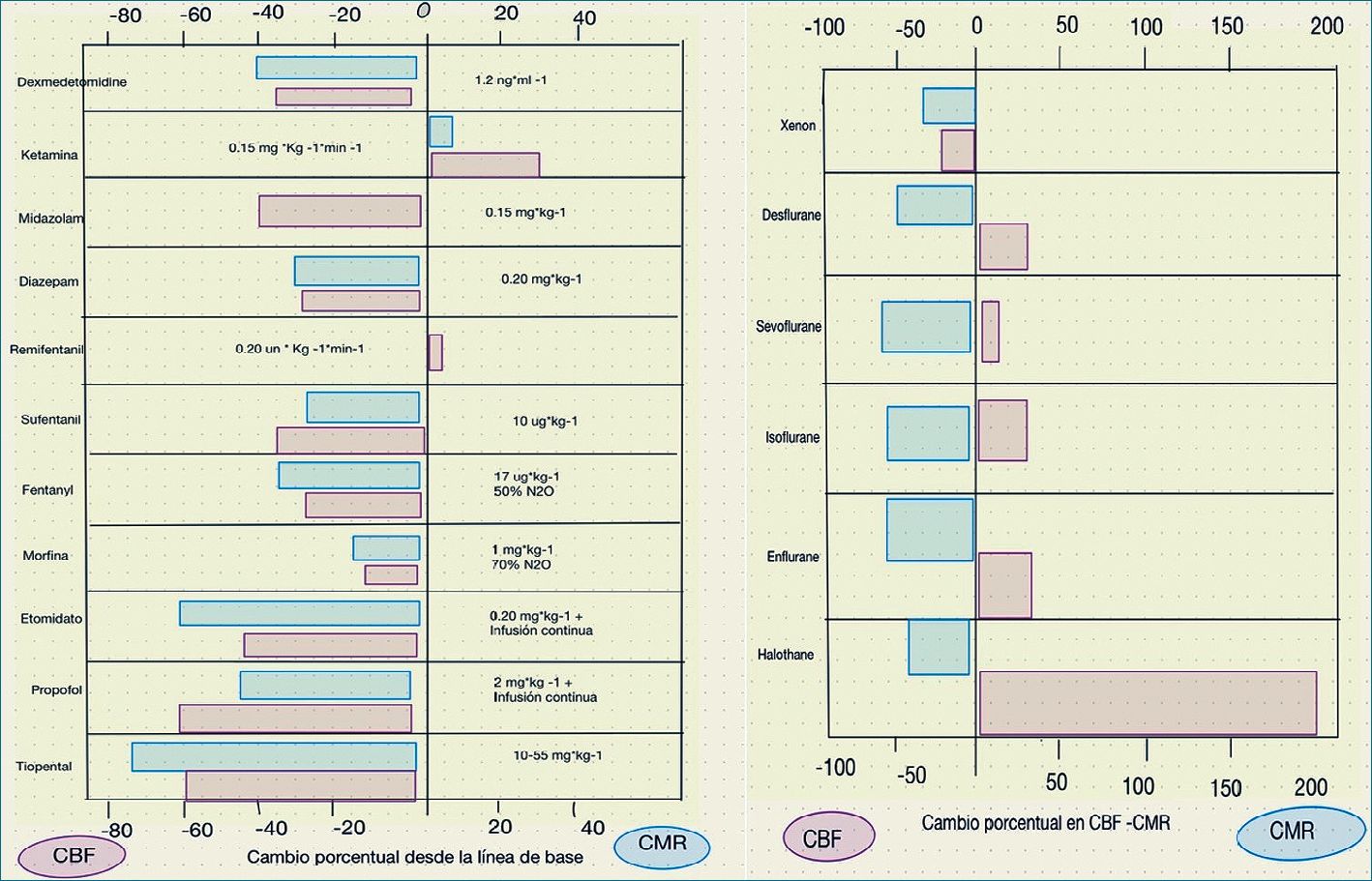
Figura 4. Porcentaje de cambio en el FSC (CBF) y TMC (CMR) con anestésicos venosos (izquierda) e inhalados (derecha). Modificado de: Miller’s anesthesia eight Edition, by Saunders, an imprint of Elsevier Inc, 2015. CMR (Tasa metabólica cerebral), CBF (Flujo sanguíneo cerebral).
La PPC se define como la presión efectiva que mantiene el flujo sanguíneo al cerebro, la cual está regulada, por un lado, por la presión sanguínea que llega desde las arterias carótidas internas la cual se equipara a la presión arterial media (PAM), y por el otro a la PIC. Esto permite calcular una estimación de la PPC por medio de la siguiente fórmula:
PPC = PAM – PIC[20]
La PPC brinda información indirecta del metabolismo cerebral ya que en la práctica es difícil medir en forma directa el FSC, de esta manera se considera que el FSC es directamente proporcional a la PPC e inversamente proporcional a las resistencias vasculares cerebrales (RVC)[20].
La PIC se traduce en la presión existente al interior de la bóveda craneana, que en condiciones normales se encuentra determinada por la suma de las presiones de cada uno de sus componentes: tejido encefálico (80% del componente intracraneano), la sangre que representa 10% y el LCR 10%. El aumento de uno de estos componentes se debe acompañar por una reducción igual de los otros para mantener la PIC en valores normales. Esta capacidad es conocida como compliance cerebral; es decir, la compliance cerebral es igual a la cantidad de unidades de volumen que se necesitan para aumentar la PIC en una unidad de presión en un punto de la curva.
Esto se explica por la Ley de Monroe – Kellie, que determina que si uno de los 3 componentes intracerebrales aumenta o disminuye de volumen, los demás deben compensar el cambio[3].
En condiciones patológicas, un pequeño cambio en el volumen intracraneal causa un gran cambio en la PIC y por lo tanto, una disminución de la PPC.
El objetivo en los pacientes con aumento de la PIC es reducir controladamente el volumen de cada componente intracraneal (posicionamiento de la cabeza para mejorar el drenaje venoso, hiperventilación para disminuir la PaCO2 y el FSC, drenaje de LCR y administración de soluciones hiperosmolares para disminuir el edema, entre otros)[3] (Tabla 2).
El mantenimiento de un adecuado FSC garantiza un metabolismo suficiente para suplir las altas demandas energéticas de este órgano. Durante el acto anestésico es prioridad controlar todos los factores que modifican el metabolismo cerebral, guiados por las metas hemodinámicas establecidas y considerando los diferentes factores que tienen influencia sobre el flujo sanguíneo cerebral para mantener al paciente en homeostasis y evitar complicaciones o secuelas neurológicas permanentes.
• El FSC y la TMC están estrechamente relacionados. Si el FSC se modifica la TMC responde igual.
• La reserva de O2 y de energía cerebral es muy baja, cuando hay disminución del FSC menor a 10 ml/100 g/min, se presenta muerte neuronal temprana.
• El FSC y la TMC están regulados por factores hemodinámicos, químicos, reológicos, térmicos, neurológicos y farmacológicos.
• Los vasodilatadores sistémicos (nitroglicerina, nitroprusiato, hidralazina, calcioantagonistas) modifican la PAM, aumentan el FSC y la PIC.
• Todos los anestésicos inhalados producen cambios del FSC
Tabla 2. Presión de perfusión cerebral y presión intracranea
Presión de perfusión cerebral y presión intracraneana
PPC1 Valor normal 70 – 80 mmHg, cuando es < 40 hay isquemia crítica
(PPC = PAM – PIC)
PIC1 2 3 4 5 6 7 8 Valor normal 7- 12mmHg. Es dinámica, varía con los cambios de calibre de los vasos sanguíneos, cambios de posición,
(PIC = PPC/FSC) esfuerzos, respiración y tos.
1PPC (Presión de perfusión cerebral), PAM (presión arterial media); 2PIC (presión intracerebral), RVC (Resistencia vascular cerebral), FSC (Flujo sanguíneo cerebral). Fuente: Autores.
según la dosis, en dosis menores a 1 MAC disminuyen el FSC y por acople deprimen la TMC, en dosis superiores a 1 MAC predomina su efecto vasodilatador y lo aumentan.
• Los anestésicos intravenosos (excepto ketamina) disminuyen el FSC, la TMC, mantienen la reactividad al CO2 y no tienen mayor efecto sobre la producción de líquido cefalorraquídeo.
Referencias
1. Veenith Tony and David K. Menon, chapter 2 The cerebral circulation, Core Topics in Neuroanaesthesia and Neurointensive Care Applied clinical physiology and pharmacology, Cambridge University Press 2011.
2. Plyush M. Patel, John C. Drummond, BRIAN P. Lemkul. Chapter 17 Cerebral Physiology and the Effects of Anesthetic Drugs, Miller’s anesthesia eight Edition, by Saunders, an imprint of Elsevier Inc, 2015.
3. Chris Taylor, Applied cerebral physiology Neurosurgical, Anaesthesia and intensive care Medicine 8:10, elsevier ltd, 2007. https://doi.org/10.1016/j.mpaic.2007.08.010
4. Rafi Avitsian, Armin Schubert, Anesthetic Considerations for Intraoperative Management of Cerebrovascular Disease in Neurovascular Surgical Procedures, Anesthesiology Clin 25 (2007) 441-463. https://doi.org/10.1016/j.anclin.2007.06.002
5. S. Kass, James E. Cottrell, Baiping Lei, Chapter 1. Brain metabolism the pathophysiology of brain injury and potential benefical agents and technics, Cotrell and Young’s neuroanesthesia Fifth edition James E. Cottrell, William L. Young, by Mosby, Inc 2010. https://doi.org/10.1016/B978-0-323-05908-4.10006-5
6. Robert C. Tasker, Brain vascular and hydrodynamic physiology, semin pediatric surgery, NIH Public Access, Elsevier, 2014.
7. Jayashree Raikhelkar and Peter J. Papadako, chapter 10 Oxygen delivery, oxygen transport, and tissue oxygen tension: critical monitoring in the ICU, Monitoring in Anesthesia and Perioperative Care, Editor David L. Reich, Cambridge University 2011.
8. Paul Nyquist, Management of acute intracranial and intraventricular hemorrhage, Crit Care Med Vol. 38, No. 3, 2010. https://doi.org/10.1097/CCM.0b013e3181d16a04
9. M. ter Laan, Sympathetic regulation of cerebral blood flow in humans: a review, ,British Journal of Anaesthesia 111 (3): 361-7 (2013). https://doi.org/10.1093/bja/aet122
10. J. Urriza, L. Imirizaldu, R.M. Pabón, O. Olaziregi, I. García de Gurtubay, An. Sist. Sanit. Navar, Monitorización neurofisiológica intraoperatoria: métodos en neurocirugía; 32 (Supl. 3): 115-124, Servicio de Neurofisiología Clínica. Hospital Virgen del Camino. Pamplona. 2009. https://doi.org/10.4321/S1137-66272009000600010
11. Jeffrey J. Pasternak and William L. Lanier, Neuroanesthesiology Update 2010, J Neurosurgery Anesthesiol Volume 23, Number 2, April 2011. https://doi.org/10.1097/ANA.0b013e318210f594
12. Drummond, J., 2019. Blood Pressure and the Brain. Anesthesia & Analgesia, 128(4), pp.759-771. https://doi.org/10.1213/ANE.0000000000004034
13. Meng, L., Hou, W., Chui, J., Han, R., & Gelb, A. W. (2015). Cardiac Output and Cerebral Blood Flow. Anesthesiology, 123(5), 1198-1208. https://doi.org/10.1097/ALN.0000000000000872
14. Caroline A. Rickards, Arterial pressure and cerebral blood flow variability: friend or foe? A review, Frontiers in physiology, published: 07 April 2014. https://doi.org/10.3389/fphys.2014.00120
15. McBryde, F. D., Malpas, S. C., & Paton, J. F. R. (2016). Intracranial mechanisms for preserving brain blood flow in health and disease. Acta Physiologica, 219(1), 274-287. doi:10.1111/apha.12706 https://doi.org/10.1111/apha.12706
16. Slupe, A. M., & Kirsch, J. R. (2018). Effects of anesthesia on cerebral blood flow, metabolism, and neuroprotection. Journal of Cerebral Blood Flow & Metabolism https://doi.org/10.1177/0271678X18789273
17. Fabregas N., Candil JF., Complications in neuroanesthesia, section V, complications related to respiratory system, cahpter 20 Hypercapnia, 2016. https://doi.org/10.1016/B978-0-12-804075-1.00020-1
18. Armstead WM. Cerebral Blood Flow Autoregulation and Dysautoregulation. Anesthesiol Clin. 2016 Sep;34(3):465-77. https://doi.org/10.1016/j.anclin.2016.04.002
19. Ruesch A, Acharya D, Schmitt S, Yang J, Smith MA, Kainerstorfer JM. Comparison of static and dynamic cerebral autoregulation under anesthesia influence in a controlled animal model. PLoS One. 2021 Jan 8;16(1):e0245291. https://doi.org/10.1371/journal.pone.0245291
20. Susan L. Bratton, Cerebral Perfusion Thresholds, Journal of Neurotrauma Volume 24, Supplement 1, 2007. https://doi.org/10.1089/neu.2007.9987

 ORCID
ORCID