Iván Iglesias MD. 1
Recibido: 05-08-2021
Aceptado: 12-09-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 774-779|https://doi.org/10.25237/revchilanestv5030091046
PDF|ePub|RIS
Intraoperative echocardiography in aortic valve sparing operations
Abstract
Aortic valve sparing operations are feasible to treat the majority of patients with either symptomatic aortic insufficiency or pathology of the aortic root and ascending aorta. Along the last 20 years knowledge on anatomy of the aortic valve functional unit, the aortic root, has evolved and lead to develop surgical techniques to preserve the aortic valve and offer great benefit to these patients. Intraoperative transesophageal echocardiography has evolved at the same pace, and this has supported the work done by surgeons to repair the aortic valve. The close collaboration of surgeons and echocardiographers yields excellent results when performing these procedures. The present review shows the main findings to consider to successfully preserve the aortic valve when performing aortic root and ascending aorta surgery and when treating patients with symptomatic aortic insufficiency.
Resumen
Preservar la válvula aórtica tanto en el manejo de la insuficiencia aórtica como en la cirugía de raíz aórtica y aorta ascendente es un procedimiento posible en la mayoría de los pacientes. En los últimos 20 años el conocimiento de la anatomía de la raíz aórtica como unidad funcional valvular ha permitido desarrollar conocimiento y técnicas quirúrgicas que conservan la válvula aórtica con gran beneficio para los pacientes. La evolución de le ecocardiografía transesofágica intraoperatoria ha permitido apoyar este desarrollo y el trabajo asociado del cirujano y el ecocardiografista en el quirófano permite que se logren resultados muy satisfactorios en el reparo valvular aórtico. La presente revisión muestra los factores que deben considerarse para preservar exitosamente la válvula aórtica en estos escenarios.
La práctica de cirugías de reparo valvular ha ganado espacio debido al deseo de evitar las complicaciones relacionadas con las prótesis valvulares[1]. Un mejor entendimiento de la anatomía y función de la válvula aórtica y la disponibilidad de ecocardiografía transesofágica intraoperatoria (ETEI) han permitido una gran evolución en las técnicas de preservación valvular aórtica[2]. La presente breve revisión está basada en la posición del autor que sostiene que la ETEI ha evolucionado a una nueva subespecialidad: ecocardiografía quirúrgica (Tabla 1).
La válvula aórtica debe verse como una unidad funcional que comprende: unión ventrículo-aórtica y anillo valvular, senos de valsalva, valvas aórticas y la unión senotubular. El anillo valvular es 45% muscular y 55% fibroso. Las valvas aórticas tienen bases de implantación que son 1,5 veces la longitud de la porción libre que coapta; las valvas se encuentran en las cúspides debajo de la unión senotubular y debajo de sus uniones (comisuras) se forman espacios triangulares, los triángulos subcomisurales a los dos lados de la no coronaria son fibrosos,
Tabla 1. Características de la ecocardiografía quirúrgica
1- Es estructural, es decir se enfoca en revisar la(s) estructura(s) que se va(n) a reparar
2- Sistemática, es decir debe revisarse todo de manera organizada y consistente
3- Funcional, es decir, se determina el impacto funcional de los hallazgos.
4- Operacional, o sea ayuda a entender qué debe hacerse para reparar el problema.
5- Responsable, es decir que los hallazgos se comprueban de inmediato en la sala de operaciones.
6- Comprometida, es decir el ecocardiografista entiende la técnica quirúrgica y ayuda a que el resultado de la cirugía sea satisfactorioO
Definición y tabla original del autor.
Tabla 2. Mecanismos de insuficiencia aórtica basados en los trabajos publicados por Haydar en 1997 y El Khoury en 2005[6],[7]
1. Mobilidad normal de las valvas
1A Dilatación de unión senotubular, asociada a aneurismas de aorta ascendente
1B Dilatación de senos de Valsalva
1C Dilatación de unión ventrículo-arterial (conocido como anillo aórtico)
1D Perforación de tejidos valvares
2. Prolapso de la(s) valva(s), mobilidad excesiva de las valvas
3. Restricción de la(s) valva(s), mobilidad restringida de las valvas
el triángulo subcomisural entre las dos coronarias es muscu- lar[2],[3].
El anillo aórtico, las valvas y la unión senotubular tienen un papel predominante en mantener la competencia valvular aórtica[1]. Los senos de valsalva no juegan un papel directo en la competencia valvular[1],[4],[5]. En la Figura 1 se ven estos elementos de una vista de ETE eje largo. En la Figura 2 se observan estos elementos en una foto intraoperatoria.
Los trabajos de Haydar en 1997 aplicaron la clasificación de Carpentier a los mecanismos de insuficiencia aórtica (IA) y fueron perfeccionados por El Khoury en el 2005 dando como resultado un enfoque de la IA que entiende la importancia de toda la raíz aórtica en los mecanismos de la misma (Tabla 2) [6],[7].
Dilatación de la unión senotubular y aorta bicúspide son los dos mecanismos prevalentes de IA en países desarrollados[2],[8]. En un porcentaje importante de pacientes se encuentra más de un mecanismo concurrente[1],[6]. Es imprescindible familiarizarse con los mecanismos de IA para practicar un examen sistemático de la raíz aórtica usando ETEI 2D y Doppler color. Para el cirujano la clasificación de EL Khoury es considerada de gran ayuda para entender mejor el plan de reparación requerido para devolver la competencia a la válvula aórtica[1],[4],[8]. Los videos 1 al 3 muestran ejemplos de mecanismos de IA.
La utilidad de la ecocardiografía transesofágica intraoperatoria (ETEI) en cirugía valvular aórtica ha sido reconocida ampliamente[1],[2],[4],[9]-[12]. El impacto en reparos valvulares aórticos ha sido reportado entre 5%-10% de casos pre CEC[1],[13],[14]. El uso óptimo de ETEI se da cuando el anestesiólogo ecocardiografista revisa con el cirujano la válvula aórtica en vistas de eje corto y largo esofágicas medias y buscan en conjunto responder dos preguntas básicas: 1- Cuál es la anatomía valvular?; 2- Cuál(es) es (son) el (los) mecanismo(s) de insuficiencia aórtica?[4]. En la experiencia del LHSC este es un paso ineludible. Las imágenes 2D y Doppler color ayudan a entender mejor el mecanismo de insuficiencia aórtica y permiten al cirujano correlacionar sus hallazgos anatómicos integrando las imágenes ecocardiográficas para mejores resultados. Esta integración anatómico-ecocardiográfica por el cirujano fue descrita desde el trabajo original de El Khoury[6] y es mencionada como fuente de la mejor cantidad de información para el cirujano que va a emprender el reparo valvular aórtico[4].
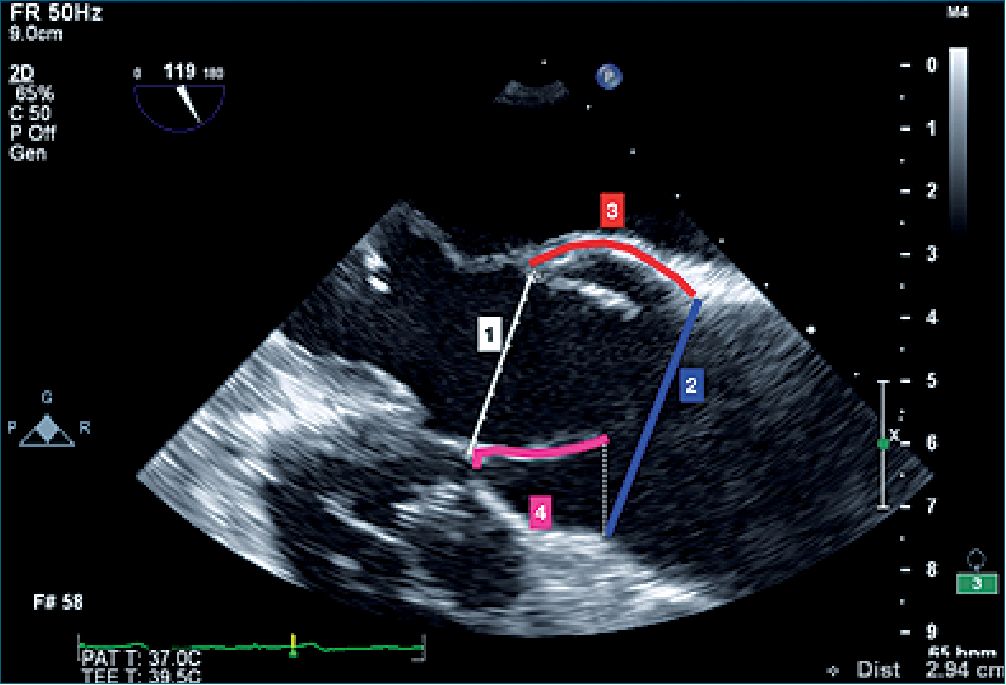
Figura 1. Componentes de la unidad valvular aórtica: 1 unión ventrículo arterial y anillo valvular; 2 unión senotubular; 3 paredes de los senos de valsalva; 4 valvas insertadas desde el anillo hasta debajo de la unión senotubular y con su porción libre coaptando en el medio de la unidad valvular. La unión senotubular, el anillo valvular y las valvas son los elementos más importantes para la competencia valvular.
Cuando existe IA se deben entonces revisar todos los componentes funcionales de la raíz aórtica para evaluar la reparabilidad valvular y el/los mecanismo(s) de IA que deben ser abordados por el cirujano. Está fuera del alcance y propósito de ésta breve revisión discutir la técnica quirúrgica, nos enfocaremos en el examen ecocardiográfico y algunas recomendaciones basadas en la literatura y en casi 10 años de experiencia en reparos valvulares aórticos en un centro universitario de referencia (LHSC).
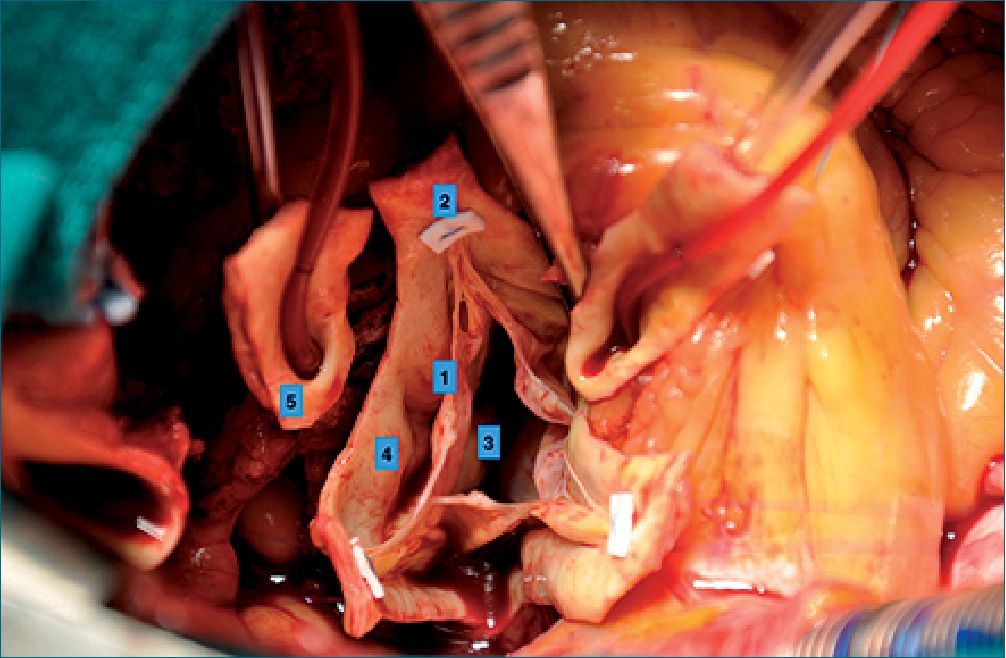
Figura 2. Foto intraoperatoria de una raíz aórtica que ha sido disecada y preparada para reparo. 1 es el borde libre valvar; 2 la comisura; 3 la unión caudal de la valva que forma parte del anillo valvular; 4 pared del seno de valsalva y 5 botón coronario izquierdo.
En cirugía de raíz aórtica y/o aorta ascendente si la válvula aórtica es competente el papel de la ETEI se limita a confirmar la anatomía y función valvular antes y después de circulación extracorpórea (CEC). Cuando existe IA el ecocardiografista tiene que enfocarse en responder preguntas específicas: 1- Cuál o cuáles mecanismos de IA existen en el paciente?; 2- Los hallazgos de ETEI son favorables para preservar la válvula? En lo que sigue de esta breve revisión nos vamos a enfocar en esas dos preguntas.
Usando imágenes de eje corto comprobamos la anatomía valvular (¿Tricúspidea? ¿Bicúspidea? ¿Unicúspide?). Ver videos 4 al 6. Combinando imágenes 2D de eje corto y eje largo con Doppler color revisamos el/los mecanismos de insuficiencia aórtica, estos dos pasos los hacemos usando eco 2D pero hay autores que mencionan el aporte del eco 3D para una mejor evaluación[15]. Simplificando, los mecanismos de IA se pueden deber a patología de las valvas (perforación, prolapso, retracción), a dilatación de la raíz (anillo, senos de valsalva, unión senotubular) o a combinación de factores. Es importante combinar imágenes de eje corto y eje largo (X plane) para medir los diámetros del anillo valvular. Como se mencionó antes en un porcentaje importante de pacientes existe más de un mecanismo concurrente de IA[1],[6], es importante recordar esto y de manera organizada y repetitiva revisar imágenes 2D y de Doppler color para confirmar si los hallazgos 2D explican el jet de IA presente en el Doppler color, si hay discrepancia quiere decir casi siempre que hay más de un mecanismos presente o que no se ha comprendido bien el mecanismo de IA presente. Es importante recalcar que se debe optimizar la imagen eco- cardiográfica para tener mejor información, esto, que parece natural, es olvidado con frecuencia. Se debe usar los botones de la máquina de ETE para tener la mejor resolución temporal posible, la resolución temporal es crítica cuando se usa Doppler
color interrogando jets de IA complejos, usar los controles de tamaño tanto de la ventana de eco 2D como de Doppler color para maximizar la resolución temporal es la mejor ayuda que se puede tener para evaluar correctamente el o los mecanismos de IA. Un mecanismo importante que causa jets de IA no esperados es la presencia de perforaciones y/o de fenestraciones, las primeras se pueden ver con más frecuencia post endocarditis bacteriana; las fenestraciones pueden ser hallazgos hacia las superficies de coaptación o pueden verse más periféricas hacia las comisuras asociadas a dilatación de los senos de valsalva[16], en éste último caso son menos fáciles de ver y solo una práctica sistemática de alta calidad técnica de ETEI incrementa la posibilidad de observarlas.
Los jets de IA excéntricos se pueden ver con fenestraciones y con mecanismos tipo II y III de El Khoury. En ausencia de prolapso o restricción valvar los jets excéntricos se atribuyen a fenestraciones. En el mecanismo tipo III observar que la valva está restringida tiende a asociarse a una valva que además se ve engrosada, calcificada. En el mecanismo tipo II es importante aclarar si el prolapso involucra total o parcialmente la valva, si involucra más de una valva y cuál está más prolapsada. Esto es, en una válvula tricúspide evaluar la posición relativa de las tres valvas ayuda a entender mejor lo que el cirujano debe hacer para corregir el problema, para esto se usan vistas de eje corto con imagen ortogonal simultanea (x plane) y se desliza la línea de plano de corte sobre las valvas (en el eje corto) observando en la imagen ortogonal (en el eje largo) que muestra la posición relativa de las valvas interrogadas; esta es práctica de todos nuestros casos de reparo valvular y es recomendada por quienes tienen la mayor experiencia en reparos valvulares aórticos[1] (Figura 3). Prolapso valvar puede observarse también en disección de la raíz aórtica que desprende la comisura valvar[6],[17].
La posibilidad de un mejor reparo se da cuando se puede devolver a la válvula aórtica una configuración cercana a la anatomía normal[4]. Para esto se han identificado parámetros que deben medirse y se han cuantificado valores de los mismos que favorecen el reparo valvular. En la Figura 4 se observan esos parámetros en un diagrama tomado de una revisión reciente publicada por H.J. Sháfers[4]. En la Figura 5 se observan estos parámetros en vistas de ETE.
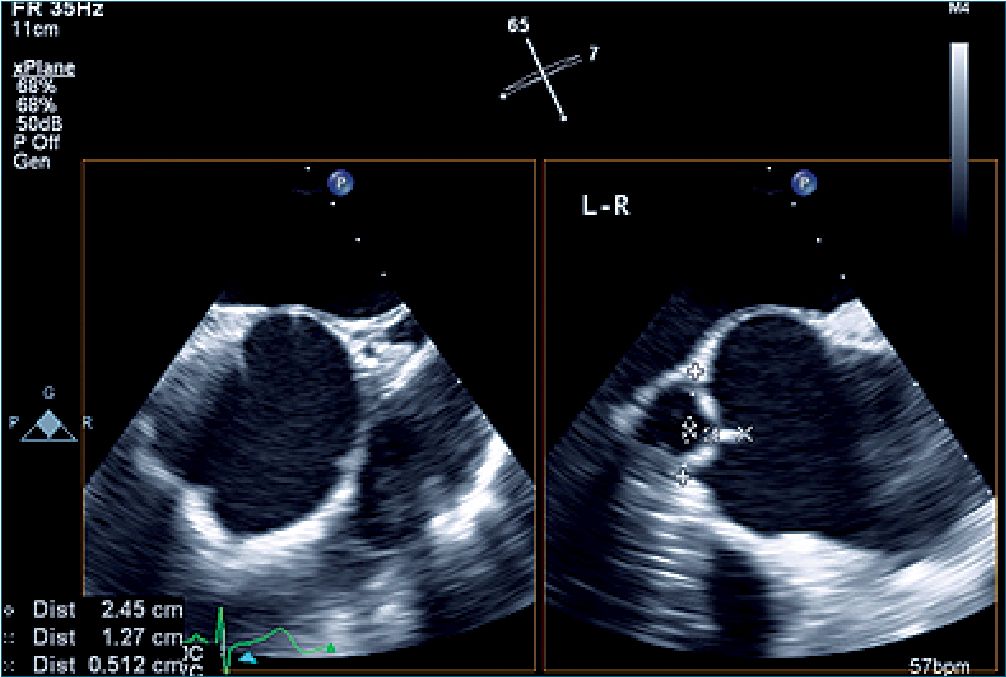
Figura 3. Imagen en planos ortogonales (x plane) partiendo de la vista de eje corto de la válvula aórtica a la izquierda. El plano ortogonal se ha puesto entre las valvas coronarias izquierda y derecha (L-R en el cuadro derecho) y se observa la simetría de coaptación entre las mismas.
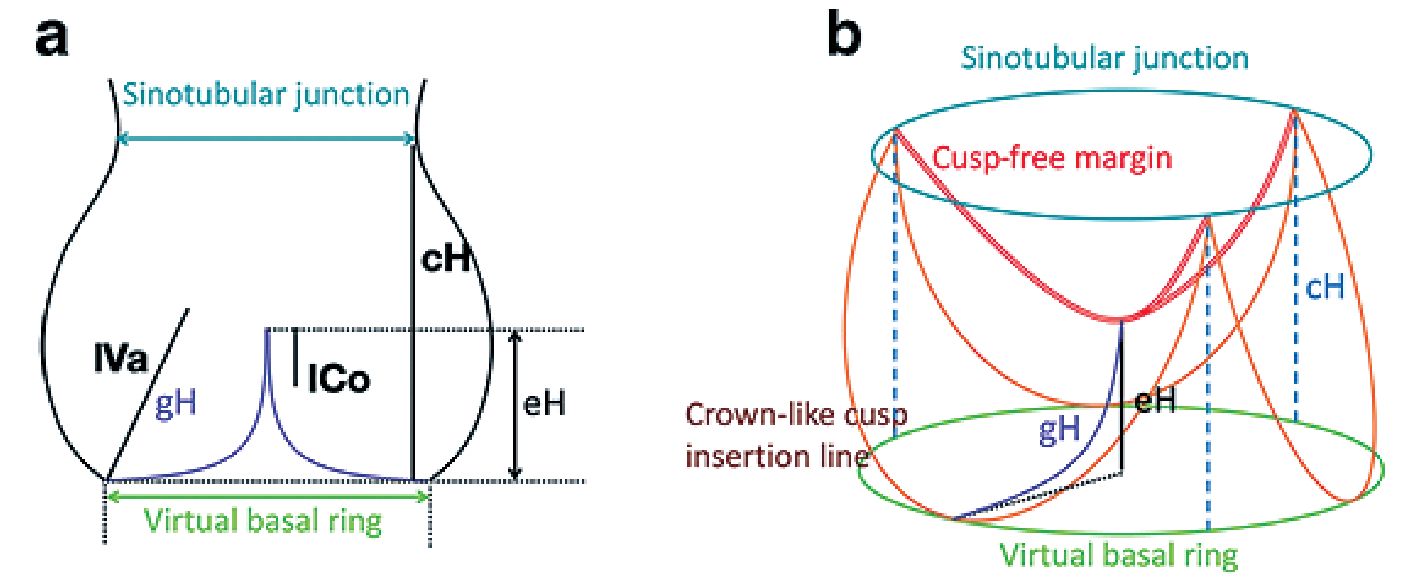
Figura 4. Parámetros medidos en ETEI de la válvula aórtica, algunos se miden en sístole (longitud de la porción libre de la cúspide o valva -lVa-), los otros se miden en diástole (altura efectiva -eH-, longitud de coaptación -lCo-, altura cúspide -cH-, diámetros de la unión senotubular y del anillo. Tomado y modificado con autorización de: Shafers H-J; In- nov 2019; 14(3):188.
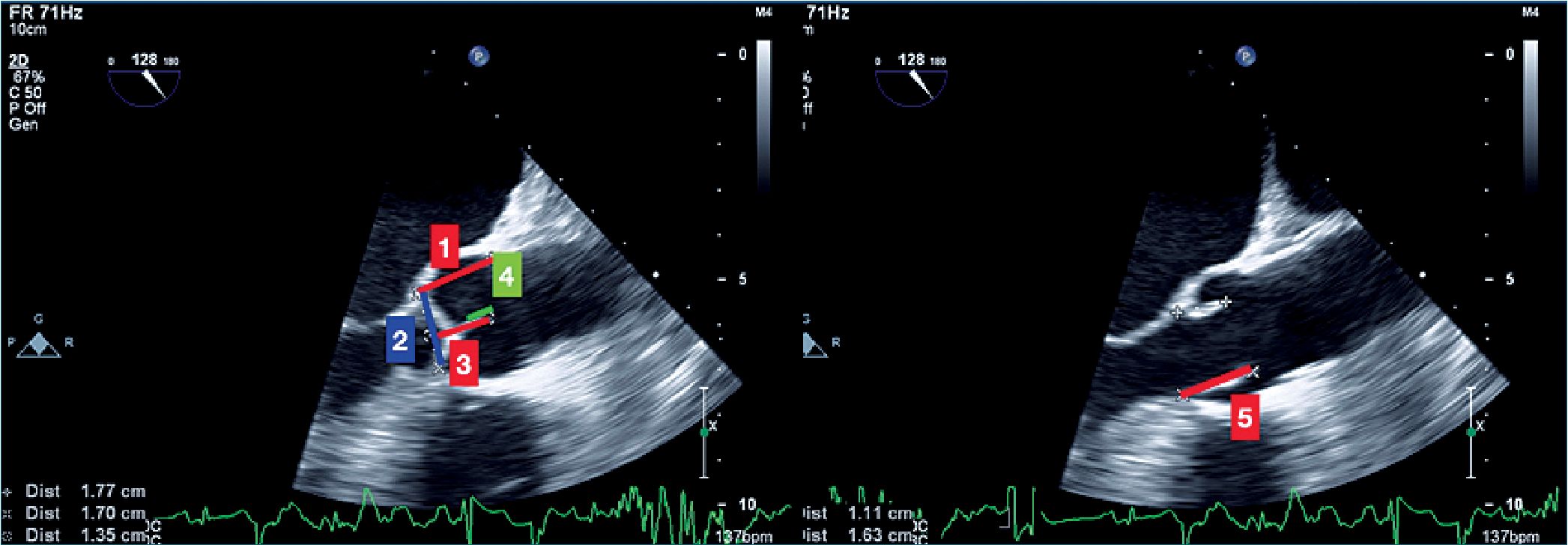
Figura 5. Parámetros a evaluar en la válvula aórtica usando vistas de eje largo 2D. 1 es la altura de cúspides; 2 es anillo valvular; 3 es altura de coaptación; 4 es la longitud de coaptación; 5 es la longitud de las valvas.
Mencionamos antes que el anillo, la unión senotubular y las valvas son los factores más importantes para la competencia valvular[1], es entonces natural que en la evaluación inicial los parámetros que medimos con mayor interés son el diámetro anular, el diámetro de la unión senotubular, las alturas geométrica y efectiva de las valvas y la altura comisural[1],[4]. La unión senotubular es 10%-15% de mayor diámetro que el anillo valvular; el diámetro del anillo valvular medido en eje largo sugiere reparo más difícil si es mayor de 26 mm en VA Tricúspide -VAT- o de 29 mm en VA Bicúspide -VAB-[1],[4],[5],[9],[18]. La cantidad y calidad de tejido de las valvas es factor importante para el reparo valvular, valvas calcificadas, cortas o retraídas tienden a dar peores resultados, una longitud de valvas < 16 mm en VAT o < 19 mm en VAB se asocia a reparos más difíciles[1],[4],[5],[9],[18]. La posibilidad de preservar la válvula aórtica es mayor cuando las valvas son de características normales, esto es, delgadas y flexibles y de superficie de coaptación uniforme. Las lesiones tipo I de El Khoury se consideran favorables para reparo, las lesiones tipo II tienden a ser reparables siempre
que no haya calcificaciones importantes sobre el cuerpo de las valvas. Tanto en lesiones tipo I como en lesiones tipo II se miden las dimensiones de los componentes de la raiz aórtica para buscar parámetros anatómicos favorables para el reparo. Las lesiones tipo III se consideran poco favorables para reparo y/o se relacionan con alta incidencia de recurrencia de IA y reoperación[8],[12],[18]. La presencia de fenestraciones hacia los triángulos comisurales también se considera de difícil reparo[16]. En la Tabla 3 se presentan hallazgos desfavorables para el plan de reparar la válvula aórtica[4],[5],[10],[12],[14],[18],[19].
Es práctica regular en nuestro hospital que al terminar el reparo se administra cardioplejia y se interroga la VA en eje largo con Doppler color y se observa el nivel de coaptación y/o si hay regurgitación importante antes de iniciar la salida de CEC, esto ha sido descrito desde el 2009[20]. Al salir de CEC se interroga la VA en eje largo y corto esofágicos medios. Los parámetros que se evalúan al salir de CEC incluyen: nivel de coaptación, IA residual, altura de coaptación, longitud de coaptación y gradiente valvular. El nivel de coaptación se mira en eje largo, se usa de referencia la unión ventrículo-aórtica (que conocemos como anillo) si las valvas coaptan por encima del nivel del anillo se es clase A, si coaptan al nivel del anillo es clase B, si coaptan por debajo del anillo es clase C[1]. La presencia de IA residual se evalúa en eje largo esofágico o transgástrico profundo con Doppler color. La altura de coaptación se mide
Tabla 3. Hallazgos pre CEC en ETEI 2D que se relacionan con reparos valvulares aórticos menos fáciles o de menor probabilidad de éxito o poca durabilidad[4],[5],[10],[12],[14],[18],[19]
Fenestraciones múltiples
Fenestraciones produciendo prolapso
Fenestraciones comisurales
Cuerpo de la porción libre de las valvas calcificada, retraída
Valvas cortas, porción libre < 16 mm en VA tricúspide, < 19 mm VA bicúspide
Anillo valvular dilatado, > 26 mm VA tricúspide, > 29 mm VA bicúspide
Anatomía unicúspide
Tabla 4. Parámetros a evaluar al terminar de reparar la válvula aórtica[1],[5],[9]-[11],[13],[18],[21]
| Parámetro | Resultado Favorable |
| Nivel de coaptación
Insuficiencia residual |
A es ideal (por encima del anillo) Cero a trazas es ideal |
| Altura de coaptación
Longitud de coaptación Gradiente valvular |
8 mm mínimo
4 mm mínimo Gradiente medio < 10 mmHg |
en eje largo esofágico usando a línea de referencia del anillo y midiendo la distancia hasta la punta donde termina la coaptación de las valvas. La longitud de coaptación se mide en eje largo esofágico midiendo la distancia de contacto entre las val- vas[1],[5],[9]-[11],[13],[18],[21].
En la Tabla 4 se pueden ver los parámetros ideales de un reparo valvular aórtico exitoso y relacionado con baja incidencia de recurrencia de IA y/o reoperación de la VA[1],[5],[9]- [11],[13],[18],[21]. En nuestro hospital usamos estos parámetros combinados, en general un nivel de coaptación clase C es considerado no aceptable y motiva consideración de revisar el reparo; la presencia de IA residual leve a moderada se evalúa en el contexto de los otros parámetros; si el nivel de coaptación, la altura de coaptación y la longitud de coaptación son satisfactorios se tiene mayor tolerancia ante la presencia de IA residual leve[1],[5],[9]-[11],[13],[18],[21].
• La ecocardiografía transesofágica intraoperatoria es ecocardiografía quirúrgica.
• La raíz aórtica es una unidad funcional de múltiples elementos.
• El anillo aórtico, la unión senotubular y las valvas son los elementos determinantes para la competencia valvular.
• El examen ecocardiográfico intraoperatorio de la raíz aórtica le aporta al cirujano información sobre el mecanismo de insuficiencia aórtica.
1. Augoustides JG, Szeto WY, Bavaria JE. Advances in aortic valve repair: focus on functional approach, clinical outcomes, and central role of echocardiography. Journal of cardiothoracic and vascular anesthesia. 2010;24(6):1016-20. https://doi.org/10.1053/j.jvca.2010.08.007
2. David TE. Surgical treatment of aortic valve disease. Nature reviews Cardiology. 2013;10(7):375-86. https://doi.org/10.1038/nrcardio.2013.72
3. Underwood MJ, El Khoury G, Deronck D, Glineur D, Dion R. The aortic root: structure, function, and surgical reconstruction. Heart (British Cardiac Society). 2000;83(4):376-80. https://doi.org/10.1136/heart.83.4.376
4. Schäfers HJ. The 10 Commandments for Aortic Valve Repair. Innovations (Philadelphia, Pa). 2019;14(3):188-98. https://doi.org/10.1177/1556984519843909
5. Yanagawa B, Mazine A, El-Hamamsy I. Predictors of Aortic Valve Repair Failure. Innovations (Philadelphia, Pa). 2019;14(3):199-208. https://doi.org/10.1177/1556984519845905
6. El Khoury G, Glineur D, Rubay J, Verhelst R, d’Acoz Y, Poncelet A, et al. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Current opinion in cardiology. 2005;20(2):115-21. https://doi.org/10.1097/01.hco.0000153951.31887.a6
7. Haydar HS, He GW, Hovaguimian H, McIrvin DM, King DH, Starr A. Valve repair for aortic insufficiency: surgical classification and techniques. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 1997;11(2):258-65. https://doi.org/10.1016/S1010-7940(96)01014-7
8. Boodhwani M, El Khoury G. Aortic valve repair: indications and outcomes. Current cardiology reports. 2014;16(6):490. https://doi.org/10.1007/s11886-014-0490-7
9. Hall T, Shah P, Wahi S. The role of transesophageal echocardiography in aortic valve preserving procedures. Indian heart journal. 2014;66(3):327-33. https://doi.org/10.1016/j.ihj.2014.05.001
10. Stern KW, White MT, Verghese GR, Del Nido PJ, Geva T. Intraoperative Echocardiography for Congenital Aortic Valve Repair: Predictors of Early Reoperation. The Annals of thoracic surgery. 2015;100(2):678-85. https://doi.org/10.1016/j.athoracsur.2015.05.002
11. Van Dyck MJ, Watremez C, Boodhwani M, Vanoverschelde JL, El Khoury G. Transesophageal echocardiographic evaluation during aortic valve repair surgery. Anesthesia and analgesia. 2010;111(1):59-70. https://doi.org/10.1213/ANE.0b013e3181dd2579
12. le Polain de Waroux JB, Pouleur AC, Goffinet C, Vancraeynest D, Van Dyck M, Robert A, et al. Functional anatomy of aortic regurgitation: accuracy, prediction of surgical repairability, and outcome implications of transesophageal echocardiography. Circulation. 2007;116(11 Suppl):I264-9. https://doi.org/10.1161/CIRCULATIONAHA.106.680074
13. Kihara C, Murata K, Wada Y, Hadano Y, Ohyama R, Okuda S, et al. Impact of intraoperative transesophageal echocardiography in cardiac and thoracic aortic surgery: experience in 1011 cases. Journal of cardiology. 2009;54(2):282-8. https://doi.org/10.1016/j.jjcc.2009.06.001
14. Michelena HI, Abel MD, Suri RM, Freeman WK, Click RL, Sundt TM, et al. Intraoperative echocardiography in valvular heart disease: an evidence-based appraisal. Mayo Clinic proceedings. 2010;85(7):646-55. https://doi.org/10.4065/mcp.2009.0629
15. Hagendorff A, Evangelista A, Fehske W, Schäfers HJ. Improvement in the Assessment of Aortic Valve and Aortic Aneurysm Repair by 3-Dimensional Echocardiography. JACC Cardiovascular imaging. 2019;12(11 Pt 1):2225-44. https://doi.org/10.1016/j.jcmg.2018.06.032
16. Reade CC, Szeto WY, Bavaria JE. Aortic valve commissural fenestrations due to sinus of valsalva dilatation. The Annals of thoracic surgery. 2009;87(2):646. https://doi.org/10.1016/j.athoracsur.2008.06.073
17. Boodhwani M, de Kerchove L, Glineur D, Rubay J, Vanoverschelde JL, Van Dyck M, et al. Aortic valve repair with ascending aortic aneurysms: associated lesions and adjunctive techniques. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2011;40(2):424-8. https://doi.org/10.1016/j.ejcts.2010.11.053
18. le Polain de Waroux JB, Pouleur AC, Robert A, Pasquet A, Gerber BL, Noirhomme P, et al. Mechanisms of recurrent aortic regurgitation after aortic valve repair: predictive value of intraoperative transesophageal echocardiography. JACC Cardiovascular imaging. 2009;2(8):931-9. https://doi.org/10.1016/j.jcmg.2009.04.013
19. de Kerchove L, Mastrobuoni S, Froede L, Tamer S, Boodhwani M, van Dyck M, et al. Variability of repairable bicuspid aortic valve phenotypes: towards an anatomical and repair-oriented classification. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2019. https://doi.org/10.1093/ejcts/ezz033
20. Koshy T, Misra S, Sinha PK, Baiju S. A novel technique to assess aortic valve repair before releasing the aortic cross-clamp. Journal of cardiothoracic and vascular anesthesia. 2009;23(1):79-81. https://doi.org/10.1053/j.jvca.2008.05.006
21. Kunihara T, Aicher D, Rodionycheva S, Groesdonk HV, Langer F, Sata F, et al. Preoperative aortic root geometry and postoperative cusp configuration primarily determine long-term outcome after valve-preserving aortic root repair. The Journal of thoracic and cardiovascular surgery. 2012;143(6):1389-95. https://doi.org/10.1016/j.jtcvs.2011.07.036

 ORCID
ORCID