Ricardo Bustamante Bozzo 1
Recibido: 12-11-2020
Aceptado: 15-11-2020
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 1 pp. 126-158|https://doi.org/10.25237/revchilanestv50n01-09
PDF|ePub|RIS
Spinal cord injury
Abstract
According to different publications, the neurological level most frequently involved in traumatic spinal cord injury is cervical (16%-75%), followed by thoracic (16%-36%) and lumbar (9%-17%). The abrupt interruption of nerve conduction at the spinal level causes spinal shock, characterized by an acute neurological, hemodynamic, respiratory and urinary compromise, which associates with thermoregulation problems. Neurological repercussions are characterized by a motor compromise, evidenced as flaccid paralysis with areflexia, sensory damage, abolition of sympathetic activity and loss of adaptive reflexes in the territory located below the lesion. The management of traumatic spinal cord, both, isolated or associated with multiple trauma, must begin at the scene of the accident. The current trend is towards a selective immobilization identifiying the group of patients in whom it will have a real benefit. Clinical features of spinal shock and other clinical aspects of the spinal cord injury are described in detail. Diagnosis should include a complete neurological examination including imaging studies. The type of image of choice is computerized axial tomography (CT). Different treatment alternatives are analyzed, including early or delayed descompressive surgery, methylprednisolone, neuroprotection and neuroregeneration. Finally, anesthetic management is described, the objective of which should be to reduce the movement of the lesion area (especially during positioning and the laryngoscopy and intubation maneuver) and to maintain the medullary perfusion pressure within normal limits. Postoperative care should focus on pain management, prevention of thromboembolic events and weaning from mechanical ventilation.
Resumen
El nivel neurológico más frecuentemente comprometido en las lesiones raquimedulares por trauma es el cervical (16%-75%), seguido del torácico (16%-36%) y lumbar (9%-17%) según diferentes publicaciones. La brusca interrupción de la conducción nerviosa a nivel medular origina el cuadro de medular, caracterizado por un agudo compromiso neurológico, hemodinámico, respiratorio y urinario, asociado a problemas de termorregulación, con repercusiones neurológicas caracterizadas por un compromiso motor que se manifiesta como una parálisis fláccida con arreflexia, daño sensitivo, desaparición de la actividad simpática y pérdida de reflejos de adaptación en el territorio ubicado por debajo de la lesión. El manejo del trauna raquimedular asociado o no a politraumatismo debe inicirse en la escena del accidente; la tendencia actual es hacia una inmovilización selectiva, haciendo una identificación del grupo de pacientes en los que tendrá un real beneficio. Se describe detalladamente el cuadro de medular o espinal y otros aspectos clínicos de la sección medular. El diagnóstico debe incluir un examen neurológico completo y estudios de imagenología; el tipo de imagen de elección es la tomografía axial computarizada (TAC). Se analizan las diferentes alternativas de tratamiento: cirugía descompresiva precoz o diferida, metilprednisolona, neuroprotección y neurorregeneración. Finalmente se detalla el manejo anestésico, cuyo objetivo debe perseguir el menor movimiento de la zona de la lesión (especialmente durante el posicionamiento y la maniobra de laringoscopía e intubación) y el mantenimiento de la presión de perfusión medular dentro de los límites más estables posilbes. Los cuidados posoperatorios deben estar dirigidos especialmente al manejo de la analgesia, la prevención de la enfermedad tromboembólica y la desconexión de la ventilación mecánica.
El traumatismo raquimedular (TRM) incluye todas las lesiones traumáticas que afectan las diferentes estructuras de la columna vertebral a cualquiera de sus niveles: estructuras óseas, ligamentosas, cartilaginosas, musculares, vasculares, meníngeas, radiculares y de la médula espinal. De este modo, el TRM a menudo es el resultado de una compleja interacción de lesiones sufridas por el sistema musculesquelético y nervioso. Está asociado frecuentemente a politraumatismo (huesos largos, pelvis, tórax) y traumatismo encefalocraneano. El diagnóstico precoz es importante para el pronóstico, pero no es fácil, por lo que debe tenerse siempre presente en el contexto de un politraumatizado.
El TRM es una patología en la que el anestesiólogo no es el protagonista, pero forma parte de un equipo multidisciplinario para el tratamiento especializado, tanto en la fase aguda (reanimación y fijación de la columna), como para enfrentar las complicaciones secundarias de la etapa crónica (cirugías de complicaciones y dolor neurogénico).
-
Epidemiología
En Chile el 7,5% de las defunciones se relacionan con causas externas de mortalidad, que incluyen los accidentes del tránsito, otros accidentes del transporte, lesiones autoinflingidas y otras[1]. El TRM está incluido en este último ítem, pero no hay estudios de incidencia y mortalidad publicados. Una publicación chilena reporta incidencias anuales en Chile que fluctúan entre 11,5-53,4/1.000.000 habitantes, sin mencionar la fuente de los datos[2]. Se estima que la incidencia es de entre 20 a 30 casos/año por cada millón de habitantes. Un estudio prospectivo realizado en Valparaíso mostró dentro del perfil de estos enfermos edades de 15-29 años, 72,8% de sexo masculino y como causa más frecuente los “piqueros” en el mar (28%)[3].
Los datos de información epidemiológica en TRM están disponibles para sólo 41 países del mundo, en su mayoría europeos y de altos ingresos[4]. Se estima que aproximadamente 500.000 persona sufren TRM en todo el mundo cada año, por lo que el desarrollo de terapias potenciales para reducir su morbilidad y el impacto socioeconómico sigue siendo una prioridad de investigación urgente.
De todos los individuos que sufren una lesión traumática, la columna cervical está involucrada en el 4,4% de los casos, la toracolumbar en el 6,36% y la médula espinal en el 1,3%[5]. Las fracturas de la columna vertebral son más frecuentes a nivel torácico, luego lumbar y en último término cervical. Las lesiones de la columna se asocian con las áreas más móviles de ésta, que incluyen la columna cervical (el 75% de las lesiones de la columna cervical se presentan entre C3-C7) y la unión toracolumbar (el 16% de las lesiones toracolumbares se presentan en la unión de L1); hasta una quinta parte de ellas involucra múltiples niveles[6].
A nivel global el TRM es una afección neurológica que destruye la vida y afecta entre 250.000 y 500.000 personas cada año; se estima que dos a tres millones de personas en todo el mundo viven con una discapacidad relacionada con TRM.
En Estados Unidos, la incidencia de TRM reportado es de 12 a 55 pacientes por millón de habitantes por año, con una prevalencia de 253.000 personas. Los pacientes del sexo masculino son afectados en relación 4 a 1 con respecto a las mujeres y más de la mitad de estos casos se presentan en personas menores de 30 años. Las causas más frecuentes son los accidentes automovilísticos (46,9%-50,4%), las caídas (23,7%), la violencia (11,2%-13,7%), los accidentes deportivos y recreativos (8,7%-9,0%) y otras causas (7%)[7]. Existe otro tipo de pacientes con riesgo, portadores de daños degenerativos (artritis reumatoide, espondilitis anquilosante, artritis psoriásica) o lesiones congénitas (trisomía 21, neurofibromatosis), que cursan con cierto grado de inestabilidad cervical que puede ser descompensada con traumatismos menores[8],[9].
Algunos estudios demuestran que el perfil demográfico del TRM ha ido cambiando con el tiempo. En Escocia, por ejemplo, ha aumentado el número de pacientes entre 40 y 50 años y las incidencias de lesiones de C1 a C4, que se traducen en una mayor incidencia de tetraplejia[10].
En países en vías de desarrollo las principales causas suelen diferir de las anteriormente mencionadas, aumentando la incidencia relativa de las causas debidas a violencia (heridas por arma de fuego y objetos cortopunzantes). El nivel neurológico más frecuentemente comprometido es el cervical (16%-75%), seguido del torácico (16%-36%) y lumbar (9%-17%) según diferentes publicaciones[11].
Un metaanálisis reciente demostró que la incidencia global de TRM era de 10,5 casos por 100.000 habitantes, lo que resulta en una estimación de 768.473 [95% CI, 597.213-939.732] nuevos casos por año. La incidencia es mayor en los países con ingresos bajos y medios (13,7 por 100.000) en comparación con los países de altos ingresos (8,7 por 100.000). Los accidentes de tráfico, seguidos de caídas, fueron el mecanismo más común de TRM en todo el mundo. En general, el 48,8% de los pacientes no requiriere cirugía[12].
Las lesiones de columna cervical son relativamente inestables y más susceptibles de una lesión secundaria por una inadecuada manipulación del paciente. Los traumatismos de columna cervical ocurren en el 2% a 5% de los pacientes con traumas contusos[13], y entre el 7% y el 14% se trata de lesiones inestables[14]. Por el contrario, las lesiones de columna torácica y lumbar son relativamente estables. La frecuencia e inestabilidad de las lesiones cervicales explica que las tetraplejias sean tan frecuentes como las paraplejias: de las personas que padecen una lesión medular, la tetraplejia incompleta es la más común (34,5%), seguida en orden descendente por la paraplejía completa (23,1%), la tetraplejía completa (18,4%) y la paraplejía incompleta (17,5%)[7].
En los accidentes automovilísticos que ocurren a baja velocidad, la vértebra cervical más frecuentemente lesionada es C2 (51%), en tanto en los de alta velocidad las fracturas más frecuentes son a nivel de C7 (37%). Además, las lesiones de la columna cervical superior ocurren más a menudo en traumas de baja energía y en mujeres mayores (por ejemplo, caídas a nivel); por el contrario, las vértebras subaxiales se comprometen más en accidentes de alta energía
y en hombres jóvenes (por ejemplo, caídas de altura) [15]. La región atlantoaxial es el sitio predominante de lesión y es la que tiene mayor posibilidad de movilización durante la laringoscopía e intubación.
La incidencia de lesiones asociadas es menos frecuente a nivel cervical (12%) que a nivel torácico (46%) o lumbar (22%)[16]. Los traumatismos contusos del macizo craneofacial se asocian a 1% a 5% de fracturas de vértebra cervical[17].
En el Hospital de Urgencia Asistencia Pública, haciendo un corte en dos períodos, para demostrar cambios demográficos se observa un claro aumento de las causas por agresión[18]:
Entre los años 2000 y 2004 se atendieron 62 pacientes con TRM (alrededor de 1 x 1.000 atenciones). Cincuenta y dos eran hombres (86%) y 10 mujeres (14%), con una edad promedio de 37 años. 22 casos presentaban politraumatismos (36%). Diez y ocho de los 62 pacientes fallecieron (30%), de los cuales 10 eran politraumatizados. Las causas fueron: accidentes del tránsito (24), caídas a nivel y de altura (24), agresiones con arma blanca y de fuego (8), deportivas (4) y aplastamiento (1).
Entre el año 2011 y 2019 se atendieron 35 casos, con una edad promedio trambién de 37 años nuevamente con mayoría de hombres (80% vs 20%). El 54% de las lesiones ocurrió a nivel cervical (19), el 37% a nivel torácico (13) y el 9% a nivel lumbosacro (3). Durante este período no hubo mortalidad. Las causas más frecuentes fueron: agresiones con arma blanca y de fuego (18), accidentes del tránsito (8), caída a nivel y de altura (3), lesiones utoinflingidas (2) y otros (4).
Debido a las diferentes aproximaciones al tratamiento y al avance de los cuidados intensivos, la mortalidad del TRM ha disminuido enormemente en los últimos 50 años; la probabilidad de muerte después de una lesión medular es de 6,3% durante el primer año, disminuyendo a 1,8% durante el segundo año y de 0,7% a 1,3% por año de allí en adelante, con sobrevida de 85,1% a los 12 años[19].
En los países desarrollados, la disminución de la mortalidad ha sido paralela a la disminución de los accidentes automovilísticos, lo que está lejos de ocurrir en Chile: de 23,5% en 1966 a 14,3% en 2001 y a 6,7% en 2008. Con el aumento de la edad se ha producido un aumento de las lesiones medulares y de lesiones espinales en múltiples niveles[20]. La rehabilitación precoz, definida como a partir de los 30 días de la lesión, ha mejorado los resultados y la recuperación de los pacientes con TRM[21]. El manejo de la insuficiencia respiratoria aguda se ha reflejado en una mejor sobrevida precoz, pero la expectativa de vida dista mucho de ser la de la población general, siendo las complicaciones respiratorias la principal causa de mortalidad. Contribuye con la mortalidad la comorbilidad general, las complicaciones de úlceras por decúbito y las infecciones[22].
La lesión de la médula espinal provoca múltiples comorbilidades secundarias, que varían según la gravedad de la lesión y otras características. Un metaanálisis reciente demostró que la recuperación neurológica después de un TRM depende significativamente de los factores de la lesión (es decir, la gravedad, el nivel y el mecanismo de la lesión), pero no está asociada con el tipo de tratamiento o el país de origen[23]. Sin embargo, los bajos ingresos y la ruralidad se relacionan con resultados significativamente diferentes a sus contrapartes[24].
En las últimas décadas, ha habido un aumento en la edad media de inicio y también un aumento en la esperanza de vida después de la lesión. De este modo, a diferencia del pasado, las personas con lesión de la médula espinal pueden envejecer después de la lesión[25]. Por otra parte, esta supervivencia se ha asociado a un aumento de secuelas por discapacidad, elevando enormemente los costos médicos y ocasionando un gran impacto sobre el individuo, la familia y la sociedad entera.
-
Fisiopatología de la lesión medular
El mayor problema de las lesiones de la columna es el riesgo de lesión medular asociado al desplazamiento de las estructuras óseas y a su inestabilidad. La brusca interrupción de la conducción nerviosa a nivel medular origina el cuadro de shock medular, caracterizado por un agudo compromiso neurológico, hemodinámico, respiratorio y urinario, asociado a problemas de termorregulación. La fase inicial del cuadro comienza inmediatamente después del accidente, es de una duración variable y es seguida por una fase “crónica”, que sobreviene entre la tercera y la sexta semana, dominada por un cuadro de hiperreflexia del sistema nervioso autónomo.
Las repercusiones neurológicas consisten en un compromiso motor caracterizado por una parálisis fláccida con arreflexia, daño sensitivo, desaparición de la actividad simpática y pérdida de reflejos de adaptación en el territorio ubicado por debajo de la lesión.
La extensión final del daño de la médula espinal está determinada por mecanismos de lesión primarios y secundarios. El trauma primario inicial causa lesiones mecánicas en la médula espinal, una combinación de compresión, laceración, tracción o cizallamiento. La lesión primaria desencadena una cascada fisiopatológica de mecanismos de lesión secundaria que se desarrollan en diferentes fases a los pocos segundos del trauma primario y desde entonces permanecen durante varias semanas.
El trauma primario inicial da como resultado una lesión mecánica de las células, daña la microvasculatura de la médula y causa hemorragia, iniciándose apoptosis y edema progresivo que contribuye a producir isquemia[26]. Además, al romperse la barrera hemato-espinal, se produce una afluencia de péptidos vasoactivos, factores de coagulación, citoquinas y células inflamatorias[27]. Durante las siguientes horas o días, se liberan subproductos de la necrosis celular (ATP, ADN y K+), creando un medio citotóxico y activando la microglía para reclutar más fagocitos. Los macrófagos y los leucocitos polimorfonucleares se infiltran y generan radicales libres de oxígeno y otros subproductos citotóxicos.
Con el tiempo, los astrocitos proliferan y rodean la zona perilesional, creando una barrera irregular. Esto se acompaña de depósito de fibroblastos con proteoglicanes de condroitin sulfato, de antígenos neurogliales y tenascina. Juntos, estos mecanismos producen una distorsión estructural y restringen severamente la regeneración del circuito neural endógeno y la remielinización de oligodendrocitos a nivel celular.
A nivel sistémico, las lesiones medulares cervicales y torácicas pueden interrumpir las salidas de los nervios simpáticos correspondientes, causando el shock medular, un shock neurogénico con pérdida del tono vascular periférico y bradicardia extrema, cuyo resultado puede ser una hipotensión severa que exacerba aún más la isquemia medular[28]. La parálisis de la musculatura respiratoria y abdominal produce una severa restricción de la fase inspiratoria de la ventilación, lo que conduce inevitablemente a hipercarbia e hipoxia. Posteriormente, la limitación del reflejo de la tos, la deficiente movilización de secreciones y la inmunodeficiencia secundaria, hacen que los pacientes con TRM sean altamente sensibles a todo tipo de infecciones del árbol respiratorio.
La extensión final del daño de la médula espinal se debe a los mecanismos primarios y secundarios que comienzan en el momento de la lesión y continúan durante días e incluso semanas. La lesión asociada al evento primario es irreversible. Sin embargo, las lesiones secundarias a hipotensión e hipoxia se pueden prevenir. Los agentes neuroprotectores intentan evitar lesiones secundarias específicas y prevenir el daño neural, mientras que las terapias neuroregenerativas promueven el recrecimiento axonal después de que el daño ya ha ocurrido[29].
Hay muchas similitudes entre el tejido cerebral y la médula espinal. En ambos casos, el tejido nervioso está contenido estrechamente en una cavidad ósea no distensible, en que el flujo sanguíneo es autorregulado en un margen de presión arterial media entre 50 a 150 mmHg.
Las lesiones anatómicas medulares primarias más frecuentes son laceraciones vasculares predominantemente centromedulares, que se extienden rápidamente hacia la periferia en forma de capas hemorrágicas confluentes, asociadas a variables grados de compresión de las estructuras vasculares y nerviosas[30].
Estas lesiones son irreversibles, y desencadenan una cascada de reacciones bioquímicas que son el origen de lesiones neurológicas sobre agregadas, que constituyen lesiones anatómicas medulares secundarias. Esto conduce a un círculo vicioso, que causa una agravación de la isquemia medular perilesional y a un aumento significativo del déficit neurológico en la primeras 48 h.
En este contexto, la autorregulación es abolida en los 30 primeros minutos, lo que pone en riesgo la perfusión medular en caso de hipotensión, cuando se desarrolla el shock medular. La sección medular completa es rara. La porción medular no lesionada es particularmente susceptible a la hipoxemia, la hipercarbia y la hipotensión, tan frecuentemente observadas en las tetraplejias[3].
-
manejo prehospitalario
El manejo del TRM asociado o no a politraumatismo debe iniciarse en la escena del accidente, identificando las condiciones que pueden amenazar la vida del paciente, aplicando estrictamente los principios del ATLS (Advanced Trauma Life Support)[32] y haciéndolo en la mayor brevedad para iniciar el traslado a un centro especializado[33]. La ventilación temprana y la diferenciación entre shock hopovolémico y neurogénico son los elementos clave de la reanimación prehospitalaria del TRM.
La protección de la columna es importante, pero no más que el manejo de la vía aérea, el control de la hemorragia y otros cuidados críticos. La tendencia actual es a una inmovilización selectiva, haciendo una identificación del grupo de pacientes en los que tendrá un real beneficio, pues los dispositivos utilizados, habitualmente semirrígidos, pueden asociarse a complicaciones, tales como: aumento de la presión intracraneana, limitación para el aislamiento de la vía aérea, restricción de la función respiratoria, úlceras por presión y aumento del tiempo de traslado[34].
En términos generales, la inmovilización no está indicada en los pacientes con trauma penetrante, sin signos neurológicos. En el caso del trauma cerrado, existe una serie de algoritmos para identificar el grupo de pacientes que debe ser inmovilizado. Los criterios más utilizados en la emergencia extrahospitalaria son los propuestos por el National Emergency X-Radiography Utilization Study (NEXUS)[35] y la Canadian C-Spine Rule (CCSR)[36], sin embargo, aunque hay consenso en que debe aplicarse algún algoritmo de inmovilización selectiva, no hay acuerdo en cuál es el más apropiado. En lo que se está de acuerdo es que en un paciente politraumatizado, debe suponerse la existencia de una lesión de la columna cervical hasta demostrar lo contrario. Algunos de los criterios de bajo riesgo de necesidad de inmovilización son: ausencia de dolor en la línea media, ausencia de déficit neurológico focal, estado de alerta normal, ausencia de signos de intoxicación, ausencia de dolor y capacidad de rotar la cabeza en 45°. El compromiso de conciencia siempre será criterio de inmovilización[37]. Es así, que existe una necesidad urgente de estudios adicionales para determinar el costo/beneficio de la inmovilización[38].
En el grupo que se inmoviliza la columna, debe colocarse un collar cervical que tenga una ventana libre en la parte anterior para permitir una vía quirúrgica de emergencia en caso necesario (cricotiroidostomía, traqueostomía). El uso de un collar cervical no limita totalmente la movilidad de la columna cervical. Por lo demás, cuando se sospecha una lesión vertebral, toda la columna debe ser inmovilizada, ya que la presencia de otra lesión vertebral no contigua se produce hasta en el 20% de los casos[39]. La inmovilización completa habitualmente se hace mediante una tabla espinal con correas y fijación de la cabeza, junto con el collar cervical, aunque los métodos de inmovilización pueden ser diferentes durante el rescate, la recogida y el transporte. El traslado debe ser cuidadosos y la movilización debe hacerse en bloque.
Una revisión sistemática realizada por un equipo multidisciplinario en relación al cuidado prehospitalario de los pacientes adultos con TRM, realizó las siguientes recomendaciones[40]:
Cuando es necesaria, la inmovilización óptima debe incluir un collar cervical, la inmovilización de la cabeza y una tabla espinal; los pacientes deben ser transferidos de la tabla al ingresar al hospital lo antes posible para minimizar el tiempo en contacto con ella; si los pacientes deben esperar el traslado a otro centro de mayor complejidad deben ser retirados de la tabla mientras esperan; se recomienda el uso de tablas acolchadas o dispositivos aspirados para reducir la presión a nivel occipital y sacro.
– En relación con el manejo de la vía aérea en el sitio del suceso, debe hacerse la maniobra de alineamiento cervical con fijación manual en los pacientes que requieren ser intubados y no solo incluir el collar cervical; los métodos indirectos de intubación siempre provocan menos movimiento cervical que la laringoscopía directa con hoja de Miller.
– El tiempo de transporte al centro hospitalario definitivo tiene un impacto en el resultado final, por lo que debe realizarse antes de 24 horas de ocurrida la lesión.
Es poco probable que el diagnóstico de shock neurogénico se realice con certeza en la fase prehospitalaria, pero si está presente, el objetivo del tratamiento es una presión arterial sistólica de 90 a 100 mmHg, una frecuencia cardíaca de 60 a 100 latidos por min y un flujo urinario superior a 30 ml/h. Para lograr este objetivo puede requerirse la administración de fluidos en forma prudente, atropina (de 0,5 a 1 mg) o el apoyo de inótropos. En pacientes con bradicardia persistente puede repetirse la dosis de atropina hasta alcanzar el techo de ocupación de los receptores muscarínicos ocupados. Si a pesar de esto no hay respuesta, se debe aprovechar el efecto cronótropo positivo de los inótropos beta adrenérgicos.
En el sitio del suceso debe hacerse la primera exploración neurológica básica: la movilización de las 4 extremidades en su parte proximal y distal ante la orden del rescatista puede por un lado dar luces acerca de la indemnidad neurológica medular y, por otro, dar cuenta del nivel de conciencia del paciente. Estos elementos permiten discriminar la necesidad de una intubación precoz.
El prehospitalario es el momento en que tempranamente debe hacerse el manejo de la hipotensión y la hipoxia, para prevenir los daños secundarios. Las complicaciones más graves en el TRM son las cardiovasculares y las respiratorias, que ocurren precozmente si el impacto es grave y la lesión es alta. Si no se tiene la precaución de corregir precozmente la hopotensión y la hipoxia, se pueden producir secuelas neurológicas o incluso la muerte. La presión de perfusión medular debe mantenerse en forma adecuada mediante la corrección de la hipovolemia y eventualmente la administración de vasoconstrictores.
-
Shock medular o espinal
El término “shock espinal” fue introducido por primera vez en 1840 por Hall, al denominar así a una disminución de la irritabilidad muscular y ausencia de reflejos en la parálisis espinal. Posteriormente, Sherrington en 1920 la definió como una ruptura completa de la médula espinal que resulta en una pérdida total de la función motora y sensorial por debajo del nivel de la lesión, así como una pérdida “temporal” de los reflejos tendinosos y el tono muscular, a pesar de que el arco reflejo permanece intacto. La parálisis motora flácida se observa inmediatamente después del inicio agudo de una lesión medular completa por debajo del nivel de la lesión, sin respuestas motoras a los estímulos externos[41]. Este concepto se ha utilizado hasta la fecha.
En términos generales, mientras más severa sea la transección traumática de la médula espinal, fisiológica o anatómica, más profundo es el shock espinal. En los días y semanas siguientes, las reacciones motoras a los estímulos externos reaparecen gradualmente de manera sistemática.
El shock medular produce una pérdida temporal de la totalidad o la mayor parte de la actividad del reflejo espinal por debajo del nivel de la lesión, que se aplica a todos los fenómenos que involucran la sección anatómica o fisiológica de la médula espinal. Resulta de la pérdida temporal completa de todas las funciones neurológicas por debajo de la lesión medular[42].
La definición de shock espinal y el patrón de recuperación de los reflejos o evolución y recuperación del tono muscular sigue siendo tema de debate y controversia hasta la actualidad. Algunos clínicos consideran que el shock espinal termina con la aparición del reflejo bulbocavernoso[43]; otros que termina con la recuperación de los reflejos tendinosos profundos, lo que puede durar varias semanas[44] y finalmente otros, definen la resolución del shock espinal con la recuperación del reflejo del detrusor[45].
El shock espinal después de un evento traumático afecta principalmente a los jóvenes; la edad promedio es de 29 años. Es más común en hombres (80%) que en mujeres. La lesión medular se asocia a fracturaluxación, desgarro de ligamentos, distracción rotacional y desgarro del espacio discal. Si el shock espinal no está asociado con una lesión significativa de la columna vertebral, el pronóstico es más favorable.
Su incidencia es de 19,3% en las lesiones cervicales, de 7% en las lesiones torácicas y de 3% en las lumbares según la base de datos del Trauma Audit and Research Network[46]. Durante un período que puede durar desde unos pocos días hasta 4 a 12 semanas, los reflejos y las sensaciones están ausentes o deprimidos por debajo del nivel de la lesión.
Las repercusiones hemodinámicas de la lesión neurológica consisten en una hipotensión arterial importante, proporcional al nivel de la lesión (en la práctica con un límite máximo cuando la lesión está por encima de T6), asociada a una bradicardia sinusal cuando el daño medular compromete T4 (el vago cardíaco): un shock neurogénico o vasogénico. El diagnóstico precoz y el rápido manejo del shock neurogénico son vitales para prevenir la injuria espinal secundaria. Fisiopatológicamente es un tipo de shock distributivo, que puede asociarse a un shock hipovolémico secundario a hemorragias.
La desaparición del tono simpático es responsable de una vasoplejia sublesional y, por lo tanto, de una hipovolemia relativa. Esto se traduce en una disminución de las posibilidades de adaptación ante pequeñas variaciones de la volemia, mayor sensibilidad a movimientos, cambios de posición y aumentos de presión intratorácica (ventilación mecánica). Las lesiones medulares altas se asocian a una menor tolerancia a la sobrecarga de volumen, debido a depresión cardiaca producto de la denervación simpática[47]. La persistencia de un sistema parasimpático eficiente, explica la bradicardia habitual de estos pacientes, máxima al cuarto día[48]. Se describen bradicardias extremas y asistolias durante aspiración traqueobronquial y durante las maniobras de laringoscopía e intubación[49]. La hipoxia, la hipovolemia y la hipotermia pueden agravar el compromiso circulatorio.
La hipotensión ortostática es frecuente, de modo que los pacientes pueden experimentar una disminución de al menos 20 mmHg en la presión arterial sistólica basal, con un aumento de al menos 10 mmHg en la presión diastólica basal después de un cambio postural (supina a vertical). También pueden experimentar visión borrosa, mareos, fatiga, inquietud y disnea. Se ha sugerido que los factores involucrados en la aparición de hipotensión ortostática incluyen: Acumulación excesiva de sangre en los órganos y extremidades inferiores debido a la reducción de la actividad simpática y la pérdida del tono vascular reflejo por debajo del nivel de la lesión.
– Pérdida de la función muscular de las extremidades inferiores para contrarrestar el encharcamiento venoso.
– Reducción del volumen plasmático como consecuencia de hiponatremia.
– Decondicionamiento cardiovascular resultante del reposo prolongado en cama.
El grado de hipotensión ortostática puede variar según la gravedad y el nivel de la lesión: es mayor en los tetrapléjicos en comparación con los parapléjicos. Los mecanismos de esta hipotensión ortostática son distintos en las diferentes etapas después de una sección medular. En la fase aguda, la aparición de hipotensión ortostática es principalmente el resultado de la pérdida del tono vasomotor supraespinal y la acumulación de sangre en la vasculatura periférica y esplácnica. Por el contrario, en la etapa crónica la hipotensión ortostática está más relacionada con la reducción de la actividad simpática por debajo del nivel de la lesión. Además, la pérdida prolongada de la función muscular por debajo del nivel de la lesión contribuye a la acumulación de sangre en las extremidades inferiores para exacerbar la hipotensión[50].
La hipotensión ortostática puede ser tratada física (evitar los cambios posturales, usar compresores venosos en las extremidades inferiores) y farmacológicamente (vasoconstrictores como la efedrina, agonistas del receptor a-adrenérgico como la midodrina, bloqueadores del receptor de dopamina como la domidona, etc.).
En la etapa aguda, la arritmia más común es la bradicardia sinusal, aunque se ha reportado taquicardia sinusal, taquicardia supraventricular, fibrilación auricular e incluso paro cardíaco. Casi todos los pacientes cuadripléjicos con TRM grave tienen bradicardia persistente, definida como una frecuencia cardíaca media durante al menos 1 día, menor a 60 latidos por min.
Otro fenómeno cardiovascular que se desarrolla en los pacientes con TRM después de un tiempo es la disreflexia autonómica[51]. Se caracteriza por episodios de descarga simpática masiva que causan hipertensión severa asociada a bradicardia. Se trata de un síndrome que se desencadena a menudo por estímulos viscerales o sensoriales desagradables por debajo del nivel de la lesión. Es la razón por la cual estos pacientes, aunque no tengan sensibilidad bajo la lesión, deben ser anestesiados en procedimientos quirúrgicos. Actualmente, los únicos tratamientos son paliativos; cuando un estímulo provoca una disreflexia autonómica, se usan vasodilatadores para controlar la hipertensión, sin embargo un método más efectivo es atenuar los mecanismos contribuyentes, como la reorganización de los circuitos intraespinales por debajo del nivel de la lesión. Debido a la etiología multifacética de la disreflexia autonómica, la terapia más efectiva para restablecer permanentemente la función cardiovascular después de un TRM probablemente sea un enfoque combinado, que incluya agentes farmacológicos, protección neural, regeneración de axones y eliminación de la plasticidad aberrante.
La energía necesaria para producir una fractura de columna con shock medular durante un evento traumático es muy alta, y los pacientes deben ser examinados a fondo para detectar lesiones en otros sistemas. Una paciente que llega a emergencia con TRM debe hacer gatillar el código de activación de trauma, de manera que el equipo de trauma pueda iniciar un estudio completo de su estado hemodinámico, respiratorio y neurológico, incluyendo el score de ASIA (ver más adelante). El examen espinal completo debe considerar los reflejos motores y sensoriales, incluido el reflejo bulbocavernoso y el reflejo del parpadeo anal. La actividad motora y la fuerza disminuyen no solo en los músculos esqueléticos, sino también en los órganos internos como el intestino y la vejiga.
Al evaluar al paciente, debe asumirse el compromiso de la columna vertebral y tomarse todas las precauciones necesarias para mantenerla estable hasta que se obtenga la imagen final y se establezca su indemnidad.
El paciente con shock medular debe tratarse en una UCI, ya que la lesión puede estar asociada a múltiples complicaciones. El shock neurogénico generalmente ocurre con lesiones por encima del nivel T6. El tratamiento inicial es la infusión de norepinefrina en las dosis adecuadas para cada paciente y el uso juicioso de atropina en las bradicardias extremas. Finalmente, en pocos días se logra la estabilización hemodinámica y las drogas vasoactivas pueden disminuirse gradualmente. El uso de metilprednisolona será discutido más adelante.
-
Otros aspectos clínicos de la sección medular
El compromiso respiratorio es proporcional al nivel de la lesión (Tabla 1)[52]. En las lesiones de C1 y C2 la musculatura respiratoria es absolutamente ineficaz. En las lesiones de C3 y C4, (nivel de salida de los nervios frénicos) se produce una parálisis diafragmática y la ventilación es dependiente de la musculatura accesoria. Cuando la lesión se ubica entre C4 y C7, se preserva la inervación diafragmática y existe cierta autonomía ventilatoria relativa y precaria, sin embargo, en términos generales los pacientes con lesión motora completa por encima de C5 casi invariablemente necesitarán soporte ventilatorio. En una lesión más baja el compromiso de la ventilación está relacionado con la desaparición parcial o total de la actividad de la musculatura intercostal y con la ausencia o presencia de actividad en la musculatura abdominal. Lesiones inferiores a T5 no suelen producir insuficiencia respiratoria de origen neuromuscular. En las lesiones torácicas bajas y lumbares, las repercusiones respiratorias son mínimas. Por debajo de T12, la actividad de la musculatura abdominal permanece indemne. Si existe imposibilidad de toser se facilitará la acumulación de secreciones y la aparición de atelectasias.
La insuficiencia respiratoria finalmente es de origen multifactorial. Ocurre como resultado del agotamiento de la musculatura implicada en el proceso ventilatorio, hemorragia o edema medular ascendente, acúmulo de secreciones, atelectasias, otros traumas asociados u otras condiciones del paciente.
Entre otras consecuencias del daño medular se puede observar un íleo paralítico con distensión gástrica, que puede durar 3 a 10 días y que requiere de sondeo gástrico y retención urinaria con vejiga neurogénica que requiere de sondeo vesical.
En lesiones por encima de T6, la interrupción del sistema nervioso autónomo produce alteraciones de la termorregulación, debido a que el hipotálamo es incapaz de controlar la temperatura por pérdida del control vasomotor. De este modo, todo facilita la instalación de hipotermia por vasodilatación sublesional y disminución de la posibilidad de termogénesis por el daño motor que impide producir calor corporal a través de actividad muscular. En el manejo de la fase aguda es importante la monitorización de la temperatura[53].
| Tabla 1. músculos preservados según el nivel de la lesión | |
| Nivel | músculos |
| C1-C3 | Músculos accesorios |
| C3-C5 | Diafragma y músculos accesorios |
| C6-C8 | Diafragma, accesorios y escalenos |
| D1-D5 | Diafragma, accesorios, escalenos e intercostales |
| D6-D10 | Diafragma, accesorios, escalenos, intercostales y abdominales |
-
Reanimación
El TRM se asocia frecuentemente a otras lesiones graves, además del daño neurológico, cuyo manejo pudiera tener precedencia sobre el manejo definitivo de la lesión medular y sobre cualquier estudio radiológico. Es así, que debe priorizarse la reanimación: la permeabilidad de la vía aérea, la ventilación y la reposición de volumen, que son comunes a toda maniobra de resucitación. La mayor parte de la reanimación inicial del paciente con TRM es idéntica a la de otros enfermos traumatizados, sin embargo, existen algunos aspectos específicos.
-
Vía aérea y ventilación
Todos los pacientes deben recibir suplemento de oxígeno. El mayor o menor deterioro de la ventilación, de acuerdo al del nivel de la lesión, depende de la función de la musculatura intercostal y abdominal. Lesiones asociadas, como fracturas costales o trauma torácico, pueden contribuir a deteriorar la ventilación y oxigenación, además del compromiso causado por la denervación de la musculatura respiratoria. Una ventilación inadecuada debe ser manejada con intubación endotraqueal y ventilación mecánica. Una lesión alta empeora no solamente la función respiratoria, sino también la movilización de secreciones. La intubación no debe ser diferida con el pretexto de una lesión demostrada o hipotética de la columna cervical.
El manejo de la vía aérea es muy importante para prevenir cualquier hipoxia que pudiera deteriorar aún más el daño medular. La intubación endotraqueal puede ser dificultosa en pacientes con TRM. El procedimiento a veces es necesario antes de confirmar la lesión y su localización, por lo que, si un paciente requiere ser intubado tras un trauma, debe ser manejado como si tuviese una lesión de columna cervical, asegurando la vía aérea con el mínimo movimiento posible de la columna cervical. La técnica de intubación de urgencia ante una lesión sospechada o conocida de la columna cervical será descrita más adelante.
Si la intubación endotraqueal y ventilación mecánica pueden postergarse hasta el momento de una eventual intervención quirúrgica, debe monitorizarse la necesidad de intubación a través de la PCO2, la capacidad vital y la presión inspiratoria máxima[54]. Se debe intubar y ventilar mecánicamente a estos pacientes con indicaciones similares a las de otros pacientes con insuficiencia respiratoria: cuando la capacidad vital es inferior a 15 ml/kg, cuando la fuerza inspiratoria máxima es inferior a -20 cmH2O, cuando la relación PaO2/FiO2 es inferior a 250 o cuando la presencia de atelectasias o infiltraciones del parénquima en una radiografía de tórax imponen una asistencia ventilatoria[55].
La descompensación respiratoria puede no ser inmediata, sino después de las primeras 24 h, en que a menudo se observa una progresión cefálica del déficit neurológico asociado a un edema perilesional, o después de algunos días en que se produce una fatiga diafragmática como resultado del gran aumento de trabajo respiratorio. De hecho, la insuficiencia respiratoria ocurre con más frecuencia tras el cuarto día de la lesión, y esto es relevante de cara a la monitorización y a la consideración de mantener la intubación postoperatoria en pacientes con intervención quirúrgica precoz, especialmente en las fijaciones cervicales.
La insuficiencia respiratoria puede ser agravada por edema pulmonar o aspiración de contenido gástrico. El edema pulmonar secundario a TRM puede ser de origen cardiogénico (por altos niveles de catecolaminas y betaendorfinas) y/o no cardiogénico (hiperpermeabilidad pulmonar). El mecanismo predominante puede determinarse con ecocardiografía transtorácica, básicamente determinando la función ventricular izquierda.
Los pacientes con TRM deben ser mantenidos en posición supina y no pueden ser girados si ocurre regurgitación, sino que deben ser puestos rápidamente en posición de Trendelenburg para luego ser aspirados. Una aspiración orofaríngea muy vigorosa, puede producir una fuerte estimulación vagal y paro cardíaco, que puede evitarse con un pretratamiento con atropina.
-
Presión arterial y circulación
Es importante mantener una presión de perfusión medular y una oxigenación adecuadas para evitar aumentar el daño neurológico. El shock puede ser el resultado de hipovolemia relativa secundaria al bloqueo simpático sublesional, pero comúnmente el cuadro es potenciado por una hipovolemia secundaria a hemorragia asociada o por otras condiciones coadyuvantes. De este modo, una hipotensión persistente no siempre debe ser atribuida al shock medular hasta descartar otras causas de inestabilidad hemodinámica, como: hemorragia, neumotórax, contusión miocárdica, taponamiento cardiaco, sepsis relacionada con lesión abdominal, insuficiencia suprarrenal, etc. Otra causa de hipotensión en el TRM es el bloqueo del simpático cardíaco en lesiones sobre T5, que pueden conducir a bradicardia y disminución de la contractilidad. En tal situación es importante la disponibilidad de cronótropos e inótropos (atropina, adrenalina, noradrenalina), inhibidores de la fosfodiesterasa (aminofilina, teofilina) y estimulante b2 (salbutamol), especialmente en pacientes con TRM cervical.
El objetivo de la reanimación inicial consiste en optimizar en el menor plazo posible la distribución tisular de oxígeno a nivel medular. Esto implica un adecuado transporte de oxígeno, la restauración de la presión de perfusión medular y el mantenimiento de una PaCO2 normal. Sin embargo, se desconoce el objetivo de resucitación más apropiado y la presión arterial media óptima para mantener la perfusión medular. Estudios no controlados que utilizaron fluidos y vasopresores para lograr una presión arterial media de 85 mmHg durante un mínimo de 7 días en pacientes con sección medular han demostrado resultados favorables[56],[57]. Numerosos trabajos sostienen que debe identificarse la hipotensión, buscar la causa e iniciar resucitación con fluidos. Desde el punto de vista de la evidencia, son necesarios más estudios para definir la presión arterial media ideal, el papel de los fluidos y el soporte farmacológico en este objetivo.
La reanimación precoz mediante la administración de fluidos es lo más importante en el tratamiento de la hipotensión, con el objetivo de mantener una perfusión adecuada y prevenir el daño neurológico secundario. El déficit de base y el lactato pueden utilizarse para una mejor evaluación del estado de shock y la necesidad de iniciar la reanimación con fluidos.
En la mayoría de los centros se sigue en este tipo de pacientes las normas de reanimación de la ATLS del American College of Surgeons, en base a una agresiva administración de cristaloides, preferiblemente ringer lactato, continuando con bolos repetidos de ringer y si es necesario glóbulos rojos cuando hay una fuente de hemorragia, mientras no pueda ser corregida quirúrgicamente. El uso de coloides puede considerarse cuando comienza a desarrollarse edema tisular generalizado después de una agresiva resucitación con cristaloides, que puede comprometer la función de los órganos, como el pulmón y en que aún persisten evidencias de depleción intravascular. Existe evidencia de que los coloides (particularmente la albúmina) también producen un significativo edema cerebral y pulmonar, por lo que deben ser usados con precaución en pacientes con TRM y compromiso de conciencia por contusión cerebral asociada. Aunque en general, la elección del tipo de fluido administrado puede tener muy pequeño o ningún efecto sobre el resultado final, en el contexto del trauma, el uso de coloides se asocia a un aumento de la mortalidad.
También se debe tener en cuenta que los nuevos protocolos de resucitación de control de daños, que
se aplican en pacientes politraumatizados con hemorragias severas, consideran entre otras medidas, la limitación del aporte de cristaloides, con rápida activación de un protocolo de transfusión masiva, terapia que ayudará a optimizar las condiciones de perfusión medular.
-
Temperatura
Desde el comienzo de la reanimación debe cuidarse la temperatura del medio ambiente, de las soluciones y de los diferentes dispositivos que evitan la pérdida de calor corporal, pues se ha demostrado que una hipotermia severa secundaria a la sección medular y a la administración de soluciones endovenosas frías pueden interferir con la reanimación en la fase inicial.
Se produce una alteración del control de la temperatura, especialmente en pacientes con lesiones cervicales y torácicas altas, debido en gran medida a la disminución de las aferencias sensoriales a los centros de regulación térmica, a la pérdida del control simpático de la temperatura y la regulación del sudor por debajo del nivel de la lesión. Esto produce una serie de trastornos, especialmente poiquilotermia (incapacidad para mantener una temperatura central constante independientemente de la temperatura ambiente), e inestabilidad térmica (fluctuaciones de temperatura: hipotermia e hipertermia).
Después de la fase aguda, la lesión de la médula espinal produce adaptaciones fisiológicas que afectan la producción de calor (masa muscular reducida) y la disipación del calor (redistribución de la sangre y capacidad de sudoración reducida por debajo del nivel de la lesión). Sin embargo, es el equilibrio entre estos factores lo que determina si se alcanza el equilibrio térmico[58].
-
Diagnóstico
Una vez ingresado un paciente con trauma raquimedular y activado el equipo multidisciplinario, deben continuarse las medidas de inmovilización y de soporte vital y empezar la etapa de diagnóstico y los tratamientos específicos.
-
Examen neurológico
Una vez descartada una urgencia absoluta que necesite cirugía para controlar la hemostasia, la primera aproximación diagnóstica se hace evaluando el estado de conciencia con la escala de puntaje de Glasgow y el mecanismo de la lesión con los antecedentes del accidente.
Se continúa con un examen neurológico básico. Si el paciente está consciente puede realizarse una evaluación motora y sensitiva más detallada, pero habitualmente el paciente está con compromiso de conciencia por el trauma o la sedación o incapacitado de comunicarse si está intubado. Ante estas circunstacias debe considerarse que el paciente tiene daño medular y sospechar especialmente si tiene algunos signos clínicos como:
– Parálisis o paresia de extremidades.
– Alteraciones de la sensibilidad en el tronco o las extremidades.
– Dificultades en el lenguaje.
– Respiración diafragmática.
– Hipotensión con bradicardia paradojal.
– Dolor o deformidad de la columna vertebral.
– Ausencia de dolor ante lesiones previsiblemente dolorosas.
– Posición en flexión de codos.
– Parestesias.
– Priapismo.
– Incontinencia urinaria y rectal.
En una segunda inspección un especialista debe efectuar un detallado examen neurológico, para registrar exactamente el nivel del metámero sensitivo y motor de la lesión, de acuerdo a los Estándares Internacionales para la Clasificación Neurológica de la Lesión Medular Espinal de la American Spinal Injury Association (ASIA)[59] y de la International Spinal Cord Society[60], y si se trata de una lesión completa o incompleta. El nivel neurológico corresponde al segmento más caudal de la médula en que la función sensitiva y motora es normal en ambos lados del cuerpo; es el más cefálico de los niveles sensitivo y motor.
El daño neurológico secundario a una lesión medular se clasifica en completo o incompleto, de acuerdo al compromiso de la región sacra. La persistencia de sensibilidad perineal y de función esfinteriana (tonicidad, contracción voluntaria y reflejo anal), traducen una lesión de carácter incompleto y de mejor pronóstico. Las lesiones progresivamente más altas de la médula espinal causan grados crecientes de disfunción autonómica simpática, mientras que las lesiones de la médula inferior pueden causar disfunción autonómica parasimpática (priapismo y pérdida de la función de la vejiga y el intestino). La presencia de signos piramidales es rara en la fase inicial de una lesión medular y debe hacer pensar en una lesión completa, por lo que constituye un mal pronóstico. Clínicamente no es una lesión todo o nada y hay diferentes grados de lesión; la escala ASIA clasifica el daño neurológico en 5 grados, que tienen un valor pronóstico:
– Grado A (lesión medular completa): ausencia de función motora y sensitiva que se extiende hasta los segmentos S4-S5.
– Grado B (lesión incompleta sensitiva): preservación de la función sensitiva que se extiende hasta los segmentos S4-S5, con ausencia de función motora.
– Grado C (lesión completa motora): preservación de la función motora por debajo del nivel neurológico y más de la mitad de los músculos por debajo del nivel neurológico con un balance muscular menor de 3.
– Grado D (lesión incompleta motora): preservación de la función motora por debajo del nivel neurológico y al menos la mitad de los músculos por debajo del nivel neurológico con un balance muscular mayor o igual a 3.
– Grado E (ausencia de lesión): las funciones motora y sensitiva son normales en todos los segmentos.
-
Imagenología
Los pacientes con dolor en el cuello, con sensibilidad en la columna vertebral, signos o síntomas de déficit neurológico relacionados con la columna vertebral y aquellos que no pueden ser evaluados clínicamente por estar inconscientes, no cooperadores, incoherentes o bajo intoxicación de alcohol u otras drogas, necesitan un estudio imagenológico de la columna vertebral[61].
Como un intento de identificar a los pacientes con bajo riesgo de fractura, subluxación o dislocación cervical, se diseñó el protocolo NEXUS (acrónimo de National Emergency X-Radiography Utilization Study), que consta de cinco criterios: ausencia de dolor cervical en la línea media posterior, ausencia de intoxicación, falta de compromiso de conciencia, ninguna otra lesión dolorosa ni déficit neurológico[62]. Los pacientes que cumplen todos estos criterios tienen muy bajo riesgo de lesión cervical y se puede evitar el examen imagenológico, con una sensibilidad de 99% y un valor predictivo negativo de 99,9% para las lesiones de columna cervical. A pesar de todo, la base de datos del proyecto NEXUS demostró que esta técnica no diagnostica una lesión cervical en el 2,8% de los pacientes con trauma cervical y el 0,07% del total pacientes evaluados con este método.
Otro protocolo que aborda el mismo tema es el CCSR (acrónimo de Canadian C-Spine Rule), que plantea 3 preguntas: la presencia de un factor de alto riesgo que exige una radiografía (edad > 65 años, mecanismo peligroso de trauma o parestesia en extremidades), la presencia de factores de bajo riesgo que permiten una evaluación segura del rango de movimiento y la capacidad de rotar activamente el cuello a la izquierda y la derecha. La sensibilidad de este protocolo es de 100% y la especificidad del 42,5% para las lesiones de columna cervical[63].
El tipo de imagen de elección es la tomografía axial computarizada (TAC). Si no hay disponibilidad, se recomienda una radiografía de columna en tres planos: anteroposterior, odontoidea y lateral, que luego se complemente con una TAC (Figura 1). Un TAC permite observar mejor el rasgo de las fracturas, el retroceso de la pared vertebral posterior y los fragmentos libres en el canal vertebral. Debe efectuarse cuando existen áreas que no pueden ser vistas o son sospechosas, o si el paciente se queja de dolor cervical a pesar de radiografías normales (Figura 2). Tiene una especial indicación en las lesiones torácicas y lumbares. La TAC es el examen de imagen de primera línea en los pacientes con TRM y politraumatismo, porque proporciona imágenes rápidas con una mejor visualización de las lesiones óseas.
La resonancia nuclear magnética (RNM) ha llegado a ser un examen diagnóstico de gran valor, pues permite una visualización directa de la médula sin el uso de medios de contraste. Se ha convertido en el estándar de oro para evaluar la compresión activa de la médula espinal o la lesión vascular, en los pacientes estabilizados, que pueden ser trasladados a un servicio de imagenología. Es un examen difícil de realizar en la urgencia inmediata, pues necesita un escenario técnico especialmente adaptado y plantea problemas específicos de traslado de pacientes en malas condiciones hemodinámicas, monitorizados invasivamente, sedados y eventualmente con otras lesiones asociadas. Bajo estos términos, está indicada en pacientes previamente estables, que manifiestan una progresión del déficit neurológico, así como en quienes el nivel neurológico del daño parece estar por sobre el nivel aparente de la lesión de la columna.
Es un examen especialmente útil en la fase inicial, en lo posible dentro de las primeras 48 horas, pues revela las lesiones primarias del impacto y permite seguir la progresión de las lesiones en la fase aguda. Puede detectar lesiones en el 6% de los casos en los que la TAC es normal y es particularmente útil para las lesiones de los ligamentos. También es una herramienta valiosa para clasificar la gravedad y predecir el resultado en función de la presencia de hemorragia, la extensión del edema y la gravedad de la compresión inicial. Una imagen de resonancia magnética inicial normal se asocia generalmente con la recuperación completa.
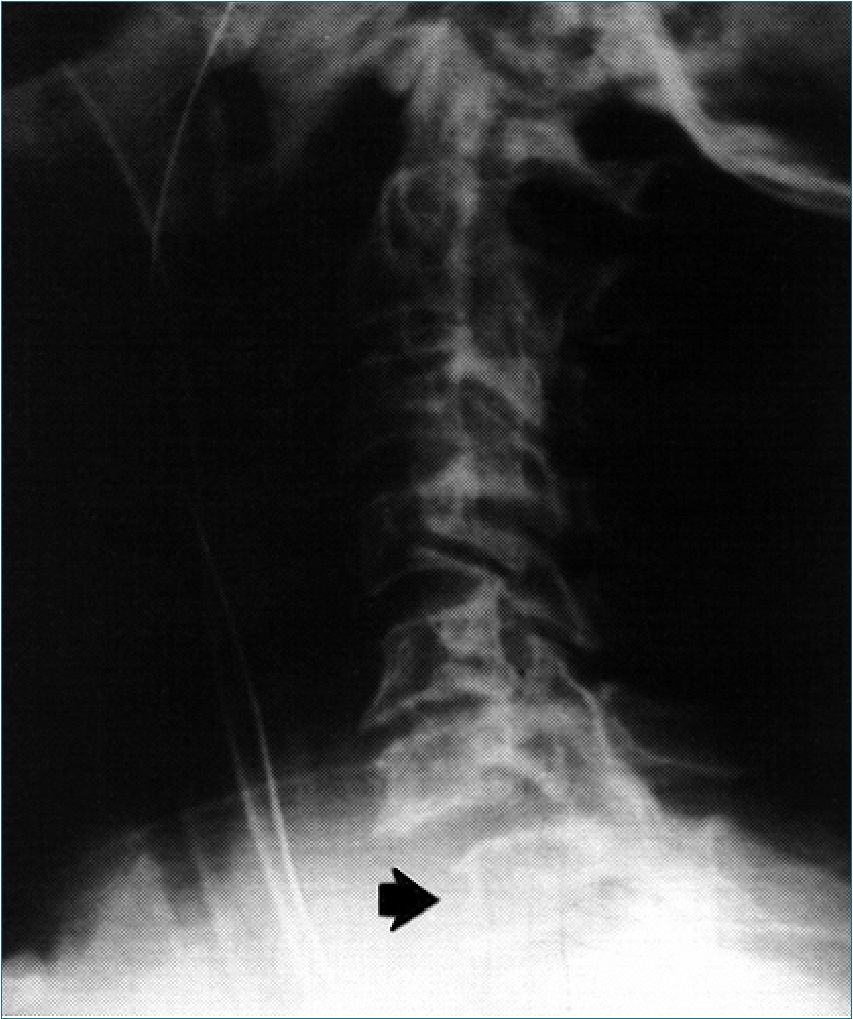
Figura 1. Radiografía de columna cervical de lateral, que muestra una luxación C6-C7 (flecha), no observada en la vista anteroposterior. La vista de perfil permite observar especialmente la unión cérvico-torácica (C7 y T1), bajando los hombros.
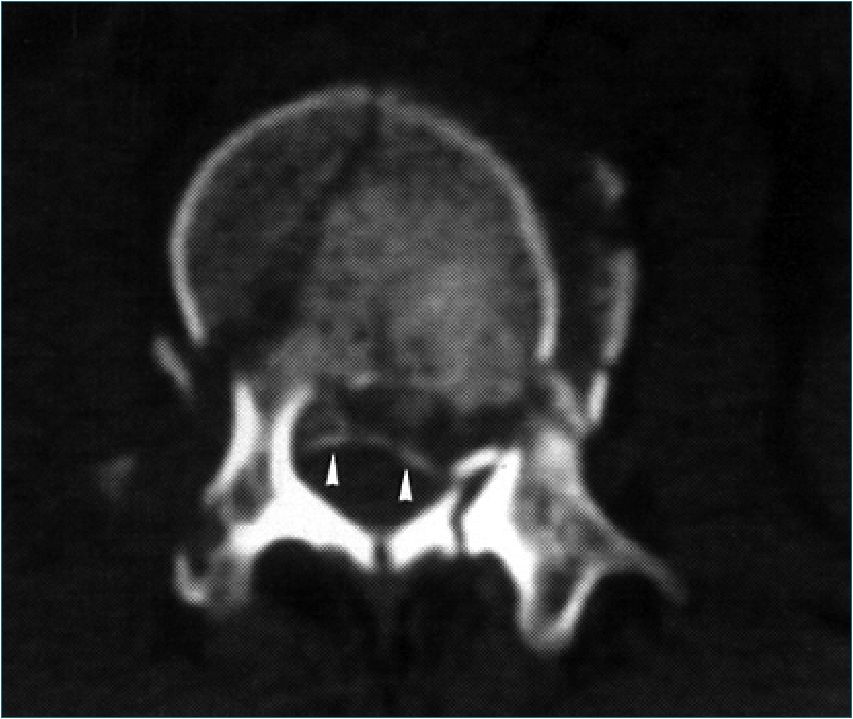
Figura 2. TAC de una vértebra lumbar que muestra un retroceso de la pared posterior que obstruye el canal y comprime la médula espinal (flechas).
A pesar del advenimiento de estas nuevas técnicas de imagen, en condiciones de urgencia la radiografía simple sigue siendo la técnica más importante en el diagnóstico de una lesión de columna, quedando la resonancia nuclear magnética indicada especialmente si existen síntomas clínicos de mielopatía traumática sin características radiográficas o tomográficas computarizadas de fractura de la columna o inestabilidad (SCIWORA spinal cord injury without radiological abnormality). Con el advenimiento de la RNM la detección se SCIWORA ha aumentado significativamente, llegándose a 97% de los casos de hernias discales traumáticas, hematomas extradurales y contusiones medulares, que constituyen 2,8% a 3,8% de las lesiones espinales y 0,07% de todos los traumas contusos[64],[65].
Hay consenso en cómo descartar el diagnóstico de lesión de columna cervical en los pacientes sin compromiso de conciencia, pero la mejor aproximación para descartar este tipo de lesiones en pacientes con estado de conciencia alterado sigue siendo una controversia. En algunos centros, a pesar de contar con estudios sofisticados, no se aclara el diagnóstico de lesión cervical hasta la recuperación completa de la conciencia.
En base a la limitada evidencia disponible y la experiencia clínica, se recomienda que se realice RNM en pacientes adultos con TRM antes de la intervención quirúrgica, cuando sea posible, para facilitar una mejor toma de decisiones clínicas (evidencia muy baja) y antes o después de la cirugía, para mejorar el pronóstico del resultado neurológico (evidencia baja) [66].
-
Tratamiento
Las modalidades de tratamiento actuales se centran en minimizar la lesión secundaria y maximizar la función residual a través de la rehabilitación. Estos tratamientos experimentales prometedores se centran en la neuroprotección con hipotermia y terapias farmacológicas, la regeneración mediante trasplante de células y el rewiring con estimulación eléctrica. Es importante probar los enfoques combinados que incluyen estrategias neuroprotectoras, reparadoras y de rehabilitación para maximizar los mecanismos de recuperación.
Se abordará a continuación las terapias con mayor evidencia en el manejo hospitalario (cirugía) y posteriormente las terapias emergentes (agentes neuroprotectores y neurorregenerativos). Los agentes neuroprotectores actúan en el proceso de lesión secundaria disminuyendo el grado de daño neurológico, en tanto los neurorregenerativos permiten la regeneración neuronal a través de diversos mecanismos. Ambas estrategias son probablemente más efectivas cuando se hacen juntas y constituyen un extenso campo de investigaciones actuales y futuras, sin embargo, aunque se ha realizado muchos esfuerzos para desarrollar tratamientos efectivos para limitar o disminuir las lesiones neurológicas ocasionadas por el TRM, las terapias comprobadas dirigidas a la regeneración neurológica y la recuperación funcional han sido de eficacia limitada[67].
-
Cirugía descompresiva
La tendencia general es a la descompresión quirúrgica precoz, para disminuir el período de compresión de la médula espinal. Estudios en animales avalan esta disposición; un metaanálisis realizado el 2013 en 21 estudios en animales demostró que la descompresión quirúrgica precoz de la médula mejora en un 35% los comportamientos neuroconductuales, de modo que la velocidad con que se actúa es uno de los factores claves para la mejoría[68]. En humanos, existen estudios que han investigado el impacto de la cirugía temprana en los resultados neurológicos, sin embargo, no hay estudios que hayan comparado descompresión quirúrgica versus no descompresión quirúrgica. Lo lógico es que la cirugía alivie el aumento de presión producido por el edema y la hemorragia sobre la microcirculación, reduciendo así la hipoxia y la isquemia secundarias[69].
Existe acuerdo en que se trata de una urgencia quirúrgica cuando la lesión medular es incompleta o se produce un agravamiento progresivo en las primeras horas. Sin embargo, en el caso de lesión medular completa, la indicación de la urgencia es discutible. Las alternativas quirúrgicas son varias: eliminación de compresiones directas (medulares o radiculares), estabilización y alineamiento del canal y la columna vertebral, reducción de fracturas y luxaciones, exploración del canal medular.
Muchos estudios han tratado de dilucidar el mejor momento para la intervención, pero todavía no se ha establecido el momento óptimo con estudios prospectivos y aleatorizados. En general se está de acuerdo en realizar la intervención lo antes posible, aunque se debe balancear el riesgo de la cirugía de urgencia y de la anestesia con los potenciales beneficios. Por ejemplo, puede ser necesario postergar una cirugía precoz cuando hay una contusión pulmonar severa[70].
El STASCIS (Surgical Timing in Acute Spinal Cord Injury Study) comparó pacientes que fueron sometidos a cirugía antes y después de 24 h de ocurrida la lesión. El primer grupo tuvo más del doble de probabilidades de tener una mejoría en la escala de deterioro ASIA de dos grados a los 6 meses de seguimiento y una tasa similar de complicaciones en comparación con el grupo con cirugía tardía (el 19,8% de los pacientes intervenidos precozmente frente al 8,8% de los intervenidos más tardíamente)[71]. Estos hallazgos se confirmaron con un estudio de cohorte canadiense incluso después de ajustar el estado preoperatorio y el nivel neurológico[72].
Los datos de estudios experimentales están a favor de la descompresión precoz, pero desde el punto de vista clínico hay poca evidencia que demuestre la viabilidad y seguridad de ésta[73]. De este modo, aunque no hay suficiente evidencia de que la descompresión precoz se asocie a mejores resultados neurológicos, puede en la actualidad efectuarse en forma segura en centros hospitalarios que dispongan de equipos multidisciplinarios especializados, para maximizar las posibilidades y el grado de recuperación.
Las últimas guías clínicas de la AOSpine (comunidad académica mundial de la columna vertebral que promueve la excelencia en la atención al paciente y los resultados finales) en relación al paciente con TRM “sugieren”[74]:
– La cirugía precoz (definida como antes de las 24 h de ocurrida la lesión) debe considerarse como el tratamiento de elección en los pacientes adultos con lesión medular (calidad de evidencia baja; fuerza de recomendación débil).
– La cirugía precoz es la opción independientemente del nivel de la lesión (calidad de evidencia baja; fuerza de recomendación débil).
Es así como ha surgido el concepto “time is spine”[75], especialmente en lo referente a la estabilización rápida de los TRM cervicales, siendo la última recomendación, hasta que no haya otra evidencia, la descompresión quirúrgica en las primeras 24 h. La lesión medular tiene un mecanismo bifásico y aunque la lesión primaria puede ser irreversible y no prevenible, la lesión secundaria puede atenuarse con intervenciones que incluyen la cirugía.
A pesar del avance en los métodos diagnósticos de imágenes y la seguridad de las técnicas anestésicas actuales, sigue habiendo autores que recomiendan un tratamiento no quirúrgico: el Active Physiologic Conservative Management (ACPM), argumentando los buenos resultados del manejo conservador y la debilidad de los argumentos para el manejo quirúrgico[76].
-
Metilprednisolona
Aunque los glucocorticoides se consideran neuroprotectores, es bueno mencionar el uso de metilprednisolona (MPS) en forma independiente por la gran cantidad de información existente y las contradicciones que han surgido a lo largo del tiempo. De hecho, comprenden los estudios terapéuticos más grandes realizados en la historia de la investigación del TRM.
Varios estudios controlados aleatorios, incluido los tres NASCIS (National Acute Spinal Cord Injury Studies),[77],[78],[79], han investigado la eficacia y seguridad de la MPS en pacientes con lesión medular cervical aguda. Las recomendaciones clínicas sobre su uso o la selectividad de su uso han ido cambiando en el transcurso de los años.
Se cree que la MPS actúa reduciendo la peroxidación de membranas y disminuyendo la inflamación. Estudios en animales y humanos han sugerido que la MPS puede minimizar el daño inflamatorio secundario que ocurre después de las lesiones agudas de la médula espinal, lo que facilitaría en alguna medida la recuperación neurológica, pero la eficacia de este tratamiento ha sido muy debatida, debido al escaso beneficio demostrado y a los potenciales efectos adversos graves y perjudiciales (depresión del sistema inmunológico, neumonía, sepsis, hiperglicemia, hemorragia gastrointestinal e incluso muerte)[80].
La decisión definitiva parecía haber llegado en 2015 después de un metaanálisis patrocinado por Cochrane, que demostraba que altas dosis de MPS (30 mg/kg en bolo durante 15 min, manteniendo una infusión de 5,4 mg/kg/h las siguientes 24 h), producían una significativa recuperación de la función motora, sin aumentar la mortalidad, si se administraban durante las primeras 8 horas desde ocurrida la lesión[81]. Sin embargo, la metodología del estudio y los conflictos de interés de los autores, han hecho repensar esta determinación. Un nuevo metaanálisis llevado a cabo en 2016 con nuevos estudios publicados demostró que la MPS no se asociaba a una recuperación neurológica a largo término[82].
Una revisión sistemática realizada en 2017 por un grupo multidisciplinario (Guideline Development Group), permitió la elaboración de una guía de recomendación clínica basadas en la escala GRADE de evidencia[83]. El resultado demostró que: no hubo diferencias en la recuperación motora en ningún momento en los pacientes tratados con MPS en comparación con los que no recibieron tratamiento; cuando se administró la MPS dentro de las 8 h posteriores a la lesión, los resultados combinados a los 6 y 12 meses indicaron mejoras modestas en las recuperación motora en el grupo tratado en comparación con el grupo control y finalmente, no hubo diferencias estadísticas en cuanto a complicaciones entre el grupo tratado y el no tratado. De este modo la guía “sugiere”: No administrar una infusión de altas dosis de MPS a pacientes que ingresen después de 8 h con una lesión aguda de médula espinal (calidad de evidencia moderada; fuerza de recomendación débil).
– Como una opción de tratamiento, administrar MPS en dosis altas e infusión durante 24 horas a pacientes que ingresen antes de 8 h con una lesión aguda de médula espinal (calidad de evidencia moderada; fuerza de recomendación débil).
– No administar una infusión de altas dosis de MPS durante 48 h en pacientes con lesión aguda de médula espinal (calidad de evidencia sin estudios incluidos; fuerza de recomendación débil).
De acuerdo con la evidencia actual entonces, la administración de MPS debe ser sopesada cuidadosamente en cada caso. Ante una lesión medular aguda no estabilizada o con deterioro neurológico, podría iniciarse la administración de MPS las primeras horas con pautas cortas y considerando los posibles efectos secundarios. Es poco probable que la evidencia adicional decida este debate. La opinión de los pacientes tiene alguna posibilidad de romper este estancamiento; los pacientes que pueden hacer un consentimiento informado y enterarse de los riesgos y beneficios de la MPS, optan por preferir su administración y considerar su enfermedad como maligna, donde se tolera posibles efectos secundarios, aunque los beneficios sean escasos[84].
Se estudió la aplicación de esta recomendación en distintas regiones del mundo mediante un cuestionario electrónico. El resultado demostró que el 53% de los cirujanos que tratan a los pacientes con TRM usó MPS, basados especialmente en el estudio NASCIS III. Los médicos tratantes de Latinoamérica, Medio Oriente y Asia-Pacífico tienen una significativa mayor tendencia al uso de MPS que los de Norteamérica[85].
-
Neuroprotección
En los últimos años ha surgido una serie de estrategias neuroprotectoras y regenerativas, que han sido objeto de una activa investigación en ensayos clínicos, o que están llegando a su fase final. Entre los ensayos en curso se encuentran RISCIS (riluzol), INSPIRE (Neuro-Spinal Scaffold), MASC (minociclina) y SPRING (VX-210)[86]. Los neuroprotectores son sustancias que apuntan a disminuir los daños secundarios. Se ha estudiado diversos enfoques, y muchos otros están actualmente siendo investigados:
– Gangliósidos: son moléculas de glicolípidos presentes en la membrana neuronal. Estudios de laboratorio han demostrado que pueden mejorar la regeneración axonal y prevenir la actividad antiexcitotóxica. Sin embargo, un ensayo controlado aleatorio del compuesto gangliósido no informó
diferencias en la recuperación neurológica después de seis meses[87].
– La naloxona fue ensayada en el segundo estudio NASCIS, conjuntamente con la metilprednisolona y un placebo, no obteniéndose resultados significativos[88].
– El nimodipino, es un bloqueador de los canales da calcio tipo L que prevendría la producción de enzimas apoptóticas dependientes del calcio y bloquea la liberación presináptica de glutamato. Su uso no ha demostrado diferentes resultados neurológicos comparados con el uso de placebo[89].
– El mesilato de tirilazad atenúa la peroxidación de la membrana neuronal. Fue ensayado en el tercer estudio NASCIS, sin diferencias entre los grupos. No hay estudios controlados con placebo.
– El riluzol, un bloqueador de los canales de sodio, reduciría la lesión secundaria al bloquear la activación patológica de los canales de sodio y disminuir la liberación de glutamato. Una revisión reciente de 37 estudios concluye que el TRM tiene demasiadas secuelas negativas como para desechar los estudios en animales y seres humanos que demuestran que el riluzol es una intervención farmacológica prometedora para atenuar los efectos devastadores de esta afección[90].
– La minociclina es un antibiótico desarrollado a partir de la tetraciclina, con propiedades antiinflamatorias: ha demostrado efectos neuroprotectores prometedores en una variedad de modelos animales, disminuyendo el tamaño de las lesiones, la pérdida neuronal en animales y mejorando la puntuación motora ASIA en un ensayo de fase 2 en humanos[91]. Además, disminuye la severidad de la disreflexia en modelos experimentales en ratas[92].
– El litio ha mostrado beneficios en el TRM, protegiendo las células nerviosas después de la lesión mediante la reducción de la inflamación, aumentando la producción y liberación de las neurotrofinas, estimulando la neurogénesis y la autofagia e inhibiendo la apoptosis[93].
– Otras sustancias, como el factor de crecimiento de fibroblastos, su análogo llamado SUN 13837, así como el factor estimulante de colonias de granulocitos de citoquinas están siendo estudiados como neuroprotectores.
No sólo fármacos, sino técnicas tan antiguas como la hipotermia o la oxigenación hiperbárica tienen efecto neuroprotector. La hipotermia, reduce el metabolismo basal del sistema nervioso central, reducen la inflamación, la apoptosis, la excitotoxicidad, el edema, la gliosis y aumentan la angiogénesis en modelos animales. Modelos animales de TRM han mostrado mejoría con la disminución transitoria de la temperatura. Un estudio piloto en seres humanos llamado LME, demostró una tendencia hacia la recuperación del deterioro neurológico (43% versus 21%), sin diferencias en las complicaciones[94]. Un estudio realizado evaluando el puntaje ASIA en 35 pacientes sometidos a hipotermia de 33 °C durante dos días, comenzando 6 horas después de la lesión que obtuvo resultados prometedores[95]; esto condujo a un ensayo de fase II / III, aun en desarrollo (The Acute Rapid Cooling Therapy for Injuries of the Spinal Cord), que planea evaluar diferentes períodos de hipotermia precoz.
El uso de hipotermia moderada (33 °C) parece ser seguro y aportar algunos beneficios en términos de recuperación a largo plazo[96]. Una hipotermia profunda, por el contrario, puede producir complicaciones como coagulopatía, inestabilidad hemodinámica e infecciones.
La oxigenación hiperbárica ha mostrado efectos neuroprotectores prometedores en varios estudios experimentales, pero el número limitado de informes clínicos ha mostrado resultados contradictorios[97].
-
Neurorregeneración
Existen diferentes alternativas terapéuticas que utilizan mecanismos de reparación endógenos y exógenos. El objetivo es superar las barreras de la recuperación, como la pérdida del marco estructural, la cavitación quística, la cicatrización astroglial y la señalización molecular inhibitoria. Este tipo de terapia podría beneficiar fundamentalmente a los pacientes con TRM que han superado la fase aguda, que son el mayor número. Entre algunas de las alternativas investigadas y aún en estudio están:
– El cethrin: es un antagonista recombinante de la proteína Rho (proteína que ocasiona inhibición del crecimiento axonal y el desarrollo del cistoesqueleto neuronal). Aplicado a la duramadre de pacientes con TRM cervical ha demostrado una mejoría de la puntuación motora después de 1 año de seguimiento[98].
– El antinogo: es un anticuerpo monoclonal diseñado para bloquer el nogo-A en experimentación animal (proteína que bloquea el crecimiento axonal en el sistema nervioso central y, por lo tanto, promueve el crecimiento neuronal)[99].
– El gangliósido GM-1 (Sygen) es un glucolípido formado por unidades de oligosacáridos cargados negativamente. Los gangliosidos se concentran especialmente en las terminaciones nerviosas del
sistema nervioso central y promueven la regeneración axonal. Los estudios controlados aleatorizados, sin embargo, no han demostrado que con su uso se obtenga una mejoría neurológica significativa[100].
– El trasplante de células madre y subtipos de células madre autólogas (células madre derivadas de médula ósea, células de glía envolvente olfativa, células de Schwann, células madre adultas derivadas de tejido neural, macrófagos autólogos activados y células madre de embriones humanos) son modalidades prometedoras de regeneración[101]. En estudios preclínicos, el trasplante celular solo o en combinación con otras terapias se ha asociado a recuperación neurológica, sin que ningún subtipo muestre superioridad sobre el otro. El transplate celular sigue siendo una terapia experimental y de investigación, sin recomendaciones formales.
-
Manejo anestésico
El anestesiólogo puede estar implicado en varias etapas del manejo de un paciente con TRM: en el prehospitalario en aquellos países que cuentan con servicios de rescate medicalizado (no es el caso de Chile); en la reanimación inicial, como parte del equipo multidisciplinario (especialmente el manejo de la vía aérea); en la cirugía de estabilización de columnas; en el manejo de complicaciones quirúrgicas que requieren del anestesiólogo; en el tratamiento del dolor neuropático en la fase crónica.
La cirugía de estabilización de columna es de larga duración. El objetivo de la anestesia debe ser el mantenimiento de la presión de perfusión medular dentro de los límites más estables. Si hay hipotensión arterial, el flujo sanguíneo medular se hace inadecuado porque la autorregulación puede estar alterada o ausente. Algunos autores creen que cierto grado de hipertensión pudiera ser beneficioso, aunque hay evidencias en experimentación animal de que la hipertensión puede aumentar el edema y la hemorragia de la médula espinal. Se ha intentado aumentar el flujo sanguíneo medular mediante el drenaje de líquido cefalorraquídeo, pero no se han demostrado beneficios. Lo más importante en este sentido parece ser el mantener una posición adecuada durante la cirugía, que permita el drenaje fisiológico de líquido cefalorraquídeo.
Los mayores problemas para el anestesista son el manejo de la vía aérea en las lesiones cervicales y las repentinas variaciones de volumen por pérdidas de sangre e hipotermia.
La embolia aérea a partir del territorio venoso es una complicación relativamente común en este tipo de cirugía, por lo que hay que estar atentos a signos precoces como arritmias (taquicardia), hipotensión, hipoxemia y una caída rápida y significativa de la ET CO2.
El anestesiólogo al conocer la fisiopatología del TRM Pueden prevenir o minimizar las lesiones neurológicas secundarias y realizar un plan específico para el manejo perioperatorio del paciente (Figura 3).
-
Evaluación
El 80% de los pacientes con TRM son politraumatizados y requieren atención especial debido al riesgo de injuria secundaria por hipoperfusión e hipoxemia. Existe todo un rango de comorbilidad y lesiones multisistémicas que pueden presentarse y deben ser evaluadas.
Si es posible hacer una historia, puede servir para determinar la causa de la lesión, que permite anticipar un patrón de ésta. Por ejemplo, los choques por atrás, pueden causar daños con un modelo de síndrome centromedular. El lapso transcurrido entre la lesión y el tratamiento permite determinar el uso de anticoagulantes, hipotermia y MPS en los centros en los que se usa.
Siempre es necesario realizar una evaluación inicial de la vía aérea, el estado respiratorio y hemodinámico del paciente, antes de la evaluación de la columna. Los pacientes con lesión medular deben ser monitoreados en cuidados intensivos y controlarse una eventual insuficiencia respiratoria o inestabilidad hemodinámica.
En todo paciente politraumatizado que va a ser sometido a cirugía se debe descartar una fractura cervical para confirmar la estabilidad del cuello, antes de la inducción de la anestesia. Si se trata específicamente de un TRM a nivel cervical, la columna debe inmovilizarse antes de la cirugía y la inducción anestésica, si el tiempo lo permite.
Los pacientes pueden tener patología pulmonar derivada del trauma o de comorbilidad previa. Si es posible, debe hacerse una historia y examen físico, así como una radiografía de tórax y gases en sangre arterial.
Pacientes con historia de insuficiencia cardíaca o en que la radiografía de tórax demuestra cardiomegalia se benefician de una ecocardiografía preoperatoria para definir mejor el tipo de patología cardíaca y la función general.
La condición neurológica debe ser evaluada y registrada para ser comparada con el postoperatorio. La presencia de déficit neurológico puede alterar la elección de los agentes anestésicos y los relajantes musculares (succinilcolina). La disreflexia autonómica es probable en pacientes con lesión medular por encima de T6 después de 3 semanas de lesión (a veces antes).
Cuando existe indicación quirúrgica, puesto que se trata de una intervención larga, sangrante y en decúbito ventral, el estudio debe incluir: una ecografía abdominal, la evaluación de una posible lesión pulmonar (radiografía de tórax y gases en sangre) y la evaluación de una posible contusión miocárdica (ecocardiografía), especialmente en pacientes con lesiones torácicas y lumbares.
-
Manejo de la vía aérea
Deben planearse varios métodos alternativos para intubar la tráquea, los que deben estar disponibles en caso de que la intubación se vuelva difícil. Ninguna evidencia muestra la superioridad de una técnica sobre otra. El método para intubar al paciente debe basarse principalmente en la experiencia del operador, más que en el temor a la movilización de la columna cervical.
Existen dos situaciones diferentes en las cuales el anestesista puede verse enfrentado a este tipo de pacientes, con estrategias también diferentes:
– En la fase prehospitalaria o al ingresar al servicio de urgencia (cuando se sospecha un trauma raquimedular).
– En pacientes estabilizados (cuando el daño raquimedular ya ha sido diagnosticado).
En el primer caso se trata de pacientes politraumatizados con compromiso de conciencia, que presentan varios riesgos asociados: hipertensión endocraneana, lesión cervical inestable, estómago lleno, compromiso respiratorio y cardiovascular variables. Estos enfermos necesitan una intubación precoz o una cirugía de salvataje.
Aunque existe controversia en relación a la técnica de intubación que puede ser utilizada en este tipo de pacientes, en general se aceptan tres opciones:
Intubación orotraqueal directa con estabilización del cuello.
– Intubación nasotraqueal a ciegas.
– Cricotiroidotomía o traqueostomía.
En el segundo caso, se trata de pacientes que han sido evaluados y diagnosticados, a los que se les realiza una cirugía semielectiva de estabilización de columna. En este caso es posible ofrecerles:
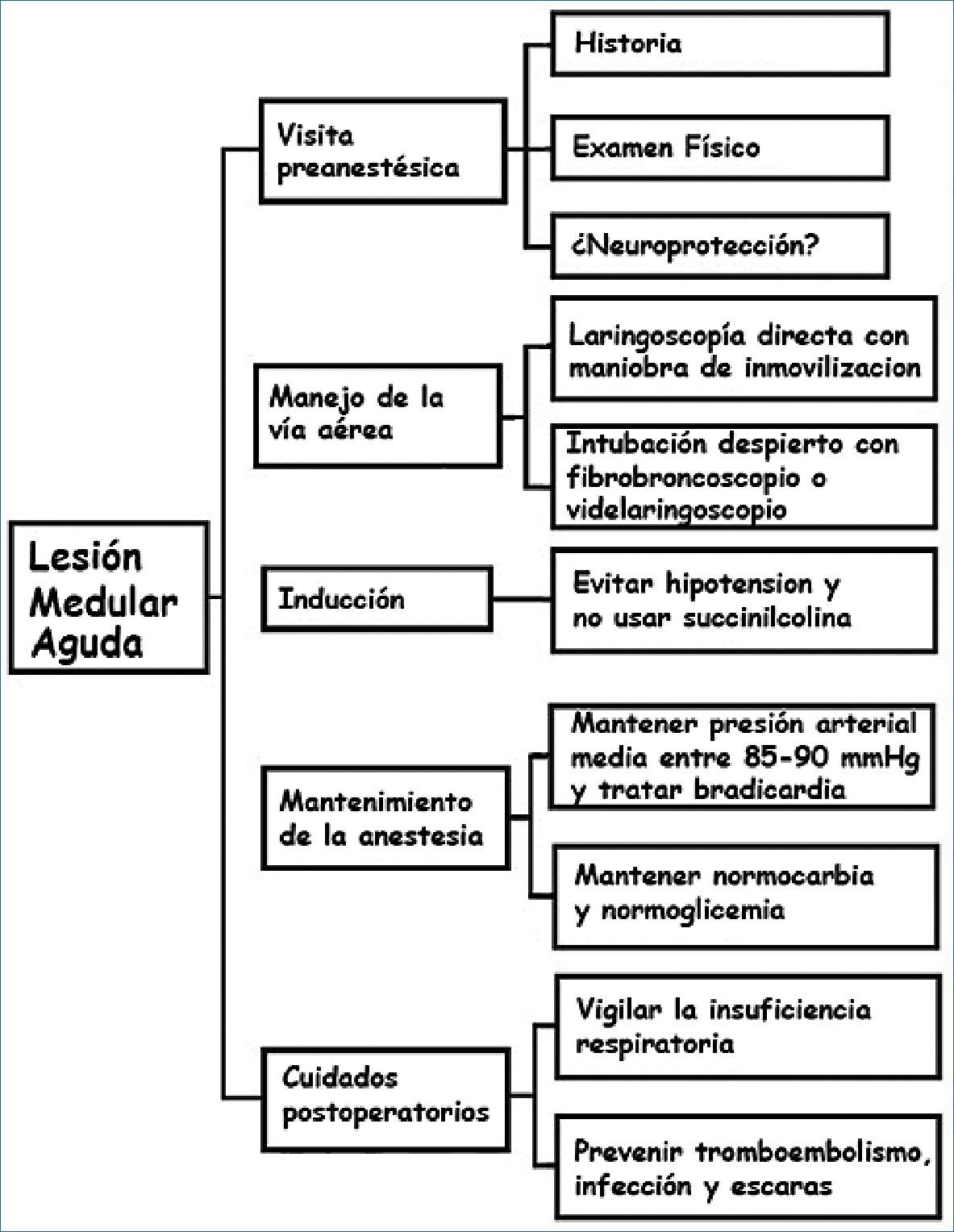
Figura 3. Plan para el manejo anestésico del paciente con lesión medular aguda (modificado de Fang-pin Bao)[102].
– Una técnica que presente el menor riesgo de movilización de la columna: intubación vigil con fibrobroncoscopio o videolaringoscopio.
– Una intubación orotraqueal directa con diferentes tipos de laringoscopios y estabilización del cuello.
Algunos expertos han planteado que los pacientes con una lesión inestable de la columna cervical, sin compromiso neurológico, deben ser intubados y posicionados despiertos, para permitir una evaluación neurológica antes de inducir la anestesia general. Sin embargo, varios estudios no han podido demostrar una mayor incidencia de lesiones neurológicas después de una intubación convencional. Más aún, se ha sugerido que cuando se realiza con cuidado y por anestesistas experimentados, el procedimiento de intubación endotraqueal en este tipo de pacientes es una “intervención de bajo riesgo”[103].
Tampoco hay que aseverar exactamente lo contrario, en el sentido de que el posible agravamiento del daño medular de una laringoscopía es sólo una leyenda[104]. Aunque excepcionales, hay reportes de daño neurológico secundario a intubación con laringoscopía directa[105].
Así como el efecto de la laringoscopía e intubación sobre un daño medular preexistente probablemente se ha sobredimensionado. Por el contrario, la contribución del estado hemodinámico durante la anestesia ha sido subestimada. Una hipotensión prolongada o una mala posición del cuello después de la intubación pueden, potencialmente, producir mucho más daño que la intubación propiamente tal. En realidad los casos reportados de posibles lesiones causadas por intubación son pocos, habitualmente publicados por autores que no son anestesistas, y si se analizan uno a uno puede prácticamente descartarse la intubación como causa de daño medular o agravamiento de daño medular[106].
La aproximación a la vía aérea tiene entonces diferentes alternativas dependiendo de las circunstancias. Aunque serán analizadas las diferentes posibilidades, no es lo mismo el rápido aislamiento de la vía aérea necesario en una situación de urgencia que en una situación semielectiva o si se anticipa una intubación difícil.
-
Intubación orotraqueal directa con estabilización del cuello
En situación de urgencia los pacientes deben ser ventilados manualmente con un dispositivo mascarilla-bolsa, aunque potencialmente pueda movilizarse la columna cervical, pues la oxigenación tiene prioridad sobre un eventual daño neurológico. La mayoría de los autores recomiendan la intubación inmediata con laringoscopía directa, a no ser que el operador tenga gran experiencia en otras técnicas. Dependiendo del estado de conciencia puede ser necesaria la sedación con un inductor y relajación muscular con succinilcolina.
La mayor parte del movimiento cervical que ocurre en un paciente anestesiado sometido a laringoscopía directa con una hoja de Macintosh ocurren por extensión de las articulaciones occipitoatlantoídea y atlantoaxial (C1-C2). Los segmentos subaxiales (C2C5) se desplazan mínimamente, por lo que el riesgo varía con el nivel lesionado, siendo los pacientes con lesiones inestables de C1 o C2 los más vulnerables al daño neurológico. A pesar de todo, en situaciones de urgencia, esta técnica como parte de una inducción en secuencia rápida, parece ser la más utilizada en la mayoría de los centros por ser la más rápida y segura, en la medida que se complemente con la maniobra MILS (Manual In-Line Stabilization) o MILI (Manual In-Line Inmovilization). La laringoscopía directa con intubación oral es el método más rápido para asegurar la vía aérea en pacientes con potencial riesgo de daño medular, con un tiempo promedio de realización del proceso de alrededor de 20 seg.
La maniobra de estabilización del cuello consiste en sostener los procesos mastoideos del paciente firmemente hacia abajo, desde atrás de la cabeza del paciente, oponiéndose a las fuerzas que se generan con la laringoscopía, de modo de que la cabeza y el cuello permanezcan en una posición neutral, teniendo especial precaución en evitar toda tracción axial. Debe ser realizada por otro operador del que hace la laringoscopía. Mientras se realiza la maniobra la parte anterior del collar cervical semirrígido debe ser removida. La porción posterior del collar queda en su lugar, ayudando a impedir la flexión de la columna cervical durante la maniobra de Sellick (Figura 4). La intubación con el collar completo puede impedir la apertura de la boca sin contribuir significativamente con la estabilización del cuello y empeorar la visión obtenida con la laringoscopía[107]. Desde el año 2000 el videolaringoscopio ha sido ampliamente utilizado en combinación con la maniobra MILS para minimizar el desplazamiento de la columna cervical en estos pacientes.
Al estudiarse el efecto de las maniobras de abordaje de la vía aérea superior sobre el movimiento de la columna cervical en cadáveres, se demostró que el desplazamiento máximo de la columna cervical era de 2,93 mm para la ventilación con mascarilla, 1,51 mm para la intubación oral y 1,20 mm para la intubación nasal. De este modo, la ventilación con mascarilla produce más movimiento que la laringoscopía directa con maniobra de estabilización[108].
Esta técnica envuelve por lo menos a tres personas, pero idealmente a cuatro: el primero preoxigena e intuba, el segundo realiza la presión transcricoídea, el tercero efectúa la maniobra de estabilización del cuello y el cuarto administra las drogas. Debe tenerse presente, sin embargo, que la intubación con laringoscopía orotraqueal directa y maniobra de estabilización del cuello: empeora la visualización de la glotis y duplica la presión aplicada por la hoja del laringoscopio[109]. En presencia de inestabilidad cervical, ambas situaciones potencialmente aumentan el movimiento patológico cráneocervical.
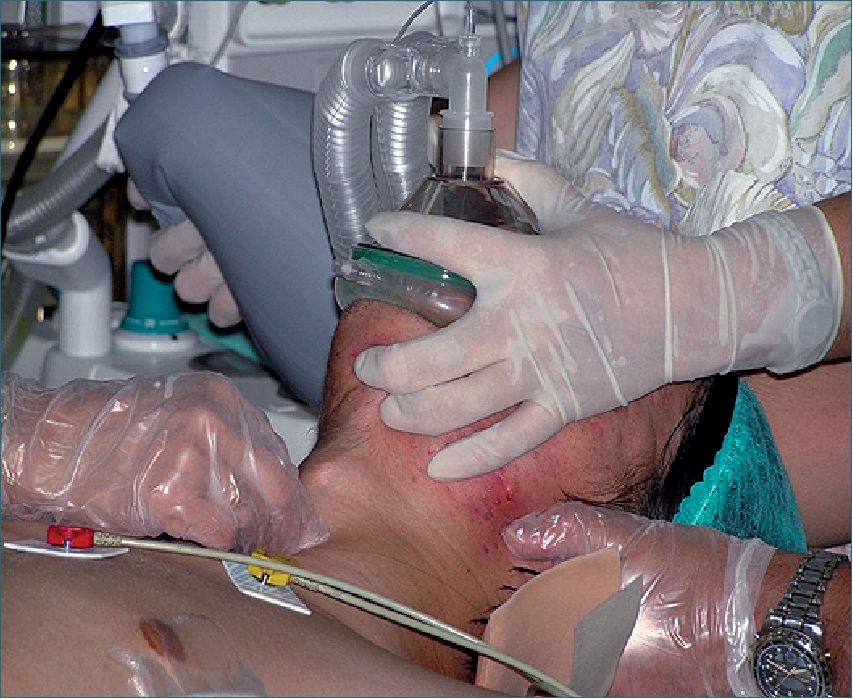
Figura 4. Maniobra de estabilización del cuello realizada conjuntamente con la maniobra de Sellick, por 3 operadores. Un cuarto operador debe administrar las drogas.
La maniobra de Sellick debe ser aplicada como parte de la inducción en secuencia rápida en todo paciente con trauma, asumiendo un estómago lleno real o virtual. La utilidad de esta maniobra es discutible, pero no es motivo de análisis de este artículo. Los pacientes con TRM tienen mayor posibilidad aún de presentar retención gástrica, debiéndose tener una especial atención en la prevención de la neumopatía aspirativa. El íleo es un fenómeno común, por lo que los pacientes deben ser sondeados y aspirados antes de la inducción de la anestesia, salvo que el operador estime que la maniobra de sondeo producirá rechazo del paciente y posible movimiento cervical. La maniobra de Sellick realizada con dos manos, manteniendo una sobre el cartílago cricoides y otra bajo la parte posterior del collar cervical, puede permitir una mejor visión y resultar en menor movimiento, lo que es especialmente apreciado en una eventual lesión medular[110]. Mediante estudios radiográficos en cadáveres se ha demostrado que la maniobra de Sellick produce un movimiento insignificante de la columna cervical[111]. Aunque los datos en relación a la calidad de la visión de la laringoscopía son contradictorios, se ha demostrado que no aumenta la dificultad de la intubación[112].
El uso de un conductor maleable plastificado puede ser de gran ayuda en la intubación de pacientes con potencial daño medular y está especialmente indicado cuando se usan tubos endotraqueales protegidos con anillo metálico, que brindan una mayor seguridad en los pacientes en decúbito ventral.
Se ha comparado las posibles ventajas de diferentes tipos de laringoscopio en el manejo de pacientes con potencial daño medular. No se ha demostrado diferencias en relación al movimiento cervical y al ángulo de visión entre el laringoscopio de Mcintosh y el de Miller (de hoja recta). El laringoscopio de McCoy puede mejorar la visión en 1 a 2 grados, y el de Bullard, puede mejorar la visión de la glotis con menor extensión de la cabeza, aunque aumenta el tiempo del procedimiento a un promedio de 44 seg.
La videolaringoscopía es una excelente opción para uso de rutina en la actualidad. La visión indirecta requiere menos fuerza del operador vara la visión de las cuerdas vocales y su hoja requiere menos apertura bucal que los laringoscopios tradicionales. Desgraciadamente, al igual que la fibrobroncoscopía, puede ser más difícil de disponer en situaciones de emergencia y requiere de un operador experimentado. También puede dificultar la maniobra la presencia de sangre o secreciones que impidan la visión. A pesar de estas limitaciones, algunos estudios sugieren mejores tasas de éxito en el primer intento con la videolaringoscopia versus laringoscopia directa[113].
El uso de bloqueadores neuromusculares hace que el cuello esté más expuesto a la movilización. Esto no contraindica su uso, pero hace que el mantenimiento del eje cabeza-cuello durante la intubación, y sobre todo al dar vuelta al paciente, sea una preocupación especial. Igualmente, la falta de relajación muscular durante la intubación bajo anestesia general, puede ser responsable de esfuerzos de tos y rechazo del tubo endotraqueal, que pueden movilizar la columna cervical.
Antes de la extubación, si es que procede, los bloqueadores neuromusculares deben ser completamente revertidos, pues, además del compromiso ventilatorio derivado de la denervación, el reflejo de tos suele ser escaso y las secreciones son abundantes.
Las lesiones torácicas y lumbares pueden requerir una aproximación anterior a la columna, a través de una toracotomía posterolateral. En estos casos puede ser de gran utilidad la utilización de un tubo de doble lumen.
-
Intubación nasotraqueal a ciegas
Esta técnica permite una intubación sin relajación muscular, lo que mantiene la función estabilizadora ejercida por la musculatura del cuello. Necesita de dos condiciones básicas para su realización: que el paciente esté ventilando espontáneamente y un cierto grado de cooperación que es difícil de obtener en pacientes en estado de ebriedad o agitados.
Aunque la intubación nasal a ciegas puede tener mejor rendimiento en manos expertas, nunca se acerca al rendimiento de la intubación orotraqueal directa bajo anestesia y su duración promedio, cuando se logra, es de alrededor de 25 seg[114]. Se ha reportado sólo 52% de éxito cuando la intubación se realiza por paramédicos en el sitio del suceso, sin embargo, el rendimiento aumenta considerablemente cuando la técnica se realiza en el hospital. Además, el índice de complicaciones es bastante importante, llegando casi a un 70% comparado con la vía oral (hemorragias de la mucosa nasofaríngea, falsas vías, vómitos y regurgitación, tos, laringoespasmo y broncoespasmo). La técnica está contraindicada ante la sospecha de fracturas de base de cráneo o del macizo facial.
Asimismo, el paso de un tubo por la fosa nasal, la faringe, la laringe y la tráquea en condiciones de vigilia, debido a la posibilidad de tos, vómitos y rechazo del tubo, puede movilizar la columna cervical. Si bien es cierto esto se puede prevenir realizando un bloqueo sensitivo de las mucosas y de la inervación laringotraqueal con anestésicos locales, muchas veces el escenario de urgencia no otorga tiempo para ello e incluso en escenarios electivos, esta maniobra requiere de un operador con mucha experiencia para su éxito.
-
Intubación vigil con fibrobroncoscopio o videolaringoscopio
La intubación vigil tiene la ventaja de verificar inmediatamente después del procedimiento la ausencia de cualquier modificación neurológica. Toda técnica de intubación vigil requiere de un anestesista experto y de un paciente cooperador. Los pacientes con trauma mayor habitualmente presentan dolor, pueden estar intoxicados y son habitualmente agresivos y poco cooperadores.
De las técnicas de intubación vigil, la mejor tolerada es la intubación nasal con fibrobroncoscopio[115]. En situaciones de urgencia, sin embargo, la sangre, las secreciones y la maniobra de Sellick hacen que esta técnica sea impracticable. En manos experimentadas el procedimiento puede durar sólo 60 seg, con maniobra de estabilización del cuello. La intubación con fibrobroncoscopio es de elección si se anticipa una intubación difícil, permitiendo efectuar el procedimiento sin movilización de la columna cervical[116].
La técnica tiene una serie de etapas regladas, desde la premedicación, hasta la inducción de la anestesia general. La aplicación de esta técnica puede asociarse a un mayor riesgo cuando es utilizada por profesionales sin experiencia:
– Preoxigenación.
– Premedicación con benzodiacepínicos (midazolam) para obtener sedación superficial a media, que permita una adecuada colaboración del paciente.
– Vaciamiento y neutralización farmacológica del pH gástrico.
– Preparación del trayecto del tubo endotraqueal:
• anestésico y vasoconstrictor de la mucosa nasal.
• gárgara con anestésico local.
• bloqueo bilateral del nervio laríngeo superior.
• anestesia transtraqueal.
– Administración de anticolinérgicos, especialmente en pacientes con lesiones cervicales altas, pues la estimulación de la vía aérea superior puede llevar a bradicardia extrema.
– Intubación oro o nasotraqueal bajo control fibrobroncoscópico con estabilización manual del eje cabeza-cuello.
– Verificación y fijación del tubo endotraqueal.
– Instalación en la mesa quirúrgica bajo sedación sin relajación.
– Control neurológico.
– Inducción de la anestesia general.
Aunque desde el punto de vista teórico esta es la opción más atractiva, hay pocos reportes sobre el uso de esta técnica en TRM. El éxito de la intubación en situación de trauma es de un 83% (95% CI, 72%94,6%)[117]. Se ha estudiado su uso en cirugía electiva de columna cervical; aunque el procedimiento es bien tolerado en la mayoría de los pacientes, en el 12% se produce desaturación de O2 (72%-89%), lo que debe ser por lo menos igual o peor, en situaciones de urgencia. En pacientes con contusión cerebral asociada, habitual en el TRM, la fibrobroncoscopía se asocia a un significativo aumento de la presión intracraneana, que no es prevenida por los benzodiacepínicos ni los opiáceos[118].
La video laringoscopía combina las ventajas de la laringoscopía directa y la intubación a través de un fibrobroncoscopio, proporcionando una visión indirecta de la glotis, lo que podría disminuir el movimiento de la columna cervical y competir con la intubación vigil con fibrobroncoscopio.
Se ha demostrado que durante la intubación bajo anestesia general, con bloqueo neuromuscular y maniobra de estabilización del cuello, el uso de videolaringoscopio produce una mejor visualización de la glotis. Los resultados en relación con el movimiento de la columna son contradictorios; algunos estudios demuestran que no disminuye significativamente el movimiento de la columna cervical en pacientes sanos, cuando se compara con la intubación con laringoscopía directa[119] y otros que lo disminuye, especialmente con operadores con experiencia en videolaringoscopía[120]. No hay estudios comparativos en pacientes con inestabilidad de columna cervical.
La videolaringoscopía ha demostrado un mayor éxito que la laringoscopía directa en pacientes que son intubados en situación de emergencia con inmovilización cervical preventiva, sin embargo, la intubación vigil a través de un fibrobroncoscopio, sigue siendo el estándar de oro en relación con la movilidad cervical. Lo que no está claro es si esto es clínicamente significativo o si un operador inexperto no tendrá menor movimiento con una laringoscopía directa.
-
Cricotiroidotomía o traqueostomía
La intubación endotraqueal de urgencia con la técnica orotraqueal directa y estabilización del cuello o la técnica nasotraqueal a ciegas se pueden realizar en más del 99% de los casos[121], pero en un pequeño número de pacientes puede ser necesario recurrir a la inserción de un catéter de grueso calibre a nivel de la membrana cricotiroídea. La cricotiroidotomía está indicada en pacientes que requieren una vía aérea inmediata y en quienes no ha tenido éxito o están contraindicadas la intubación orotraqueal directa o nasotraqueal a ciegas y no existe disponibilidad de fibrobroncoscopio o videolaringoscopio. Se ha estudiado el efecto que produce sobre modelos de columna cervical inestable en cadáveres, demostrándose un desplazamiento antero-posterior de 1 a 2 mm y una compresión axial de menos de 1 mm, sin desplazamiento angular significativo; es decir un movimiento menor que el umbral de importancia clínica[122].
En situación de “no poder intubar, no poder ventilar” la cricotiroidotomía o la traqueostomía deben poder realizarse. La técnica es tan infrecuentemente realizada, que para estar entrenado en su manejo debe ser aprendida en modelos de simulación. En el caso de la traqueostomía, debe ser realizada por un cirujano.
-
Conclusión
Al enfrentarse a un paciente con TRM en condiciones estables (respirando espontaneamente y hemodinámicamente estable), muchos anestesiólogos optan por la intubación vigil con fibrobroncoscopio[123]. Sin embargo, esta técnica requiere un entrenamiento adecuado y es difícil realizar en presencia de sangre, vómitos, secreciones o una anatomía distorsionada. Por esto, en situaciones de emergencia, la mayoría de los anestesiólogos prefieren la laringoscopía directa con maniobra de estabilización de cuello. De este modo, para cada paciente con lesión medular, el anestesiólogo debe seleccionar el método de manejo de la vía aérea basado en su experiencia previa y en las condiciones de éste.
-
Monitorización
Se recomienda la monitoría estándar sugerida por la ASA, además de algún grado de invasión, según la evaluación de cada paciente:
– Línea arterial: con el objetivo de mantener las presiones arteriales dentro de los límites recomendados para una buena perfusión medular.
– Sonda vesical: para monitoría hemodinámica y para evitar el llenado de la vejiga en operaciones largas y con grandes cambios de volumen.reanimación con fluidos en pacientes con una sección medular alta o en shock neurogénico inestable (se prefiere el acceso subclavio o femoral por el sitio de punción): los dispositivos de monitoreo de gasto cardíaco pueden mejorar la optimización de la administración de fluidos en el intraoperatorio y, de este modo, reducir la morbilidad resultante de la administración excesiva de líquidos.
– Temperatura: debe evitarse sondas nasales en pacientes con fracturas de la base del cráneo o del macizo facial. Mantener la temperatura con calentamiento de fluidos y mantas térmicas.
– Monitorización de presión intracraneana: debe evaluarse su necesidad si hay traumatismo encefalocraneano concomitante.
– Ecocardiografía transesofágica: se puede evaluar la función y la anatomía miocárdica, evaluando previamente la dificultad potencial de colocar la sonda con la columna cervical inmovilizada y la posibilidad de lesionar el esófago secundaria a su instalación, por lo que sería recomendable descartar primero una fractura inestable y contar con un operador adiestrado.
– Monitorización neurofisiológica.
La necesidad de monitoría neurofisiológica durante la cirugía raquimedular queda a criterio del equipo médico-quirúrgico. Aunque hay varios estudios centrados en ella, la evidencia no es suficiente para incorporarla en ninguna guía clínica. El diagnóstico de una situación de riesgo de daño medular potencialmente grave compete al neurofisiólogo en base a la interpretación de cambios en los parámetros objetivos de los potenciales motores y sensitivos que se registran en forma periódica. Su utilidad está en la evaluación directa del deterioro de las funciones de la médula espinal, lo que permite la corrección de factores de riesgo como la postura del paciente (posición del cuello y los hombros), hipotensión, hipotermia y factores relacionados con la cirugía.
Los potenciales evocados somatosensoriales (SSEP) son el modelo más ampliamente usado en cirugía de la columna; monitorizan la vía columna dorsal lemnisco medial, pero no directamente la médula espinal. De este modo, los SSEP pueden dar información falsa negativa en pacientes con síndrome medular anterior. Los SSEP tienen un problema de timing en la obtención de los datos, de modo puede que ocurrir daño nervioso irreversible antes de ser detectado. Además, los SSEP tienen una baja sensibilidad a la sección de raíces nerviosas. Para poder medirlos se requiere el uso de TIVA o de anestesia balanceada con bajas concentraciones de agentes inhalatorios.
También pueden ser utilizados los potenciales evocados motores y musculares para monitorización de las vías motoras durante la cirugía de TRM. Para poder medirlos se requiere el uso de TIVA, sin bloqueadores neuromusculares.
La electromiografía es ampliamente usada para monitorizar la función de raíces nerviosas selectivas. Este tipo de monitorización permite el uso de agentes volátiles, pero proscribe el uso de bloqueadores neuromusculares.
La técnica más confiable disponible es la monitorización intraoperatoria multimodal, en presencia de un neurofisiólogo y con la colaboración del anestesiólogo. Sin embargo, ninguna técnica de monitoreo puede predecir una paraplejia tardía (que aparece después del final de la cirugía). Además, en los casos de daño neurológico preexistente, el monitoreo contribuye poco y el monitoreo de las raíces L1-L4 es de baja confiabilidad. Sin embargo, puede ser útil al probar tornillos pediculares. La indicación esencial del monitoreo de la médula espinal son las desviaciones vertebrales torácicas y toracolumbares, con examen neurológico preoperatorio normal[124].
-
Inducción y mantención de la anestesia
Una vez asegurada la vía aérea, la inducción y mantención de la anestesia tiene las mismas consideraciones que cualquier otra anestesia general, dependiendo de la comorbilidad de cada paciente, sin desconocer la preferencia del anestesista. La preoxigenación debe ser efectiva, cualquiera sea la técnica de intubación elegida. Los pacientes tienen un elevado riesgo de regurgitación gástrica, especialmente aquellos con lesiones medulares altas o traumatismo reciente con estómago lleno. Deben ser premedicados con bloqueadores H2 (omeprazol, ranitidina) y si están con sonda nasogástrica, debe ser retirada previa aspiración para evitar la incompetencia del esfínter esofágico inferior.
La inducción debe ser lenta y cuidadosa, ya que frecuentemente son pacientes hipovolémicos y además la respuesta simpática puede ser impredecible en función del nivel de lesión medular. La dosis de anestésicos, principalmente hipnóticos debe ser ajustada en función del tiempo de evolución de la lesión medular.
El uso de propofol, benzodiacepinas o barbitúricos puede causar hipotensión severa en pacientes hipovolémicos. La ketamina puede aumentar la presión axial de la columna, pero este efecto puede ser contrarrestado con otro inductor. El etomidato puede ser usado solo, con gran margen de seguridad.
La relajación muscular debe obtenerse con bloqueadores neuromusculares de duración corta o intermedia si se quiere medir potenciales evocados, lo que no es habitual en cirugías de urgencia. La administración de succinilcolina en pacientes con lesión medular está asociada al riesgo de hiperkalemia, por el aumento de receptores nicotínicos de la placa motora. Se considera su uso seguro hasta las primeras 48 h después de la lesión[125]. Después de este período, la hiperkalemia puede ocurrir durante un periodo indeterminado de tiempo, que la mayoría de los autores coinciden que es hasta 9 meses después de la lesión. Tras la intubación y la fijación del tubo endotraqueal, el paciente puede prepararse para su posicionamiento.
Es importante que se haga todo lo posible para mantener la cabeza y la columna vertebral en una posición neutral durante el posicionamiento del paciente. El giro debe hacerse en bloque (evitando todo movimiento de torsión, flexión o tracción), bajo la dirección del anestesiólogo y de acuerdo con el cirujano, después de haber desconectado todo lo que se puede desconectar, incluida la conexión del tubo endotraqueal al sistema ventilatorio de la máquina de anestesia. Una vez alcanzada la posición prona, el acceso a la cabeza y el tubo endotraqueal queda restringido. Es recomendable el uso de tubos endotraqueales anillados para evitar su colapso. Los ojos deben ser cuidadosamente protegidos en su contacto con cualquier dispositivo utilizado en la posición prona, así como todos los puntos de apoyo.
La elección de una técnica anestésica específica para las operaciones en el TRM con lesión medular aguda es de menor importancia que la optimización del tratamiento médico durante el procedimiento. La elección de una técnica intravenosa o inhalatoria, dependerá inicialmente de las condiciones del paciente y del método de intubación traqueal escogido. Los agentes inhalatorios se asocian a una reducción de la amplitud de los potenciales evocados mayor a los agentes endovenosos. Se ha confirmado que el uso de agentes halogenados a determinadas CAM (generalmente < 0,5 CAM) son compatibles con la correcta interpretación de potenciales motores y somatosensoriales.
La mantención de la relajación muscular, según el uso de monitorización neurofisiológica, debe hacerse con bloqueadores neuromusculares que no liberen histamina (rocuronio, vecuronio, cisatracurio) para asegurar la inmovilidad del paciente. Sin embargo, la relajación debe ser cuidadosamente controlada si se hace monitorización neurofisiológica, manteniéndose un nivel de bloqueo estable (la primera respuesta al
tren de cuatro debe permanecer entre 10%-20% del control). Si el bloqueo se profundiza, los potenciales motores no podrán ser interpretados (los somatosensoriales no se afectan por los relajantes musculares), sin embargo, si no existe bloqueo suficiente existe riesgo de movimientos del paciente con graves consecuencias posteriores.
Se ha demostrado que la optimización de la función cardiovascular mediante el mantenimiento de la presión arterial media a niveles de 85 mmHg o superior y un débito cardíaco adecuado, previenen las lesiones secundarias de la médula espinal[126]. La hipoxemia y la hipotensión (shock neurogénico) son habituales en pacientes con sección medular. La pérdida de la autorregulación, asociada a hipotensión e hipoxemia pueden disminuir severamente la perfusión medular y el aporte de oxígeno, lo que contribuye con empeorar el evento traumático primario en el resultado final. La pérdida o disminución de la función del sistema simpático, hacen a estos pacientes especialmente sensibles a los efectos depresores miocárdicos de los anestésicos inhalatorios y endovenosos. Loa agentes a-adrenérgicos pueden aumentar la resistencia sistémica y restablecer la presión arterial a expensas de un aumento de la poscarga, pero una disminución del débito cardíaco.
Los pacientes con lesión medular tienen una mayor incidencia de edema pulmonar, lo que se favorece con la reanimación con fluidos. Esto puede requerir la administración de diuréticos y/o ventilación con PEEP durante el intraoperatorio. La ventilación debe mantener la normocarbia, pues la respuesta vascular de la médula al CO2 puede estar suprimida; una hiperventilación excesiva puede reducir el flujo sanguíneo y producir áreas mal perfundidas. Los niveles de glucosa en sangre deben mantenerse normales, pues la hiperglicemia se ha asociado con una mayor deterioro neurológico y mortalidad[127]. Si es necesario debe administrarse insulina.
La profundidad anestésica debe ser estable para que puedan ser detectados e interpretados los cambios en potenciales evocados. Debe mantenerse aun así un nivel de profundidad adecuado para impedir fenómenos de hiperreflexia autonómica, en pacientes que hayan pasado de 3 a 6 semanas tras la lesión.
Aunque hasta la fecha, no se han presentado pruebas que favorezcan de manera concluyente un agente o técnica anestésica sobre otra en pacientes hemodinámicamente estables, cuando se va a utilizar monitorización neurofisiológica, la técnica recomendada es una TIVA con propofol y remifentanil, asociada a bloqueo neuromuscular no despolarizante en bomba de infusión, manteniéndose el tren de cuatro estímulos entre 10%-20%.
-
Manejo hemodinámico
En relación con la administración de fluidos en el paciente con trauma en general y con TRM en particular es urgente la necesidad de ensayos clínicos bien diseñados. Los estudios realizados hasta el momento tienen muchas limitaciones y deben ser interpretados con cautela. Sin embargo, incluso teniendo en cuenta todas las debilidades y matices de la interpretación, los metaanálisis publicados sugieren que los pacientes con trauma deben continuar siendo resucitados con cristaloides[128]. Las soluciones hipotónicas (glucosa al 5% o solución glucosalina) puede producir o exacerbar el edema medular. Las pérdidas mayores deben ser reemplazadas con componentes sanguíneos según esquemas estrictos de ahorro de sangre, tanto desde el punto de vista económico, como de riesgo para el paciente. Si hay disponibilidad, puede usarse técnicas para minimizar la pérdida de sangre intraoperatoria o para recuperarla.
El shock empeora la perfusión medular y debe ser corregido en forma urgente. Una reposición de fluidos muy entusiasta puede resultar en edema pulmonar y, por el contrario, una reposición inadecuada se traduce en un bajo débito cardíaco y perfusión medular. Se trata de un edema pulmonar mixto, hidrostático y lesional, agravado por un reemplazo vascular excesivo. En estos casos debe optimizarse la precarga; como habitualmente se trata de pacientes jóvenes, sin patología cardiovascular o respiratoria asociada, puede ser útil el uso de un catéter de Swan-Ganz, sin exceder los 18 mmHg de presión capilar pulmonar. Cuando esto es insuficiente debe administrarse inótropos.
La mejor amina vasoactiva es todavía una cuestión de debate. Las últimas guías de manejo no abordan esta controversia. Una revisión sistemática trató de responder varias preguntas sobre el uso de vasopresores en la sección medular aguda, pero no fue concluyente en determinar qué vasopresor es mejor, cuál es la duración óptima de la terapia y cuál es el nivel de presión arterial media por debajo del cual se debe iniciar el soporte con vasopresores[129]. La elección puede depender del nivel de la lesión y de las condiciones hemodinámicas del paciente.
En lesiones cervicales o torácicas altas con hipotensión y bradicardia debe usarse fármacos con efectos cronótropos, inótropos, así como con propiedades vasoconstrictoras (Tabla 2). La norepinefrina o la epinefrina con sus propiedades agonistas a1 y b1 son opciones aceptables, o alternativamente la dopamina. En lesiones torácicas bajas y lumbares, donde la hipotensión suele ser el resultado de la vasodilatación periférica, un fármaco como la fenilefrina, que es un agonista al, con mínimo efecto p1 (que puede producir bradicardia refleja), podría ser el más apropiado[130].
El uso de vasoconstrictores debe restringirse a la mantención de una perfusión medular satisfactoria, pues se ha reportado alta incidencia de complicaciones cardiovasculares. El 70% experimenta al menos uno de los siguientes trastornos: taquicardia, bradicardia, elevación de troponina, fibrilación auricular de nueva aparición, aleteo auricular o cambios de ST del electrocardiograma compatibles con isquemia. En pacientes mayores de 55-60 años se describe una mayor incidencia de efectos secundarios con el uso de dopamina en comparación con norepinefrina y fenilefrina[131],[132].
-
Posoperatorio
Los cuidados postoperatorios deben estar dirigidos especialmente al manejo de la analgesia, la prevención de la enfermedad tromboembólica y la desconexión de la ventilación mecánica.
Todos los pacientes con TRM, especialmente aquellos con lesión medular aguda deben ser manejados en una Unidad de Cuidados Intensivos, o mejor aún, en unidades especialmente acondicionadas para este tipo de pacientes, para un mejor seguimiento neurológico, hemodinámico y respiratorio. Puede ocurrir inestabilidad cardiovascular o insuficiencia respiratoria de riesgo vital hasta los 7-10 días después de la lesión[133].
La decisión de extubar al paciente inmediatamente después de la cirugía debe considerar el nivel de la lesión inicial y el tipo de cirugía realizada, su duración, las complicaciones ocurridas, las pérdidas de sangre y la necesidad de reanimación subsiguiente, así como la facilidad de la reintubación. Las complicaciones respiratorias no ocurren siempre en el postoperato rio inmediato y pueden retrasarse. La mayor parte de los autores recomienda mantener a estos pacientes intubados, en ventilación mecánica, bajo sedación, aunque la función respiratoria hubiera estado conservada antes de la anestesia. Una vez eliminados los efectos residuales de los anestésicos y eliminadas las posibilidades de daño medular, se debe iniciar la desconexión, asociada a una kinesiterapia intensiva.
Las complicaciones pulmonares son la primera causa de morbilidad y mortalidad en los pacientes que han sobrevivido al trauma inicial, lo que también afecta la duración y los costos de la hospitalización. Los pacientes con lesiones a nivel C5-C6 tienen un 30% a 50% de reducción de la capacidad vital durante la primera semana después de la lesión, por lo que se recomienda que la capacidad vital y los gases en sangre arterial se controlen hasta que estén estabilizados. Los pacientes con una lesión por debajo de T6 se consideran con autonomía ventilatoria relativa. Los pacientes que quedan dependientes del ventilador tienen aproximadamente la mitad de esperanza de vida de los que tienen lesiones similares, pero que no dependen del ventilador[134].
| Tabla 2. Fármacos de interés en el shock neurogénico por lesión medular | |
| Fármaco | Comentarios |
| Noradrenalina | Efecto a-b. Útil para mantener la presión arterial, especialmente en lesiones medulares cervicales y torácicas altas |
| Adrenalina | Efecto a-b. Puede favorecer la aparición de arritmias |
| Dopamina
Fenilefrina |
Efecto a-b en función de la dosis. Se utiliza comúnmente en la lesión medular en menores de 50 años Se emplea con precaución en la lesión medular por riesgo de bradicardia |
| Dobutamina | Aumenta el débito cardíaco y puede disminuir la presión arterial. Generalmente no se utiliza en la lesión medular |
En general, la cirugía de la columna cervical se asocia con la menor cantidad de dolor postoperatorio, mientras que los procedimientos de fusión e instrumentación de la columna vertebral que involucran la columna torácica y la columna lumbar se asocian con el dolor postoperatorio más significativo. La analgesia es generalmente manejada con opioides: morfina intramuscular, endovenosa o controlada por el paciente. Si no hay contraindicaciones puede asociarse antiinflamatorios no esteroidales, inhibidores selectivos de la COX-2, que no interfieren con la coagulación. Las lesiones torácicas o lumbares que han sido abordadas por toracotomía o laparotomía, pueden beneficiarse de una analgesia regional (bloqueos intercostales, paravertebrales o peridurales), o un manejo multimodal con ambas técnicas. El manejo del dolor crónico de tipo neuropático y nociceptivo, que disminuye enormemente la calidad de vida de estos pacientes escapa a los propósitos de este capítulo[135].
Los pacientes deben ingresar al pabellón con medias elásticas y se debe utilizar un sistema de compresión neumática de las extremidades inferiores durante y después de la operación. En el postoperatorio el riesgo de enfermedad tromboembólica es muy alto (cercano al 100%)[136], por lo que, se recomienda profilaxis activa durante tres meses. La incidencia es máxima 2 a 3 semanas después de la lesión, seguida por un pequeño peak 3 meses después de la lesión. Durante el primer año, la incidencia de trombosis venosa profunda y tromboembolismo pulmonar se estiman en 15% y 5% respectivamente.
Debe utilizarse una combinación de heparinas de bajo peso molecular con medidas de tipo mecánica: medias elásticas o compresión neumática, cama clínica rotatoria, o estimulación eléctrica[137]. Las últimas guías clínicas de la AOSpine en relación al paciente con TRM “sugieren”[138]:
– La profilaxis con anticoagulantes debe ser administrada rutinariamente para reducir el riesgo de eventos tromboembólicos en el período agudo después de un TRM.
– La profilaxis debe consistir en la administración subcutánea de heparinas de bajo peso molecular. El uso de bajas dosis de heparina no fraccionada produce un aumento de la incidencia de sangra-
do, por lo que se sugiere no usar esta opción.
– Comenzar la tromboprofilaxis dentro de las primeras 72 h después de la lesión medular, si es posible.
Puesto que estas tres sugerencias tienen una calidad de evidencia baja y una fuerza de la recomendación débil, parece sensato ajustar tanto la dosis como el momento de la administración de tromboprofilaxis a las condiciones de cada paciente en particular, analizando el riesgo versus el beneficio de la acción.
Se trata de pacientes muy predispuestos a desarrollar úlceras por decúbito que pueden tardar muchos meses en sanar y prolongar la hospitalización. La enfermería de la prevención de escaras, la alimentación enteral y la kinesiología son elementos de gran importancia en el postoperatorio del paciente con daño medular.
Los requerimientos calóricos de los pacientes postoperados de TRM están aumentados, por lo que debe administrarse un aporte calórico y proteico apropiado. Se recomienda comenzar precozmente la nutrición enteral (en las primeras 72 h)[139].
El postoperatorio de los pacientes con TRM y lesión medular aguda tiene un riesgo aumentado de infecciones respiratorias y urinarias, especialmente si se ha usado MPS. También se reportan peritonitis encubiertas, que deben ser atentamente diagnosticadas.
Referencias
1. Datos INE 2017
2. Lavanderos J, Muñoz s, Vilches L et al. Traumatismo raquimedular Cuad Cir 2008; 22: 82-90. https://doi.org/10.4206/cuad.cir.2008.v22n1-12
3. Vargas A, Cortez S, et al. Características epidemiológicas del trauma raquimedular. Una comparación entre Valparaíso-Chile y Cochabamba-Bolivia. Rev Chil Neurocir 2011; 36: 20-26.
4. Jazayeri SB, Beygi S, Shokraneh F et al. Incidence of traumatic spinal cord injury worldwide: a systematic review. Eur Spine J. 2015; 24:905-918. https://doi.org/10.1007/s00586-014-3424-6
5. Holmes J, Miller P, Panacek E et al. Epidemiology of thoracolumbar spine injury in blunt trauma. Acad Emerg Med 2001; 8: 866-72. https://doi.org/10.1111/j.1553-2712.2001.tb01146.x
6. Lindsey RW, Gugala Z, Pneumaticos SG: Injury to the vertebra and spinal cord. En Moore EE, Feliciano DV, Mattox KL, editores: Trauma, ed 5, New York, 2004, McGraw-Hill, pp 459-492.
7. Ho CH, Wuermser L-A, Priebe MM et al: Spinal cord injury medicine 1: Epidemiology and classification, Arch Phys Med Rehabil 2007; 88 (Supl1): S49-S54. https://doi.org/10.1016/j.apmr.2006.12.001
8. Crosby TC, Lui A. The adult cervical spine: Implication for airway management. Can J Anaesth 1990; 37: 77. https://doi.org/10.1007/BF03007488
9. Manczak M, Gasik R. Cervical spine instability in the course of rheumatoid arthritis – imaging methods. Reumatologia. 2017; 55: 201-207. https://doi.org/10.5114/reum.2017.69782
10. McCaughey EJ, Purcell M, McLean AN et al. Changing demographics of spinal cord injury over a 20-year period: a longitudinal population-based study in Scotland. Spinal Cord. 2016; 54: 270-276. https://doi.org/10.1038/sc.2015.167
11. Chiu WT, Lin HC, Lam C, et al. Review paper: epidemiology of traumatic spinal cord injury: comparisons between developed and developing countries. Asia Pac J Public Health 2012; 22: 9-18. https://doi.org/10.1177/1010539509355470
12. Kumar R, Lim J, Mekary RA et al. Traumatic Spinal Injury: Global Epidemiology and Worldwide Volume. World Neurosurg 2018; 113: e345-e363. https://doi.org/10.1016/j.wneu.2018.02.033
13. Lowery DW, Waid MM, Brownw BJ et al. Epidemiology of cervical spine injury victims. Ann Emerg Med 2001; 38: 12. https://doi.org/10.1067/mem.2001.116149
14. Ajani AE, Cooper DJ, Scheinskestel CD et al. Optimal assesment of cervical spine trauma in critically ill patients: a prospective evaluation. Anaesth Intens Care 1998; 26: 487. https://doi.org/10.1177/0310057X9802600502
15. Scheidt S, Roessler PP, Pedrood S et al. [Influence of the trauma mechanism on cervical spine injuries]. Unfallchirurg. 2019 Mar 6. [Epub ahead of print] https://doi.org/10.1007/s00113-019-0622-z
16. Moeschler O, Ravussin O. Anesthésie du patient avec traumatisme du rachis cervical. Ann Fr Anesth Réanim 1992;11:657. https://doi.org/10.1016/S0750-7658(05)80786-5
17. Williams J, Jehle D, Cottington E, Shufflebarger C. Head, facial and clavicular trauma as a predictor of cervical spine injury. Ann Emerg Med 1992; 21: 719. https://doi.org/10.1016/S0196-0644(05)82786-6
18. Rojas C, Rivera R, Rojas P et al. Análisis de Gestión Clínica asociada a la Producción Hospitalaria, basado en la aplicación del Sistema Informático “Grupos Relacionados al Diagnóstico” (IR-GRD).
19. DeVivo MJ, Stover SL, Black KJ. Prognostic factors for 12-year survival after spinal cord injury. Arch Phys Med Rehabil 1992; 73:156-62.
20. Oliver M, Inaba K, Tang A et al. The changing epidemiology of spinal trauma: a 13-year review from a Level I trauma centre. Injury 2012; 43: 1296-300. https://doi.org/10.1016/j.injury.2012.04.021
21. Labruyère R, Agarwala A, Curt A. Rehabilitation in spine and spinal cord trauma. Spine (Phila Pa 1976). 2010; 35 (21 Suppl): S259-62. https://doi.org/10.1097/BRS.0b013e3181f1a979
22. Cao Y, DiPiro N, Krause JS. Health factors and spinal cord injury: a prospective study of risk of cause-specific mortality. Spinal Cord. 2019 Feb 25. doi: 10.1038/s41393-019-0264-6. [Epub ahead of print] https://doi.org/10.1038/s41393-019-0264-6
23. Khorasanizadeh M, Yousefifard M, Eskian M et al. Neurological recovery following traumatic spinal cord injury: a systematic review and meta-analysis. J Neurosurg Spine. 2019 Feb 15:1-17. [Epub ahead of print] https://doi.org/10.3171/2018.10.SPINE18802
24. Jorge A, White MD, Agarwal N. Outcomes in socioeconomically disadvantaged patients with spinal cord injury: a systematic review. J Neurosurg Spine 2018; 29: 680-686. https://doi.org/10.3171/2018.5.SPINE171242
25. Pili R, Gaviano L, Pili L, Petretto DR. Ageing, Disability, and Spinal Cord Injury: Some Issues of Analysis. Curr Gerontol Geriatr Res. 2018. https://doi.org/10.1155/2018/4017858
26. Choo AM, Liu J, Lam CK, et al. Contusion, dislocation, and distraction: primary hemorrhage and membrane permeability in distinct mechanisms of spinal cord injury. J Neurosurg Spine 2007; 6: 255-266. https://doi.org/10.3171/spi.2007.6.3.255
27. Mautes AE, Weinzierl MR, Donovan F et al. Vascular events after spinal cord injury: contribution to secondary pathogenesis. Phys Ther 2000; 80: 673-687. https://doi.org/10.1093/ptj/80.7.673
28. Popa C, Popa F, Grigorean VT, et al. Vascular dysfunctions following spinal cord injury. J Med Life 2010; 3: 275-85.
29. Wilson JR, Forgione N, Fehlings MG. Emerging therapies for acute traumatic spinal cord injury. CMAJ. 2013; 185: 485-92. https://doi.org/10.1503/cmaj.121206
30. Wagner FC, Vangilder JC, Dormán GJ. Pathological changes from acute to chronic in experimental spinal cord trauma. J Neurosurg 1978; 38: 92. https://doi.org/10.3171/jns.1978.48.1.0092
31. Seingry DR. Cervical injuries; anaesthetic implications, monitoring and management. Clin Anaesth 1987; 1: 459. https://doi.org/10.1016/S0950-3501(87)80013-2
32. ATLS Subcommittee; American College of Surgeons’ Committee on Trauma; International ATLS working group. Advanced trauma life support (ATLS®): the ninth edition. J Trauma Acute Care Surg. 2013; 74: 1363-6. https://doi.org/10.1097/TA.0b013e31828b82f5
33. Harris MB, Sethi RK. The initial assessment and management of the multiple-trauma patient with an associated spine injury. Spine (Phila Pa 1976). 2006; 31 (Supl): S9-S15. https://doi.org/10.1097/01.brs.0000217924.56853.0d
34. Connor D, Greaves I, Porter K, Bloch M, Consensus group FcoP- HC. Pre-hospital spinal immobilization: an initial consensus statement. Emerg Med J. 2013; 30:1067-199. https://doi.org/10.1136/emermed-2013-203207
35. Hoffman JR, Mower WR, Wolfson AB et al. Validity of a set of clinical criteria to rule out injury to the cervical spine in patients with blunt trauma. National Emergency X-Radiography Utilization Study Group. N Engl J Med. 2000; 343: 94-9. https://doi.org/10.1056/NEJM200007133430203
36. Stiell IG, Wells GA, Vandemheen KL et al.The Canadian C-spine rule for radiography in alert and stable trauma patients. JAMA. 2001; 286: 1841-8. https://doi.org/10.1001/jama.286.15.1841
37. Galeiras Vázqueza R, Ferreiro Velasco ME, Mourelo Fariña M et al. Actualización en lesión medular aguda postraumática. Parte 1. Med Intensiva. 2017; 41: 237-47. https://doi.org/10.1016/j.medin.2016.11.002
38. Purvis TA, Carlin B, Driscoll P. The definite risks and questionable benefits of liberal pre-hospital spinal immobilisation. Am J Emerg Med. 2017; 35: 860-6. https://doi.org/10.1016/j.ajem.2017.01.045
39. Miller CP, Brubacher JW, Biswas D et al. The incidence of noncontiguous spinal fractures and other traumatic injuries associated with cervical spine fractures: A 10-year experience at an academic medical center. Spine (Phila Pa 1976). 2011; 36: 1532-40. https://doi.org/10.1097/BRS.0b013e3181f550a6
40. Ahn H, Singh J, Nathens A et al. Pre-Hospital Care Management of a Potential Spinal Cord Injured Patient: A Systematic Review of the Literature and Evidence-Based Guidelines. Journal of Neurotrauma 2011; 28: 1341-61. https://doi.org/10.1089/neu.2009.1168
41. Ko HY. Revisit Spinal Shock: Pattern of Reflex Evolution during Spinal Shock. Korean J Neurotrauma 2018; 14:47-54. https://doi.org/10.13004/kjnt.2018.14.2.47
42. Atkinson PP, Atkinson JL. Spinal shock. Mayo Clin. Proc. 1996; 71: 384-9. https://doi.org/10.4065/71.4.384
43. Atkinson PP, Atkinson JL. Spinal shock. Mayo Clin Proc 1966; 71: 384-9. https://doi.org/10.4065/71.4.384
44. Hiersemenzel LP, Curt A, Dietz V. From spinal shock to spasticity: neuronal adaptations to a spinal cord injury. Neurology 2000; 54: 1574-82. https://doi.org/10.1212/WNL.54.8.1574
45. Ditunno JF, Little JW, Tessler A, Burns AS. Spinal shock revisited: a four-phase model. Spinal Cord 2004; 42: 383-95. https://doi.org/10.1038/sj.sc.3101603
46. Guly HR, Bouamra O, Lecky FE. The incidence of neurogenic shock in patients with isolated spinal cord injury in the emergency department. Resuscitation 2008; 76: 57-62. https://doi.org/10.1016/j.resuscitation.2007.06.008
47. Mackenzie CF, Shin B, Krishnaprasad D et al. Assessment of cardiac and respiratory function during surgery on patients with acute quadriplegia. J Neurosurg 1985; 62: 843. https://doi.org/10.3171/jns.1985.62.6.0843
48. Lehmann KG, Lane JG, Piepmeier JM, Batsford WP. Cardiovascular abnormalities accompanying acute spinal cord injury in humans: incidence, time course and severity. J Am Coll Cardiol 1987; 10: 46. https://doi.org/10.1016/S0735-1097(87)80158-4
49. Mathias CJ. Bradycardia nad cardiac arrest during tracheal suction. Mechanisms in tetraplegic patients. Eur J Intens Care Med 1976; 2: 147. https://doi.org/10.1007/BF00624607
50. Partida E, Mironets E, Hou S, Tom VJ. Cardiovascular dysfunction following spinal cord injury. Neural Regen Res 2016; 11:189-194. https://doi.org/10.4103/1673-5374.177707
51. Sharif H, Hou S. Autonomic dysreflexia: a cardiovascular disorder following spinal cord injury. Neural Regen Res. 2017 Sep; 12(9): 1390-1400. https://doi.org/10.4103/1673-5374.215241
52. Mansel JK, Norman JR. respiratory complications and management of spinal cord injuries. Chest 1990; 97: 1446. https://doi.org/10.1378/chest.97.6.1446
53. Price MJ, Campbell IG. Effects of spinal cord lesion level upon thermoregulation during exercise in the heat. Med Sci Sports Exerc. 2003; 35: 1100-7. https://doi.org/10.1249/01.MSS.0000074655.76321.D7
54. Roth EJ, Lu A, Primack S et al. Ventilatory function in cervical and high thoracic spinal cord injury. Relationship to level of injury and tone. Am J Phys Med Rehabil. 1997; 76: 262-7. https://doi.org/10.1097/00002060-199707000-00002
55. McKenzie CF, Ducker TB. Cervical Spinal Cord Injury and Neurosurgery. En: J.Matjasko ed. Clinical controversies in neuroanesthesia and neurosurgery. Grune & Straton, Orlando, 1986.
56. Levi L, Wolf A, Belzberg H. Hemodynamic parameters in patients with acute cervical cord trauma: Description, intervention, and prediction of outcome. Neurosurgery. 1993; 33: 1007-16. https://doi.org/10.1227/00006123-199312000-00008
57. Ploumis A, Yadlapalli N, Fehlings MG et al. A systematic review of the evidence supporting a role for vasopressor support in acute SCI. Spinal Cord. 2010; 48: 356-62. https://doi.org/10.1038/sc.2009.150
58. Price MJ, Trbovich M. Thermoregulation following spinal cord injury. Handb Clin Neurol. 2018; 157: 799-820. https://doi.org/10.1016/B978-0-444-64074-1.00050-1
59. ASIA International Standards For Neurological Classification Of Spinal Cord Injury (ISNCSCI). En: http://asia-spinalinjury.org/ wp-content/uploads/2016/02/International Stds Diagram Worksheet.pdf
60. Kirshblum SC, Burns SP, Biering-Sorensen F et al. International standards for neurological classification of spinal cord injury (revised 2011). J Spinal Cord Med. 2011; 34: 535-46. https://doi.org/10.1179/204577211X13207446293695
61. Resnick DK. Update guidelines for the management of acute cervical spine and spinal cord injury. Neurosurgery. 2013; 72 (Supl 3): 1. https://doi.org/10.1227/NEU.0b013e318276ed9a
62. Hoffman JR, Mower WR, Wolfson et al. Validity of a set of clinical criteria to rule out injury to the cervical spine in patients with blunt trauma. N Engl J Med. 2000; 343: 94-9. https://doi.org/10.1056/NEJM200007133430203
63. Stiell IG, Wells GA, Vandemheen KL et al. The Canadian C-spine rule for radiography in alert and stable trauma patients. JAMA. 2001; 286: 1841-8. https://doi.org/10.1001/jama.286.15.1841
64. El-Khoury GY, Kathol MH, Daniel WW. Imaging of acute injuries of the cervical spine: value of plain radiography, CT and MR imaging. Am J Roentgoenol 1995;164 :43. https://doi.org/10.2214/ajr.164.1.7998567
65. Demetriadesw D, Charalambides K, Chahwan S et al. Nonskeletal cervical spine injuries: epidemiology and diagnostic pitfalls. J Trauma 2000; 48: 724. https://doi.org/10.1097/00005373-200004000-00022
66. Fehlings MG, Martin AR, Tetreault LA et al. A Clinical Practice Guideline for the Management of Patients with Acute Spinal Cord Injury: Recommendations on the Role of Baseline Magnetic Resonance Imaging in Clinical Decision Making and Outcome Prediction. Global Spine J. 2017;7 ( Supl): S221-S230. https://doi.org/10.1177/2192568217703387
67. Donovan J, Kirshblum S. Clinical Trials in Traumatic Spinal Cord Injury. Neurotherapeutics 2018;15: 654-68. https://doi.org/10.1007/s13311-018-0632-5
68. Batchelor PE, Wills TE, Skeers P et al. Meta-analysis of preclinical studies of early decompression in acute spinal cord injury: a battle of time and pressure. PLoS One. 2013; 8: e72659. https://doi.org/10.1371/journal.pone.0072659
69. Ahuja CS, Martin AR, Fehlings MG. Recent advances in managing spinal cord injury secondary to trauma. F1000 Research. 2016; 5 (F1000 Faculty Rev): 1017. https://doi.org/10.12688/f1000research.7586.1
70. Petitjean ME, Mousselard H, Pointillart V et al. Thoracic spinal trauma and associated injuries: should early spinal decompression be considered? J Trauma 1995; 39: 368-72. https://doi.org/10.1097/00005373-199508000-00030
71. Fehlings MG, Vaccaro A, Wilson JR et al. Early versus delayed decompression for traumatic cervical spinal cord injury: results of the Surgical Timing in Acute Spinal Cord Injury Study (STASCIS). PLo S One 2012; 7(2): e32037. https://doi.org/10.1371/journal.pone.0032037
72. Wilson JR, Singh A, Craven C et al. Early versus late surgery for traumatic spinal cord injury: the results of a prospective Canadian cohort study. Spinal Cord 2012; 50: 840-3. https://doi.org/10.1038/sc.2012.59
73. El Tecle NE, Dahdaleh NS, Hitchon PW. Timing of surgery in spinal cord injury. Spine (Phila Pa 1976). 2016; 41: E995-1004. https://doi.org/10.1097/BRS.0000000000001517
74. Fehlings MG, Tetreault LA, Wilson JR et al. A Clinical Practice Guideline for the Management of Patients with Acute Spinal Cord Injury and Central Cord Syndrome: Recommendations on the Timing (<24 Hours versus >24 Hours) of Decompressive Surgery. Global Spine Journal 2017; 7(Supl 3): 195S-202S. https://doi.org/10.1177/2192568217706367
75. Badhiwala JH, Ahuja CS, Fehlings MG. Time is spine: a review of translational advances in spinal cord injury. J Neurosurg Spine 2018; 30: 1-18. https://doi.org/10.3171/2018.9.SPINE18682
76. El Masri WS. Traumatic spinal injury and spinal cord injury: point for active physiological conservative management as compared to surgical management. 2018; 4: 14-17. https://doi.org/10.1038/s41394-018-0045-z
77. Bracken MB, Shepard MJ, Hellenbrand KG et al. Methyl- prednisolone and neurological function 1 year after spinal cord injury. Results of the National Acute Spinal Cord Injury Study. J Neurosurg. 1985; 63: 704-713. https://doi.org/10.3171/jns.1985.63.5.0704
78. Bracken MB, Shepard MJ, Collins WF Jr et al. Methylprednisolone or naloxone treatment after acute spinal cord injury: 1-year follow-up data. Results of the Second National Acute Spinal Cord Injury Study. J Neurosurg. 1992; 76: 23-31. https://doi.org/10.3171/jns.1992.76.1.0023
79. Bracken MB, Shepard MJ, Holford TR, et al. Administration of methylprednisolone for 24 or 48 hours or tirilazad mesylate for 48 hours in the treatment of acute spinal cord injury. Results of the Third National Acute Spinal Cord Injury Randomized Controlled Trial. National Acute Spinal Cord Injury Study. JAMA. 1997; 277: 1597-1604. https://doi.org/10.1001/jama.1997.03540440031029
80. Hurlbert R. Methylprednisolone for acute spinal cord injury: an inappropriate standard of care. J Nerosurg Spine. 2000; 93: 1-7. https://doi.org/10.3171/spi.2000.93.1.0001
81. Evaniew N, Dvorak M. Cochrane in CORR: Steroids for Acute Spinal Cord Injury. Clin Orthop Relat Res 2016; 474: 19-24. https://doi.org/10.1007/s11999-015-4601-6
82. Evaniew N, Belley-Côte EP, Fallah N et al. Methylprednisolone for the Treatment of Patients with Acute Spinal Cord Injuries: A Systematic Review and Meta-Analysis. J Neurotrauma 2016; 33: 468-81. https://doi.org/10.1089/neu.2015.4192
83. Fehlings MG, MD, Wilson JR, Tetreault LA et al. A Clinical Practice Guideline for the Management of Patients with Acute Spinal Cord Injury: Recommendations on the Use of Methylprednisolone Sodium Succinate. Global Spine Journal 2017; 7(Supl) S203-S211. https://doi.org/10.1177/2192568217706366
84. Bowers CA, Kundu B, Hawryluk GWJ. Methylprednisolone for acute spinal cord injury: an increasingly philosophical debate. Neural Regeneration Research. 2016: 11; 882-5. https://doi.org/10.4103/1673-5374.184450
85. Falavigna A, MD, Quadros FW, Teles AR. Worldwide Steroid Prescription for Acute Spinal Cord Injury. Global Spine Journal 2018; 8: 303-10. https://doi.org/10.1177/2192568217735804
86. Badhiwala JH, Ahuja CS, Fehlings MG. Time is spine: a review of translational advances in spinal cord injury. J Neurosurg Spine 2018; 30: 1-18. https://doi.org/10.3171/2018.9.SPINE18682
87. Geisler FH, Coleman WP, Grieco G, Poonian D. The Sygen multicenter acute spinal cord injury study. Spine. 2001; 26 (24 Supl): 87-98. https://doi.org/10.1097/00007632-200112151-00015
88.
89. Petitjean ME, Pointillart V, Dixmerias et al. [Medical treatment of spinal cord injury in the acute stage]. Ann Fr Anesth Reanim. 1998; 17: 115-22.
90. Srinivas S, Wali AR, Pham MH. Efficacy of riluzole in the treatment of spinal cord injury: a systematic review of the literature. Neurosurg Focus. 2019; 46: E6. https://doi.org/10.3171/2019.1.FOCUS18596
91. Casha S, Zygun D, McGowan MD et al. Results of phase II placebo-controlled randomized trial of minocycline in acute spinal cord injury. Brain. 2012; 135:1224-36. https://doi.org/10.1093/brain/aws072
92. Squair JW, Ruiz I, Phillips AA et al. Minocycline Reduces the Severity of Autonomic Dysreflexia after Experimental Spinal Cord Injury. J Neurotrauma 2018; 35: 2861-71. https://doi.org/10.1089/neu.2018.5703
93. Duo Z, He XJ. Advances in mechanisms of treatment for spinal cord injury with lithium. Zhongguo Gu Shang 2015; 28: 679-82.
94. Levi AD, Green BA, Wang MY et al. Clinical application of modest hypothermia after spinal cord injury. J Neurotrauma. 2009; 26: 407-15. https://doi.org/10.1089/neu.2008.0745
95. Dididze M, Green BA, Dietrich WD et al. Systemic hypothermia in acute cervical spinal cord injury: a case-controlled study. Spinal Cord 2013; 51: 395-400. https://doi.org/10.1038/sc.2012.161
96. 12. Dietrich WD, Levi AD, Wang M, Green BA. Hypothermic treatment for acute spinal cord injury. Neurotherapeutics 2011; 8: 229-39. https://doi.org/10.1007/s13311-011-0035-3
97. Patel NP, Huang JH. Hyperbaric oxygen therapy of spinal cord injury. Med Gas Res 2017; 7): 133-43. https://doi.org/10.4103/2045-9912.208520
98. Fehlings MG, Theodore N, Harrop J et al. A phase I/IIa clinical trial of a recombinant Rho protein antagonist in acute spinal cord injury. J Neurotrauma 2011; 28: 787-796. https://doi.org/10.1089/neu.2011.1765
99. Freund P, Wannier T, Schmidlin E et al. Anti-Nogo-A antibody treatment enhances sprouting of corticospinal axons rostral to a unilateral cervical spinal cord lesion in adult macaque monkey. J Comp Neurol 2007; 502: 644-59. https://doi.org/10.1002/cne.21321
100. Geisler FH, Coleman W, Grieco G et al. The Sygen multicenter acute spinal cord injury study. Spine 2001; 26 (Supl 24): S87-S98. https://doi.org/10.1097/00007632-200112151-00015
101. Wilson JR, Forgione N, Fehlings MG. Emerging therapies for acute traumatic spinal cord injury. CMAJ 2013; 185: 485-92. https://doi.org/10.1503/cmaj.121206
102. Fang-ping Bao, Hong-gang Zhang, Sheng-mei Zhu. Anesthetic considerations for patients with acute cervical spinal cord injury. Neural Regen Res 2017; 12: 499-04. https://doi.org/10.4103/1673-5374.202916
103. Crosby ET. Traqueal intubation in the cervical spine injuried patient. Can J Anaesth 1992; 39: 105-9. https://doi.org/10.1007/BF03008637
104. Rosen P, Wolfe RE. Therapeutic legends of emergency medicine. J Emerg Med 1989; 7: 387-9. https://doi.org/10.1016/0736-4679(89)90312-0
105. Hastings RH, Kelley SD. Neurologic deterioration asociated with airway management in a cervical spine-injured patient, Anesthesiology 1993; 78: 580-3. https://doi.org/10.1097/00000542-199303000-00022
106. McLeod ADM, Calder I. Spinal cord injury and direct laringoscopy – the legend lives on. Br J Anaesth 2000; 84: 705-9. https://doi.org/10.1093/bja/84.6.705
107. Health KJ. The effect on laryngoscopy of different cervical spine inmovilization trchniques. Anaesthesia 1994; 49: 843-5. https://doi.org/10.1111/j.1365-2044.1994.tb04254.x
108. Hauswald M, Sklar DP, Tandberg D et al. Cervical spine movement during airway management: Cinefluoroscopic appraisal in human cadavers. Am J Emerg Med 1991; 9: 535-8. https://doi.org/10.1016/0735-6757(91)90106-T
109. Santoni BG, Hindman BJ, Puttlitz CM. Manual In-line Stabilization Increases Pressures Applied by the Laryngoscope Blade during Direct Laryngoscopy and Orotracheal Intubation. Anesthesiology 2009; 10: 24-31. https://doi.org/10.1097/ALN.0b013e318190b556
110. Yentis SM. The effect of single handed and bimanual cricoid pressure on the view at laryngoscopy. Anaesthesia 1997;52:332. https://doi.org/10.1111/j.1365-2044.1997.87-az0089.x
111. Helliwell V, Gabott DA. The effect of single-handed cricoid pressure on cervical spine movement after applying manual in-line stabilization – a cadaver study. Resuscitation 2001; 49: 53. https://doi.org/10.1016/S0300-9572(00)00307-5
112. Tungeon AF, Nicole, PC, Trépanier CA et al. Cricoid pressure does not the rate of failed intubation by direct laringoscopy in adults. Anesthesiology 2005; 102: 315-9. https://doi.org/10.1097/00000542-200502000-00012
113. Mosier JM, Stolz U, Chiu S, Sakles JC. Difficult airway management in the emergency department: GlideScope videolaryngoscopy compared to direct laryngoscopy. J Emerg Med 2012; 42: 629-34. https://doi.org/10.1016/j.jemermed.2011.06.007
114. Van-Elstraete AC, Mamie JC, Mehdaoui H. Nasotracheal intubation in patients with immobilized cervical spine: a comparison of tracheal tube cuff inflation and fiberoptic bronchoscopy. Anesth Analg 1998; 87: 400-2. https://doi.org/10.1097/00000539-199808000-00031
115. Benumof JL, Management of the difficult adult airway. With special emphasis on awake tracheal intubation.. Anesthesiology 1991;75:1087. https://doi.org/10.1097/00000542-199112000-00021
116. Calder I, Calder J, Crockard HA. Difficult direct laryngoscopy in patients with cervical spine disease. Anaesthesia 1995; 50: 756-63. https://doi.org/10.1111/j.1365-2044.1995.tb06135.x
117. Dunham CM, Barraco RD, Clark DE et al. EAST Practice Management Guidelines Work Group: Guidelines for emergency tracheal intubation immediately after traumatic injury. J Trauma 2003; 55: 162-79. https://doi.org/10.1097/01.ta.0000083335.93868.2c
118. Kerwin AJ, Croce MA, Timmons SD et al. Effects of fiberoptic bronchoscopy on intracranial pressure in patients with brain injury: A prospective clinical study. J Trauma 2000; 48: 878-83. https://doi.org/10.1097/00005373-200005000-00011
119. Robitaille A, Williams S, , Stephan R, Tremblay MH et al. Cervical Spine Motion During Tracheal Intubation with Manual In-Line Stabilization: Direct Laryngoscopy versus GlideScope® Videolaryngoscopy. Anesth Analg 2008; 106: 935-41. https://doi.org/10.1213/ane.0b013e318161769e
120. Kill C, Risse J, Wallot P et al. Videolaryngoscopy with Glidescope Reduces Cervical Spine Movement in Patients with Unsecured Cervical Spine. J Emerg Med 2013; 44:, 750-6. https://doi.org/10.1016/j.jemermed.2012.07.080
121. Grande CM, Barton CB, Stene JK. Appropiate techniques for airway management of emergency patients with suspected spinal cord injury. Anesth Analg 1988; 67: 714-15. https://doi.org/10.1213/00000539-198807000-00025
122. Gerling MC, Davis DP, Hamilton RS et al. Effect of surgical cricothyrotomy on the unstable cervical spine in a cadaver model of intubation. J Emerg Med 2001; 20: 1-5. https://doi.org/10.1016/S0736-4679(00)00287-0
123. Jenkins K, Wong DT, Correa R. Management choices for the difficult airway by anesthesiologists in Canada. Can J Anaesth. 2002; 49: 850-6. https://doi.org/10.1007/BF03017419
124. Gavaret M, Jouve JL, Péréon Y et al. Intraoperative neurophysiologic monitoring in spine surgery. Developments and state of the art in France in 2011. Orthopaedics & Traumatology: Surgery & Research 2013; 99: S319-S327. https://doi.org/10.1016/j.otsr.2013.07.005
125. Cooperman LH. Succinylcholine-induced hyperkalemia in neuromuscular disease. JAMA 1970; 213: 1867-71. https://doi.org/10.1001/jama.1970.03170370051009
126. Levi L, Wolf A, Belzberg H. Hemodynamic parameters in patients with acute cervical cord trauma: Description, intervention and prediction of outcome. Neurosurgery 1993; 33: 1007-16. https://doi.org/10.1227/00006123-199312000-00008
127. Drummond JC, Moore SS. The influence of dextrose administration on neurologic outcome after temporary spinal cord ischemia in the rabbit. Anesthesiology 1989; 70: 64-70. https://doi.org/10.1097/00000542-198901000-00014
128. Rizoli SB. Cristalloids and colloids in trauma resuscitation: A brief overview of the current debate. J Trauma. 2003; 54 (Supl): S82-S88.
129. Ploumis A, Yadlapalli N, Fehlings MG et al. A systematic review of the evidence supporting a role for vasopressor support in acute SCI. Spinal Cord. 2010; 48: 356-62. https://doi.org/10.1038/sc.2009.150
130. Consortium for Spinal Cord Medicine. Early acute management in adults with spinal cord injury: a clinical practice guideline for health-care professionals. J Spinal Cord Med. 2008; 31: 403-79. https://doi.org/10.1080/10790268.2008.11760744
131. Readdy WJ, Whetstone WD, Ferguson AR, et al. Complications and outcomes of vasopressor usage in acute traumatic central cord syndrome. J Neurosurg Spine. 2015; 23:574-80. https://doi.org/10.3171/2015.2.SPINE14746
132. Readdy WJ, Dhall SS. Vasopressor administration in spinal cord injury: should we apply a universal standard to all injury patterns? Neural Regen Res. 2016; 11: 420-1. https://doi.org/10.4103/1673-5374.179051
133. Ryken TC, Hurlbert RJ, Hadley MN et al. The acute cardiopulmonary management of patients with cervical spinal cord injuries. Neurosurgery 2013; 72 (Supl 2): S84-S92. https://doi.org/10.1227/NEU.0b013e318276ee16
134. DeVivo MJ, Krause JS, Lammertse DP. Recent trends in mortality and causes of death among persons with spinal cord injury. Arch Phys Med Rehabil 1999; 80: 1411-19. https://doi.org/10.1016/S0003-9993(99)90252-6
135. Hagen EM, Rekand T. Management of Neuropathic Pain Associated with Spinal Cord Injury. Pain Ther 2015; 4: 51-65. https://doi.org/10.1007/s40122-015-0033-y
136. Myllynen F, KammonenM Rokkanen P et al. Deep venous thrombosis and pulmonary embolism in patients with acute spinal cord injury: a comparison with nonparalyzed patients immobilized due spinal fractures. J Trauma 1985; 25: 541-3. https://doi.org/10.1097/00005373-198506000-00013
137. Dhall SS, Hadley MN, Aarabi B et al. Deep venous thrombosis and thromboembolism in patients with cervical spinal cord injuries. Neurosugery 2013; 72 (Supl 2): 244-54. https://doi.org/10.1227/NEU.0b013e31827728c0
138. Fehlings MG, Tetreault LA, Aarabi B et al. A Clinical Practice Guideline for the Management of Patients with Acute Spinal Cord Injury: Recommendations on the Type and Timing of Anticoagulant Thromboprophylaxis. Global Spine Journal 2017; 7 (Supl 3): S212-S220. https://doi.org/10.1177/2192568217703387
139. Dhall SS, Hadley MN, Aarabi B et al. Nutritional support after spinal cord injury. Neurosugery 2013; 72 (Supl 2) :255-59. https://doi.org/10.1227/NEU.0b013e31827728d9

 ORCID
ORCID