Héctor J. Lacassie 1 , Antonia Cárdenas 1
Recibido: 20-11-2020
Aceptado: 23-11-2020
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 1 pp. 196-216|https://doi.org/10.25237/revchilanestv50n01-12
PDF|ePub|RIS
Obstetric patient and anesthesia
Abstract
Pregnancy induces changes in almost every body system, pushing their reserves to the limit. There is a decrease in systemic vascular resistance, a progressive increase in blood volume, heart rate and myocardial size, resulting in an increased cardiac output. It reduces the functional residual capacity and increases the tidal volume. Oxygen consumption increases, leading to a decrease in oxygen reserves and increased risk of hypoxemia under hypoventilation or apnea (more frequent due to difficult airway management as a result of edema). Important changes are also observed at the hematological, renal and intestinal levels. Uterineplacental blood flow increases progressively during pregnancy, elevating the risk of massive hemorrhage. When intrauterine resuscitation does not resolve acute fetal distress, urgent cesarean section should be performed. Neuraxial over general anesthesia is recommended. In emergency situations, general anesthesia or “Rapid Sequence Spinal Anesthesia” is suggested as an alternative. The requirements of both, hypnotics and inhalation agents, decrease during pregnancy. Obstetric hemorrhage may be the result of bleeding from placenta or a consequence of trauma to the genital tract during delivery. The most severe cases present hypovolemic shock. Along with controlling the source of bleeding, the treatment goals are: treat hypovolemia and acute trauma coagulopathy, preserve oxygen transport capacity, repair the endothelium and prevent dilutional coagulopathy. Management of placenta accreta must be multidisciplinary. Preoperative diagnosis is essential for adequate preparation. Combined spinal-epidural technique is recommended. When hysterectomy becomes necessary, conversion to general anesthesia should be considered. Amniotic fluid embolism in its early stage produces right ventricular dysfunction due to acute pulmonary hypertension and, in its late stage, left ventricular dysfunction. In 40% of cases, multifactorial coagulopathy is observed. The diagnostic criteria are: 1) hypotension or cardiac arrest, hypoxia and coagulopathy; 2) during labor, caesarean section, uterine curettage or in the first 30 minutes postpartum; 3) in the absence of another diagnosis that explains the symptoms. Treatment is supportive, besides termination of pregnancy. Resuscitation during pregnancy must be led by a professional who understands the complexities of the situation. Maternal well-being is the best predictor of fetal well-being. A perimortem cesarean may become necessary.
Resumen
El embarazo induce cambios en casi todos los sistemas corporales, llevando al límite las reservas a cada uno de ellos. Hay disminución de la resistencia vascular sistémica, aumento progresivo de la volemia, frecuencia cardiaca y tamaño miocárdico, lo que produce un aumento del débito cardiaco. Se reduce de la capacidad residual funcional y aumenta del volumen corriente. Aumenta el consumo de oxígeno, lo que conlleva disminución de la reserva de oxígeno y aumenta el riesgo de hipoxemia frente a hipoventilación o apnea (más frecuente dificultad en el manejo de vía aérea por edema). También se observan importantes cambios a nivel hematológico, renal e intestinal. El aumento progresivo de flujo úteroplacentario propicia el desarrollo de hemorragias masivas. Cuando la reanimación intrauterina no resuelve el sufrimiento fetal agudo se debe proceder a la cesárea de urgencia. En dicho caso, se privilegia la anestesia neuroaxial por sobre la general. En la cesárea de emergencia se recomienda anestesia general o “anestesia espinal en secuencia rápida” como alternativa. Los requerimientos tanto de hipnóticos como de agentes inhalatorios disminuyen en el embarazo. La hemorragia obstétrica resulta del sangrado del lecho placentario o como consecuencia del traumatismo al tracto genital durante el parto. La forma de presentación de los casos graves generalmente es con hipovolémico. Junto con controlar la fuente del sangrado los objetivos son: tratar la hipovolemia, tratar la coagulopatía aguda del trauma, preservar la capacidad de transporte de oxígeno, reparar el endotelio y prevenir la coagulopatía dilucional. El manejo de la placenta acreta es multidisciplinario. El diagnóstico preoperatorio es imprescindible para la adecuada preparación. Es recomendable una técnica combinada espinal-epidural y conversión a anestesia general en caso de histerectomía. La embolia de líquido amniótico en su etapa temprana produce disfunción ventricular derecha, por hipertensión pulmonar aguda y en su etapa tardía, disfunción ventricular izquierda. En el 40% de los casos, se observa coagulopatía multifactorial. Los criterios diagnósticos son: 1) hipotensión o paro cardíaco, hipoxia y coagulopatía; 2) durante el trabajo de parto, cesárea, legrado uterino o en los primeros 30 min posparto; 3) en ausencia de otro cuadro que explique los síntomas. El tratamiento es de soporte y la interrupción del embarazo. La reanimación durante el embarazo debe ser liderada por un profesional que conozca las particularidades del manejo. El bienestar materno es el mejor predictor de bienestar fetal. Una cesárea puede ser necesaria.
-
Introducción
El manejo anestésico de las urgencias en las pacientes obstétricas implica la preocupación y cuidado primariamente de la madre y, secundariamente, del feto y eventual recién nacido. Si bien el objetivo es el bienestar del binomio, no siempre es factible y se debe priorizar por la primera.
Los cambios propios del embarazo hacen de esta población un desafío adicional al quehacer del anestesiólogo y requieren de su conocimiento para lograr los mejores desenlaces.
El objetivo de esta revisión es describir el manejo desde el punto de vista anestesiológico de las urgencias de la paciente embarazada que requieren de resolución quirúrgica. Las urgencias quirúrgicas del ámbito no obstétrico en la embarazada serán abordadas en otro artículo de esta revista.
-
Epidemiología
La tasa de muertes maternas en el Reino Unido entre 2014-2016 fue de 9,8 por 100.000 embarazos. Las principales causas directas de mortalidad materna estuvieron dadas por: 1) trombosis y tromboembolismo; 2) hemorragia obstétrica; 3) suicidios; 4) infecciones y sepsis; 5) embolia de líquido amniótico y 6) complicaciones de la preeclampsia y eclampsia[1].
En Chile, las cinco primeras causas de mortalidad materna en el período entre 2002 y 2015 fueron: 1) enfermedades concurrentes; 2) hipertensión arterial; 3) embarazo ectópico; 4) hemorragia y 5) embolias. A su vez, el análisis por edad muestra que la razón de mortalidad materna asociada a enfermedades concurrentes, hipertensión arterial, aborto y hemorragia posparto aumenta en los extremos de edad materna, siendo mayor en el quinquenio superior[2].
Así, muchas de las causas que potencialmente derivan en un desenlace fatal serán en algún momento motivo de cirugía de urgencia o emergencia en la embarazada. Todo lo anterior obliga a los anestesiólogos a optimizar su quehacer, mejorando la comunicación con el equipo, preocuparse de disponer de los implementos y competencias necesarias para el tratamiento de las complicaciones mencionadas, perfeccionar el registro y asegurar una atención oportuna y de la mejor calidad[3].
-
Anatomía y fisiología del embarazo
Durante el embarazo se producen múltiples cambios anatómicos y fisiológicos que pueden tener implicancias para el anestesiólogo y en particular, frente a una urgencia. Recientemente, la Sociedad Americana de Anestesiólogos (ASA) clasificó el embarazo en una paciente sana como ASA II, es decir, reconociendo el embarazo como una condición fisiopatológica[4]. Si bien el embarazo es una situación normal, conlleva riesgos aumentados en cuanto a morbimortalidad.
El embarazo induce cambios en casi todos los sistemas corporales, llevando al límite de las reservas a cada uno de ellos, lo que mantiene a la paciente en un equilibrio muy delicado, susceptible de ser alterado por mínimos estímulos. Los cambios más precoces están mediados hormonalmente, mientras que los más tardíos se asocian a cambios mecánicos dados por el aumento en el tamaño uterino, aumento en las demandas metabólicas del feto y la baja resistencia de la circulación placentaria[5].
Aunque el tema será tratado más extensamente en otro artículo de esta revista, parece indispensable como aproximación al tema recordar las modificaciones anatómicas y fisiológicas más importantes ocurridas durante el embarazo.
-
Sistema cardiovascular
Los cambios hemodinámicos más importantes del embarazo son la disminución de la resistencia vascular sistémica, el aumento progresivo de la volemia, la frecuencia cardiaca y el del tamaño miocárdico, lo que se traduce en un aumento del débito cardiaco, manteniéndose normotensión arterial con presiones de llenado ventriculares normales (Figura 1)[6]. El gasto cardíaco aumenta durante el trabajo de parto con respecto a los valores previos: en etapa inicial temprana 10%, tardía 25% y en el expulsivo 40%. En el posparto inmediato puede llegar a ser 75% mayor que los valores preparto. Se reduce a las 24 h y vuelve a valores preembarazo entre las 12 y 24 semanas posparto.
-
Sistema respiratorio
Los cambios espirométricos más importantes son una reducción de la capacidad residual funcional (20%) y aumento del volumen corriente. El impacto ácido-base es una alcalosis respiratoria compensada. Por otra parte, hay un aumento en las demandas metabólicas, aumentando el consumo de oxígeno en hasta 60%[7], asociado a una disminución de la reserva de oxígeno. Esto se traduce en un riesgo aumentado de presentar hipoxemia en forma más rápida que una paciente no embarazada frente a situaciones de hipoventilación o apnea.
Se produce ingurgitación capilar de la mucosa respiratoria como también edema, lo que dificulta el manejo de la vía aérea. Estas alteraciones se mantienen hasta las 6 a 8 semanas posparto.
-
Sistema hematológico
Todos los factores de coagulación están aumentados, excepto los factores II y V que no se modifican y los factores XI y XIII que disminuyen. Por otra parte, hay una disminución de la proteína S y antitrombina III, junto con un aumento en la fibrinolisis. Así, el estado de la embarazada es el de una coagulación intravascular acelerada, pero controlada[7]. Debe tenerse presente que 15% a 20% de la mortalidad materna es por tromboembolismo pulmonar[8] y constituye la primera causa de muerte directa en el Reino Unido1 y la quinta en Chile[9].
-
Sistema renal
El flujo plasmático renal y la filtración glomerular aumentan hasta 150% del valor basal de la paciente no embarazada, con el consiguiente aumento en el clearance de creatinina, donde el mayor aumento es en la mitad del segundo trimestre. En el tercer trimestre vuelven a valores normales. La implicancia inmediata es que un valor en el extremo superior del rango normal de una paciente no embarazada, traducirá insuficiencia renal en la embarazada.
-
Sistema gastrointestinal
El riesgo de aspiración de contenido gástrico aumenta en el embarazo. Aunque se ha demostrado que el vaciamiento gástrico es normal durante el embarazo y justo antes del parto[10], el riesgo de aspiración de contenido gástrico sigue aumentando debido a la reducción de la presión a nivel del esfínter esofágico inferior, por lo que toda embarazada debe ser considerada como “estómago lleno virtual”, con las implicancias que esto tiene, en especial desde las 12 semanas de gestación y hasta 24 h posparto.
-
Unidad uteroplacentaria
El flujo sanguíneo uterino aumenta drásticamente durante el embarazo, desde 50-100 mlTnm a 700900 ml^min-1 en la paciente de término, siendo aún mayor en los embarazos múltiples. El flujo sanguíneo uterino representa 12% del gasto cardíaco en el término del embarazo. El 80%-90% de este flujo sanguíneo se dirige hacia la placenta.
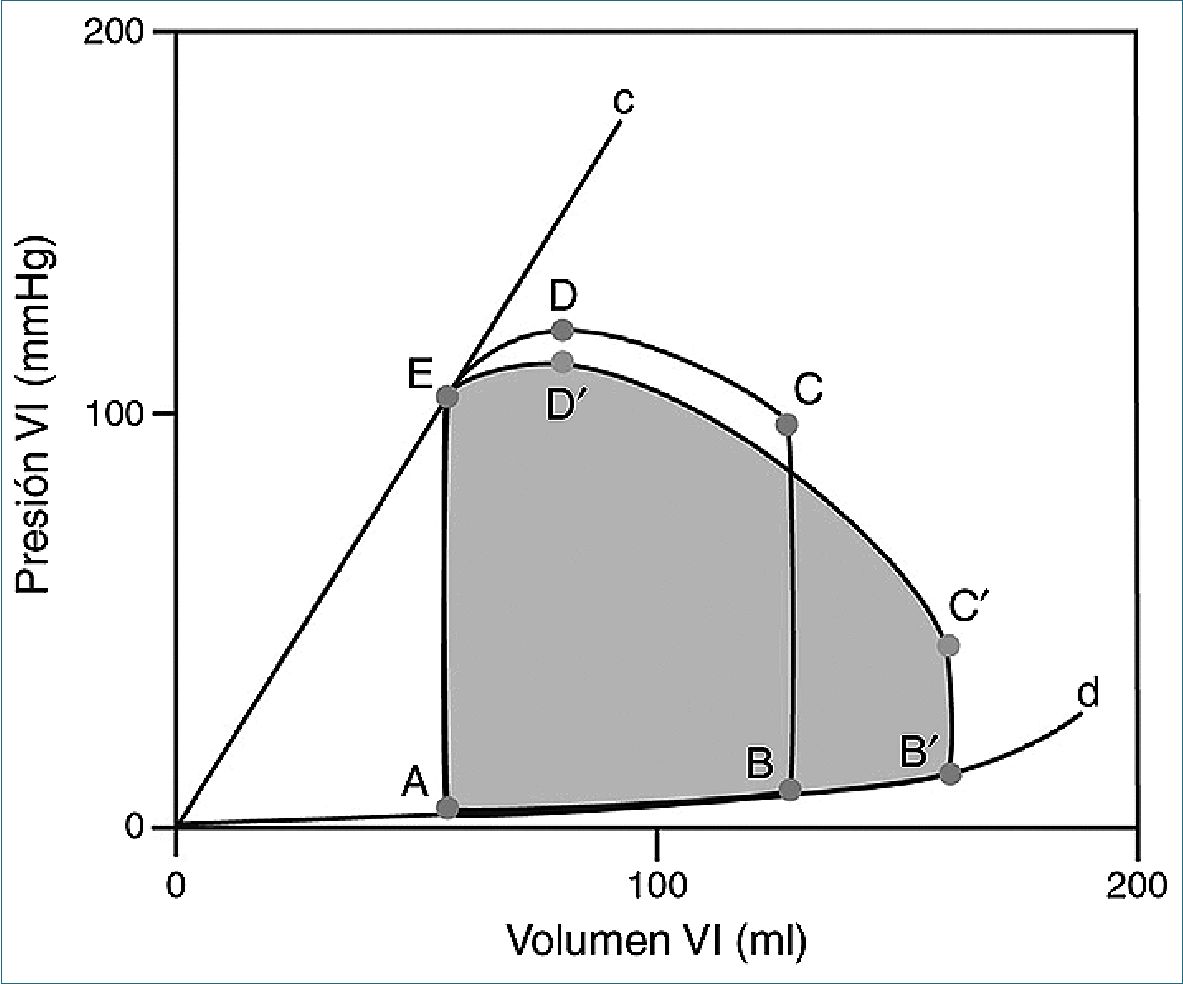
Figura 1. Gráfico presión/volumen del ventrículo izquierdo (VI). Área ABCDE es la curva de una paciente normal. A: apertura de la válvula mitral; B: cierre de la válvula mitral; C: apertura de la válvula aórtica; D: presión arterial sistólica máxima; E: cierre de la válvula aórtica; Línea 0-c: elastancia máxima (que es un índice de contractilidad miocárdica); Línea 0-d: distensibilidad ventricular. Área AB’C’DE (área gris) curva de una paciente embarazada de término, sana. Segmento AB’: distensibilidad del VI que sigue la curva de distensibilidad normal (línea 0-d). B’: cierre de la válvula mitral en la embarazada, que ocurre con un volumen de fin de diástole 40% mayor a lo normal; C’: apertura de la válvula aórtica a una presión menor que la no embarazada, dado por una menor resistencia vascular sistémica; D’: presión arterial sistémica menor a la no embarazada. Notar que el volumen de fin de sístole no se modifica, por lo que el aumento en el débito cardiaco es secundario a mayor volumen eyectivo (+25%) asociado a mayor frecuencia cardiaca (+25%) y no a mayor contractilidad miocárdica (la pendiente de la curva 0-c no se modifica). (Reimpreso de: Reflexión sobre la curva presión/volumen ventricular de la embarazada sana. Lacassie HJ, Lema G. Rev Esp Anestesiol Reanim. Apr 29; 64 (6): 360-1, Copyright (2017), con permiso de Elsevier).
Considerando lo anterior, las hemorragias de origen obstétrico rápidamente pueden transformarse en hemorragias masivas, teniendo que estar preparados para su manejo, ya que, con ese nivel de flujo sanguíneo, puede existir sangrados de hasta 1 l·min-1, lo que equivale a sangrar una volemia en menos de cinco minutos.
-
Monitorización fetal
La opinión del Comité del Colegio Americano de Obstetricia y Ginecología sobre cirugía no obstétrica en el embarazo afirma que: “aunque no hay datos para apoyar recomendaciones específicas en cuan
to a la cirugía no obstétrica y la anestesia durante el embarazo, es importante que los médicos obtengan una opinión obstétrica antes de realizar una cirugía no obstétrica. La decisión de utilizar monitorización fetal debe ser individualizada y basada en la edad gestacional, tipo de cirugía y recursos disponibles”. En términos generales, no es necesario monitorización continua antes de las 22-24 semanas, sin embargo, posteriormente es cada vez más relevante. El monitoreo de la frecuencia cardíaca fetal podría ser útil para identificar las condiciones intraoperatorias que conducen a deterioro del flujo sanguíneo uteroplacentario y la oxigenación fetal. La frecuencia cardiaca fetal normal es de 120 a 160 latidos·min-1. Si cae a 80 latidos·min-1, el gasto cardiaco se reduce significativamente y a 60 latidos·min-1, el feto está en peligro[11].
-
Condiciones que obligan a una cirugía de urgencia: sufrimiento fetal
Sufrimiento fetal es un término muy usado, pero vagamente definido. Corresponde a una asfixia fetal progresiva que, de no ser corregida, resultará en la descompensación de las respuestas fisiológicas produciendo daño permanente al sistema nervioso central, daño a otros órganos y finalmente la muerte.
Como definición operacional se puede decir que la asfixia fetal es la condición resultante de una falla en el intercambio gaseoso, cuyo biomarcador es la acidosis mixta asociada a hipoxemia. El diagnóstico clínico del cuadro en el recién nacido se establece según los criterios de la Tabla 1.
La detección de lo anterior durante el trabajo de parto estará dada por cambios característicos en el registro cardíaco fetal, que no se modifiquen en el tiempo, meconio en el líquido amniótico y la medición de pH sanguíneo fetal durante el trabajo de parto. Cabe señalar que, frente a una bradicardia fetal, el pH disminuye en 0,011 unidades por minuto (intervalo de confianza 95% 0,003-0,020)[13].
El tratamiento dependerá de la gravedad del cuadro. Inicialmente se puede intentar una reanimación intrauterina y en el caso de no ser efectiva se debe proceder a la extracción del feto por la vía más expedita en el momento.
Para la reanimación intrauterina se procede a realizar lateralización materna para evitar o aliviar la posible compresión aorto-cava o de cordón umbilical; administración de oxígeno a la madre para aumentar el aporte de oxígeno al feto; prevención o tratamiento de hipotensión arterial materna; suspensión de oxitócicos y considerar el uso de tocolíticos. Si con estas maniobras no se logra revertir el problema, se debe interrumpir el embarazo en forma urgente, para lo que se dispone de 30 min desde la decisión de operar hasta el nacimiento, como ha sido planteado en las últimas recomendaciones de la Sociedad Alemana de Obstetricia y Ginecología[14]. Sobre este lapso de tiempo, el bienestar fetal se deteriorará rápidamente.
-
Anestesia para cesárea de emergencia por sufrimiento fetal agudo
Como se trata de una situación de emergencia, se debe pedir ayuda para agilizar y optimizar los tiempos anestésicos, quirúrgicos y otros.
La monitorización será la estándar para cualquier procedimiento quirúrgico, es decir, presión arterial no invasiva, electrocardiografía, oximetría de pulso y capnografía en caso del uso de anestesia general. Se debe asegurar una vía venosa de grueso calibre previo al inicio de la anestesia.
La técnica anestésica a utilizar debe decidirse considerando factores de riesgo anestésicos, obstétricos y fetales. La Sociedad Americana de Anestesiología recomienda seleccionar anestesia neuroaxial por sobre anestesia general para la mayoría de las cesáreas, debido a los beneficios maternos que la anestesia neuroaxial otorga y los riesgos asociados a la anestesia general, como dificultad de intubación traqueal, mayor infección en sitio quirúrgico y mayor riesgo de enfermedad tromboembólica.
En la Tabla 2 se describe un resumen del protocolo de manejo anestésico en una situación de urgencia obstétrica. En las siguientes secciones se discutirá el manejo específico de anestesia espinal y general para cesárea de urgencia.
-
Anestesia espinal para operación cesárea de urgencia
La interrupción del embarazo por cesárea es clasificada en 4 categorías según la urgencia de la cesárea: Categoría 1: riesgo vital materno o fetal inmediato; Categoría 2: compromiso materno o fetal que no implica riesgo vital inmediato; Categoría 3: necesidad de interrupción temprana sin compromiso materno o fetal y Categoría 4: interrupción cuando el equipo tratante y la madre lo estimen conveniente. La anestesia espinal ha sido el estándar de manejo en las cesáreas de categorías 2, 3 y 4. En las cesáreas de emergencia de categoría 1 se estima que deberían transcurrir menos de 30 min entre la decisión de la interrupción y el nacimiento, tiempo que debe incluir la decisión de la interrupción, traslado de la paciente al pabellón, monitorización, anestesia, preparación del campo e inicio de cirugía. Tradicionalmente, se han manejado con anestesia general e inducción en secuencia rápida, pues sería más veloz que la realización de anestesia neuroaxial.
| Tabla 1. Criterios diagnósticos de asfixia neonatal[12] |
| 1. Acidosis metabólica o mixta grave (pH < 7,0) en muestra de sangre de arteria umbilical |
| 2. Persistencia de puntaje de Apgar menor a 3 por más de 5 min |
| 3. Presencia de síntomas neurológicos como convulsiones, hipotonía o coma |
| 4. Presencia de compromiso multiorgánico |
Kinsella y cols., introdujeron el concepto de la “Anestesia Espinal en Secuencia Rápida” (AESR) como alternativa de manejo anestésico en pacientes que requieren cesáreas de categoría 1[15]. El objetivo de esta aproximación es minimizar el tiempo de realización de una técnica neuroaxial y evitar los riesgos asociados a la anestesia general, en particular al manejo de la vía aérea. Los elementos de la AESR incluyen:
1) Inserción de aguja espinal con técnica no touch. Pincelar solo una vez con clorhexidina y luego puncionar.
2) Simplificación de la combinación de drogas utilizadas: utilizar opioides o aumentar la dosis de bupivacaína hiperbárica.
3) No es necesario infiltrar la piel con anestesia local. 4) Limitar el tiempo y número de intentos a realizar.
En general, limitarse a un intento y una corrección si se estima que esta asegurará el éxito de la punción. Sino se debe proceder a un plan alternativo.
5) Inicio de la cirugía antes de que se establezca el bloqueo definitivo. Es decir, con un nivel T10 o superior.
6) Tener todo preparado para una inducción de anestesia general en la eventualidad de falla de la técnica espinal.
Otros factores que pueden ayudar a mejorar los tiempos de intervención son seleccionar al anestesiólogo de mayor experiencia para la punción, el cual debe prepararse para el procedimiento mientras la paciente está siendo trasladada a pabellón y encontrarse listo para ella apenas sea posicionada en la mesa quirúrgica. Se puede también trasladar a la paciente en decúbito lateral si se puncionará en esa posición, aunque también se ha descrito la punción
con la paciente sentada para facilitar la técnica. La posición a utilizar dependerá de la experiencia del operador y condición de la paciente. Finalmente, luego de administrar la anestesia espinal se puede posicionar la mesa quirúrgica en Trendelemburg leve para favorecer el ascenso del anestésico local si se utilizan drogas hiperbáricas.
En 2016, Bhattacharya y cols., compararon los tiempos de realización de anestesia general versus anestesia espinal con secuencia rápida en mujeres que requerían cesárea de urgencia categoría 1, encontrando que el tiempo de anestesia era menor en el grupo de anestesia espinal[16]. Esto demuestra que con un protocolo bien establecido de manejo, se puede realizar una anestesia espinal ante estas situaciones.
Por último, al momento de enfrentar una situación de cesárea de urgencia/emergencia recomendamos primero evaluar el estado materno y fetal, junto con considerar la experiencia propia. Si la condición materna o fetal lo permiten, sugerimos priorizar una técnica de anestesia regional.
-
Anestesia general para operación cesárea
Desde el punto de vista materno, el uso de anestesia general para la operación cesárea ha sido tema de debate por dos motivos: manejo de la vía aérea y respuesta hipertensiva a las maniobras dolorosas.
El manejo de la vía aérea puede ser un problema real en este grupo de pacientes dado por el aumento de peso seguido de edema generalizado y en particular de la vía aérea. Como la mortalidad materna por causa anestesiológica es mayor para el uso de anestesia general que para su contraparte regional[17],[18], debiera favorecerse el uso de anestesia regional dentro de lo posible. Un riesgo omnipresente asociado a esta técnica es que la paciente presente vómitos
| Tabla 2. Recomendaciones para la operación cesárea de urgencia frente a un sufrimiento fetal agudo |
| 1. Un intento de anestesia subaracnoídea por el anestesiólogo de mayor experiencia presente en el pabellón: Aguja punta cónica, para administrar bupivacaína 9 a 12 mg asociado a fentanyl 20 ug |
| 2. Mientras se realiza el intento de anestesia subaracnoídea, un ayudante carga drogas para una anestesia general: Un hipnótico (propofol o tiopental), succinilcolina, atropina, lidocaína y fentanyl o remifentanil |
| 3. Si falla la punción subaracnoídea, se induce la anestesia general con técnica de inducción de secuencia rápida. Una vez dormida la paciente, se debe iniciar la cirugía y extraer al feto lo antes posible. La intubación es con un tubo orotraqueal N° 6,0, 6,5 o 7,0 |
| 4. Se conecta a ventilación mecánica y se aportan gases halogenados en concentración de 1 concentración alveolar mínima (CAM) o menor |
| 5. Uso de una benzodiacepina para prevenir recuerdo intraoperatorio (awareness) |
| 6. Tratamiento específico de la condición desencadenante del cuadro asfíctico si corresponde (sangrado, embolia, etc.) |
y éstos sean aspirados, produciendo el síndrome de Mendelson, con la consiguiente morbilidad y riesgo de muerte[19].
El riesgo de muerte materna por causa anestesiológica ha ido disminuyendo en el tiempo gracias a la implementación de medidas tales como: reconocimiento de la necesidad de contar con un anestesiólogo entrenado; implementación de políticas de ayuno para pacientes en trabajo de parto; técnicas de inducción anestésica de secuencia rápida; monitorización apropiada de oxigenación sanguínea (oximetría de pulso) y de dióxido de carbono espirado (capnógrafo) y preferencia en el uso de anestesia regional sobre la general[19].
Con respecto a la respuesta hipertensiva a las maniobras de manipulación de la vía aérea, antiguos trabajos considerados clásicos demostraban una gran alza tensional en momentos críticos, tales como la laringoscopia, la intubación y la extubación traqueal[20]. Sin embargo, las drogas utilizadas en la anestesia no fueron más que tiopental y óxido nitroso[20]. El principal problema de esa técnica es el consiguiente riesgo de hemorragia intracraneana, en especial en el contexto de los trastornos hipertensivos del embarazo, primera causa de muerte materna directa[9]. Diferente es la situación si se utilizan drogas de alta potencia analgésica y de corta duración como el remifentanil. Con esta última se ha reportado un muy buen control de las respuestas hipertensivas[21] y con mínimos efectos en el recién nacido[22]. Existen, además, otras drogas para atenuar la respuesta hipertensiva, tales como betabloqueadores y vasodilatadores, con efectividad variable[23]. La elección de la técnica anestésica será un balance entre riesgos y beneficios.
Las principales indicaciones de anestesia general en la operación cesárea son la contraindicación o el rechazo por parte de la paciente de la anestesia regional. Está también indicada en aquellos casos de fracasos de la anestesia regional y en emergencias obstétricas como el desprendimiento de placenta o la rotura uterina en que no hay tiempo para realizar una técnica regional.
La anestesia general debe ser balanceada, teniendo en cuenta que, además de la madre, existe el feto. Por esto, las dosis de anestésicos que se usen deben ser las mínimas efectivas[24],[25]. Es imperativo hacer respirar previamente a la paciente, oxígeno 100%, durante dos a tres minutos para elevar el contenido de oxígeno arterial y denitrogenar los pulmones[26].
La inducción se puede hacer con un opiáceo que atenuará la respuesta a la laringoscopía e intubación traqueal y concomitantemente se agrega cualquier hipnótico de rápido inicio de acción, tal como propofol (2 mg∙kg-1) o tiopental (2-4 mg∙kg-1) endovenosos administrados rápidamente y, en lo posible, al comenzar una contracción uterina[27], para así disminuir al máximo el paso del anestésico al feto. Es muy importante asegurar una buena analgesia frente a la intubación traqueal ya que es en este momento donde hay mayor riesgo materno a presentar un alza de presión arterial que pueda derivar en una complicación mayor. Cabe destacar que es importante informar al equipo de Neonatología sobre las drogas utilizadas en la inducción, en particular los opioides.
Realizada la inducción anestésica, se administra un relajante muscular (succinilcolina, 1-2 mg∙kg-1), haciendo presión sobre el cricoides (maniobra de Sellick), para ocluir el esófago y disminuir el riesgo de regurgitación. Si bien esta maniobra no ha demostrado ser inferior al placebo en cuanto a complicaciones pulmonares en adultos sanos sometidos a intubación traqueal de urgencia[28], su aplicación es suficientemente inocua como para utilizarla en poblaciones de riesgo como la embarazada, obteniendo un potencial beneficio, sin dañar.
Luego se procede a la intubación endotraqueal. Inflando el manguito del tubo se sella la tráquea, con lo que se disminuye el riesgo aspiración pulmonar de contenido gástrico. En este momento el cirujano puede iniciar la cesárea.
Se debe mantener a la paciente con oxígeno 100% o con una mezcla de O2/aire u O2/N2O al 50% y gases halogenados en concentraciones menores a 1 concentración alveolar mínima (CAM), ya que sobre ese valor, tiene un potente efecto tocolítico. Es recomendable que el feto sea extraído rápidamente. El tiempo quirúrgico más importante es el que media entre la incisión del útero y el nacimiento (sección del cordón umbilical), que debe ser menor a tres minutos, pues en este período se producen las mayores alteraciones del flujo uteroplacentario[29]. Se debe tener en consideración la acción tocolítica de los agentes halogenados, con el objeto de evitar la inercia uterina. Inmediatamente después de extraído el feto y la placenta, se inicia la administración de oxitocina por vía endovenosa para obtener una adecuada retracción uterina. Como efecto colateral al uso de oxitocina por vía endovenosa se puede observar hipotensión arterial y taquicardia[30], por lo que, su uso debe ser juicioso y en forma de infusión continua por una bomba. La administración de grandes bolos de oxitocina ha sido reconocida como causal de isquemia miocárdica y de muerte materna[19],[31], por lo que debe evitarse.
Vale la pena resaltar que el requerimiento anestésico está disminuido para todos los anestésicos inhalatorios. Se produce una disminución en 20% a 30%, desde las 8va semana de gestación hasta las 48 h posparto[32]. Sin embargo, la eficacia anestésica indicada por la CAM refleja el efecto principalmente a nivel espinal y no en el cerebro, haciendo de la CAM un mal indicador de la profundidad hipnótica[33]. Para el caso de los hipnóticos (tanto tiopental como propofol), su dosis efectiva 95% para la pérdida de conciencia disminuye en 20% ya desde las 7 semanas de gestación[34],[35].
-
Hemorragia obstétrica
-
Definición
Es la hemorragia que resulta del sangrado del lecho placentario o como consecuencia del traumatismo al tracto genital durante el parto. Se escapa a esta definición la inserción velamentosa del cordón umbilical (vasa previa), que produce un sangrado fetal, a diferencia de los otros casos en que es materna (ruptura uterina, inercia uterina, inversión uterina y lesión del canal del parto) o mixta (desprendimiento prematuro de placenta normoinserta (DPPNI)).
Hemorragia obstétrica se define como la pérdida sanguínea en las primeras 24 h de 500 ml de sangre en caso de parto vaginal o 1.000 ml de sangre en caso de cesárea. Hemorragia obstétrica masiva, a su vez, está definida por la pérdida mayor a 2.500 ml de sangre, disminución > 4 g-dl de hemoglobina, la transfusión de > 5 unidades de glóbulos rojos o la presencia de coagulopatía clínica o de laboratorio. Su incidencia es de 1:6.000-1:1.650 nacimientos[36],[37]. Sin embargo, clínicamente las más funcionales son: Más de 1.000 ml con síntomas de hipovolemia, dentro de las primeras 24 h posparto[38], o bien, una pérdida de al menos 30% de la volemia. Esta última definición es posible valorarla con la “regla de los 30”, la que incluye: disminución en la presión arterial sistólica de 30%, aumento en la frecuencia cardiaca de 30%, frecuencia respiratoria mayor a 30-mirr1, hemoglobina o hematocrito que descienda más de 30% y débito urinario menor a 30 ml-hr1. De presentar estos parámetros, la paciente muy probablemente ha perdido 30% de su volemia y estará en shock hipovolémico moderado, acercándose a uno grave.
La hemorragia posparto habitualmente es secundaria a cuatro grandes grupos de problemas, que pueden ser recordados con la nemotecnia “4-T”: tono; tejido; trauma y trastorno de coagulación.
El grupo más frecuente y que abarca cerca del 70% de los casos son los trastornos en el tono uterino después del nacimiento. Normalmente, el útero se retrae una vez salido el feto, la placenta y las membranas ovulares. Sin embargo, en ocasiones esto no ocurre, incluso después de la administración de oxitócicos, constituyéndose el cuadro de inercia uterina. La inercia puede tratarse médicamente al inicio con masaje uterino vigoroso, oxitócicos parenterales (infusión de 20-30 unidades en solución salina), metilergonovina intramuscular (0,5-1 mg), prostaglandinas F2 alfa oral, transrectal o paracervical, en forma secuencial. Si estas medidas no son efectivas, se debe proceder al tratamiento quirúrgico que incluye legrado uterino para descartar restos ovulares en la cavidad uterina, taponamiento uterino, ligadura de arterias ilíacas internas y, finalmente, histerectomía obstétrica.
La segunda etiología es la presencia de restos de tejidos que queden en el útero, ya sea placenta o membranas ovulares. Habitualmente, luego de una revisión instrumental de la cavidad uterina, el sangrado cede.
La tercera es el trauma, ya sea del útero o del canal del parto. Una adecuada revisión detallada de la vagina y periné es fundamental para descartar esta etiología.
Finalmente, los trastornos de coagulación pueden ser desencadenantes de un sangrado importante, sin embargo, son la causa menos frecuente.
En la paciente embarazada es muy relevante poner énfasis en productos que tengan mayor contenido de fibrinógeno (factor I). Este factor es el más abundante y a su vez más susceptible de disminuir por dilución durante la reanimación con fluidos. A su vez, en un sangrado masivo, es el primero en descender bajo niveles críticos. En el embarazo los niveles plasmáticos aumentan a 400-500 mg·dl-1 [39], por lo que valores considerados normales en la no embarazada, pueden ser muy bajos. En 2007, Charbit y cols. evaluaron si el descenso de fibrinógeno plasmático es un predictor temprano de gravedad de sangrado obstétrico. En dicho estudio determinaron que para niveles de fibrinógeno bajo 200 mg·dl-1 medido con el método tradicional de Clauss, tiene un valor predictivo positivo de 100% para hemorragia posparto grave[40]. Cabe destacar que en la embarazada se presentan dos cuadros clínicos únicos que pueden generar o bien contribuir a la hemorragia al generar además un estado hiperfibrinolítico: desprendimiento de placenta normoinserta y embolia de líquido amniótico.
-
Clínica
La forma de presentación de los casos graves generalmente es con shock hipovolémico, sin embargo, el desprendimiento prematuro de placenta normoinserta se puede acompañar de coagulación intravascular diseminada por el paso de tromboplastina tisular a través del lecho placentario a la circulación materna.
El cuadro de inercia uterina puede ser la primera manifestación de una embolia de líquido amniótico. A su vez, el cuadro hemorragíparo puede perpetuarse debido al uso de hemoderivados en grandes cantidades, hipotensión arterial prolongada, hipotermia y al cuadro de base.
-
Tratamiento
La reanimación se basa en el control de la vía aérea, aporte de volumen efectivo intravascular, optimización del transporte de oxígeno y uso de drogas vasoactivas, una vez normalizada la volemia de la paciente. El tratamiento es de soporte hasta que la fuente de sangrado esté controlada, que generalmente es el útero.
De todas las acciones, hay dos que no pueden desoírse: evitar la negación y el retraso en la implementación de las medidas. El flujo sanguíneo uterino en un embarazo de término es de 600-800 ml/min, por lo que un sangrado por un lapso de 6-8 min pudiera comprometer toda la volemia de la paciente.
En la reanimación de un sangrado es reconocido que, de no mediar una pronta corrección, se arriesga caer en la tríada mortal de: acidosis, hipotermia y coagulopatía[41]. La hipotermia (temperatura menor a 35 °C) disminuye reacciones enzimáticas: disminuye la producción de trombina y la síntesis de fibrinógeno. Además, reduce la agregación y activación plaquetaria. La acidosis inhibe la actividad enzimática sobre fosfolípidos, disminuye la afinidad por el calcio, produce alteraciones en la forma de las plaquetas y aumenta la degradación del fibrinógeno. Así, es necesario instaurar una “reanimación de control de daños” cuanto antes. Esto implica el control rápido de la hemorragia (reanimación hemostática) [42] mediante la administración temprana de productos sanguíneos en una relación equilibrada (1: 1: 1) para unidades de plasma fresco congelado, plaquetas y glóbulos rojos (que es la aproximación más cercana a sangre entera reconstituida), prevención y corrección inmediata de la coagulopatía y uso racional de fluidos (limitar el uso de cristaloides a menos de 3 lt en las primeras 6 h)[43]. Así, los objetivos son tratar la hipovolemia, tratar la coagulopatía aguda del trauma, preservar la capacidad de transporte de oxígeno, reparar el endotelio y prevenir la coagulopatía dilucional.
Frente a una hemorragia obstétrica, las herramientas con las que se cuenta son el uso de agentes uterotónicos, el taponamiento de la cavidad uterina (balón de Bakri o similar), procedimientos de radiología intervencional (embolización o uso de balones en arterias iliacas internas o aórtico infrarrenal), maniobras quirúrgicas como la sutura de B-Lynch, ligadura de arterias e histerectomía. Lo anterior va frecuentemente acompañado de transfusión de hemocomponentes, uso de agentes antifibrinolíticos[44] y técnicas de ahorro de sangre como, por ejemplo, el uso de Cell Saver[45].
-
Espectro de placenta acreta
Este grupo de anomalías corresponde a una implantación placentaria anormal, donde las vellosidades trofoblásticas atraviesan la decidua endometrial. La gravedad del cuadro dependerá de la magnitud de la invasión. La nueva clasificación las agrupa en: grado 1 o placenta anormalmente adherida (placenta adherenta or creta) si compromete la decidua endometrial y se adhiere directamente al miometrio; grado 2 o placenta anormalmente invasiva (increta) si invade el miometrio o incluso el lumen de vasculatura uterina profunda (arterias radiales o arcuatas), y grado 3 o placenta anormalmente invasiva (percreta), con grado 3a si se limita a la serosa uterina; 3b si invade vejiga y; 3c si invade tejidos pélvicos u órganos[46], (Figura 2).
-
Epidemiología
La incidencia de acretismo placentario está estrechamente relacionada a la presencia de placenta previa, de hecho, 75% de las pacientes que presentan acretismo placentario tienen este antecedente[47]. A su vez, la incidencia de placenta previa tiene una estrecha relación con el número de cesáreas anteriores (Tabla 3).
Así, los factores de riesgo para acretismo placentario son la presencia de placenta previa, inserción placentaria sobre una cicatriz de cesárea o sobre decidua atrófica secundaria a legrados reiterados o traumáticos.
Al asociar el número de cesáreas anteriores con el hallazgo de placenta previa se puede ver un aumento muy importante en el riesgo de acretismo placentario (Tabla 4). Estas cifras demuestran lo importante que resulta la evaluación preoperatoria, especialmente en pacientes con factores de riesgo para acretismo placentario.
-
Diagnóstico
El diagnóstico debe sospecharse en el preoperatorio sobre la base de antecedentes, el uso de ecotomografía doppler transvaginal para la placenta acreta y resonancia nuclear magnética para detectar placenta percreta[49]. Sin embargo, es inusual el diagnóstico preoperatorio a menos que se busquen dirigidamente los signos ecotomográficos en pacientes con factores de riesgo y en especial en aquellas que presenten placenta previa. De hecho, más de 80% de los casos con criterios ecotomográficos de acretismo placentario terminan en histerectomía obstétrica[47].
Si el diagnóstico no se ha realizado preoperatoriamente, habitualmente se sospecha en el intraoperatorio cuando hay dificultad en separar la placenta del útero. Se confirma el diagnóstico en la laparotomía.
-
Tratamiento
El tratamiento es interdisciplinario, donde deben converger anestesiólogos, obstetras, ginecólogos oncólogos, urólogos, cirujanos vasculares, radiólogos, neonatólogos e intensivistas.
| Tabla 3. Relación entre número de cesáreas anteriores y placenta previa | |
| N° cesáreas | Placenta previa (%) |
| 1 | 0,65 |
| 2 | 1,8 |
| 3 | 3 |
| 4 | 10 |
El diagnóstico preoperatorio es imprescindible para la adecuada preparación de equipo. El sangrado intraoperatorio en estos casos es habitualmente de 3 a 5 litros[47], por lo que 90% de las pacientes van a ser transfundidas. Así, se debe disponer en pabellón de 8 a 10 unidades de glóbulos rojos y en el banco de sangre, otra cantidad similar, además de otros hemoderivados como crioprecipitados, plasma fresco congelado y plaquetas. La evidencia actual apunta a que la reposición de glóbulos rojos debe ir de la mano de plasma y plaquetas en proporción cercana a 1:1:1, con lo que mejora el desenlace materno en estos casos[50].
| Tabla 4. Relación entre el hallazgo de placenta previa asociado al número de cesáreas previas y el riesgo de presentar acretismo placentario[48] | |
| Placenta previa + N° de cesáreas previas | Acretismo |
| 1 | 25% |
| 2 | 50% |
| 4 | 67% |
A su vez, la hemorragia obstétrica grave se asocia frecuentemente a hipofibrinogenemia. Cuando al inicio de una hemorragia posparto se asocia a fibrinogenemia menor a 200 mg·dl-1 tiene un valor predictivo de 100% de hemorragia grave[40], por lo que, las guías de la Sociedad Americana de Anestesiólogos han especificado que los déficits de fibrinógeno deben ser tratados precozmente en estos casos[51], en base a crioprecipitado en dosis de 1 unidad por cada 10 kg o liofilizado de fibrinógeno en dosis de 1-3 mg y controlando según fibrinogenemia y exámenes viscoelásticos de la coagulación[52].
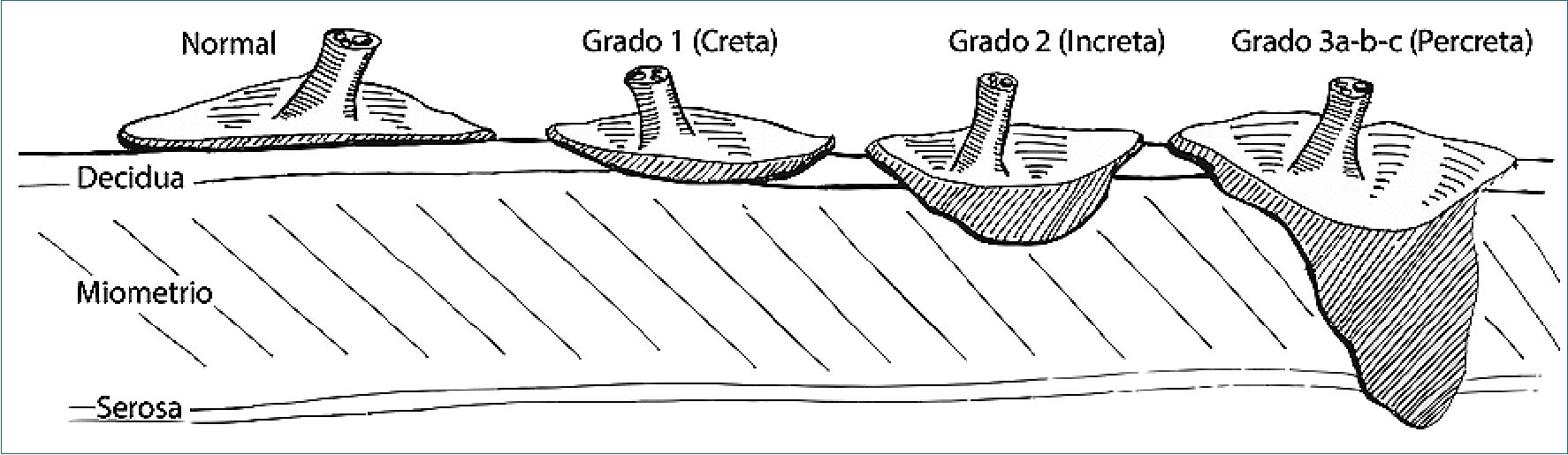
Figura 2. Tipos de inserción placentaria. De izquierda a derecha: la placenta normal no atraviesa la decidua basal; la placenta creta atraviesa la decidua basal y se adhiere al miometrio, sin invadirlo; la placenta anormalmente invasiva increta invade el miometrio, sin atravesarlo; la percreta atraviesa el miometrio, la serosa (3a) y pudiese comprometer vejiga (3b) u órganos vecinos (3c)[46].
Como prevención al sangrado intraoperatorio puede utilizarse embolización selectiva de las arterias uterinas, arterias hipogástricas o incluso la aorta infrarrenal con balones inflables intraoperatorios, maniobra que podría disminuir el riesgo de histerectomía y la necesidad de menos uso de hemoderivados, comparado con las otras modalidades de oclusión[53]. De no contar con estos balones, durante la cirugía se debe tener un contacto permanente con el cirujano, pidiéndole en casos de sangrados masivos, que ocluya la aorta para tener tiempo de reponer el volumen perdido.
Una buena opción en casos de sangrados masivos es el uso de técnicas ahorradoras de sangre. Una alternativa es el empleo de Cell Saver. Aún no es de uso generalizado en obstetricia por el temor a la embolia de líquido amniótico, a la aloinmunización materna y el costo. Sin embargo, el uso de filtros reductores de leucocitos disminuye considerablemente el conteo de glóbulos blancos en la sangre recuperada, involucrados en el potencial proceso de aloinmunización y una eventual reacción transfusional febril no hemolítica que se busca evitar. Los filtros de reducción de leucocitos actuales (de “tercera generación”) pueden lograr una reducción de cuatro unidades logarítmicas, dejando recuentos leucocitarios residuales por debajo de 5 •106 y generalmente por debajo de 1 •106 [54]. Recientemente, se han reportado 1.498 casos en que se ha utilizado Cell Saver en pacientes obstétricas sin haber generado embolia de líquido amniótico, lo que es una señal positiva a favor de su uso en esta población[55].
Las vías venosas deben ser periféricas y de grueso calibre (teflón #16, #14 o un Rapid Infusion catheter (RIC) que es 8,5F y 6,5 cm de largo), que permitan un aporte de volumen en forma rápida. Es recomendable disponer de apuradores de suero con lo que se facilita el aporte de volumen. Así mismo, el uso de calentadores de sueros (Hotline® o similar) es una estrategia deseable para evitar la hipotermia, que puede agravar el cuadro. Finalmente, el uso de mantas de aire convectivo favorece la mantención de la normotermia.
La administración de agentes antifibrinolíticos (ácido tranexámico) en la hemorragia obstétrica ha recibido atención reciente. Se ha visto que el ácido tranexámico debe administrarse tan pronto como sea posible en hemorragia posparto independientemente de la causa, o después de cualquier hemorragia asociada a inestabilidad hemodinámica[44]. Especial atención debiesen tener situaciones en que se activa la fibrinólisis, como en el desprendimiento prematuro de placenta normoinserta o la embolia de líquido amniótico (ver abajo). Múltiples estudios han detectado que la administración de ácido tranexámico después de 3 h de iniciado el sangrado no aporta mayor beneficio en términos de control de la fibrinólisis[56]. Es posible que el efecto sea secundario al fenómeno de “apagamiento de la fibrinólisis” (fibrinolysis shutdown) que ocurre con una temporalidad similar a lo descrito[57].
A la monitorización estándar, que incluye el control de la temperatura, se agregará presión arterial invasiva y eventualmente un catéter venoso central para administración de drogas vasoactivas. Rara vez será necesario utilizar un catéter de arteria pulmonar, pero de ser así, pudiera ayudar en la evaluación hemodinámica y de función cardiovascular. Para la reposición de volumen y hemoderivados, una buena estrategia es guiar su administración con exámenes de laboratorio tradicionales (hemoglobina, plaquetas, tiempo de tromboplastina y protrombina), además de pruebas viscoelásticas como la tromboelastografía y el ROTEM[52].
En general, se utiliza una técnica combinada espinal-epidural para pacientes con placenta creta o increta. Sin embargo, en algunos casos, se planea la conversión a anestesia general después del parto si se necesita una histerectomía. Para pacientes con placenta percreta, se puede colocar un catéter epidural lumbar antes de la operación para proporcionar analgesia poscesárea, mientras que se usa anestesia general para realizar los procedimientos quirúrgicos[58]. Esta diferenciación está dada porque es más fácil el manejo hemodinámico de la paciente en shock hipovolémico con la técnica anestésica general que con una neuroaxial. Más aún, se asegura la vía aérea a priori y no cuando la paciente pierde conciencia por hipotensión arterial profunda secundaria a un sangrado agudo profuso. Sin embargo, pudiese ser una alternativa el uso de anestesia regional, aunque evaluando caso a caso su factibilidad. Algunas series han reportado el uso de anestesia regional en 95% de sus casos, necesitando en 45% de ellos, conversión a anestesia general[59].
-
Embolia de líquido amniótico
-
Definición
Es una situación devastadora, propia del embarazo, originalmente descrita por Steiner y Lushbaugh en 1941 como un síndrome de shock periparto súbito, caracterizado por edema pulmonar agudo.
-
Epidemiología
Tiene una incidencia variable de aproximadamente 1,9-6,1/100.000 nacidos vivos[60]. Esta incidencia es poco clara, ya que es un diagnóstico de descarte y sólo corroborado en los casos fatales por autopsia. Es la causa del 12% de las muertes maternas. Tiene una mortalidad cercana al 80%, donde la mitad de las pacientes muere en la primera hora.
-
Etiología
El cuadro se produce por el paso de líquido amniótico a la circulación sistémica materna. Sin embargo, ni el líquido per se ni la cantidad de material particulado parecieran desencadenar el problema, sino que se requeriría de algunas sustancias especiales, entre las que se incluyen: metabolitos del ácido araquidónico (leucotrienos) y algunos agentes presores termoestables del meconio.
Todos los factores de riesgo clásicamente descritos han sido refutados como tal con estudios debidamente diseñados. Hasta el momento el único factor claramente predisponente es el embarazo[61].
-
Patogenia
Es una respuesta bifásica, con una etapa temprana en que se produce un vasoespasmo del territorio pulmonar, que es transitorio (menos de 30 min), pero intenso, con hipertensión pulmonar aguda, lo que desencadena una disfunción ventricular derecha[62], que puede ser fatal o bien producir alteraciones en la relación ventilación/perfusión por hipodébito cardíaco con la consiguiente hipoxemia y, finalmente, muerte.
La etapa tardía incluye disfunción ventricular izquierda de causa no aclarada hasta el momento, pero muy probablemente de carácter hipóxico, asociada a edema pulmonar agudo. Por otra parte, se desencadena una alteración de coagulación en 40% de los casos, de tipo multifactorial, entre los que destacan una coagulación intravascular diseminada secundaria a procoagulantes como el activador tisular del factor X, sustancias procoagulantes liberadas por el trofoblasto circulante, leucotrienos y otros metabolitos del ácido araquidónico con propiedades procoagulantes y elementos humorales relacionados al daño tisular.
Otro de los factores involucrados son hipotonía uterina por bajo débito e hipoperfusión uterina, junto a factores depresores miometriales circulantes y coagulopatía de consumo.
Cuando se toma en cuenta el espectro de manifestaciones clínicas y de laboratorio del síndrome clásico de embolia de líquido amniótico, son sorprendentes las similitudes entre la embolia de líquido amniótico y enfermedades como el shock anafiláctico o el shock mediado por endotoxinas. Todos parecen implicar una respuesta anormal del huésped a la exposición a diversos antígenos externos, con la posterior liberación de mediadores endógenos que provocan la fisiopatología del síndrome clínico específico[60].
-
Clínica
La presentación clásica de la embolia de líquido amniótico es la tríada general de: hipoxia, hipotensión arterial y coagulopatía, lo que traduce una falla respiratoria aguda y colapso cardiovascular. Sin embargo, esta tríada no es patognomónica ni se presenta en todos los casos. Puede verse, además: calofríos, sudoración, ansiedad, tos, convulsiones y sangrados. Toda esta sintomatología puede ocurrir durante el primer y segundo trimestre (abortos inducidos), durante el trabajo de parto y parto e incluso en el período posparto. Hay algunos reportes de presentación del cuadro luego de trauma abdominal durante el embarazo.
Como diagnóstico diferencial se debe pensar en otras situaciones que lleven a un cuadro de colapso cardiovascular materno. Entre ellas se encuentran complicaciones obstétricas (desprendimiento prematuro de placenta normoinserta y eclampsia), complicaciones no obstétricas (embolias pulmonares tromboembólicas o aéreas, shock séptico, anafilaxia o infarto miocárdico) o bien derivadas de alguna intervención médica (anestesia espinal total o intoxicación por anestésicos locales).
Este síndrome incluye una serie de signos clínicos, síntomas y cambios hemodinámicos centrales reconocibles, similares a aquellos observados en muchos casos de anafilaxia o un síndrome de respuesta inflamatoria sistémica (SRIS) y shock séptico, lo cual sugiere la participación de una activación o liberación de mediadores proinflamatorios y procoagulantes endógenos similares como respuesta a sustancias antigénicas externas[60], en este caso, derivados del trofoblasto.
En las mujeres que sufren paro cardiaco, se ha descrito cualquiera de los tres patrones letales clásicos de disritmia (fibrilación ventricular, asistolia y actividad eléctrica sin pulso), lo que probablemente refleja diferentes mecanismos de paro cardiaco, incluyendo hipoxia, depresión miocárdica directa y exsanguinación por coagulopatía grave[60].
-
Diagnóstico
El diagnóstico es fundamentalmente clínico y de exclusión[60]. Se debe tener un alto grado de sospecha frente a un caso de colapso cardiocirculatorio con insuficiencia respiratoria. En 1988 se establecieron criterios diagnósticos para este cuadro, los que se pueden ver en la Tabla 5.
-
Laboratorio
Todos los exámenes que se realizan son poco sensibles e inespecíficos. La detección de células escamosas y otros residuos de presunto origen fetal en el lecho arterial pulmonar de las mujeres embarazadas ya no se considera como diagnóstico de embolia de líquido amniótico, ya que frecuentemente están presentes en embarazadas sanas, que no han presentado el cuadro clínico[60].
Entre los exámenes más útiles destaca la ecocardiografía transesofágica (en el caso que la paciente se encuentre bajo anestesia general) o transtorácica (en caso de anestesia general o regional). En examen se puede encontrar: falla ventricular derecha aguda, desviación septal de derecha a izquierda, insuficiencia tricuspídea y presiones derechas suprasistémicas[62]. El ventrículo izquierdo se puede ver pequeño y comprimido en una primera etapa, sin embargo, en etapas tardías aparecen signos de insuficiencia cardiaca izquierda. Además, puede evidenciarse derrame pericárdico[62].
-
Tratamiento
El tratamiento es básicamente de soporte y se basa en la fisiopatología observable[60]. La reanimación inicial es la estándar para las situaciones graves y devastadoras como ésta.
Una vez instauradas las medidas básicas, es de gran utilidad el uso de un catéter de arteria pulmonar para guiar el tratamiento con volumen, la toma de muestras para exámenes (gases venosos mixtos) y como guía en el manejo de inótropos. De ellos, el más usado es la norepinefrina, que se dosifica según la respuesta hemodinámica.
Se suma un problema extra al manejo antes mencionado: el feto. Se debe interrumpir el embarazo lo antes posible. Su compromiso va a depender del tiempo transcurrido desde la embolia y del grado de éxito en la reanimación materna. La evidencia disponible apoya que el parto inmediato mejora la probabilidad de un buen resultado en el recién nacido[60].
Como hay 40% de pacientes que hacen algún grado de coagulopatía, se debe corregir esta alteración por medio de hemoderivados, entre los que se incluyen plaquetas (1 unidad aumenta el recuento plaquetario entre 5.000 y 10.000 plaq·ml-1), plasma fresco congelado (1 unidad por cada 10 kg), crioprecipitado (1 unidad por cada 10 kg) y glóbulos rojos.
Debido a que la coagulopatía es frecuente, el uso de anestesia neuraxial para cualquier procedimiento en estas pacientes tiene una contraindicación relativa, por el riesgo de producir un hematoma raquimedular.
Existen algunos reportes anecdóticos sobre el uso de bypass pulmonar con un oxigenador de membrana (ECMO), asociado a balón de contra pulsación aórtica en pacientes evolucionando con shock secundario a la embolía de líquido amniótico, con buenos resultados[63]. Otros han reportado casos de supervivencia asociada con hemodiafiltración continua, derivación cardiopulmonar, uso de dispositivo de asistencia ventricular derecha y óxido nítrico, sin embargo, tales técnicas deben ser consideradas actualmente como no comprobadas y experimentales[60].
-
Reanimación cardiopulmonar en la embarazada
El manejo del paro cardiorrespiratorio (PCR) en una paciente embarazada requiere de trabajo en equipo, con adecuada comunicación entre los participantes y el actuar de profesionales de la salud de múltiples especialidades. La reanimación debe ser liderada por un profesional que conozca las particularidades del manejo del PCR en embarazadas. Es decir, los cambios fisiológicos propios del embarazo como las alteraciones circulatorias y síndrome de compresión aorto-cava, cambios generados en vía aérea y manejo de ésta. Se debe conocer que el bienestar materno es el mejor predictor de bienestar fetal y anticipar la necesidad de cesárea perimortem.
| Tabla 5. Criterios diagnósticos para embolia de líquido amniótico[61] |
| 1. Hipotensión arterial aguda o paro cardíaco |
| 2. Hipoxia aguda* |
| 3. Coagulopatía** |
| 4. Inicio de los síntomas mencionados durante el trabajo de parto, cesárea, legrado uterino o en los primeros 30 min posparto |
| 5. Ausencia de otro cuadro que explique los síntomas |
| *Disnea, cianosis o paro respiratorio; **Evidencia de laboratorio de consumo intravascular o fibrinolisis o hemorragia clínica grave en ausencia de otra causa. |
Al momento de diagnosticar este escenario, el primer paso es pedir ayuda o activar el código de emergencia correspondiente. Además, de pedir ayuda para el manejo de la reanimación, carro de paro y desfibrilador, uno de los primeros requisitos a hacer es solicitar la presencia del equipo de neonatología y llamar al equipo quirúrgico necesario para realizar un parto operatorio[64].
La secuencia de reanimación de la paciente no embarazada se mantiene en estas pacientes, es decir, compresiones toráxicas (C), manejo de la vía aérea (A) y ventilación (B), con énfasis en que la reanimación cardiopulmonar (RCP) comienza con las compresiones torácicas. Al igual que en otros pacientes, se debe comprimir 1/3 del diámetro anteroposterior del tórax o al menos 5 cm, permitir la expansión torácica entre compresiones, comprimir con una frecuencia de 100 a 120 por min y minimizar las interrupciones que aumenten los intervalos entre compresiones torácicas. En 2010 la Asociación Americana del Corazón (AHA por sus siglas en inglés) recomendó posicionar las manos del reanimador, 2-3 cm más hacia cefálico sobre el esternón, para compensar el desplazamiento cefálico de estructuras intratorácicas, por el útero grávido cercano al término[65]. Sin embargo, no hay evidencia que avale la efectividad de esa medida y actualmente no se recomienda, debiendo posicionar las manos de manera habitual[66]. La paciente debe posicionarse en decúbito supino, sobre una superficie rígida. Para que la reanimación sea más efectiva, se debe desplazar el útero de manera de reducir la compresión aorto-cava por el útero grávido y favorecer el retorno venoso. Idealmente esto se realiza por un segundo operador, que tracciona el útero hacia arriba y la izquierda desde el costado izquierdo de la paciente. Se ha descrito también la lateralización completa y el uso de cuña para lograr la desviación uterina, pero la AHA recomienda la tracción manual, ya que esta sería la técnica con menor interferencia en las compresiones torácicas y potencial manejo de la vía aérea[64].
Con respecto a la ventilación, la prioridad en estos escenarios es ventilar para mantener la oxigenación, sobrepasando los riesgos de aspiración de contenido gástrico si hay regurgitación o vómito. Como ya se mencionó, una paciente embarazada se considera estómago lleno desde las 12 semanas de gestación, por lo que se ha planteado el uso de la compresión cricoídea (maniobra de Sellick) para reducir el riesgo de aspiración de contenido gástrico. Sin embargo, ésta puede ser obviada si dificulta la ventilación o intubación traqueal. Se recomienda asegurar la vía aérea precozmente, idealmente por un operador experimentado. Antes de realizar la intubación traqueal se debe revisar disponibilidad como mínimo de laringoscopio, tubos orotraqueales 6,0 y 6,5 y aspiración operativa. En caso de intubación fallida, la AHA recomienda considerar el uso de dispositivos supraglóticos (como, por ejemplo: máscara laríngea) para mantener la ventilación[64].
La instalación de accesos vasculares debe realizarse sobre el nivel del diafragma para evitar los efectos potencialmente deletéreos de la compresión aortocava, que podría retrasar la llegada de fluidos y drogas al corazón y resto de la circulación[64],[67].
Con respecto al algoritmo de reanimación avanzada (Tabla 6), este es el mismo que se realiza en la reanimación de adultos. Las drogas y dosis a utilizar son las mismas, al igual que la potencia utilizada al desfibrilar. Sobre la desfibrilación, se recomienda realizarla lo antes posible en pacientes con ritmo desfibrilable. Si la paciente tiene monitores fetales deberían ser retirados previo a la descarga para evitar quemaduras, pero el retirar los monitores no debería retrasar las compresiones ni la ventilación.
Las guías actuales recomiendan un parto expedito en el caso de colapso cardiovascular materno sin respuesta a RCP. Cuando no es posible realizar un parto vaginal de forma inmediata se debería proceder a una cesárea perimortem para aumentar las posibilidades de sobrevida materna y fetal[64]. Ésta posiblemente mejora el desenlace materno al reducir la obstrucción al retorno venoso y mejora del gasto cardíaco, junto con una disminución del consumo de oxígeno y mejoría de la mecánica pulmonar. Esta maniobra probablemente es beneficiosa cuando el fondo uterino está al menos a la altura del ombligo, independiente de la edad gestacional, lo que puede condicionar la compresión de grandes vasos abdominales e interferir con el retorno venoso y con la posibilidad de recuperar la circulación espontánea[65].
Al momento del inicio de la reanimación se debe estar planificando la interrupción del embarazo. La AHA recomienda extraer el feto dentro de los primeros 5 min desde que se diagnosticó el PCR o se iniciaron las maniobras de reanimación[64],[65]. Por lo tanto, la cesárea debería empezar a no más tardar 4 min del PCR. En la práctica, si nos encontramos frente a un evento presenciado, se debería solicitar un equipo quirúrgico inmediatamente e iniciar la asepsia de la piel de forma concomitante, de manera de encontrarse listos para operar a los 4 min. Por otro lado, si el evento no fue presenciado, se debería iniciar la cesárea perimortem de manera simultánea con la reanimación.
Es importante recalcar que el traslado de la paciente a pabellón quirúrgico no debe retrasar las medidas de reanimación. La recomendación es realizar la intervención operatoria en el lugar de diagnóstico del PCR. Se ha demostrado que el traslado de la paciente a pabellón retrasa la incisión uterina para la interrupción del embarazo, genera más retrasos y disminuye la eficiencia de las compresiones torácicas[68].
Al diagnosticar un PCR e iniciar las maniobras de reanimación debe, además, diagnosticarse la causa de éste, de manera de iniciar el manejo de situaciones reversibles. En la Tabla 5 se identifican las causas posibles de PCR en la paciente embarazada. Estas pueden recordarse con la nemotecnia A-B-C-D-E-F-G-H, donde A es anestesia, B: sangrado (por bleeding en inglés), C: causa cardiovascular, D: drogas, E: embolia, F: fiebre, G: causas generales (“6 Hs y 6 Ts” ver en la Tabla 6) de PCR y H: complicaciones hipertensivas. Las causas más comunes son de origen cardíaco, hemorrágico y trastornos embólicos. No se deben olvidar las sobredosis de fármacos: la oxitocina en bolos puede producir vasodilatación, hipotensión arterial y PCR. Por otro lado, si se sospecha una sobredosis de sulfato de magnesio como posible causa, es necesario administrar 1 g de cloruro de calcio o 3 g de gluconato de calcio endovenoso[65].
Deben seguirse las guías AHA sobre cuidados posparo para prevenir deterioro secundario de la condición materna, como por ejemplo, el uso de soporte circulatorio mecánico (oxigenación por membrana extracorpórea (ECMO) arteriovenoso o circulación extracorpórea (bypass cardiopulmonar)) como terapia puente si están disponibles[64],[67]. La corrección de etiologías reversibles del paro, junto con el parto, pueden conducir al retorno del gasto cardíaco y aumentar el riesgo de recuerdo intraoperatorio (awareness). Se sugiere trasladar a la madre a una unidad de cuidados intensivos lo antes posible luego de haber completado la cesárea perimortem y haber retornado a ritmo sinusal. Si no se realizó interrupción del embarazo se debe continuar con lateralización uterina y monitorización fetal, para guiar el manejo obstétrico. Se puede considerar el uso de hipotermia, con las mismas indicaciones que en una paciente no embarazada, sin embargo, se desconocen sus efectos en el feto y se debe considerar que puede empeorar la hemostasia y precipitar mayores pérdidas sanguíneas en el caso de un PCR de origen hemorrágico[64].
En conclusión, el manejo de un paro cardiorrespiratorio en la paciente embarazada tiene algunas diferencias con la RCP tradicional. Requiere de intervenciones interdisciplinarias y del conocimiento de la fisiología materna. El objetivo es la mantención del bienestar materno, para así asegurar el bienestar fetal. Por lo anterior, es recomendable tener una guía de manejo de PCR en los carros de paro de los servicios de maternidad y asegurarse que estos tengan los implementos básicos para la realización de un parto quirúrgico y la reanimación neonatal. En la Figura 3 se ejemplifica una lista de verificación a seguir para la reanimación en la embarazada.
| Tabla 6. Potenciales causas de PCR materno. Adaptada de Consenso de manejo de PCR en Embarazo de la Sociedad de Anestesia Obstétrica y Perinatología |
| A. Complicaciones anestésicas: anestesia espinal total, aspiración de contenido gástrico, depresión respiratoria, ISAL |
| B. Sangrado: coagulopatía, inercia uterina, malainserción placentaria, desprendimiento placentario, ruptura uterina, trauma, causa quirúrgica, reacción transfusional |
| C. Cardiovascular: cardiomiopatía, disección aórtica, arritmias |
| D. Drogas: anafilaxia, drogas ilícitas, error de drogas, sulfato de magnesio, opioides, insulina, sobredosis de oxitocina |
| E. Embolia: TEP, ELA, embolia aérea, grasa |
| F. Fiebre: infección/sepsis |
| G. General: causas no obstétricas (6H y 6T) |
| H. Hipertensión: preeclampsia/eclampsia/HELLP, ACV hemorrágico |
| ISAL: intoxicación sistémica por anestésicos locales; IAM: infarto agudo al miocardio; TEP: tromboembolismo pulmonar; ELA: embolía de líquido amniótico; 6H: hipoxia, hipovolemia, hiper/hipokalemia, hipo/hipertermia, hidrogeniones (acidosis), hipoglicemia; 6T: (neumotórax a) tensión; taponamiento, tabletas/toxinas, tromboembolismo trombosis (infarto miocárdico) y trauma; HELLP: hemólisis, elevación de enzimas hepáticas y trombocitopenia; ACV: accidente cerebrovascular. |


Figura 3. (Continuación). Lista de verificación de reanimación materna en PCR.
Referencias
1. Knight M, Bunch K, Tuffnell D, et al.: Saving Lives, Improving Mothers’ Care – Lessons learned to inform maternity care from the UK and Ireland Confidential Enquiries into Maternal Deaths and Morbidity 2014-16., 2018, pp 1-104
2. Vera C, Donoso E. Desaceleración en la reducción de la mortalidad materna en Chile impide alcanzar el 5° Objetivo de Desarrollo del Milenio. Ars Med. 2019;43(1):13–20. https://doi.org/10.11565/arsmed.v44i1.1526.
3. Leighton BL. Why obstetric anesthesiologists get sued. Anesthesiology. 2009 Jan;110(1):8–9. https://doi.org/10.1097/ALN.0b013e318190e18e PMID:19104161
4. ASA House of Delegates/Executive Committee, ASA Physical Status Classification System. 2014 (última actualización: 15 de octubre 2014). Asociación Americana de Anestesiólogos (ASA); http://www.asahq.org/resources/clinical-information/asa-physical-status-classification-system
5. Reitman E, Flood P. Anaesthetic considerations for non-obstetric surgery during pregnancy. Br J Anaesth. 2011 Dec;107 Suppl 1:i72–8. https://doi.org/10.1093/bja/aer343 PMID:22156272
6. Lacassie HJ, Lema G. Reflexión sobre la curva presión/volumen ventricular de la embarazada sana. Rev Esp Anestesiol Reanim. 2017 Jun – Jul;64(6):360–1. https://doi.org/10.1016/j.redar.2016.12.001 PMID:28366294
7. Conklin K (Chestnut D, editor). Physiologic changes of pregnancy, Obstetric Anesthesia. Principles and Practice. St Louis (MO): Mosby-Year Book Inc.; 1994. pp. 17–42.
8. James M, Anthony J (Birnbach D, Gatt S, Datta S, editors). Critical care management of the pregnant patient, Textbook of Obstetric Anestesia. Philadelphia (Pennsylvania): Churchill Livingstone; 2000. pp. 716–32.
9. Donoso E. MORTALIDAD MATERNA EN CHILE, 2000-2004. REV CHIL OBSTET REV CHIL OBSTET GINECOL. 2006;71:246–51.
10. Wong CA, Loffredi M, Ganchiff JN, Zhao J, Wang Z, Avram MJ. Gastric emptying of water in term pregnancy. Anesthesiology. 2002 Jun;96(6):1395–400. https://doi.org/10.1097/00000542-200206000-00019 PMID:12170052
11. Kuczkowski KM. Nonobstetric surgery during pregnancy: what are the risks of anesthesia? Obstet Gynecol Surv. 2004 Jan;59(1):52–6. https://doi.org/10.1097/01.OGX.0000103191.73078.5F PMID:14707749
12. Cifuentes J (Pérez A, Donoso E, editors). Asfixia del Recién Nacido, Obstetricia. Santiago: Publicaciones Técnicas Mediterráneo Ltda; 1999. pp. 927–37.
13. Leung TY, Chung PW, Rogers MS, Sahota DS, Lao TT, Hung Chung TK. Urgent cesarean delivery for fetal bradycardia. Obstet Gynecol. 2009 Nov;114(5):1023–8. https://doi.org/10.1097/AOG.0b013e3181bc6e15 PMID:20168102
14. Frölich MA (Birnbach D, Gatt S, Datta S, editors). Anesthesia for Presumed Fetal Jeopardy, Textbook of Obstetric Anesthesia. Philadelphia: Churchill Livingstone; 2000. pp. 267–80.
15. Kinsella SM, Girgirah K, Scrutton MJ. Rapid sequence spinal anaesthesia for category-1 urgency caesarean section: a case series. Anaesthesia. 2010 Jul;65(7):664–9. https://doi.org/10.1111/j.1365-2044.2010.06368.x PMID:20642523
16. Bhattacharya S, Ghosh S, Chattopadhya U, et al. Rapid sequence spinal anesthesia versus general anesthesia: A prospective randomized study of anesthesia to delivery time in category-1 caesarean section. J Obstet Anaesth Crit Care. 2016;6(2):75–80. https://doi.org/10.4103/2249-4472.191597.
17. Hawkins JL, Chang J, Callaghan W, Gibbs CP, Palmer SK. Anesthesia-Related Maternal Mortality in the United States, 1991-1996. An Update. Anesthesiology. 2002;96 Sup 2:A1046. https://doi.org/10.1097/00000542-200209002-01046.
18. Hawkins JL, Koonin LM, Palmer SK, Gibbs CP. Anesthesia-related deaths during obstetric delivery in the United States, 1979-1990. Anesthesiology. 1997 Feb;86(2):277–84. https://doi.org/10.1097/00000542-199702000-00002 PMID:9054245
19. Cooper GM, McClure JH. Maternal deaths from anaesthesia. An extract from Why Mothers Die 2000-2002, the Confidential Enquiries into Maternal Deaths in the United Kingdom: Chapter 9: Anaesthesia. Br J Anaesth. 2005 Apr;94(4):417–23. https://doi.org/10.1093/bja/aei066 PMID:15758081
20. Hodgkinson R, Husain FJ, Hayashi RH. Systemic and pulmonary blood pressure during caesarean section in parturients with gestational hypertension. Can Anaesth Soc J. 1980 Jul;27(4):389–94. https://doi.org/10.1007/BF03007461 PMID:7407669
21. Johannsen EK, Munro AJ. Remifentanil in emergency caesarean section in pre-eclampsia complicated by thrombocytopenia and abnormal liver function. Anaesth Intensive Care. 1999 Oct;27(5):527–9. https://doi.org/10.1177/0310057X9902700517 PMID:10520397
22. Ngan Kee WD, Khaw KS, Ma KC, Wong AS, Lee BB, Ng FF. Maternal and neonatal effects of remifentanil at induction of general anesthesia for cesarean delivery: a randomized, double-blind, controlled trial. Anesthesiology. 2006 Jan;104(1):14–20. https://doi.org/10.1097/00000542-200601000-00004 PMID:16394684
23. Gatt S (Birnbach D, Gatt S, Datta S, editors). Hypertensive disorders and renal disease in pregnancy and labor, Textbook of Obstetric Anestesia. Philadelphia (Pennsylvania): Churchill Livingstone; 2000. pp. 541–52.
24. Fox GS, Smith JB, Namba Y, Johnson RC. Anesthesia for cesarean section: further studies. Am J Obstet Gynecol. 1979 Jan;133(1):15–9. https://doi.org/10.1016/0002-9378(79)90404-6 PMID:32770
25. Stenger VG, Blechner JN, Andersen TW, Eitzman DV, Cestaric E, Prystowsky H. Observations on pentothal, nitrous oxide, and succinylcholine anesthesia at cesarean section. Am J Obstet Gynecol. 1967 Nov;99(5):690–701. https://doi.org/10.1016/0002-9378(67)90417-6 PMID:6051163
26. Mushambi MC, Kinsella SM, Popat M, Swales H, Ramaswamy KK, Winton AL, et al.; Obstetric Anaesthetists’ Association; Difficult Airway Society. Obstetric Anaesthetists’ Association and Difficult Airway Society guidelines for the management of difficult and failed tracheal intubation in obstetrics. Anaesthesia. 2015 Nov;70(11):1286–306. https://doi.org/10.1111/anae.13260 PMID:26449292
27. Bonica J, McDonald J. Principles and Practice of Obstetric Analgesia and Anesthesia, Williams & Wilkins 1995. Philadelphia: Williams & Wilkins; 1995.
28. Birenbaum A, Hajage D, Roche S, et al.: Effect of Cricoid Pressure Compared With a Sham Procedure in the Rapid Sequence Induction of Anesthesia: The IRIS Randomized Clinical Trial. JAMA Surg 2018
29. Datta S, Ostheimer GW, Weiss JB, Brown WU Jr, Alper MH. Neonatal effect of prolonged anesthetic induction for cesarean section. Obstet Gynecol. 1981 Sep;58(3):331–5. PMID:7266952
30. Dyer RA, Piercy JL, Reed AR, Lombard CJ, Schoeman LK, James MF. Hemodynamic changes associated with spinal anesthesia for cesarean delivery in severe preeclampsia. Anesthesiology. 2008 May;108(5):802–11. https://doi.org/10.1097/01.anes.0000311153.84687.c7 PMID:18431115
31. Svanström MC, Biber B, Hanes M, Johansson G, Näslund U, Bålfors EM. Signs of myocardial ischaemia after injection of oxytocin: a randomized double-blind comparison of oxytocin and methylergometrine during Caesarean section. Br J Anaesth. 2008 May;100(5):683–9. https://doi.org/10.1093/bja/aen071 PMID:18385263
32. Gin T, Chan MT: Decreased minimum alveolar concentration of isoflurane in pregnant humans. 1994; 81: 829-832 https://doi.org/10.1097/00000542-199410000-00009.
33. Ueyama HH, Hagihira SS, Takashina MM, Nakae AA, Mashimo TT: Pregnancy does not enhance volatile anesthetic sensitivity on the brain: an electroencephalographic analysis study. 2010; 113: 577-584 https://doi.org/10.1097/ALN.0b013e3181e4f508.
34. Gin T, Mainland P, Chan MT, Short TG. Decreased thiopental requirements in early pregnancy. unobtrusively wearable sensor suite for inferring the onset, causality, and consequences of stress in the field 1997; 86: 73-78.
35. Mongardon N, Servin F, Perrin M, Bedairia E, Retout S, Yazbeck C, et al. Predicted propofol effect-site concentration for induction and emergence of anesthesia during early pregnancy. Anesth Analg. 2009 Jul;109(1):90–5. https://doi.org/10.1213/ane.0b013e3181a1a700 PMID:19439683
36. Collis R, Guasch E. Managing major obstetric haemorrhage: pharmacotherapy and transfusion. Best Pract Res Clin Anaesthesiol. 2017 Mar;31(1):107–24. https://doi.org/10.1016/j.bpa.2017.02.001 PMID:28625299
37. Mhyre JM, Shilkrut A, Kuklina EV, Callaghan WM, Creanga AA, Kaminsky S, et al. Massive blood transfusion during hospitalization for delivery in New York State, 1998-2007. Obstet Gynecol. 2013 Dec;122(6):1288–94. https://doi.org/10.1097/AOG.0000000000000021 PMID:24201690
38. ACOG. Obstetric Hemorrhage. 2019 (última actualización: https://www.acog.org/About-ACOG/ACOG-Districts/District-II/SMI-OB-Hemorrhage?IsMobileSet=false
39. Pacheco LD, Saade GR, Costantine MM, Clark SL, Hankins GD. An update on the use of massive transfusion protocols in obstetrics. Am J Obstet Gynecol. 2016 Mar;214(3):340–4. https://doi.org/10.1016/j.ajog.2015.08.068 PMID:26348379
40. Charbit B, Mandelbrot L, Samain E, Baron G, Haddaoui B, Keita H, et al.; PPH Study Group. The decrease of fibrinogen is an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost. 2007 Feb;5(2):266–73. https://doi.org/10.1111/j.1538-7836.2007.02297.x PMID:17087729
41. Cannon JW. Hemorrhagic Shock. N Engl J Med. 2018 Jan;378(4):370–9. https://doi.org/10.1056/NEJMra1705649 PMID:29365303
42. Dyer RA, Vorster AD, Arcache MJ, Vasco M. New trends in the management of postpartum haemorrhage. Southern African Journal of Anaesthesia and Analgesia. 2014;20(1):44–7. https://doi.org/10.1080/22201173.2014.10844564.
43. Holcomb JB, Jenkins D, Rhee P, Johannigman J, Mahoney P, Mehta S, et al. Damage control resuscitation: directly addressing the early coagulopathy of trauma. J Trauma. 2007 Feb;62(2):307–10. https://doi.org/10.1097/TA.0b013e3180324124 PMID:17297317
44. Collaborators WT; WOMAN Trial Collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet. 2017 May;389(10084):2105–16. https://doi.org/10.1016/S0140-6736(17)30638-4 PMID:28456509
45. Vergara C, Soto D, Fernández C, Balde D, Brañes J, Lacassie HJ. Cell Saver en Obstetricia. Primer caso reportado en Chile. Ars Med. 2018;43(2):43. https://doi.org/10.11565/arsmed.v43i2.1118.
46. Jauniaux E, Ayres-de-Campos D, Langhoff-Roos J, et al.: FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders,, International Journal of Gynecology and Obstetrics, John Wiley & Sons, Ltd, 2019, pp 20-24
47. Hudon L, Belfort MA, Broome DR. Diagnosis and management of placenta percreta: a review. Obstet Gynecol Surv. 1998 Aug;53(8):509–17. https://doi.org/10.1097/00006254-199808000-00024 PMID:9702791
48. Clark SL, Koonings PP, Phelan JP. Placenta previa/accreta and prior cesarean section. Obstet Gynecol. 1985 Jul;66(1):89–92. PMID:4011075
49. Mayer D, Smith A (Chestnut D, editor). Antepartum and Postpartum Hemorrhage, Obstetric Anesthesia. Principles and Practice, 4a edition. Philadelphia (PA): Mosby Elsevier; 2009. pp. 811–36.
50. Alexander JM, Sarode R, McIntire DD, Burner JD, Leveno KJ. Whole blood in the management of hypovolemia due to obstetric hemorrhage. Obstet Gynecol. 2009 Jun;113(6):1320–6. https://doi.org/10.1097/AOG.0b013e3181a4b390 PMID:19461429
51. Lim G, Facco FL, Nathan N, et al.: A Review of the Impact of Obstetric Anesthesia on Maternal and Neonatal Outcomes. 2018; 129: 192-215 https://doi.org/10.1097/ALN.0000000000002182.
52. Reale SC, Leffert LR, Farber MK: Update on Obstetric Hemorrhage. 2019: 1-9 https://doi.org/10.1007/s40140-019-00311-6.
53. Shahin Y, Pang CL. Endovascular interventional modalities for haemorrhage control in abnormal placental implantation deliveries: a systematic review and meta-analysis. Eur Radiol. 2018 Jul;28(7):2713–26. https://doi.org/10.1007/s00330-017-5222-0 PMID:29404775
54. Silvergleid A, Kleinman S, Tirmauer J. Leukoreduction to prevent complications of blood transfusion., Up To Date. Waltham (MA): UpToDate Inc.; 2018.
55. Khan KS, Moore P, Wilson M, Hooper R, Allard S, Wrench I, et al. A randomised controlled trial and economic evaluation of intraoperative cell salvage during caesarean section in women at risk of haemorrhage: the SALVO (cell SALVage in Obstetrics) trial. Health Technol Assess. 2018 Jan;22(2):1–88. https://doi.org/10.3310/hta22020 PMID:29318985
56. Shakur H, Roberts I, Fawole B, Chaudhri R, El-Sheikh M, Akintan A, et al.; WOMAN Trial Collaborators. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled trial. Lancet. 2017 May;389(10084):2105–16. https://doi.org/10.1016/S0140-6736(17)30638-4 PMID:28456509
57. Moore HB, Moore EE, Neal MD, Sheppard FR, Kornblith LZ, Draxler DF, et al. Fibrinolysis Shutdown in Trauma: Historical Review and Clinical Implications. Anesth Analg. 2019 Sep;129(3):762–73. https://doi.org/10.1213/ANE.0000000000004234 PMID:31425218
58. Panigrahi AK, Yeaton-Massey A, Bakhtary S, Andrews J, Lyell DJ, Butwick AJ, et al. A Standardized Approach for Transfusion Medicine Support in Patients With Morbidly Adherent Placenta. Anesth Analg. 2017 Aug;125(2):603–8. https://doi.org/10.1213/ANE.0000000000002050 PMID:28640786
59. Taylor NJ, Russell R. Anaesthesia for abnormally invasive placenta: a single-institution case series. Int J Obstet Anesth. 2017 May;30:10–5. https://doi.org/10.1016/j.ijoa.2017.01.008 PMID:28258943
60. Clark SL. Amniotic fluid embolism. Obstet Gynecol. 2014 Feb;123(2 Pt 1):337–48. https://doi.org/10.1097/AOG.0000000000000107 PMID:24402585
61. Cattaneo A (Birnbach D, Gatt S, Datta S, editors). Air and Amniotic Fluid Embolism, Textbook of Obstetric Anestesia. Philadelphia (Pennsylvania): Churchill Livingstone; 2000. pp. 435–54.
62. Shechtman M, Ziser A, Markovits R, Rozenberg B. Amniotic fluid embolism: early findings of transesophageal echocardiography. Anesth Analg. 1999 Dec;89(6):1456–8. PMID:10589627
63. Hsieh YY, Chang CC, Li PC, Tsai HD, Tsai CH. Successful application of extracorporeal membrane oxygenation and intra-aortic balloon counterpulsation as lifesaving therapy for a patient with amniotic fluid embolism. Am J Obstet Gynecol. 2000 Aug;183(2):496–7. https://doi.org/10.1067/mob.2000.104834 PMID:10942494
64. Lipman S, Cohen S, Einav S, Jeejeebhoy F, Mhyre JM, Morrison LJ, et al.; Society for Obstetric Anesthesia and Perinatology. The Society for Obstetric Anesthesia and Perinatology consensus statement on the management of cardiac arrest in pregnancy. Anesth Analg. 2014 May;118(5):1003–16. https://doi.org/10.1213/ANE.0000000000000171 PMID:24781570
65. Vanden Hoek TL, Morrison LJ, Shuster M, Donnino M, Sinz E, Lavonas EJ, et al. Part 12: cardiac arrest in special situations: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010 Nov;122(18 Suppl 3):S829–61. https://doi.org/10.1161/CIRCULATIONAHA.110.971069 PMID:20956228
66. Jeejeebhoy FM, Zelop CM, Lipman S, Carvalho B, Joglar J, Mhyre JM, et al.; American Heart Association Emergency Cardiovascular Care Committee, Council on Cardiopulmonary, Critical Care, Perioperative and Resuscitation, Council on Cardiovascular Diseases in the Young, and Council on Clinical Cardiology. Cardiac Arrest in Pregnancy: A Scientific Statement From the American Heart Association. Circulation. 2015 Nov;132(18):1747–73. https://doi.org/10.1161/CIR.0000000000000300 PMID:26443610
67. Neumar RW, Otto CW, Link MS, Kronick SL, Shuster M, Callaway CW, et al. Part 8: adult advanced cardiovascular life support: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010 Nov;122(18 Suppl 3):S729–67. https://doi.org/10.1161/CIRCULATIONAHA.110.970988 PMID:20956224
68. Lipman S, Daniels K, Cohen SE, Carvalho B. Labor room setting compared with the operating room for simulated perimortem cesarean delivery: a randomized controlled trial. Obstet Gynecol. 2011 Nov;118(5):1090–4. https://doi.org/10.1097/AOG.0b013e3182319a08 PMID:22015877

 ORCID
ORCID