Pablo O. Sepúlveda V. 1 ,*, Luis F. Tapia 2 , Gabriela Faúndez 3
Recibido: 18-04-2022
Aceptado: 10-05-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 5 pp. 552-559|https://doi.org/10.25237/revchilanestv5101071114
PDF|ePub|RIS
Abstract
General anaesthesia is often homologated to physiological sleep whereas they only share some of the same characteristics. The differences are remarkable in electroencephalographic characteristics and in the way in which the state of disconnection from the environment is established. General anaesthesia and surgery are phenomena that alter the physiological cycles of postoperative sleep depending on the drugs used, the neurological depression achieved, the functional reserve of the patient and specific phenomena of neuroinflammation triggered by the surgery. Anaesthesia shares very partially the mechanisms that trigger sleep but shares a common phenomenon: the sleep inertia; They do share a common phenomenon: the inertia of awake- ning, possibly enhanced by anaesthesia in susceptible patients. Given the physiological importance of sleep in the postoperative reparative process, it is essential to recognize which patients are likely to influence their reconnection and to take preventive actions to minimize the impact on postoperative sleep architecture. This article describes the differences and similarities between anaesthetic and physiological sleep, including electroencephalographic differences, the effect of different anaesthetics on postoperative sleep architecture, the phenomenon of common inertia and neuroinflammation.
Resumen
La anestesia general se la homologado frecuentemente al sueño fisiológico cuando solo comparten algunas de sus características. Las diferencias son llamativas en características electroencefalográficas y en la forma de instalar el estado de desconexión al medio. La anestesia general y la cirugía son fenómenos que alteran los ciclos fisiológicos del sueño posoperatorio dependiendo de las drogas, la depresión neurológica alcanzado, la reserva funcional del paciente y fenómenos específicos de neuroinflama- ción desencadenados por la cirugía. La anestesia comparte muy parcialmente los mecanismos que desencadenan el sueño. Si comparten un fenómeno común: la inercia del despertar, eventualmente potenciada por la anestesia. Dada la importancia fisiológica del sueño en el proceso reparativo post operatorio, son fundamentales el reconocimiento de los pacientes susceptibles de enlentecer su reconexión y eventuales acciones preventivas para minimizar efectos en la arquitectura del sueño posoperatorio y su requerimiento en el proceso de recuperación. El presente artículo, describe las diferencias y similitudes entre el sueño anestésico y el fisiológico, incluyendo las diferencias electroencefalograficas entre ambos, el impacto de diferentes anestésicos en la arquitectura del sueño posoperatorio, el fenómeno de la inercia común, comentando algunas acciones que ayudarían a disminuir estos problemas.
-
Introducción
El fenómeno sueño es ubicuo en el reino animal. El sueño y sus diferentes etapas son un fenómeno evolutivo que aparece progresivamente desde hace ya 500 millones de años, y se le considera parte de las características de los animales capaces de desarrollar fenómenos de autoconciencia más o menos complejos, cuidados parentales y relaciones sociales, homeotermia, la denominada teoría de la mente (base teórica de la capacidad de subjetivar) con memoria episódica. Las etapas del sueño, en especial la emergencia del sueño REM es incluso una caracterización considerada como un tipo de proto- consciencia[1],[2].
Su déficit prolongado en humanos, específicamente el déficit de sueño REM, genera progresivamente problemas tales como confusión, paranoia, alteraciones afectivas, disminución de la eficiencia motora, dificultad en consolidar memoria y alteraciones inmunológicas[1],[5].
En el posoperatorio los factores que influyen la calidad del sueño son el largo de la cirugía, comorbilidades como síndrome de apnea obstructiva (SAHOS), y el infarto miocárdico recien- te[3], la presencia de dolor y el uso inapropiado de opioides que alteran el sueño REM[4], las molestias posicionales, los controles de enfermería nocturnos y las invasiones orificiales. La anestesia general, la neuroinflamación posquirúrgica y la condición de fragilidad cognitiva previa del paciente son condiciones, especialmente, interesantes que se considerarán en forma particular.
La descrita inercia del sueño, entidad clínica no bien estudiada, junto a la recientemente descrita inercia neuronal como fenómeno farmacodinámico intrínseco en anestesia, representan una nueva área para el estudio de la fisiología de ambos fenómenos, y su eventual potenciación en el despertar.
Se ha descrito, confusamente, en un escenario multifacto- rial, que la anestesia general es un proceso que interrumpe los ciclos fisiológicos del sueño y también impacta de diferentes formas en la arquitectura del sueño fisiológico posoperatorio. Este impacto sería diferente, dependiendo de los fármacos usados, la dosificación y el grado o tipo de depresión neuronal impactado y sus interacciones, y también en la forma como realizamos el proceso de reconexión de la conciencia tras la anestesia general.
-
Fisiología del sueño
Para comprender como impacta el proceso anestésico-quirúrgico en la arquitectura del sueño, debemos comprender las diferencias del estado anestésico y el sueño fisiológico.
El fenómeno evolutivo del sueño y sus etapas se replica de alguna forma en la ontogenia y cambia, progresivamente, en el trascurso del envejecimiento. En el recién nacido se observan muchas horas de sueño con mayor proporción de sueño REM, el cual es importante en la generación de circuitos de elabora- ción[5] y se caracteriza por atonía de la musculatura estriada, manteniendo inhibido el locus coeruleus (LC) y otros núcleos que participan en la actividad gravitacional.
El sueño fisiológico se desencadena por requerimientos tanto homeostáticos endógenos como la acumulación de adenosina a nivel pontino, prostaglandinas D2 en áreas preóptica medial del hipotálamo, interleuquina 1, etc., activando circuitos de sueño, principalmente, desde el núcleo ventrolateral preóp
tico (VLPO). Desde este núcleo se produce una activación de vías GABAergicas troncales, provocando una hiperpolarización de los núcleos inespecíficos del tálamo, que desencadena las ondas lentas del sueño en sincronía con la corteza frontal. Son los llamados ritmos delta (1-2 Hz) basales con superposición de spidle en alfa (7-12 Hz) (denominados huso en castellano). Esta condición es considerada como un cierre de la puerta ta- lámica, impidiendo así el flujo de una importante cantidad de actividad intero y sobre todo exteroceptiva hacia el córtex. Este estado permite a la corteza entrar en estado de sueño sin ser interrumpido, a no ser que el estímulo sea capaz de sobrepasar el bloqueo. Esta condición representa una condición inercial protectora entre los estados de sueño y vigilia.
Además, la actividad GABAergicas del VLPO, produce específicamente una disminución de la actividad acetilcolinérgica, serotoninérgica y monoaminérgica, fundamentales para la integración de información o de amplificación de señales periféricas hacia el córtex, como también de la liberación de orexina activadora[6]. Las neuronas activadoras de la zona posterior del tronco monoaminérgicas del LC (con actividad noradrenérgica), núcleos del Rafe (NR, con actividad serotoninérgica) y núcleo tuberomamilar (TMN, con actividad histaminérgica) descargan más rápido durante la alerta, y son inhibidos por el VLPO durante el estadio no-REM (NREM). En estadio REM, las neuronas monoaminérgicas están inhibidas, pero las neuronas del núcleo pedúnculo pontino y el tegmental laterodorsal (PPT-LDT) se liberan de la inhibición que éstas ejercen y son las responsables de generar el sueño REM[7].
Todo este ciclo se repite cada 24 h, y se expresa en las 5 etapas del sueño. Cuatro etapas NoREM y una REM como ciclo completo que se repite 3 a 4 veces por noche. Serían ciclos circadianos programados, o “ciclos de ciclos” tipo “flip-flop” autorregulados por reciprocidad entre ellos y de carácter bies- table. Aquí radica una gran diferencia con la anestesia, donde no existen ciclos y se observada un estado relativamente monótono y estereotipado.
-
Diferencias y similitudes entre sueño fisiológico y anestesia
Tradicionalmente, el denominado componente “inconsciencia” de la anestesia general, se lo ha homologado con una condición de hipnosis del sueño. Esto es inexacto en muchos sentidos y sería más preciso referirse a este estado como inconciencia anestésica.
La condición de desconexión perceptiva del medio que producen los anestésicos gabaergicos, es un estado farmacológico inducido y reversible que no responde a necesidades homeostá- ticas ni reparativas, no presenta las diferentes etapas del sueño fisiológico, es fenomenológicamente y EEG diferente, e incluso genera alteraciones de la homeostasis sistémica y variablemente de la arquitectura del sueño normal en el posoperatorio.
A diferencia del mecanismo ascendente inhibidor desde el núcleo VLPO, la perdida de la conciencia en anestesia sería predominantemente desde arriba hacia abajo, produciendo un desacoplamiento modular y de redes específicas. Esto es observable, muy significativamente, al realizar la inducción anestésica en forma lenta para lograr desacoplar solo la capacidad de generar consciencia explicita[8],[9].
Otro mecanismo de perdida de la conciencia anestésica es tras un bolo que desacopla el tronco y las aferencias alimenta- doras del tálamo. Esto generó por un tiempo la confusión de asimilar mecanismos a los del sueño, por ser la práctica del bolo de inducción muy extendido.
La anestesia gabaergica bloquea, muy intensamente, la puerta talámica y al incluir también bloqueos o hiperpolariza- ciones espinales que alimentan la actividad cortical la actividad rítmica en sincronía alfa talámica se fortalece. Eso no sucede en el sueño fisiológico. Esta reducción de la alimentación cortical se logra tanto con anestésicos locales espinal, el uso de opioi- des e incluso la relajación del huso muscular estriado. Todo ello lleva a la corteza a tener un mayor grado de sincronía (enlente- cimiento), al recibir menos información (o estímulo).
El estado de inconsciencia anestésico mantiene conectivi- dad de pequeña distancia, pero desacopla la de larga distancia, en especial los flujos de información de reciproca fronto-parie- tales, la ínsula posterior, los tractos de la red de modo default (cuando funcionamos en modo semi automático) y la red de atención dorsal (red de foco ejecutivo). Estas últimas dos redes que en vigilia son antagónicas, durante la anestesia se apagan ambas[10].
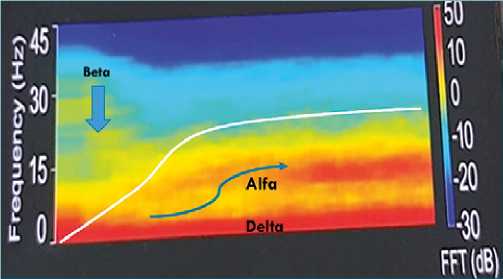
Figura 1. Inducción lenta con propofol (línea blanca) con aparición de actividad denominada actividad “desinhibitoria” en banda beta (13 a 30 Hz) previa a la inconsciencia y luego la progresiva aparición de actividad de banda alfa (7-12,5 Hz) y delta (1-3Hz) con la pérdida de la conciencia (Espectrograma del monitor Conox).
-
Diferencias en el EEG y los mecanismos de inconsciencia y recuperación
Ya se mencionó que el sueño, a diferencia de la anestesia, tiene etapas. Aún en las etapas profundas 3 y 4 del sueño lento NREM existen diferencias importantes con el EEG del estado anestésico. Por ejemplo, la aparición de complejos K y spindles (ritmos alfa 7-12 Hz) en etapa 2 del sueño, de las cuales no se conoce exactamente la función. Los complejos K representan combinación de un ciclo de oscilación lenta cortical seguido de un spindle de neuronas talamocorticales[11].
Habría entonces una discontinuidad en los spindle durante el sueño mientras en anestesia estos son mucho más continuos. El origen de los spindle sería similar, pero desencadenado por orígenes corticales mayoritariamente en el caso de la anestesia y troncales en el sueño. La evidencia del origen de los spindle en frecuencias alfa en la zona perigeniculada del tálamo se explica porque: 1) el tálamo juega rol de filtro y administrador y éstos ocurren aún en ausencia de corteza cerebral; 2) grandes lesiones del tálamo o desaferentaciones de los núcleos reticulares, abole la actividad en spindle.
Hay además diferencias en el EEG entre el sueño fisiológico y cada droga particular. Usando EEG de alta densidad se ha podido comparar el sueño fisiológico con el producido por pro- pofol u otros anestésicos. Propofol tras la inducción lenta y pérdida de la conciencia produce una anteriorización hacia frontal de la actividad alfa, predominantemente occipital en vigilia. También se observa una aparición de ondas lentas generalizadas (delta) que se asimilan a las que aparecen en etapa NREM del sueño. Las ondas lentas de propofol y de sueño tendrían el mismo origen cortical, y se propagan por el componente mesial de la red default. Sin embargo, las ondas lentas de propofol fueron borrosas en el espacio en comparación con las ondas lentas del sueño y no lograron efectivamente la actividad del huso.
Desde fines de los 70 hasta los 2010, se identifica que, tras la inconciencia con propofol o los gases anestésicos, se produce una desaparición del ritmo alfa occipital y aparecer un alfa de alto poder en el frontal. Propofol también muestra, en el trascurso de la inducción lenta, algunas diferencias importantes con el sueño, como un aumento de la actividad de poder gamma (25-40 Hz) en concentraciones bajo 1 ug/ml originados de la corteza cingulada y luego en concentraciones previas a entrar en un estado de desinterés o disociación del medio o la inconsciencia misma, un aumento de la actividad en Beta (14 a 24 Hz) que disminuye, progresivamente, solo después de la inconsciencia. El aumento de estas frecuencias altas se las asocia con la fase de desinhibición conductual que presentan los pacientes en la inducción progresiva (Figura 1).
En particular, el deterioro selectivo de la función de la ínsula anterior inducido por los anestésicos sugiere que podría haber una diferencia crucial entre anestesia y el sueño natural en lo que respecta a la red que integra los sentimientos y emociones. Con concentraciones alrededor de 1,5 a 2 ug/ml de propofol, los pacientes se despersonalicen, pero conserven muchas funciones de orden superior (responden coherentes pero lentos) y una autoconciencia incorpórea, hasta que se alcanzan condición de inconsciencia. En este sentido, la anestesia general difiere, significativamente, del sueño fisiológico, en el que parece que la pérdida de motivación de actuar y sensibilidad es paralela, o la disminución de la conciencia de sí mismo. Curiosamente, la conectividad dentro de las regiones posteriores del cerebro, en especial de la corteza cingulada posterior, se mantiene incluso a concentraciones bastante altas de anestésicos. Se asocia esta zona con un marcador patognomónico del núcleo del “self” (o sentido de la existencia), porque su depresión está implicado en la aparición de ritmos de supresión y desajuste homeostáti- co[12],[13].
La entrada en estado de sueño fisiológico es, en cambio un fenómeno eminentemente bottom up, de abajo hacia arriba, por la activación de VLPO, junto a la inhibición subsecuente de los núcleos activadores ya mencionados. Por años se propuso para anesteisa un modelo basado en este mecanismo producto de que un bolo o perfusiones rápidas producen gran impacto en la actividad troncal.
Recientemente, se ha establecido que en el fenómeno anestésico predomina la depresión corticocortical que desencadenaría en los núcleos inespecíficos del tálamo la actividad sincrónica en alfa (delta spindle) observada en los nuevos monitores que incluyen espectrografía frontal. Sepúlveda y cols., muestran al hacer inducciones lentas o rápidas, observando una instalación de un sólido alfa tras la inducción lenta. La inducción rápida genera, en cambio, un alfa débil por largos minutos tras la perdida de la conciencia clínica asociada, además a la caída de reflejos de tronco[14].
Gases anestésicos como sevofluorano provocan otro patrón EEG en el estado de inconciencia, donde a la actividad delta spindle se agrega una fuerte actividad theta (3-6 Hz), observándose un patrón de relleno “fill in” (Figura 2). Los efectos específicos de sevofluorano se alejan más de las características del sueño NoREM, y tienen efectos particulares sobre la arquitectura del sueño que se comentan más adelante.
Por ahora el problema es que muchas veces los EEG y sus análisis clásicos de Fourier y aún los espectrogramas, no permiten diferenciar algunos estados clínicos. Por ejemplo, pacientes jóvenes, con dexmedetomidina en dosis elevadas (1 ug/kg/h), se observa una profunda actividad delta predominante, casi o sin actividad alfa, pero estos pacientes son despertables. Solo recientemente con técnicas complejas de mediciones no lineales, a partir de un conjunto disperso de derivaciones de EEG se ha podido rastrear los cambios de estado de consciencia. Son los llamados análisis de complejidad de la Figura 3 y serán, probablemente, parte de los próximos monitores.
-
Inercia del sueño y de la anestesia
Tal vez uno de los más interesantes fenómenos compartidos es un tipo de comportamiento biestable entre el estado consciente-inconsciente o despierto-dormido, descrito como una “inercia neuronal”. Esta refiere a la tendencia del cerebro a resistir los cambios de estado y se manifiesta en que la recupe ración de la anestesia se produce a concentraciones inferiores a las requeridas para la inducción[16],[17].
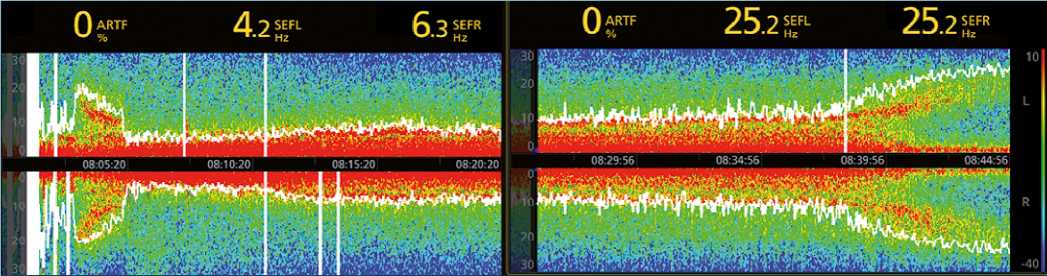
Figura 2. Anestesia sevofluorano. Inducción inhalatoria 7%, luego mantenimiento en 2%. Obsérvese gran depresión inicial con predominancia delta y theta. Luego se abre espectro observándose siempre una actividad intermedia entre alfa y delta de relleno (efecto fill in). Al final se observa el despertar.
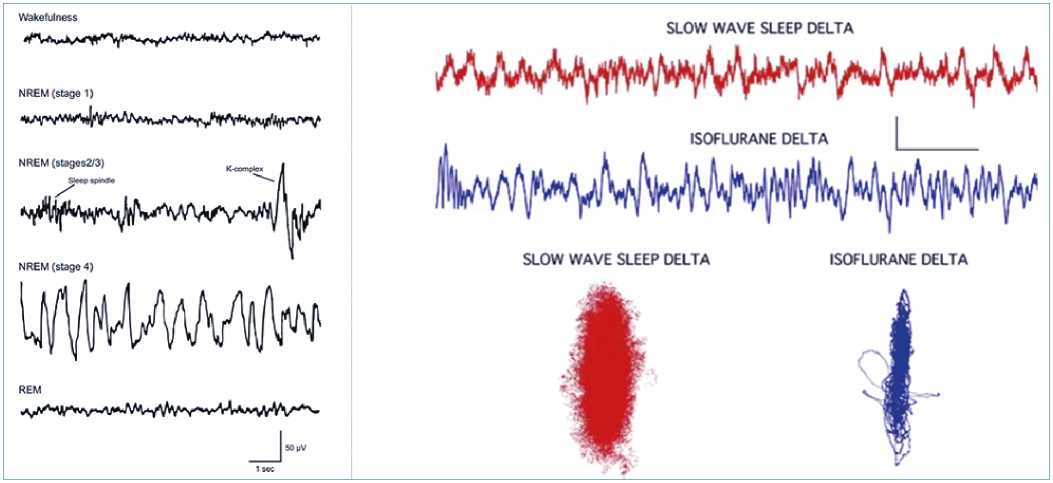
Figura 3. A izquierda un EEG crudo de etapas del sueño. A derecha arriba sueño lento y debajo anestesia con isofluorano. Se observa en el EEG una predominante actividad delta, pero no es posible diferenciarlos. Al usar técnicas de análisis no lineal de atractores caóticos tridimensionales se puede diferenciar ambos estados. Los atractores son diferentes y tienen radios diferentes[15].
Esta característica filogenéticamente sería desarrollada desde el sueño fisiológico y le permite al cerebro mantenerse estable tanto en estado de vigilia consciente como en estado de sueño, y solo la aplicación de potente energía (ruido) lo hace pasar a el otro estado. En el caso del sueño esta potente energía se refiere a la presencia de concentraciones de somnógenos o despertadores que activan los mecanismos de flip-flop hacia uno u otro lado, y que en anestesia se agregan fenómenos como el estímulo nóxico para romper el estado de inconsciencia (Figura 4).
La “inercia del sueño” se describe, hace unos años, para referirse a una etapa tras el despertar donde se observa menor nivel de alerta, somnolencia, confusión, menor rendimiento conductual y menor actividad en el EEG por unos minutos hasta horas[19],[20].
El EEG puede mostrar los 10 min después del despertar intenso poder de frecuencias lentas (1-9 Hz) y reducción del poder beta (18-25 Hz)[21]. La inercia del sueño puede ocurrir con o sin deprivación de sueño, y habría alguna importante asociación con el despertar desde estados de sueño lento. Este punto es importante probablemente para la consideración del despertar en anestesia[22].
El sueño reducido y fragmentado es común entre los ancianos y, especialmente, entre los pacientes con enfermedad de Alzheimer. Este sueño fragmentado en ancianos tiende a aumentar la actividad de las ondas lentas por lo que el despertar provoca mayores niveles de inercia del sueño, al igual que la privación del sueño[23].
El delirio en anestesia se asocia a estas condiciones de fragilidad y desde la electroencefalografía se lo ha descrito como un fenómeno de alteración de la conectividad. Estudios recientes muestran alteraciones del flujo de información a través de los nodos de las redes de conectividad intrínseca (ICN; modo de- fault, sensibilidad y red de control ejecutivo) evaluadas utilizando la centralidad entre los nodos con una desconexión global de la banda alfa y regional de beta, más una hiperconectividad de la banda theta en los pacientes con delirio. Aunque estos no son específicos de las redes de conectividad intrínseca únicas, sino que afectan a múltiples nodos de las redes relacionadas con el nivel de conciencia y la atención, la memoria de trabajo y el control ejecutivo[24].
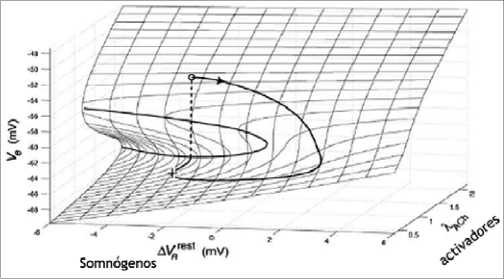
Figura 4. Modelo histerético del ciclo del sueño. Los potenciales de membrana caen progresivamente a medida que se acumulan somnó- genos (adenosina) y se recuperan siguiendo una curva inercial a medida que aumentan los activadores y caen los somnógenos, hasta el punto de cambio de biestabilidad (despertar)[18].
Por estas características del delirium, es la sugerencia para no forzar la sobrecarga informática del despertar esperando que la recuperación del bloqueo colinérgico disminuya al máximo. Recientemente, un estudio con más de 600 casos se asoció que la trayectoria del EEG desde estados profundo (Bajo SEF, predominancia delta) a un estado de vigilia abrupto, presenta más riesgos asociados de delirium. El paso por estados intermedios con aparición de bandas alfa sería en este caso un factor protector[25].
Dado que la densidad del spindle aumenta a medida que la presión impulso homeostático del sueño disminuye a lo largo de la noche, se ha planteado la hipótesis de que el mecanismo subyacente a la producción del spindle es importante para consolidar el sueño en las primeras horas de la mañana y evitar el despertar prematuro. Esto fue asociado a que durante el despertar anestésico el despertar abrupto tuviera más frecuencia de delirium[25].
El fenómeno de inercia en anestesia es explicado por Proekt diciendo: “mientras pasar de un estado estructurado (consciencia) a uno desestructurado es trivial, después de una perturbación dramática (anestesia) la restauración de la estructura no es genéricamente esperable”[26]. y la recuperación de la consciencia corresponde ser un proceso activo con mecanismos neurobiológicos específicos.
Esta respuesta inercial es además típica de las dinámicas oscilatorias como la cerebral, y que se explica esa característica para poder generar estados pseudoestables o llamados metaestados que sean capaces de generar información y me- morias[27]. En anestesia es esperable que esta resistencia al cambio se manifiesta con intensidad, dado a efectos de las drogas[28].
Es un hecho conocido que el envejecimiento aumenta la sensibilidad a los anestésicos y prolonga su efecto, pero ahora se agrega la evidencia de que la edad influye en un recién descrito marcador EEG de inercia neural en los seres humanos: la saturación de actividad de onda lenta (SWAS). Esta SWAS que es una estabilización precoz del poder de SWAS tras la perfusión de propofol en inducción y su caída abrupta al despertar en los pacientes de edad avanzada o frágiles, son formas de respuesta inercial asociada además a mayor fragilidad y probabilidad de delirio postoperatorio[29].
En anestesia ha sido un fenómeno complejo de desentrañar, porque solo recientemente se ha podido explicar mejor los comportamientos de la actividad cerebral y la modelación farmacodinámica (Concentración-Efecto)[30].
Los avances en conocimiento y conceptualizaciones actuales nos dicen que la inconciencia anestésica debe tener características específicas y no requiere ser un estado de depresión cortical profundo, sino específico. Debe limitarse al correlato neural de la conciencia explicita. Es así como puede explicarse el soñar durante estados anestésicos.
El uso de drogas gabaergicas (benzodiazepinas, propofol) generan mayor impacto depresivo de la actividad integrativa cortical (bloqueo acetilcolinérgico) disminuyendo la capacidad productiva de actividad mental intrínseca de la corteza y disminuyendo la posibilidad de soñar durante la anestesia.
Dado que los mecanismos fisiológicos de sueño tienen equilibrios fisiológicamente regulados y estados denominados de “consciencia desconectada” como el estado REM, en anestesia es frecuente sobre dosificar y generar depresiones de módulos neurológicos que en el sueño fisiológico siguen activos.
Se ha descrito que existe una diferencia intensa en la presencia y tipo de ensoñación onírica entre el sueño y la anestesia. Durante el sueño REM, con alta actividad se manifiestan sueños de carácter más bien aberrantes por falta de modulación exteroceptiva. En anestesia los sueños descritos, en especial con propofol, son sueños gratos y relativamente ordenados, pero con una actividad eléctrica monótona y de frecuencias más bajas. La incidencia de sueños (ensoñaciones) durante anestesia oscilaría entre 3,2% a 52,6% según la serie en pacientes entrevistados en el posoperatorio y con una enorme mayoría de experiencias de sensaciones agrada- bles[31],[32],[33],[34].
En realidad, la presencia de ensoñación en anestesia es por ahora poco explicable, dada la magra cuantificación objetiva del grado y tipo de depresión cortical con los EEG disponibles. Los índices EEG aún masivamente usados como guía en anestesia, son instrumentos muy burdos para estos análisis y, más aún, si los correlatos neurales asociados a la ensoñación natural se habrían identificado con las actualmente descritas “zonas calientes” del correlato neural de la consciencia, ubicado en cortezas más posteriores y no frontales como se pensaba[35].
Lo interesante es que, a pesar de las diferencias neurofar- macológicas muy significativas de cómo se instala una condición o la otra, el fenómeno de mentalización que genera ensoñación, y por defecto el recuerdo al despertar se manifiesta en forma evidente. Esto habla de que el cerebro está siempre activo buscando y generando, permanentemente, asociaciones experienciales que tienden a representar imágenes. Hoy en día se describe incluso que el estado despierto, es solamente, una continuidad de ese estado de alucinación, pero controlada[36], por efecto de la modulación dada por la información de los sentidos que alimenta al cerebro. La inhibición total de la capacidad de mentalización sería a la inversa un fenómeno anti protector cerebral, dado que la mentalización es lo que el cerebro produce, tal como el riñón produce orina. Eso explicaría en parte que fenómenos de excesiva depresión cortical como la Burst supression sean asociados a alteraciones cognitivas postoperatorias.
La existencia de la inercia y de la disociación entre conciencia conectada y desconectada es útil en anestesia, especialmente en cerebros frágiles, al darnos tiempo de limpiar el córtex de efecto gabaergico, reestablecer la conectividad cortico-cortical antes de reconectar al medio tal como en las mañanas tras un sueño fisiológico. Esto se logra manteniendo poca carga informática al córtex al evitar aportar información activadora a la corteza con concentraciones moderadas de remifentanil o dex- medetomidina. La utilidad de la inercia y de la disociación del componente de conexión al medio, ganan vigencia en cerebros enlentecidos o frágiles para que recuperen su capacidad de integrar información, sin saturar la capacidad informática de esos cerebros. Tras lograr un orden razonable con la actividad cortical intrínseca, se puede proceder a aportar información progresivamente. Este proceso incluye la estadía inicial en la sala de recuperación, evitando el sobre estimulo y, eventualmente, mantenido perfusiones de dexmedetomidina.
-
Impacto de los anestésicos en la arquitectura del sueño posoperatorio
Los efectos específicos de las drogas anestésicas sobre la arquitectura del sueño han sido estudiados especialmente en ratas. Mashour et al., describe en este estudio experimental37 la experimentación con 10 ratas Sprague-Dawley y concluye que propofol de alguna manera restauraría, abiertamente, déficit REM[38],[39]. Los datos muestran que los agentes inhalados no satisfacen la homeostasis necesaria para el sueño REM[40].
El impacto en los ciclos de sueño y electroencefalograma de isofluorano y desfluorano muestra que ayudarían a compensar el sueño de ondas lentas posdeprivación[41], pero que agentes inhalados como sevofluorano y desfluorano producirían un rebote selectivo de sueño REM, en deprivados previos[42],[43].
En nuestra experiencia de 15 años, el descrito efecto rebote REM tras iniciar terapias de CPAP, no se ve tras cirugías de ortognáticas de apnea del sueño, basadas en propofol y remi- fentanil. Los mecanismos propuestos son que Propofol borraría el registro homeostático, o que su efecto sobre núcleos gravi- tacionales que producen también una atonía similar a REM que serían responsable en parte de este efecto.
-
Neuroinflamación por la cirugía y alteración del sueño
Las alteraciones del patrón del sueño tras una cirugía mayor no-cardíaca han sido caracterizadas por una eliminación total de la fase REM durante las primeras noches del posoperatorio, una marcada reducción en la cantidad de slow wave sleep (SWS) y un aumento de la fase 2 no-REM[44]. Clínicamente, esto se evidencia como un sueño altamente fragmentado, con numerosos despertares espontáneos de larga duración[45]. El sueño REM reaparece con un aumento de densidad y duración (efecto rebote) en la mayoría de los pacientes, lo cual está asociado con reportes frecuentes de pesadillas vívidas, las cuales se han descrito hasta en 20% de los pacientes durante la primera semana después de una cirugía mayor no-cardíaca, siendo mayor la incidencia en la cuarta noche posoperatoria (lo que se correlaciona temporalmente con el rebote del sueño REM) [45],[46].
Aparte de los actos de invasividad, sondajes, controles nocturnos, aislamiento, alarmas de monitores y dolor, otro mecanismo a través del cual la cirugía causa alteraciones en el ciclo circadiano y los patrones del sueño que involucra una compleja respuesta hormonal al estrés y mediadores humorales es la descrita neuroinflamación[48].
El fenómeno de neuroinflamación es producto de una liberación específica de citoquinas y macrófagos que cruzan la barrera hematoencefálica, produciendo un fenómeno inflamatorio en especial en las zonas hipocámpicas.
Por ahora los datos dicen que la fragmentación del sueño y la cirugía pueden producir, independientemente, un deterioro significativo de la memoria. La fragmentación postoperatoria aumenta, significativamente, la inflamación del hipocampo, aunque sin que se produzca un mayor deterioro cognitivo. Aparentemente habría una disociación entre la neuroinflamación y el deterioro cognitivo que puede estar, básicamente, relacionado a la alteración de memoria[49].
Por último, recomendamos una interesante revisión reciente del manejo clínico y farmacológico de la neuroinflamación y la disfunción cognitiva[50].
Sugerimos que el diagnóstico de alteraciones de sueño preoperatorio[51] se incluya en los programas de prehabilitación para tener pacientes sin déficit de sueño preoperatorio previniendo así la potenciación de su condición por la cirugía y/o la anestesia.
Conflicto de interés: los autores manifiestan no tener conflicto de interés.
Referencias
1. Li X, Yu F, Guo A. Sleep deprivation specifically impairs short-term olfactory memory in Drosophila. Sleep. 2009 Nov;32(11):1417–24. https://doi.org/10.1093/sleep/32.11.1417 PMID:19928381
2. Hobson JA. REM sleep and dreaming: towards a theory of protoconsciousness. Nat Rev Neurosci. 2009 Nov;10(11):803–13. https://doi.org/10.1038/nrn2716 PMID:19794431
3. Su X, Wang DX. Improve postoperative sleep: what can we do? Curr Opin Anaesthesiol. 2018 Feb;31(1):83–8. https://doi.org/10.1097/ACO.0000000000000538 PMID:29120927
4. Chung F, Liao P, Elsaid H, Shapiro CM, Kang W. Factors associated with postoperative exacerbation of sleep-disordered breathing. Anesthesiology. 2014 Feb;120(2):299–311. https://doi.org/10.1097/ALN.0000000000000041 PMID:24158050
5. Rechtschaffen A, Gilliland MA, Bergmann BM, Winter JB. Physiological correlates of prolonged sleep deprivation in rats. Science. 1983 Jul;221(4606):182–4. https://doi.org/10.1126/science.6857280 PMID:6857280
6. Kushikata T, Yoshida H, Kudo M, Kudo T, Hirota K. Changes in plasma orexin A during propofol-fentanyl anaesthesia in patients undergoing eye surgery. Br J Anaesth. 2010 Jun;104(6):723–7. https://doi.org/10.1093/bja/aeq098 PMID:20430767
7. Brown RE, Basheer R, McKenna JT, Strecker RE, McCarley RW. Control of sleep and wakefulness. Physiol Rev. 2012 Jul;92(3):1087–187. https://doi.org/10.1152/physrev.00032.2011 PMID:22811426
8. Obert DP, Sepúlveda P, Kratzer S, Schneider G, Kreuzer M. The influence of induction speed on the frontal (processed) EEG. Sci Rep. 2020 Nov;10(1):19444. https://doi.org/10.1038/s41598-020-76323-8 PMID:33173114
9. Sepúlveda P, Acosta I, Hoppe A, Lobo FA, Carrasco E. Influencia de la tasa de administración en el mecanismo subyacente a la pérdida de consciencia inducida por propofol. Rev Esp Anestesiol Reanim. 2021;68(5):245–51. https://doi.org/10.1016/j.redar.2020.05.024.
10. Huang Z, Zhang J, Wu J, Mashour GA, Hudetz AG. Temporal circuit of macroscale dynamic brain activity supports human consciousness. Sci Adv. 2020 Mar;6(11):eaaz0087. https://doi.org/10.1126/sciadv.aaz0087 PMID:32195349
11. Cash SS, Halgren E, Dehghani N, Rossetti AO, Thesen T, Wang C, et al. The human K-complex represents an isolated cortical down-state. Science. 2009 May;324(5930):1084–7. https://doi.org/10.1126/science.1169626 PMID:19461004
12. Langsjo JW, Alkire MT, Kaskinoro K, et al. Returning from oblivion: imaging the neural core of consciousness. J Neurosci 2012; 32: 4935e43
13. Golkowski D, Ranft A, Kiel T, et al. Coherence of BOLD signal and electrical activity in the human brain during deep sevoflurane anesthesia. Brain Behav 2017; 7, e00679 27. https://doi.org/10.1002/brb3.679 .
14. Sepúlveda P, Cortinez LI, Irani M, Egaña JI, Contreras V, Sánchez Corzo A, et al. Differential frontal alpha oscillations and mechanisms underlying loss of consciousness: a comparison between slow and fast propofol infusion rates. Anaesthesia. 2020 Feb;75(2):196–201. https://doi.org/10.1111/anae.14885 PMID:31788791
15. Maciver MB, Bland BH (2014) Chaos analysis of EEG during isoflurane-induced loss of righting in rats. Front Sys Neurosci Front Syst Neurosci. 2014:16;8:203. https://doi.org/10.3389/fnsys.2014.00203..
16. Sepúlveda PO 5th, Carrasco E, Tapia LF, Ramos M, Cruz F, Conget P, et al. Evidence of hysteresis in propofol pharmacodynamics. Anaesthesia. 2018 Jan;73(1):40–8. https://doi.org/10.1111/anae.14009 PMID:28872658
17. McKinstry-Wu AR, Proekt A, Kelz MB. Neural Inertia: A Sticky Situation for Anesthesia. J Neurosurg Anesthesiol. 2020 Jul;32(3):190–2. https://doi.org/10.1097/ANA.0000000000000687 PMID:32349048
18. Stein-Ross D, Stein-Ross M, Sleight J, Wilson M, Guillies I, Wright J. The Sleep Cycle Modelled as a Cortical Phase Transition Journal of Biological Physics. 2005;31:547–69. PMID:23345918
19. Luppi AI, Spindler LR, Menon DK, Stamatakis EA. The inert brain: explaining neural inertia as post-anaesthetic sleep inertia. Front Neurosci. 2021 Mar;15:643871. https://doi.org/10.3389/fnins.2021.643871 PMID:33737863
20. Trotti LM. Waking up is the hardest thing I do all day: sleep inertia and sleep drunkenness. Sleep Med Rev. 2017 Oct;35:76–84. https://doi.org/10.1016/j.smrv.2016.08.005 PMID:27692973
21. Marzano C, Ferrara M, Mauro F, Moroni F, Gorgoni M, Tempesta D, et al. Recalling and forgetting dreams: theta and alpha oscillations during sleep predict subsequent dream recall. J Neurosci. 2011 May;31(18):6674–83. https://doi.org/10.1523/JNEUROSCI.0412-11.2011 PMID:21543596
22. Matchock RL, Mordkoff JT. Effects of sleep stage and sleep episode length on the alerting, orienting, and conflict components of attention. Exp Brain Res. 2014 Mar;232(3):811–20. https://doi.org/10.1007/s00221-013-3790-z PMID:24337231
23. Guarnieri B, Adorni F, Musicco M, Appollonio I, Bonanni E, Caffarra P, et al. Prevalence of sleep disturbances in mild cognitive impairment and dementing disorders: a multicenter Italian clinical cross-sectional study on 431 patients. Dement Geriatr Cogn Disord. 2012;33(1):50–8. https://doi.org/10.1159/000335363 PMID:22415141
24. Fleischmann R, Traenkner S, Kraft A, Schmidt S, Schreiber SJ, Brandt SA. Delirium is associated with frequency band specific dysconnectivity in intrinsic connectivity networks: preliminary evidence from a large retrospective pilot case-control study. Pilot Feasibility Stud. 2019 Jan;5(1):2. https://doi.org/10.1186/s40814-018-0388-z PMID:30631448
25. Hesse S, Kreuzer M, Hight D, Kreuzer M, Hight D, Gaskell A, Devari P, Singh D, Taylor NB, Whalin MK, Lee S Sleight JW, Garcia PS. Association of electroencephalogram trajectories during emergence from anaesthesia with delirium in the post-anaesthesia care unit: an early sign of postoperative complications. British Journal of Anaesthesia, 2019;122 (5): 622e634 doi.org/https://doi.org/10.1016/j.bja.2018.09.016..
26. Proekt A, Kelz MB. Explaining anaesthetic hysteresis with effect-site equilibration. Br J Anaesth. 2021 Jan;126(1):265–78. https://doi.org/10.1016/j.bja.2020.09.022 PMID:33081972
27. Kelso JA. Multistability and metastability: understanding dynamic coordination in the brain. Philos Trans R Soc Lond B Biol Sci. 2012 Apr;367(1591):906–18. https://doi.org/10.1098/rstb.2011.0351 PMID:22371613
28. Sepúlveda PO, Tapia LF, Monsalves S. Neural inertia and differences between loss of and recovery from consciousness during total intravenous anaesthesia: a narrative review. Anaesthesia. 2019 Jun;74(6):801–9. https://doi.org/10.1111/anae.14609 PMID:30835820
29. Róisín Ní Mhuircheartaigh, Catherine Warnaby, Richard Rogers, Saad Jbabdi, Irene Tracey. Slow-Wave Activity Saturation and Thalamocortical Isolation During Propofol Anesthesia in Humans. Sci Transl Med. 2013; 23;5(208):208ra148. https://doi.org/10.1126/scitranslmed.3006007..
30. Sepúlveda PO, Naranjo M. La electroencefalografía en anestesia, abriendo las mentes al futuro. Rev Esp Anestesiol Reanim (Engl Ed). 2019 Feb;66(2):59–61. https://doi.org/10.1016/j.redar.2018.11.002 PMID:30527951
31. Xu L, Wu AS, Yue Y. The incidence of intra-operative awareness during general anesthesia in China: a multi-center observational study. Acta Anaesthesiol Scand. 2009 Aug;53(7):873–82. https://doi.org/10.1111/j.1399-6576.2009.02016.x PMID:19496761
32. Leslie K, Skrzypek H, Paech MJ, Kurowski I, Whybrow T. Dreaming during anesthesia and anesthetic depth in elective surgery patients: a prospective cohort study. Anesthesiology. 2007 Jan;106(1):33–42. https://doi.org/10.1097/00000542-200701000-00010 PMID:17197843
33. Brandner B, Blagrove M, McCallum G, Bromley LM. Dreams, images and emotions associated with propofol anaesthesia. Anaesthesia. 1997 Aug;52(8):750–5. https://doi.org/10.1111/j.1365-2044.1997.161-az0171.x PMID:9291759
34. Leslie K, Myles PS, Forbes A, Chan MT, Swallow SK, Short TG. Dreaming during anaesthesia in patients at high risk of awareness. Anaesthesia. 2005 Mar;60(3):239–44. https://doi.org/10.1111/j.1365-2044.2004.04087.x PMID:15710008
35. Siclari F, Baird B, Perogamvros L, Bernardi G, LaRocque JJ, Riedner B, et al. The neural correlates of dreaming. Nat Neurosci. 2017 Jun;20(6):872–8. https://doi.org/10.1038/nn.4545 PMID:28394322
36. https://www.findcenter.com/video/34230/consciousness-perception-and-controlled-hallucinations-with-anil-seth
37. Pal D, Lipinski WJ, Walker AJ, Turner AM, Mashour GA. State-specific effects of sevoflurane anesthesia on sleep homeostasis: selective recovery of slow wave but not rapid eye movement sleep. Anesthesiology. 2011 Feb;114(2):302–10. https://doi.org/10.1097/ALN.0b013e318204e064 PMID:21239972
38. Tung A, Lynch JP, Mendelson WB. Prolonged sedation with propofol in the rat does not result in sleep deprivation. Anesth Analg. 2001 May;92(5):1232–6. https://doi.org/10.1097/00000539-200105000-00028 PMID:11323352
39. Tung A, Bergmann BM, Herrera S, Cao D, Mendelson WB. Recovery from sleep deprivation occurs during propofol anesthesia. Anesthesiology. 2004 Jun;100(6):1419–26. https://doi.org/10.1097/00000542-200406000-00014 PMID:15166561
40. Li N, Stanewsky R, Popay T, Warman G, Cheeseman J. The effect of general anaesthesia on circadian rhythms in behaviour and clock gene expression of Drosophila melanogaster. Clocks Sleep. 2020 Oct;2(4):434–41. https://doi.org/10.3390/clockssleep2040032 PMID:33113932
41. Nelson AB, Faraguna U, Tononi G, Cirelli C. Effects of anesthesia on the response to sleep deprivation. Sleep. 2010 Dec;33(12):1659–67. https://doi.org/10.1093/sleep/33.12.1659 PMID:21120128
42. Pick J, Chen Y, Moore JT, Sun Y, Wyner AJ, Friedman EB, et al. Rapid eye movement sleep debt accrues in mice exposed to volatile anesthetics. Anesthesiology. 2011 Oct;115(4):702–12. https://doi.org/10.1097/ALN.0b013e31822ddd72 PMID:21934405
43. Moote CA, Knill RL. Isoflurane anesthesia causes a transient alteration in nocturnal sleep. Anesthesiology. 1988 Sep;69(3):327–31. https://doi.org/10.1097/00000542-198809000-00007 PMID:3415013
44. Rosenberg-Adamsen S, Kehlet H, Dodds C, Rosenberg J. Postoperative sleep disturbances: mechanisms and clinical implications. Br J Anaesth. 1996 Apr;76(4):552–9. https://doi.org/10.1093/bja/76.4.552 PMID:8652329
45. Bell RF, Dahl JB, Moore RA, Kalso E. Perioperative ketamine for acute postoperative pain. Cochrane Database Syst Rev. 2006 Jan;(1):CD004603. PMID:16437490
46. Brimacombe J, Macfie AG. Peri-operative nightmares in surgical patients. Anaesthesia. 1993 Jun;48(6):527–9. https://doi.org/10.1111/j.1365-2044.1993.tb07078.x PMID:8322996
47. Su X, Wang DX. Improve postoperative sleep: what can we do? Curr Opin Anaesthesiol. 2018 Feb;31(1):83–8. https://doi.org/10.1097/ACO.0000000000000538 PMID:29120927
48. Rampes S, Ma K, Divecha YA, Alam A, Ma D. Postoperative sleep disorders and their potential impacts on surgical outcomes. J Biomed Res. 2019 Aug;34(4):271–80. https://doi.org/10.7555/JBR.33.20190054 PMID:32519977
49. Vacas S, Degos V, Maze M. Fragmented Sleep Enhances Postoperative Neuroinflammation but Not Cognitive Dysfunction. Anesth Analg. 2017 Jan;124(1):270–6. https://doi.org/10.1213/ANE.0000000000001675 PMID:27755058
50. Safavynia SA, Goldstein PA. The Role of Neuroinflammation in Postoperative Cognitive Dysfunction: Moving From Hypothesis to Treatment. Front Psychiatry. 2019 Jan;9:752. https://doi.org/10.3389/fpsyt.2018.00752 PMID:30705643
51. Hillman DR. Sleep Loss in the Hospitalized Patient and Its Influence on Recovery From Illness and Operation. Anesth Analg. 2021 May;132(5):1314–20. https://doi.org/10.1213/ANE.0000000000005323 PMID:33857973

 ORCID
ORCID