Sergio Cerda San Martín1,*
Recibido: 14-09-2022
Aceptado: 16-09-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 6 pp. 716-724|https://doi.org/10.25237/revchilanestv5103101449
PDF|ePub|RIS
Intratecal morphine in cesarian section
Abstract
The Cesarean section is the most frequently performed surgical intervention in most countries, in Chile there are approximately 80,000 cases per year. In the postoperative period, effective analgesia is essential since patients define the absence of intra- and post-cesarean pain as priorities[]. On the other hand, entities such as cronical pain and postpartum depression have been associated with persistent postoperative pain and difficulty in mother-child interaction[]. Intrathecal morphine (ITM) was first described in obstetric analgesia in the 1980s and has since become widely used for post-cesarean section analgesia due to its prolonged analgesic action. In this review we will focus on the most relevant aspects that may lead to the incorporation of MIT in the Analgesia protocols for Cesarean section in our country.
Resumen
La Operación Cesárea es la intervención quirúrgica más frecuentemente realizada en la mayoría de los países, en Chile son aproximadamente 80.000 casos por año. En su posoperatorio la analgesia eficaz es fundamental, dado que las pacientes definen la ausencia de dolor intra y poscesárea como prioritarios[]. Por otra parte, entidades como dolor cónico y depresión posparto han sido asociados con dolor posoperatorio persistente y dificultad en la interacción madre-hijo[]. La morfina intratecal (MIT) se describió por primera vez en analgesia obstétrica en la década de 1980 y desde entonces se ha vuelto ampliamente utilizada para la analgesia poscesárea debido a su prolongada acción analgésica. En esta revisión nos centraremos en los aspectos más relevantes que puedan conducir a la incorporación de MIT en los protocolos de Analgesia para Cesárea en nuestro país.
-
Analgesia
-
I .- Eficacia analgésica
Si asumimos que la vía espinal es la técnica más frecuentemente elegida para anestesia en cesárea, se facilita la administración de una dosis única de MIT. Diferentes estudios han demostrado analgesia de calidad superior y larga duración para opioides neuraxiales comparado con su administración por via parenteral (ej PCA)[3],[4]. Por otra parte, una dosis de MIT actúa como el componente central de un esquema de analgesia multimodal, con paracetamol y AINEs (antiiflamatorios no esteroidales) asociados.
La latencia de acción de MIT es más rápida que la de morfina epidural[5], dado que alcanza una alta concentración en LCR y la distancia de difusión hasta el sitio objetivo es mínima. Sin embargo, la eficacia analgésica, duración de acción y efectos adversos son equivalentes entre ambas vías.
-
II .- Duración de analgesia
Esta es la principal variable que respalda la utilización de MIT poscesárea. Debido a su carácter hidrofílico, se alcanzan altas concentraciones de morfina en el líquido extracelular de la sustancia gris medular, aumentando la biodisponibilidad para analgesia de larga duración comparado con opioides lipofíli-
cos[6]. Además, la absorción de morfina desde el espacio in- tratecal es considerablemente más lenta comparada con la del espacio epidural (mayor vascularización). Ambas variables aumentan el tiempo de residencia y explican la extensa duración de acción analgésica, de 14 a 36 h. Distintos estudios encuentran que el tiempo a la primera solicitud de analgésicos poscesárea, expresado como mediana de tiempo hasta la primera solicitud de analgésicos es de 27 h (rango 11 a 29 h)[7]
Distintos estudios y metaanálisis recientes demuestran que la duración de analgesia con MIT exhibe un comportamiento dosis respuesta[8],[9],[10].
-
III.- Dosis MIT
Desde el estudio señero de Palmer[9], se avanzó en la hipótesis de un efecto techo (ceiling) con dosis de MIT mayores de 75 mcg. Es decir, dosis mayores , hasta 500 mcg no diferían significativamente en consumo de morfina en PCA intravenosa y solo aumentaban los efectos adversos. Estudios similares , contemporáneos al de Palmer coinciden en esos resultados con dosis mayores de 100 mcg MIT[11],[12] (Figura 1).
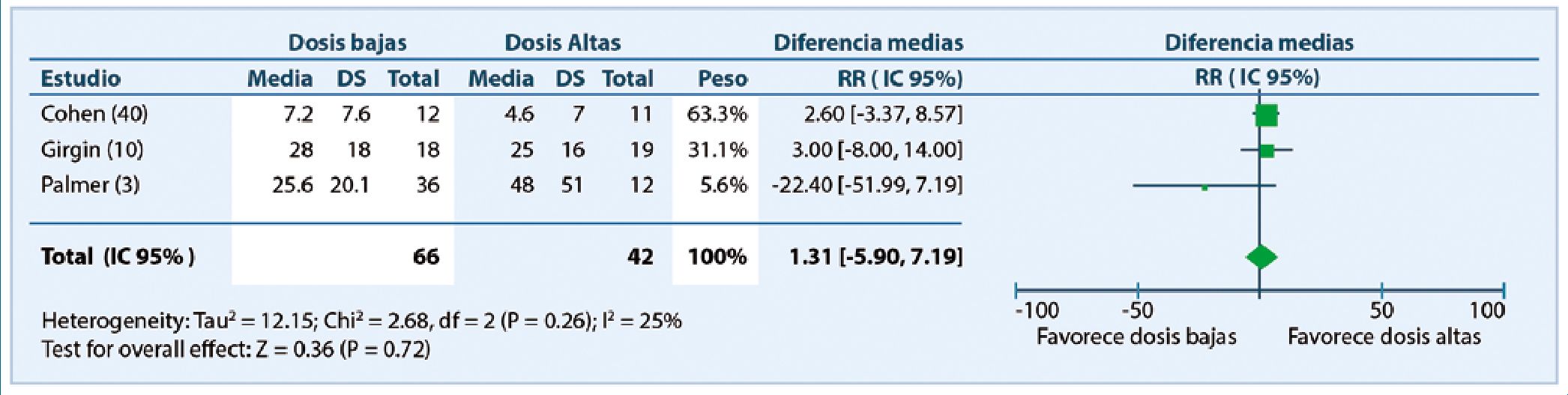
Figura 1. Consumo de morfina (PCA) /24 h. Reproducido de Sultan P, Halpern SH, Pushpanathan E, et al. The effect of intratethecal morphine dose on outcomes after elective cesarean delivery: a meta-analysis. Anesth Analg. 2016;123:154-64.
Se han realizado múltiples estudios de dosis-respuesta para dilucidar la dosis óptima de MIT para analgesia por cesá- rea[13],[14]. La mayoría de los estudios no demuestran beneficio adicional en score de dolor o en el uso de opioides IV para el dolor irruptivo (breaktrough pain) usando dosis analgésicas mayores de 75-100 mcg[15],[16].
También se ha podido demostrar que en combinación con AINEs IV, dosis ultrabajas de 25-50 mcg pueden proveer analgesia comparable, pero de menor duración que 100-150 mcg de MIT, respectivamente[17].
En nuestro hospital, iniciamos MIT primero en histerecto- mía abdominal[18], y luego a partir de 2001 en cesárea. En el primer estudio, comparando dosis de 0-50-100 y 150 mcg de MIT observamos dosis dependencia en analgesia evaluada en reposo (EVA 12- 24 h) y funcional (EVA dinámico 24-36 h) y también en efectos adversos, por lo que se eligió dosis 100 mcg MIT como pilar de un esquema de analgesia multimodal en cesárea.
Aunque las relaciones dosis-respuesta se han descrito después de la administración epidural de morfina, la evidencia es contradictoria acerca de la relación dosis-respuesta de MIT y eficacia analgésica.
Es así que aún no se ha determinado la dosis de MIT que provea analgesia óptima en cesárea, minimizando los efectos secundarios. Quizás si la mejor aproximación es el metaanálisis publicado por Sultan y colaboradores[8], comparando MIT en dosis baja o altas. Específicamente, se comparó el tiempo desde la inyección de MIT hasta la primera solicitud de suplemento analgésico en pacientes que recibieron dosis bajas (50-100 mcg) con los que recibieron dosis altas ( > 100-250 mcg). El tiempo a la primera solicitud de analgesia fué 4,5 h, mayor en el grupo de dosis altas. El rango de tiempo de analgesia en el grupo de dosis altas fué 13,8 – 39,5 h comparado con 9,7 – 26,6 h en el grupo de dosis bajas. Con el aumento de la duración analgésica en grupo de dosis altas , eran esperables diferencias en dolor (EVA) y consumo de morfina entre ambos grupos, sin embargo, no se encontraron diferencias en score de dolor a 12 y 24 h consumo de morfina a las 24 h (Figura 2).
Este fenómeno se repite también en estudios de Carvalho y Flood[19],[20] en que se ofrece a la paciente elegir la dosis de MIT a administrar en su cesárea. Como resultado, se concluye que las pacientes tienen una idea de sus necesidades analgésicas de tal manera que a las que se les ofrece una opción y eligieron el protocolo de dosis MIT más alta, tuvieron mayores requerimientos de oxicodona posoperatorio, y aquellos que eligieron dosis MIT más bajas requirieron menos. En suma, la decisión no afecta el consumo de oxicodona, el dolor posoperatorio o los efectos secundarios relacionados con MIT, pero parece mejorar la satisfacción y, por lo tanto, puede valer la pena considerar la elección de dosis como una opción estándar cuando se utiliza MIT en analgesia poscesárea.
Aunque la mayoría de las pacientes eligieron el protocolo de dosis MIT medio, se encontró en el estudio que aproximadamente un tercio de los pacientes prefieren un cambio respecto del protocolo de rutina. La selección por el paciente de dosis MIT altas o bajas es más comúnmente impulsada por preocupaciones relacionadas con aversión al dolor y a los efectos secundarios, lo que sugiere que estas variables deben abordarse en la entrevista preanestésica y pueden compensar la variabilidad interindividual de respuesta analgésica.
-
Efectos adversos
-
I.- Prurito
Un efecto secundario informado con frecuencia es prurito.
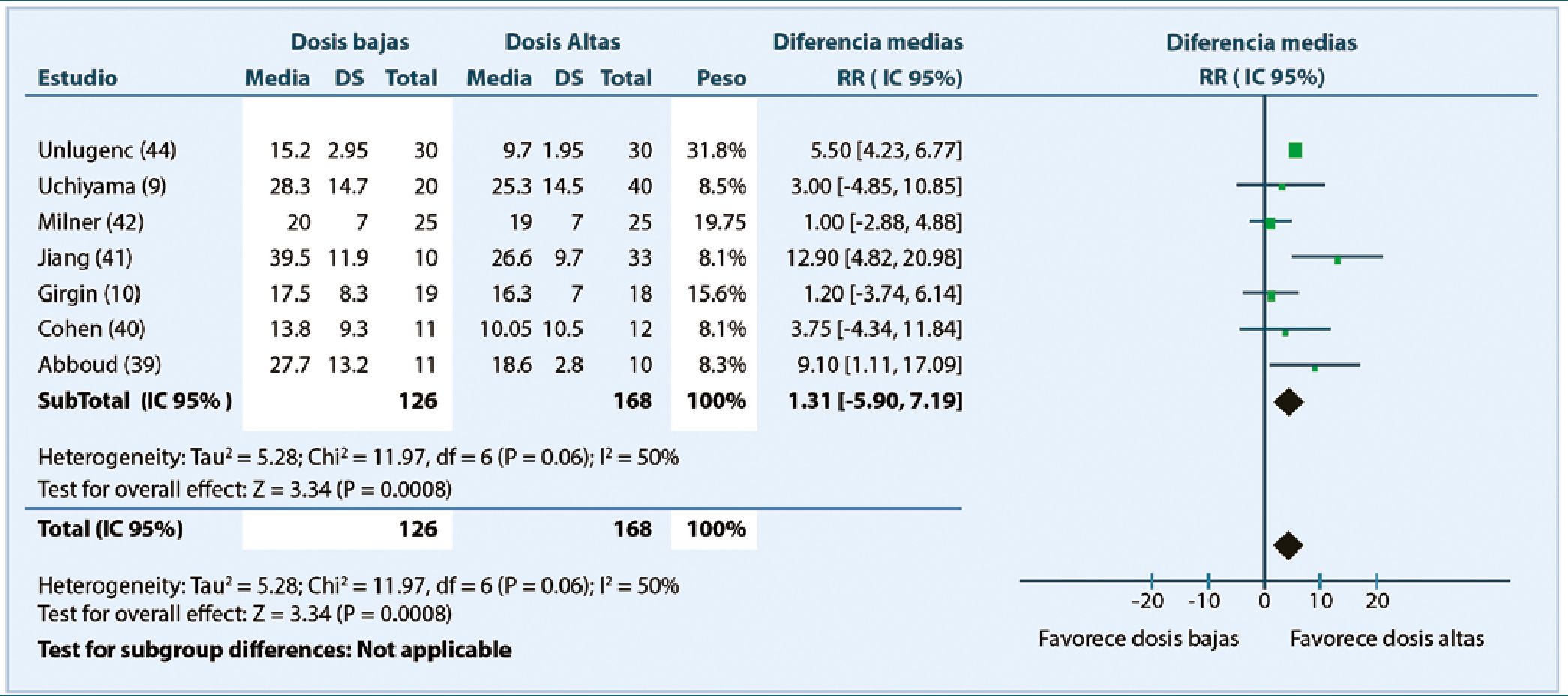
Figura 2. Tiempo de 1a solicitud de analgesia. Reproducido de Sultan P, Halpern SH, Pushpanathan E, et al. The effect of intratethecal morphine dose on outcomes after elective cesarean delivery: a meta-analysis. Anesth Analg. 2016;123:154-64.
Dependiendo de las características quirúrgicas y del paciente, se estima que del 30% al 60% de los pacientes de cirugía general y hasta el 100% de las pacientes poscesárea presentan prurito tras la administración neuroaxial de opioides[21],[22]. En ocasiones puede ser percibido como algo peor que el dolor, que provoca intensa incomodidad intensa. El nivel máximo de intensidad ocurre 6 a 9 h después de la administración de MIT y varía de leve a severo en los pacientes que solicitan tratamiento.
El mecanismo del prurito inducido por opioides neuraxiales aún no está definido. Se han sugerido múltiples mecanismos , entre estos la modulación de las vías serotoninérgicas. La sero- tonina contribuye a la sensibilización periférica e hiperalgesia. Un estudio reciente revela un aumento dosis dependiente de serotonina y prurito después de MIT apoyando la hipótesis de que la vía serotoninérgica es esencial en este efecto adverso.
Los antagonistas del receptor 5HT3 tienen un efecto anti- serotoninérgico y se utilizan con frecuencia para prevenir náuseas y vómitos posoperatorios.
Otra vía podría ser a través de receptores opioides p (mu) de acción central y periférica.
Un metaanálisis[8] reporta dosis dependencia para la presentación de prurito. La incidencia fué menor con dosis de 50100 mcg que con dosis mayores (RR 0,34 [IC 95% 0,20-0,59]) (Figura 3).
Una extensa revisión de prevención y tratamiento del prurito inducido por opioides neuraxiales[23] concluye que los antagonistas de la dopamina (droperidol) y los agonistas/antago- nistas de opioides (mixtos) lo previenen eficazmente. Cuando se administran antes de morfina neuraxial, los antagonistas de 5HT3 también muestran un excelente efecto profiláctico. Solo 33% de los estudios en que se administró antagonistas 5HT3 al mismo tiempo o después de morfina neuraxial mostraron eficacia. Esto sugiere una modulación irreversible de las vías serotoninérgicas causada por la morfina al ser administrada vía neuraxial.
Es así que según la evidencia actual: droperidol, nalbufina u ondansetrón IV (antes de la administración de MIT) se pueden utilizar para prevenir y nalbufina IV se puede usar para tratar el prurito inducido por morfina neuroaxial. La evidencia sugiere que el prurito después de morfina neuroaxial no es causado por reacción alérgica o liberación de histamina, pero los antihista- mínicos aún se usan con frecuencia como tratamiento.
Otros grupos farmacológicos no fueron consistentemente efectivos y no se recomiendan para prevenir o tratar el prurito inducido por morfina neuraxial.
-
II. Náuseas y vómitos
Se ha reportado[8] que las probabilidades de presentar náuseas o vómitos con MIT muestran también dosis dependencia, favoreciendo el uso de dosis bajas de morfina neuraxial. (RR 0,44 [IC 95% 0,27-0,73]).
-
III. Depresión respiratoria
Este es un efecto secundario reconocido de morfina neura- xial en el entorno perioperatorio, ocurre con menos frecuencia en comparación con otros efectos adversos, pero puede tener consecuencias fatales
Anteriormente, se pensaba que la depresión respiratoria era el resultado de la interacción de opioides en el líquido cefalorraquídeo con receptores opioides medulares ventrales.
Las neuronas del complejo pre-Botzinger, una subregión de la médula ventrolateral, son responsables de controlar las funciones neuronales autonómicas, incluida la respiración normal, estas neuronas expresan una variedad de receptores que incluyen neuroquinina-1, serotonina (5-HT) y receptor opioide mu. La inhibición de las neuronas que generan el ritmo de la respiración en el complejo pre-Botzinger causa disminución de la frecuencia respiratoria después de la administración sistémica de opioides.
Los opioides neuroaxiales pueden causar depresión respiratoria tanto por mecanismos directos e indirectos, y el momento de inicio de la depresión de la respiración puede ser: temprano, bifásico y tardío. Depresión respiratoria de inicio temprano, específicamente, reducción respuesta ventilatoria a la hipoxia, podría ocurrir entre 30 y 90 minutos después de la inyección debido a la rápida vascular absorción del opioide, pero esto es poco probable con dosis bajas de MIT utilizadas en la práctica moderna.
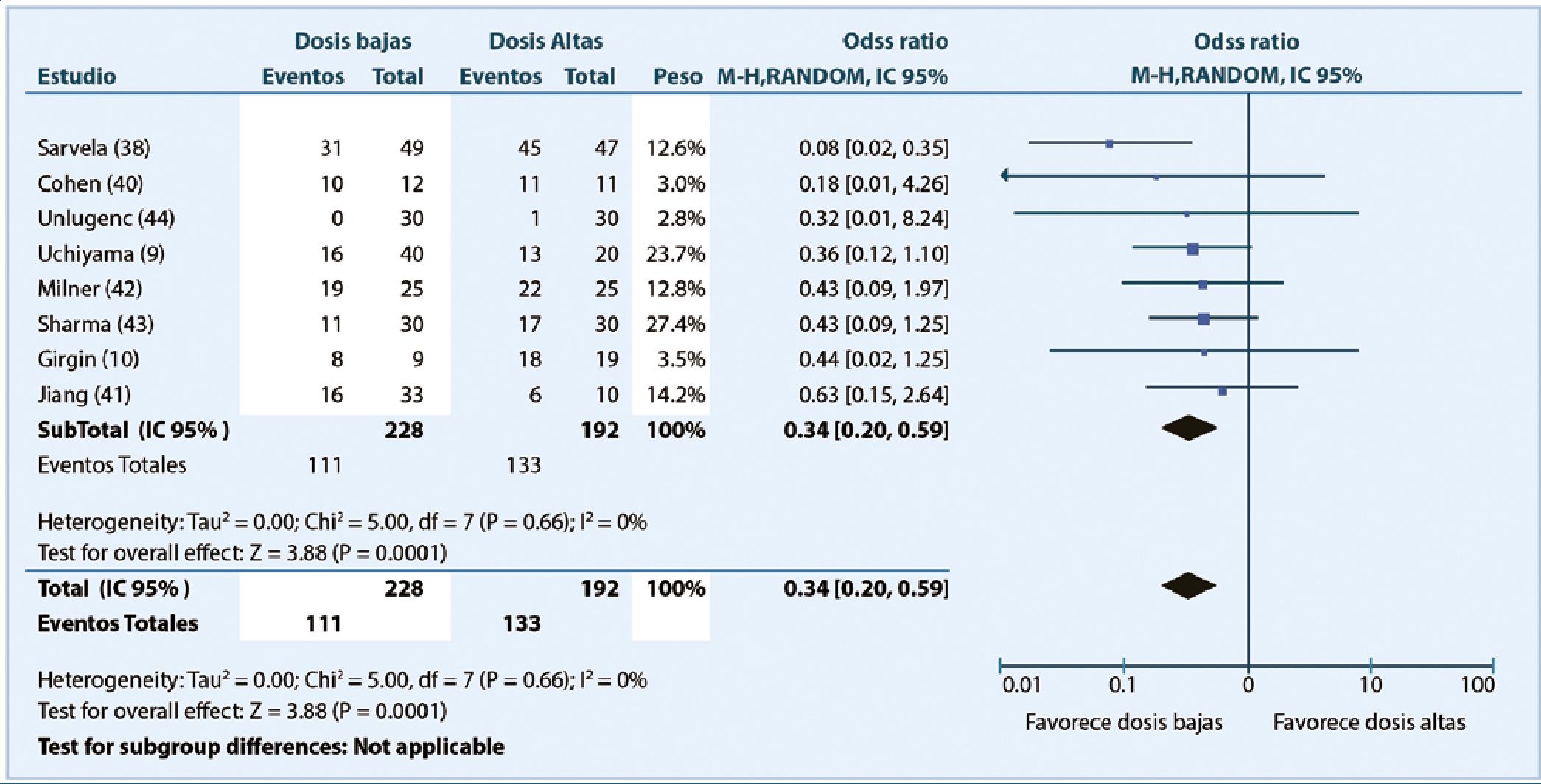
Figura 3. Prurito y MIT. Reproducido de Sultan P, Halpern SH, Pushpanathan E, et al. The effect of intratethecal morphine dose on outcomes after elective cesarean delivery: a meta-analysis. Anesth Analg. 2016;123:154-64.
Depresión del impulso ventilatorio, 6 a 18 h después de morfina neuraxial, puede ocurrir debido a la diseminación rostral a través del LCR, con efecto máximo entre 6,5 y 7,5 h después de su administración. La depresión tardía es menos probable con MIT comparado con morfina epidural en que la captación en LCR aparece desde los 90 minutos.
Al inicio de la administración de opioides neuraxiales, Cou- sins et al.[24], sugerían que era más probable que MIT causara depresión respiratoria tardía que la morfina epidural, sin embargo, este hecho probablemente reflejaba el uso de dosis más altas de MIT (1-5 mg) reportadas en los primeros estudios clínicos[25]. La reducción de la dosis de morfina neuroaxial reduce su efecto depresor respiratorio[26],[27]. Un metaanálisis realizado por Gehling[28] de poblaciones mixtas obstétricas y no obstétricas (28 estudios; n = 790) buscó determinar efectos adversos de MIT. Concluyeron que dosis más altas (> 300 mcg) se asociaron con alta frecuencia de depresión respiratoria, 9% (7/80) en comparación a dosis más bajas (< 300 mcg) 1% (2/247), aunque no alcanzó significación estadística.
En el metaanálisis más reciente[8] se evaluó los efectos en frecuencia respiratoria de dosis bajas 50-100 mcg y dosis más altas 100-250 mcg de MIT en cesárea electiva. Se incluyeron 8 estudios controlados aleatorios, bajo una amplia variedad de definiciones de Depresión Respiratoria, hasta 24 h poscesárea No hubo episodios de depresión respiratoria, sin embargo, por limitado número de pacientes incluidas, este estudio puede carecer de potencia en la detección de este fenómeno.
Los estudios que investigan MIT en dosis bajas han tenido también poca potencia para detectar diferencias en esta rara complicación que es la depresión respiratoria.
Como corolario todos los estudios apuntan a administrar la dosis efectiva más baja de MIT para minimizar los efectos secundarios y posiblemente el riesgo de depresión respiratoria.
La prevalencia de depresión respiratoria clínicamente significativa después de morfina o diamorfina neuraxial en población obstétrica fue evaluada por Sharawi[28] reportando un rango de 5,96-8,67 por 10.000 considerando TODAS las dosis administradas. Con una sola dosis baja de MIT, de acuerdo a la práctica actual, dicha prevalencia es aún más baja, con un rango de 1,08-1,63 por 10.000.
Esta estimación de riesgo puede presentarse al obtener el consentimiento informado en la evaluación anestésica previa a cesárea, destacando el beneficio analgésico por sobre la mínima incidencia de una complicación grave, como es la depresión respiratoria clínicamente significativa.
La variación en incidencia y severidad reportadas se debe en parte importante a la heterogeneidad para definir depresión respiratoria. Varía entre los estudios con criterios que incluyen frecuencia respiratoria baja, hipercapnia e hipoxemia. Un síntoma acompañante es la somnolencia, que se asocia con aumento del riesgo de depresión respiratoria.
Una serie publicada recientemente[28], con casos de administración por error de dosis altas de MIT (rangos entre 3.0005.000 mcg), y una revisión de 63 casos con efectos adversos severos, demuestra que los síntomas varían en severidad y tiempo. Dosis menores 900 mcg indujeron depresión respiratoria que generaba riesgo vital solo cuando se asoció a fármacos que potenciaban su acción sobre SNC. Resultados adversos potencialmente mortales se asociaron con dosis superiores a 1.000 mcg.
En esta revisión también se demuestra que la aparición de los síntomas no siempre es tardía, y puede aparecer inmediatamente poscirugía. Esta forma es inesperadamente rápida, considerando que la morfina se inyecta a nivel lumbar y requiere extensión rostral a nivel supraespinal para inducir depresión respiratoria clínicamente significativa. El 70% de los pacientes respondieron bien solo a naloxona, siendo a veces necesaria una infusión continua. Ninguno de estos pacientes tuvieron secuelas de largo plazo. La terapia de soporte vital es raramente requerida.
El uso de dosis bajas de naloxona antagoniza la depresión respiratoria y la somnolencia sin afectar la analgesia. El mecanismo propuesto para este fenómeno es que la concentración de morfina es más alta alrededor del sitio de inyección (sustancia gris de médula lumbar), por lo que se requeriría una mayor concentración de naloxona en ese territorio , cuyo flujo plasmático es mínimo[29], comparado con la oferta de antagonista al territorio supraespinal.
Aludiendo al origen anatómico de la depresión respiratoria en la zona pre-Boetzinger, se ha identificado moléculas ampa- kinas que revierten la depresión ventilatoria inducida por opioi- des en humanos, sin revertir el efecto analgésico, lo que es una alternativa prometedora a futuro[30].
Sugerimos evitar altas dosis de MIT y el uso concomitante otros depresores de SNC para reducir el riesgo de depresión respiratoria potencialmente mortal.
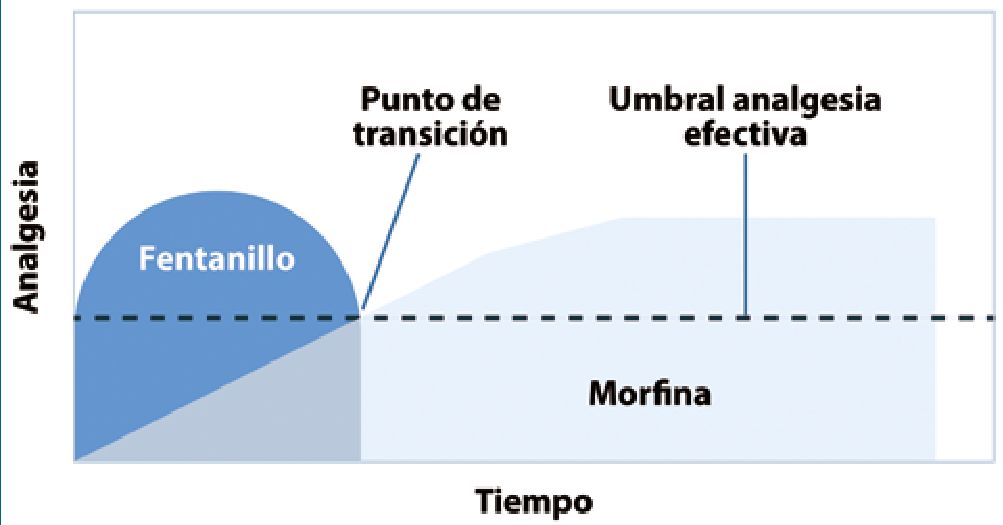
Figura 4. Morfina y fentanilo intratecal. Reproducido de Chestnuts Obsetric Anesthesia Sixth Edition fig 26-3, pag 584, Part VII: Cesarean Delivery.
-
Formas de administración y dilución de MIT
-
I. Administración opioides IT
Es actualmente aceptada, la adición intratecal de un opioide lipofílico y uno hidrofílico al anestésico local en anestesia espinal para cesárea. Se aprovecha el inicio rápido de acción del liposoluble y la duración prolongada del hidrosoluble.
Una ventaja adicional de la administración intratecal de fentanilo en dosis 10-25 mcg en cesárea es su efecto en reducir la incidencia de nauseas y vómitos intraoperatorios durante los períodos de estimulación visceral (exteriorización uterina , y cierre peritoneal). Morfina intratecal puede mejorar la analgesia intraoperatoria, pero tiene una latencia de 30 a 60 minutos por lo que es principalmente utilizada para proveer analgesia prolongada (12 a 24 h) con perfiles aceptables de efectos secundarios en dosis entre 50-150 mcg. Por otra parte, la adición de morfina intratecal, además de proveer analgesia posoperatoria efectiva y prolongada ,reduce significativamente el área de hiperalgesia primaria alrededor de la cicatriz, fenómeno considerado protector de dolor persistente y eventualmente dolor crónico poscesárea[31].
Sin embargo, existe evidencia limitada de que al administrar por via intratecal un opioide liposoluble y un hidrosoluble induciría tolerancia espinal aguda a los opioides[32]. En este estudio la puntuación de dolor posoperatorio fué mayor en las pacientes que recibieron sólo fentanilo, pero no se observaron diferencias entre los grupos en el consumo de morfina en PCA IV. Las mujeres que no recibieron fentanilo tuvieron una mayor incidencia de náuseas y vómitos intraoperatorios, lo que sugiere que el fentanilo es un complemento importante para la anestesia intraoperatoria[33]. Es así que una mejor analgesia intra Cesárea supera el potencial de tolerancia aguda a los opioides esbozado (Figura 4).
-
II. Precisión de dosis administrada
De acuerdo a lo expuesto respecto de efectos adversos menores y depresión respiratoria clínicamente significativa, que exhiben un comportamiento dosis-respuesta, la precisión de la dosis de morfina administrada es un factor esencial para la seguridad clínica. Las soluciones diluidas de morfina (ej Dimorf 200 mcg/ml) no están disponibles en nuestro país, lo que obliga a preparar la dosis a partir de una ampolla de 10 mg/ml. Este proceso puede ser inexacto e impreciso, contribuyendo a la variabilidad en respuesta analgésica y en los riesgos descritos. En el estudio de Baker et al.[34], un grupo de 20 anestesistas prepararon dosis de 100 mcg a partir de ampolla de 10 mg/ml utilizando 2 técnicas, la primera consistió en una sola dilución a 10 ml, obteniendo 0,1 ml con jeringa de tuberculina y la segunda con doble dilución a 10 ml. En el primer caso se obtiene una media de 113 mcg (83-120) y en el segundo caso una media de 143 mcg (52-199) alcanzando P = 0,047, sin embargo, los datos revelan una amplia varianza (Figura 5).
Un segundo estudio, más reciente[35] comparó 5 formas de obtener 100 mcg, incorporando en 4 de ellas la agitación manual de la jeringa por 1 minuto para homogenizar la dilución, y determinando que en distintas muestras obtenidas en segmentos de la jeringa y la concentración de morfina medida en HPLC es similar entre ellos.
En nuestro Servicio utilizamos una mezcla de ambos procesos y las concentraciones de morfina medidas en 37 muestras (HPLC) oscilan entre 83-121 mcg, estando en el rango de las 100 mcg definidos como dosis MIT en cesárea.
Como recomendación, después de más de 26.000 administraciones de MIT en Cesárea y Cirugía Ginecológica, éste es EL paso esencial en asegurar adecuada analgesia y limitar el riesgo de depresión respiratoria. Conocer el proceso de dilución y realizarlo sin innovar, rutinariamente siguiendo todas las etapas. Es esencial que todos los opioides utilizados por vía neuraxial sean extraídos con jeringa de tuberculina para asegurar la precisión del volumen(dosis) a administrar.
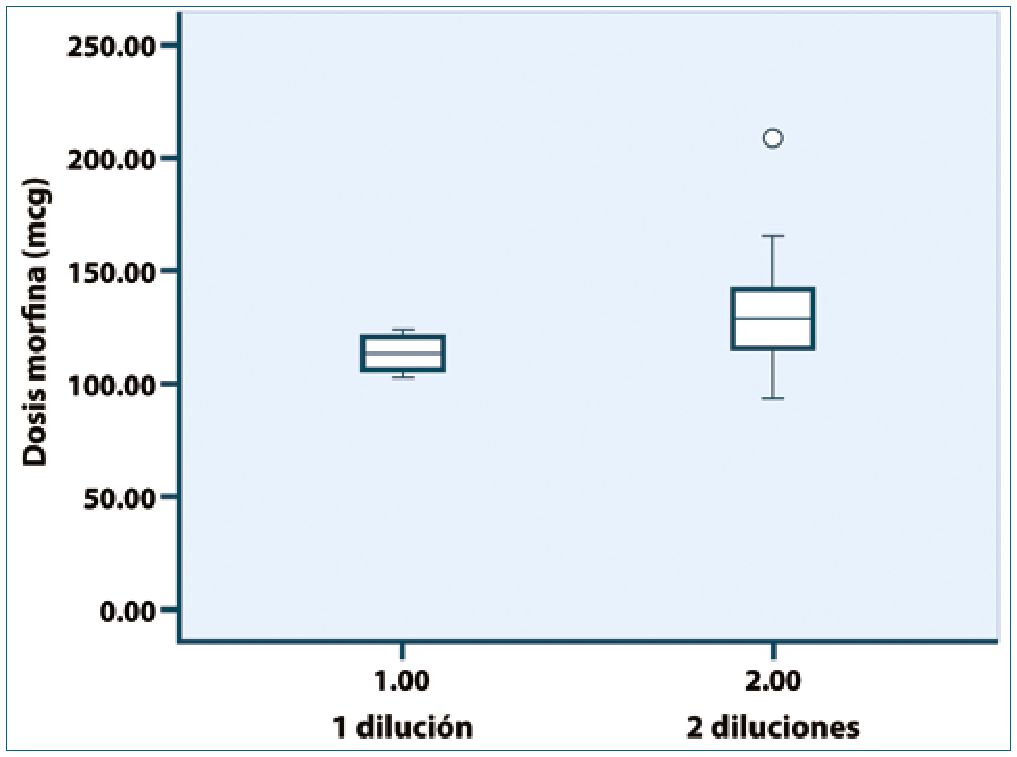
Figura 5. Presición de dilución-dosis. Reproducido de Baker AR, Ruther- ford DM, Myles PS. Accuracy of dilution of morphine for intrathecal use; Anaesth Intensuve Care: 2007;35:378-81.
-
Protocolos de utilización segura de morfina neuraxial
La mayoría de las mujeres que se someten a cesárea en los Estados Unidos reciben morfina neuroaxial, considerada la forma más efectiva de analgesia posoperatoria para esta cirugía.
La Sociedad Americana de Anestesiólogos (ASA) y la Sociedad Americana de Anestesia Regional y Medicina del Dolor (ASRA)[36] han recomendado estándares de monitorización respiratoria después de la administración de morfina neuroaxial en la población quirúrgica general que pueden ser demasiado frecuentes e intensivos cuando se aplican a población obstetrica sana. Estas pautas no distinguen entre pacientes que reciben morfina neuroaxial dosis única poscesárea y la población de cirugía general que recibe morfina neuroaxial para la analgesia postoperatoria. Muchos autores estiman que las pautas ASA/ ASRA de monitorización postoperatoria de analgesia opioide neuroaxial son demasiado rigurosas para aplicarse en población obstétrica sana, en la que el riesgo de depresión respiratoria con morfina neuroaxial en dosis bajas es mínimo comparado con pacientes mayores y/o con patologías concomitantes. Bajo este prisma la adhesión irrestricta a estas guías ASA/ASRA puede limitar la utilización de un recurso analgésico altamente efectivo.
La Sociedad de Anestesia Obstétrica y Perinatología (SOAP) propendiendo al bienestar del binomio materno fetal en el período periparto convocó a un grupo de trabajo para recomendar estrategias de prevención y detección de depresión respiratoria asociada con morfina neuroaxial en Cesárea y colaborar en difundir su utilización de forma segura[37]. Este consenso se construye con los siguientes hallazgos con respaldo en evidencia médica:
• Morfina neuraxial proporciona analgesia superior comparada a la de opioides vía sistémica y debe utilizarse en forma preferente en analgesia poscesárea.
• Opioides neuraxiales se han administrado con seguridad a millones de mujeres en cesárea. Reportes de literatura o registros de morbimortalidad severa en población obstétrica sana por depresión respiratoria son extremadamente raros.
• Existe evidencia limitada para apoyar/guiar la modalidad, frecuencia y duración óptimas de monitoreo respiratorio requerido para detectar/prevenir eventos respiratorios adversos con morfina neuraxial en analgesia poscesárea.
• El monitoreo debe ajustarse apropiadamente para pacientes con comorbilidades que predisponen a la depresión respiratoria.
• La vigilancia puede ser intrusiva, molestar interrumpir el sueño, aumentar la carga de trabajo y afectar la asignación de recursos sin mejorar la seguridad.
Los miembros del grupo de trabajo están de acuerdo en que la frecuencia y modalidad de monitorización respiratoria debe basarse en dosis de morfina neuroaxial administrada, entorno clínico y estratificación de riesgo del paciente.
Todos estos factores son incorporados en el algoritmo de monitorización respiratoria poscesárea bajo analgesia con morfina neuraxial (Figura 6).
-
Analgesia en protocolos de recuperación acelerada (ERAS) en cesárea
La provisión de analgesia posoperatoria adecuada es una parte integral de los protocolos ERAS en mujeres sometidas a cesárea.
La analgesia subóptima se asocia con una recuperación funcional retardada, movilización retrasada que podría aumentar el riesgo de tromboembolismo, pobre vínculo materno con el recién nacido, dificultades para amamantar, aumento del riesgo de dolor persistente y depresión posparto. Respecto de la analgesia se describen los siguientes objetivos:
• Minimizar la utilización de opioides sistémicos poscesárea y prescribir opioides posalta de forma individualizada, estratificados para reducir consumo innecesario de opioides después de cesárea electiva.
• Utilizar MIT 50-100 mcg en anestesia espinal o 2-3 mg morfina epidural.
• Prescribir paracetamol y/o AINEs a intervalos regulares.
Varios protocolos ERAS[37],[38],[39],[40] desarrollados en distintos países y descritos en la literatura actual describen la utilización de morfina neuraxial como un componente esencial para lograr los objetivos deseados e incidir en la calidad del postoperatorio en cesárea.
-
Conclusiones
Pocas intervenciones en anestesia permiten proporcionar, en un procedimiento único, condiciones de anestesia y analgesia de calidad, simple, económica y con una relación riesgo/ beneficio ampliamente favorable. El entorno obstétrico, de pacientes sanas, es escenario propicio para iniciar su implementación, y luego, eventualmente extenderlo a otras áreas quirúrgicas, donde la experticia obtenida y la aplicación de cuidados
posoperatorios estratificados al riesgo de cada paciente permitirán mejorar la calidad de cuidados y resultados posoperatorios.
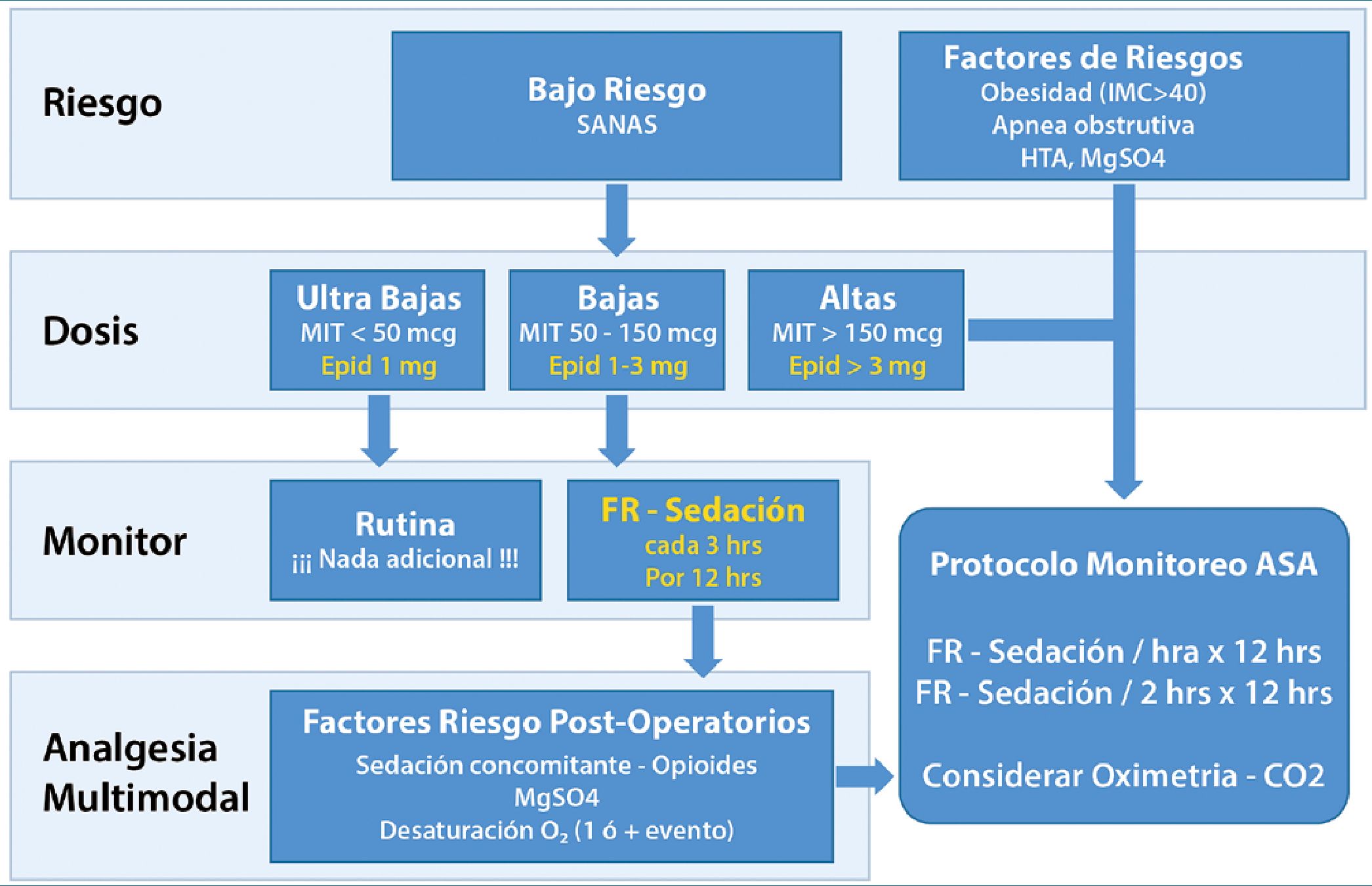
Figura 6. Algoritmo SOAT morfina neuraxial en analgesia poscesárea. Reproducido de Society for Obstetric Anesthesia and Perinatology Consensus Statement: Monitoring Recommendation for Prevention and Detection of Respiratory Depression Associated with Administration of Nueroaxial Mor- phine for Cesarean Delivery Analgesia. Anesth Analg 2019;129:458-74.
Referencias
1. Carvalho B, Cohen SE, Lipman SS, Fuller A, Mathusamy AD, Macario A. Patient preferences for anesthesia outcomes associated with cesarean delivery. Anesth Analg. 2005 Oct;101(4):1182–7. https://doi.org/10.1213/01.ane.0000167774.36833.99 PMID:16192541
2. Eisenach JC, Pan PH, Smiley R, Lavand’homme P, Landau R, Houle TT. Severity of acute pain after childbirth, but not type of delivery, predicts persistent pain and postpartum depression. Pain. 2008 Nov;140(1):87–94. https://doi.org/10.1016/j.pain.2008.07.011 PMID:18818022
3. Lim Y, Jha S, Sia AT, Rawal N. Morphine for post-caesarean section analgesia: intrathecal, epidural or intravenous? Singapore Med J. 2005 Aug;46(8):392–6. PMID:16049608
4. Harrison DM, Sinatra R, Morgese L, Chung JH. Epidural narcotic and patient-controlled analgesia for post-cesarean section pain relief. Anesthesiology. 1988 Mar;68(3):454–7. https://doi.org/10.1097/00000542-198803000-00025 PMID:3278653
5. Dualé C, Frey C, Bolandard F, Barrière A, Schoeffler P. Epidural versus intrathecal morphine for postoperative analgesia after Caesarean section. Br J Anaesth. 2003 Nov;91(5):690–4. https://doi.org/10.1093/bja/aeg249 PMID:14570792
6. Bernards CM, Shen DD, Sterling ES, Adkins JE, Risler L, Phillips B, et al. Epidural, cerebrospinal fluid, and plasma pharmacokinetics of epidural opioids (part 1): differences among opioids. Anesthesiology. 2003 Aug;99(2):455–65. https://doi.org/10.1097/00000542-200308000-00029 PMID:12883420
7. Dahl JB, Jeppesen IS, Jørgensen H, Wetterslev J, Møiniche S. Intraoperative and postoperative analgesic efficacy and adverse effects of intrathecal opioids in patients undergoing cesarean section with spinal anesthesia: a qualitative and quantitative systematic review of randomized controlled trials. Anesthesiology. 1999 Dec;91(6):1919–27. https://doi.org/10.1097/00000542-199912000-00045 PMID:10598635
8. Sultan P, Halpern SH, Pushpanathan E, Patel S, Carvalho B. The effect of intrathecal morphine dose on outcomes after elective cesarean delivery: a meta-analysis. Anesth Analg. 2016 Jul;123(1):154–64. https://doi.org/10.1213/ANE.0000000000001255 PMID:27089000
9. Palmer CM, Emerson S, Volgoropolous D, Alves D. Dose-response relationship of intrathecal morphine for postcesarean analgesia. Anesthesiology. 1999 Feb;90(2):437–44. https://doi.org/10.1097/00000542-199902000-00018 PMID:9952150
10. Yang T, Breen TW, Archer D, Fick G. Comparison of 0.25 mg and 0.1 mg intrathecal morphine for analgesia after Cesarean section. Can J Anaesth. 1999 Sep;46(9):856–60. https://doi.org/10.1007/BF03012975 PMID:10490154
11. Uchiyama A, Nakano S, Ueyama H, Nishimura M, Tashiro C. Low dose intrathecal morphine and pain relief following caesarean section. Int J Obstet Anesth. 1994 Apr;3(2):87–91. https://doi.org/10.1016/0959-289X(94)90175-9 PMID:15636923
12. Milner AR, Bogod DG, Harwood RJ. Intrathecal administration of morphine for elective Caesarean section. A comparison between 0.1 mg and 0.2 mg. Anaesthesia. 1996 Sep;51(9):871–3. https://doi.org/10.1111/j.1365-2044.1996.tb12622.x PMID:8882255
13. Cardoso MM, Carvalho JC, Amaro AR, Prado AA, Cappelli EL. Small doses of intrathecal morphine combined with systemic diclofenac for postoperative pain control after cesarean delivery. Anesth Analg. 1998 Mar;86(3):538–41. PMID:9495409
14. Gerancher JC, Floyd H, Eisenach J. Determination of an effective dose of intrathecal morphine for pain relief after cesarean delivery. Anesth Analg. 1999 Feb;88(2):346–51. https://doi.org/10.1213/00000539-199902000-00023 PMID:9972754
15. Singh SI, Rehou S, Marmai KL, Jones AP. The efficacy of 2 doses of epidural morphine for postcesarean delivery analgesia: a randomized noninferiority trial. Anesth Analg. 2013 Sep;117(3):677–85. https://doi.org/10.1213/ANE.0b013e31829cfd21 PMID:23921652
16. Girgin NK, Gurbet A, Turker G, Aksu H, Gulhan N. Intrathecal morphine in anesthesia for cesarean delivery: dose-response relationship for combinations of low-dose intrathecal morphine and spinal bupivacaine. J Clin Anesth. 2008 May;20(3):180–5. https://doi.org/10.1016/j.jclinane.2007.07.010 PMID:18502360
17. Berger JS, Gonzalez A, Hopkins A, Alshaeri T, Jeon D, Wang S, et al. Dose-response of intrathecal morphine when administered with intravenous ketorolac for post-cesarean analgesia: a two-center, prospective, randomized, blinded trial. Int J Obstet Anesth. 2016 Dec;28:3–11. https://doi.org/10.1016/j.ijoa.2016.08.003 PMID:27717635
18. Cerda S, Hidalgo G, Born A, Cumsille F. Intrathecal morphine for analgesia after hyterectomy: A dose response study. Reg Anesth Pain Med. 1999 Jun;24(3):82. https://doi.org/10.1016/S1098-7339(99)90259-6.
19. Carvalho B, Mirza F, Flood P. Patient choice compared with no choice of intrathecal morphine dose for caesarean analgesia: a randomized clinical trial. Br J Anaesth. 2017 May;118(5):762–71. https://doi.org/10.1093/bja/aex039 PMID:28486595
20. Carvalho B, Sutton CD, Kowalczyk JJ, Flood PD. Impact of patient choice for different postcesarean delivery analgesic protocols on opioid consumption: a randomized prospective clinical trial. Reg Anesth Pain Med. 2019 May;44(5):578–85. https://doi.org/10.1136/rapm-2018-100206 PMID:30867278
21. Koju RB, Gurung BS, Dongol Y. Prophylactic administration of ondansetron in prevention of intrathecal morphine-induced pruritus and post-operative nausea and vomiting in patients undergoing caesarean section. BMC Anesthesiol. 2015 Feb;15(1):18. https://doi.org/10.1186/1471-2253-15-18 PMID:25971957
22. Swaro S, Karan D, Banerjee A. Comparison of Palonosetron, Dexamethasone, and Palonosetron Plus Dexamethasone as Prophylactic Antiemetic and Antipruritic Drug in Patients Receiving Intrathecal Morphine for Lower Segment Cesarean Section. Anesth Essays Res. 2018 Apr-Jun;12(2):322–7. https://doi.org/10.4103/aer.AER_183_17 PMID:29962591
23. Leonie M. Becker, Aart Jan W Teunissen, Joseph SHA Koopman Prevention and Treatment of Neuraxial Morphine-Induced Pruritus: A Scoping Review. J Pain Res. 2022;15:1633–45. https://doi.org/10.2147/JPR.S361225.
24. Cousins MJ, Mather LE, Bernards CM. Intrathecal and epidural administration of opioids. Anesthesiology. 1984 Sep;61(3):276–310. https://doi.org/10.1097/00000542-198409000-00008 PMID:6206753
25. Etches RC, Sandler AN, Daley MD. Respiratory depression and spinal opioids. Can J Anaesth. 1989 Mar;36(2):165–85. https://doi.org/10.1007/BF03011441 PMID:2565167
26. Bailey PL, Lu JK, Pace NL, Orr JA, White JL, Hamber EA, et al. Effects of intrathecal morphine on the ventilatory response to hypoxia. N Engl J Med. 2000 Oct;343(17):1228–34. https://doi.org/10.1056/NEJM200010263431705 PMID:11071674
27. Sharawi N, Carvalho B, Habib AS, Blake L, Mhyre JM, Sultan P. A Systematic Review Evaluating Neuraxial Morphine and Diamorphine-Associated Respiratory Depression After Cesarean Delivery. Anesth Analg. 2018 Dec;127(6):1385–95. https://doi.org/10.1213/ANE.0000000000003636 PMID:30004934
28. Koning MV, Reussien E, Vermeulen B et al . Serious Adverse Events after a Single Shot of Intrathecal Morphine: A Case Series and Systematic Review Pain Research and Management Volume 2022, Article ID 4567192, https://doi.org/10.1155/2022/4567192..
29. Cerda SE, Tong C, Deal DD, Eisenach JC. A physiologic assessment of intrathecal amitriptyline in sheep. Anesthesiology. 1997 May;86(5):1094–103. https://doi.org/10.1097/00000542-199705000-00013 PMID:9158359
30. Oertel BG, Felden L, Tran PV, et al. Selective antagonism of opioid induced ventilatory depression by an ampakine molecule in humans without loss of opioid analgesia www.nature.com Number 2, February 2010 https://doi.org/10.1038/clpt.2009.194.
31. Ortner CM, Granot M, Richebé P, Cardoso M, Bollag L, Landau R. Preoperative scar hyperalgesia is associated with post-operative pain in women undergoing a repeat Caesarean delivery. Eur J Pain. 2013 Jan;17(1):111–23. https://doi.org/10.1002/j.1532-2149.2012.00171.x PMID:22689634
32. Carvalho B, Drover DR, Ginosar Y, Cohen SE, Riley ET. Intrathecal fentanyl added to bupivacaine and morphine for cesarean delivery may induce a subtle acute opioid tolerance. Int J Obstet Anesth. 2012 Jan;21(1):29–34. https://doi.org/10.1016/j.ijoa.2011.09.002 PMID:22100823
33. Baker AR, Rutherford DM, Myles PS. Accuracy of dilution of morphine for intrathecal use. Anaesth Intensive Care. 2007 Jun;35(3):378–81. https://doi.org/10.1177/0310057X0703500310 PMID:17591132
34. Benkhadra M, Rivory JC, Wessels C, Guerard P, Vadot L, Astruc K, et al. Accuracy in obtaining 100 μg from 10 mg of morphine for spinal anesthesia. J Clin Anesth. 2015 Dec;27(8):638–45. https://doi.org/10.1016/j.jclinane.2015.06.004 PMID:26359017
35. Horlocker TT, Burton AW, Connis RT, et al. Practice Guidelines for the Prevention, Detection, and Management of Respiratory Depression Associated with Neuraxial Opioid Administration: An Updated Report by the American Society of Anesthesiologists Task Force on Neuraxial Opioids and the American Society of Regional Anesthesia and Pain Medicine. Anesthesiology. 2016 Mar;124(3):535–52. https://doi.org/10.1097/ALN.0000000000000975 PMID:26655725
36. Bauchat JR, Weiniger CF, Sultan P, Habib AS, Ando K, Kowalczyk JJ, et al. Society for Obstetric Anesthesia and Perinatology Consensus Statement: Monitoring Recommendations for Prevention and Detection of Respiratory Depression Associated With Administration of Neuraxial Morphine for Cesarean Delivery Analgesia. Anesth Analg. 2019 Aug;129(2):458–74. https://doi.org/10.1213/ANE.0000000000004195 PMID:31082964
37. Roofthooft E, Joshi GP, Rawal N, Van de Velde M, Joshi GP, Pogatzki-Zahn E, et al.; PROSPECT Working Group* of the European Society of Regional Anaesthesia and Pain Therapy and supported by the Obstetric Anaesthetists’ Association. PROSPECT guideline for elective caesarean section: updated systematic review and procedure-specific postoperative pain management recommendations. Anaesthesia. 2021 May;76(5):665–80. https://doi.org/10.1111/anae.15339 PMID:33370462
38. Liu ZQ, Du WJ, Yao SL. Enhanced recovery after cesarean delivery: a challenge for anesthesiologists. Chin Med J (Engl). 2020 Mar;133(5):590–6. https://doi.org/10.1097/CM9.0000000000000644 PMID:32032080
39. Ituk U, HabibAS. Enhanced recovery after cesarean delivery. F1000Research 2018, 7(F1000 Faculty Rev):513 Last updated: 27 APR 2018.
40. Sultan P, George R, Weiniger CF, El-Boghdadly K, Pandal P, Carvalho B; CRADLE Study Investigators. Expert Consensus Regarding Core Outcomes for Enhanced Recovery after Cesarean Delivery Studies: A Delphi Study. Anesthesiology. 2022 Aug;137(2):201–11. https://doi.org/10.1097/ALN.0000000000004263 PMID:35511169

 ORCID
ORCID