Aleix Carmona Blesa M.D. 1 ,*, Ana Tejedor Navarro M.D. 1 , Carmen Deiros García M.D. 1 , Josep Masdeu Castellví M.D. 1
Recibido: 12-06-2021
Aceptado: 23-12-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 2 pp. 191-198|https://doi.org/10.25237/revchilanestv5108021142
PDF|ePub|RIS
Impact of the anesthetic technique in postoperative pain in breast reconstructive surgery
Abstract
Objective: Our goal was to evaluate acute postoperative pain in patients undergoing breast reconstructive surgery with Deep Inferior Epigastric Perforator Artery (DIEP) flap technique. Material and Methods: A retrospective study was carried out in patients undergoing DIEP-flap breast reconstruction between January 2014 and December 2019. The main goal was the evaluation of acute postoperative pain through visual analogic pain scale (VAS) at rest (VASr) and movement (VASm) in the immediate postoperative period in post-anesthesia care unit (0h), at 24 h and at 48 h post-intervention and intravenous (IV) morphine con- sumption, depending on whether General Anesthesia (GA group) or Combined Anesthesia (CA group) was performed. Secon- dary outcomes were chronic pain incidence, perioperative complications, postoperative nausea and vomiting (PONV), reinterven- tion and readmission rate and lenght of hospital saty. Results: Sixty seven patients were included, 24 in GA group and 43 in CA group. CA group showed better VASm values at 24 h postintervention (p = 0.01). Postoperative IV morphine continuous infusion was required for acute pain management in 10.4% of patients (25% in GA vs 2.3% in the CA group; p = 0.004). Chronic pain rate was 13.4% (25% in GA vs 7% in the CA group; p = 0.038). Patients with worse initial pain control (VASr > 3 at 0 h) showed a higher incidence of chronic pain (66.6% vs 9.6%; p = 0.008). GA group presented higher rate of postoperative complications (66.6% vs 34.9%; p = 0,012), as well reintervention rate (58.3% vs 30.2%; p = 0.025). A sub-analysis showed that of the 10 patients (5 in the AC and 5 in the AG group) who reported poor initial pain control (VASr > 3 at 0 h), those belonging to the AC group, the IV morphine requirements were lower at post-anesthesia care unit (2 (0-5) mg vs 16 (9.5-23) mg; p = 0.016) and throughout the hospitalization period (4 (0-6) vs 24 (17.5-49, 2); p = 0.008). Conclusions: Locorregional techniques could offer a better control of postoperative acute pain and a lower incidence of chronic pain, without assuming implying a higher risk of complications related to them in patients undergoing breast reconstructive surgery by DIEP flap technique.
Resumen
Objetivo: El objetivo del estudio fue evaluar el dolor agudo posoperatorio en las pacientes sometidas a cirugía de reconstrucción mamaria mediante colgajo de la arteria perforante epigástrica inferior profunda (colgajo DIEP). Material y Métodos: Se revisaron retrospectivamente las pacientes intervenidas de reconstrucción mamaria con colgajo DIEP entre enero de 2014 y diciembre de 2019. El objetivo principal fue la valoración del dolor agudo posoperatorio mediante la escala visual analógica (EVA) en reposo (EVAr) y movimiento (EVAm) en el posoperatorio inmediato en la unidad de Reanimación (0 h), a las 24 h y a las 48 h post-intervención y el consumo de morfina endovenosa (ev), según si se realizó una Anestesia General (AG) o una Anestesia Combinada (AC). Los objetivos secundarios fueron: incidencia de dolor crónico posoperatorio, complicaciones peroperatorias, náuseas y vómitos posoperatorios (NVPO), tasa de reintervención y reingreso y estancia hospitalaria. Resultados: Se incluyeron 67 pacientes, 24 en el grupo AG y 43 en el grupo AC. El grupo AC mostró un mejor control del dolor en movimiento a las 24 h (p = 0,01). Un 10,4% de las pacientes precisaron infusión de morfina endovenosa (ev) para control del dolor agudo posoperatorio en reposo (25% en el grupo AG vs 2,3% en el grupo AC; p = 0,004). La incidencia de dolor crónico fue del 13,4% (25% en el grupo AG vs 7% en el grupo AC; p = 0,038). Las pacientes con mal control inicial del dolor (EVAr > 3 a las 0 h) presentaron mayor incidencia de dolor crónico (66,6% vs 9,6%; p = 0,008). El grupo AG presentó mayor tasa de complicaciones posoperatorias (66,6% vs 34,9%; p = 0,012), así como tasa de reintervención (58,3% vs 30,2%; p = 0,025). Un subanálisis mostró que de las 10 pacientes (5 en el grupo AC y 5 en el grupo AG) que refirieron un mal control inicial del dolor (EVAr > 3 a las 0 h), las pertenecientes al grupo AC requirieron menos morfina ev en unidad de reanimación postanestésica (2 (0-5) mg vs 16 (9,5-23) mg; p = 0,016) y durante toda su hospitalización (4 (0-6) vs 24 (17,5-49,2); p = 0,008). Conclusiones: Las técnicas locorregionales podrían ofrecer un mejor control del manejo del dolor agudo y una menor incidencia de dolor crónico, sin suponer un mayor riesgo de complicaciones relacionadas con ellos en pacientes sometidas a cirugía reconstructiva mamaria mediante técnica de colgajo DIEP.
La cirugía de resección mamaria de origen oncológico se realiza en ocasiones de forma conjunta con cirugía de reconstrucción mamaria, con excelentes resultados a largo plazo y con un elevado grado de satisfacción y confort de las pacientes[1]. La técnica de elección para la reconstrucción con tejido autólogo es mediante un colgajo libre abdominal con la arteria perforante epigástrica profunda (colgajo DIEP), que permite preservar la musculatura del abdomen, disminuyendo así la morbilidad asociada[2].
La cirugía de reconstrucción mamaria está asociada a elevadas necesidades de opioides perioperatorios y a una tasa de dolor crónico muy relevante (algunas series la estiman en hasta 50%)[3],[4]. Algunos estudios sugieren que esta tasa de croni- ficación puede estar relacionada con la calidad del control del dolor agudo[5],[6]. Por tanto, además de la técnica quirúrgica, un adecuado manejo anestésico es esencial para conseguir buenos resultados perioperatorios[7]. Además, en el caso de esta técnica quirúrgica, la presencia de campos quirúrgicos tanto a nivel abdominal y pectoral, contribuye a la dificultad del manejo del dolor.
Un adecuado control del dolor agudo posoperatorio da lugar a una movilización precoz[8], una disminución de las complicaciones posoperatorias[9],[10] y a un aumento en la satisfacción de las pacientes[11],[12]. Todo ello podría tener un impacto en la reducción de la estancia hospitalaria y en los costes asociados al procedimiento.
Inicialmente la técnica analgésica utilizada para el control del dolor agudo posoperatorio era la administración de opioi- des endovenosos (ev)[13]. Sin embargo, el uso de esta estrategia entraña importantes efectos secundarios, como náuseas y vómitos posoperatorios (NVPO), íleo paralítico, depresión respiratoria e hiperalgesia asociada, entre otros[14]. Como consecuencia, se han ido desarrollando nuevas estrategias con el fin de conseguir un mejor control del dolor agudo posoperatorio minimizando el uso de estos. Las técnicas anestésico-analgésicas utilizadas han sido, y son, muy variadas: desde la analgesia multimodal mediante combinación de antiinflamatorios no es- teroideos (AINES) y opiáceos[15], hasta la asociación de técnicas locorregionales como la analgesia epidural[16],[17], el bloqueo paravertebral[18] o los nuevos bloqueos periféricos interfasciales[19]-[22]. Hoy en día, la técnica de elección para esta cirugía dentro de los abordajes analgésicos multimodales no está definida. En nuestro centro, el abordaje analgésico también ha ido evolucionando, abarcando desde el uso de analgesia con morfina ev hasta la aplicación de técnicas locorregionales centrales o periféricas, intentando optimizar el control del dolor y reducir el consumo de opioides y, por tanto, contribuir a una recuperación más rápida de nuestras pacientes.
El objetivo principal de este estudio fue evaluar el manejo del dolor agudo posoperatorio en las pacientes sometidas a la cirugía de reconstrucción mamaria mediante colgajo DIEP en nuestro centro según si se llevó a cabo una Anestesia General (AG) o Anestesia Combinada (AC).
Tras la aprobación por parte de comité ético (protocolo 19/46) y, de acuerdo con la declaración de Helsinki, se realizó este estudio observacional retrospectivo. Ha sido redactado siguiendo las guías STROBE. Registramos los datos de las pacientes intervenidas de reconstrucción mamaria mediante colgajo DIEP en el Hospital Sant Joan Despí Moisés Broggi y el Hospital General de l’Hospitalet, ambos partes del Complejo hospitalario Moisés Broggi, entre enero de 2014 y diciembre de 2019. En ambos centros, el equipo de anestesiología y cirugía estuvo y está formado por el mismo personal y el manejo perioperatorio fue el mismo.
Los criterios de inclusión fueron las pacientes sometidas a cirugía de reconstrucción mamaria mediante técnica de colgajo DIEP y edad > 18 años. Los datos se obtuvieron mediante la revisión de las historias clínicas.
El objetivo principal del estudio fue la evaluación del dolor agudo posoperatorio mediante los valores de EVA en reposo (EVAr) y en movimiento (EVAm) en el posoperatorio inmediato (0 horas), a las 24 h y a las 48 h tras la cirugía, y el consumo de morfina ev posoperatoria asociada. Los valores de EVA fueron agrupados en dolor leve (< 3), moderado (4 a 6) o severo (> 7). Un mal control del dolor fue considerado con valores de EVA > 3[23]. El consumo de morfina ev se cuantificó según si se administró en la unidad de reanimación postanestésica (URPA) (0-24 h posoperatorias) o en Planta convencional de Hospitalización (> 24 h).
Los objetivos secundarios fueron: incidencia de dolor crónico posoperatorio, incidencia de NVPO, complicaciones peroperatorias (quirúrgicas y médicas), tasa de reintervención y de readmisión, y estancia hospitalaria.
Se definió el dolor crónico posoperatorio como aquel dolor que, 6 meses después de la cirugía, persistía en las zonas de las heridas quirúrgicas (tanto en zona abdominal como en zona pectoral), o bien que hubieran sido remitidas a la Clínica del Dolor por este motivo. Las complicaciones quirúrgicas incluyeron eventos que ocurrieron en el sitio del injerto, como pérdida total o parcial del colgajo, congestión del colgajo venoso, infección, hematoma, seroma, necrosis grasa y problemas de heridas. Este último incluyó dehiscencia de la herida y necrosis cutánea superficial relacionada con la reconstrucción mamaria. Se consideraron complicaciones médicas los eventos que involucraron órganos o sitios distantes del campo quirúrgico.
La reintervención se definió como el regreso al quirófano durante el ingreso hospitalario correspondiente a la cirugía de colgajo DIEP y la readmisión como el regreso al hospital dentro de los 30 días posteriores al alta.
Tras monitorización estándar (electrocardiograma, pulsioximetría y presión arterial no invasiva), se administraron entre 1-3 mg de midazolam ev para ansiolisis.
Según la práctica del anestesiólogo responsable, la técnica anestésico-analgésica perioperatoria se llevó a cabo mediante una anestesia general o anestesia combinada (anestesia general asociada a una técnica locorregional). La inducción anestésica endovenosa se realizó con fentanilo (1,5-2 pg/kg), propo- fol (1,5-2 mg/kg) y rocuronio (0,6 mg/kg) y el mantenimiento anestésico con sevoflurano (Baxter Drager, Vapor 2000). La profilaxis antiemética fue con dexametasona 4 mg ev en la inducción y ondansetrón 4 mg ev previa finalización de la cirugía. Se monitorizó la presión arterial contínua mediante catéter en arteria radial, así como diuresis horaria, temperatura mediante catéter esofágico y sensor de profundidad anestésica mediante Sedline (Massimo®).
En las pacientes en las que se llevó a cabo una anestesia combinada, las técnicas locorregionales que se asociaron fueron: analgesia epidural torácica, bloqueo paravertebral (PV), bloqueo transversus abdominis plane (TAP), bloqueo de las ramas cutáneas laterales de los nervios intercostales a nivel de línea media axilar (BRILMA), el bloqueo interpectoral (PEC) y el bloqueo del plano del erector de la espina (ESP). La técnica epi- dural torácica se realizó entre los niveles T7-T10 mediante técnica estéril, en sedestación, con test de aspiración para descartar localización intravascular, y dosis test mediante 3 mililitros (ml) lidocaína al 2% para excluir localización intratecal del catéter. El bloqueo PV se realizó mediante técnica estéril, en decúbito lateral, ecoguiado con aguja 22G Whitacre a nivel T6-T7 con 10 ml de bupivacaína 0,25% y mepivacaína 1% de manera unilateral. Los bloqueos interfasciales se realizaron mediante técnica estéril, ecoguiados y con aguja Whitacre 22G. El bloqueo TAP se realizó de manera bilateral con 20 ml de bupivacaína 0,25% y mepivacaína 1% por lado. El bloqueo BRILMA, el bloqueo PEC y el bloqueo ESP se realizaron de manera unilateral o bilateral según la lateralidad de la intervención con 20ml de bupivacaína 0,25% y mepivacaína 1% por lado.
Al finalizar la cirugía, se procedió al despertar y extubación traqueal de todas las pacientes. Posteriormente, fueron trasladadas a la URPA, donde permanecieron las primeras 24 horas para el control del dolor, sangrado y perfusión del colgajo. El colgajo se revisó cada hora, mediante color, temperatura, as pecto, turgencia y relleno capilar. A las 6 h de la cirugía, se inició profilaxis antitrombótica mediante heparina de bajo peso molecular (HBPM) a 1 mg/kg y se mantuvo durante al menos 10 días. En caso de complicación, la HBPM se mantuvo más tiempo.
En todas las pacientes (salvo alergia o contraindicación), la analgesia convencional posoperatoria consistió en la administración de paracetamol 1g/8h ev, dexketoprofeno 50mg /8h ev, sustituyendo este último por metamizol 2g ev/8h ev en caso de intolerancia o insuficiencia renal. Si tras la administración de la analgesia convencional, la paciente refería EVA en reposo > 3, se administró un bolus de morfina ev (2 mg) como rescate. En las pacientes que tras 3 bolus de morfina ev (6 mg), persistió EVA en reposo > 3, se inició infusión de morfina ev.
Las pacientes que no presentaron complicaciones durante las primeras 24 h posoperatorias fueron trasladadas a la planta de hospitalización convencional, y fueron visitadas a diario por el equipo de la unidad de dolor agudo posoperatorio, formada por una enfermera y un anestesiólogo. Tras el alta hospitalaria, fueron visitadas para control posoperatorio por parte del cirujano a las 2-4 semanas y a los 6 meses.
Los resultados fueron expresados mediante media (desviación estándar) en datos cuantitativos y porcentaje o rango en datos cualitativos. Se llevó a cabo la prueba de Kolmogorov- Smirnov para evaluar la distribución de datos.
Para los datos numéricos distribuidos con normalidad, se utilizó la prueba t de Student de muestras independientes para comparar la diferencia en las medias entre los dos grupos de estudio. Para datos numéricos que no cumpliesen criterios de normalidad, se aplicó la prueba de suma de rangos de Wil- coxon. Se utilizó la prueba de Chi cuadrado de Pearson para comparar los dos grupos en lo que respecta a las diferencias en los datos categóricos. Se aplicó la prueba exacta de Fisher en lugar de la prueba de Chi cuadrado, si > 20% de las celdas en cualquier tabla de contingencia tuvo un recuento esperado de < 5. Se aplicó la corrección de Bonferroni para comparaciones repetidas en las variables EVA en reposo y en movimiento. Todos los valores de P fueron biasintóticos. Un valor de P < 0,05 se consideró estadísticamente significativo. Los análisis estadísticos se realizaron el programa SPSS v 22.0 (SPSS, Chicago, IL, EE. UU.).
Se analizaron 67 pacientes: 35,8% (24 pacientes) se intervino bajo Anestesia General (AG) y 64,2% (43 pacientes) bajo Anestesia Combinada (AC). Los datos antropométricos y las características clínicas de las pacientes han sido detallados en la Tabla 1.
La técnica locorregional más frecuentemente asociada fue la combinación de bloqueo TAP bilateral con bloqueo BRILMA unilateral o bilateral (según lateralidad del procedimiento). La distribución de las técnicas locorregionales aparece en la Figura 1.
No se reportaron complicaciones derivadas de las propias técnicas locorregionales.
Tabla 1 Datos antropométricos y características clínicas
| AG (n = 24) | AC (n =43) | P | |
| IMC (Kg/m2) | 29 (4,73) | 27,16 (4,10) | 0,1 |
| Edad (años) | 53,08 (10,81) | 55,33 (9,29) | 0,38 |
| ASA ( I / II / III ) | 0 / 21 (87,5%) / 3 (12,5%) | 2 (4,7%) / 40 (93%) / 1 (2,3%) | 0,15 |
| HTA | 9 (37,5%) | 10 (23,3%) | 0,22 |
| DM | 1 (4,2%) | 4 (9,3%) | 0,44 |
| Tabaco | 2 (8,3%) | 9 (20,9%) | 0,18 |
| QT previa | 16 (66,7%) | 26 (60,5%) | 0,62 |
| RT previa | 4 (16,7%) | 7 (16,3%) | 0,97 |
| Inmediata / Diferida | 15 (62,5%) / 9 (95,8%) | 35 (81,4%) / 8 (18,6%) | 0,09 |
| Unilateral / Bilateral | 9 (37,5%) / 15 (62,5%) | 25 (58,1%) / 18 (41,9%) | 0,11 |
Los datos se muestran mediante media (desviación estándar) o número de pacientes (%). Valor de p para diferencias significativas entre el grupo anestesia general (AG) o anestesia combinada (AC). Diferencias estadísticamente significativas entre los grupos: * p < 0,05.
IMC: Índice masa corporal; ASA: Clasificación de riesgo anestésico de la American Society of Anesthesiology; HTA: hipertensión arterial; DM: diabetes mellitus; QT: quimioterapia; RT: radioterapia; Reconstrucción inmediata versus diferida en el tiempo; Cirugía unilateral vs cirugía bilateral.
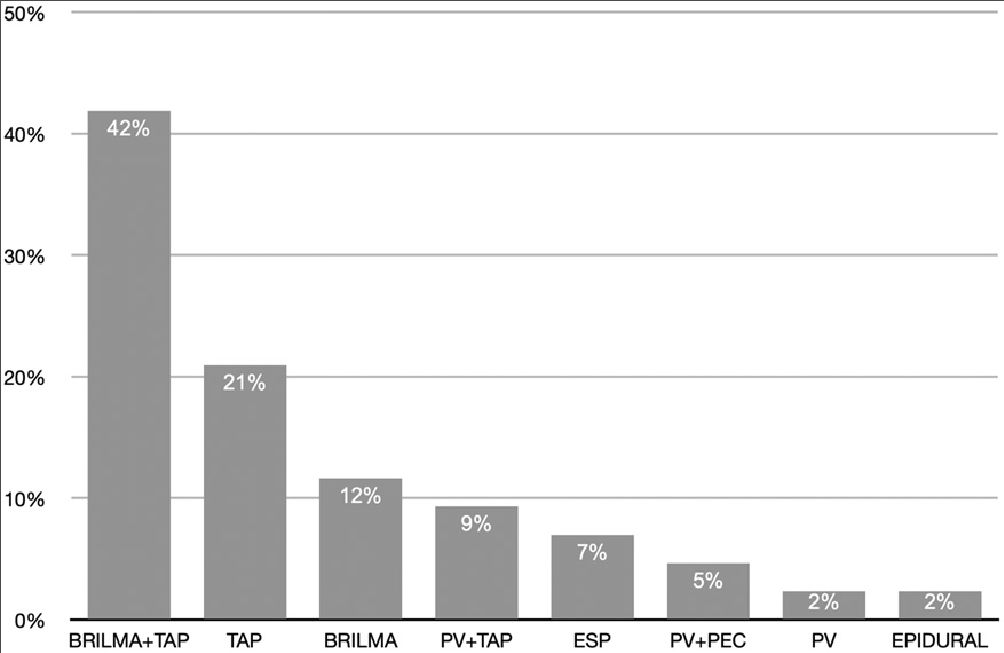
Figura 1. Distribución de la técnica locorregional realizada en las pacientes en las que se llevó a cabo una anestesia combinada. Datos expresados en porcentaje.
Los valores de EVA durante el posoperatorio se muestran en la Figura 2. Las pacientes a las que se les realizó una AC presentaron un mejor control del dolor en movimiento a las 24 h posoperatorias (p = 0,01). En el resto de las determinaciones de EVA, no se encontraron diferencias estadísticamente significativas (p > 0,05).
En el consumo posoperatorio de morfina ev no se encontraron diferencias estadísticamente significativas en el grupo AG vs AC, siendo en la URPA(0-24 h) de 5,33 ± 8,36 mg vs 1,81 ± 2,53 mg (p = 0,06), en planta 3,68 ± 9,29 mg vs 0,72 ± 2,27 mg (p = 0,14) y en total 8,02 ± 14,93 mg vs 2,58 ± 3,40 mg (p = 0,09). El consumo mínimo y máximo de morfina fue de 0 y 52 mg en el grupo AG y de 0 y 13 mg en el grupo AC. El 10,4% (7) de las pacientes requirió inicio de infusión de morfina ev perteneciendo 6 de ellas al grupo AG (33,3% en AG vs 2,3% en AC, p = 0,004).
Diez (14,9%) pacientes presentaron un mal control del dolor agudo en el posoperatorio inmediato (EVAr > 3 a las 0 h).
Al analizar los requerimientos de morfina ev en estas pacientes, precisaron mayor cantidad de morfina ev en la URPA (9,30 ± 8,99 mg vs 1,98 ± 3,97 mg, p < 0,001), pero también posteriormente en la planta de hospitalización (7,84 ± 13,15 mg vs 0,72 ± 2,49 mg, p < 0,001) respecto a las que presentaron un buen control inicial del dolor. El consumo total de morfina ev en todo el ingreso fue superior respecto a las pacientes con buen control del dolor inicial (17,34 ± 18,69 mg vs 2,28 ± 4,22 mg, p = 0,001).
Realizamos un análisis de subgrupo de estas pacientes con EVAr > 3 a las 0 h) según si pertenecían al grupo AC o AG. En el grupo AC, se registró un menor consumo de morfina ev posoperatorio en URPA (2 (0-5) mg vs 16 (9,5-23) mg; p = 0,016); y en total (4 (0-6) vs 24 (17,5-49,2); p = 0,008). Sin embargo, no se encontraron diferencias respecto a la cantidad administrada en planta (0 (0-1) mg vs 10 (2-31,2) mg; p = 0,056).
El 13,4% de las pacientes (9) presentaron dolor crónico posoperatorio a nivel de la herida quirúrgica. La incidencia fue menor en el grupo AC (AG 25% vs AC 7%, p = 0,038).
Las pacientes que presentaron un mal control inicial del dolor agudo presentaron una incidencia de dolor crónico superior respecto a las pacientes con buen control inicial (66,6% vs 9,6% (p = 0,008). Por otro lado, según el análisis de este subgrupo, el hecho de haber recibido una AG o una AC no influyó en el desarrollo de dolor crónico (40% en ambos subgrupos, p = 1).
El 14% (9) de las pacientes presentaron algún tipo de complicación intraoperatoria: 12,4% (8) presentaron sangrado de campo quirúrgico y 1,6% (1) presentó un fallo de la sutura vascular de manera inmediata.
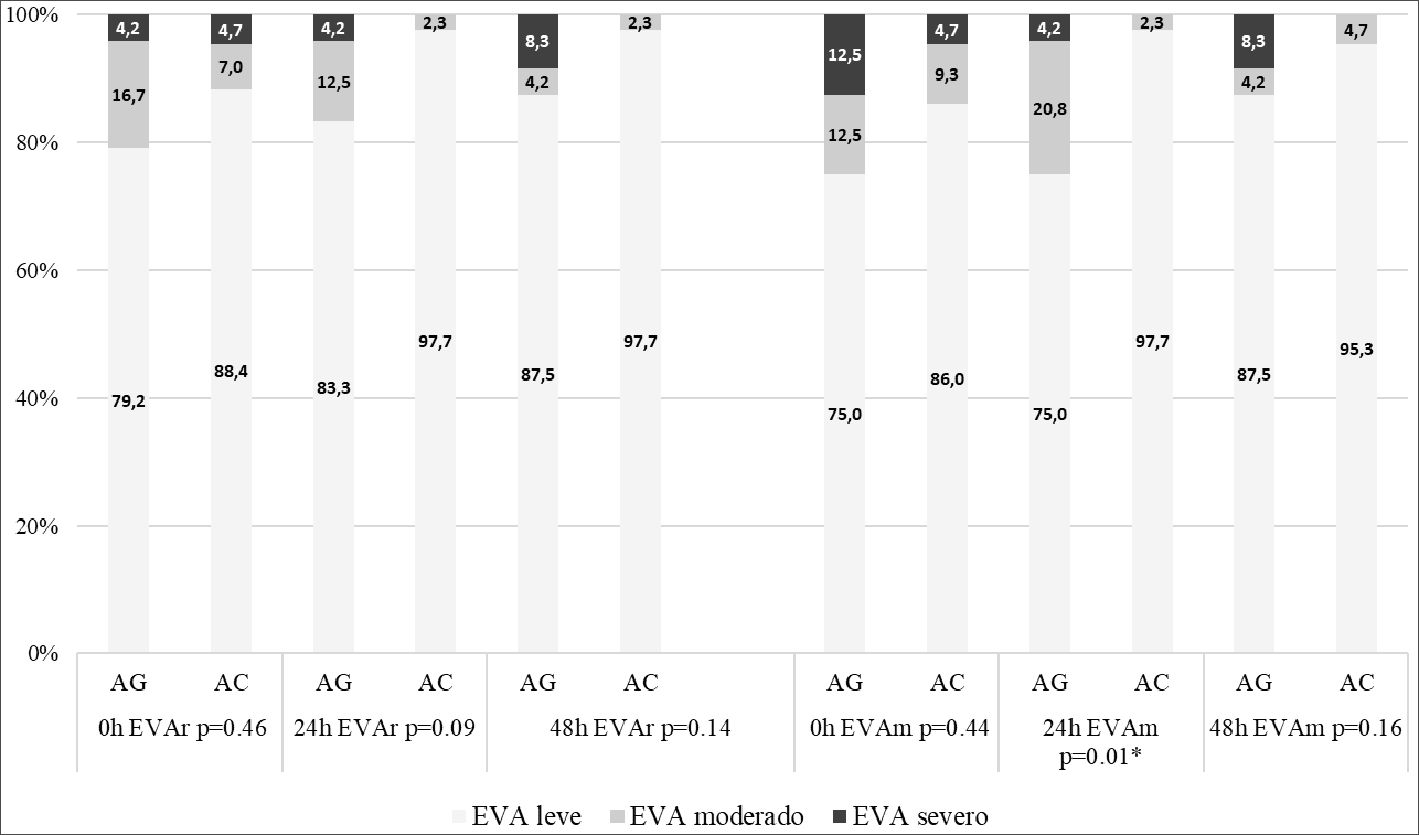
Figura 2. Distribución de los valores de la escala visual analógica (EVA) en reposo y en movimiento, a las 0 h, 24 h y 48 h, agrupados en leve, moderado y severo, según se ha realizado una Anestesia General o Anestesia Combinada. Datos expresados en porcentaje. Se aplicó la corrección de Bonferroni para múltiples comparaciones (n = 3). Los valores de p en negrita son estadísticamente significativos después de la corrección para comparaciones múltiples. Diferencias estadísticamente significativas entre los grupos: * p < 0,0016.
Respecto a las complicaciones posoperatorias, 46,3% (31) de las pacientes presentaron alguna complicación, requiriendo reintervención quirúrgica en el 40,3% (27). La tasa de complicaciones posoperatorias fue menor en el grupo AC (34,9% vs 66,7%, p = 0,04), así como la necesidad de reintervención (30,2% vs 58,3% p = 0,025).
En las pacientes intervenidas bajo AG, encontramos: 6 necrosis parciales del colgajo, 5 necrosis totales, 2 casos de congestión venosa del colgajo, 1 infección de herida quirúrgica, 1 caso de linfedema posoperatorio y, por último, una paciente que presentó una taquicardia paroxística supraventricu- lar durante el posoperatorio en la URPA que se solventó con tratamiento médico. En las pacientes intervenidas bajo AC se registraron 3 necrosis parciales y 6 totales del colgajo, 1 caso de congestión venosa del colgajo, 2 casos de hematoma en la zona mamaria (1 con manejo conservador y 1 requirió reintervención), 1 caso de infección de herida quirúrgica, 1 caso de trombosis arterial del colgajo y 1 caso de sangrado a nivel del recto anterior del abdomen (que requirió derivación para embolización de la arteria perforante).
La incidencia de NVPO fue del 14,9% (10), siendo similar (20,8% (5) en el grupo AG vs 11,6% (5) en el grupo AC; p = 0,47).
La estancia hospitalaria fue de 7,94 ± 2,24 días, sin objetivar diferencias entre grupos (8,17 ± 2,12 días en grupo AG vs 7,81 ± 2,31 días en grupo AC; p = 0,54) así como en la tasa de readmisión antes de los 30 días, que fue del 16,4% (11 pacientes) siendo de 25% en el grupo AG vs 11,6% en el grupo AC; p = 0,16).
La técnica de elección en la cirugía de reconstrucción mamaria es el colgajo DIEP. Este procedimiento se asocia a mayor preservación de la integridad de la pared abdominal con mayor funcionalidad posterior y menos dolor que otras técnicas reconstructivas[24], pero el manejo del dolor agudo perioperato- rio ofrece un desafío importante por implicar un campo quirúrgico amplio[3],[4].
En nuestro estudio, en el posoperatorio inmediato, registramos un buen control del dolor agudo posoperatorio de manera global. El 85,1% de las pacientes refirieron EVA < 3 en reposo y el 82,1% de las pacientes EVA < 3 en movimiento. Estos datos contrastan con literatura publicada al respecto, donde se afirma que este procedimiento reconstructivo se asocia a un intenso dolor agudo posoperatorio y a unos elevados requerimientos de opioides postoperatorios[3],[25]. Esto podría ser debido a que, por un lado, el abordaje anestésico-analgésico realizado en ambos grupos fue multimodal y, por otro lado, a que en el grupo AC se asociaron técnicas locorregionales. Todo ello, tal y como está descrito en la literatura, son estrategias dirigidas a optimizar el control del dolor y a reducir los requerimientos de opiáceos[19]-[21],[26].
En nuestro estudio, los valores de EVA en movimiento a las 24 h posoperatorias fueron inferiores en el grupo AC. Los valores de EVA en reposo y el consumo de morfina ev administrada durante todo el ingreso no mostraron diferencias estadísticamente significativas. Sin embargo, la necesidad de iniciar una infusión continua de morfina ev por mal control del dolor agudo posoperatorio sí fue claramente superior en el grupo AG (25% vs 2,3%, p = 0,004). Este dato podría sugerir, de manera indirecta, un peor control del dolor en este grupo.
El análisis del subgrupo formado por las pacientes con mal control inicial del dolor (EVAr > 3 en el posoperatorio inmediato), mostró que en el grupo AC los requerimientos de morfina ev en el posoperatorio inmediato y totales fueron inferiores. Nuestros resultados están en concordancia con la literatura publicada al respecto, la cual sugiere que las técnicas locorregionales son estrategias efectivas para optimizar el control del dolor agudo posoperatorio y como ahorradoras de opioides[3],[19]-[21],[24],[27]-[31]. En esta línea, los datos de nuestra serie sugieren que las técnicas locorregionales podrían haber protegido a las pacientes con peor control del dolor de precisar dosis aún mayores de morfina ev. Creemos, por otro lado, que la falta de diferencias significativas entre grupos en el global de las pacientes podría ser debida a un error de tipo II, dada la gran variabilidad observada en la administración de morfina (AG: 0-52 mg vs AC: 0-13 mg) y a la potencia estadística limitada debida al tamaño muestral de nuestro estudio.
La técnica anestésico-analgésica más frecuente en nuestro centro fue la asociación de AG con un bloqueo TAP bilateral y un bloqueo BRILMA con analgesia endovenosa convencional. Varios estudios han demostrado que el bloqueo TAP es seguro y reduce el consumo de opioides en las cirugías de reconstrucción mamaria autóloga[19]-[21]. Hivelin y cols. observaron una disminución en los valores de EVA y requerimientos de opiáceos menores mediante el bloqueo TAP vs AG en cirugía con colgajo DIEP[19]. Sin embargo, hay que tener en cuenta que, en la cirugía de reconstrucción mamaria se debe proporcionar analgesia tanto en la zona abdominal como en la pectoral. En este contexto, asociamos el bloqueo BRILMA para la analgesia del campo receptor del colgajo, ya que posee un buen perfil de seguridad, una baja dificultad[32] y ha demostrado disminuir la intensidad del dolor agudo posoperatorio y la necesidad de analgesia de rescate en cirugía mamaria no reconstructiva[28].
La incidencia global de dolor crónico posoperatorio observada fue del 13,4%. Honkanen y cols[33] reportaron una incidencia similar. Al comparar dicha incidencia entre grupos, observamos la cronificación del dolor agudo fue superior en el grupo AG (25% vs 7%; p = 0,038). Nuestros hallazgos sugieren que la asociación de técnicas locorregionales podría tener un papel protector contra la cronificación del dolor agudo posoperatorio. Estos datos concuerdan con estudios publicados que abogan por el papel de estas técnicas para reducir la incidencia de dolor crónico[6],[34],[35]. Algunos de los mecanismos descritos probablemente implicados, son consecuencia directa del bloqueo del estímulo nociceptivo quirúrgico: a nivel periférico, evita la sensibilización de nociceptores y de las fibras nerviosas secundaria a la inflamación; y evita los cambios por neuroplas- ticidad que se producen a nivel central[36]. Estos mecanismos contribuyen al mantenimiento y amplificación de la señal dolorosa que, de forma conjunta, posibilitan la cronificación del dolor postquirúrgico mal controlado inicialmente. Datos similares fueron descritos por Bar-Meir y cols[34] y por Hickey y cols[6]. Por otro lado, el análisis de la incidencia de dolor crónico en el subgrupo de pacientes con peor control inicial del dolor, según si recibieron AG o AC, no mostró diferencias significativas. Esto podría ser debido a que el número de pacientes analizados en este subgrupo fue muy pequeño.
El 46% de las pacientes presentaron alguna complicación posoperatoria, siendo menor su incidencia en el grupo AC, así como la tasa de reintervención. Varios trabajos han reportado datos similares[8],[10],[18]. Ledowsky y cols[10] sugirieron que las técnicas locorregionales podrían tener un papel protector frente a las complicaciones posquirúrgicas que afectan a la viabilidad del injerto, como resultado del bloqueo del estímulo no- ciceptivo a nivel periférico, dando lugar a una disminución en la liberación de catecolaminas circulantes al disminuir la respuesta simpática y, por tanto, menor afectación a nivel microvascular. Además, en nuestro estudio no observamos ninguna complicación derivada de la propia técnica anestésica como podría haber sido la intoxicación por anestésicos locales. Es por esto que, dado su buen perfil de riesgo/beneficio, deberíamos considerarlas herramientas seguras y potencialmente útiles en el proceso perioperatorio de la cirugía de reconstrucción mamaria.
La incidencia de NVPO y la estancia hospitalaria no mostraron diferencias entre grupos. Respecto a las NVPO, siguiendo el protocolo de nuestro hospital, se realizó doble profilaxis antiemética en todas las pacientes. Respecto a la estancia hospitala
ria, nuestros datos contrastan con algunos estudios que describen el papel de las técnicas locorregionales en la disminución de la estancia hospitalaria[18],[30],[37]. Estos trabajos han sido realizados evaluando una sola técnica locorregional en concreto. Sin embargo, en nuestro estudio, este análisis podría estar sesgado por la amplia variabilidad de técnicas locorregionales incluidas en el grupo AC.
Una de las principales limitaciones de nuestro estudio es que se trata de un estudio observacional retrospectivo, con el sesgo que esto puede generar. La amplia variedad de técnicas locorregionales, así como las combinaciones aplicadas, nos ha imposibilitado realizar análisis de subgrupos válidos para compararlas entre sí y, por lo tanto, poder evaluar la eficacia específica de cada una de ellas. Este hecho también puede haber influido en el control del dolor y en las necesidades de morfina ev posoperatoria, dado que posiblemente no todas las técnicas evaluadas ofrecerían la misma eficacia analgésica, sesgando así dichas variables en el grupo de anestesia combinada.
A pesar de estas limitaciones, creemos muy relevante destacar que nuestros hallazgos podrían sugerir que la asociación de técnicas locorregionales podría suponer un factor de protección frente a la cronificación del dolor agudo posoperatorio, sin suponer un riesgo de complicaciones derivadas de su realización. A la vista de nuestros hallazgos, y considerando las limitaciones en cuanto a potencia y diseño de nuestro trabajo, sería necesaria la realización de estudios prospectivos randomizados para valorar de manera más precisa el papel de cada una de las técnicas locorregionales en la cirugía reconstructiva autóloga mamaria mediante colgajo DIEP.
Las técnicas locorregionales podrían jugar un papel importante en el proceso perioperatorio de las pacientes intervenidas de reconstrucción mamaria mediante colgajo DIEP, contribuyendo a un mejor control del dolor agudo postoperatorio y, por ende, una potencial protección frente a la cronificación del mismo. En las pacientes con mal control del dolor, el hecho de asociar técnicas locorregionales podría asociarse a un menor requerimiento de morfina ev durante el período posoperatorio.
Conflicto de interese: Ninguno de los autores de este estudio declara ningún conflicto de intereses para la realización de este trabajo.
Referencias
1. Homsy A, Rüegg E, Montandon D, Vlastos G, Modarressi A, Pittet B. Breast Reconstruction. Ann Plast Surg. 2018 Apr;80(4):457–63. https://doi.org/10.1097/SAP.0000000000001312 PMID:29389700
2. Nimalan N, Branford OA, Stocks G. Anaesthesia for free flap breast reconstruction. BJA Educ. 2016 May;16(5):162–6. https://doi.org/10.1093/bjaed/mkv036.
3. Knackstedt R, Oliver JD, Gatherwright J. Optimizing Postoperative Pain Control in Autologous Breast Reconstruction: A Systematic Review. J Reconstr Microsurg. 2020 Sep;36(7):480–5. https://doi.org/10.1055/s-0040-1708834 PMID:32289845
4. Gart MS, Smetona JT, Hanwright PJ, Fine NA, Bethke KP, Khan SA, et al. Autologous options for postmastectomy breast reconstruction: a comparison of outcomes based on the American College of Surgeons National Surgical Quality Improvement Program. J Am Coll Surg. 2013 Feb;216(2):229–38. https://doi.org/10.1016/j.jamcollsurg.2012.11.003 PMID:23211118
5. Humble SR, Dalton AJ, Li L. A systematic review of therapeutic interventions to reduce acute and chronic post-surgical pain after amputation, thoracotomy or mastectomy. Eur J Pain. 2015 Apr;19(4):451–65. https://doi.org/10.1002/ejp.567 PMID:25088289
6. Hickey OT, Burke SM, Hafeez P, Mudrakouski AL, Hayes ID, Shorten GD. Severity of acute pain after breast surgery is associated with the likelihood of subsequently developing persistent pain. Clin J Pain. 2010 Sep;26(7):556–60. https://doi.org/10.1097/AJP.0b013e3181dee988 PMID:20639740
7. Chen WK, Miao CH. The effect of anesthetic technique on survival in human cancers: a meta-analysis of retrospective and prospective studies. PLoS One. 2013;8(2):e56540. https://doi.org/10.1371/journal.pone.0056540 PMID:23437162
8. Kehlet H. Postoperative pain, analgesia, and recovery-bedfellows that cannot be ignored. Pain. 2018 Sep;159(1 Suppl 1):S11–6. https://doi.org/10.1097/j.pain.0000000000001243 PMID:30113942
9. Kehlet H, Dahl JB. Anaesthesia, surgery, and challenges in postoperative recovery. Lancet. 2003 Dec;362(9399):1921–8. https://doi.org/10.1016/S0140-6736(03)14966-5 PMID:14667752
10. Ledowski T, Reimer M, Chavez V, Kapoor V, Wenk M. Effects of acute postoperative pain on catecholamine plasma levels, hemodynamic parameters, and cardiac autonomic control. Pain. 2012 Apr;153(4):759–64. https://doi.org/10.1016/j.pain.2011.11.002 PMID:22305628
11. Vadivelu N, Schreck M, Lopez J, Kodumudi G, Narayan D. Pain after mastectomy and breast reconstruction. Am Surg. 2008 Apr;74(4):285–96. https://doi.org/10.1177/000313480807400402 PMID:18453290
12. Poleshuck EL, Katz J, Andrus CH, Hogan LA, Jung BF, Kulick DI, et al. Risk factors for chronic pain following breast cancer surgery: a prospective study. J Pain. 2006 Sep;7(9):626–34. https://doi.org/10.1016/j.jpain.2006.02.007 PMID:16942948
13. Kroll SS, Sharma S, Koutz C, Langstein HN, Robb GL, Chang DW, et al.; Evans GRD. Postoperative morphine requirements of free TRAM and DIEP flaps. Plast Reconstr Surg. 2001 Feb;107(2):338–41. https://doi.org/10.1097/00006534-200102000-00006 PMID:11214047
14. Møiniche S, Kehlet H, Dahl JB. A qualitative and quantitative systematic review of preemptive analgesia for postoperative pain relief: the role of timing of analgesia. Anesthesiology. 2002 Mar;96(3):725–41. https://doi.org/10.1097/00000542-200203000-00032 PMID:11873051
15. Dumestre DO, Redwood J, Webb CE, Temple-Oberle C. Enhanced Recovery After Surgery (ERAS) Protocol Enables Safe Same-Day Discharge After Alloplastic Breast Reconstruction. Plast Surg (Oakv). 2017 Nov;25(4):249–54. https://doi.org/10.1177/2292550317728036 PMID:29619347
16. Lou F, Sun Z, Huang N, Hu Z, Cao A, Shen Z, et al. Epidural Combined with General Anesthesia versus General Anesthesia Alone in Patients Undergoing Free Flap Breast Reconstruction. Plast Reconstr Surg. 2016 Mar;137(3):502e–9e. https://doi.org/10.1097/01.prs.0000479933.75887.82 PMID:26910694
17. Correll DJ, Viscusi ER, Grunwald Z, Moore JH Jr. Epidural analgesia compared with intravenous morphine patient-controlled analgesia: postoperative outcome measures after mastectomy with immediate TRAM flap breast reconstruction. Reg Anesth Pain Med. 2001 Sep-Oct;26(5):444–9. https://doi.org/10.1097/00115550-200109000-00010 PMID:11561265
18. Parikh RP, Sharma K, Guffey R, Myckatyn TM. Preoperative Paravertebral Block Improves Postoperative Pain Control and Reduces Hospital Length of Stay in Patients Undergoing Autologous Breast Reconstruction after Mastectomy for Breast Cancer. Ann Surg Oncol. 2016 Dec;23(13):4262–9. https://doi.org/10.1245/s10434-016-5471-1 PMID:27489056
19. Hivelin M, Wyniecki A, Plaud B, Marty J, Lantieri L. Ultrasound-guided bilateral transversus abdominis plane block for postoperative analgesia after breast reconstruction by DIEP flap. Plast Reconstr Surg. 2011 Jul;128(1):44–55. https://doi.org/10.1097/PRS.0b013e3182174090 PMID:21701318
20. Zhong T, Ojha M, Bagher S, Butler K, Srinivas C, McCluskey SA, et al. Transversus abdominis plane block reduces morphine consumption in the early postoperative period following microsurgical abdominal tissue breast reconstruction: a double-blind, placebo-controlled, randomized trial. Plast Reconstr Surg. 2014 Nov;134(5):870–8. https://doi.org/10.1097/PRS.0000000000000613 PMID:25347623
21. Zhong T, Wong KW, Cheng H, Ojha M, Srinivas C, McCluskey SA, et al. Transversus abdominis plane (TAP) catheters inserted under direct vision in the donor site following free DIEP and MS-TRAM breast reconstruction: a prospective cohort study of 45 patients. J Plast Reconstr Aesthet Surg. 2013 Mar;66(3):329–36. https://doi.org/10.1016/j.bjps.2012.09.034 PMID:23142025
22. Cubitt J, Barber Z, Khan AA, Tyler M. Breast reconstruction with deep inferior epigastric perforator flaps. Ann R Coll Surg Engl. 2012 Nov;94(8):552–8. https://doi.org/10.1308/003588412X13373405386457 PMID:23131224
23. Pardo C, Muñoz T, Chamorro C; Analgesia and Sedation Work Group of SEMICYUC. Monitorización del dolor. Recomendaciones del grupo de trabajo de analgesia y sedación de la SEMICYUC. Med Intensiva. 2006 Nov;30(8):379–85. https://doi.org/10.1016/S0210-5691(06)74552-1 PMID:17129536
24. Kroll SS, Sharma S, Koutz C, Langstein HN, Robb GL, Chang DW, et al.; Evans GRD. Postoperative morphine requirements of free TRAM and DIEP flaps. Plast Reconstr Surg. 2001 Feb;107(2):338–41. https://doi.org/10.1097/00006534-200102000-00006 PMID:11214047
25. Momeni A, Ramesh NK, Wan D, Nguyen D, Sorice SC. Postoperative analgesia after microsurgical breast reconstruction using liposomal bupivacaine (Exparel). Breast J. 2019 Sep;25(5):903–7. https://doi.org/10.1111/tbj.13349 PMID:31131501
26. Martinez L, Ekman E, Nakhla N. Perioperative Opioid-sparing Strategies: Utility of Conventional NSAIDs in Adults. Clin Ther. 2019 Dec;41(12):2612–28. https://doi.org/10.1016/j.clinthera.2019.10.002 PMID:31733939
27. Helander EM, Menard BL, Harmon CM, Homra BK, Allain AV, Bordelon GJ, et al. Multimodal Analgesia, Current Concepts, and Acute Pain Considerations. Curr Pain Headache Rep. 2017 Jan;21(1):3. https://doi.org/10.1007/s11916-017-0607-y PMID:28132136
28. González-García J, González-Bada A, López-Ramos JM, Echevarria-Correas MA, Muñecas-Herreras MB, Aguilera-Celorrio L. Estudio prospectivo, aleatorizado comparativo entre el bloqueo guiado por ultrasonidos de las ramas cutáneas laterales de los nervios intercostales frente a analgesia convencional en cirugía no reconstructiva de mama. Rev Esp Anestesiol Reanim. 2019 Mar;66(3):137–43. https://doi.org/10.1016/j.redar.2018.11.001.
29. Elsharkawy H, Pawa A, Mariano ER. Interfascial Plane Blocks: back to Basics. Reg Anesth Pain Med. 2018 May;43(4):341–6. https://doi.org/10.1097/AAP.0000000000000750 PMID:29561295
30. Coopey SB, Specht MC, Warren L, Smith BL, Winograd JM, Fleischmann K. Use of preoperative paravertebral block decreases length of stay in patients undergoing mastectomy plus immediate reconstruction. Ann Surg Oncol. 2013 Apr;20(4):1282–6. https://doi.org/10.1245/s10434-012-2678-7 PMID:23064793
31. Shah A, Rowlands M, Krishnan N, Patel A, Ott-Young A. Thoracic Intercostal Nerve Blocks Reduce Opioid Consumption and Length of Stay in Patients Undergoing Implant-Based Breast Reconstruction. Plast Reconstr Surg. 2015 Nov;136(5):584e–91e. https://doi.org/10.1097/PRS.0000000000001717 PMID:26505714
32. Fernández Martín MT, López Álvarez S. Bloqueos BRILMA y PEC: opciones más sencillas y adecuadas en cirugía radical de mama. Rev Esp Anestesiol Reanim. 2018 Oct;65(8):478–9. https://doi.org/10.1016/j.redar.2018.04.004.
33. Honkanen N, Mustonen L, Kalso E, Meretoja T, Harno H. Breast reconstruction after breast cancer surgery – persistent pain and quality of life 1-8 years after breast reconstruction. Scand J Pain. 2021 Jun;21(3):522–9. https://doi.org/10.1515/sjpain-2021-0026 PMID:34087967
34. Bar-Meir ED, Yueh JH, Hess PE, Hartmann CE, Maia M, Tobias AM, et al. Postoperative Pain Management in DIEP Flap Breast Reconstruction: Identification of Patients With Poor Pain Control [Internet]. Eplasty. 2010 Sep;10:e59. Available from: https://pubmed.ncbi.nlm.nih.gov/20862295 PMID:20862295
35. Oh J, Pagé MG, Zhong T, McCluskey S, Srinivas C, O’Neill AC, et al. Chronic Postsurgical Pain Outcomes in Breast Reconstruction Patients Receiving Perioperative Transversus Abdominis Plane Catheters at the Donor Site: A Prospective Cohort Follow-up Study. Pain Pract. 2017 Nov;17(8):999–1007. https://doi.org/10.1111/papr.12550 PMID:27996199
36. Chapman CR, Vierck CJ. The Transition of Acute Postoperative Pain to Chronic Pain: An Integrative Overview of Research on Mechanisms. J Pain. 2017 Apr;18(4):359.e1–38. https://doi.org/10.1016/j.jpain.2016.11.004 PMID:27908839
37. Fahy AS, Jakub JW, Dy BM, Eldin NS, Harmsen S, Sviggum H, et al. Paravertebral blocks in patients undergoing mastectomy with or without immediate reconstruction provides improved pain control and decreased postoperative nausea and vomiting. Ann Surg Oncol. 2014 Oct;21(10):3284–9. https://doi.org/10.1245/s10434-014-3923-z PMID:25034821

 ORCID
ORCID