Recibido: 10-09-2021
Aceptado: 22-12-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 4 pp. 385-389|https://doi.org/10.25237/revchilanestv5110051453
PDF|ePub|RIS
Weaning and efficacy of gasometry
Abstract
The gasometric analysis offers a formal evaluation in the process of weaning for the mechanical ventilation (MV). Gasometry and clinical symptoms allow the identificaron of patients who are candidates for a spontaneous breathing test (SBT). The decrease in SvcO2 > 5.4% and the increase in APv-aCO2 > 40%, after 30 minutes of SBT, predict with very good precision failure to remove MV. The oxygenation indices (IsOx) show changes and also change at the end of the SBT and could predict extubation failure, but cut-off points need to be established in pulmonary and non-pulmonary problems.
Resumen
El análisis gasométrico ofrece una evaluación formal en el proceso de weaning y para retiro de la ventilación mecánica (VM). La gasometría y la clínica permiten identificar a los pacientes candidatos a una prueba de respiración espontánea (PRE). La disminución de la SvcO2 > 5,4% y el incremento del APv-aCO2 > 40%, posterior a 30 minutos de PRE predicen con muy buena precisión fracaso en el retiro de la VM. Los índices de oxigenación (IsOx) presentan cambios también se modifican al final de la PRE y podría predecir fracaso en la extubación, pero se necesita establecer puntos de corte en problemas pulmonares y no pulmonares.
-
Introducción
El análisis gasométrico ofrece una evaluación formal en el proceso de weaning y para retiro de la ventilación mecánica (VM). La gasometría permite identificar a los pacientes candidatos a una prueba de respiración espontanea (PRE) y aquellos que pueden iniciar el weaning, incluso a los que tienen mayor posibilidad de ser extubados[1]. La utilidad de la gasometría para evaluar el equilibrio ácido base y el intercambio de gases (oxigenación y ventilación) es bien conocida[2]. Sin embargo, también puede clasificar la severidad de un problema pulmonar a través de los índices de oxigenación, llevar a cabo “monitoreo hemodinámico” mediante la saturación venosa central de oxígeno (SvcO2), la diferencia de presión venoarterial de dióxido de carbono (ΔPv-aCO2) o de la diferencia de presión venoarterial de dióxido de carbono/diferencia del contenido arteriovenoso de oxígeno (ΔPv-aCO2/ΔCa-vO2) o determinar el pronóstico con los valores del déficit de base (DB) y el lactato[3]. Finalmente, el weaning y el retiro de la VM es el objetivo de esta revisión.
Retrasar el inicio del weaning incrementa la morbimortalidad (OR 1,10)[4]. De hecho, los médicos somos un factor de riesgo independiente para buenos o malos resultados (OR 0,92) [5]. Sin embargo, utilizar un protocolo para retiro de la VM me jora el desenlace[6]. El 30% al 50% del tiempo en VM corresponde al proceso de weaning[7]. Esto permite considerar que toda maniobra que disminuya el tiempo de desconexión, repercute en la sobrevida[8]. Cuando el paciente con VM fracasa al proceso de weaning o a la extubación esto convierte inmediatamente al weaning en “difícil”, lo anterior indica: 1) resolución incompleta del problema; 2) evaluación incorrecta u omisión o 3) problema nuevo agregado. Las causas implicadas en el fracaso del weaning son: factores neurológicos, insuficiencia de la bomba cardiaca, insuficiencia de la bomba respiratoria y factores metabólicos, dichos mecanismos pueden presentarse solos o combinados[9]. Consecuentemente, el fracaso en la extuba- ción incrementará el riesgo de muerte hasta en 30%, solo por reintubar al paciente. Por lo anterior, resulta importante identificar a aquellos pacientes con mayor riesgo de fracaso, antes de ser extubados[10]. La relación VO2/DO2 (consumo de oxígeno/ disponibilidad de oxígeno) es la variable a considerar durante el weaning. El incremento del VO2 secundario al aumento del trabajo respiratorio, acompañado de DO2 insuficiente durante el weaning se asocia a fracaso en el retiro de la VM[11]. Es aquí donde la gasometría se convierte en una herramienta asequible y confiable para evaluar dicho proceso.
-
Método
Se realizó una revisión no sistemática de la literatura de artículos publicados entre 2000 y 2021 en las bases de datos de PubMed, OvidSP y ScienceDirect, se utilizaron los términos de búsqueda en español e inglés: weaning, extubación, saturación venosa central de oxígeno, diferencia de presión venoarterial de dióxido de carbono e índices de oxigenación. La selección de artículos se hizo de acuerdo con el título y resumen, se incluyeron estudios de revisión, observacionales e intervención, eliminando los que no aportan información relevante para el objetivo o estaban fuera de la fecha de búsqueda. Las conclusiones de esta revisión son conforme a la perspectiva de los autores.
-
Argumento fisiopatológico
La “bomba respiratoria” se integra por los músculos inspi- ratorios y espiratorios. El diafragma genera aproximadamente el 80% del trabajo para inspirar de forma activa, en cambio, para que la espiración ocurra deben relajarse los músculos ins- piratorios, la presión alveolar y atmosférica deben igualarse y el volumen intrapulmonar debe superar el de reposo, proceso pasivo favorecido por la elasticidad pulmonar[12]. El trabajo respiratorio total que realiza un paciente con ventilación mecánica invasiva (VMI) en modalidad espontánea, consta de 2 componentes: impuesto y fisiológico. El trabajo respiratorio impuesto (generado por tubo endotraqueal y circuito respiratorio), es una carga adicional y ocurre por resistencia al flujo[13], por otra parte, el trabajo respiratorio fisiológico incluye un componente elástico y el de resistencia. El trabajo respiratorio normal oscila entre 0,3 y 0,6 Joule/L[14]. El trabajo respiratorio (impuesto y fisiológico) puede ser evaluado mediante el diagrama de Cam- pbell, a su vez si el ventilador mecánico cuenta con hardware y software apropiado podría ser calculado por el equipo[15]. El incremento de la carga sobre el diafragma aumenta su fuerza y tiempo de contracción o índice de tensión-tiempo diafragmático (TTdi) con el cual podemos tener una aproximación de la demanda energética del musculo. La disfunción muscular se puede presentar de 2 formas: 1) fatiga, secundaria a músculos sobrecargados y 2) atrofia, secundaria a músculos totalmente descargados. La falla de la bomba respiratoria sucederá cuando la demanda o consumo de energía excedan el suministro[16]. El incremento del trabajo respiratorio y la consecuente falla de la bomba respiratoria puede ser evaluada mediante la relación VO2/DO2, la cual se puede inferir con variables obtenidas de la gasometría (arterial y venosa central) como son SvcO2(consumo de oxígeno) y ΔPv-aCO2 (disponibilidad de oxígeno), sumando los índices de oxigenación por su alto valor en los problemas pulmonares. En cualquier paciente el VO2 se puede calcular con el principio Fick de la siguiente manera: VO2 (ml/min/kg) = GC x (CaO2 – CvO2), donde GC = gasto cardiaco, CaO2 = contenido arterial de oxígeno y CvO2 = contenido venoso de oxígeno, el resultado se multiplica por 10 porque el GC se mide en L/ min, mientras que el CaO2 y el CvO2 en ml/dl. Otra variable que debemos considerar es la disponibilidad de oxígeno, calculada con la siguiente formula: DO2 (ml/min/kg) = GC x CaO2. Finalmente, la relación entre el VO2 y el DO2 se puede evaluar con la extracción de oxígeno (EO2), la cual oscila entre 20% a 30% y la calculamos con la fórmula: EO2 = (CaO2 – CvO2) / CaO2[17].
-
¿Cómo predice falla en la extubación la SvcO2?
La SvcO2 es un excelente subrogado de la relación VO2/DO2, en otras palabras, traduce el estado de oxigenación celular de forma confiable. Según lo anterior, la EO2 también refleja la relación VO2/DO2, el incremento de la EO2 ocasiona disminución de la SvcO2 por aumento del VO2 y la disminución de la EO2 ocasiona incremento de la SvcO2 por disminución del VO2[18]. La intervención a una SvcO2 baja, no es el incremento de la DO2, tal vez la mejor opción es la disminución del VO2, por otro lado, la SvcO2 elevada indica VO2 disminuido, aunque esto no excluye la necesidad de intervención[19]. Lo más importante al analizar la SvcO2 es evaluar de forma organizada sus determinantes: 1) ingreso de oxígeno (SaO2); 2) transporte de oxígeno (Hb); 3) disponibilidad del oxígeno (DO2) y 4) consumo de oxígeno (VO2) [20].
Una manera objetiva de evaluar el trabajo respiratorio es a través del VO2. En personas sanas el VO2 de los músculos respiratorios no supera el 5% del VO2 corporal total, porcentaje empleado para vencer las fuerzas elásticas y resistivas. En pacientes con “falla respiratoria” el VO2 de los músculos respiratorios supera fácilmente este valor, documentándose que con un valor superior al 15%, la posibilidad de fracasar en el retiro de la ventilación mecánica incrementa. El VO2 “normal” en un paciente “sano” es en promedio 3,5 ml/min/kg, pero el VO2máx (consumo de oxígeno máximo) es de 24 ml/min/kg, aunque podría variar según la edad, sexo y acondicionamiento físico. El VO2 corporal total varía en proporción a la carga de trabajo impuesta sobre el sistema respiratorio, por lo que, la diferencia entre el VO2 medido durante la ventilación mecánica controlada y el VO2 durante la ventilación mecánica espontanea es información clínicamente útil durante el proceso de weaning o en la decisión de retiro de la ventilación mecánica[21]-[23].
El VO2 se puede medir utilizando calorimetría indirecta o si contamos con el gasto cardiaco (GC) lo podríamos obtener de la siguiente manera: VO2 = GC (CaO2 – CvO2)[24]. De forma sencilla, cambios en el VO2 se verán reflejados en la SvcO2 con una relación inversamente proporcional, > VO2 = < SvcO2 y < VO2 = > SvcO2. Los cambios en el VO2 y la SvcO2 se han utilizado para predecir la capacidad de respirar espontáneamente y éxito extubación, en este proceso de retiro de la ventilación mecánica, la SvcO2 advierte rápidamente cambios agudos de la relación VO2/DO2[25].
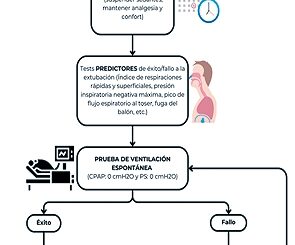
Una vez que el paciente tolera la PRE,[26] con presión soporte < 7 cmH2O y PEEP (Positive End Expiratory Pressure) < 8 cmH2O,[27] realizar gasometría arterial y venosa central para obtener SvcO2 y ΔPv-aCO2, posterior a esto disminuir la PEEP a 0 cmH2O y mantener presión soporte < 7 cmH2O, otra opción es colocar al paciente en “pieza T”, ambas maniobras durante 30 minutos. En caso de que el paciente presente datos de mala tolerancia a la prueba[26],[27] antes de los 30 minutos, deberá reiniciarse la ventilación mecánica asistocontrolada en modo volumen o presión. Por otro lado, si presenta tolerancia a la prueba llegando a los 30 minutos, realice nuevamente gasometría arterial y venosa central para obtener SvcO2 y ΔPv-aCO2, evalué los cambios en estas variables, dependiendo de ellos determine si el paciente es candidato a ser extubado.
Múltiples estudios han evaluado la ScvO2 y su capacidad para predecir fracaso en el retiro de la VM, todos tiene en común que el descenso de la SvcO2 posterior a la PRE predice de forma independiente fracaso en el retiro de la VM. Diferentes son los puntos de corte que se han obtenido como resultado, su aparición a través del tiempo es: Teixeira y cols.[28] en 2010, documentaron disminución de la SvcO2 > 4,5%, Martínez y cols.[29] en 2015, > 6,33%, Georgakas y cols.[30] en 2018, > 4%, Williams y cols.[31] en 2020, > 9,8%, Mallat y cols.[32] en 2020 > 5,4% y finalmente Ashmawi y cols.[33] en 2020, > 3,8%. Los valores difieren en sensibilidad, especificidad y área bajo la curva (ABC).
-
¿Cómo predice falla en la extubación APv-aCO2?
La relación entre producción de dióxido de carbono (VCO2) y GC está bien documentada[34]. El ΔPv-aCO2 es la diferencia entre la PCO2 venosa central y la PCO2 arterial con un valor normal < 6 mmHg[35]. El ΔPv-aCO2 > 6 mmHg ocurre por disminución del aclaramiento del CO2, relacionado a la disminución del flujo sanguíneo. En otras palabras, el aumento del VO2 va de la mano del incremento de la VCO2, si el flujo sanguíneo es apropiado GC idóneo, el CO2 será bien eliminado y el ΔPv-aCO2 será < 6 mmHg, pero sin el flujo sanguíneo es inapropiado, el CO2 será mal eliminado y el ΔPv-aCO2 > 6 mmHg (GC no idóneo). Cuando aplicamos la ecuación de Fick al CO2, entendemos que la VCO2 depende del gasto cardiaco y de la diferencia entre el contenido de CO2 de la sangre venosa (CvCO2) y el contenido de CO2 en sangre arterial (CaCO2) o VCO2 = GC x (CvCO2 – CaCO2). De esta forma, podemos sustituir los contenidos de CO2 (CCO2) por las presiones parciales de CO2, por lo tanto: ΔPv-aCO2 =k x (PvCO2 – PaCO2), donde k = relación entre PCO2 y CCO2. En este contexto, con la ecuación de Fick modificada podemos calcular la VCO2 de la siguiente manera: ΔPv-aCO2 = (k x VCO2)/GC. De modo que, el principal determinante de los cambios en el ΔPv-aCO2 es el GC, siendo inversamente proporcional: < GC = > ΔPv-aCO2 y > GC = < ΔPv-aCO2[36]-[40]. Cuando un paciente en PRE presenta datos de mala tolerancia e incrementa su trabajo respiratorio, esto aumentará su VO2 y su VCO2, si el GC no es el idóneo y el flujo sanguíneo es inapropiado (DO2 insuficiente), disminuirá la eliminación del CO2 y consecuentemente el ΔPv-aCO2 aumentará, lo que se asocia a fracaso en el retiro de la VM. Debe existir de forma obligada aumento de la DO2mediado por el GC “ideal” para satisfacer el VO2 necesario de los músculos respiratorios durante la PRE. Se ha planteado la hipótesis que el ΔPv-aCO2 durante la PRE valora la relación VO2/GC siendo un marcador útil de la adecuación del GC al VO2 y podría predecir fracaso en el retiro de la VM. Mallat y cols. evaluaron pacientes que recibieron VM más de 48 h a los cuales se les realizó PRE en “pieza T” durante 60 minutos. Se dividieron los pacientes en un grupo de éxito en el retiro de la VM y otro de fracaso, en este último la SvcO2 disminuyó y el ΔPv-aCO2 se incrementó, siendo factor de riesgo independiente. El mejor punto de corte para la SvcO2 fue disminución > 5,4% con ABC de 0,865, S = 67%, E = 86%, LR+ = 4,7, LR– = 0,4 y para el ΔPv-aCO2 el mejor punto de corte fue incremento > 40% con ABC de 0,856, S = 67%, E = 93%, LR+ = 9,5, LR– = 0,4, no existió diferencia estadisticamente significativa entre SvcO2 y ΔPv-aCO2 Cuando se combinan estas dos variables obtenemos ABC de 0. ,940, S = 56%, E = 96%, LR+ = 15,8, LR- = 0,46[41].
-
¿Cómo predicen falla en la extubación los índices de oxiganación?
Los índices de oxigenación (IsOx) tienen utilidad para evaluar mecanismo de hipoxemia, gravedad, tratamiento, evolución y pronóstico de los problemas pulmonares. Sencillamente, el intercambio de oxígeno, una opción simple para un problema complejo. Existen numerosos IsOx los cuales están basados en la “cascada de oxígeno”, dependen de la presión atmosférica (patm) y la fracción inspirada de oxígeno (FiO2), en los pacientes con VM también dependen de los determinantes de la presión media de la vía aérea (Paw). Los IsOx que más utilizamos son: 1) presión alveolar de oxígeno (PAO2); 2) diferencia alveolo- arterial de oxígeno [D(A-a)O2]; 3) presión arterial de oxígeno/ fracción inspirada de oxígeno (PaO2/FiO2); 4) presión arterial de oxígeno/presión alveolar de oxígeno (PaO2/PAO2); 5) diferencia alveoloarterial de oxígeno/ presión arterial de oxígeno [D(A-a) O2/PaO2] o también llamado índice respiratorio (IR) y el índice de oxigenación propiamente o IO [(presión media de la vía área x FiO2 x 100)/PaO2][42],[43]. Pocos trabajos han documentado la importancia de los índices de oxigenación como predictores de fracaso en la extubación. Cortés y cols.[44], llevaron a cabo un estudio en pacientes con VM invasiva > 48 h ingresados a la unidad de cuidados intensivos (UCI). Se midieron los IsOx antes y 30 minutos después de la PRE, en el grupo de fracaso en la extubación, la PaO2/FiO2 fue < 150 mmHg pos-PRE (media pre-PRE 279,5 mmHg), la PaO2/PAO2 fue < 0,4 pos-PRE (media pre-PRE 0,54) y el IR fue > 2 pos-PRE (media pre-PRE 1,32). Las limitantes del estudio es el tamaño de la muestra (50 pacientes), de los cuales solo el 24% de los pacientes tenían problema pulmonar (neumonía), la gran mayoría su problema fue neu- rológico, además, no se documentó el fracaso en la extuba- ción por subgrupos. Resulta evidente que la modificación de los IsOx al final de la PRE podría predecir fracaso en la extubación, pero se necesitan estudios con mayor número de pacientes, establecer puntos de corte en problemas pulmonares y no pulmonares. El IO es ampliamente utilizado en pediatría, tiene la característica de evaluar la gravedad del problema pulmonar, incluye el soporte ventilatorio a través de los determinantes de la presión media de la vía aérea[45]. No existen estudios que evalúen su utilidad en el retiro de la VM.
-
Conclusión
La disminución de la SvcO2 > 5,4% y el incremento del ΔPv-aCO2 > 40%, posterior a 30 minutos de PRE predicen con muy buena precisión fracaso en el retiro de la VM con ABC de 0,940, donde, los cambios en el VO2 se verán reflejados en la SvcO2 con una relación inversamente proporcional, > VO2 = < SvcO2 y < VO2 = > SvcO2, por otro lado, el principal determinante de los cambios en el ΔPv-aCO2 es el GC, siendo inversamente proporcional: < GC = > ΔPv-aCO2 y > GC = < ΔPv-aCO2. Debe existir de forma obligada aumento de la DO2 mediado por el GC “ideal” para satisfacer el VO2 necesario de los músculos respiratorios durante la PRE. Se puede utilizar la SvcO2 y el ΔPv- aCO2 de forma individual para predecir fracaso en el retiro de la VM, pero por separado su ABC es menor con 0,865 y 0,856 respectivamente. Los IsOx también se modifican al final de la PRE y podría predecir fracaso en la extubación, pero se necesita establecer puntos de corte en problemas pulmonares y no pulmonares.
Referencias
1. Soo Hoo GW. Blood gases, weaning, and extubation. Respir Care. 2003 Nov;48(11):1019–21. PMID:14585112
2. Pawson SR, DePriest JL. Are blood gases necessary in mechanically ventilated patients who have successfully completed a spontaneous breathing trial? Respir Care. 2004 Nov;49(11):1316–9. PMID:15507165
3. Sánchez-Díaz JS, Peniche-Moguel KG, Rivera-Solís G, Martínez-Rodríguez EA, Del-Carpio-Orantes L, Pérez-Nieto OR, et al. Hemodynamic monitoring with two blood gases: “a tool that does not go out of style”. Colomb. J. Anesthesiol. [Internet]. 2020 Aug;49(1): https://doi.org/10.5554/22562087.e928.
4. Peñuelas O, Frutos-Vivar F, Fernández C, Anzueto A, Epstein SK, Apezteguía C, et al.; Ventila Group. Characteristics and outcomes of ventilated patients according to time to liberation from mechanical ventilation. Am J Respir Crit Care Med. 2011 Aug;184(4):430–7. https://doi.org/10.1164/rccm.201011-1887OC PMID:21616997
5. Béduneau G, Pham T, Schortgen F, Piquilloud L, Zogheib E, Jonas M, et al.; WIND (Weaning according to a New Definition) Study Group and the REVA (Réseau Européen de Recherche en Ventilation Artificielle) Network ‡. Epidemiology of Weaning Outcome according to a New Definition. The WIND Study. Am J Respir Crit Care Med. 2017 Mar;195(6):772–83. https://doi.org/10.1164/rccm.201602-0320OC PMID:27626706
6. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017 Mar;43(3):304–77. https://doi.org/10.1007/s00134-017-4683-6 PMID:28101605
7. Correger E, Murias G, Chaconc E, Estrugac A, Sales B, LopezAguilar J, et al. Interpretación de las curvas del respirador en pacientes con insuficiencia respiratoria aguda. Med Intensiva. 2012;36:294-306. https://doi.org/10.1016/j.medin.2011.08.005..
8. Pingleton SK. Complications associated with mechanical ventilation. Tobin MJ, editores. Principles and practice of mechanical ventilation. New York: McGraw-Hill; 1994. pp. 775–92.
9. Perren A, Brochard L. Managing the apparent and hidden difficulties of weaning from mechanical ventilation. Intensive Care Med. 2013 Nov;39(11):1885–95. https://doi.org/10.1007/s00134-013-3014-9 PMID:23863974
10. Sánchez-Díaz JS, Flores-Hernández R, Martínez-Rodríguez EA, Peniche-Moguel KG, Huanca-Pacaje JM, Calyeca-Sánchez MV. Respiración de Biot. Fracaso de la extubación. Med Crit. 2016;30:347–50.
11. Hubmayr RD, Loosbrock LM, Gillespie DJ, Rodarte JR. Oxygen uptake during weaning from mechanical ventilation. Chest. 1988 Dec;94(6):1148–55. https://doi.org/10.1378/chest.94.6.1148 PMID:3142721
12. Laghi F, Tobin MJ. Disorders of the respiratory muscles. Am J Respir Crit Care Med. 2003 Jul;168(1):10–48. https://doi.org/10.1164/rccm.2206020 PMID:12826594
13. Banner MJ, Kirby RR, Blanch PB, Layon AJ. Decreasing imposed work of the breathing apparatus to zero using pressure-support ventilation. Crit Care Med. 1993 Sep;21(9):1333–8. https://doi.org/10.1097/00003246-199309000-00017 PMID:8370298
14. Otis AB. The work of breathing. Handbook of physiology: A critical, comprehensive presentation of physiological knowledge and concepts. Section 3. Respiration, pp. 463-476. https://doi.org/10.1152/physrev.1954.34.3.449.
15. Kallet RH, Hemphill JC 3rd, Dicker RA, Alonso JA, Campbell AR, Mackersie RC, et al. The spontaneous breathing pattern and work of breathing of patients with acute respiratory distress syndrome and acute lung injury. Respir Care. 2007 Aug;52(8):989–95. PMID:17650353
16. Bellemare F, Wight D, Lavigne CM, Grassino A. Effect of tension and timing of contraction on the blood flow of the diaphragm. J Appl Physiol. 1983 Jun;54(6):1597–606. https://doi.org/10.1152/jappl.1983.54.6.1597 PMID:6874482
17. Dunn JO, Mythen MG, Grocott MP. Physiology of oxygen transport. BJA Educ. 2016 Oct;16(10):341–8. https://doi.org/10.1093/bjaed/mkw012.
18. Gutierrez G. Central and Mixed Venous O2 Saturation. Turk J Anaesthesiol Reanim. 2020 Feb;48(1):2–10. https://doi.org/10.5152/TJAR.2019.140 PMID:32076673
19. Gattinoni L, Vasques F, Camporota L, Meessen J, Romitti F, Pasticci I, et al. Understanding Lactatemia in Human Sepsis. Potential Impact for Early Management. Am J Respir Crit Care Med. 2019 Sep;200(5):582–9. https://doi.org/10.1164/rccm.201812-2342OC PMID:30985210
20. Gattinoni L, Pesenti A, Matthay M. Understanding blood gas analysis. Intensive Care Med. 2018 Jan;44(1):91–3. https://doi.org/10.1007/s00134-017-4824-y PMID:28497267
21. Bellani G, Foti G, Spagnolli E, Milan M, Zanella A, Greco M, et al. Increase of oxygen consumption during a progressive decrease of ventilatory support is lower in patients failing the trial in comparison with those who succeed. Anesthesiology. 2010 Aug;113(2):378–85. https://doi.org/10.1097/ALN.0b013e3181e81050 PMID:20613464
22. Shikora SA, Benotti PN, Johannigman JA. The oxygen cost of breathing may predict weaning from mechanical ventilation better than the respiratory rate to tidal volume ratio. Arch Surg. 1994 Mar;129(3):269–74. https://doi.org/10.1001/archsurg.1994.01420270045011 PMID:8129602
23. Shete AN, Bute SS, Deshmukh PR. A Study of VO2 Max and Body Fat Percentage in Female Athletes. J Clin Diagn Res. 2014 Dec;8(12):BC01–03. https://doi.org/10.7860/JCDR/2014/10896.5329 PMID:25653935
24. Posadas CJ, Ugarte TA, Domínguez CG. El transporte y la utilización tisular de oxígeno de la atmósfera a la mitocondria. Neumol Cir Torax. 2006;65(2):60–7.
25. Ellens T, Kaur R, Roehl K, Dubosky M, Vines DL. Ventilatory equivalent for oxygen as an extubation outcome predictor: A pilot study [published correction appears in Can J Respir Ther. 2019 Sep 16;55:72]. Can J Respir Ther. 2019;55:65-71. Published 2019 Jul 9. https://doi.org/10.29390/cjrt-2019-007.
26. Saeed F, Lasrado S. Extubation[Updated 2021 Jan 8] StatPearls [Internet]Treasure Island (FL): StatPearls Publishing; 2021 Jan., Available from https://www.ncbi.nlm.nih.gov/books/NBK539804/
27. Girard TD, Alhazzani W, Kress JP, Ouellette DR, Schmidt GA, Truwit JD, et al.; ATS/CHEST Ad Hoc Committee on Liberation from Mechanical Ventilation in Adults. An Official American Thoracic Society/American College of Chest Physicians Clinical Practice Guideline: Liberation from Mechanical Ventilation in Critically Ill Adults. Rehabilitation Protocols, Ventilator Liberation Protocols, and Cuff Leak Tests. Am J Respir Crit Care Med. 2017 Jan;195(1):120–33. https://doi.org/10.1164/rccm.201610-2075ST PMID:27762595
28. Teixeira C, da Silva NB, Savi A, Vieira SR, Nasi LA, Friedman G, et al. Central venous saturation is a predictor of reintubation in difficult-to-wean patients. Crit Care Med. 2010 Feb;38(2):491–6. https://doi.org/10.1097/CCM.0b013e3181bc81ec PMID:19789441
29. Martínez Medina M, Cendejas Gutiérrez M, Brito Zurita OR. Delta de saturación venosa central de O2 como pronóstico de disfunción diastólica y fracaso del retiro del ventilador. Rev. Asoc. Mex. Med. Crít. Ter. Intensiva. 2015;29(3):145–51.
30. Georgakas I, Boutou AK, Pitsiou G, Kioumis I, Bitzani M, Matei K, et al. Central Venous Oxygen Saturation as a Predictor of a Successful Spontaneous Breathing Trial from Mechanical Ventilation: A Prospective, Nested Case-Control Study. Open Respir Med J. 2018 Mar;12(1):11–20. https://doi.org/10.2174/1874306401812010011 PMID:29643948
31. Williams J, McLean A, Ahari J, Jose A, Al-Helou G, Ibi I, et al. Decreases in Mixed Venous Blood O2 Saturation in Cardiac Surgery Patients Following Extubation. J Intensive Care Med. 2020 Mar;35(3):264–9. https://doi.org/10.1177/0885066617741435 PMID:29141527
32. Mallat J, Baghdadi FA, Mohammad U, Lemyze M, Temime J, Tronchon L, et al. Central Venous-to-Arterial PCO2 Difference and Central Venous Oxygen Saturation in the Detection of Extubation Failure in Critically Ill Patients. Crit Care Med. 2020 Oct;48(10):1454–61. https://doi.org/10.1097/CCM.0000000000004446 PMID:32520890
33. Ashmawi SS, Salem HM, Nagy ME. Central venous oxygen saturation as a predictor of failure of weaning from mechanical ventilation. Egypt J Chest Dis Tuberc. 2020;69(1):155–61. https://doi.org/10.4103/ejcdt.ejcdt_92_19.
34. Van der Linden P, Rausin I, Deltell A, Bekrar Y, Gilbart E, Bakker J, et al. Detection of tissue hypoxia by arteriovenous gradient for PCO2 and pH in anesthetized dogs during progressive hemorrhage. Anesth Analg. 1995 Feb;80(2):269–75. https://doi.org/10.1097/00000539-199502000-00012 PMID:7818112
35. Groeneveld AB. Interpreting the venous-arterial PCO2 difference. Crit Care Med. 1998 Jun;26(6):979–80. https://doi.org/10.1097/00003246-199806000-00002 PMID:9635634
36. Teboul JL, Mercat A, Lenique F, Berton C, Richard C. Value of the venous-arterial PCO2 gradient to reflect the oxygen supply to demand in humans: effects of dobutamine. Crit Care Med. 1998 Jun;26(6):1007–10. https://doi.org/10.1097/00003246-199806000-00017 PMID:9635647
37. Teboul JL, Mercat A, Lenique F, Berton C, Richard C. Value of the venous-arterial PCO2 gradient to reflect the oxygen supply to demand in humans: effects of dobutamine. Crit Care Med. 1998 Jun;26(6):1007–10. https://doi.org/10.1097/00003246-199806000-00017 PMID:9635647
38. Ospina-Tascón GA, Hernández G, Cecconi M. Understanding the venous-arterial CO2 to arterial-venous O2 content difference ratio. Intensive Care Med. 2016 Nov;42(11):1801–4. https://doi.org/10.1007/s00134-016-4233-7 PMID:26873834
39. Yuan S, He H, Long Y. Interpretation of venous-to-arterial carbon dioxide difference in the resuscitation of septic shock patients. J Thorac Dis. 2019 Jul;11(S11 Suppl 11):S1538–43. https://doi.org/10.21037/jtd.2019.02.79 PMID:31388458
40. Gavelli F, Teboul JL, Monnet X. How can CO2-derived indices guide resuscitation in critically ill patients? J Thorac Dis. 2019 Jul;11(S11 Suppl 11):S1528–37. https://doi.org/10.21037/jtd.2019.07.10 PMID:31388457
41. Mallat J, Baghdadi FA, Mohammad U, Lemyze M, Temime J, Tronchon L, et al. Central Venous-to-Arterial PCO2 Difference and Central Venous Oxygen Saturation in the Detection of Extubation Failure in Critically Ill Patients. Crit Care Med. 2020 Oct;48(10):1454–61. https://doi.org/10.1097/CCM.0000000000004446 PMID:32520890
42. Armstrong J, Guleria A, Girling K. Evaluation of gas exchange deficit in the critically ill. Contin Educ Anaesth Crit Care Pain. 2007;7(4):131–4. https://doi.org/10.1093/bjaceaccp/mkm024.
43. González-Escudero EA, Sánchez-Díaz JS, Hernández-Leyva IM, Peniche-Moguel KG, Villegas-Domínguez JE, Calyeca-Sánchez MV. Índices de oxigenación en los pacientes neuroquirúrgicos utilizando dos estrategias ventilatorias en el perioperatorio. Med Crit. 2020;34(5):265–72. https://doi.org/10.35366/96456.
44. Cortés-Román JS, Sánchez-Díaz JS, Castañeda-Valladares E, Peniche-Moguel KG, Gutiérrez-Jímenez AA, Calyeca-Sánchez MV. Índices de oxigenación como predictores de fracaso en la extubación en pacientes críticamente enfermos. Acta Colomb Cuid Intensivo. 2018;18(3):140–6. https://doi.org/10.1016/j.acci.2018.04.001.
45. Trachsel D, McCrindle BW, Nakagawa S, Bohn D. Oxygenation index predicts outcome in children with acute hypoxemic respiratory failure. Am J Respir Crit Care Med. 2005 Jul;172(2):206–11. https://doi.org/10.1164/rccm.200405-625OC PMID:15817802

 ORCID
ORCID