Verónica Maureira Moreno1,2, Anamaría Correa Bustillos1,2
Recibido: 26-05-2022
Aceptado: 28-05-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 4 pp. 492-501|https://doi.org/10.25237/revchilanestv5115061100
PDF|ePub|RIS
Technologies and strategies for mechanical ventilation in pediatric patient’s anesthesia
Abstract
Safe mechanical ventilation in pediatric anesthesia includes the use of protective ventilatory strategies. In anesthesia, the evidence-based literature is scarce and derives from intensive care and adult patients. New technologies, monitoring and knowledge of applied pathophysiology allow these data to be extrapolated. The technological advance in ventilators of the new anesthesia machines has allowed its use in smaller patients with greater safety, deploying more ventilatory modes for use in the operating room. The programming of the ventilator must be done looking for physiological objectives according to the stage of the child’s development, step of anesthesia and surgery, in a dynamic and individualized way. This narrative review aims to summarize the available evidence about intraoperative pediatric mechanical ventilation and provide practical clinical recommendations aimed at optimizing the performance of the anesthesia machine, applying safe ventilatory strategies in pediatric patients.
Resumen
Una ventilación mecánica segura en anestesia pediátrica incluye el uso de estrategias ventilatorias protectoras. En anestesia la literatura basada en la evidencia al respecto es escasa, deriva del intensivo y del paciente adulto. Las nuevas tecnologías, moni- torización y el conocimiento de la fisiopatología aplicada, permiten extrapolar estos datos. El desarrollo del avance tecnológico de los ventiladores de las nuevas máquinas de anestesia, ha permitido su uso en pacientes cada vez más pequeños y con mayor seguridad, desplegando más modos ventilatorios para uso en pabellón. La programación del ventilador debe ser buscando objetivos fisiológicos según la etapa del desarrollo del niño, la etapa del proceso anestésico y la cirugía, de manera dinámica e individualizada. La presente revisión narrativa pretende resumir la evidencia disponible sobre ventilación mecánica pediátrica intraoperatoria y entregar recomendaciones clínicas prácticas orientadas a optimizar las prestaciones de la máquina de anestesia, aplicando estrategias ventilatorias seguras en el paciente pediátrico.
-
Introducción
La ventilación mecánica (VM) es un procedimiento invasivo de apoyo a la función ventilatoria, que debe dominar todo anestesiólogo que atienda a pacientes pediátricos.
Existe amplia literatura que valida su uso en pacientes críticos adultos, siendo ésta más limitada en el paciente pediátrico y en anestesia. En ambos casos las recomendaciones suelen ser una extensión de las unidades de cuidados intensivos (UCI).
En pabellón y UCI, hay diferencias en los equipos disponibles para ventilar a los pacientes. En el ámbito quirúrgico, la mayoría de las anestesias y procedimientos comprenden una VM por períodos cortos de tiempo, con cambios significativos de la compliance pulmonar por manipulación quirúrgica, sumado al uso de bloqueadores neuromusculares, que obligan a utilizar modos ventilatorios controlados.
Las máquinas de anestesia han evolucionado significativamente en la última década, mejorando las prestaciones del ventilador, su monitorización y las tecnologías asociadas. Y aunque comparten elementos similares, la variación entre ellas es cada vez mayor, por lo cual, es necesario que los anestesiólogos conozcan sus características antes de utilizarlas, particularmente en pacientes pediátricos, los que por su anatomía y fisiología en desarrollo presentan aspectos distintivos a considerar para realizar una VM segura, sobretodo en neonatos y lactantes menores, siendo la mo- nitorización de la VM y de la función respiratoria un punto crítico.
Un estudio reciente en Francia demuestra que existe una gran heterogeneidad del manejo ventilatorio durante la anestesia en el grupo etario pediátrico[1].
El objetivo de esta revisión es resumir la evidencia disponible sobre VM pediátrica intraoperatoria y entregar recomendaciones clínicas prácticas orientadas a optimizar las prestaciones de la máquina de anestesia, aplicando estrategias ventilatorias seguras en un paciente pediátrico. La monitorización de la VM será abordada en una próxima revisión.
-
Metodología
Se realizó una búsqueda iterativa de evidencia científica publicada en la base de datos electrónica MEDLINE/pubMed. Adicionalmente, se realizó una búsqueda manual de literatura relacionada.
-
Estrategia de búsqueda
Se definen los elementos críticos para generar una respuesta clínica estructurada, aplicando formato PICO, para definir los términos en lenguaje controlado y así las palabras clave. Para la búsqueda adicional, se utiliza lenguaje natural.
Incluyendo todo tipo de estudios en población humana.
De la búsqueda, se obtiene un listado de artículos que son seleccionados por los autores en forma independiente según resumen y título.
-
I. Máquinas de anestesia y ventilación mecánica intraoperatoria en pediatría
Las máquinas de anestesia son un sistema complejo de suministro de gasesy su objetivo primordial es entregar una mezcla de ellos con una fracción inspirada de O2 (FiO2) ajustable a las necesidades del paciente y una concentración de anestésicos volátiles en proporciones precisas para alcanzar el nivel de profundidad anestésica deseado, de manera segura y costo efectiva. Están diseñadas para sostener la ventilación tanto espontánea como mecánica a presión positiva.
Los tipos de ventiladores o generadores de flujo de anestesia incluyen, los de concertina, pistón, turbina y reflector de volumen. Cada diseño tiene sus propias ventajas y limitaciones.
Mientras que los ventiladores de UCI (de turbina o inyector de flujo) son un sistema abierto de ventilación, con un flujo continuo de gas, tanto en inspiración como en espiración.
En la actualidad, los ventiladores de anestesia soportan una amplia variedad de modos de ventilación similares a los de UCI e incluyen los modos espontáneos, controlados, asistido/ controlado, ventilación mandatoria sincronizada intermitente; todos los cuales pueden ser utilizados en pacientes pediátricos quirúrgicos.
-
Avances tecnológicos y de monitorización en las máquinas de anestesia que impactan en la seguridad
-
1. Autochequeo, medición de la compliance y test de fugas del circuito respiratorio
Actualmente, las máquinas de anestesia realizan un chequeo automatizado previo a su uso. Se constata el correcto funcionamiento de sus sensores y dispositivos internos, se evalúa la “compliance del sistema respiratorio” y se realiza un test de fugas. Estos procesos tienen como objetivos entre otros, garantizar la entrega de Volúmenes corrientes (Vt) pequeños de manera fidedigna (hasta 5 ml en PCV y 10 a 20 ml en VCV), lo cual ha permitido ventilar a neonatos y lactantes pequeños con mayor seguridad que en el pasado[2],[3]. La compliance, definida como cambio de volumen por unidad de presión, es medida en el circuito respiratorio interno de la máquina de anestesia, con las tubuladuras extendidas al largo de trabajo; pieza en Y, filtros y línea de capnografía instaladas, durante y posterior a la presurización del gas en su interior. El volumen de gas que fluctúa por efecto de la presión en el circuito se compensa para que el Vt inspirado (Vti) sea lo más cercano al programado[4],[5]. Los cambios de compliance por sobre la del circuito respiratorio corresponderán a los cambios de compliance pulmonar estática o dinámica intraoperatoria que sufra el paciente[6].
Las máquinas suelen tolerar y compensar fugas menores a 250 ml/min, a > 30 cm H2O de presión. Si el gas tomado del analizador de gases no es redireccionado al circuito respiratorio, debería ser compensado para no afectar significativamente el Vti en pacientes < 20 kg. En casos de fugas significativas generadas en el paciente como las provocadas por tubos endo- traqueales sin cuff, o por el uso de mascarillas laríngeas (ML), la pérdida de aire probablemente no será suficientemente compensada, no se alcanzará el PEEP y el Vt se verá reducido, sobre todo si la compliance está disminuida o existe un incremento en la resistencia como en el broncoespasmo. El ventilador FLOW-i Maquet (reflector de volumen) que se entiende como un reser- vorio activo de gas con inyector independiente, compensa las fugas con oxígeno casi al 100%, pasando a funcionar como un circuito abierto como los ventiladores de UCI[7].
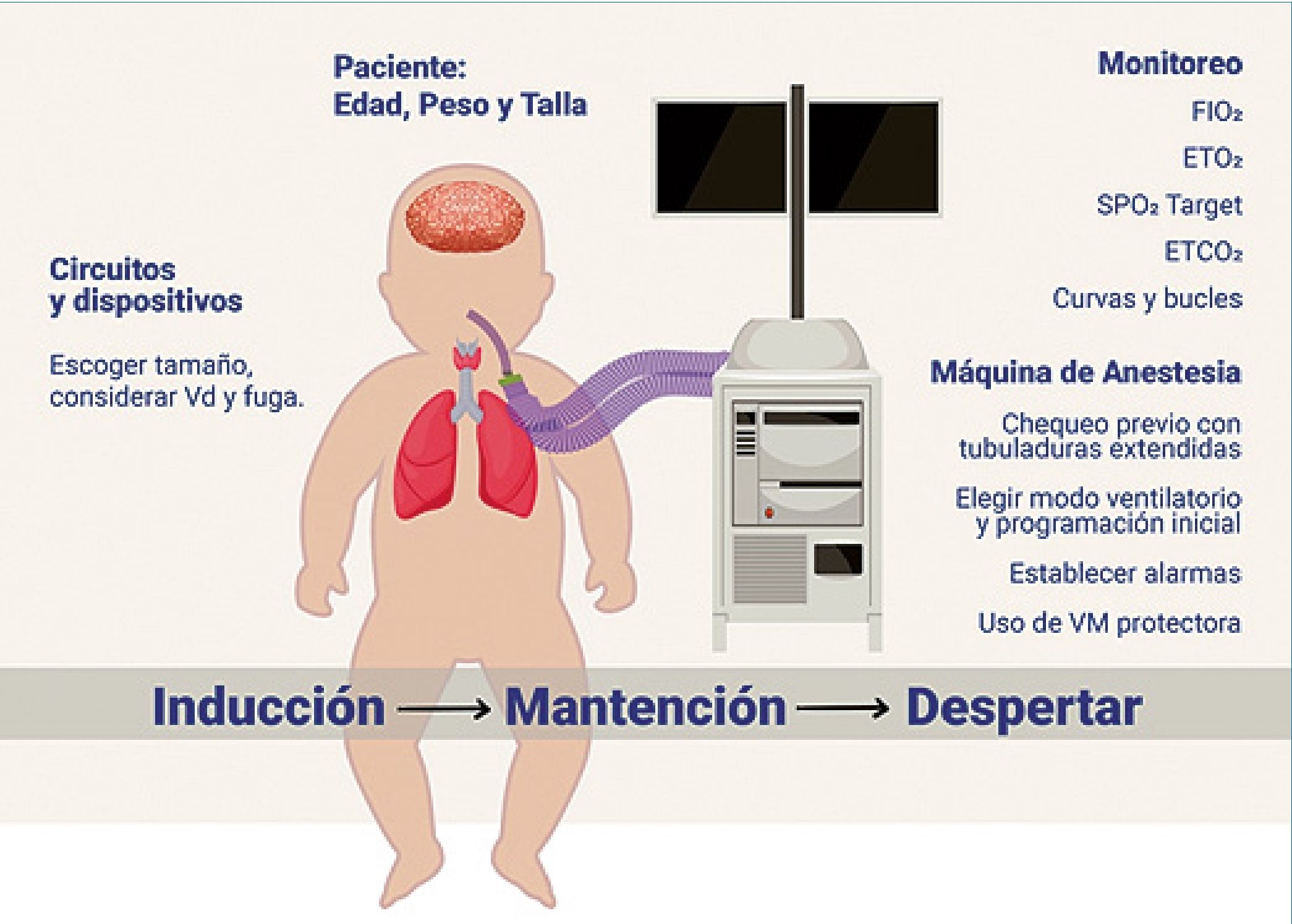
Figura 1. Esquema de la ventilación mécanica.
-
2. Flujo de gas fresco (FGF) y Vt
Las máquinas de anestesia de nueva generación o bien desacoplan el flujo de gas fresco del volumen corriente inspirado (ej. Pistón), o bien compensan el flujo de gas fresco al calcular la cantidad de gas que hay que entregar como Vt (ej. concertinas turbinas). Este avance, impide que el aumento del flujo de gas fresco incremente el Vti y aumente la presión en la vía aérea durante la ventilación con presión positiva, lo cual puede ser muy deletéreo en pacientes con Vt pequeños, como neonatos o lactantes[7],[8].
-
3. Disminución de la constante de tiempo del circuito
Las máquinas modernas poseen un volumen del circuito respiratorio menor que las más antiguas y por ende, la constante de tiempo del circuito anestésico (t), definido como el tiempo necesario para completar el 63% del cambio en la composición del gas del circuito aportado al paciente, cuando se modifica la concentración de gas fresco, también se ha reducido (con tres (t) se alcanza el 95% del equilibrio). Así para tratar una hipoxemia debemos incrementar la FiO2 y aumentar un poco
el FGF. Por el contrario, si manejamos máquinas antiguas que tienen constantes de tiempo de varios minutos, tendremos que accionar el FLUSH de oxígeno o incrementar el FGF a niveles máximos, para que los cambios se produzcan de forma más rápida[3].
La constante de tiempo de los ventiladores de UCI es prácticamente despreciable.
-
4. Sensores de flujo
En la actualidad los sensores de flujo se ubican a la salida de las ramas inspiratorias y espiratorias del circuito respiratorio. Contando con ambos sensores y comparando las mediciones de volumen inspiratorio y exhalatorio se pueden pesquisar fácilmente las fugas. Las mediciones de volumen tidal espirado (Vte) pequeños son más confiables (5 ml PCV, 20 ml en VCV y particularmente 10 ml en la máquina Primus Infinity de Drager)[3]. Lamentablemente, las mediciones de Vte (en rango neonatal) tienen un porcentaje de variabilidad considerable frente a las mediciones de Vte proximales a la boca del paciente realizada por los ventiladores de UCI, en particular cuando se producen cambios intraoperatorios significativos de la compliance dinámica del paciente[9]. Para corregir esta variabilidad, algunos ventiladores de máquinas de anestesia (GE) para uso pediátrico, utilizan un sensor de flujo externo, posicionado distal a la pieza en Y, cercano a la vía aérea del paciente. Adicionalmente, las mediciones de flujo proximal tienen un mejor control sobre señales de ruido y mejoran la respuesta de sincronización del ventilador al esfuerzo inspiratorio del paciente durante la respiración espontánea asistida. Sin embargo, el espacio muerto adicional y el riesgo de desconexión pueden limitar los beneficios de este método[3].
Algunas máquinas también emplean sensores para construir las ondas de flujo, las curvas y bucles o ambas, similares al monitoreo respiratorio de los ventiladores de UCI. La información que entregan es clave para la correcta ventilación de los pacientes y se hacen imprescindibles ante situaciones de ventilación complicadas.
-
5. Rango de trigger
Entendemos como trigger el umbral del ventilador para reconocer y responder a la respiración espontánea. Para sincronizar el esfuerzo respiratorio del paciente con el soporte ejercido por el ventilador, se requiere en el caso de pacientes pediátricos un trigger de flujo muy sensible, tan bajos como 0,2 L en RNPT[6]. En la actualidad el rango de trigger es muy amplio, habitualmente comienza en 0,2 L (Care Station 650, Avance CS2, Aysis de GE) o en 0,3 L (Primus, Perseus y Zeus de Drager) permitiendo las prestaciones de PSV y modos asistidos (SIMV + PS) en pacientes pediátricos. Los triggers gatillados por presión negativa se utilizan en UCI, cada vez menos y deben ser de -1 cmH2O en lactantes y niños pequeños.
-
6. Potencia de insuflación del ventilador
La potencia del ventilador de las máquinas anestesia, debe ser capaz de ejercer un flujo inspiratorio máximo o pico, adecuado incluso en caso de compliance baja o resistencia elevada. Estas condiciones son relativamente frecuentes en pacientes pediátricos en pabellón. Esta tecnología corresponde a las turbinas e inyectores de algunas máquinas de anestesia o ventiladores de UCI.
-
7. Analizador de gases
El analizador de oxígeno es la única protección contra una mezcla hipóxica en la sección de baja presión de las máquinas de anestesia. Siempre se debe establecer la alarma de FIO2 baja, en particular cuando se utiliza anestesia con flujos bajos.
En la actualidad, la monitorización de la concentración de O2 se realiza en el brazo inspiratorio o en la pieza en “Y”, conectado a una alarma que debe activarse antes de 30 seg si la FIO2 cae por debajo del valor programado (nunca inferior a 18% a 21%). Las celdas galvánicas han sido reemplazadas por sensores de O2 paramagnético, porque requieren de calibración menos frecuente, tienen un mejor funcionamiento y mayor du- rabilidad[3].
El analizador de gases informa además el ETO2, dato relevante para asegurar una preoxigenación efectiva previo a maniobras de intubación en pacientes con vía aérea difícil u otras con riesgo de hipoxemia, como la desconexión del circuito de anestesia para cambios de posición o aspiración del tubo endotraqueal.
-
II. ¿Qué modo ventilatorio es más seguro para utilizar en niños?
Un modo ventilatorio seguro debe considerar, el tipo de paciente, sus comorbilidades, la intervención quirúrgica a realizar, el dispositivo de vía aérea elegido y el tipo de ventilador mecánico con que contamos con el objetivo de cumplir las metas fisiológicas. Sin embargo, sabemos que la VM induce una injuria pulmonar (VILI) que puede contribuir en morbilidad y mortalidad, por lo que se han establecido estrategias ventilato- rias protectoras en UCI[10] que se han extrapolado a la VM en anestesia.
Revisaremos a continuación los modos ventilatorios más frecuentemente utilizados en anestesia pediátrica y sus aspectos distintivos.
Modos espontáneos: El esfuerzo respiratorio es realizado continuamente por el paciente, con o sin soporte (“ayuda”) del ventilador.
Ventilar implica un trabajo respiratorio o WOB (work of breathing) que requiere un gasto de energía[11]. El WOB es proporcional a la fuerza generada para vencer la resistencia y las fuerzas elásticas que se oponen a la expansión pulmonar y al flujo de gas que se moviliza[12],[13] y se expresa como:
WOB = Presión x Volumen o como el área bajo la curva de la curva Presión -Volumen.
2/3 del WOB es para vencer fuerzas elásticas y estáticas del pulmón y tórax; y 1/3 para superar la resistencia friccional[11].
En un paciente con anestesia general, en ventilación espontánea aumenta el WOB, debido a cambios en la compliance pulmonar, aparición de atelectasias, alteración de la función diafragmática y uso de dispositivos de vía aérea, lo que genera mayor reducción de la capacidad residual funcional (CRF) y de la ventilación minuto.
Por tanto, una primera estrategia ventilatoria sería reducir el WOB utilizado modos como presión soporte (PSV) y presión positiva continua de la vía respiratoria (CPAP), lo que ha demostrado optimizar la ventilación y disminuir las complicaciones asociadas.
Aplicación clínica: Utilice apoyo a la ventilación espontánea con CPAP y PSV.
• Espontáneo con bolsa: En neonatos y lactantes se sugiere una ventilación manual gentil, con hasta 10 cm de H2O para evitar la distensión gástrica, regulada por válvula APL. El volumen de la bolsa debe ser elegido según el tipo de paciente. Neonatos 0,5 L; lactantes y niños < 30 kg 1 L y niños > 30 kg bolsa de 3L.
• CPAP: Un nivel de 5 cmH2O de CPAP durante la inducción y la emergencia en niños sanos demostró prevenir la reducción de CRF, aparición de atelectasias, incluido hasta 1 h en el posoperatorio y reducir la necesidad de MR en el intrao- peratorio[14],[5].
Importancia: Prevenir desreclutamiento pulmonar. Facilitar la inducción/ventilación en pacientes con vía aérea patológica, como la presencia de laringo y broncomalacia o que estén con VMNI en preoperatorio.
Aplicaciones clínicas: En la inducción y el despertar con un buen sello de la máscara facial (MF) o ventilación espontánea con tubo endotraqueal y ML.
• PSV: Modo de soporte parcial de la respiración ciclado por flujo, limitado por presión y gatillado por el paciente. Es necesario configurar la sensibilidad de trigger para sincronizar el ventilador a los esfuerzos respiratorios del paciente; la rampa que es el tiempo requerido para alcanzar la presión pico (velocidad de flujo en seg); la presión positiva al final de la espiración (PEEP) y la presión de soporte (PS), que será la presión sobre el PEEP necesaria para obtener un Volumen corriente (Vt) adecuado. La PS es inversamente proporcional a la edad y al esfuerzo respiratorio del paciente. La frecuencia respiratoria (FR) es determinada por el paciente.
La mayoría de los ventiladores permiten programar una FR de respaldo en apnea como medida de seguridad[4],[5].
En UCI, la PSV es usada para mejorar la sincronía entre el ventilador y el paciente, lo que facilita el weaning[5]. En el escenario de pabellón, puede ser usada en cualquier paciente independiente del tamaño, si el trigger lo permite. Este modo tiene ventajas, como: facilitar la emergencia apoyando la ventilación minuto[4], reduciendo el WOB y mejorando el retorno venoso, mientras esperamos la eliminación de gases en el despertar. Previene atelectasias y desreclutamiento.
En nuestra práctica clínica una vez finalizada la cirugía recomendamos establecer el menor trigger posible para pesquisar el esfuerzo respiratorio inicial del paciente y posteriormente, ajustarlo por edad[15]. Se recomienda programar un soporte inicial de 10 cm H2O para pacientes de peso > 10 kg y de 15 cm H2O para pacientes < 10 kg[6], que se irá retirando en la medida que el paciente realice mayor esfuerzo respiratorio[6].
En pacientes con mascarillas laríngeas (LMA ProSeal N° 1,5 -3) la PSV ha demostrado mejor oxigenación que la CPAP, menor nivel de presión positiva para el mismo target de Vt y menos fugas[4].
Las recomendaciones del Paediatric Mechanical Ventilation Consensus Conference[16] establecen con alto nivel de acuerdo, que cuando se restablece el drive respiratorio la PSV puede ser considerada. La PSV puede ser utilizada en ventilación espontánea o como un modo mixto de asistencia ventilatoria asociada a un modo controlado.
Aplicaciones clínicas: Uso en destete del ventilador y cuando se utilice ML en ventilación espontánea.
-
Modos controlados por el ventilador (CMV)
El ventilador controla todas las ventilaciones ya que el paciente no realiza esfuerzo respiratorio debido a la abolición de la ventilación por la anestesia general o sedación profunda, y por el uso de bloqueadores neuromusculares. Existen las modalidades de control Presión y control Volumen.
• Modo controlado por Presión (PCv): Modo ciclado por tiempo, cuyo objetivo es controlar la presión de ventilación. Entrega flujo de gas hasta alcanzar la Presión inspiratoria pico programada (PIP), la cual es sostenida durante toda la fase inspiratoria gracias a que el flujo es desacelerado. Durante la fase exhalatoria la presión cae hasta el nivel de PEEP[5]. La PIP programada debería ser la suficiente para alcanzar un Vt adecuado. En algunos ventiladores se fija la delta pressure (DP) sobre el PEEP (PIP = DP + PEEP).
El Vt es función del sistema respiratorio (compliance y resis
tencia) y de la presión de ventilación.
En este modo se obtiene una curva de Presión – tiempo cuadrada y una curva de flujo – tiempo desacelerada o en aleta de tiburón[4] (Figura 2).
El PCV, históricamente ha sido de elección en anestesia pediátrica, dado que los ventiladores de las máquinas de anestesia tradicionales no han sido diseñados para entregar Vt peque- ños[4].
Su uso favorece el reclutamiento pulmonar ya que ingresa una presión inspiratoria máxima y un rápido incremento del flujo que luego desacelera, lo que hace posible ventilar sistemas de alta resistencia en menor tiempo y permite llegar a más alveolos distales al disminuir el flujo turbulento, como en neonatos y niños pequeños con tubos endotraqueales < 4,5 o en caso de broncoespasmo[2],[6].
Mantiene los volúmenes a pesar de las fugas (tubos sin cuff, uso de ML). Previene el barotrauma ya que la presión es limitada.
Su desventaja es la pérdida del volumen garantizado y por tanto, cualquier cambio de la compliance dinámica o estática podría alterar el Vt esperado, lo que genera una limitación de este modo ventilatorio sobre todo si queremos mantener una ventilación protectora. Por tanto, el Vt debe ser medido acuciosamente.
Aplicaciones clínicas: Uso en neonato y < 3 kg. Al realizar maniobras de reclutamiento (MR), uso en situación de fuga, en caso de broncoespasmo y ventilación monopulmonar. En presencia de reducción de compliance estática (p. ej. neumonía, neumotórax) o dinámica (por ej. cirujano se apoya en tórax, neumoperitoneo) verificar el Vte[3].
• Modo controlado por Volumen (VCV). Modo mandatorio ciclado por tiempo, cuyo objetivo es controlar el Vt y el Volumen minuto. El flujo es constante durante el Ti. La PIP se alcanza al final del tiempo inspiratorio. El Vt está garantizado, dentro del rango de presión máxima. La P° pico varía según las variaciones de la compliance, hasta el límite máximo de P° establecida, como por ejemplo con la tos, lo que puede generar barotrauma, por lo que, se debe limitar la presión máxima como medida de seguridad[5].
Se puede programar una pausa inspiratoria para medir la P° plateau o meseta al final del tiempo inspiratorio que representa la presión en equilibrio del pulmón; y medir la driving pressure con las cuales se puede monitorizar los cambios de compliance estática/dinámica y los cambios de resistencia (Figura 1). La driving pressure fundamentalmente refleja el grado de estiramiento pulmonar durante un ciclo respiratorio y en ese contexto tiene relación con el strain dinámico pulmonar.
Además, como libera un Vt fijo, su compensación ante fugas es limitada. En VCV el análisis de los cambios en la fisiología respiratoria es más preciso, analizando las curvas y bucles derivadas del monitoreo respiratorio en esta modalidad.
Aplicaciones clínicas: Ampliamente utilizado en VM protectora, excepto en pacientes que necesiten VT < 20 ml y sistemas con fuga, por lo que se recomienda tubo endotraqueal con cuff. Utilizar en situaciones de cambio de compliance intraoperatorias[3],[4].
• Volumen garantizado o Autoflow. Modo dual control presión ciclado por tiempo y con Vt garantizado. Incorpora lo mejor de la VCV y PCV[5 https://paperpile.com/c/UrqFCy/e4gXh].
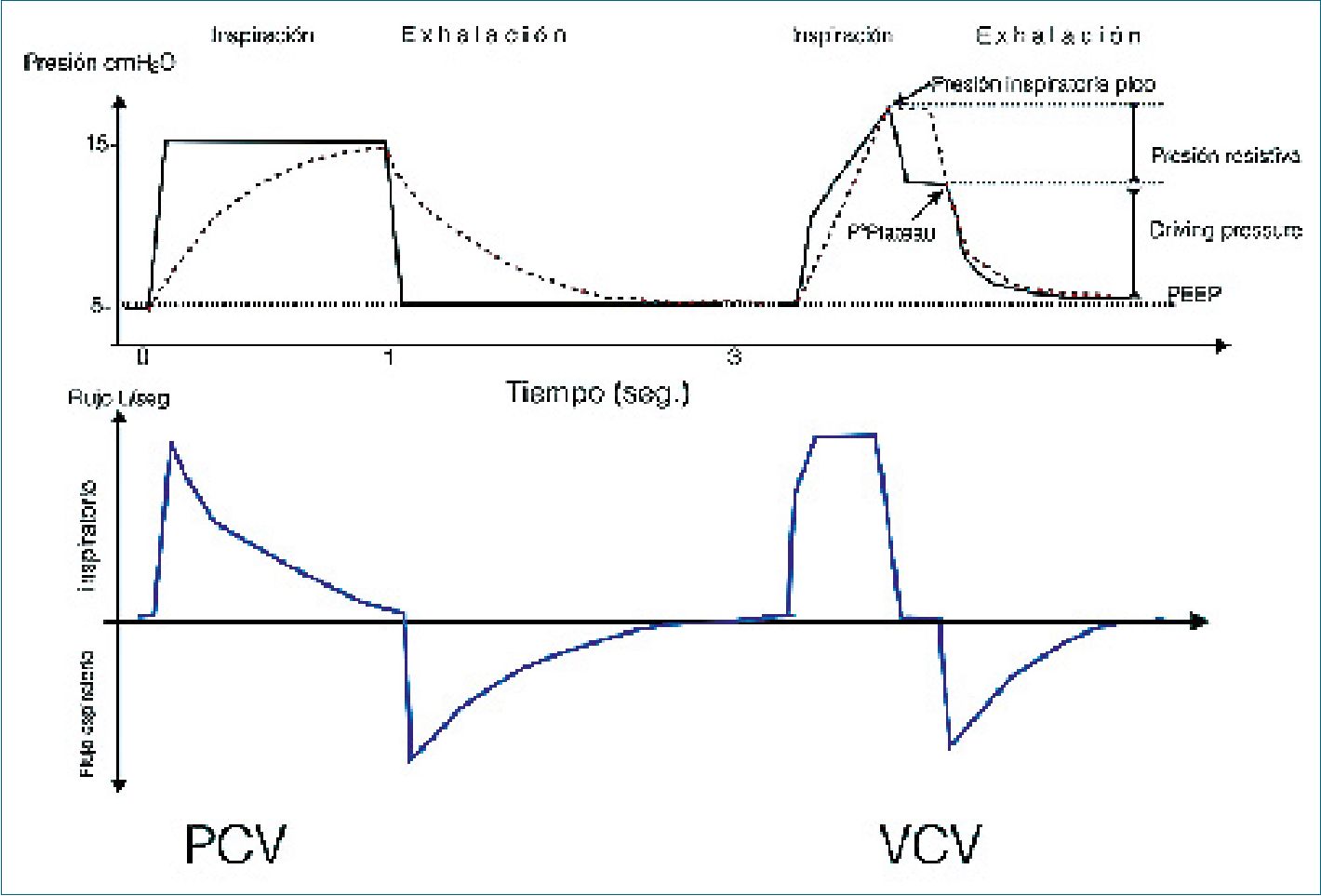
Figura 2. Principales curvas en Modo Control Presión y Volumen Control.
A la izq. PCV. La curva de presión-tiempo es cuadrada (línea negra continua), es decir, la P° es sostenida hasta al final del Ti; durante la espiración la P° cae hasta el nivel del PEEP (5 cmH2O); mientras la curva de flujo inspiratorio es decreciente en el tiempo o en aleta de tiburón. El volumen pulmonar sobre la CRF es representado por el área bajo la curva de la línea entrecortada roja. La relación I:E es aproximadamente 1:2. A la der. VCV. La curva de presión (línea negra continua) alcanza el punto de máxima presión al término del Ti. La presión plateau se mide tras realizar una pausa inspiratoria. La driving pressure es la diferencia entre la P° meseta y la PEEP. La diferencia entre la P° meseta y PIP representa el componente resistivo al flujo. El volumen pulmonar sobre la CRF está representado en el área bajo la curva de la línea entrecortada roja. El flujo (línea entera azul) constante en VCV está determinado por la relación entre el Vt establecido y el Ti, que cesa durante la pausa inspiratoria (cero flujo), luego de la cual se da paso al flujo espiratorio. La relación I:E es aproximadamente 1:2.
Se programa: PIM; PEEP, Vt con un mínimo de 20 ml, el Ti y FR.
El ventilador de la máquina de anestesia es capaz de procesar la información de los cambios de compliance o resistencia, respiración a respiración y determinar la menor presión de trabajo posible durante el Ti para alcanzar el Vt prefijado. En consecuencia, la onda de P° es cuadrada como en PCV y la curva flujo-tiempo, desacelerada. Los cambios de P° requeridos son escalonados tanto hacia el alza como hacia la baja.
El volumen entregado varía en unas pocas ventilaciones hasta lograr el Vt que está garantizado siempre que no existan fugas.
Este modo parece ser más efectivo en prematuros y neonatos de término, reduciendo la DBP, neumotórax, hemorragia intraventricular severa, hipocarbia, leucomalacia periventricular y disminuyendo la duración de la VM(17), sin embargo, en anestesia la literatura no ha mostrado los outcomes de su uso.
Aplicaciones clínicas: Ampliamente utilizado, excepto en paciente que necesite Vt < 20 ml y sin fuga significativa.
• Modos de Ventilación Mandatoria intermitente: SIMV con o sin PSV. Modo ventilatorio asistido de flujo continuo ciclado por tiempo y limitados por presión. Se aplica una PIP sincronizada con las propias respiraciones del paciente a una frecuencia respiratoria programada. Para las respiraciones más allá de la frecuencia establecida, se proporcionan respi
raciones con soporte de presión (PS) por encima de la PEEP para ayudar a superar la resistencia y trabajo respiratorio asociado a la respiración espontánea a través del tubo en- dotraqueal. El modo SIMV se encuentra también en modo control presión[2].
Ha ido perdiendo utilidad en intensivo pediátrico por el riesgo de asincronías, ya que los ciclos son gatillados por tiempo y en consecuencia la espiración comienza al término del Ti programado.
-
Estrategias protectoras
Neonatos y lactantes, tienen una CRF disminuida, una capacidad de cierre que excede la CRF y alto consumo de O2, que en el contexto de pabellón y la anestesia general predisponen a atelectasias e hipoxemia en el 68% a 100% de los niños con anestesia general[18].
Inmediatamente, luego de la inducción con anestésicos volátiles o propofol se produce una reducción de la CRF de 15% – 20% en adultos, lo que es más marcado en lactantes, alterando la relación V/Q y la compliance pulmonar[19].
En UCI se han generado estrategias de VM protectora, especialmente en paciente con SDRA que consisten en minimizar la injuria pulmonar generada por la VM ( VILI), que consideran la prevención de: atelectrauma, barotrauma, volutrauma y biotrauma[10],[20].
En niños sanos, independiente del modo ventilatorio escogido, se recomienda resguardar las medidas protectoras reco mendadas[16],[20]:
VT target de 6-10 ml/kg (no usar Vt mayor a 10 ml/kg). Limitar la presión peak inspiratoria (< 30 cmH2O) y driving pressure (< 10 cmH2O). Monitorizar variaciones del Vt. Uso de PEEP (4-8 cmH2O).
Uso de maniobras de reclutamiento (presión sostenida de 30 cmH2O por 10 a 30 segundos o un un incremento gradual del PEEP segun paciente).
Evitar FIO2 de 1,0, a menos que exista una emergencia.
Respecto de las maniobras de reclutamiento (MR), definidas como una PIM sostenida sobre la presión crítica de apertura alveolar durante un período de tiempo, seguido de PEEP; éstas mejorarían la aireación pulmonar, la mecánica ventilatoria, su compliance y ayudarían a la prevención de atelectasias y mejorar la transferencia de O2[19]. Lo que ha sido demostrado por diferentes medios diagnósticos, incluido el seguimiento con ultrasonografía en niños anestesiados, demostrando que MR seguidas de un PEEP de 8 cmH2O, antes del neumoperitoneo previenen el colapso pulmonar y desarrollo de atelectasias[21].
Para realizarlas en forma segura, además de respetar los criterios fisiológicos generales, debemos tener en consideración no superar las presiones máximas recomendadas: en niños 30 cmH2O en pulmón sano[21],[22]; 40 cm H2O en SDR y en RNPT 20 cmH2O con un techo de 25 cm. H2O[22].
Programando el ventilador (Tabla 1)
En la Tabla 1, se señala la programación inicial del ventilador.
Como conceptos relevantes incorporados a los nuevos ventiladores, destacamos:
Tiempo Inspiratorio. Ti. Este tiempo es la resultante entre la compliance y resistencia (Ct: Re x Comp) y corresponde al tiempo necesario en alcanzar el equilibrio entre presión alveolar y vía aérea. Con tres Ct se alcanza el 95% del equilibrio, que corresponde al Ti a programar. En pacientes con mayor resistencia de la vía aérea, se requieren Ti largos (por ejemplo, displasia broncopulmonar). En pacientes con menor distensibi- lidad se requieren Ti más cortos, por ejemplo, enfermedad por membrana hialina, bronconeumonía aguda.
Relación Inspiración/Espiración (I:E). Se basa en el flujo espiratorio, el cual debe llegar a cero en la curva flujo/tiempo. Deriva del Ti sumado a la FR. Lo normal es que la espiración sea mayor que la inspiración (1:2). No se recomienda programar relación I:E 1:1.
PEEP. Presión positiva programada al final de la espiración. Es un importante componente de la ventilación pulmonar protectora. Mantiene la distensión alveolar en un pulmón reclutado. No hay evidencia científica que sugiera un nivel óptimo de PEEP en niños sanos anestesiados[20]. Se sugiere iniciar con 5 cmH2O (rango 4 y 8 cmH2O) y reevaluar según la mecánica respiratoria[20].
Presión Inspiratoria Pico (PIP). En PCV, luego del aseguramiento de la vía aérea, se debe verificar que con la presión programada se logre una expansión torácica simétrica, particularmente en neonatos en que el Vte es menos preciso. En VCV, parte de esta presión es el reflejo del componente resistivo elevado producto TOT de menor diámetro y no refleja la presión alveolar.
Tabla 1. Programación VM intraoperatoria inicial según rango etario
| Paciente | Neonato | lactante < 1año/Pre-escolar | Escolar/adolescentes |
| Peso | < 4 kg | Lactante (4 – 10 kg) Prescolar (10 – < 40 kg) | Peso ideal (> 40 kg) |
| FIO2/SpO2 | Inducción: 1,0
Mantención 0,35 – 0,45; ajustar para SpO2 RNT 92% y 95% RNPT 90%-95% Despertar 1,0 |
Inducción 0,8
Mantención 0,35 – 0,45; ajustar para SpO2 97 a < 100% Despertar 0,8 |
Inducción 0,8
Mantención 0,35 – 0,45; ajustar para SpO2 97 a < 100% Despertar 0,8 |
| Modo ventilatorio | Inducción: CPAP
Mantención: VCV, PCV, PCV VG o AF, PSV Despertar: PSV, CPAP |
Inducción: CPAP (5 cm H2O) Mantención: VCV, PCV, PCV VG o AF, PSV
Despertar: PSV, CPAP |
Inducción: CPAP (5 cm H2O) Mantención: VCV, PCV, PCV VG o AF, PSV
Despertar: PSV, CPAP |
| Vt ml/kg (peso ideal > 2 años) | 4 – 6 | 6 – 8; no usar Vt > 10 | 6 – 8; no usar Vt > 10 |
| FR (x min) | 30 – 40 | Lactante: 20 – 40
Prescolar: 15 -25 |
12 – 20 |
| PEEP (cm H2O) | 3 – 5 | 4-8 (titulado)
> 8 si 1 compliance |
4-8 (titulado)
> 8 si 1 compliance |
| Maniobras de reclutamiento | SI
P° máxima 25 cm H2O |
SI
P° máxima 28 – 30 cm H2O |
SI
P° máxima 30 – 40 cm H2O |
| Ti (seg) | 0,3 – 0,4 | Lactante 0,4 – 0,7
Prescolar 0,7 – 0,9 |
0,9 – 1,2 |
| PIM (cm H2O) | Máximo 25 – 28 | Máximo 25 – 30 | Máximo 25 – 35 |
| Trigger (L/min) | 0,2 – 0,5 | Lactantes 0,25 – 0,5
Prescolar 0,5 – 2 |
1 – 2 |
498
-
III. La composición del gas respiratorio y su monitorización
-
Fracción Inspirada de Oxígeno – SpO2
Los cambios anatomo – fisiológicos asociados al desarrollo del niño, sumados a los cambios inducidos por la anestesia en la función pulmonar, predisponen a mayor incidencia de eventos respiratorios en la población pediátrica, como ha quedado refrendado en el estudio APRICOT de 2017, donde la presencia de eventos críticos respiratorios es más frecuente en infantes y preescolares, con una incidencia de 3,1%[23].
Estos eventos son causa de morbilidad y mortalidad en anestesia pediátrica, y por lo mismo la entrega de altas concentraciones de O2 intraoperatorias es una práctica frecuente en estos pacientes[19].
Una encuesta practicada a anestesiólogos en UK el 2019 muestra una variabilidad en la administración de O2 tanto en la inducción, mantención y durante la extubación[24]; mostrando la utilización de una estrategia de oxigenación con FIO2 más alta para neonatos, con el objetivo de prevenir la hipoxia en esta población[24], la cual está asociada a anormalidades del neurodesarrollo, muerte y NEC[25],[26]. La modificación de la FIO2 se realizó utilizando mezclas O2 con aire u N2O[24].
Sin embargo, la exposición a FIO2 elevadas en neonatos prematuros puede generar retinopatía, incremento de radicales libres y displasia broncopulmonar[20]. Además, FIO2 altas han mostrado inducir cambios en la compliance pulmonar, presencia de atelectasias, disbalance en relación V/Q y menor CRF.
Un reciente estudio en niños sanos compara FIO2 > 0,8 en la inducción y extubación, manteniendo FIO2 0,8 en la mantención vs FIO2 0,8 inducción y extubación, con FIO2 0,35 durante la mantención; mostrando una pérdida del volumen pulmonar y una ventilación heterogénea, que se mantiene hasta el primer día posoperatorio en el grupo FIO2 > 0,8[20],[27].
En consecuencia, la FIO2 “segura” debiese ser titulada e individualizada, a la mínima requerida por el paciente, monito- rizando no solo la FIO2, sino el ETO2 y la SpO2, para alcanzar el target requerido, en un rango de PaO2 óptima[3],[4]. Por ejemplo, realizando incrementos de la reserva de O2 en situaciones de hipoventilación como en la inducción y el despertar, no excediendo una FIO2 0,8[28], y reduciendo la FIO2 en pacientes sanos a 30%-35% durante la mantención anestésica, una vez asegurada la vía aérea y estabilizada la ventilación[19],[28].
Esto se resume en el concepto de “oxigenación protectora”, donde debemos evitar la hiperoxia, tanto como la hipoxia. Estableciendo en neonatos de término un rango de SpO2 óptima, con O2 suplementario, entre 94%-98% y en RNPT entre 90%-95%[26].
Pacientes con cardiopatías cianóticas, hernia diafragmática congénita (HDC) y otras comorbilidades, deberán ser manejados particularmente según la patología.
-
Importancia del CO2/Capnografía
Cambios en la ventilación producen aumentos o disminución de la PaCO2, y generan cambios ácido-base, con relevante impacto en la fisiología cardiaca, pulmonar y cerebral, entre otras. Por ejemplo, la hipocapnia en prematuros puede determinar la presencia de isquemia cerebral y leucomalacia periven-
Las recomendaciones de ventilación mecánica, publicadas en el 2017, promueven niveles normales de PaCO2 en niños sanos (35-45 mmHg) que se deben conseguir con la estrategia ventilatoria y utilizar hipercapnia permisiva en casos particulares con un target de pH > 7,2 como por ejemplo en HDC[4],[16].
La capnografía representa indirectamente la medición de la PaCO2, que sigue siendo el gold standard y que mantiene una diferencia con el ETCO2 que no debiese ser mayor de ± 5,2 mmHg[30]. Dentro de las limitaciones en la población pediátrica, destaca la pérdida del plateau alveolar en la curva de monitoreo, la cual puede ser debida a varios factores, como: el efecto de dilución del CO2 por aumento del Vd del circuito respiratorio, cuando la relación Vd/Vt es > 0,3; excesiva fuga peritubo endotraqueal, alta FR, excesivo flujo de aspiración de la muestra del capnógrafo, tiempo de respuesta del capnógrafo inapropiada[31].
Ante estas limitaciones, se recomienda realizar un análisis de gases en sangre si se requiere un control agudo de la PaCO2[4].
-
IV. Limitantes
-
Espacio Muerto (Vd)
El Vd no participa del intercambio gaseoso, e incluye el aire en la vía aérea y los alvéolos no ventilados. En el paciente en VM, se debe adicionar el volumen en el circuito distal a la pieza en Y[32], que tiene un flujo bidireccional sin intercambio gaseoso[4]. Este Vd puede aumentar, debido a la conexión de filtros, alargadores, etc., entre el tubo y la pieza en Y, que pueden variar entre los 8 y 55 ml según el elemento usado[33]. El aumento inapropiado del Vd puede generar hipercapnia, reinhalación CO2 e hipoxia, debido a que los volúmenes involucrados pueden ser mayores que el Vt del niño si no son considerados.
Por lo tanto, en pacientes pediátricos se debe minimizar el Vd para un efectivo intercambio de gas y seleccionar el dispositivo adecuado según el tamaño del paciente, limitando el aparato de espacio muerto a no más de 1/3 del Vt o lo más bajo posible[32],[33], lo que además permite una capnografía más fidedigna. En lactantes < 5 kg tener precaución de no adicionar piezas extra, particularmente cuando se utilizan flujos bajos. En esta población, se recomienda el uso de humidificador activo en UCI. En anestesia se puede utilizar un HME sin muestreo de capnografía y un filtro tipo HEPA en la rama espiratoria del circuito respiratorio, lo que adicionará no más de 2 ml de espacio muerto[32]. En general, los HME que no adicionan la línea de capnografía, suman menos espacio muerto[32].
-
Resistencias y obstrucciones
Los dispositivos HME con y sin filtro bacteriano son ampliamente usados en anestesia por su costo efectividad, fácil uso, capacidad de filtro de bacterias e intercambio de humedad y calor[32].
Además de adicionar Vd, contribuyen a aumentar la resistencia al flujo y el WOB, incluyendo el riesgo de atrapamiento aéreo al final de la espiración. En un modo VCV se observará un incremento de la PIP incluso hasta superar la alarma de presión máxima. Mientras en PCV se observará una caída del Vt y de la ventilación pulmonar, gatillando las alarmas correspondientes[3].
-
Discusión
La VM intraoperatoria en el paciente pediátrico ha evolucionado acompañado del avance de las tecnologías y del conocimiento de la fisiopatología respiratoria asociado al desarrollo del niño, siendo el grupo de mayor desafío los recién nacidos y lactantes menores.
No existe un modo ventilatorio único recomendable, más bien debemos conocer las limitaciones y ventajas de cada uno de ellos antes de seleccionarlo para un paciente determinado. La modalidad ventilatoria debe ser flexible, acorde a las necesidades individuales a lo largo del proceso anestésico – quirúrgico, en base a objetivos o metas fisiológicas y con una constante monitorización de la interacción entre el ventilador y el niño (Figura 2).
La VM protectora tiene fuerte evidencia en paciente adulto crítico, algo menor en neonatología y menos aún en anestesia; sin embargo, la opinión de consenso de expertos, recomienda utilizar estrategias de VM protectora aun en pacientes sanos en pabellón, independiente del modo ventilatorio seleccionado.
Dentro de los principales avances en tecnología y seguridad de las máquinas de anestesia están los chequeos automatizados previos a su uso, que deben ser respetados. Lo que ha permitido medir y compensar compliance y fuga del sistema respiratorio, además de desacoplar o compensar las variaciones de Vt en relación al FGF. La suma de estos elementos garantiza la entrega de Vt pequeños y la realización de VM protectora en pacientes pediátricos.
Los modos PSV y CPAP, han sido una innovación en la VM intraoperatoria pediátrica de los últimos años.
Esto hace que los anestesiólogos y el equipo de salud deban mantenerse actualizados, para optimizar el soporte ventilatorio, reducir los eventos adversos y las complicaciones.
En conclusión, la VM en pediatría implica un desafío para el anestesiólogo, aplicando la tecnología y la fisiología al cuidado perioperatorio; pero en la actualidad con una gama más amplia de prestaciones y elementos de seguridad disponible en pabellón.
Conflictos de interés: Los autores declaran no tener conflicto de interés.
Referencias
1. Lebossé M, Kern D, De Queiroz M, Bourdaud N, Veyckemans F, Chassard D, et al.; ADARPEF (Association Des Anesthésistes Réanimateurs Pédiatriques d’Expression Française). Ventilation in pediatric anesthesia: A French multicenter prospective observational study (PEDIAVENT). Paediatr Anaesth. 2020 Aug;30(8):912–21. https://doi.org/10.1111/pan.13909 PMID:32500930
2. Rivera-Tocancipá D, Díaz-Sánchez E. How to ventilate the anesthetized child with the modern anesthesia machines?. Vol. 46, Colombian Journal of Anesthesiology. 2018. p. 58–65. https://doi.org/10.1097/CJ9.0000000000000047.
3. Spaeth J, Schumann S, Humphreys S. Understanding pediatric ventilation in the operative setting. Part I: physical principles of monitoring in the modern anesthesia workstation. Paediatr Anaesth. 2022 Feb;32(2):237–46. https://doi.org/10.1111/pan.14378 PMID:34902201
4. Feldman JM. Optimal ventilation of the anesthetized pediatric patient. Anesth Analg. 2015 Jan;120(1):165–75. https://doi.org/10.1213/ANE.0000000000000472 PMID:25625261
5. Liu S, Kacmarek RM, Oto J. Are we fully utilizing the functionalities of modern operating room ventilators? Curr Opin Anaesthesiol. 2017 Dec;30(6):698–704. https://doi.org/10.1097/ACO.0000000000000527 PMID:28938301
6. Garcia-Fernandez J, Castro L, Javier Belda F. Ventilating the newborn and child. Vol. 21. Curr Anaesth Crit Care. 2010;21(5-6):262–8. https://doi.org/10.1016/j.cacc.2010.07.014.
7. Hendrickx JF, De Wolf AM. The Anesthesia Workstation: quo Vadis? Anesth Analg. 2018 Sep;127(3):671–5. https://doi.org/10.1213/ANE.0000000000002688 PMID:29239956
8. Gropper MA, Eriksson LI, Fleisher LA, Cohen NH, Wiener-Kronish JP, Leslie K. Miller’s Anesthesia, 2-Volume Set. Elsevier; 2019. 3576 pp.
9. Abouzeid T, Perkins EJ, Pereira-Fantini PM, Rajapaksa A, Suka A, Tingay DG. Tidal Volume Delivery during the Anesthetic Management of Neonates Is Variable. J Pediatr. 2017 May;184:51–56.e3. https://doi.org/10.1016/j.jpeds.2017.01.074 PMID:28410092
10. Beitler JR, Malhotra A, Thompson BT. Ventilator-induced Lung Injury. Clin Chest Med. 2016 Dec;37(4):633–46. https://doi.org/10.1016/j.ccm.2016.07.004 PMID:27842744
11. Goldsmith JP, Karotkin E, Suresh G, Keszler M. Assisted Ventilation of the Neonate E-Book. Elsevier Health Sciences; 2016. 630 pp.
12. Chakkarapani AA, Adappa R, Mohammad Ali SK, Gupta S, Soni NB, Chicoine L, et al. “Current concepts in assisted mechanical ventilation in the neonate” – Part 2: Understanding various modes of mechanical ventilation and recommendations for individualized disease-based approach in neonates. International Journal of Pediatrics and Adolescent Medicine [Internet]. Elsevier BV; 2020 Dec;7(4):201–8.
13. Chakkarapani AA, Adappa R, Mohammad Ali SK, Gupta S, Soni NB, Chicoine L, et al. “Current concepts of mechanical ventilation in neonates” – Part 1: basics. Int J Pediatr Adolesc Med. 2020 Mar;7(1):13–8. https://doi.org/10.1016/j.ijpam.2020.03.003 PMID:32373697
14. Acosta CM, Lopez Vargas MP, Oropel F, Valente L, Ricci L, Natal M, et al. Prevention of atelectasis by continuous positive airway pressure in anaesthetised children: A randomised controlled study. Eur J Anaesthesiol. 2021 Jan;38(1):41–8. https://doi.org/10.1097/EJA.0000000000001351 PMID:33009190
15. Dos Santos Rocha A, Habre W, Albu G. Novel ventilation techniques in children. Paediatr Anaesth. 2022 Feb;32(2):286–94. https://doi.org/10.1111/pan.14344 PMID:34837438
16. Kneyber MC. on behalf of the section Respiratory Failure of the European Society for Paediatric and Neonatal Intensive Care, de Luca D, Calderini E, Jarreau P-H, Javouhey E, et al. Recommendations for mechanical ventilation of critically ill children from the Paediatric Mechanical Ventilation Consensus Conference (PEMVECC). Vol. 43, Intensive Care Medicine. 2017. p. 1764–80. https://doi.org/10.1007/s00134-017-4920-z.
17. Keszler M. Novel Ventilation Strategies to Reduce Adverse Pulmonary Outcomes. Clin Perinatol. 2022 Mar;49(1):219–42. https://doi.org/10.1016/j.clp.2021.11.019 PMID:35210003
18. Bruins S, Sommerfield D, Powers N, von Ungern-Sternberg BS. Atelectasis and lung recruitment in pediatric anesthesia: an educational review. Paediatr Anaesth. 2022 Feb;32(2):321–9. https://doi.org/10.1111/pan.14335 PMID:34797011
19. Trachsel D, Svendsen J, Erb TO, von Ungern-Sternberg BS. Effects of anaesthesia on paediatric lung function. Br J Anaesth. 2016 Aug;117(2):151–63. https://doi.org/10.1093/bja/aew173 PMID:27440626
20. Heath C, Hauser N. Is there a role for lung-protective ventilation in healthy children? Paediatr Anaesth. 2022 Feb;32(2):278–85. https://doi.org/10.1111/pan.14345 PMID:34839569
21. Acosta CM, Sara T, Carpinella M, Volpicelli G, Ricci L, Poliotto S, et al. Lung recruitment prevents collapse during laparoscopy in children: A randomised controlled trial. Eur J Anaesthesiol. 2018 Aug;35(8):573–80. https://doi.org/10.1097/EJA.0000000000000761 PMID:29278555
22. Dargaville PA, Tingay DG. Lung protective ventilation in extremely preterm infants. J Paediatr Child Health. 2012 Sep;48(9):740–6. https://doi.org/10.1111/j.1440-1754.2012.02532.x PMID:22970667
23. Habre W, Disma N, Virag K, Becke K, Hansen TG, Jöhr M, et al.; APRICOT Group of the European Society of Anaesthesiology Clinical Trial Network. Incidence of severe critical events in paediatric anaesthesia (APRICOT): a prospective multicentre observational study in 261 hospitals in Europe. Lancet Respir Med. 2017 May;5(5):412–25. https://doi.org/10.1016/S2213-2600(17)30116-9 PMID:28363725
24. Elgie L, Miskovic A, Nandi R. Intraoperative oxygenation and ventilation in children – A U.K. survey of current practice. Paediatr Anaesth. 2019 Aug;29(8):878–9. https://doi.org/10.1111/pan.13688 PMID:31233674
25. Schulzke SM, Stoecklin B. Update on ventilatory management of extremely preterm infants-A Neonatal Intensive Care Unit perspective. Paediatr Anaesth. 2022 Feb;32(2):363–71. https://doi.org/10.1111/pan.14369 PMID:34878697
26. Askie LM, Darlow BA, Finer N, Schmidt B, Stenson B, Tarnow-Mordi W, et al.; Neonatal Oxygenation Prospective Meta-analysis (NeOProM) Collaboration. Association Between Oxygen Saturation Targeting and Death or Disability in Extremely Preterm Infants in the Neonatal Oxygenation Prospective Meta-analysis Collaboration. JAMA. 2018 Jun;319(21):2190–201. https://doi.org/10.1001/jama.2018.5725 PMID:29872859
27. Grandville B, Petak F, Albu G, Bayat S, Pichon I, Habre W. High inspired oxygen fraction impairs lung volume and ventilation heterogeneity in healthy children: a double-blind randomised controlled trial. Br J Anaesth. 2019 May;122(5):682–91. https://doi.org/10.1016/j.bja.2019.01.036 PMID:30916028
28. Habre W, Peták F. Perioperative use of oxygen: variabilities across age. Br J Anaesth. 2014 Dec;113 Suppl 2:ii26–36. https://doi.org/10.1093/bja/aeu380 PMID:25498579
29. McCann ME, Schouten AN. Beyond survival; influences of blood pressure, cerebral perfusion and anesthesia on neurodevelopment. Paediatr Anaesth. 2014 Jan;24(1):68–73. https://doi.org/10.1111/pan.12310 PMID:24267703
30. Humphreys S, Schibler A, von Ungern-Sternberg BS. Carbon dioxide monitoring in children-A narrative review of physiology, value, and pitfalls in clinical practice. Paediatr Anaesth. 2021 Aug;31(8):839–45. https://doi.org/10.1111/pan.14208 PMID:34008907
31. Schmalisch G. Current methodological and technical limitations of time and volumetric capnography in newborns. Biomed Eng Online. 2016 Aug;15(1):104. https://doi.org/10.1186/s12938-016-0228-4 PMID:27576441
32. King MR, Feldman JM. Optimal management of apparatus dead space in the anesthetized infant. Paediatr Anaesth. 2017 Dec;27(12):1185–92. https://doi.org/10.1111/pan.13254 PMID:29044830
33. Pearsall MF, Feldman JM. When does apparatus dead space matter for the pediatric patient? Anesth Analg. 2014 Apr;118(4):776–80. https://doi.org/10.1213/ANE.0000000000000148 PMID:24651232

 ORCID
ORCID