Rafael Lima Linares 1 ,*, Arturo Vázquez Peralta 2 , Paola Vazquez Castañeda 3 , Astrid De la Torre Cinco 4
Recibido: 22-08-2021
Aceptado: 11-11-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 1 pp. 82-86|https://doi.org/10.25237/revchilanestv5129121214
PDF|ePub|RIS
Atrial septal defect surgical repair under Neuroaxial anesthesia and sedation: case report
Abstract
We present the case report of one of the co-authors for the closure of her atrial septal defect under neuraxial anesthesia. The influence of the Cardiovascular Anesthesiologist on the response to perioperative stress in the context of cardiac surgery with the choice and application of the best anesthetic technique adjusted to a high-risk patient, has a positive impact on the main objectives of high-value care in the critical area of medicine and in the immediate postoperative evolution after a heart surgery. The safety of neuraxial anesthesia in cardiac surgery is a subject in wide debate in Mexico, even in hospitals with high volume of cardiac surgery it is a controversial subject, we present the first clinical case in Mexico of a 21-year-old female patient under- going closure of Atrial septal defect (ASD) via median sternotomy with extracorporeal circulation under neuraxial anesthesia and sedoanalgesia without orotracheal intubation.
Resumen
Presentamos el reporte de caso de una de las coautoras para el cierre de su comunicación interatrial bajo anestesia neuroaxial. La influencia del Anestesiologo Cardiovascular en la respuesta al estres perioperatorio en el contexto de cirugía cardíaca con la elección y aplicación de la mejor tecnica anestesica ajustada a un paciente de alto riesgo, tiene un impacto positivo en los principales obejtivos del cuidado de alto valor en el área de la medicina critica y en la evolución posoperatoria inmediata tras una cirugía caridaca. La seguridad de la anestesia neuroaxial en cirugía cardíaca es un tema en amplio debate en México, aun en hospitales con alto volumen de cirugía cardíaca es un tema controversial. Presentamos el primer caso clínico en México de una paciente femenino de 21 años sometida a cierre de comunicación interauricular (CIA) vía esternotomia media con circulación extracorporea bajo anestesia neuroaxial y sedoanalgesia sin intubación orotraqueal.
Con el advenimiento de cirugía cardíaca mínimamente invasiva, protocolos ERAS y fast track en anestesia, el papel de las técnicas regionales han obtenido un rol importante en la analgesia multimodal, con mayor énfasis en los últimos años sobre bloqueo de nervios periféricos en planos neurales guiados por ultrasonido (USG)[1].
La insición de la piel, retracción de las costillas, inserción de drenajes torácicos estimulan vías nociceptivas y neuropati- cas originadas en aferencias somaticas y viscerales. Los nervios intercostales transportan las aferencias somáticas nociceptivas hacia el asta dorsal ipsilateral de la médula espinal, principal proceso para la generación del dolor postoracotomía[2].
Los grandes objetivos que la anestesia regional ha obtenido en los últimos años con dirección hacia el menor uso de opioides, han sido menor tasa de infecciones, menor riesgo de falla renal o complicaciones pulmonares asociadas a dolor (capacidad tusigena reducida, hipoxia y atelectasias), extubación temprana, reduccion del riesgo de isquemia cerebral y cardíaca, menores costos económicos, menor tiempo de estancia en UCI y hospitalaria[3].
La anestesia neuroaxial generalmente se complementa con anestesia general (preferiblemente con agentes de inhalación para aprovechar su efecto sobre la protección miocardica) lo suficientemente profunda como para mantener la inconsciencia y la amnesia. El rol de la anestesia regional ha jugado un papel importante para la analgesia multimodal, en segundo plano de la anestesia general, por su eficacia y seguridad ampliamente descritas. Preocupaciones por hematomas espinales y epidura- les potenciados por la administración de heparina y coagulapa- tia inducida por circulación extracorpórea, colapso hemodiná- mico generado por vasodilatación y bradicardia en el terreno de un sistema cardiovascular con pobre respuesta intrínseca y la falta de ensayos clínicos extensos que avalen la amplia recomendación de su uso son los posibles elementos que han obstaculizado su empleo de primera línea para manejo anestesico principal y en nuestros días sigue permaneciendo como una controversia en curso. Es importante considerar que el riesgo de hematoma epidural es 1:12.000 (IC 95% de 1:2.100 a 1:6.800) y que es comparable a una cirugía no cardíaca[4].
Femenino de 21 años, coautora de este reporte, estudiante de medicina, sin antecedentes de importancia. Historia cardiovascular de 1 año de evolución con disnea, clase funcional II, siendo diagnosticada con comunicación interauricular tipo ostium secundum, sin bordes adecuados para cierre percutáneo, con hipertensión pulmonar moderada y función biventricular conservada, ingresa para cierre quirúrgico por esternotomía media. En la valoración preanestésica se propone a la paciente, técnica anestésica neuroaxial y sedación, autorizando dicho procedimiento. En sala de quirófano se coloca línea arterial radial izquierda y catéter venoso central, ambos con anestesia local. Después se colocó catéter peridural inerte en T7 – T8, sin incidentes y posteriormente se realiza bloqueo subaracnoideo a nivel L1 – L2, con aguja whitacre #27 al 1er intento, se administran 22,5 mg ropivacaína 7,5%, con adecuado bloqueo motor y sensitivo en sitio quirúrgico. Al manejo se agregada sedoanalgesia con midazolam 2 mg IV, sufentanil 10 mcg IV, y dexmedetomidina 0,3 mcg/kg/h manteniendo ventilación espontánea con apoyo de oxígeno por mascarilla reservorio a 5 lts por minuto (Figura 1).
Durante transanestésico se mantiene hemodinámicamen- te estable con apoyo vasopresor con norepinefrina hasta 0,05 mcg/kg/min. En circulación extracorpórea se incrementa dosis de dexmedetomidina a 0,5 mcg/kg/h, sin cambios hemodiná- micos y con RASS -3. Se realiza cierre quirúrgico del defecto interauricular, saliendo de derivación cardiopulmonar sólo con soporte vasopresor (Figura 2).
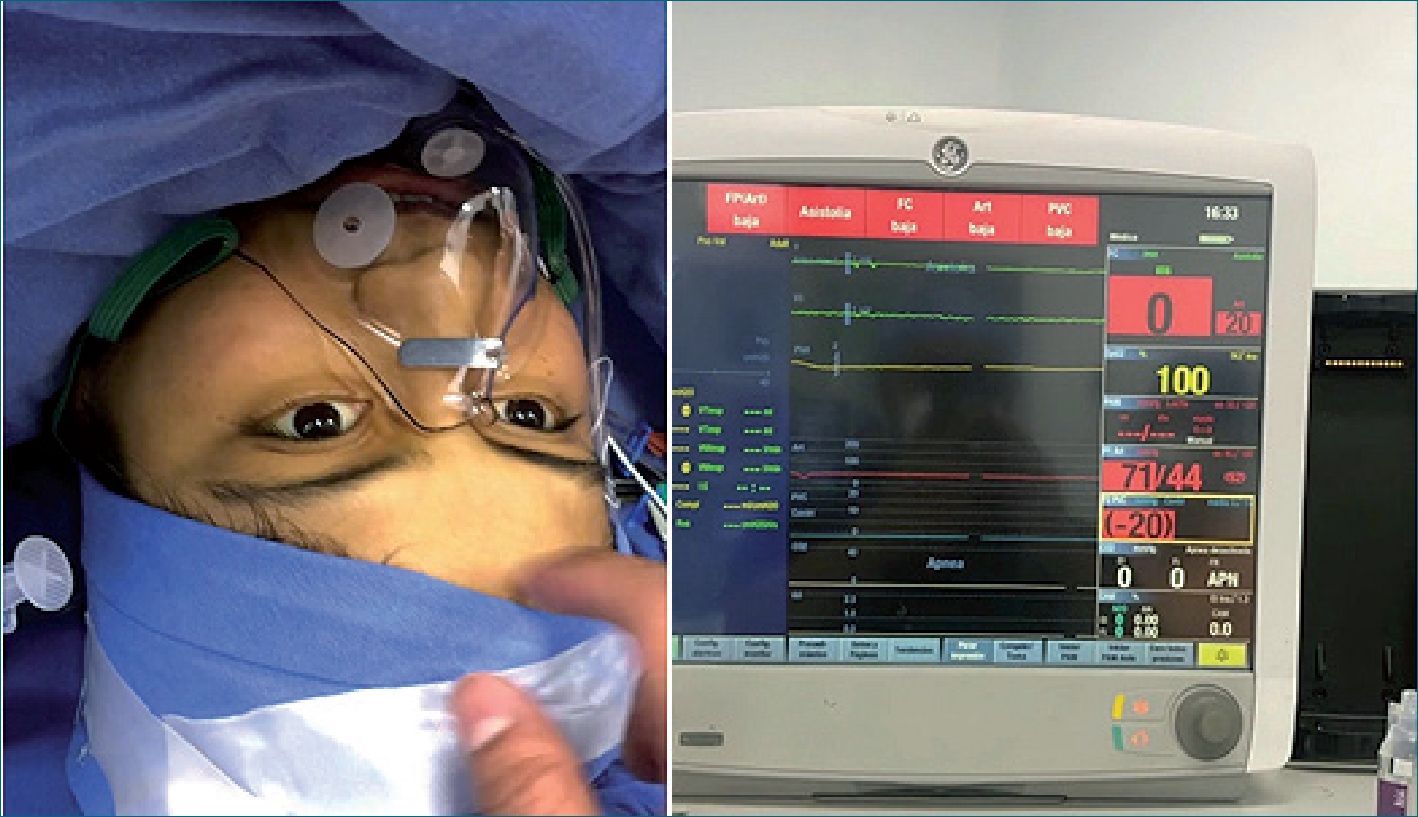
Figura 1. Paciente despierto durante asistolia y pinzamiento aortico.
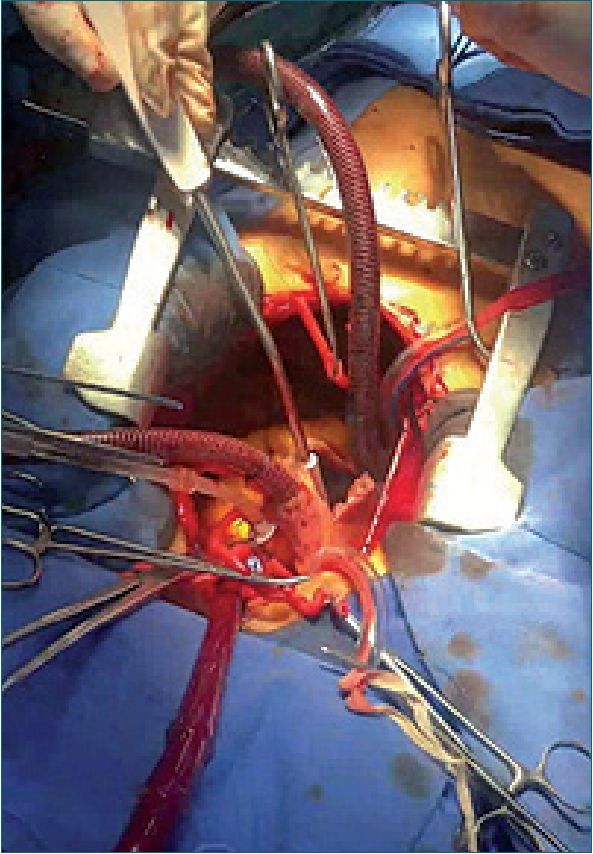
Figura 2. Esternotomia media y canula- ción central.
Pasa a terapia postquirúrgica manteniendo RASS -2, con analgesia peridural con ropivacaína reportando dolor postoperatorio mínimo. Se retiró el catéter 30 horas después del evento quirúrgico, previa verificación de tiempos de coagulación dentro de parámetros normales, sin incidentes neurológicos neuroaxiales. Con adecuada evolución durante su estancia, se decide egreso a su domicilio 5 días después. En seguimiento por el Servicio de Cardiología continua, con evolución satisfactoria, documentando en ecocardiograma de control a los 6 meses, buena función biventricular, sin cortocircuito residual, clínicamente sin deterioro, realizando actividades acordes a su edad sin problemas.
La denervación farmacologica por un período de tiempo que confiere analgesia sensorial profunda, más bloqueo motor y simpatico otorgada por anestesia espinal o peridural empleando concentraciones altas de anestesicos locales más sedación podria convertirse en la técnica de elección ante cirugía cardíaca con bajo riesgo de sangrado, tiempos de pinzamiento aortico y circulación extracorporea mínimos y candidatos a protocolos de fast track reduciendo los días de estancia hospitalaria[5].
Los beneficios de esta simpatectomía incluyen balance positivo de oxígeno miocárdico, redistribución de flujo a órganos abdominales, menores alteraciones homeostáticas, humorales e inmunosupresivas y protección contra la regulación negativa de receptores B[6].
Algunos autores como Kumar[7] y Yalamuri[8] han descrito el empleo de bloqueos de la facia de músculos pectorales (PECS) I y II para cirugía de revascularización miocárdica y cambio valvular como adyuvantes de la analgesia posoperatoria. Encontraron datos interesantes: disminución del tiempo de soporte ventilatorio, mayor flujo inspiratorio pico, obteniendo menores tasas de dolor medidas con escala visual análoga dentro de las primeras 18 h.
En el campo de la cirugía cardíaca pediátrica la estimación del dolor agudo posoperatorio ha sido mayormente estudiado, Kaushal y cols[9] en un estudio prospectivo, ramdomizado, doble ciego y comparativo de 108 niños con cardiopatias con- genitas; evaluarón la eficacia del bloqueo del plano fascial del músculo serrato anterior (SABP por siglas en inglés), bloqueo de nervio intercostal (ICNB) y PECS I y II para el manejo del dolor postoracotomia, usando ropivacaina 2% a 3 mg/kg guiado por USG, concluyendo que el SABP y PECS I y II son igualmente efectivos y ligeramente superiores a ICNB.
En México, se ha documentado la seguridad del bloqueo caudal en la población pediátrica para corrección de cardiopatias congánitas en el marco de la analgesia multimodal. Rojas- Pérez y cols[10] en 2003 publicarón sus estudios en 30 pacientes aleatorizados y comparando 2 grupos. Al primer grupo se le añadió al manejo anestésico, la administración vía caudal de bupivacaina 0,22%, calculada a 4 mg/kg y morfina 150 mcg/ kg, ambos mantenidos bajo anestesia general balanceada. Descubrieron que el grupo 1 tuvo menores variaciones hemodinamicas, se redujerón los requerimentos de opiodes y tiempo de extubación más corto.
Un informe no aleatorio de Wijeysundera y sus colegas[11] confirmó una reducción pequeña, pero significativa, de la mortalidad a 30 días bajo el empleo de analgesia epidural torácica, en cirugía mayor no cardíaca (1,7 frente a 2,0% sin uso de esta técnica, riesgo relativo 0,89, p = 0,02). Por el contrario, en cirugía cardíaca, su uso se ha moderado en todo el mundo debido al temor latente de hematoma epidural debido a la anticoagulación de dosis completa requerida para la circulación extracorpórea. En una revisión sistematizada y metaanalisis de la literatura internacional, incluyendo a 3.320 pacientes, se encontró que el uso de analgesia epidural en cirugía cardíaca se asocia con una reducción de la mortalidad (NNT = 70) y con un riesgo estimado de hematoma epidural de 1: 3.552 y la incidencia de infarto de miocardio perioperatorio fue significativamente menor en el grupo epidural (2,4%) frente a (3,7%) el grupo control (RR 0,68 [IC 95%], P = 0,007, NNT = 78)[12] (Tabla 1).
Las principales complicaciones que se han descrito son hematoma espinal, hematoma peridural, paraplegia, parálisis unilateral de extremidades pélvicas e inestabilidad hemodinámica.
Un grupo de anestesiólogos canadienses han descrito en un texto, su técnica de anestesia espinal torácica alta con aguja calibre 27 G en más de 10.000 pacientes, sin reportar un sólo caso de hematoma[17]. Utilizando una solución intratecal que consta de 20 a 40 mg de bupivacaina hiperbárica 0,75%, 0,3 a 0,4 mg de morfina y 10 a 20 mcg de sufentanilo con un volumen total de 4 a 6 ml a nivel T1, el manejo de la bradicardia e hipotensión lo describen de manera sencilla empleando posición Trendelemburg y pequeñas dosis de vasopresores como dopamina y fenilefrina.
A raíz del conocimiento obtenido de la utilización de ECMO (Oxigenación por membrana extracorpórea) veno-arterial como soporte hemodinámico en pacientes con falla cardíaca que se mantienen despiertos durante el tiempo que dura el soporte, se ha aprendido que facilita la rehabilitación del paciente, evita complicaciones asociadas a la intubación y ventilación mecánica y aunque la función cardíaca del paciente sea mínima, el soporte hemodinámico con ECMO puede ser total mantenien do una perfusión cerebral adecuada. Esta situación se puede extrapolar a las cirugías cardíacas, por lo que al tener la analgesia quirúrgica asegurada por medio de la anestesia neuroaxial, el mantenimiento de la estabilidad hemodinámica, incluso durante la circulación extracorpórea, no debería implicar mayor riesgo en el paciente bajo sedación[18].
| Tabla 1. Publicaciones con reporte de complicaciones en cirugía cardíaca empleando anestesia peridural | |||
| Autor | Tipo de estudio | Complicación | Desenlace |
| Yoshinawa y cols[13] 2004 | Reporte de caso | Hematoma epidural (n = 1) | Paraplejia |
| Rosen y cols[14] 2004 | Reporte de caso | Hematoma epidural (n = 1) | Recuperación completa 6 semanas después |
| Yoshida y cols[15] 2005 | Reporte de caso | Síndrome espinal anterior (n = 1) | Páralisis unilateral de miembro pélvico |
| Chaney y cols[16] 2006 | Reporte de caso | Hematoma epidural y fenomeno tromboembolico (n = 1) | Paraplejia |
Las técnicas anestésicas combinadas han probado ser ideales para el control del dolor posoperatorio en cirugía cardíaca, lo cual mejora la evolución de este tipo de pacientes. Hasta nuestro entender, este es el primer reporte de caso en México donde se usó anestesia neuroaxial y sedación para un procedimiento quirúrgico cardíaco con circulación extracorpórea, con pinzado aórtico y asistolia. Es importante tener en cuenta que el paciente va a mantenerse con ventilación espontánea, por lo que es ideal que no haya apertura pleural, ya que esto generaria mucha interferencia en el campo quirúrgico. El paciente debe estar enterado ampliamente del procedimiento anestésico. En este caso, el hecho de que la paciente es estudiante de medicina facilitó el procedimiento. Usar el bloqueo subaracnoideo como técnica anestésica principal y dejar un catéter peridural para analgesia posoperatoria parece una buena combinación, aunque la posibilidad de complicaciones como hematomas neuroaxiales existe, su incidencia es muy baja.
La evolución posoperatoria en este caso fue excelente como era esperado, la analgesia óptima y el uso de dosis mínimas de opioides evitó los efectos secundarios asociados a ellos. El reto es mantener la estabilidad hemodinamica del paciente durante cada momento del evento quirúrgico, incluso durante la circulación extracorpórea, en donde podría profundizarse más la sedación, ya que la oxigenación y decarboxilación puede hacerse totalmente por medio de la circulación extracorpórea. A decir de la misma coautora y paciente de este caso, el transoperatorio no representó un evento traumático o que le haya condicionado ansiedad o estrés en algún punto. Adicionalmente fue posible respetar la decisión de la paciente de evitar la intubación orotraqueal, que es un argumento común en los anestesiólogos con el fin de evitar mantener a un paciente despierto durante una cirugía cardíaca o que pudiera poner en riesgo el evento quirúrgico.
La anestesia neuroaxial asociada a sedación es una opción viable y segura para la realización de procedimientos quirúrgicos cardíacos no complejos con circulación extracorpórea, pinzamiento aortico y asistolia. Es indiscutible la ventaja de la analgesia neuroaxial para el manejo del dolor posoperatorio, así mismo el evitar la intubacion orotraqueal que disminuye considerablemente el riesgo de infecciones asociadas a la intubación y ventilación mecánica. El mantenimiento de la estabilidad hemodinámica, en todo momento, supone un reto para el anestesiólogo cardiovascular. Este reporte del propio caso de una de las coautoras, nos amplia aún más el panorama del uso de este tipo de técnicas en cirugía cardíaca, ya que con una sedación no profunda, este tipo de cirugías no representa un evento de estrés o angustia para el paciente. Siempre debe tenerse en mente la individualización de cada acto médico, tratando, en la medida que sea seguro, de considerar la decisión del paciente en cada momento.
Figura 3. video descriptivo del caso.
1. Noss C, Prusinkiewicz C, Nelson G, Patel PA, Augoustides JG, Gregory AJ. Enhanced recovery for cardiac surgery. J Cardiothorac Vasc Anesth. 2018 Dec;32(6):2760–70. https://doi.org/10.1053/j.jvca.2018.01.045 PMID:29503121
2. Mesbah A, Yeung J, Gao F. Pain after thoracotomy. BJA Educ. 2016;16(1):1–7. https://doi.org/10.1093/bjaceaccp/mkv005.
3. Chakravarthy M. Regional analgesia in cardiothoracic surgery: A changing paradigm toward opioid-free anesthesia? Ann Card Anaesth. 2018 Jul-Sep;21(3):225–7. https://doi.org/10.4103/aca.ACA_56_18 PMID:30052206
4. Horlocker TT, Vandermeuelen E, Kopp SL, et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American society of regional anesthesia and pain medicine evidence-based guidelines (Fourth Edition). Reg Anesth Pain Med 2018;43(3):263-309.
5. Ruppen W, Derry S, McQuay HJ, Moore RA. Incidence of epidural haematoma and neurological injury in cardiovascular patients with epidural analgesia/anaesthesia: systematic review and meta-analysis. BMC Anesthesiol. 2006 Sep;6(1):10–10. https://doi.org/10.1186/1471-2253-6-10 PMID:16968537
6. Lee TW, Grocott HP, Schwinn D, Jacobsohn E; Winnipeg High-Spinal Anesthesia Group. High spinal anesthesia for cardiac surgery: effects on beta-adrenergic receptor function, stress response, and hemodynamics. Anesthesiology. 2003 Feb;98(2):499–510. https://doi.org/10.1097/00000542-200302000-00032 PMID:12552211
7. Kumar KN, Kalyane RN, Singh NG, Nagaraja PS, Krishna M, Babu B, et al. Efficacy of bilateral pectoralis nerve block for ultrafast tracking and postoperative pain management in cardiac surgery. Ann Card Anaesth. 2018 Jul-Sep;21(3):333–8. https://doi.org/10.4103/aca.ACA_15_18 PMID:30052231
8. Yalamuri S, Klinger RY, Bullock WM, Glower DD, Bottiger BA, Gadsden JC. Pectoral fascial (PECS) I and II blocks as rescue analgesia in a patient undergoing minimally invasive cardiac surgery. Reg Anesth Pain Med. 2017 Nov/Dec;42(6):764–6. https://doi.org/10.1097/AAP.0000000000000661 PMID:29016551
9. Kaushal B, Chauhan S, Saini K, Bhoi D, Bisoi AK, Sangdup T, et al. Comparison of the efficacy of ultrasound-guided serratus anterior plane block, pectoral nerves II block, and intercostal nerve block for the management of postoperative thoracotomy pain after pediatric cardiac surgery. J Cardiothorac Vasc Anesth. 2019 Feb;33(2):418–25. https://doi.org/10.1053/j.jvca.2018.08.209 PMID:30293833
10. Rojas-Pérez E. Castillo-Zamora C. Nava-Ocampo A. A randomized trial of caudal block with bupivacaine 4 mg·kg−1 (1.8 ml·kg-1) plus morphine (150 µg·kg−1) vs general anaesthesia with fentanyl for cardiac surgery. Paediatr Anaesth. 2003 May;13:311–7. https://doi.org/10.1046/j.1460-9592.2003.01063.x PMID:12753443
11. Wijeysundera DN, Beattie WS, Austin PC, Hux JE, Laupacis A. Epidural anaesthesia and survival after intermediate-to-high risk non-cardiac surgery: a population-based cohort study. Lancet. 2008 Aug;372(9638):562–9. https://doi.org/10.1016/S0140-6736(08)61121-6 PMID:18692893
12. Landoni G, Isella F, Greco M, Zangrillo A, Royse CF. Benefits and risks of epidural analgesia in cardiac surgery. Br J Anaesth. 2015 Jul;115(1):25–32. https://doi.org/10.1093/bja/aev201 PMID:26089444
13. Yoshinaga A, Sonoda H. [Epidural hematoma caused after epidural catheterization for the coronary artery bypass graft: a case report]. Masui. 2004 May;53(5):551–4. PMID:15198242
14. Rosen DA, Hawkinberry DW 2nd, Rosen KR, Gustafson RA, Hogg JP, Broadman LM. An epidural hematoma in an adolescent patient after cardiac surgery. Anesth Analg. 2004 Apr;98(4):966–9. https://doi.org/10.1213/01.ANE.0000103267.37895.5B PMID:15041581
15. Yoshida S, Nitta Y, Oda K. Anterior spinal artery syndrome after minimally invasive direct coronary artery bypass grafting under general combined epidural anesthesia. Jpn J Thorac Cardiovasc Surg. 2005 Apr;53(4):230–3. https://doi.org/10.1007/s11748-005-0114-7 PMID:15875563
16. Chaney MA, Labovsky JK. Thoracic epidural anesthesia and cardiac surgery: balancing postoperative risks associated with hematoma formation and thromboembolic phenomenon. J Cardiothorac Vasc Anesth. 2005 Dec;19(6):768–71. https://doi.org/10.1053/j.jvca.2005.03.033 PMID:16326303
17. Kowalewski R, Seal D, Tang T, Prusinkiewicz C, Ha D. Neuraxial anesthesia for cardiac surgery: thoracic epidural and high spinal anesthesia – why is it different? HSR Proc Intensive Care Cardiovasc Anesth. 2011;3(1):25–8. PMID:23440039
18. Lima Linares R, Guerrero Gutiérrez M, Vázquez Peralta A, Pérez Nieto R, Zamarrón E. Oxigenación con membrana extracorpórea. Revista Chilena de Anestesia. 2021;50(2):314–29. https://doi.org/10.25237/revchilanestv50n02-07

 ORCID
ORCID