Edgardo Banille1,*, Alfredo Rodríguez-Portelles2, Javier Ponce3, Betina Vega1, Ricardo Ledesma1,a, Carlos Maure1,b, Mario Espósito1,b, Marco Emmanuel Jiménez Texcalpa4
Recibido: 17-04-2023
Aceptado: 23-05-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 5 pp. 558-564|https://doi.org/10.25237/revchilanestv52n5-19
PDF|ePub|RIS
Score de VExUS fetal
Abstract
We present a male patient of 1 day of life, preterm newborn (PTNB): 36 weeks of gestation and large for gestational age (LGA): Weight: 3,500 grams. Prenatal diagnosis of hypertrophic cardiomyopathy was made. She was born by cesarean section due to maternal history of type I diabetes and hypothyroidism for 2 years of age, treated with NPH insulin 40 IU in the morning and corrections according to glycemia and levothyroxine 125 mg/day. The primary objective is to analyze the mechanisms involved in fetal heart failure and the physiopathogenesis of water overload by means of a scoring system (VExUS score). The score is obtained with Doppler profiles of abdominal vessels (inferior vena cava, suprahepatic veins, portal vein and renal veins). We tried to find a correlation with the fetal heart failure score described by Huhta and Paul in 1996, which combines cardiac size and function with Doppler flow parameters of fetal abdominal vessels. Both scores reflected severe congestion. The secondary objective is to observe the evolution of heart failure and venous congestion with the treatment implemented.
Resumen
Se presenta un paciente masculino de 1 día de vida, recién nacido pretérmino (RNPT): 36 semanas de gestación y grande para edad gestacional (GEG): Peso: 3.500 gramos. Se realiza diagnóstico prenatal de miocardiopatía hipertrófica. Nace por operación cesárea por antecedentes maternos con diabetes tipo I e hipotiroidismo desde los 2 años de edad, tratada actualmente con insulina NPH 40 UI por la mañana y correcciones según glucemia y levotiroxina 125 mg/día. El objetivo primario es analizar los mecanismos involucrados en la insuficiencia cardíaca fetal y la fisiopatogenia de la sobrecarga hídrica por intermedio de un sistema de puntaje (score VExUS). El mismo se obtiene con los perfiles Doppler de los vasos abdominales (vena cava inferior, venas suprahepáticas, vena porta y venas renales) (Figuras 1). Tratamos de buscar una correlación con el de insuficiencia cardíaca fetal descripto por Huhta y Paul en el año 1996, este combina el tamaño y la función cardíaca con parámetros de flujo Doppler de vasos abdominales fetales (Figura 2). Ambos reflejaron congestión severa. El objetivo secundario, es observar la evolución de la insuficiencia cardíaca y de la congestión venosa con el tratamiento implementado.
-
Introducción
La utilidad del uso score VExUS en pacientes adultos, es una herramienta innovadora en el monitoreo de la sobrecarga hídrica en escenarios de insuficiencia cardíaca de diferente etiología, preferentemente, en pacientes que cursan un posquirúrgico cardiovascular.
La congestión venosa generalmente ocasionada por insuficiencia del ventrículo derecho, altera la capacitancia venosa sistémica, las ondas de la presión venosa central (PVC) reflejan el ciclo cardíaco y se transmiten en forma retrógrada hacia los vasos abdominales[1]-[5]
En la población pediátrica y neonatal Banille y cols.[6],[7] demuestran la utilidad del score VExUS en pacientes con cardiopatías congénitas.
En nuestro paciente encontramos que la disfunción diastólica biventricular puede evidenciarse precozmente en etapas tan tempranas, como la vida fetal manifestándose como insuficiencia cardíaca y congestión venosa.
Estos hallazgos nos permiten tomar conductas proactivas y adelantarnos a tratar la sobrecarga hídrica, que de no ser advertida o mal interpretada, puede generar en el recién nacido fallo multiorgánico a partir de la congestión esplácnica y renal[1]-[5].
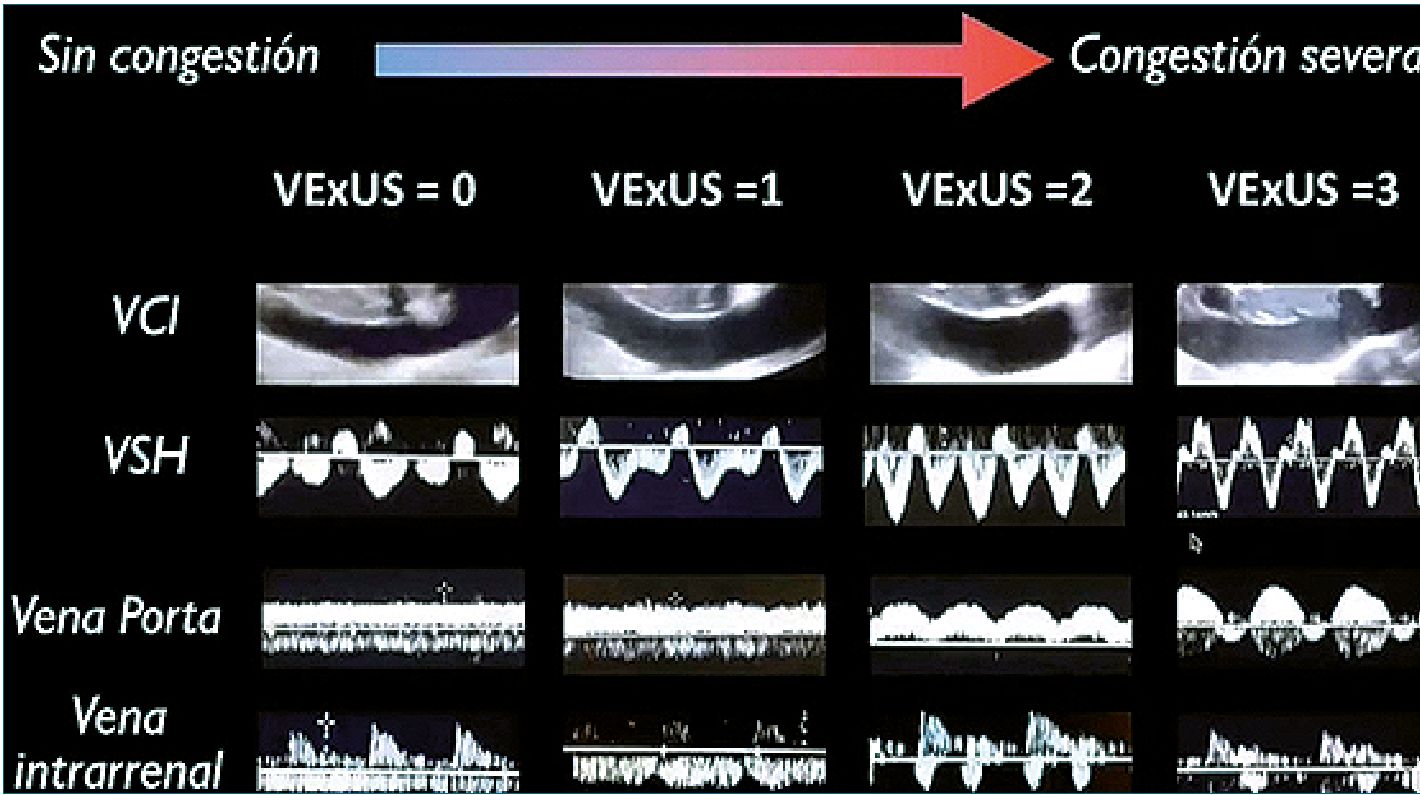
Figura 1. Score VExUS. Modificado de Kora- tala y cols[1].
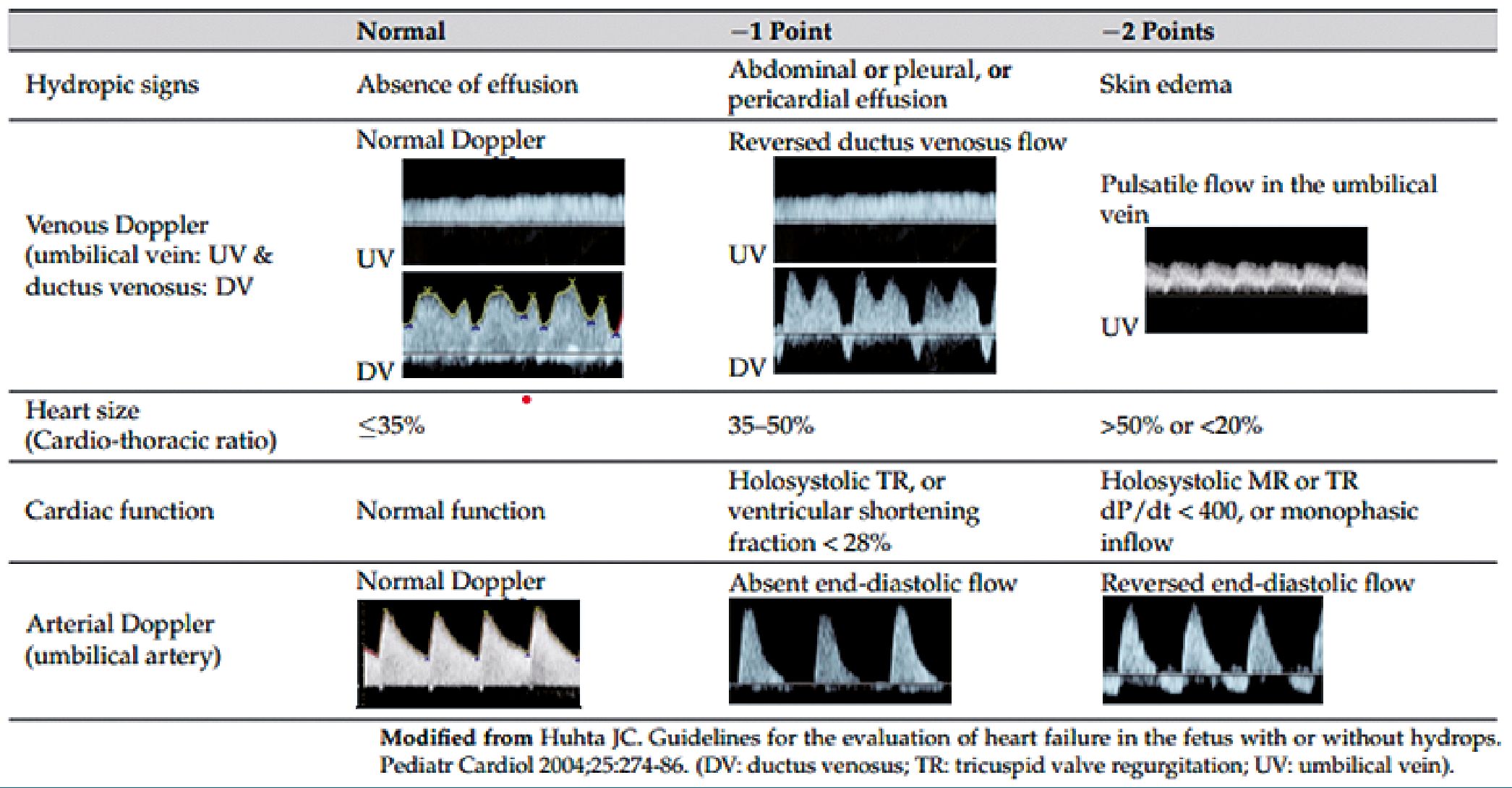
Figura 2. Score de insuficiencia cardíaca fetal. Modificado de Huhta JC[4].
-
Presentación del caso
Paciente de sexo masculino de 1 día de vida, RNPT: 36 sem, GEG: peso: 3.510 g. Nace por operación cesárea programada por los antecedentes maternos (diabetes tipo 1) con signos de insuficiencia placentaria (alteración del flujo de arteria umbilical) y antecedentes fetales: (cardiomiopatía con signos de insuficiencia cardiaca reflejados en la onda “a” reversa del ductus venoso, polihidramnios e hidrops fetal no inmune). Presenta al nacer un score de Apgar: 6-8. Ingresa a neonatología con signos de dificultad respiratoria que requiere asistencia respiratoria mecánica (ARM). El examen clínico muestra tiraje subcostal e intercostal, estertores crepitantes bilaterales, frecuencia respiratoria 60 respiraciones por minuto (rpm), SaO2: 85% con FiO2: 50%, mal perfusión periférica, frecuencia cardíaca 164 latidos por minuto, tensión arterial 57/30 mmHg, no se auscultan soplos y los pulsos femorales y braquiales estaban palpables.
Los gases obtenidos de cordón umbilical revelan acidosis metabólica /pH: 6,90 – HCO3: 11, EB: -11,5, PaCO2: 38. La radiografía de tórax muestra cardiomegalia y signos de infiltrados intersticio alveolar.
Los ecocardiogramas fetales mostraron cardiomiopatía hipertrófica con un grosor del tabique interventricular de 8 mm y de la pared posterior del ventrículo izquierdo de 6 mm, sin signos de obstrucción al tracto de salida, con función sistólica estaba conservada, en cambio se evidenció disfunción diastólica (curvas de lleno mitral: onda E monofásica (Figura 3).
Se realizó ecografía prenatal de los vasos abdominales, en eje corto y largo se visualiza dilatación de la vena cava inferior (VCI): 7,8 mm, sin colapso y mientras que la aorta abdominal (Ao abd) medía: 4 mm. Con Doppler pulsado se analiza el flujo de las venas suprahepáticas, porta y renales se calcula un score VExUS: 3. (Figura 4 A-B-C). Además se encontró flujo reverso en el ductus venoso, inversión de fin de diástole en el flujo de arteria umbilical, y pulsatilidad en la vena umbilical (Figura 5).
Se realiza además Doppler de vasos arteriales (cerebral media, mesentérica y renal) y se evidencia un incremento de los índice de resistencia (IR) (Figura 6 A-B-C).
En la ecografía abdominal presenta hepatomegalia homogénea, leve ascitis y líquido en el espacio de Morison y a nivel interasas.
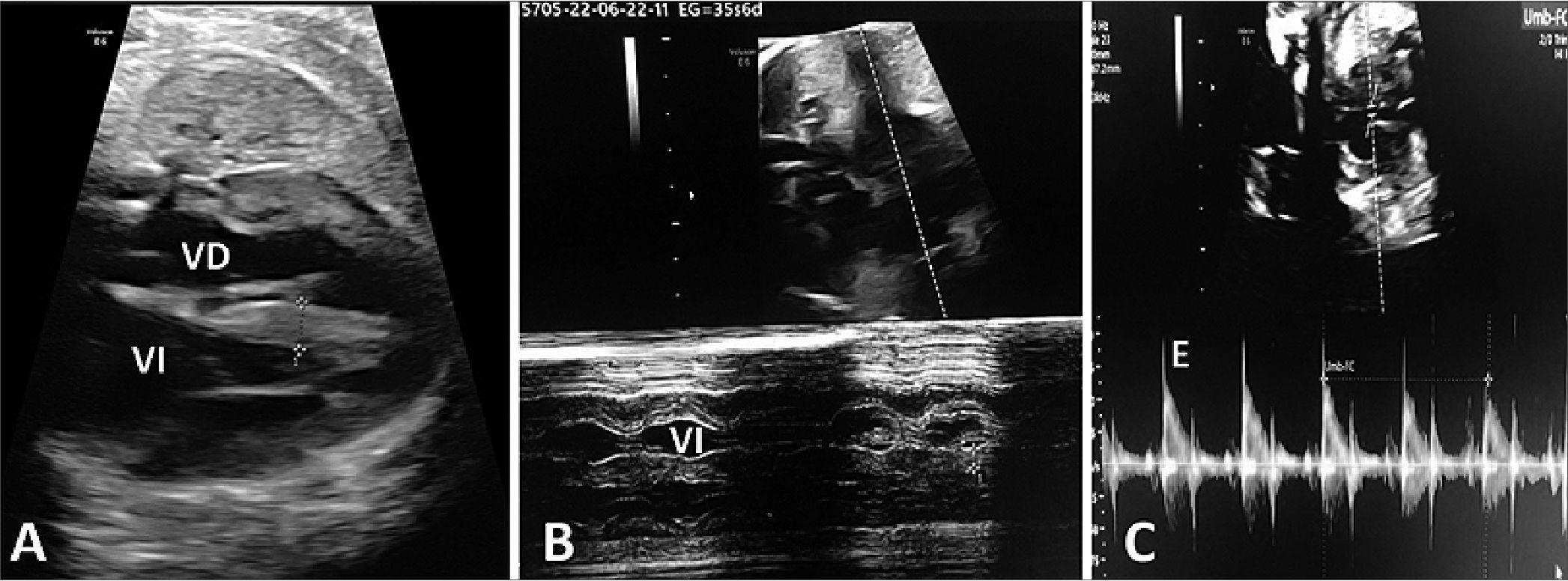
Figura 3. Ecocardiograma Fetal Grosor TIV en eco 2 “D”. A. Corte de 4 cámaras; B. Tabique interventricular 8 mm (Grosor en MODO M); C. Disfunción diastólica. Patrón monofásico (congestión severa).
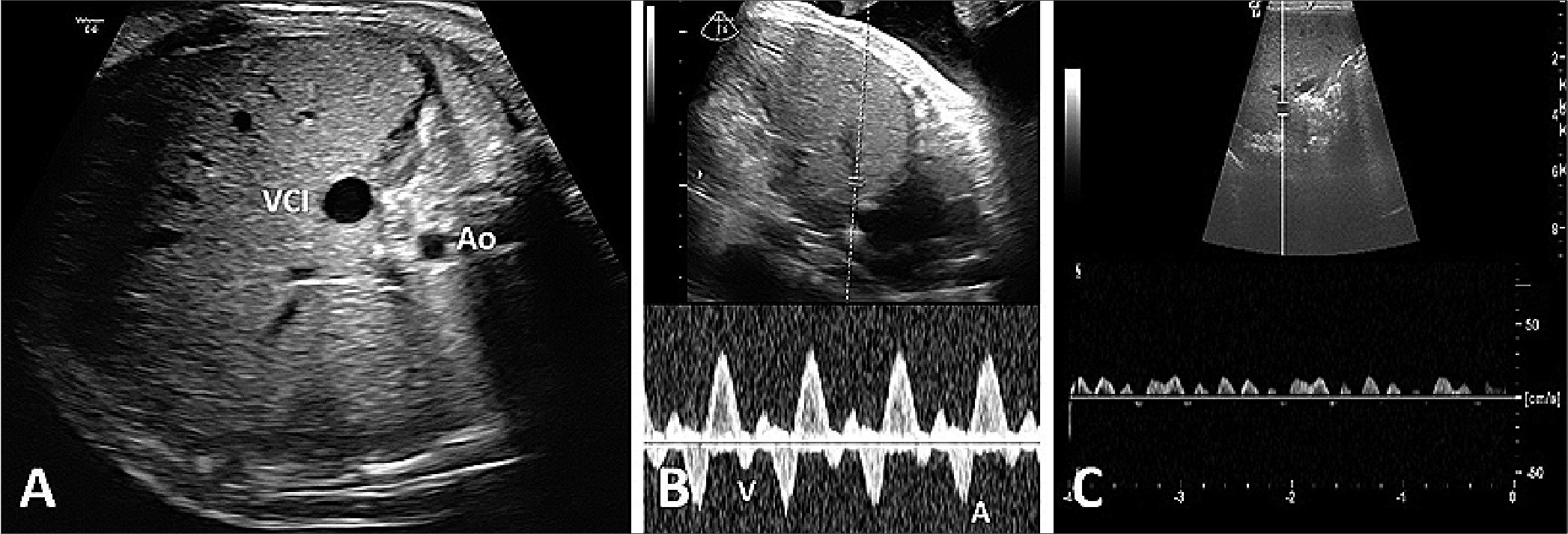
Figura 4. A. Relación VCI/Ao eje corto. VCI: 7,8 mm. Ao: 4 mm; B. Doppler em venas supra-hepáticas. VSH tetrafásica; C. Vena porta. Vena porta onda bifásica.
A las 2 horas de vida se realiza ecocardiograma y ecografía abdominal que muestran hallazgos similares a los encontrados en los estudios prenatales.
La evolución es favorable, se encuentra compensado he- modinámicamente, no requirió soporte inotrópico (función sistólica normal). Se indicó furosemida 1 mg/kg/cada 8 h por vía endovenosa durante 3 días al igual que la asistencia respiratoria mecánica. Con la mejoría clínica ya radiológica, se cambia a ventilación no invasiva (VNI) durante 48 h más.
A los 7 días de vida se repite ecocardiograma donde disminuyeron los signos de hipertrofia ventricular (tabique interventricular 6 mm) y el Doppler de vasos abdominales muestra un score VExUS: 1, con un diámetro de vena cava inferior de 6,3 mm (Figura 7 A, B, C, Figuras 8 A, B, C).
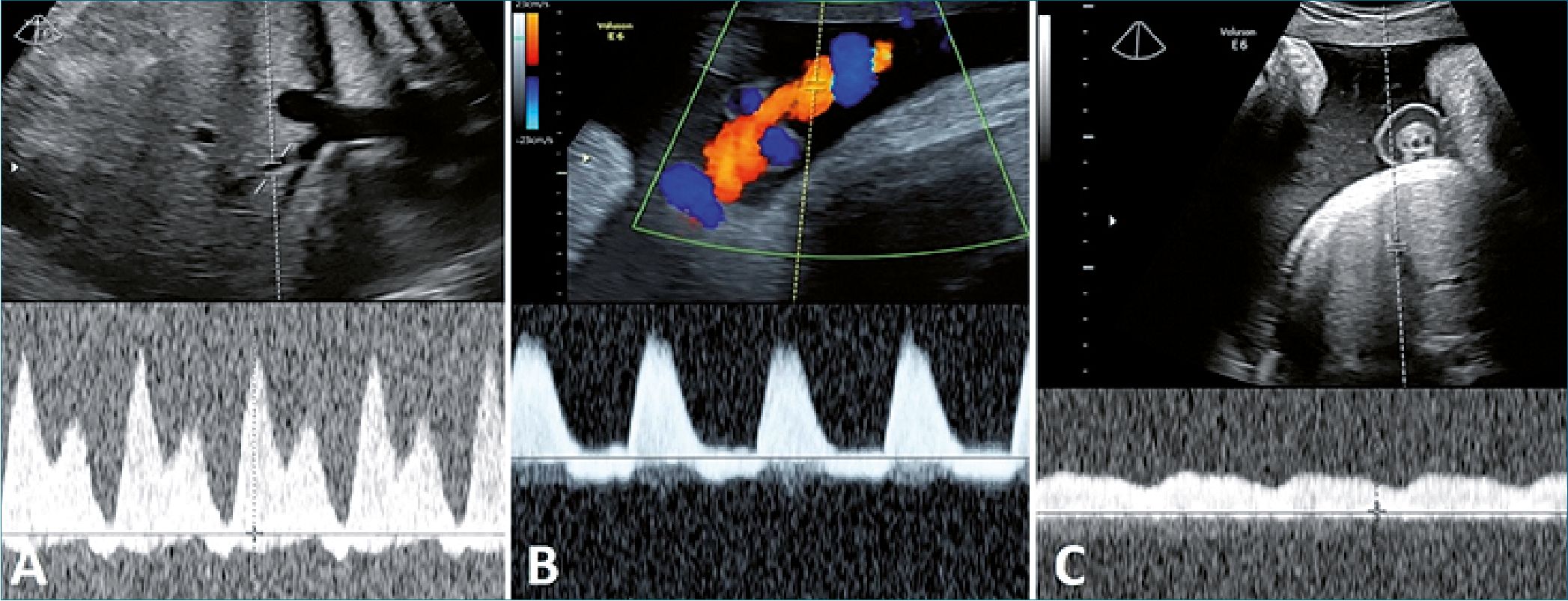
Figura 5. A: Doppler ductus venoso. Onda “A” reversa; B: Doppler de arteria umbilical com inversión a fin de diástole; C: Doppler de vena umbilical pulsátil.
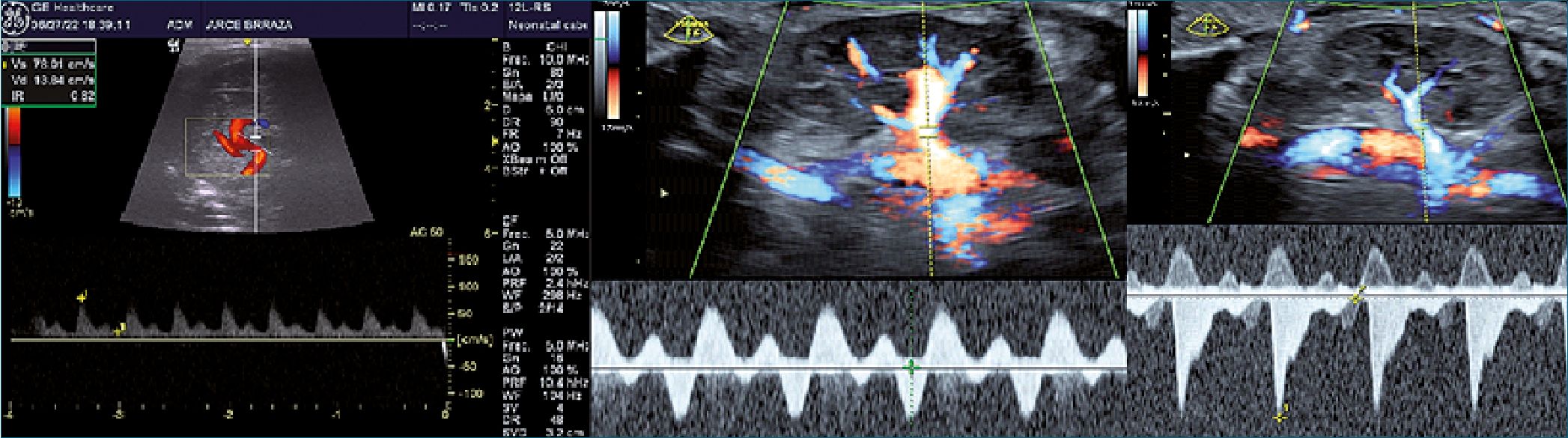
Figura 6. A. Arteria cerebral media; B. Vena renal. Flujo tetrafásico idem VSH; C. Arteria renal. IR: 0,97.
-
Discusión
La insuficiencia cardíaca fetal puede ser multifactorial (cardiopatías congénitas, arritmias severas, miocardiopatías, anemia, hernia diafragmática, infecciones maternas, fármacos, etc). Para comprender los mecanismos de disfunción miocárdica fetal, es necesario recordar las marcadas diferencias entre el sistema cardiovascular fetal respecto al postnatal, las mismas son: 1) estructurales: los precursores miocitarios del feto se replican e incrementan en número (hiperplasia) y muy poco en tamaño (hipertrofia), disminución de la organización miofibrilar, escasa presencia del sistema tubular T y del retículo sarcoplásmico/ mitocondrial, y predominio de elementos no contráctiles; 2) biológicas: menor captación de calcio sarcoplásmico y menor densidad de receptores adrenoreceptores y 3) metabólicas: utilización preferente de la glucosa en la vía energética miocárdica[8],[9].
Por tales diferencias, el miocardio fetal es más rígido. Esto se manifiesta en las curvas de flujo transmitral y tricúspide con: predominio de la onda A (Doppler del llenado activo ventricular-contracción atrial), respecto de la onda E (llenado precoz pasivo), menos eficiente en la utilización de los mecanismos de relajación activa y en tensión sistólica respecto del miocardio adulto a una longitud miofibrilar inicial similar[4],[5],[9]. La reducción en la complacencia del ventrículo derecho es más acentuada que la del ventrículo izquierdo como resultado de la dominancia intrauterina[9].
La miocardiopatía hipertrófica secundaria a diabetes tipo 1, tiene elementos propios que pueden agravar la disfunción contráctil, presentan engrosamiento del miocardio y cavidades pequeñas y se manifiestan, inicialmente, como disfunción diastólica que puede evolucionar de manera progresiva a una disfunción sistólica[8].
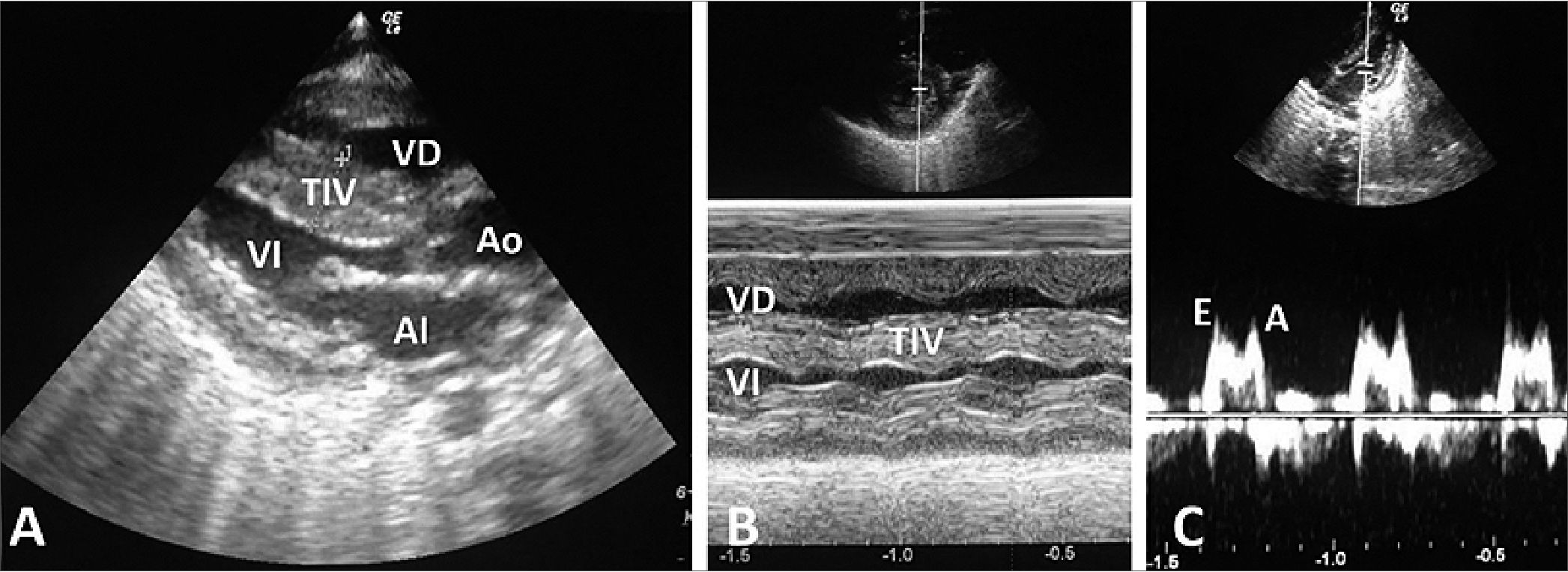
Figura7. Ecocardiograma posnatal 1 día de vida. A y B. Hipertrofia ventricular; 2 D. B: Modo M. Hipertrofia TIV; C. Disfunción diastólica.
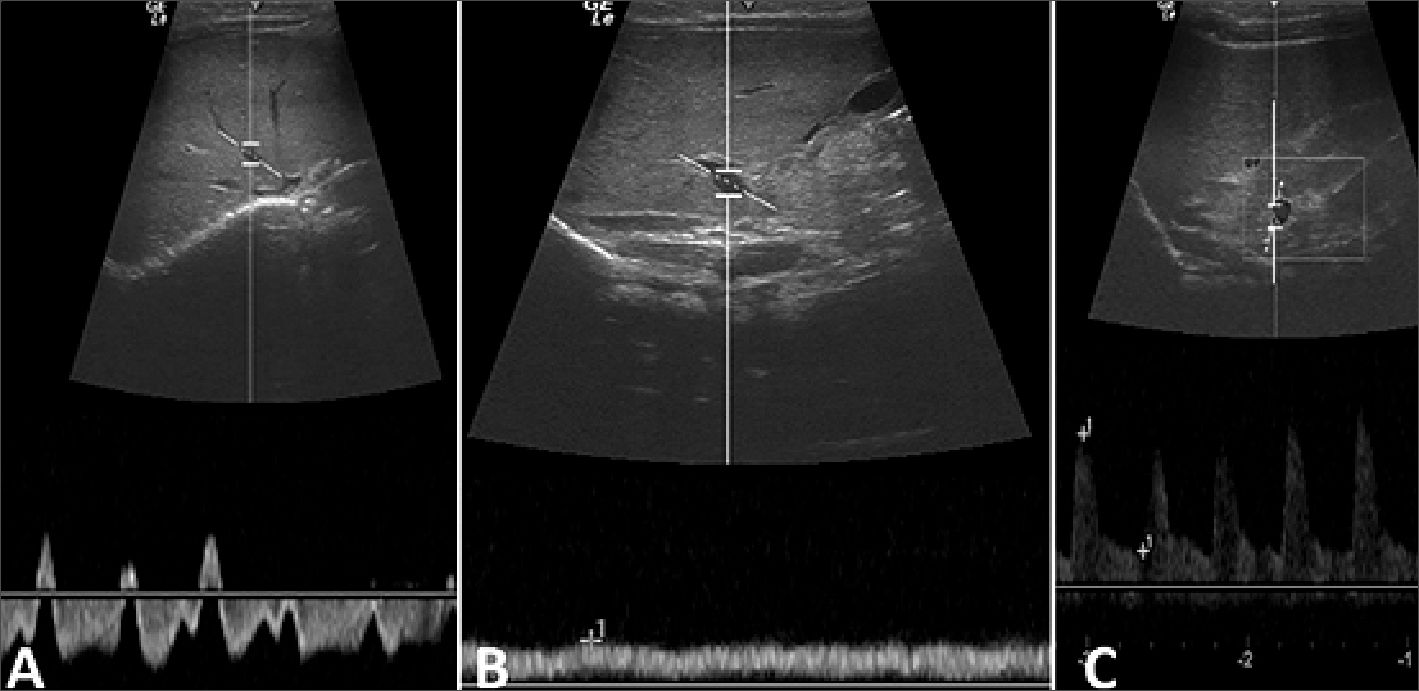
Figura 8. Ecografía de vasos abdominales a la semana de vida. A. Vena suprahepática bifásica; B. Vena porta monofásica; C. Vena renal/ Arteria renal. IR: 0,77.
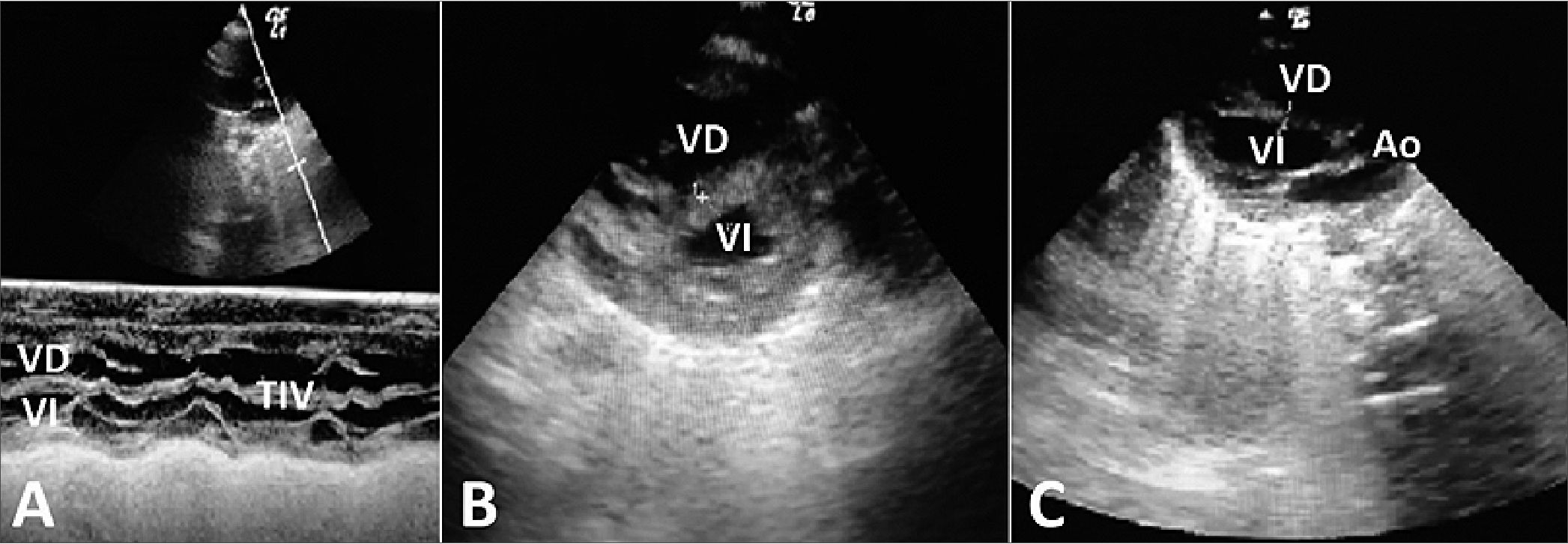
Figura 9. A. Ecocardiograma al mes de vida, modo “M”; B. Eje corto paraesternal; C. Eje largo paraesternal.
Durante la gestación el nivel elevado de glucemia materna causa hiperglucemia fetal a través de la placenta y afecta al miocardio por diferentes vías generando hipertrofia y a veces obstrucción al tracto de salida ventricular[8],[9].
La hipertrofia ventricular resulta de un cambio anabólico provocado por la hiperinsulinemia fetal gatillada por la hiper- glucemia materna en el primer trimestre del embarazo[8].
El efecto deletéreo sobre el gasto cardíaco en mayor en la etapa prenatal que en la posnatal, ya que a la inmadurez miocárdica se le suma menor tolerancia a las condiciones de car- gas[(4],[5],[9].
El mayor determinante del gasto cardíaco, es la poscarga, de manera que cualquier incremento del esfuerzo sistólico ventricular (aumento de la resistencia placentaria, oclusión prematura del ductus arterioso, hipoxia intraútero) puede limitar la capacidad funcional global del corazón[4],[5],[8],[9].
Huhta[5] sugiere que, desde la perspectiva hemodinámica, un aumento de la presión telediastólica ventricular y de la presión atrial/venosa sistémica, acaba de inducir una serie de fenómenos bio-patológicos “en cascada” que provocan congestión retrógrada y alteración de la presión de perfusión de los órganos abdominales. Siendo la aurícula derecha el “centro hemodinámico medular” de la circulación fetal, no debe extrañar que, precozmente, se encuentre dilatada en el examen ecocardiográfico.
Huhta demuestra el incremento de pulsatilidad en vasos umbilicales y ductus venoso a medida que se agrava la insuficiencia cardíaca fetal[4],[5].
Rizzo G y cols[11], demuestran la alteración de las ondas de flujo de la vena cava inferior y del índice de pulsatilidad de la arteria umbilical en fetos con resistencia placentaria elevada, siendo más importante en fetos con retardo de crecimiento intrauterino donde ese cambio es progresivo a medida que avanza el embarazo.
En ecografía crítica, el tamaño y colapsabilidad de la vena cava inferior, es considerada como subrogante de la presión de aurícula derecha y la alteración de su flujo es mucho más precoz que la aparición de signos clínicos de sobrecarga. Siempre hay que tener en cuenta los factores confundidores en la medición de la vena cava inferior, como la variación interindividual, etáreas y las influencias de los cambios de presión intratorácica e intraabdominal. En nuestra experiencia, la medición se realiza en antes de la emergencia de las venas suprahepáticas, que no presente colapso y evaluamos el perfil de flujo de los vasos abdominales con Doppler pulsado para categorizar el grado de congestión y (1).
En nuestro paciente encontramos una coincidencia en la severidad de la congestión demostrada por el score VExUS (puntaje 3) y el score de insuficiencia cardíaca fetal publicado por Huhta (puntaje 2)[4],[5].
La evolución clínica de la miocardiopatía fue favorable, al mes de vida normalizó el grosor del septum interventricular (3,9 mm), (Figura 9 A, B, C) en acuerdo a lo que publica Levy y col[8] se habla de un tiempo de resolución entre 2 semanas a 4 meses. En lo que refiere a los patrones de flujo Doppler venoso abdominal, la normalización ocurrió a la semana de vida, en cambio los índices de resistencia arteriales persistieron elevados durante 2 semanas lo que podría indicar una disfunción endotelial.
-
Conclusiones
1- El score VExUS nos permite evaluar en forma precoz la distensibilidad del ventrículo derecho y la sobrecarga hídrica en el territorio venoso sistémico.
2- También nos permite evaluar las consecuencias hemodinámicas de cualquier tipo de shock (cardiogénico o séptico).
3- Permite seguir la respuesta al tratamiento indicado: restricción hídrica, diuréticos o técnicas de reemplazo.
4- Existe una coincidencia en la gravedad de la congestión entre el score VExUS y el score Huhta de insuficiencia cardíaca fetal.
-
Cuestiones no resueltas
1- Deberían realizarse más estudios para evaluar la congestión venosa fetal en pacientes con riesgo de presentar insuficiencia cardíaca o hipertensión pulmonar intraútero. (cardiopa- tías congéntias, malformaciones pulmonares o torácicas, hernia diafragmática).
2- El patrón descongestivo no es lineal (circulación venosa distal a proximal), puede variar de acuerdo al contexto clínico y la influencia de las presiones torácicas y abdominales.
3- Los estudios deber ser con equipos que tengan software para evaluar función cardíaca sistólica y diastólcia con Doppler tisular y eco Strain.
Ninguno de los autores presenta conflicto de intereses.
Referencias
1. Koratala A, Kazory A. Point of Care Ultrasonography for Objective Assessment of Heart Failure: Integration of Cardiac, Vascular, and Extravascular Determinants of Volume Status. Cardiorenal Med. 2021;11(1):5–17. https://doi.org/10.1159/000510732 PMID:33477143
2. Rola P, Miralles-Aguiar F, Argaiz E, Beaubien-Souligny W, Haycock K, Karimov T, et al. Clinical applications of the venous excess ultrasound (VExUS) score: conceptual review and case series. Ultrasound J. 2021 Jun;13(1):32. https://doi.org/10.1186/s13089-021-00232-8 PMID:34146184
3. Beaubien-Souligny W, Rola P, Haycock K, Bouchard J, Lamarche Y, Spiegel R, et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J. 2020 Apr;12(1):16. https://doi.org/10.1186/s13089-020-00163-w PMID:32270297
4. Huhta JC. Perinatal cardiology: current and future technologies for the diagnosis of fetal congestive heart failure. ACC Curr J Rev. 1996 Mar/Apr;5(2):43–5. https://doi.org/10.1016/1062-1458(96)82266-5.
5. Srisipundidt K, Lewan S, Tongsong T. Prenatal Diagnosis of Fetal Heart Failure Diagnostics 2023;13. 779. https://doi org/10.3390/diagnostics 13040779.
6. Banille E, Haycock K, Iriarte M, et al. Utilidad de VExUS en un paciente pediátrico con Anomalía de Ebstein. Revista Chilena de Anestesiología. 2022;51(2):221–4.
7. Banille E, Contreras A. Ledesma R y cols. Ecografía Doppler de Vasos Abdominales. Nuevo Paradigma de Monitoreo Hemodinámico. Rev Chil Anest. 2021;50(6):881–4. https://doi.org/10.25237/revchilanestv5007101025.
8. Levy PT, Tissot C, Horsberg Eriksen B, Nestaas E, Rogerson S, McNamara PJ, et al.; European Special Interest Group ‘Neonatologist Performed Echocardiography’ (NPE). Application of Neonatologist Performed Echocardiography in the Assessment and Management of Neonatal Heart Failure unrelated to Congenital Heart Disease. Pediatr Res. 2018 Jul;84(S1 Suppl 1):78–88. https://doi.org/10.1038/s41390-018-0075-z PMID:30072802
9. Garcia Guevara C, Cazzaniga ME, Perezs Pedregoza J. Capítulo 1: El diagnóstico prenatal de las cardiopatías congénitas. En: Cardiointnesivismo PediátricoII: “Una Mirada Ampliada”. 1a ed. Córdoba: El autor,2015.
10. Rizzo G, Arduini D, Romanini C. Inferior vena cava flow velocity waveforms in appropriate- and small-for-gestational-age fetuses. Am J Obstet Gynecol. 1992 Apr;166(4):1271–80. https://doi.org/10.1016/S0002-9378(11)90621-8 PMID:1566784
11. Riggs TW, Rodriguez R, Snider AR, Batton D, Pollock J, Sharp EJ. Doppler echocardiographic evaluation of right and left ventricular diastolic function in normal neonates. J Am Coll Cardiol. 1989 Mar;13(3):700–5. https://doi.org/10.1016/0735-1097(89)90614-1 PMID:2918176

 ORCID
ORCID