Liliana Serna-Santos MD.1,*, Lizeth Castro-Montañez MD.2, Juan Manuel Velasco MD.2, Mario Mendoza-Obirne MD.2
Recibido: 26-07-2023
Aceptado: 02-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 7 pp. 639-645|https://doi.org/10.25237/revchilanestv52n7-02
PDF|ePub|RIS
Effectiveness of dexmedetomidine compared to placebo in the management of postoperative pain: systematic literature review and meta-analysis
Abstract
Introduction: Postoperative pain increases the risk of postoperative complications. Dexmedetomidine has shown positive effects on the reduction of pain. Objective: To determine the efficacy of dexmedetomidine for the management of POP pain and its impact in reducing the use of opioids compared to placebo. Methodology: Electronic searches were conducted through the Cochrane Central Register of Controlled Trials (CENTRAL), MEDLINE, (PubMed platform), and LILACS. Results: The estimated pooled mean difference for postoperative pain was -0.81, with respect to postoperative opioid use in 24 hours, a mean difference of -0.27 was obtained. Conclusions: It was not possible to conclude that dexmedetomidine is superior to placebo, there was no difference in the VAS pain scale in the postoperative period, it was not possible to demonstrate a difference in the consumption of postoperative opioids.
Resumen
Introducción: El dolor posoperatorio aumenta el riesgo de complicaciones posquirúrgicas. La dexmedetomidina ha mostrado efectos positivos sobre la disminución del dolor. Objetivo: Determinar la eficacia de la dexmedetomidina para el manejo de dolor POP y su impacto para disminuir el uso de opioides comparada con placebo. Metodología: Se realizaron búsquedas electrónicas a través del registro Cochrane Central de Ensayos Controlados (CENTRAL), MEDLINE, (plataforma PubMed), y LILACS. Resultados: La diferencia de medias combinada estimada para dolor posoperatorio fue de -0,81, con respecto al consumo de opioide posoperatorio en 24 horas se obtuvo una diferencia de medias de -0,27. Conclusiones: No fue posible concluir que la dexmedetomidina sea superior al placebo, no hubo diferencia en la escala EVA de dolor en el posoperatorio, no fue posible demostrar una diferencia en el consumo de opioides postoperatorios.
-
Introducción
El dolor es una experiencia sensorial y emocional desagradable, asociada al daño tisular real o potencial[1]. La respuesta adaptativa del cuerpo frente al dolor involucra innumerables cambios fisiológicos, sin embargo, si esta respuesta
adaptativa persiste, puede llegar a amenazar la homeostasis, produciendo efectos nocivos y potencialmente mortales[2]. Según la ASA, (American Society of Anestesiologists) el dolor posoperatorio es el que está presente en el paciente debido a la enfermedad, al procedimiento quirúrgico y a sus complicaciones o a una combinación de ambos, y se caracteriza fundamentalmente por ser un dolor agudo, limitado en el tiempo, predecible y evitable. Su mal control afecta negativamente a la calidad de vida, a la recuperación funcional y aumenta el riesgo de complicaciones posquirúrgicas, se asocia a un aumento de la morbilidad y de los costos en salud; aumentando el riesgo de desarrollar dolor crónico persistente[3],[4].
Más del 80% de los pacientes que se someten a procedimientos quirúrgicos experimentan dolor posoperatorio agudo y aproximadamente el 75% de aquellos con dolor posoperatorio informan que la gravedad es moderada, grave o extrema, la evidencia sugiere que menos de la mitad de los pacientes que se someten a una cirugía reportan un alivio adecuado del dolor posoperatorio. El dolor crónico secundario es un problema significativo ya que 10% a 50% de los pacientes operados pueden presentar dolor crónico que interfiere con las actividades y la calidad de vida del paciente, el dolor agudo severo es un factor de riesgo para el desarrollo del dolor crónico y se puede prevenir[5],[6].
El dolor posoperatorio puede provocar complicaciones y una rehabilitación prolongada, también se producen efectos negativos a largo plazo como el deterioro de la función y el metabolismo con atrofia muscular subsecuente, ocasionando una prolongación al retorno a la funcionalidad[4],[7]. Se estima que entre 30% y 70% de los pacientes sometidos a un procedimiento quirúrgico experimentan en algún momento dolor de moderado a severo, situación que se relaciona con el aumento de la morbilidad, costos y disminución del bienestar; el manejo del dolor posoperatorio sigue siendo un problema importante y un desafío para muchos cirujanos y anestesiólogos, especialmente en países de bajos y medianos ingresos. La incidencia de dolor moderado y severo varía en todo el mundo y es de alrededor del 14% al 55% en los países occidentales, siendo el más alto el día de la cirugía. En los países de ingresos bajos y medianos, los datos son escasos, pero la prevalencia aumenta hasta el 95%, lo que se demostró en una cohorte de Kenia y Etiopía. Incluso en los entornos más sofisticados con la disponibilidad de diferentes tipos de analgésicos, técnicas de anestesia regional y la introducción de los servicios de dolor agudo todavía se presenta un inadecuado alivio de POPSI[8],[9].
Teniendo en cuenta lo anterior, debe contemplarse el dolor como un efecto directo de la intervención quirúrgica, por lo que prevenir su aparición con la implementación temprana de analgesia debe ser una prioridad. La dexmedetomidina un alfa dos agonista selectivo, ha mostrado efectos positivos sobre la intensidad del dolor posoperatorio, el consumo de opioides y otros parámetros de recuperación[6],[11]; la siguiente revisión sistemática tiene como finalidad determinar la eficacia de la dexmedetomidina para el manejo de dolor POP y su impacto para disminuir el uso de opioides comparada con placebo.
-
Métodos
Esta revisión sistemática siguió las pautas de Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) y las recomendaciones del manual de Cochrane[12].
-
Criterios de selección
Para la realización de esta revisión sistemática se empelaron búsquedas electrónicas a través del registro Cochrane Central de Ensayos Controlados (CENTRAL), MEDLINE, (plataforma PubMed), y LILACS; además se hizo la búsqueda en otros recursos; se buscó literatura gris en el Sistema de Información sobre Literatura Gris en Europa OpenGrey (www.opengrey.eu), actas y repositorios de congresos; la búsqueda fue limitada por fecha para los últimos 10 años, sin restricción de idioma, además solo se tuvieron en cuenta ensayos clínicos y ensayos clínicos aleato- rizados
-
Estrategia de búsqueda
Como estrategia de búsqueda se utilizó (((Dexmedetomidine) OR (“Dexmedetomidine”[Mesh])) AND ((“Placebos”[Mesh]) OR (placebos))) AND ((((“Pain Management”[Mesh]) OR (Pain Management)) OR (Pain, Postoperative)) OR (“Pain, Postoperative”[Mesh])), en el título del artículo, resumen y palabras clave (descriptores), con campos de búsqueda equivalentes en cada base de datos consultada.
-
Criterios de inclusión y exclusión
Fueron incluidas las siguientes tipologías documentales: originales, fueron excluidas las tipologías: revisiones, cartas al editor, comentarios, opiniones, perspectivas, guías y normativas, páginas web de opinión; se tuvieron en cuenta las siguientes selecciones bibliográficas por ensayos clínicos y ensayos clínicos aleatorizados; se incluyeron solo los estudios publicados en revistas médicas. La adecuación de los artículos seleccionados al objeto del estudio y a los criterios de inclusión y con el fin de aumentar la fiabilidad y la seguridad del proceso fue realizada por 2 autores (L. Serna), (L. Castro) de forma independiente (cuando al revisar el título, el resumen, y las palabras clave del artículo existían dudas para su inclusión se revisó el texto completo del documento y si aun así existía discrepancia entre los 2 autores se incorporaba un tercero para arbitrar la decisión de su inclusión o exclusión.
La localización, la selección de artículos, tanto los incluidos como los eliminados, y la causa de su eliminación en la fase cribado y de elección se realizó en concordancia con la herramienta PRISMA (Figura 1).
-
Extracción de datos
Los datos fueron extraídos de los estudios incluidos por las dos revisoras por medio de la herramienta Excel a partir de los títulos, los resúmenes, las palabras clave o del artículo completo (en algún caso del material suplementario del documento), además se tuvo en cuenta los componentes de la pregunta de investigación interés; se tomaron los datos para la características del estudio (título, primer autor y año de publicación, idioma, país, tipo de análisis), diseño del estudio (diseño, aleatorización, ocultamiento, enmascaramiento), población (número de participantes asignados, criterios de inclusión y exclusión, tiempo de seguimiento, tamaño de muestra, intervención (dexmedetomidina), comparador (placebo), desenlaces (efectividad, control de dolor, disminución de uso de opioides) (Tabla 1 ).
-
Riesgo de sesgos de los estudios
El riesgo de sesgo de los estudios incluidos se evaluó a través de la herramienta Rob2 para ensayos clínicos, que se encuentra estructurada para la evaluación de 5 dominios; el riesgo de sesgo en cada uno de los cinco dominios será clasificado en “bajo riesgo”, “algunas preocupaciones” y “alto riesgo”, siguiendo el algoritmo de la herramienta, el cual generará un riesgo de sesgo global. La evaluación del riesgo de sesgo se realizó por las dos revisoras de forma ciega e independiente en caso de discordancia se llegará a un consenso con el concepto de un tercer evaluador.
-
Desenlaces
El resultado principal que se analizó fue la eficacia analgésica de la dexmedetomidina perioperatoria en manejo de dolor durante las 24 h del posoperatorio, y el objetivo secundario fue establecer el efecto economizador de opiáceos de la dexmede- tomidina medido como el uso de opioide POP.
-
Análisis de datos
Utilizando los softwares Stata/IC 16.1 se realizó el análisis estadístico; debido a que los resultados consistían en datos continuos se obtuvo g de Hedges, con su respectivo IC al 95%. El metaanálisis para la evaluación de la eficacia teniendo en cuenta la evaluación de dolor de POSI en 24 h y el efecto economizador del opioide, se llevó a cabo combinando la media de efecto mediante el modelo de efectos aleatorios con el método de estimación de máxima verosimilitud restringida, teniendo en cuenta que los datos se registraron en promedios y desviación estándar. Para el cálculo del I2, en caso de no presentar una heterogeneidad sustancial se procedería a realizar el análisis estadístico con el modelo de efectos comunes, en caso de I2 > 50% se describió los resultados reportados en los estudios seleccionados. El riesgo de sesgo de publicación (RoB) se evaluó mediante un gráfico en embudo (funnel plot) y se probó mediante la prueba de correlación de rangos para la asimetría.
La calidad de la evidencia (QoE) se evaluó utilizando métodos GRADE, que cubren RoB, inconsistencia, direccionalidad, imprecisión y sesgo de publicación. La QoE se evaluó para cada resultado y se describió en las tablas de resumen de hallazgos, que se crearon con GRADEpro. software GDT.
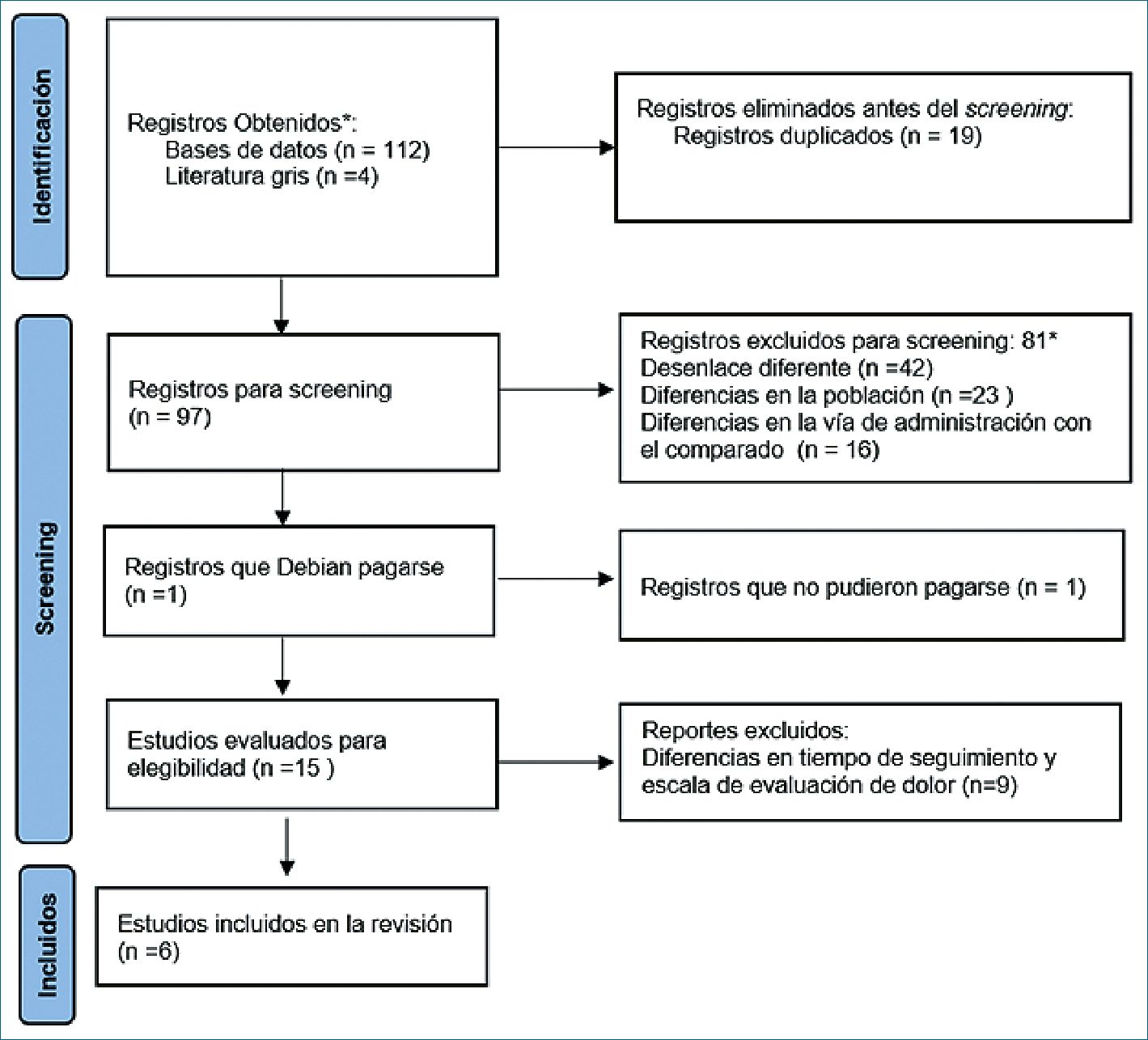
Figura 1. Diagrama PRISMA. * Los registros fueron excluidos por las dos revisoras de manera independiente a través de la herramienta Rayyan.
-
Resultados
Realizamos búsquedas sistemáticas en PubMed, Embase, Lilacs, The Cochrane Library y en el Europa OpenGrey (www. opengrey.eu). Actas y repositorios de congresos, para estudios publicados en los últimos 10 años (Figura 1). De 116 estudios identificados, de los cuales 19 eran duplicados por lo que se revisaron 97 registros; se encontró que 81 eran irrelevantes según sus títulos y resúmenes. De los 15 registros restantes, 9 fueron excluidos por las diferencias en el tiempo de seguimiento y escala de evaluación de dolor previamente definidas e los criterios de inclusión y exclusión. Se analizó un tamaño de muestra total de 510 pacientes resultante de los 6 estudios elegidos.
-
Características de los estudios incluidos
Se incluyeron un total de 6 estudios, todos ensayos clínicos aleatorizados, unicentricos, dos realizados en China, uno en Corea, uno en Irán y uno en Estados Unidos; todos los estudios reclutaron pacientes adultos con restricción de edad (18 a 80 años), los procedimientos realizados bajo anestesia general incluyeron mastectomía radical por cáncer de seno, fusión espinal posterior, hepatectomía abierta, craneotomía, lobectomía y cirugía de columna, a los pacientes se les administro dosis de carga inicial de dexmedetomedina que oscilaron entre 0,2 a 1 pg/kg entre los primeros 15 a 20 minutos de la cirugía y uno solo estudio administro el medicamento 5 minutos antes de dar por terminado procedimiento; el desenlace primario para los estudios fue el consumo de opioide posoperatorio como remifentanilo, fentanilo, morfina, tramadol y meperidina, en todos los estudios se realizó la evaluación de dolor con escala visual análoga (VAS) en las primeras 24 h posterior al procedimiento.
-
Riesgo de sesgos
Se evaluaron de forma independiente el riesgo de sesgo de cada ensayo clínico por desenlace, utilizando la herramienta RoB2; la evaluación de la calidad metodológica de los estudios incluidos, evidencio que uno de los ensayos fue calificado como algunas preocupaciones y el resto de los estudios como bajo riesgo de sesgo.
-
Resultado global
Los 6 estudios presentaron datos continuos algunos con medianas y rangos intercuartílicos (RIQ) y otros con medias y desviación estándar (SD); para tener una medida unificada se realizó la conversión de medianas a medias y del rango intercuartílico a desviación estándar. Se realizó el análisis de efectos con la g de Hedges, la diferencia de medias combinada estimada para dolor posoperatorio fue de -0,81 (IC del 95%: -1,55 a .0,07 n = 465, 5 estudios, I2 = 92,74%) (Figura 2).
Para medir el consumo de opioide posoperatorio en 24 h se estandarizo la medida con mg de morfina; el análisis de efecto se obtuvo a partir de una medida combinada con la g de Hedges, con una diferencia de medias de -0,27 (IC 95%: -0,59 a 0,05 n = 510 , estudios 6 I2: = 67,73%) (Figura 3).
-
Sesgo publicación y evaluación de la evidencia
El sesgo de publicación se evaluó mediante gráficos en embudo. La prueba regresión de Egger; para dolor POP (p = 0,6067) y para uso de opioide POP ( p= 0-9736) revelaron que hay sesgo de publicación, que puede ser explicado por el escaso número de publicaciones que cumplen con los criterios de la búsqueda (Figura 4 y 5). Según GRADE[16], la QoE mostró una certeza de la evidencia muy baja para dolor POP medido con EVA, y baja para consumo de opioide POP, ambos desenlaces con un efecto marcadamente impreciso con intervalo de confianza del 95% anchos, presencia de riesgo grave de sesgo, con un sesgo de publicación sustancial y presencia de una inconsistencia grave de los resultados (Tabla 1 ).
-
Discusión
En esta revisión sistemática y metaanálisis se investigó el efecto de la dexmedetomidina para manejo de dolor y el consumo de opioide posoperatorio en las 24 h comparado con placebo; estuvo basado en 6 ensayos clínicos controlados aleatorizados, que incluyeron un total de 510 pacientes, de diferentes centros hospitalarios en diferentes países. En general, no se encontró evidencia que demostrara una mejor efectividad de la dexmedetomidina comparada con placebo para los dos desenlaces de interés. Hay que tener varias consideraciones al analizar los resultados; para el desenlace de uso de opioide posoperatorio; dado que los estudios primarios reportaron sus datos con resultados continuos algunos basados en medias y desviación estándar, otros los reportaron en medianas y rangos intercuartílicos, por lo cual fue necesario unificar la medida del efecto para todos los estudios con medias y desviación estándar (SD), adicionalmente, el opioide usado fue diferente entre cada uno de los estudios por lo cual fue necesario hacer la conversión a mg de morfina endovenoso para cada uno de ellos; estudios como el de Li-Hong Zhao, 2015 reporta la eficacia de la dexmedetomidina para el control posoperatorio basado en las dosis de fentanilo (mg/paciente) con una media de 0,06 ± 0,02 SD comparado con placebo de 0,08 ± 0,03 SD, asi como Wei-Cheng Tseng 2020, también reporto los datos por medio de medias y SD con un total de fentanilo en mcg en 24 h de placebo vs dexmedetomedina (563,41 ± 94,53) y (501,35 ± 83,54) respectivamente, por otro lado Nasinm 2021, reporta la cantidad de petidina con una media de 1,34 ± 0,48 SD de dexmedetomidina comparado con 2,1± 0,72 SD de placebo; mientras que Xin-qi Cheng 2021, mostro el total de demanda en 24 h de sufentalil en microgramos reportando medias con RIQ asi (1,0 [0-4,0]), El estudio de Bhiken I., 2016, mostro el control de dolor en 24 h basado la cantidad de opioide medido en mg de morfina con medianas y rangos intercuartílicos tanto para placebo y dexmedetomedina de (49 [30-78] vs 61 [34-77]) respectivamente; finalmente, el estudio de Kim 2013 también reporto el total de tramadol usado en el posoperatorio en mg/24 h con una medina (RIQ) de 50 (50-100) para el grupo control comparado con 50 (0-100) para el grupo de dexmedetomedina. Teniendo en cuenta lo anterior se sugiere que los resultados del metaanálisis sean interpretados con cuidado ya que es altamente probable que los resultados sean debido a la heterogeneidad de los estudios, y además la distribución de algunos resultados puede estar sesgado.
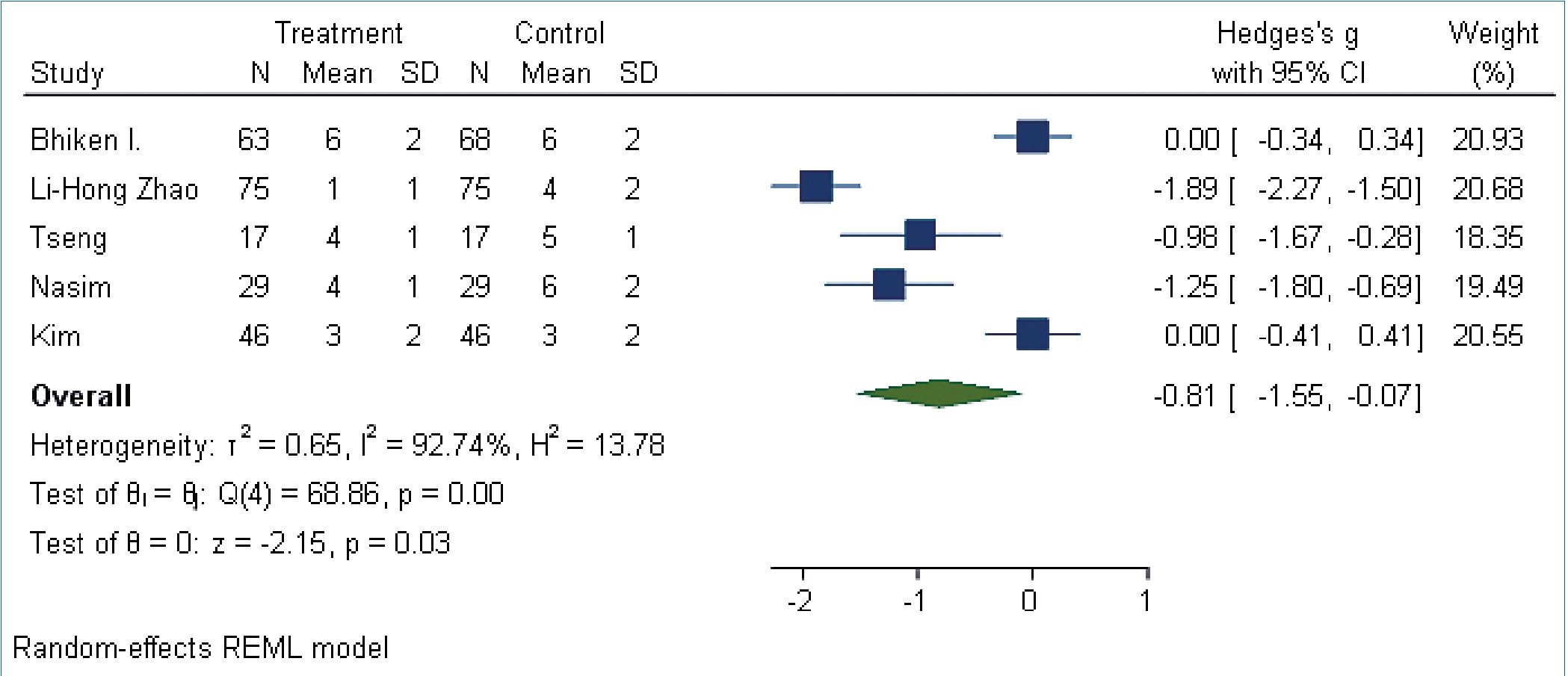
Figura 2. Foresplot evaluación de dolor posoperatorio en 24 h.
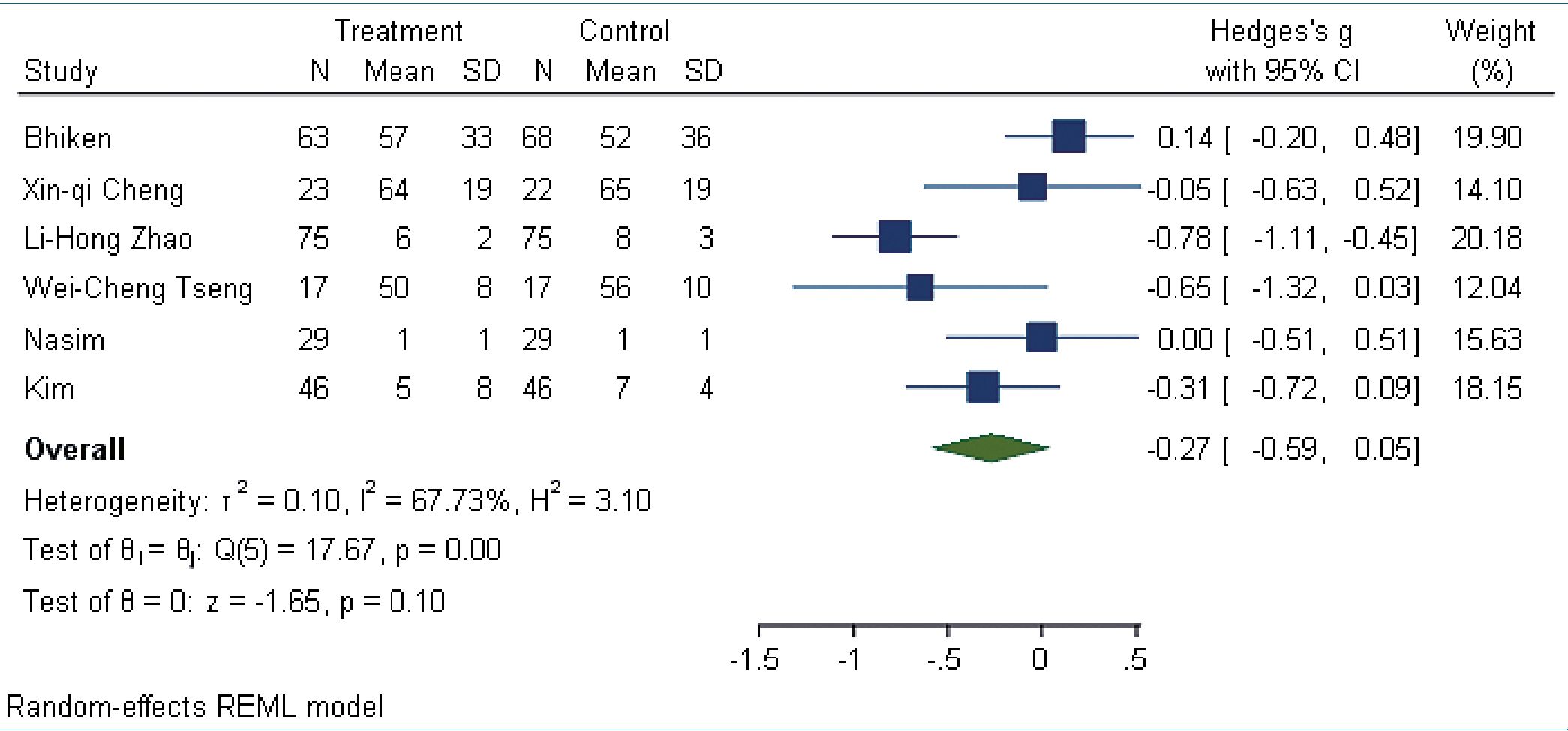
Figura 3. Medida de efecto para uso de opioide posoperatorio en mg de morfina.
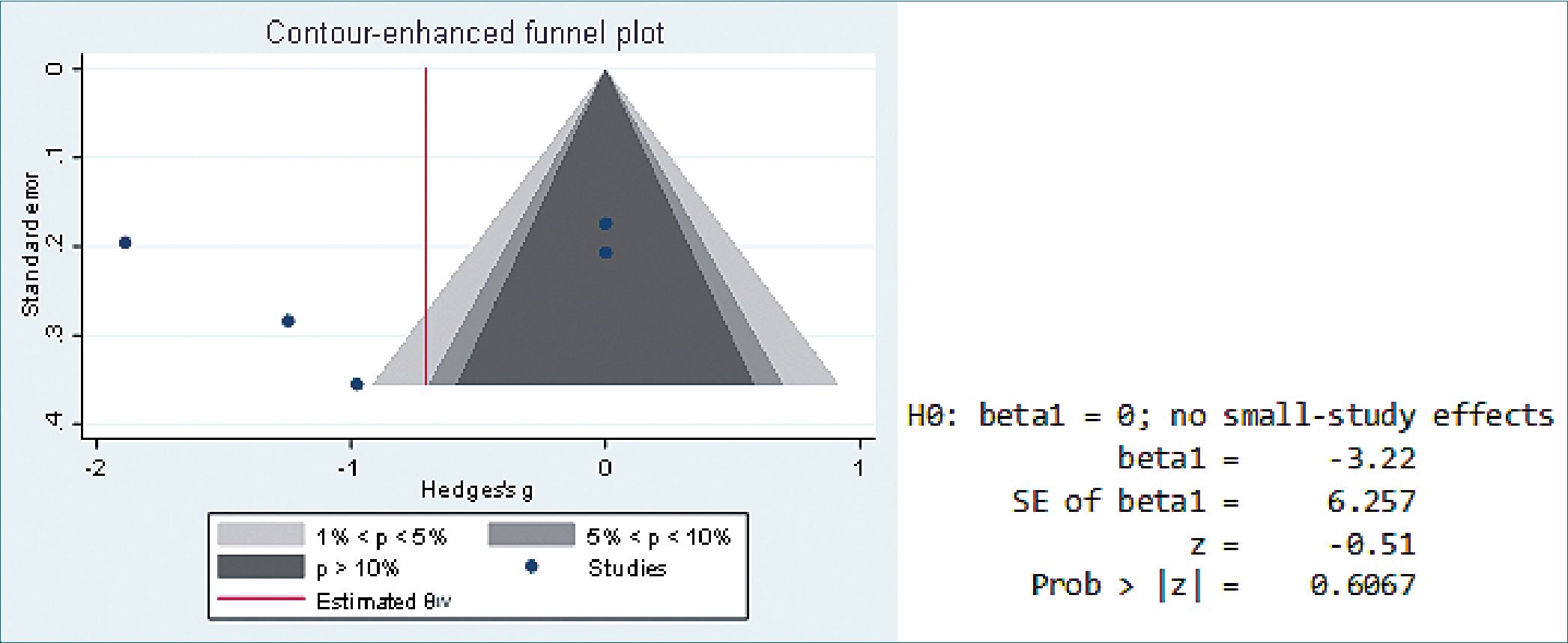
Figura 4. Gráfico de embudo y prueba de Egger en control de dolor POP.
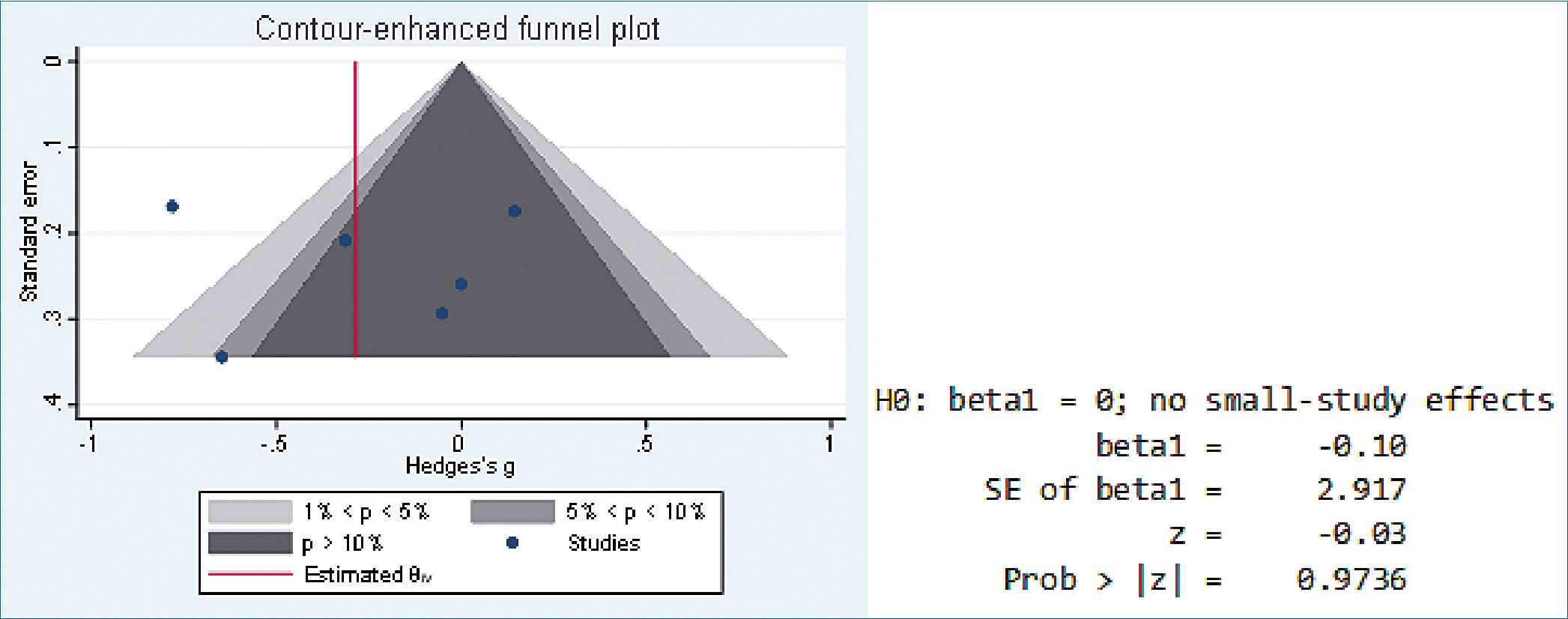
Figura 5. Gráfico de embudo y prueba de Egger en dosis de opioide POP.
-
Conclusiones
No fue posible concluir que la dexmedetomidina sea superior al placebo, no hubo diferencia en la escala EVA de dolor en el posoperatorio, tampoco fue posible demostrar una diferencia en el consumo de opioides posoperatorios medido en mg de morfina a las 24 h.
Los datos de este metaanálisis deben ser interpretados con mesura ya que existe una alta heterogeneidad entre los estudios, explicada por que la medida del efecto pudo no ser la adecuada, al tener datos continuos algunos reportados como medianas y otros como medias, adicionalmente es probable que al enfrentarse a poblaciones en las que la dosis de la dexmedetomedina no fue la misma, e intervenciones quirúrgicas diferentes en las que la inducción anestésica también fue diferente, los resultados pueden estar segados.
Referencias
1. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Vol. 161, Pain. NLM (Medline); 2020. p. 1976–82.
2. Swift Amelia. Understanding the effect of pain and how the human body responds [online]. Nurs Times. 2018;114(3):22–6.
3. Montero A. Dolor postoperatorio: ¿hacia dónde vamos? Vol. 24, Revista de la Sociedad Espanola del Dolor. Ediciones Doyma, S.L.; 2017. p. 57–8.
4. Garimella V, Cellini C. Postoperative pain control. Clin Colon Rectal Surg. 2013 Sep;26(3):191–6. https://doi.org/10.1055/s-0033-1351138 PMID:24436674
5. Fernández Carlos Francisco, Gómez María Patricia. DOLOR AGUDO Y POSTOPERATORIO. ACED. Colombia;
6. Chou R, Gordon DB, de Leon-Casasola OA, Rosenberg JM, Bickler S, Brennan T, et al. Management of postoperative pain: A clinical practice guideline from the American pain society, the American society of regional anesthesia and pain medicine, and the American society of anesthesiologists’ committee on regional anesthesia, executive committee, and administrative council. J Pain. 2016 Feb;17(2):131–57. https://doi.org/10.1016/j.jpain.2015.12.008 PMID:26827847
7. Rekatsina M. Effects of Intravenous Dexmedetomidine Versus Lidocaine on Postoperative Pain, Analgesic Consumption and Functional Recovery After Abdominal Gynecological Surgery: A Randomized Placebo-controlled Double Blind Study [Internet]. Available from: www.painphysicianjournal.com
8. Ndebea AS, van den Heuvel SA, Temu R, Kaino MM, van Boekel RL, Steegers MA. Prevalence and risk factors for acute postoperative pain after elective orthopedic and general surgery at a tertiary referral hospital in Tanzania. J Pain Res. 2020 Nov;13:3005–11. https://doi.org/10.2147/JPR.S258954 PMID:33244259
9. Eshete MT, Baeumler PI, Siebeck M, Tesfaye M, Wonde D, Haileamlak A, et al. The views of patients, healthcare professionals and hospital officials on barriers to and facilitators of quality pain management in Ethiopian hospitals: A qualitative study. PLoS One. 2019 Mar;14(3):e0213644. https://doi.org/10.1371/journal.pone.0213644 PMID:30870467
10. Machado Alba JE, Quintero AM, Fernando M, García M, Andrés C, Carmona C, et al. Evaluación de manejo de dolor posquirúrgico en pacientes adultos de una clínica de tercer nivel de Pereira Colombia. Vol. 25, Investigaciones ANDINA INVESTIGACIONES ANDINA
11. Rekatsina M. Effects of Intravenous Dexmedetomidine Versus Lidocaine on Postoperative Pain, Analgesic Consumption and Functional Recovery After Abdominal Gynecological Surgery: A Randomized Placebo-controlled Double Blind Study [Internet]. Available from: www.painphysicianjournal.com
12. Deeks JJ, Higgins JP, Altman DG, Jpt H. (2019). Cochrane Handbook for Systematic Reviews of Interventions. www.training.cochrane.org/handbook

 ORCID
ORCID