Rodrigo Díaz1,*, Rafael Lima Linares2, Marta Velia Antonini3, Catalina Alvarado4, Carmen Gloria Karlezi5, Marco Antonio Montes de Oca Sandoval6
Recibido: 03-11-2023
Aceptado: 17-11-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 2 pp. 85-90|https://doi.org/10.25237/revchilanestv53n2-03
PDF|ePub|RIS
The general anaesthetist faced with an ecmo-connected patient
Abstract
The need to move the patient connected to ECMO for X rays or to undergo a non-cardiac surgery, is quite common. In this article we provide the management details that may be most useful, as an anesthesiologist, to deal with this situation.
Resumen
La necesidad de llevar el paciente conectado a ECMO a imágenes o quirófano de cirugía no cardíaca es algo frecuente, en este artículo entregamos los detalles de manejo que pueden ser más útiles en el caso de que como anestestesiólogo deba manejar esta situación.
Apartir del año 2009, después de la pandemia AH1N1 y la publicación del estudio CESAR, el número de pacientes adultos conectados a soporte ECMO aumentó, pues se reportó un mejor resultado en casos de falla respiratoria grave al comparar el tratamiento con soporte extracorpóreo vs manejo convencional[1]. La evidencia actual en ECPR (Extracorporeal Cardiopulmonary Resuscitation) es controversial, con datos que lo apoyan y otros que no, lo mismo ocurre con el uso de ECMO en Shock Cardiogénico[2],[3].
Es habitual que los pacientes conectados, requieran studio de imágenes, cirugías o procedimientos en el pabellón de hemodinamia. En un estudio observacional retrospectivo de 563 pacientes en ECMO V-V y V-A, el 47,8% requirió una cirugía durante el soporte (siendo la cirugía general, cirugía vascular y torácica las más frecuentes)[4].
Este artículo tiene como objetivo describir cómo enfrentar el manejo anestésico frente a una emergencia o ausencia del equipo de perfusión y/o anestesia cardiovascular.
ELSO (Extracorporeal Life Support Organization) clasifica el soporte extracorpóreo según lo descrito en Figura 1.
Podemos dividir la indicación de ECMO; como respiratoria o circulatoria, o una mezcla de ambos. El paro cardíaco y el ECMO asociado a su uso, se denomina ECPR.
-
ECMO veno venoso (ECMO V-V)
El ECMO VV tiene como objetivo transferir oxígeno y eliminar CO2 para permitir una ventilación mecánica (VM) menos agresiva. Clásicamente esta conexión se hace en el lado derecho de la circulación, extrayendo sangre de la unión aurícula derecha (AD)/vena cava (VC) inferior y devolviendo sangre oxigenada en la entrada de la AD desde la VC superior.
En este caso no hay soporte hemodinámico directo, aunque muchas veces se logra mejorar las condiciones de poscarga del ventrículo derecho (VD) gracias a un mejor intercambio de gases y consecuente disminución de las presiones de arteria pulmonar y decremento de las presiones intratorácicas[6].
En esta configuración, el flujo de sangre de ECMO es el mayor determinante de la oxigenación del paciente, este flujo NO altera las presiones de llenado de la AD y el flujo de gases frescos determina el barrido de CO2 en la membrana y por lo tanto la PaCO2[7].
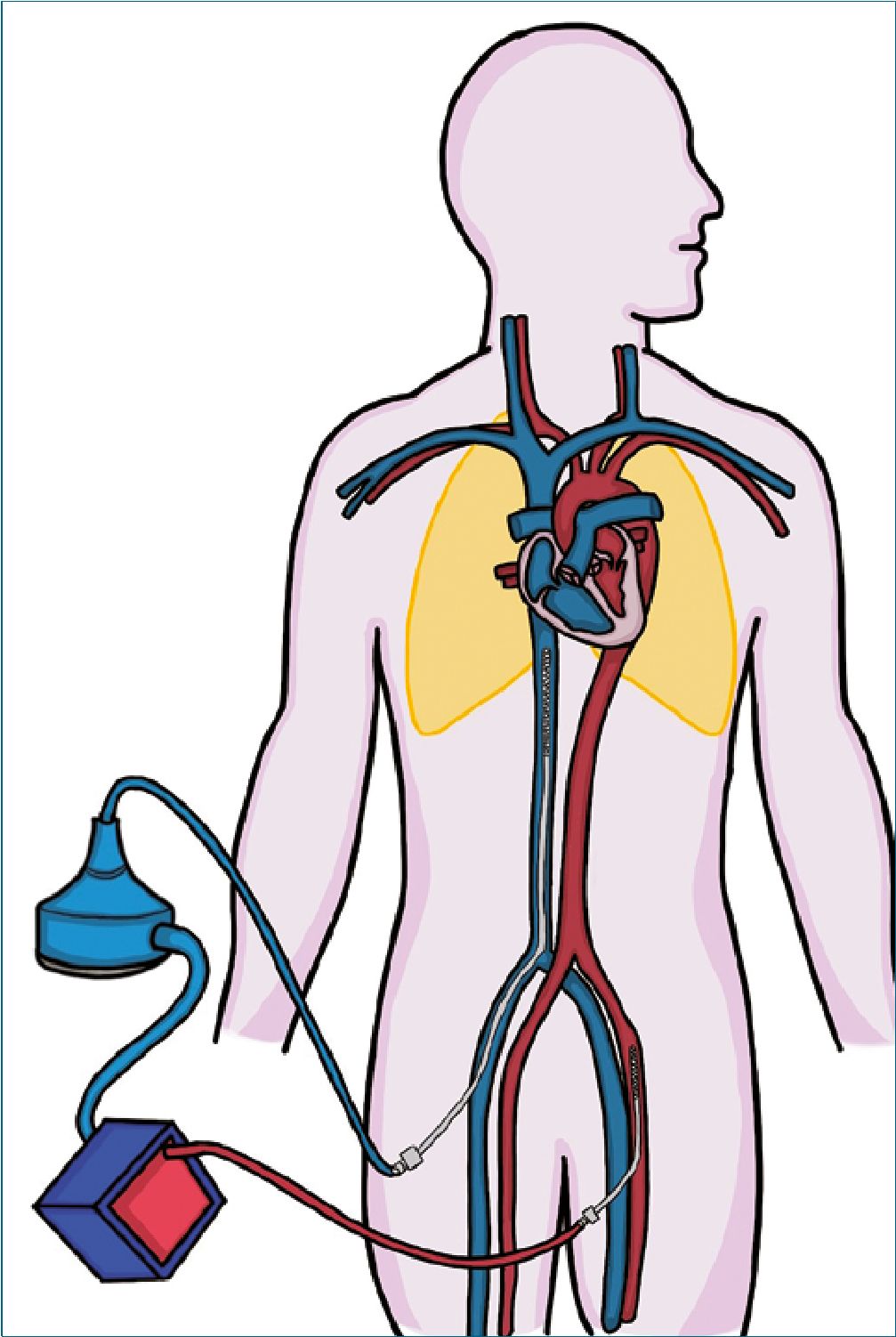
Figura 2. Configuración ECMO Veno-Venoso. Extracción de sangre desoxigenada de la vena cava inferior y retorno de sangre oxigenada que pasa por una membrana de oxigenación a la aurícula derecha.
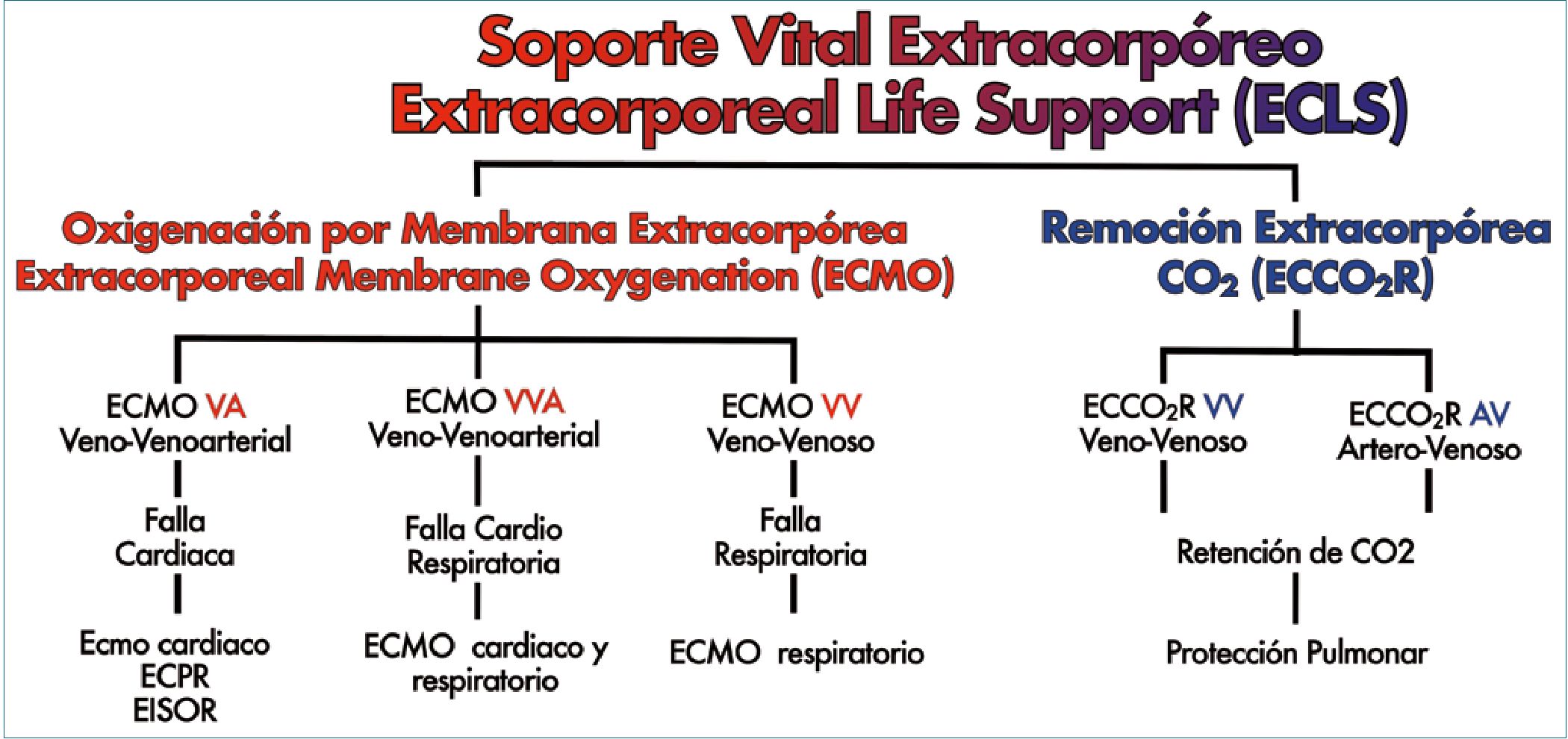
Figura 1. Clasificación modos de ECMO. Diferentes modos de uso de Extracorporeal Membrane Oxigenation (ECMO)[5].
-
Los puntos importantes si está enfrentado a este tipo de paciente en el quirófano son:
1. Si es posible, se debe asistir al procedimiento con el perfusionista o enfermero ecmólogo. Su ayuda será invaluable.
2. Tener especial cuidado con la entrada de aire al circuito. Puntos frecuentes de entrada son las llaves abiertas del catéter venoso central (CVC)[8].
3. Si se observa una baja intermitente del flujo, con “baile de succión” en la línea venosa del circuito, es un fuerte indicativo de hipovolemia, muy común durante los primeros días de soporte o en sangrado durante el procedimiento. La recomendación es bajar un poco las revoluciones y/o admi-
nistrar volumen con cristaloides.
4. Se deben considerar las limitaciones de espacio en el traslado, como los ascensores por ejemplo, se debe verificar si cabe la unidad de ECMO, de no ser así, el perfusionista o enfermero experto es indispensable, pues se debe desarmar la torre y poner la máquina sobre la cama del paciente.
5. Utilizar lo que esté más acostumbrado en la anestesia, excluyendo técnicas regionales. Aún en pacientes sin heparina, habrá discrasia sanguínea multifactorial como Von Willebrand adquirido, déficit factor XIII, hiperfibrinolisis, trombocitopenia, CID del circuito, etc. Siempre considerar el protocolo de su institución de manejo de anticoagulación en ECMO[9].
6. El uso de ácido tranexámico es casi rutina, se recomienda dosis 15 mg/kg repetida en 3 dosis en 24 h[10].
7. NO instalar nada por nariz, las epistaxis son muy frecuentes y difíciles de controlar.
8. La suspensión de la heparina es posible, es recomendable hacerlo estando de acuerdo con el resto del equipo[9].
9. Movilizar al paciente y las cánulas en bloque, uno de los riesgos en la movilización del paciente es la decanulación.
10. Precaución al instalar catéteres, y evitar el retiro de invasivos por riesgo de sangrado.
11. Evitar manipular el circuito y las llaves de paso que se encuentran en él, por el riesgo de embolia aérea.
12. Respecto a la ventilación mecánica, mantener los mismos parámetros de reposo que tenía el paciente en la Unidad de Cuidados Intensivos, no reclutar, pues esto puede causar barotrauma severo o inestabilidad hemodinámica[11]. Mantener la FiO2 del ventilador en el mínimo posible para mantener saturación sistémica 88%-92%. Dejar la FiO2 de la membrana del ECMO en lo que esté predeterminado, habitualmente es 100%.
13. Monitoreo cardiovascular de rutina, la presión venosa central es un parámetro útil en su tendencia y si sube su valor se puede sospechar taponamiento, neumotórax a tensión o falla del ventrículo derecho. Los cambios de flujo del ECMO V-V no afectan este parámetro. Siempre monitorizar también: línea arterial, capnografía, pulsioxímetro y temperatura esofágica[12].
14. Se pueden utilizar halogenados, teniendo en cuenta que un volumen corriente bajo podría afectar la transferencia de halogenados, pero se ha visto que incluso con menos de 350 ml se logra efecto hipnótico[13]. Es recomendable medir profundidad anestésica. Tener en cuenta también que la membrana de polimetilpenteno no difunde los halogenados, a diferencia de la membrana de polipropileno (usualmente utilizada en circulación extracorpórea)[14].
15. Si el paciente presenta paro cardiorrespiratorio, se deben activar maniobras básicas y avanzadas de resucitación, con compresiones torácicas sin suspender el soporte[8].
-
ECMO veno arterial (V-A)
ECMO V-A se utiliza más comúnmente en paros intrahospitalarios y shock cardiogénico de distintas causas. El ECMO permite recomponer el flujo y así la perfusión hacia los tejidos periféricos y órganos blanco. El problema con este soporte en falla izquierda es la descompresión del ventrículo izquierdo, que, por encontrarse con contractilidad disminuida, es sensible a aumentos de la poscarga, ya sea por resistencia vascular sistémica aumentada (por uso de vasoconstrictores, por ejemplo) o por aumento del flujo sistémico, así es que se ha descrito el ECMO como un “flujpresor”. La monitorización de las presiones de llenado con catéter de arteria pulmonar (objetivo de PDAP < 18 mmHg) y complementariamente de ultrasonido cardíaco orientan a la presencia de aumento de presiones de llenado del VI[15]. Esta condición es menos probable si el VI mantiene eyección (presión de pulso > 15 mmHg). El uso de inodilatadores es frecuente en estos pacientes, con la intención de mantener la eyección sistólica. El concepto de reposo de las cavidades cardíacas es posible solo si se logran mantener bajas las presiones de fin de diástole.
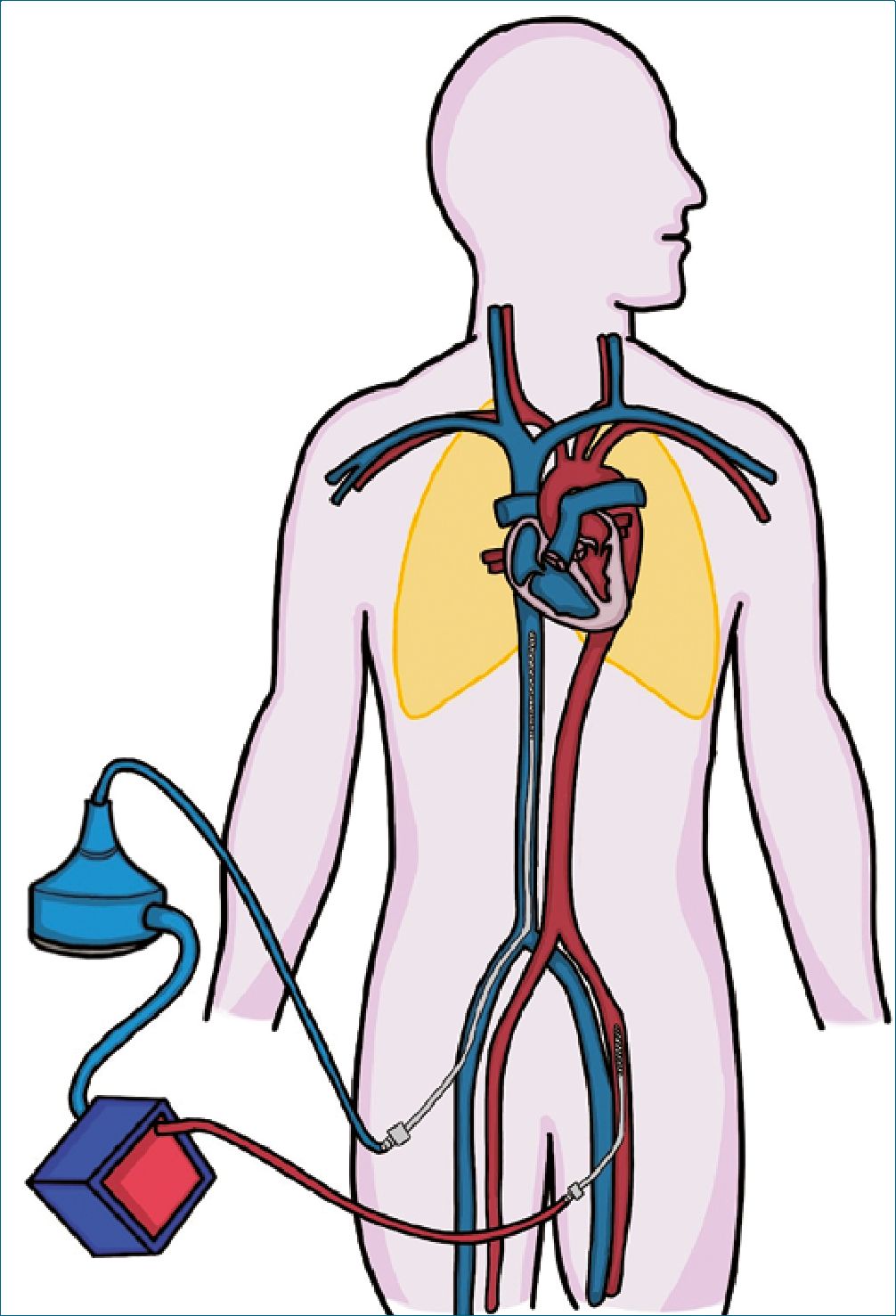
Figura 3. Configuración ECMO Veno-Arterial. Extracción de sangre desoxigenada de la vena cava inferior y retorno de sangre oxigenada que pasa por una membrana de oxigenación a la circulación izquierda.
Los puntos importantes si está enfrentado a este tipo de paciente en el quirófano son:
Se repiten puntos del 1 al 11:
16. Respecto a la VM, continuar con VM protectora convencional (6 ml /kg, FR de 12-14 x minuto, FiO2 60% o más durante el procedimiento).
17. Monitoreo cardiovascular: Catéter de Arteria Pulmonar en al menos las primeras 72 h. El monitoreo general mínimo será: CVC, línea arterial, capnografía, pulsioxímetro de dedo derecho (para detectar hipoxemia regional) y temperatura esofágica.
Tabla 1. Variables a monitorizar en ECMO y objetivos
| Variable | Objetivo ECMO Veno-Venoso | Objetivo ECMO Veno-Arterial | |
| Gasometría | SVO2 pH Hematocrito | Mayor a saturación sistèmica 7.36 – 7.44 > 24% | 65 – 75% 7,36 – 7,44 > 24% |
| Línea arterial | Presión arterial media
Presión de pulso |
60 – 80 mmHg – | 60-80 mmHg > 15 mmHg |
| Ecocardiograma | Ventrículo derecho
Ventrículo izquierdo |
Volumen y función global
Volumen y función global |
Volumen y función global
Volumen y función global (especial énfasis en llenado de cavidades izquierdas) |
| Catéter de arteria pulmonar | Presión venosa central
Presión de enclavamiento capilar pulmonar |
10 – 12 mmHg < 17 mmHg | 10 – 12 mmHg < 17 mmHg |
| Espectroscopia cercana al infrarrojo | Cabeza | > 60% | > 60% |
| (NIRS)
Flujo Urinario |
EEII | > 60%
> 0,5 ml/k/h |
> 60% y simétricos
> 0,5 ml/k/h |
Tabla 2. Alteraciones farmacológicas esperables en ECMO[17],[18]
| Factores | Acción | Alteraciones farmacocinéticas | Acción terapéutica |
| Cebado | Incremento súbito de la volemia y hemodilución
Inactivación de drogas por líquido de cebado |
Incremento del volumen de distribución
Disminuye biodisponibilidad |
Considerar dosis adicional de carga de fármacos hidrofílicos
Considerar dosis de carga de fármacos lipofílicos |
| Factores propios del circuito (circuitos nuevos) | Secuestro | Disminuye biodisponibilidad | Considerar dosis de carga de fármacos lipofílicos, dosis mayores de mantenimiento |
| Factores del paciente | Inflamación, estado hiperdinámico Fallo orgánico | Incrementa el volumen de distribución y el aclaramiento Disminuye aclaramiento, valorar vía de eliminación de fármacos | Considerar dosis de carga y dosis de mantenimiento más altas
Considerar dosis de carga en caso de fallo orgánico de la vía de eliminación del fármaco en cuestión |
Tabla 3. Drogas y los cambios farmacocinéticos[17]
| Fármaco | Vd. (L/kg) (Unión a proteínas) | Lipofilicidad | Dosificación |
| Propofol | 60 (Alto) | 3,8 | Se sugiere usar alternativa** |
| Midazolam | 1 – 3,1 (Alto) | 3,9 | Se sugiere usar alternativa** |
| Fentanilo | 4 – 6 (Alto) | 4 | Se sugiere usar alternativa** |
| Dexmedetomidina | 1,7 – 2,2 (Alto) | 3,1 | Subir dosis de carga y mantenimiento: 50% a 100% |
| Morfina | 1 – 4,7 (Bajo) | 0,8 | Dosis de carga estándar. Incrementar dosis de mantenimiento: 25%-50% |
| Ketamina | 2,4 (Moderado) | 2,2 | Dosis de carga estándar. Incrementar dosis de mantenimiento: 50% a 100% |
| Paracetamol | 1 (Bajo) | 0,5 | Dosis de carga y mantenimiento estándar |
| Cefazolina | 0,29 (Alto) | -0,4 | Administrar extremo superior de dosis y frecuencia |
| Amiodarona | 40 – 80 (Alto) | 7,6 | Pueden requerirse dosis más altas en bolo |
| Rocuronio | 0,2 – 0,3 (Alto) | 5 | Titular hasta conseguir efecto |
| Vecuronio | 0,3 – 0,4 (Alto) | Desconocido | Titular hasta conseguir efecto |
18. Si el paciente presenta paro cardíaco: se debe cardiovertir, desfibrilar o prender el marcapasos según sea la situación. En este caso, no realizar masaje cardiopulmonar, el flujo sistémico está dado por el ECMO. En el caso de que falle la bomba se debe hacer compresiones torácicas, con líneas de ECMO pinzadas, si no el masaje no será efectivo.
19. Si el paciente tiene monitoreo de espectroscopía cercana al infrarrojo (NIRS) en extremidades inferiores, se debe continuar usándolo si la cirugía durará más de 2 h, por el riesgo que se altere la perfusión, aunque tenga una línea dedicada de reperfusión a la extremidad.
-
Cambios farmacológicos
Pueden haber cambios sustanciales en la distribución del volumen intravascular y extravascular debido a factores como el exceso de agua corporal total, lesión del endotelio vascular, cambios en concentración de proteínas plasmáticas o disfunción de órganos terminales[16].
Dentro de las principales alteraciones farmacocinéticas se encuentran[17],[18].
• Volumen de distribución (Vd): El efecto de un fármaco puede disminuir en un paciente con sobrecarga de volumen intravascular, y puede aumentar en pacientes con volumen intravascular reducido, debido a los cambios en el volumen de distribución. Los medicamentos hidrofílicos, tienen un Vd más bajo, por lo tanto, su concentración se ve afectada por los cambios en la volemia del paciente.
• Unión a proteínas: El catabolismo asociado a los estados de sepsis y traumatismos disminuye las proteínas plasmáticas, afectando la biodisponibilidad de este, teniendo como consecuencia un aumento del nivel de fármaco libre con riesgo de efectos tóxicos de los fármacos altamente unidos a proteínas.
• Aclaramiento: Tanto el ECMO V-V como V-A se asocian a disfunción renal y mala distribución de flujo sanguíneo al hígado, por lo tanto, se puede afectar el aclaramiento de los fármacos. Se debe tener en consideración la función renal y hepática para evitar el fracaso del tratamiento o toxicidad en pacientes con alteraciones en estos órganos.
• Secuestro: El secuestro de medicamentos por el circuito depende de las características bioquímicas del fármaco, el diseño del oxigenador y el tipo de cebado. Los medicamentos más lipofílicos tienen, en general, más afinidad por los componentes del circuito.
Finalmente, el ECMO es un soporte vital que se utiliza cada vez más, en el caso que deba enfrentar un paciente en esta condición, no siempre tendrá acceso al equipo de ECMO, especialmente en caso de una emergencia, así hemos listado las recomendaciones para poder enfrentar la situación.
-
Referencias
1. Peek GJ, Mugford M, Tiruvoipati R, Wilson A, Allen E, Thalanany MM, et al.; CESAR trial collaboration. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet. 2009 Oct;374(9698):1351–63. https://doi.org/10.1016/S0140-6736(09)61069-2 PMID:19762075
2. Low CJ, Ramanathan K, Ling RR, Ho MJ, Chen Y, Lorusso R, et al. Extracorporeal cardiopulmonary resuscitation versus conventional cardiopulmonary resuscitation in adults with cardiac arrest: a comparative meta-analysis and trial sequential analysis. Lancet Respir Med. 2023 Oct;11(10):883–93. https://doi.org/10.1016/S2213-2600(23)00137-6 PMID:37230097
3. Zeymer U, Freund A, Hochadel M, Ostadal P, Belohlavek J, Rokyta R, et al. Venoarterial extracorporeal membrane oxygenation in patients with infarct-related cardiogenic shock: an individual patient data meta-analysis of randomised trials. Lancet. 2023 Oct;402(10410):1338–46. https://doi.org/10.1016/S0140-6736(23)01607-0 PMID:37643628
4. Conrad SA, Broman LM, Taccone FS, Lorusso R, Malfertheiner MV, Pappalardo F, et al. The extracorporeal life support organization Maastricht treaty for nomenclature in extracorporeal life support. A position paper of the extracorporeal life support organization. Am J Respir Crit Care Med. 2018 Aug;198(4):447–51. https://doi.org/10.1164/rccm.201710-2130CP PMID:29614239
5. Taghavi S, Jayarajan SN, Mangi AA, Hollenbach K, Dauer E, Sjoholm LO, et al. Examining noncardiac surgical procedures in patients on extracorporeal membrane oxygenation. ASAIO J. 2015;61(5):520–5. https://doi.org/10.1097/MAT.0000000000000258 PMID:26102174
6. Brusatori S, Zinnato C, Busana M, Romitti F, Gattarello S, Palumbo MM, et al. High- versus Low-Flow Extracorporeal Respiratory Support in Experimental Hypoxemic Acute Lung Injury. Am J Respir Crit Care Med. 2023 May;207(9):1183–93. https://doi.org/10.1164/rccm.202212-2194OC PMID:36848321
7. MacLaren G, Brodie D, Lorusso R, et al., editors. Extracorporeal Life Support: The ELSO Red Book. 6th ed. Ann Arbor (MI): Extracorporeal Life Support Organization; 2022. pp. 73–95.
8. Agliati R, Díaz R, Fajardo C, Van Sint Jan N. Manual de Emergencias en ECMO, 1ra edición. Buenos Aires, Argentina: Ediciones Journal; 2018.
9. Kumar G, Maskey A. Anticoagulation in ECMO patients: an overview. Indian J Thorac Cardiovasc Surg. 2021 Apr;37(S2 Suppl 2):241–7. https://doi.org/10.1007/s12055-021-01176-3 PMID:33967447
10. Kalbhenn J, Zieger B. Bleeding during veno-venous ECMO: prevention and treatment. Front Med (Lausanne). 2022 May;9:879579. https://doi.org/10.3389/fmed.2022.879579 PMID:35677828
11. Dianti J, Tisminetzky M, Ferreyro BL, Englesakis M, Del Sorbo L, Sud S, et al. Association of positive end-expiratory pressure and lung recruitment selection strategies with mortality in acute respiratory distress syndrome: a systematic review and network meta-analysis. Am J Respir Crit Care Med. 2022 Jun;205(11):1300–10. https://doi.org/10.1164/rccm.202108-1972OC PMID:35180042
12. Mossadegh C. Monitoring the ECMO. Nursing Care and ECMO; 2017. pp. 45–70.
13. Rand A, Zahn PK, Schildhauer TA, Waydhas C, Hamsen U. Inhalative sedation with small tidal volumes under venovenous ECMO. J Artif Organs. 2018 Jun;21(2):201–5. https://doi.org/10.1007/s10047-018-1030-9 PMID:29508167
14. Prasser C, Zelenka M, Gruber M, Philipp A, Keyser A, Wiesenack C. Elimination of sevoflurane is reduced in plasma-tight compared to conventional membrane oxygenators. Eur J Anaesthesiol. 2008 Feb;25(2):152–7. https://doi.org/10.1017/S0265021507001330 PMID:17655810
15. Møller JE, Sionis A, Aissaoui N, Ariza A, Bělohlávek J, De Backer D, et al. Step by step daily management of short-term mechanical circulatory support for cardiogenic shock in adults in the intensive cardiac care unit: a clinical consensus statement of the Association for Acute CardioVascular Care of the European Society of Cardiology SC, the European Society of Intensive Care Medicine, the European branch of the Extracorporeal Life Support Organization, and the European Association for Cardio-Thoracic Surgery. Eur Heart J Acute Cardiovasc Care. 2023 Jul;12(7):475–85. https://doi.org/10.1093/ehjacc/zuad064 PMID:37315190
16. Buscher H, Vaidiyanathan S, Al-Soufi S, Nguyen DN, Breeding J, Rycus P, et al. Sedation practice in veno-venous extracorporeal membrane oxygenation: an international survey. ASAIO J. 2013;59(6):636–41. https://doi.org/10.1097/MAT.0b013e3182a84558 PMID:24088903
17. MacLaren G, Brodie D, Lorusso R, et al., editors. Extracorporeal Life Support: The ELSO Red Book. 6th ed. Ann Arbor (MI): Extracorporeal Life Support Organization; 2022. pp. 643–64.
18. Brogan TV, Annich G, Ellis WC. ECMO Specialist Training Manual 4th Edition. Extracorporeal Life Support Organization (ELSO), 2018, p. 59 – 68.

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution