Estefanía Romero-Serrano MD.1,*, Anabel Forte PhD.2, Teresa Pérez Pérez MD.3, Celia Calderón MD.4, José De Andrés MD. PhD.5
Recibido: 14-10-2023
Aceptado: 11-12-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 2 pp. 115-123|https://doi.org/10.25237/revchilanestv53n2-06
PDF|ePub|RIS
Comparison of regional anaesthetic blocks and the development of pain after breast tumour surgery
Abstract
Background and Aims: This article compare three regional block techniques in preventing Acute Postoperative Pain (APP) and Chronic Postoperative Pain (CPP) after breast tumour surgery. Methods: A single-centre study was performed on 103 women undergoing breast tumour surgery, in which the regional block was randomized (1:1:1) between the following: Erector Spinae Plane block (ESP), Pectoral nerve type II block (PECS-II), and Serratus-Intercostal Fascial Plane block (SIFP). Pain was assessed by using visual analogue scales (VAS) at baseline, at the immediate postoperative period, after 24 hours, 3 and 12 months from surgery. Results: 35 subjects received ESP block, 34 PECS-II block and 34 SIFP block. APP control was similar between groups: only 14% of the patients required a rescue opioid analgesic. PECS-II reduced opioid consumption 53% compared to ESP, and 73% compared to SIFP. The global incidence of CPP was 28.2%. PECS-II was associated with a lower incidence of CPP, lower VAS scores, and a lower need for analgesic drug consumption. Conclusion: There were no differences in APP, but there was less opioid demand in PECS-II. However, we observed a clear superiority of PECS-II over SIFP and ESP in preventing CPP.
Resumen
Antecedentes y Objetivo: Se compara la prevención de dolor agudo posoperatorio (DAP) y de dolor crónico posoperatorio (DCP) tras cirugía tumoral de mama con tres bloqueos anestésicos: bloqueo del plano del erector espinal (ESP), bloqueo de los nervios pectorales tipo II (PECS-II) y bloqueo fascial de plano del serrato intercostal (SIFP). Material y Métodos: 103 mujeres sometidas a cirugía tumoral de mama con ESP, PECS-II y SIFP. Se analizó DAP y DCP mediante escala visual analógica (EVA) basal, posoperatorio inmediato, a las 24 h, 3 y 12 meses. Resultados: 35 sujetos recibieron ESP, 34 PECS-II, 34 SIFP. El control del DAP fue similar; 14% de las pacientes requirió analgesia de rescate con opioide. PECS-II redujo 53% el consumo agudo de opioide en comparación con ESP, y 73% respecto de SIFP. La incidencia global de DCP fue 28,2%. PECS-II asoció EVA inferiores a los 3 y 12 meses, con menor consumo de analgesia. Conclusión: No hubo diferencias en el control de DAP entre ESP, PECS-II o SIFP, pero sí una menor demanda de opioide en PECS-II. Se objetivó menor incidencia de DCP en PECS-II, y menor consumo analgésico tras 12 meses.
-
Introducción
Los bloqueos anestésicos permiten mejor control del dolor agudo posoperatorio (DAP) y menor consumo opioide[1]-[4]. El DAP se erige como el principal factor de riesgo para sufrir dolor crónico posoperatorio (DCP)[5]; de hecho, entre el 10% y el 50% de pacientes con DAP desarrollará DCP[6], por lo que un adecuado abordaje de DAP reduce el riesgo de DCP. La cirugía de mama, la cirugía axilar y la posible adición de cirugía reconstructiva de mama son intervenciones quirúrgicas con alta incidencia de DCP. Durante muchos años, la anestesia regional gold standard fue el bloqueo paravertebral torácico y el bloqueo epidural torácico. En 2011, Blanco et al., publicaron el bloqueo del nervio pectoral tipo I (PECS) y posteriormente, el tipo II (PECS-II)[7]. En 2012, se publicó el bloqueo del plano fascial del serrato intercostal (SIFP)[8] y en 2016 Forero et al., describieron el bloqueo del plano del erector espinal (ESP)[9].
Diversos estudios han comparado la efectividad de los bloqueos interfasciales en el manejo del dolor posoperatorio de cirugía de mama[10]-[15]. Los resultados generalmente se pronuncian a favor de PECS-II, aunque desde su aparición la balanza se ha inclinado por ESP, siendo una técnica prometedora cuyo target es enclave de múltiples vías anatómicas. Aun así, los estudios que asocian ESP con menor DAP y DCP son de pequeño tamaño muestral, no aleatorizados y por tanto, no permiten extraer conclusiones definitivas sobre la superioridad de uno u otro. Esta es una circunstancia de alta relevancia en la cirugía de mama, donde el DCP alcanza cifras del 25%-30%[16].
-
Objetivo
La finalidad de este estudio es comparar la efectividad de tres de los más comunes bloqueos anestésicos (ESP, PECS-II y SIFP) en el manejo de DAP y de DCP tras cirugía tumoral de mama. Se ha evaluado la intensidad del dolor registrando la escala visual analógica (EVA) y el consumo opioide. También se ha recogido la aparición de eventos adversos y la duración de la estancia hospitalaria con cada técnica. Hasta donde sabemos, se trata del primer estudio simple ciego que compara estos tres bloqueos.
-
Material y Métodos
-
Diseño del estudio
El estudio se llevó a cabo en un único centro, reclutando pacientes en el período comprendido entre el 1 de junio de 2018 y el 30 de junio de 2019. Un total de 165 pacientes fueron so
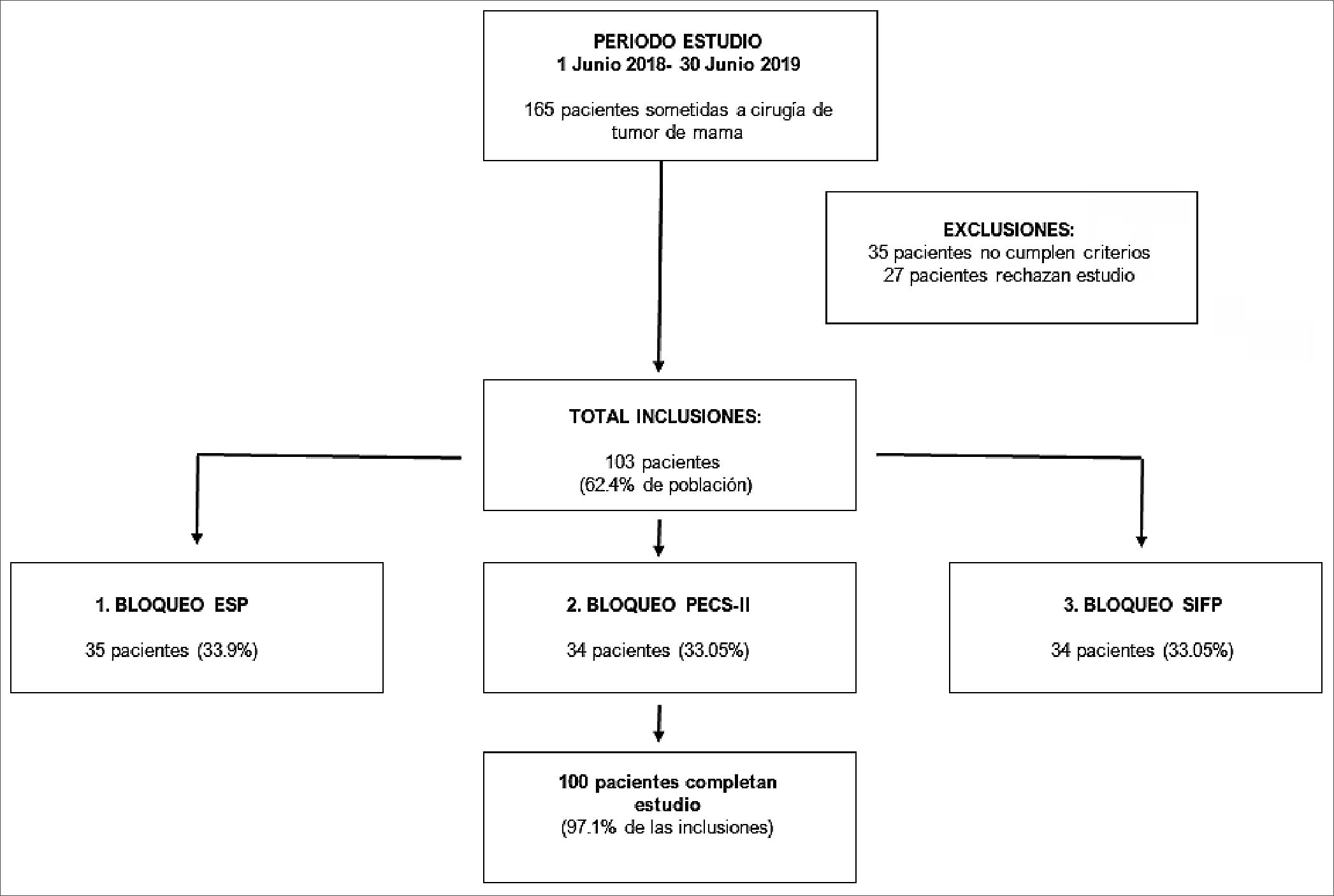
Figura 1. Resumen del estudio.
metidos a cirugía tumoral de mama. Un total de 103 pacientes fueron incluidas en el estudio (Figura 1). Hubo una pérdida de datos de 3 pacientes (2 decesos y 1 transferencia a otro país).
La selección de pacientes se basó en los siguientes criterios de inclusión: (A) pacientes de sexo femenino; (B) edad > 18 años; (C) sometidas a cirugía electiva de tumor de mama. Los criterios de exclusión fueron los siguientes: (A) cirugía previa de tumor de mama; (B) prótesis mamaria; (C) coagulopatía; (D) estado de gestación o de lactancia; (E) infección en la zona de punción; (F) deformidad en pared torácica; (G) inestabilidad hemodinámica; (H) rechazo a la práctica de técnica locorregional anestésica; (I) y rechazo a la participación en el estudio o revocación del consentimiento informado.
El tamaño muestral se determinó en el diseño del estudio por el Institut d’Investigació Sanitària Pere Virgili (IISPV) de modo que fuera apropiado según los objetivos y los condicionamientos particulares. El cálculo se realizó con GRANMO v7.12 – Herramienta Calculadora de Grandària Mostral versión 7.12 abril de 2012 (Instituto Municipal de Investigaciones Médicas, Barcelona, España) – para análisis de varianzas, aceptando riesgo alfa de 0,05 y riesgo beta < 0,2 en contraste bilateral; eran necesarios 34 sujetos por cada grupo, habiendo 3 grupos, para así detectar una diferencia mínima de 2 puntos en la EVA y una desviación estándar de 2,4[17]. Se contempló una pérdida de seguimiento del 10%.
La aleatorización se realizó por bloques, evitando la desigualdad numérica entre los grupos de tratamiento, en una ratio 1:1:1. De esta manera, por orden de fecha de intervención, la paciente era incorporada al bloque 1 (ESP), la siguiente paciente al bloque 2 (PECS-II) y la siguiente paciente al bloque 3 (SIFP). Ninguna de las participantes supo en qué grupo de estudio fue incluida.
Las variables clínicas consideradas en la estratificación de las pacientes fueron: edad, índice de masa corporal (IMC), tamaño tumoral, estadificación tumoral, categorización por riesgo anestésico según escala ASA (American Society of Anesthesiologists), diagnóstico anatomopatológico y tipo de intervención quirúrgica.
Al diseñar el estudio, la posibilidad de añadir un grupo placebo fue considerada para incrementar el poder estadístico posibilitando un doble enmascaramiento al realizar la técnica locorregional con suero fisiológico, algo que se ha llevado a cabo en diversos estudios. No obstante, se desestimó por la convicción de que con ello las pacientes solamente serían sometidas a posibles efectos adversos y a ningún beneficio clínico.
Se obtuvo la aprobación del Comité de Ética de Investigación con Medicamentos del IISPV en Tarragona (España), que emitió un informe favorable (Referencia 070/2018) para la realización del estudio con fecha de 31 de mayo de 2018 en el Hospital de Tortosa Verge de la Cinta, Tarragona, España. Todas las participantes entregaron un consentimiento informado firmado, en el que se explicaba de forma detallada el objetivo del estudio, sus riesgos e implicaciones, el trato confidencial de los datos y el cumplimiento de las normas de la declaración de Helsinki de 1975, revisado en 2013, además del Real decreto 1090/2015 de 4 de diciembre que regula los ensayos clínicos y productos sanitarios a través de la Agencia Española de Medicamentos y Productos Sanitarios. El estudio fue registrado en clinicaltrials.gov (NCT05185752). Este manuscrito se ha adherido a las guías CONSORT.
-
Evaluación del dolor
Se documentó mediante la Escala Visual Analógica (EVA) cuantificado por la propia paciente en un determinado momento en que estuviera en movimiento y no en reposo. La paciente debía determinar la puntuación EVA relacionada con la zona anatómica de la intervención (mama, pared torácica, área axilar, hombro y miembro superior ipsilateral), descartando dolor en otras localizaciones. Se registraron cinco momentos: (i) previo a la intervención quirúrgica; (ii) posoperatorio inmediato; (iii) 24 horas después; (iv) tres meses después; y (v) doce meses después. El dolor a los 3 y 12 meses se evaluó mediante entrevista telefónica, en la que las pacientes expresaban la intensidad y la localización anatómica del dolor. Todos los datos obtenidos mediante entrevista telefónica fueron contrastados también con el historial clínico de las pacientes.
Se registró el consumo opioide de cada paciente desde su salida de quirófano y durante su estancia hospitalaria. La administración de opioide era reservada para aquellas pacientes que el anestesiólogo responsable de Sala de Despertar apreció con dolor intenso a la salida de quirófano. Se disponía de tramadol, fentanilo, meperidina, morfina, metadona. El total de opioide administrado se registró en miligramos de morfina equivalentes vía oral (MME).
Se detallaron las variables que caracterizaban a las participantes, para analizar la homogeneidad de la muestra. En primer lugar, categorización del riesgo anestésico mediante escala de clasificación ASA en dos grupos: A o de riesgo alto (ASA III-IV) y B o de riesgo bajo (ASA I y II). En segundo lugar, diagnóstico anatomopatológico (benigno, preinvasivo, maligno). Tercer lugar, estadificación del tumor según el Breast Cancer Staging en: no avanzado (estadíos 0 – IIA), y avanzado (estadíos IIB – IV[18].
Para finalizar, como se registraron pacientes sometidas a diferentes tipos de intervención quirúrgica, los tres grupos de pacientes fueron sometidos también a un estudio de homogeneidad. De esta manera, el tipo de intervención quirúrgica fue categorizado en tres tipos de cirugía según su complejidad:
1. Cirugía menor: tumorectomía.
2. Cirugía intermedia: tumorectomía asociando disección o biopsia de ganglio centinela.
3. Cirugía mayor: mastectomía o tumorectomía con linfade- nectomía, o cirugía reconstructiva.
Asimismo, se registraron la aparición de eventos adversos posoperatorios, la inestabilidad hemodinámica (considerando como tal a la disminución de la presión arterial media < 65 mmHg o variación de > 20%, o frecuencia cardíaca > 100 latidos por minuto) y la duración de la estancia hospitalaria.
A los doce meses de la cirugía, se recogió la necesidad de tratamiento analgésico y el escalón de la clasificación de la OMS en que éste se encontraba: I- no opioides ± coadyuvantes; II – opioides débiles ± no opioides ± coadyuvantes; III- opioides fuertes ± no opioides ± coadyuvantes; IV-tratamiento intervencionista del dolor. Se registró también cuántas pacientes eran atendidas en este momento por Unidades de Dolor especializadas.
-
Procedimiento anestésico
Monitorización con pulsioximetría, electrocardiograma, tensión arterial no invasiva, índice biespectral (BIS®). Se induce anestesia general intravenosa con fentanilo 2 mcg/kg, propofol 2-3 mg/kg y mascarilla laríngea iGel® de tamaño ajustado a cada paciente. El mantenimiento anestésico fue bien anestesia general balanceada con sevofluorane, o bien TIVA (Anestesia Total Intravenosa) con propofol en infusión continua. Ventilación controlada manteniendo normocapnia.
Se administró en quirófano analgesia endovenosa convencional, que por protocolo fue paracetamol 1 g y dexketopro- feno 50 mg (en caso de alergia a alguno de estos fármacos se administraría en su lugar metamizol 2 g). Como profilaxis de náuseas y vómitos posoperatorios, se administra al final de la intervención ondansetrón 4 mg IV.
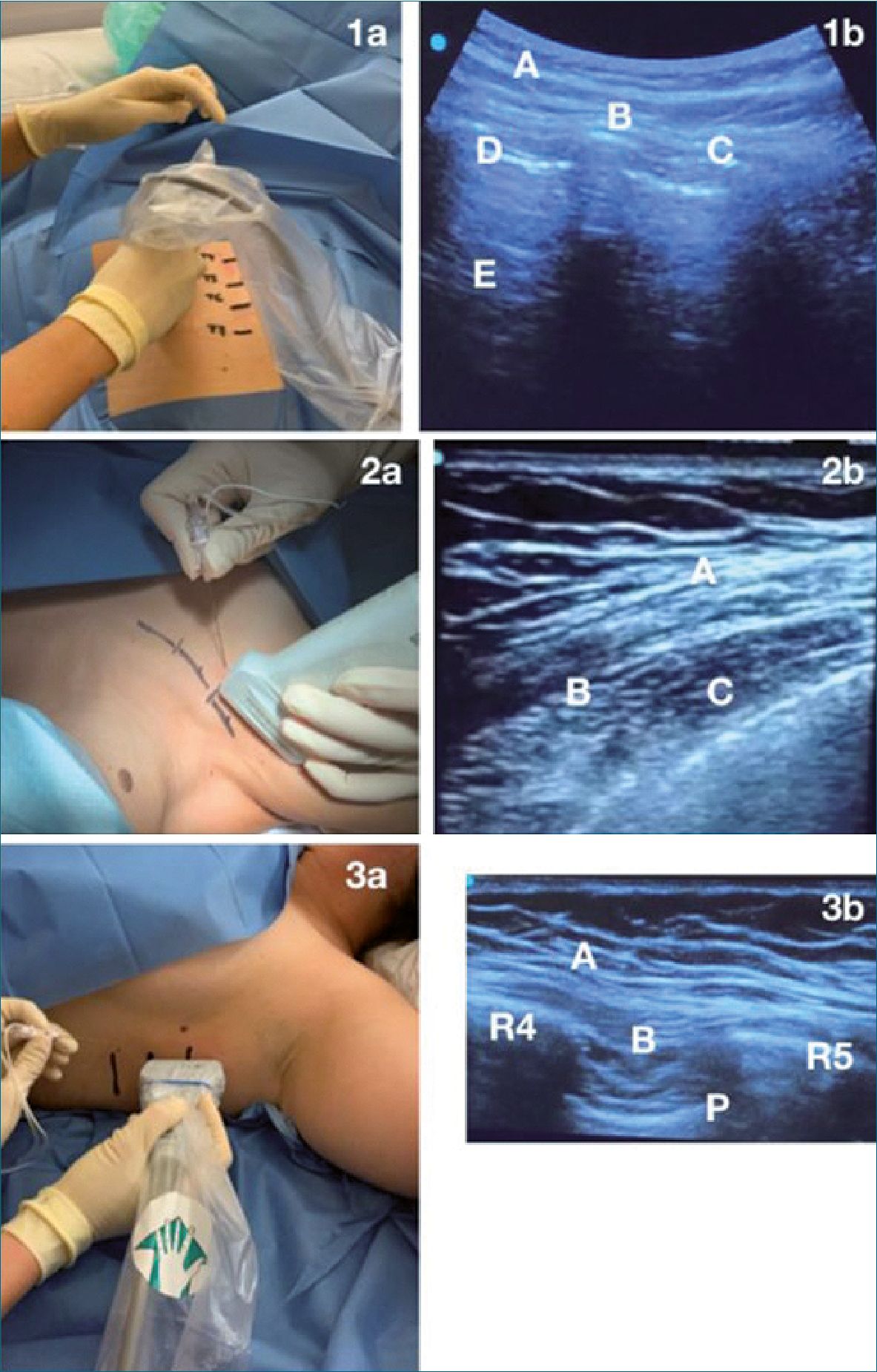
Figura 2. Técnicas de bloqueo bajo US utilizadas.
-
Realización de los bloqueos interfasciales
La técnica locorregional fue realizada previamente a la inducción anestésica, bajo sedación ligera con midazolam 0,0150,03 mg/kg intravenosa y oxígeno suplementario con cánulas nasales. Se empleó ecógrafo S-Nerve® (SonoSiteInc, Bothell, USA) con transductores lineal 6-13 MHz y convex 2-5 MHz y agujas SonoPlex® STIM 22G x 50 mm (Pajunk®).
El fármaco seleccionado para la realización de los bloqueos fue bupivacaína 0,25%, a dosis de 30 cc, siendo habitual esta selección en literatura[18],[19]. Este fármaco a esta determinada concentración permitió emplear un volumen alto que procuraba difusión anatómica por los tejidos fasciales siendo dosis terapéuticas y seguras, sin llegar a niveles de toxicidad.
Las tres técnicas locorregionales realizadas fueron las siguientes:
(i) Bloqueo del plano del erector espinal (ESP): En decúbito prono (Figura 2 [1a]) con sonda en corte transversal, se visualiza la apófisis espinosa de T4, con barrido lateral se obtiene la articulación costotransversa. La visión ecográfica sagital permite observar las cuatro líneas ecográficas (línea intertransversa, interfacetaria, interlaminar e interespinosa). Sobre la línea inter
transversa se observan trapecio [A], romboides [B], y erector espinal [C] (Figura 2 [1b]). Se realiza punción única craneocaudal hacia ápex de apófisis costotransversa y tras elevar el erector espinal, se suministra 30 cc de bupivacaína 0,25%.
(ii) Bloqueo de nervios pectorales tipo II (PECS-II): Paciente en decúbito supino con miembro superior ipsilateral extendido (Figura 2 [2a]). Se traza la línea clavicular, y se remarca su tercio externo. De forma paralela, se remarca la línea costal inferior y espacio infraclavicular. En corte transversal se aplica la sonda lineal, obteniendo una imagen que permite la identificación de pectoral mayor [A] y pectoral menor [C]. Si se añade Doppler- color se identifica la arteria acromiotorácica, que debe ser [B] (Figura 2 [2b]). Se inserta la aguja a 45° desde medial hasta lateral, suministrando 30 cc de bupivacaína 0,25% (20 cc de bupivacaína 0,25% entre ambos pectorales, y 10 cc de bupiva- caína 0,25% entre pectoral menor y serrato anterior).
(iii) Bloqueo del plano de fascia de serrato intercostal (SIFP): en decúbito supino, con miembro superior ipsilateral a 90° (Figura 2 [3a]). Se identifican cuarta, quinta y sexta costilla en línea media axilar. En visión coronal, se observa serrato anterior [B], músculos intercostales [C], pleura [P] (Figura 2 [3b]). La aguja se inserta en sentido caudocraneal hasta descansar sobre la cuarta costilla, suministrando 30 cc de bupivacaína 0,25% entre serrato anterior y músculos intercostales.
-
Resultados
-
Descripción de la población
Las participantes fueron mujeres de edad 62,7 ± 11,9 años, con un IMC 28,7 ± 6,1 kg/m2. El tamaño del tumor de mama fue de 21,8 ± 18,1 mm. Los sujetos distribuidos en los tres grupos de estudio presentaron homogeneidad en las variables contempladas en el diseño del estudio (Tabla 1). De las participantes, 77,6% presentó lesión maligna y en 15,5% de los casos se trató de una enfermedad en estadío avanzado. Respecto al tipo de intervención quirúrgica, 38,8% se sometió a cirugía mayor, 46,6% a cirugía intermedia y, 14,6% a cirugía menor. Solamente 15,5% (14 sujetos) fueron sometidas a linfadenec- tomía. No hubo diferencias entre los tres grupos de estudio en clasificación ASA, en diagnóstico anatomopatológico, en esta- dificación tumoral, ni en tipo de intervención quirúrgica (Tabla 1).
-
Eventos adversos agudos y duración de la estancia hospitalaria
Hubo una incidencia muy baja (8,7%) de inestabilidad he- modinámica durante la cirugía, ligeramente mayor en el caso del bloqueo ESP (4,9%) que en las otras dos técnicas (1,9% para PECS-II y 1,9% para SIFP). No se identificaron eventos adversos en ninguno de los tres grupos de estudio en el período posoperatorio.
| ASA niveles A | 6 | 17,2 | 3 | 8,8 | 0,08c | ||
| B | 29 | 82,8 | 31 | 91,2 | |||
| Diagnóstico AP Benigno | 0 | 0 | 2 | 5,9 | 0,63c | ||
| Preinvasivo | 9 | 25,7 | 5 | 14,7 | |||
| Maligno | 26 | 74,3 | 27 | 79,4 | |||
| Estadiaje No avanzado | 27 | 77,2 | 29 | 85,3 | 0,27c | ||
| Avanzado | 8 | 22,8 | 5 | 14,7 | |||
| Tipo de intervención quirúrgica Cirugía menor | 4 | 11,4 | 4 | 11,8 | 0,31c | ||
| Cirugía intermedia | 13 | 37,2 | 19 | 55,8 | |||
| Cirugía mayor | 18 | 51,4 | 11 | 32,4 | |||
| Linfadenectomía | 8 | 2 | 6 | 5,8% | |||
ESP = bloqueo del plano del erector espinal; PECS-II = bloqueo de los nervios pectorales tipo II; SIFP = bloqueo fascial de plano del serrato intercostal; DE = desviación estándar; Sign. = significancia estadística; a: ANOVA (Comprobación de normalidad y homogeneidad de varianzas); b: Kruskal-Wallis (no se detecta normalidad); c Chi cuadrado; ASA: Escala de riesgo anestésico según estado clínico preoperatorio: [A] Alto riesgo: ASA III y ASA IV [B]; Bajo riesgo: ASA I y ASA II. Diagnóstico AP: = anatomopatológico: tumores benignos, preinvasivos o malignos. Estadiaje: No avanzado (estadíos 0 – IIA) o avanzado (IIB – IV). Tipo de intervención quirúrgica: Cirugía Menor (Tumorectomía), Cirugía Intermedia (Tumorectomía + biopsia de ganglio centinela), Cirugía Mayor (Tumorectomía o Mastectomía ± biopsia de ganglio centinela en mastectomía o linfadenectomía ± cirugía reconstructiva).
En cuanto a la duración de la estancia hospitalaria, el bloqueo ESP obtuvo una mayor duración (media de 31,5 h) frente a SIFP (15,5 h) y PECS-II (16,9 h).
-
Incidencia de dolor agudo y manejo
Durante el período preoperatorio, las participantes fueron interrogadas sobre la existencia de dolor en la localización anatómica correspondiente en la intervención (EVA basal), sin observarse diferencias entre los tres grupos. Se reevaluó el dolor en el posoperatorio inmediato y transcurridas 24 h desde la cirugía. Hubo un lógico incremento de los valores medios de EVA posteriores a la cirugía respecto al basal preoperatorio, pero que no conllevó diferencias estadísticamente significativas entre los diferentes bloqueos (Tabla 2, Figura 3: 3A, 3B, 3C). Globalmente, los valores EVA obtenidos fueron bajos, especialmente a las 24 h de la cirugía, momento en que fueron inferiores al del posoperatorio inmediato.
Respecto a la necesidad de opioides de rescate, 24 h tras la cirugía solamente 14% de las pacientes lo demandaron: 5,8% ESP (n = 6; a 3 pacientes se les suministró tramadol, a 2 pacientes fentanilo y a 1 paciente morfina), 5,8% PECS-II (n = 2; en ambos casos se suministró tramadol), 7,7% SIFP (n = 8; a 7 pacientes se les suministró tramadol y a 1 paciente fentanilo). Al analizar las dosis suministradas en MME (miligramos de morfina equivalentes vía oral), las pacientes con ESP requirieron una media de 0,84 MME, PECS- II 0,39 MME y SIFP 1,47 MME. Se podría decir que las pacientes con PECS-II requirieron menor
dosis MME que el resto (53% menor que bloqueo ESP y 73% menor que el bloqueo SIFP), pero sin resultar estadísticamente significativo.
Tabla 2. Evolución de los datos EVA en cada grupo de pacientes con su correspondiente técnica anestésica
| Media | ESP | DE | PECS-II | SIFP | Kruskall-Wallis | |||
| Media | DE | Media | DE | |||||
| EVA basal | 0,74 | 1,8 | 0,59 | 1,48 | 0,44 | 0,95 | 0,975 | |
| EVA posoperatorio | 2,03 | 2,4 | 2,24 | 2,4 | 1,94 | 2,0 | 0,844 | |
| EVA 24 h | 1,74 | 2,1 | 1,65 | 1,8 | 1,44 | 1,7 | 0,895 | |
| EVA 3 meses | 2,47 | 2,7 | 1,03 | 1,6 | 2,32 | 2,2 | 0,035* | |
| EVA 1 año | 2,21 | 2,1 | 0,79 | 1,3 | 2,55 | 2,7 | 0,002* | |
ESP = bloqueo del plano del erector espinal; PECS-II = bloqueo de los nervios pectorales tipo II; SIFP = bloqueo fascial de plano del serrato intercostal; EVA = escala visual analógica; DE = desviación estándar.
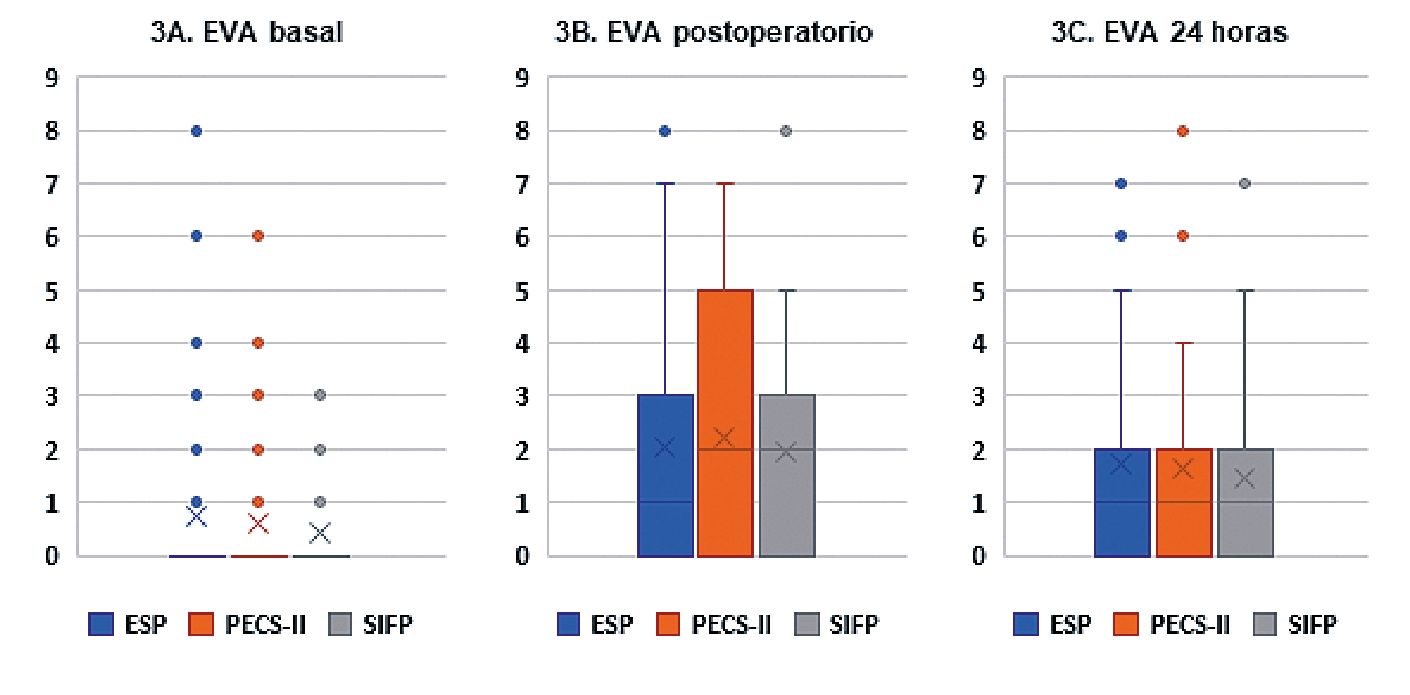
Figura 3. Dolor agudo posoperatorio.
-
Desarrollo de DCP
Hubo una incidencia de aparición de DCP del 28,2% (n = 29). Se debe destacar que al analizar la incidencia en cada grupo, se identificaron diferencias significativas entre bloqueos, siendo que la menor incidencia se asoció a PECS-II (3,9%, n = 4), seguido de ESP (10,7%, n = 11) y finalmente SIFP (13,6%, n = 14).
Las localizaciones anatómicas referidas como área de DCP fueron: mama y pared torácica (5,8%, n = 6); hombro y/o miembro superior ipsilateral (10,5%, n = 11) y ambas localizaciones (11,6%, n = 12).
Respecto a la evolución de los datos EVA, transcurridos 3 meses desde la cirugía se detectaron diferencias estadísticamente significativas entre los tres grupos de estudio. Las pacientes con PECS-II obtuvieron valores inferiores al resto, mientras que no hubo diferencias estadísticamente significativas entre los grupos ESP y SIFP (Tabla 2, Figura 4 A). Transcurridos 12 meses desde la intervención, se obtuvieron resultados similares en los datos EVA, siendo que las pacientes con PECS-II volvieron a obtener valores inferiores a los otros dos grupos (Tabla 2, Figura 4 B).
La necesidad de algún tratamiento analgésico al año de la intervención por dolor residual en la zona quirúrgica ascendió
al 49% (n = 51). En función del tipo de bloqueo, los resultados obtenidos fueron: 30,3% (n = 10) en los que recibieron PECS-II, frente a 70,6% (n = 24) ESP y 60,6% (n = 13) SIFP (Figura 5). Con todo ello, PECS-II podría relacionarse con cifras inferiores de dolor crónico posoperatorio.
Finalmente, 12 meses después de la cirugía, el 20,6% de las pacientes con dolor crónico era seguido por una Unidad de Dolor especializada (es decir, 5,8% de los sujetos del estudio). No hubo diferencias entre los tres grupos en esta variable.
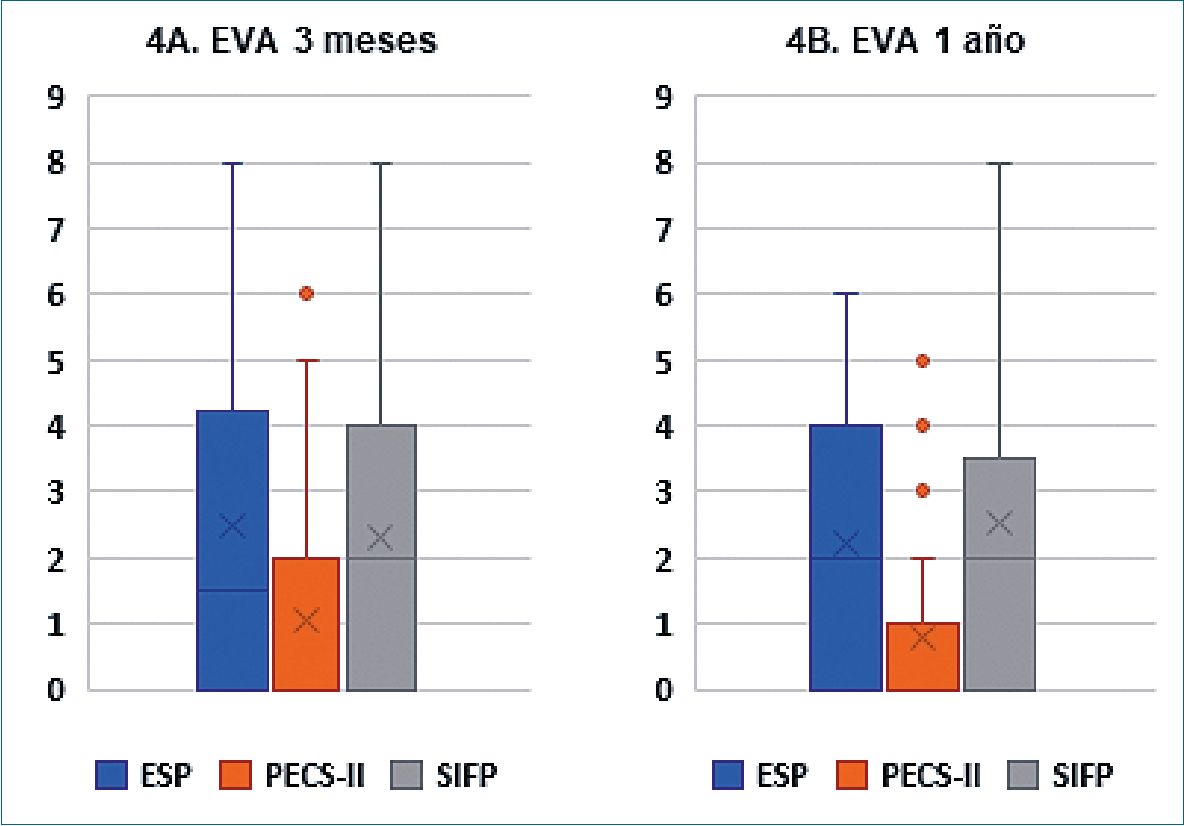
Figura 4. Dolor crónico posoperatorio.
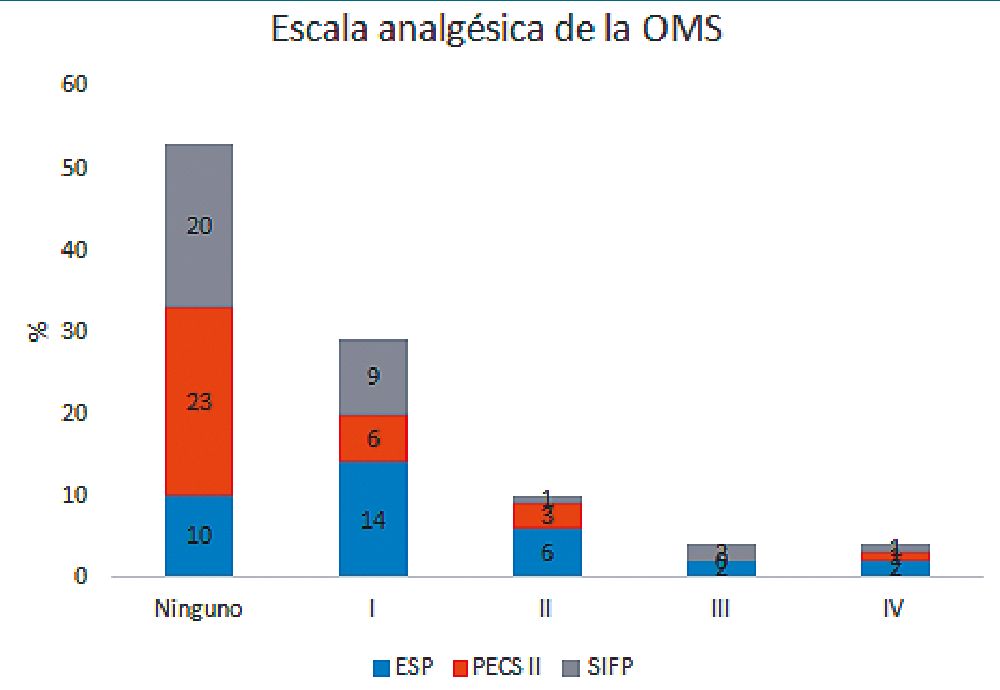
Figura 5.
-
Discusión
Este manuscrito presenta los resultados de un estudio que compara la efectividad de tres técnicas regionales anestésicas (ESP, PECS-II y SIFP) al controlar el DAP y en la prevención del desarrollo de DCP en pacientes de sexo femenino sometidas a cirugía de tumor mamario.
Al diseñar el estudio, como hipótesis inicial se esperaba que ESP se mostrara superior en comparación con PECS-II y SIFP, por su amplia cobertura anatómica (rama dorsal y anterior del
nervio espinal y ramo comunicante blanco y gris debido a la difusión del espacio paravertebral). Sin embargo, los tres métodos anestésicos confirieron una adecuada analgesia (evidenciada por cifras EVA bajas) tanto en el posoperatorio inmediato como 24 h después, y sin diferencias estadísticamente significativas entre los tres grupos. Esto significa que el área anatómica involucrada en la intervención quirúrgica había quedado cubierta por la analgesia procurada con los tres tipos de bloqueo interfascial, a pesar de que cada bloqueo presente un target específico y en diferentes nervios. No obstante, el hecho de haber administrado un amplio volumen de 30 cc de anestésico local permitió la difusión del anestésico hasta completar la zona afectada.
No hubo eventos adversos en la realización de las técnicas regionales descritas, y se mantuvo la estabilidad hemodinámica intraoperatoria, por lo que, los tres tratamientos se manifiestan como igualmente seguros para el paciente en este período.
A una tasa muy baja (14%) de las pacientes se les administró opioide en el posoperatorio inmediato, lo que indica la efectividad de las técnicas locorregionales implementadas. Pese a ello, las pacientes con PECS-II presentaron cifras de EVA inferiores y consumieron menor dosis media de opioide.
La incidencia de dolor crónico posoperatorio tras la cirugía de tumor de mama es del 25%-30%[16]. La que se ha obtenido en este estudio se encuentra dentro de este rango (28,2%) sin haber conseguido disminuirla a pesar de que todas las pacientes fueron tratadas con técnica locorregional anestésica en su intervención quirúrgica y del buen control del dolor desde el momento inicial más agudo. Cabe destacar que PECS-II sí obtuvo datos de EVA significativamente inferiores que ESP y SIFP, tanto 3 meses como 12 meses después de la cirugía. Además, las pacientes con PECS-II fueron las que menos consumo analgésico registraron.
Estos resultados son apoyados por anatomía, pues el target del bloqueo PECS-II son los nervios pectorales, siendo la única de las tres técnicas que interviene en el plexo braquial, además de en área torácica y pectoral, y cubre área axilar y torácica de forma directa y no sólo por difusión del fármaco.
Se ha estudiado la distribución del anestésico local en el bloqueo ESP, que incluiría el plexo braquial si el abordaje se practicara a nivel T3[19]. Este estudio ha situado el abordaje a nivel T4 tras haber repasado que es el más habitual de la literatura. Por otro lado, en el caso del bloqueo SIFP, cubriría la inervación de la pared torácica anterior (ramas intercostales mediales) y axila[20]. No obstante, estudios en cadáveres[21] no corroboran la difusión a la axila.
Sería encomiable poder tratar a toda paciente con DCP por una Unidad de Dolor especializada. Solamente 20,6% del total de pacientes afectadas por DCP de este estudio fueron atendidas por la Unidad de Dolor. Existen muchas razones para justificar este hecho: por un lado, pacientes que minimizan su dolor y/o rechazan el seguimiento de su dolor residual, la Psicooncología estudia las respuestas de las pacientes sometidas a procesos de gravedad emocional. Por otro lado, en la práctica asistencial el diagnóstico del DCP tras cirugía tumoral de mama es muchas veces infraestimado, lo que retrasa la remisión a la Unidad de Dolor. Además, existen motivos de planificación sanitaria y de sobrecarga asistencial por parte de las Unidades de Dolor, que generalmente, cuentan con largas listas de espera para valorar a todos los pacientes con dolor crónico derivados, y conllevando frecuentemente falta de adherencia terapéutica por parte del paciente. En conclusión, se debe abogar por implementar el correcto diagnóstico de DCP para optimizar el tratamiento y recurrir a los tratamientos especializados que puede dispensar una Unidad de Dolor en los casos pertinentes.
Es destacable, como punto fuerte de este estudio, el elevado tamaño muestral (de 103 pacientes) en comparación con muchos de los trabajos publicados hasta la actualidad. Esto permitió aleatorizar tres ramas de estudio para establecer comparaciones entre grupos. No obstante, el estudio cuenta con diversas limitaciones. Como principal y que es común a muchos otros estudios publicados[22]-[25], no se diferenció un único tipo de intervención quirúrgica sino que se incluyeron muy diferentes tipos de intervenciones. Para controlar esta variable, se estratificó de la manera descrita previamente; categorizando tres tipos de cirugías según su complejidad (menor, intermedia y mayor) y sometiendo a test estadístico Chi cuadrado. Se determinó que había homogeneidad en las tres muestras de pacientes (ESP, PECS-II y SIFP) y que por tanto, podía establecerse un análisis comparativo entre estas tres muestras.
Otra limitación fue no haber evaluado el dolor con más escalas multidimensionales, sino haber empleado una escala unidimensional (EVA). Finalmente, también hubiera sido interesante que a los 3 y 12 meses además de la entrevista telefónica con la paciente se hubiera podido llevar a cabo una entrevista personal.
En conclusión, este estudio proporciona datos preliminares sobre las diferencias en la efectividad de tres técnicas regionales anestésicas (ESP, PECS-II y SIFP) en la prevención de la aparición de DAP y DCP tras una cirugía de tumor de mama. Los tres bloqueos se mostraron igual de seguros y efectivos en el posoperatorio inmediato, pero a los 3 y 12 meses el bloqueo PECS-II se erige como la técnica que permitió un mejor control de DCP. No obstante, se hace necesaria una mayor investigación en este campo para confirmar estos resultados.
-
Conclusiones
Se ha evidenciado un adecuado control del dolor agudo con las tres técnicas en el período posoperatorio inmediato y a las 24 h. Asimismo, existen diferencias estadísticamente significativas por las que las pacientes con PECS-II presentaron superioridad respecto al desarrollo de dolor crónico posoperatorio a los 3 y a los 12 meses en los otros bloqueos. Es necesario continuar investigaciones que profundicen en estos resultados para conseguir optimizar la calidad de vida de estos pacientes.
Financiación: El presente proyecto obtuvo una beca en los premios otorgados por la Fundación Ferran (https://fundacioferran.org/) en mayo de 2018, dotada con 3.000 euros destinados al desarrollo del trabajo.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
-
Referencias
1. Cronin P, Gemignani M. Enfermedades de la mama En: Diasia Creasman, Mannel McMeekin Mutch. Oncología ginecológica clínica. Novena edición. Elsevier, España, 2018. C14, 320-324.
2. Singh, N. P., Makkar, J. K., Borle, A., & Singh, P. M. (2020, November 1). Analgesic efficacy of erector spinae plane block for oncologic breast surgery: A meta-analysis and trial sequential analysis. Breast Journal. Blackwell Publishing Inc. https://doi.org/10.1111/tbj.14001 .
3. Zhao J, Han F, Yang Y, Li H, Li Z. Pectoral nerve block in anesthesia for modified radical mastectomy: A meta-analysis based on randomized controlled trials. Medicine (Baltimore). 2019 May;98(18):e15423. https://doi.org/10.1097/MD.0000000000015423 PMID:31045802
4. Saravanan R, Venkatraman R, Yogalakshmi K, Karthik K. A prospective randomized control study on evaluation of effectiveness of serratus anterior plane block for post-operative analgesia in modified radical mastectomy surgeries. Indian J Anaesth. 2020;64(13):S75–6.
5. Ramesh, Shukla NK, Bhatnagar S. Phantom breast syndrome [doi]. Indian J Palliat Care. 2009 Jul;15(2):103–7. https://doi.org/10.4103/0973-1075.58453 PMID:20668586
6. Vidal, et al. Manual de Medicina del Dolor. Fundamentos, evaluación y tratamiento. 1a Edición. Editorial Médica Panamericana; 2016.ISBN: 978-84-9110-095-9.
7. Blanco R. The ‘pecs block’: a novel technique for providing analgesia after breast surgery. Anaesthesia. 2011 Sep;66(9):847–8. https://doi.org/10.1111/j.1365-2044.2011.06838.x PMID:21831090
8. Fajardo Pérez M, García Miguel FJ, López Álvarez S, Diéguez García P, Alfaro de la Torre P. Nuevo abordaje de las ramas de los nervios intercostales a nivel de la línea media axilar Cir May Amb, 18 (2013), pp. 4-7.
9. Forero M, Adhikary SD, Lopez H, Tsui C, Chin KJ. The erector spinae plane block: A novel analgesic technique in thoracic neuropathic pain. Reg Anesth Pain Med. 2016;41(5):621–7. Available from: https://www.ncbi.nlm.nih.gov/pubmed/27501016 https://doi.org/10.1097/AAP.0000000000000451 PMID:27501016
10. Fujii T, Shibata Y, Akane A, Aoki W, Sekiguchi A, Takahashi K, et al. A randomised controlled trial of pectoral nerve-2 (PECS 2) block vs. serratus plane block for chronic pain after mastectomy. Anaesthesia. 2019 Dec;74(12):1558–62. https://doi.org/10.1111/anae.14856 PMID:31535722
11. Kaur U, Shamshery C, Agarwal A, Prakash N, Valiveru RC, Mishra P. Evaluation of postoperative pain in patients undergoing modified radical mastectomy with pectoralis or serratus-intercostal fascial plane blocks. Korean J Anesthesiol. 2020 Oct;73(5):425–33. https://doi.org/10.4097/kja.20159 PMID:32987492
12. Bakeer AH, Kamel KM, Abdelgalil AS, Ghoneim AA, Abouel Soud AH, Hassan ME. Modified pectoral nerve block versus serratus block for analgesia following modified radical mastectomy: A randomized controlled trial. J Pain Res. 2020 Jul;13:1769–75. https://doi.org/10.2147/JPR.S252539 PMID:32765052
13. Kubodera K, Fujii T, Akane A, Aoki W, Sekiguchi A, Iwata K, et al. <Editors’ Choice> Efficacy of pectoral nerve block type-2 (Pecs II block) versus serratus plane block for postoperative analgesia in breast cancer surgery: a retrospective study. Nagoya J Med Sci. 2020 Feb;82(1):93–9. https://doi.org/10.18999/nagjms.82.1.93 PMID:32273637
14. Gad M, Abdelwahab K, Abdallah A, Abdelkhalek M, Abdelaziz M. Ultrasound-guided erector spinae plane block compared to modified pectoral plane block for modified radical mastectomy operations. Anesth Essays Res. 2019;13(2):334–9. https://doi.org/10.4103/aer.AER_77_19 PMID:31198256
15. Sinha C, Kumar A, Kumar A, Prasad C, Singh PK, Priya D. Pectoral nerve versus erector spinae block for breast surgeries: A randomised controlled trial. Indian J Anaesth. 2019 Aug;63(8):617–22. https://doi.org/10.4103/ija.IJA_163_19 PMID:31462806
16. Shah SB, Hariharan U, Bhargava AK. Recent trends in anaesthesia and analgesia for breast cancer surgery. Trends Anaesth Crit Care. 2018;20:11–20. https://doi.org/10.1016/j.tacc.2018.03.001 .
17. Sopena-Zubiria LA, Fernández-Meré LA, Valdés Arias C, Muñoz González F, Sánchez Asheras J, Ibáñez Ernández C. Bloqueo paravertebral torácico frente al bloqueopararavertebral torácico más bloqueo de nervios pectoralesen cirugía reconstructiva de mama. Rev Esp Anestesiol Reanim. 2012 Jan;59(1):12–7. https://doi.org/10.1016/j.redar.2011.10.001 PMID:22429631
18. NCT04606147 Effectiveness of Ultrasound Guided Erector Spinae Plane Block Against Ultrasound Guided Serratus Anterior Block in Modified Radical Mastectomy
19. NCT03941223 Regional Anesthesia for Breast Surgery
20. Greene FL, Page DL, Fleming ID, et al., editors. American joint committee on cancer staging manual. 6th ed. New York: Springer; 2002.[Google Scholar] [Ref list]. https://doi.org/10.1007/978-1-4757-3656-4.
21. Forero M, Rajarathinam M, Adhikary SD, Chin KJ. Erector spinae plane block for the management of chronic shoulder pain: a case report. Can J Anaesth. 2018 Mar;65(3):288–93. https://doi.org/10.1007/s12630-017-1010-1 PMID:29134518
22. Sanllorente-Sebastián R, de Vicente-Lorenzo JM, Mediavilla-Herrera FJ, Gutiérrez-García S, Alario-Poza IS, Bustinza-Beaskoetxea Z. Case report: serratus intercostal plane block/BRILMA and sedation for mastectomy in a high risk patient. Rev Esp Anestesiol Reanim (Engl Ed). 2019 Jan;66(1):46–8. Available from: https://www.ncbi.nlm.nih.gov/pubmed/30115502 https://doi.org/10.1016/j.redare.2018.06.009 PMID:30115502
23. Kunigo T, Murouchi T, Yamamoto S, Yamakage M. Spread of injectate in ultrasound-guided serratus plane block: a cadaveric study. JA Clin Rep. 2018;4(1):10. https://doi.org/10.1186/s40981-018-0147-4 PMID:29457120
24. Syed A, Devkaran A, Mehta S, Michail M, Bradpiece H. Post operative analgesia for breast surgery: Intercostal nerve block versus subcutaneous infiltration. Cancer research (Chicago, Ill.). 2009;69(24 Supplement):5052. https://doi.org/10.1158/0008-5472.SABCS-09-5052..
25. Versyck B, van Geffen GJ, Van Houwe P. Prospective double blind randomized placebo-controlled clinical trial of the pectoral nerves (Pecs) block type II. J Clin Anesth. 2017 Aug;40:46–50. https://doi.org/10.1016/j.jclinane.2017.03.054 PMID:28625445
26. Cros J, Sengès P, Kaprelian S, Desroches J, Gagnon C, Labrunie A, et al. (2018). Pectoral i Block Does Not Improve Postoperative Analgesia after Breast Cancer Surgery: A Randomized, Double-Blind, Dual-Centered Controlled Trial. In Regional Anesthesia and Pain Medicine (Vol. 43, pp. 596–604). Lippincott Williams and Wilkins. https://doi.org/10.1097/AAP.0000000000000779.
27. Mirkheshti A, Memary E, Sayyadi S, Samsami M, Motevalli SH. The Effect of Pectoral Nerves Blocks on Narcotic Consumption and Pain Intensity in the Patients Undergoing Breast Cancer Surgery. International Journal of Cancer Management [Internet]. 2020 Apr 19;In Press(In Press). Available from: http://dx.doi.org/10.5812/ijcm.98879

 ORCID
ORCID