Javiera Flores C. MD.1, Alejandro González A. MD.2,*
Recibido: 26-07-2023
Aceptado: 04-10-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 2 pp. 165-170|https://doi.org/10.25237/revchilanestv53n2-12
PDF|ePub|RIS
Urinary catheterization in prolonged general surgery: a literature review
Abstract
Urinary catheterization is commonly used as part of perioperative care of patients undergoing prolonged surgery, however, its routine use is controversial. Urinary retention is a common postoperative complication associated with morbidity and increased health care costs. Nevertheless, urinary catheterization it is not extent of risks hence its indication must be strict. Age, male sex, previous neurologic and prostatic diseases, high opioid and anticholinergic doses, among others, have been described as risk factors for urinary retention. The use of risk scores allows an adequate stratification of patients avoiding preemptive urinary catheterization and minimizing adverse effects associated to this intervention.
Resumen
El uso de cateterización urinaria en pacientes sometidos a cirugías prolongadas es parte habitual de los cuidados anestésicos, sin embargo, su amplio uso es controversial. La retención aguda de orina es una complicación posoperatoria frecuente que se asocia a morbilidad y aumento de los costos. Sin embargo, el uso de cateterización urinaria no está exento de riesgos por lo que su indicación debe ser estricta. Han sido descritos como factores de riesgo de retención urinaria la edad, sexo masculino, patología neurológica o prostática previa, uso de dosis altas de opioides y anticolinérgicos, entre otros. El uso de escalas de riesgos permite una estratificación adecuada de los pacientes para evitar el uso de cateterización urinaria en forma preventiva, minimizando los efectos adversos asociados a esta intervención.
-
Introducción
El uso de catéter urinario (CU) es parte habitual de los cuidados perioperatorios de pacientes sometidos a cirugías de larga duración, para monitorización de diuresis, prevención de retención urinaria aguda y disminución de lesiones vesicales en cirugías que comprometen la zona pélvica. Sin embargo, este manejo es aún controversial[1],[2].
La retención aguda de orina (RAO) se describe frecuentemente dentro de las complicaciones del período posoperatorio de pacientes sometidos a anestesia general. Su incidencia es variable, reportándose en 5% a 70% de los casos[3],[4],[5],[6], en parte debido a la falta de consenso en su definición y a la heterogeneidad de los estudios. La RAO se asocia a complica-
ciones y a aumento de la estadía hospitalaria y de los costos asociados a salud[4],[6]. Se cree que la RAO es responsable del 20,25% de los ingresos no planificados después de cirugía am- bulatoria[5].
Han sido descritos como factores de riesgo de RAO la edad, sexo, tipo y duración de cirugía, algunas comorbilidades y uso de anticolinérgicos, simpaticomiméticos o beta bloqueadores; sin embargo, con resultados que no han podido ser reproducidos sistemáticamente en otros estudios.
Considerando que el uso de CU, tal como la sonda Foley (SF), se asocia a complicaciones mayores como riesgo de infecciones del tracto urinario, trauma uretral, disconfort, entre otros, es que la indicación de cateterización de las vías urinarias debe ser cuidadosamente revisada.
A lo largo de este artículo se revisará la evidencia disponible asociada a la retención urinaria postquirúrgica, repasando su fisiología, factores de riesgo, diagnóstico, manejo y las indicaciones de cateterización urinaria en cirugía general de duración prolongada.
-
Fisiología de la micción
La vejiga se compone de dos partes: cuerpo, formado por el músculo detrusor, y cuello, que se compone de fibras musculares lisas y estriadas que forman el esfínter interno y externo respectivamente. Tiene inervación somática, simpática y parasimpática. La inervación parasimpática causa la relajación del cuello y contracción del detrusor permitiendo la micción, mientras que el sistema simpático hace lo contrario, relajando al detrusor y contrayendo las fibras musculares del cuello. Esta respuesta autonómica se regula por reflejos medulares comandados por centros de control a nivel del puente. La vejiga de un adulto tiene una capacidad promedio de 400-600 ml. Cuando el volumen vesical alcanza los 300 ml de capacidad, se activan receptores de distensión que envían señales hacia la médula y centros de control superior iniciando el reflejo de micción. Cuando excede los 600 ml, la vejiga se sobredistiende y pierde su capacidad contráctil3].
-
Factores de riesgo de retención urinaria
Se han descrito diversos factores que aumentan el riesgo (FR) de desarrollar una RAO en el periodo post operatorio.
Edad
La edad es uno de los principales factores de riesgo de RAO, descrito en múltiples estudios, aumentando el riesgo més de dos veces en pacientes sobre 50 años[3],[5], y más de 3 veces en mayores de 60 años[2],[7],[8],[9],[10]. Probablemente, su asociación se debe a la mayor incidencia de comorbilidades asociadas a disfunción en la micción en pacientes mayores.
Género
Frecuentemente se describe una mayor incidencia de RAO en hombres que en mujeres (OR 2,79), probablemente secundario a patología prostática relacionada al género[7].
Tipo de cirugía
La incidencia de retención urinaria varía mucho según el tipo de cirugía. Las cirugías que presentan una frecuencia mayor de
esta complicación son: las artroplastias de cadera y rodilla, con una incidencia reportada de 10,7%-84%; cirugía anorrectal, entre 1%-52%; reparación de hernia inguinal, entre 5,9%- 38%, probablemente secundario al uso de anestesia espinal, a la proximidad quirúrgica con la inervación vesical o con reflejos dolorosos que aumenten el tono del esfínter interno. Una comparación realizada entre cirugías de cabeza y cuello, tórax y otorrinolaringológicas vs cirugías de abdomen o extremidades ya sea con anestesia general o espinal, mostró que la incidencia aumentó de 4,9% a 11,8 y 10,2% respectivamente[8].
Cabe destacar la cirugía ginecológica, que pese al potencial riesgo de daño a las vías urinarias presenta una baja incidencia de RAO, probablemente secundario al amplio uso de SF profiláctica en este contexto[3],[4].
Comorbilidades
Diversas enfermedades neurológicas como la parálisis cerebral, esclerosis múltiple, lesiones espinales o neuropatía diabética predisponen al desarrollo de retención urinaria[3],[11].
La historia previa de hiperplasia prostática benigna (HPB) o síntomas urinarios bajos (LUTS) ha sido frecuentemente reportada como factor predisponente[5],[8],[10]. En un estudio realizado en pacientes hombres mayores de 60 años, la incidencia de retención urinaria fue de 19,6% en pacientes con historia de HPB vs 5,9% en pacientes sin el antecedente[2],[11]. Otro estudio mostro un odds ratio (OR) de 11 para la historia de HPB[9].
El antecedente de una creatinina basal elevada también ha mostrado asociación con una mayor incidencia de RAO[10].
Los volúmenes vesicales medidos tanto en el período preoperatorio como en el posoperatorio también han sido estudiados. Se ha descrito que un volumen vesical mayor a 150 ml en el período preoperatorio constituye un factor de riesgo significativo para RAO (RR 2,4, IC 1,6-3,5, p < 0,02)[8].
Por otro lado, una capacidad vesical máxima menor se asoció a una mayor incidencia de necesidad de sondeo vesical (RR 7,0 con capacidad vesical menor a 500 ml, IC 2,5-19,1, p < 0,0001)[8].
La presencia de un volumen vesical mayor a 250 ml al llegar a la unidad de recuperación fue descrita como un FR independiente para el desarrollo de RAO (RR 2,1)[8].
-
Fármacos
Algunos fármacos que se usan frecuentemente en el período perioperatorio pueden alterar la función vesical por diversos mecanismos, sin embargo, múltiples estudios han fallado en determinar el efecto significativo de las drogas anestésicas en la incidencia de retención urinaria[8],[12].
– Atropina: produce bloqueo de las contracciones del detrusor e hipotonia, facilitando la distensibilidad y el sobrellenado pasivo de la vejiga[3]. En algunos estudios, su uso ha sido descrito como FR independiente para el desarrollo de RAO[2],[12].
– Clonidina/Dexmedetomidina: tiene efectos a nivel del músculo liso de las vías urinarias, disminuyendo el tono muscular y disminuyendo el output medular[3],[4].
– Alfa bloqueadores como la tamsulosina ha sido descrito como factor protector (OR 0,37, IC 0.15-0,91)[5].
– Opioides: descritos frecuentemente como FR, dependiendo de la vía de administración. La morfina intratecal genera
RAO al bloquear la actividad parasimpática. La incidencia reportada varia entre 42%-80%. Los opioides, administrados por vía intramuscular o endovenosa, han mostrado una menor incidencia de RAO comparado con la vía intra- tecal[6]. Pueden inhibir la liberación de acetilcolina desde los terminales parasimpáticos de los nervios sacros que controlan la contractilidad del detrusor. Se ha descrito una relación directamente proporcional entre la cantidad de opioides usados y el riesgo de retención urinaria[3],[4].
– Anestésicos endovenosos o inhalatorios pueden causar retención urinaria al interferir con el sistema nervioso autónomo. Se ha visto que hipnóticos endovenosos y anestésicos volátiles suprimen el reflejo de la micción y las contracciones del detrusor (propofol, diazepam, tiopental, isofluorano, halotano). Además, el halotano aumenta la capacitancia vesical. Se describe también que estos anestésicos producirían una inhibición a nivel pontino y en el control voluntario de la micción[3],[4].
-
Fluidos intravenosos
Un aporte generoso de volumen en el intraoperatorio puede causar retención por sobre distención de la vejiga. Es conocido que la capacidad de contracción de la vejiga es óptima con aproximadamente 300 ml. Con volúmenes mayores, la capacidad contráctil de la vejiga disminuye significativamente. En un estudio, la limitación de fluidos a 250 ml redujo la incidencia de retención de 15 a 4, comparado con los pacientes que recibieron volumen endovenoso “ad libitum”. En otro trabajo, volúmenes sobre 1.200 ml aumentaron la incidencia de retención. Sin embargo, trabajos randomizados han fallado en demostrar significancia entre el volumen infundido en el intraoperatorio y la incidencia de RAO, especialmente en pacientes de bajo ries- go[2],[4].
En pacientes de alto riesgo de retención se ha visto que cantidades aumentadas de fluidos perioperatorios aumentan el riesgo de retención. A modo de ejemplo, en cirugía de hernia inguinal, el aporte de más de 750 ml durante la primera hora aumento 2,3 veces el riesgo de retención urinaria[4].
-
Duración de la cirugía
Este es un tema aún controversial. Algunos trabajos han mostrado asociación positiva entre la duración de la anestesia y el riesgo de retención. Sin embargo, en otros estudios, al ajustar por variables confundentes, se ha visto que la retención urinaria tiene que ver con una mayor administración de fluidos endovenosos más que con la duración de la anestesia per se.
En un estudio randomizado controlado (RCT) fue el FR mo- dificable más significativo (RR 30-60 min 4,5, IC 1,8-11,3, RR > 60 min 5,1, IC 2,1-12,8, p < 0,001)[8].
En otro estudio realizado en pacientes sometidos a hernio- plastia laparoscópica, anestesias mayores a dos horas fueron asociadas a mayor incidencia de RAO (OR 0,75) cuando se analizó como FR independiente[8], y en cirugía coloproctológica mostró un aumento del riesgo de 1,27 veces[7].
-
Dolor
El aumento de la actividad simpática producto del dolor posoperatorio inhibe las contracciones del detrusor y aumenta el tono de los esfínteres, con lo cual aumenta el riesgo de retención. Un manejo adecuado del dolor posoperatorio puede incidir también en la aparición de retención urinaria, especialmente en pacientes de alto riesgo[4].
-
Diagnóstico de retención urinaria
La definición de retención urinaria es variable entre los estudios. Se basa en 3 pilares: historia clínica, examen físico y examen ecográfico, recientemente introducido[6].
Historia clínica
El dolor o “disconfort” en la zona pélvica es un síntoma frecuentemente manifestado por pacientes con retención urinaria; sin embargo, en el contexto perioperatorio, estos síntomas pueden no ser manifestados en un gran porcentaje de los casos debido a sedación o los efectos residuales de la anestesia neu- roaxial[3],[4]. Se ha reportado que hasta 60% de los pacientes que llegan a la unidad de recuperación no manifiestan síntomas pese a tener volúmenes urinarios elevados medidos por ultra- sonido[3] y que la correlación con el examen físico es de solo 54%[4}.
Examen físico
La palpación de globo vesical o percusión mate en la región suprapúbica han sido descritos como signos clásicos de retención urinaria; sin embargo, son poco sensibles, detectándose solo con volúmenes de al menos 500 ml[3].
Ultrasonido (US)
Esta técnica diagnóstica recientemente introducida ha demostrado una buena correlación con los volúmenes urinarios medidos por cateterización (actualmente, el gold estándar o estándar de referencia). Ha demostrado ser mejor que el examen físico, especialmente en pacientes obesos o con cirugías abdominales previas y ha reducido los tiempos de alta hospitalaria y primera micción en pacientes con alto riesgo de RAO posoperatoria. Sin embargo, es una técnica operador dependiente, que requiere una curva de aprendizaje y consistencia entre opera- dores[3].
Cateterización urinaria diagnóstica
Cabe mencionar que el estándar diagnóstico es la cateterización urinaria única, la cual constituye una herramienta diagnóstica y terapéutica; sin embargo, al ser un procedimiento invasivo, no está exento de riesgos como infecciones, trauma, prostatitis y disconfort del paciente[3],[6].
En pacientes con factores de riesgo se debe tener un alto índice de sospecha en el contexto posoperatorio, dado lo difícil que puede ser el diagnóstico en este período. Pese a que hay poca consistencia entre la historia previa de retención urinaria y el riesgo de desarrollarla en el posoperatorio, en contexto de cirugía ambulatoria y protocolos ERAS es útil un screening de disfunción urinaria preoperatoria o historia de retención[4].
La mejor manera de diagnosticar una retención urinaria de manera no invasiva es con el uso de US, el cual permite una medición rápida y acertada del volumen urinario.
El diagnóstico e intervención precoz previene el daño vesical y disfunción urinaria permanente; sin embargo, debe ser confrontado con el riesgo de daño e infección urinaria con el uso de SF. En un RCT se evaluó el efecto del uso de US en evaluar la capacidad vesical máxima y prevenir la cateterización urinaria innecesaria, reduciendo el riesgo en forma significativa (RR 0,73 IC 0,55-0,96, p = 0,025)[8]. Volúmenes urinarios mayores a 600 ml han sido recomendados como corte para instalación de una SF[4],[8].
-
Complicaciones de la retención urinaria
La RAO se asocia a múltiples complicaciones con consecuencias, que podrían ser severas, en la recuperación de los pacientes sometidos a anestesia general.
Respuesta autonómica: la sobre distensión vesical puede provocar una respuesta dolorosa, causando una descarga autonómica con alteraciones del ritmo cardíaco, vómitos, hipo- tensión/hipertensión, asistolia, entre otros. Se ha visto que la retención urinaria prolonga la estadía hospitalaria y el tiempo al alta en pacientes sometidos a colecistectomías electivas ambulatorias en 19% de los pacientes[3].
Infecciones: el desarrollo de infecciones del tracto urinario puede ser un resultado directo de la retención urinaria o secundaria a la necesidad de uso de SF. La incidencia de bacteriemia después de una cateterización urinaria única alcanza hasta 8%[3]. El riesgo de infección aumenta más de dos veces en pacientes cateterizados vs no cateterizados[1]. Por otro lado, la incidencia de síntomas urinarios aumenta 2,4 veces en pacientes cateterizados[1].
-
Prevención y manejo de la retención urinaria
Se basa en una adecuada estratificación de riesgo. Los pacientes que no presenten factores de riesgo para el desarrollo de retención urinaria y que no se sometan a una cirugía donde la monitorización de la diuresis, el recambio de fluidos y la necesidad de una vejiga vacía sean relevantes para el manejo, puede omitirse el uso de SF pese a ser sometidos a cirugías de larga duración dado que la incidencia de retención en población de bajo riesgo es menor al 1% comparado con 15% en los pacientes de alto riesgo[3].
Se propone un esquema de manejo en la Figura 1. Con una adecuada estratificación de riesgo los pacientes que tienen un bajo riesgo de retención urinaria podrían ser dados de alta sin necesidad de orinar. En población general menos del 1% de los pacientes desarrollara retención urinaria[3]. La mayoría de los pacientes orinará en las primeras 3 h posterior a la cirugía. El requerimiento de orinar antes del alta retrasa el alta hospitalaria en 5%-6% de los pacientes, lo cual puede ser evitado con un protocolo establecido e instrucciones claras a los pacientes de reconsultar en el servicio de urgencia si la micción no se produce en las siguientes 6-8 h. Los pacientes de alto riesgo pueden ser monitorizados con US vesical, para realizar un sondeo si el volumen supera los 600 ml. Los pacientes cateterizados previamente tienen un mayor riesgo de retención (25%)[4].
Los pacientes de alto riesgo por otro lado, deben orinar en las primeras 8 h postcirugía, por lo que, deben ser evaluados con US y cateterizados cuando el volumen vesical ha alcanzado
los 600 ml o ser enviados a domicilio con indicación de consultar si es que no se ha producido la micción en este período de tiempo.
Se han estudiado alternativas al uso de SF. En un estudio realizado en cirugía ginecológica se comparó el uso de cateterismo intermitente, cateterismo permanente y drenaje suprapú- bico. El riesgo de infección disminuyó con el uso de dispositivos suprapúbicos (RR 0,39, IC 0,24-0,65, p 0,0003); sin embargo, la tasa de hematuria fue considerablemente mayor (RR 4,49, IC 1,16-17,42, p 0,03). La cateterización permanente aumento el riesgo de re-cateterización comparado con el drenaje suprapú- bico (RR2,95, IC 1,22-7,11, p 0,02) y tuvo una mayor tasa de ITU comparado con la cateterización intermitente[13].
-
¿Por cuánto tiempo debe mantenerse la SF?
Tanto el cateterismo intermitente como permanente se han asociado a ITU.
En contexto de cirugía ambulatoria, el cateterismo intermitente es una alternativa razonable. En pacientes hospitalizados lo ideal es no sobrepasar las 24 h de SF[3],[11],[14],[15]. El uso de US puede ayudar a evaluar volúmenes sobre 600 ml y la necesidad de cateterismo. La remoción precoz de SF ha demostrado menores estadías hospitalarias y menor tiempo a deam- bulación[14].
-
¿Es necesaria la cateterización en la época de protocolos ERAS?
Si bien el uso de SF ayuda a monitorizar la diuresis, a evitar la RAO en casos seleccionados y a vaciar la vejiga facilitando el campo quirúrgico, los riesgos asociados y la baja incidencia de RAO en pacientes sin FR hacen cuestionar su uso en todos los pacientes. A modo de ejemplo, en nefrectomías robóticas, la incidencia de RAO fue igual entre grupos con SF y sin SF, tanto inmediata como a 30 días. Tampoco hubo diferencias en la incidencia de ITU ni en la movilización temprana de los pacien- tes[16].
Con estos datos, parece razonable omitir el uso de SF en pacientes sin FR que irán a ser dados de alta en período breve. De considerarse necesario el uso de SF, esta no debería permanecer por más de 24 h. No está clara la indicación en el caso de cirugías con anestesia peridural[17],[18].
-
Conclusión
El cuidado anestésico en los últimos años se ha dedicado a potenciar la recuperación acelerada de los pacientes y evitar las conductas innecesarias, de manera de disminuir los riesgos, la estadía hospitalaria y los costos asociados a salud. La RAO es un fenómeno poco frecuente en población general pese a ser sometidos a cirugías de larga duración. El manejo protocolizado de estos pacientes, con una adecuada estratificación de riesgo basada en factores predisponentes permite evitar el uso de SF de manera preventiva, evitando de esta manera los efectos adversos de esta intervención. Cabe destacar, que el cuidado posoperatorio debe ser siempre individualizado, considerando las alternativas de acceso a centros de salud y riesgo particular de cada paciente.
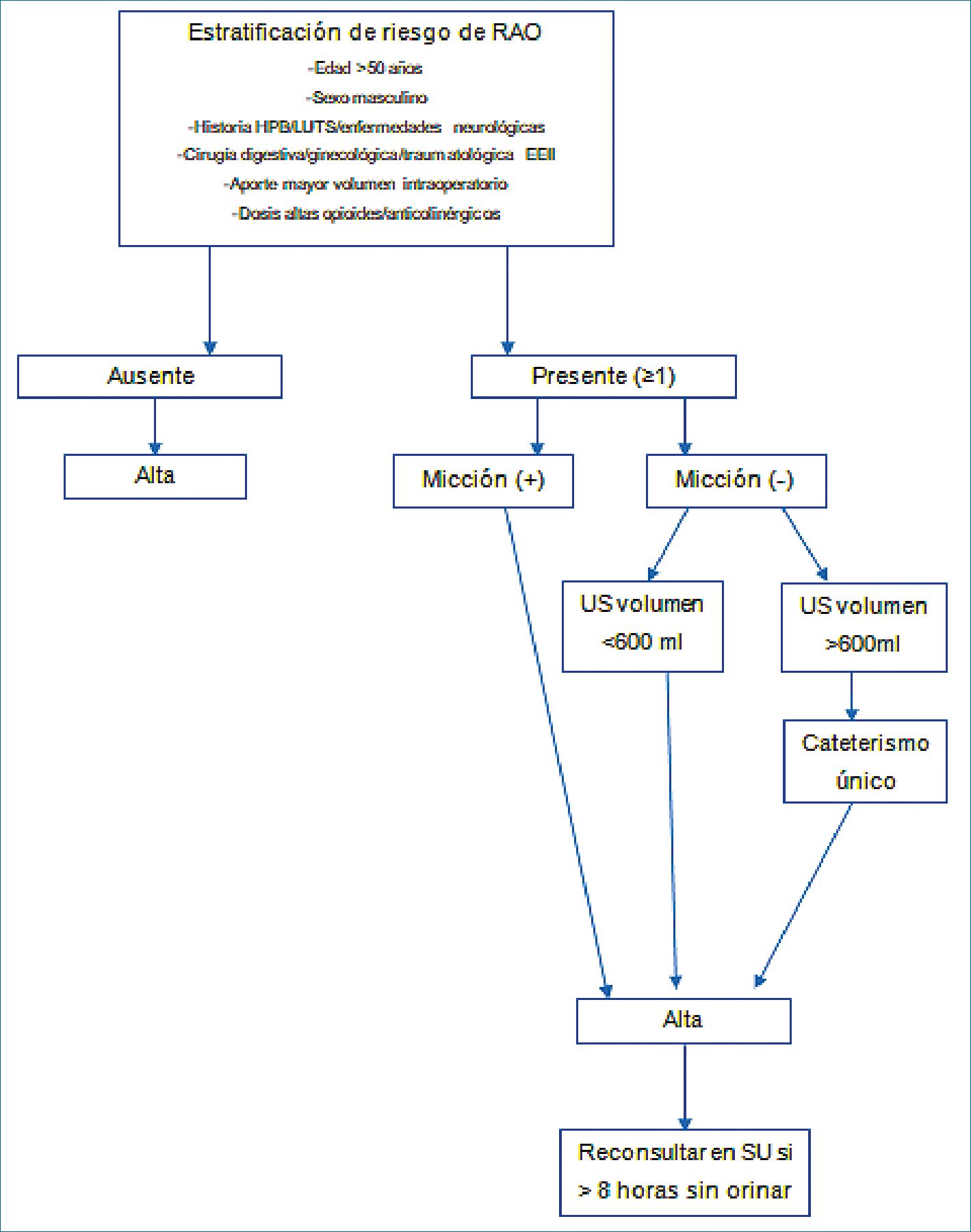
Figura 1. Protocolo de manejo en unidad de recuperación. Adaptado de Baldini et al.
El artículo no ha sido enviado a otra revista nacional o internacional.
Financiamiento: ninguno.
Conflicto de intereses: los autores declaran no tener conflictos de interés.
-
Referencias
1. Nevins EJ, Nevins EG, Moori PL, Strong C, Al-Zubaidi S, Wayman J, et al. Urethral Catheterization Is Not Necessary During Nononcological Laparoscopic Pelvic Surgery. J Patient Saf. 2019 Dec;15(4):e21–3. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1097/PTS.0000000000000612 https://doi.org/10.1097/PTS.0000000000000612 PMID:31765331
2. Fafaj A, Lo Menzo E, Alaedeen D, Petro CC, Rosenblatt S, Szomstein S, et al. Effect of Intraoperative Urinary Catheter Use on Postoperative Urinary Retention After Laparoscopic Inguinal Hernia Repair: A Randomized Clinical Trial. JAMA Surg. 2022 Aug;157(8):667–74. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1001/jamasurg.2022.2205 https://doi.org/10.1001/jamasurg.2022.2205 PMID:35704302
3. Baldini G, Bagry H, Aprikian A, Carli F, Warner D, Warner M. Postoperative urinary retention: anesthetic and perioperative considerations. Anesthesiology. 2009 May;110(5):1139–57. https://doi.org/10.1097/ALN.0b013e31819f7aea PMID:19352147
4. Darrah DM, Griebling TL, Silverstein JH. Postoperative urinary retention. Anesthesiol Clin. 2009 Sep;27(3):465–84. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1016/j.anclin.2009.07.010 https://doi.org/10.1016/j.anclin.2009.07.010 PMID:19825487
5. Scott AJ, Mason SE, Langdon AJ, Patel B, Mayer E, Moorthy K, et al. Prospective Risk Factor Analysis for the Development of Post-operative Urinary Retention Following Ambulatory General Surgery. World J Surg. 2018 Dec;42(12):3874–9. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1007/s00268-018-4697-4 https://doi.org/10.1007/s00268-018-4697-4 PMID:29947990
6. de Boer HD, Detriche O, Forget P. Opioid-related side effects: postoperative ileus, urinary retention, nausea and vomiting, and shivering. A review of the literature. Best Pract Res Clin Anaesthesiol. 2017 Dec;31(4):499–504. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1016/j.bpa.2017.07.002 https://doi.org/10.1016/j.bpa.2017.07.002 PMID:29739538
7. Tam V, Lutfi W, Morgan K, Vasan R, Scaife R, Mahler B, et al. Impact of Enhanced Recovery Pathways and early urinary catheter removal on post-operative urinary retention. Am J Surg. 2020 Nov;220(5):1264–9. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1016/j.amjsurg.2020.06.057 https://doi.org/10.1016/j.amjsurg.2020.06.057 PMID:32680619
8. Brouwer TA, van Roon EN, Rosier PF, Kalkman CJ, Veeger N. Postoperative urinary retention: risk factors, bladder filling rate and time to catheterization: an observational study as part of a randomized controlled trial. Perioper Med (Lond). 2021 Jan;10(1):2. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1186/s13741-020-00167-z https://doi.org/10.1186/s13741-020-00167-z PMID:33397468
9. Sivasankaran MV, Pham T, Divino CM. Incidence and risk factors for urinary retention following laparoscopic inguinal hernia repair. Am J Surg. 2014 Feb;207(2):288–92. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1016/j.amjsurg.2013.06.005 https://doi.org/10.1016/j.amjsurg.2013.06.005 PMID:24200291
10. Merlo A, Fano R, Strassle PD, Bui J, Hance L, Teeter E, et al. Postoperative Urinary Retention in Patients Undergoing Lung Resection: Incidence and Risk Factors. Ann Thorac Surg. 2020 Jun;109(6):1700–4. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1016/j.athoracsur.2019.12.056 https://doi.org/10.1016/j.athoracsur.2019.12.056 PMID:32057810
11. Lee Y, McKechnie T, Springer JE, Doumouras AG, Hong D, Eskicioglu C. Optimal timing of urinary catheter removal following pelvic colorectal surgery: a systematic review and meta-analysis. Int J Colorectal Dis. 2019 Dec;34(12):2011–21. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1007/s00384-019-03404-0 https://doi.org/10.1007/s00384-019-03404-0 PMID:31707560
12. Dreijer B, Møller MH, Bartholdy J. Post-operative urinary retention in a general surgical population. Eur J Anaesthesiol. 2011 Mar;28(3):190–4. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1097/EJA.0b013e328341ac3b https://doi.org/10.1097/EJA.0b013e328341ac3b PMID:21206278
13. Li M, Yao L, Han C, Li H, Xun Y, Yan P, et al. The incidence of urinary tract infection of different routes of catheterization following gynecologic surgery: a systematic review and meta-analysis of randomized controlled trials. Int Urogynecol J. 2019 Apr;30(4):523–35. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1007/s00192-018-3791-3 https://doi.org/10.1007/s00192-018-3791-3 PMID:30374534
14. Chen SF, Wang PH, Kuo SC, Chen YC, Sia HJ, Lee PH, et al. Early and Standard Urinary Catheter Removal After Gynecological Surgery for Benign Lesions: A Quasi-Experimental Study. Clin Nurs Res. 2022 Mar;31(3):489–96. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1177/10547738211044500 https://doi.org/10.1177/10547738211044500 PMID:34514876
15. Lang P, Quezada Y, Whiteside J. Urinary Catheter Management Approaches Among Women Undergoing Benign Gynecologic Surgery: A Randomized Trial. Female Pelvic Med Reconstr Surg. 2020 Dec;26(12):e73–7. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1097/SPV.0000000000000781 https://doi.org/10.1097/SPV.0000000000000781 PMID:31688528
16. Tremblais B, Dominique I, Terrier JE, Ecochard R, Hacquard H, Ruffion A, et al. Robot-assisted Partial Nephrectomy: Is Routine Urinary Catheterization Still Mandatory in the Era of Enhanced Recovery? Urology. 2019 Feb;124:148–53. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1016/j.urology.2018.09.028 https://doi.org/10.1016/j.urology.2018.09.028 PMID:30300660
17. Roulet M, Delbarre B, Vénara A, Hamy A, Barbieux J. Urine drainage management in colorectal surgery. J Visc Surg. 2020 Aug;157(4):309–16. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1016/j.jviscsurg.2020.05.002 https://doi.org/10.1016/j.jviscsurg.2020.05.002 PMID:32446914
18. Xie N, Hu Z, Ye Z, Xu Q, Chen J, Lin Y. A systematic review comparing early with late removal of indwelling urinary catheters after pelvic organ prolapse surgery. Int Urogynecol J. 2021 Jun;32(6):1361–72. Available from: https://doi-org.pucdechile.idm.oclc.org/10.1007/s00192-020-04522-y https://doi.org/10.1007/s00192-020-04522-y PMID:32886172

 ORCID
ORCID