Melisa Reyes L.1, Eduardo Vega P.1, Tania Contreras L.1, Paula León S.1, María Francisca Elgueta L.1,*
Recibido: 21-11-2023
Aceptado: 16-12-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 2 pp. 94-99|https://doi.org/10.25237/revchilanestv53n2-17
PDF|ePub|RIS
Pain in patients with Chronic Kidney Disease, which analgesics should be indicated and which should not?
Abstract
The prevalence of chronic non-cancer pain in Chile corresponds to 34.7%, which increases in the population with Chronic Kidney Disease, with implications for people’s quality of life. The pharmacodynamics and pharmacokinetics of some analgesics are altered in this population with risk of adverse effects, so the stage of the disease, type of pain, intensity of pain and routes of administration must be taken into consideration. This review aims to define which analgesics are recommended for use, which ones not to use and ideally to avoid in Chronic Kidney Disease.
Resumen
La prevalencia de dolor crónico no oncológico en Chile corresponde al 34,7%, la cual aumenta en la población con Enfermedad Renal Crónica, con implicancias en la calidad de vida de las personas. La farmacodinamia y farmacocinética de algunos analgésicos se ve alterada en esta población con riesgo de efectos adversos, por lo que hay que tener en consideración la etapa de la enfermedad, tipo de dolor, intensidad de este y vías de administración. Esta revisión tiene por objetivo definir qué analgésicos están recomendados para uso, cuáles no usar e idealmente evitar en Enfermedad Renal Crónica.
-
Introducción
En Chile, de acuerdo con la Encuesta Nacional de Salud 2016-2017, el 3,2% de la población vive con enfermedad renal crónica (ERC) en etapas 3a-5 (Tabla 1)[1],[2]. Considerando que la prevalencia de dolor crónico no oncológico en Chile corresponde al 34,7%[3] es interesante conocer que esta cifra aumenta hasta 60% en la subpoblación de pacientes sometidos a diálisis[4],[5], llegando hasta 73% para el dolor agudo[6],[7]. Es importante mencionar que esta alta prevalent cia de dolor crónico en pacientes con ERC, no se asocia con la edad, sexo o raza.
El dolor crónico en la ERC es una patología habitualmente subdiagnosticada y subtratada, asociándose a una peor calidad de vida, insomnio y síntomas depresivos[8]. Uno de los instrumentos de autorreporte frecuentemente utilizados para evaluar los síntomas comunes en pacientes con ERC en diálisis, es la escala Edmonton Symptom Assessment System-Revised: Renal (ESAS-r: Renal)[9], haciendo especial énfasis en la detección de dolor mediante su cuantificación y la localización.
Tabla 1. Categorías de enfermedad renal crónica según velocidad de filtración glomerular[2]
| Categoría de VFG en ERC | VFG (mL/min/1,73 m2) | Término |
| G1 | > 90 | Normal |
| G2 | 60 – 89 | Levemente disminuida |
| G3a | 45 – 59 | Leve a moderadamente disminuida |
| G3b | 30 – 44 | Moderada a severamente disminuida |
| G4 | 15 – 29 | Severamente disminuida |
| G5 | < 15 | Falla renal |
VFG: Velocidad de Filtración Glomerular; ERC: Enfermedad Renal Crónica; G1-5: grado 1-5.
Tabla 2. Causas de dolor crónico en ERC
| Asociada a la enfermedad renal | Enfermedad poliquística renalAmiloidosis
Calcifilaxis |
|
| Asociado a comorbilidades | Musculoesquelético | ArtrosisOsteoporosis
Síndrome de piernas inquietas Osteodistrofia renal Osteomielitis |
| Isquémico | Enfermedad vascular periféricaVasculitis | |
| Neuropático | Síndrome del túnel del carpo Neuropatía diabética periférica | |
| Asociado a diálisis | Hemodiálisis | CefaleaCalambres
Neuropatía isquémica por fístulas arterio- venosas Infección de catéter venoso central |
| Peritoneo-diálisis | Dolor por distensión abdominalDolor lumbar
Peritonitis |
-
Causas de dolor en ERC
Existen múltiples causas de dolor crónico en pacientes con ERC, pudiendo estar asociadas a la causa de la falla renal, co- morbilidades, o a la diálisis. La principal causa de dolor en la ERC es de origen musculoesquelético[10],[11] (Tabla 2).
-
Tratamiento multidisciplinario
El tratamiento del dolor crónico debe contemplar un manejo multidisciplinario considerando la farmacoterapia, psicoterapia, kinesioterapia, terapia ocupacional y la realización de procedimientos intervencionales si correspondiese[11],[12],[13].
-
Manejo farmacológico
Existen principios básicos del manejo farmacológico de dolor crónico y algunas consideraciones especiales a tener en esta población[8],[11]:
• Al planificar un esquema analgésico se debe conocer la etapa de la ERC, el tipo del dolor (nociceptivo, neuropático o
mixto) y su intensidad.
• Preferir la ruta oral o transdérmica y evitar la vía intravenosa para brindar una mayor seguridad del tratamiento y disminuir el potencial abuso de fármacos.
• Al indicar fármacos de forma horaria, hay que considerar que algunos medicamentos son eliminados mediante la diálisis, por lo que se convendría indicarlos posterior a esta (ej. gabapentinoides).
• Los fármacos de liberación prolongada no están recomendados para pacientes con VFG < 30 ml/min/1,73m2.
• No existen estudios sobre la seguridad de uso prolongado de analgésicos y adyuvantes en población con ERC, por lo que deben ser constantemente evaluados en su eficacia y perfil de seguridad.
-
¿Qué fármacos no debemos usar en la ERC?
Algunos analgésicos deben ser evitados en los pacientes con ERC debido a la alteración de su farmacocinética y farma- codinamia sumado al riesgo de toxicidad por su acumulación. Se presentan en la Tabla 3[8],[12].
| Tabla 3. Fármacos contraindicados en ERC | |
| Fármaco | Efectos adversos reportados |
| AINEs: incluyendo los COX2 selectivos | Renal: Disminución aguda de la VFG, hipertensión, hiperkalemia Gastrointestinales: Úlceras, hemorragia digestiva alta Cardiovasculares: Trombosis, eventos isquémicos |
| Morfina | MiocloníasAcumulación de dos metabolitos activos (M3G y M6G) y depresión del sistema nervioso central y respiratorio
Depresión respiratoria Muerte |
| Codeína | HipotensiónDisminución del clearance de eliminación con potencial acumulación de metabolitos tóxicos y depresión del sistema nervioso central y respiratorio
Muerte |
| Tapentadol | Disminución del clearance de eliminación del metabolito (tapentadol-O-glucuronido). Uso no recomendado con clearence de creatinina < 30ml/min |
| Meperidina | MiocloníasAlteración estado mental
Prolongación del metabolito normeperidina asociado a convulsiones |
| AINES: antiinflamatorios no esteroidales; COX: ciclooxigenasa; VFG: velocidad de filtración glomerular; M3G: Morfina 3 glucuronido y M6G: Morfina 6 glucuronido.*AINEs: No hay ninguna dosis de AINEs que se considere segura en pacientes con VFG disminuida. Los AINEs tópicos proporcionan alivio eficaz del dolor sin los efectos sistémicos de los AINES orales en la ERC. Se podría considerar el uso de AINES en ERC etapa 5, con extrema precaución, adecuada indicación y por un período de tiempo acotado, teniendo en cuenta la función renal residual y evitando el uso de otros fármacos nefrotóxicos simultáneamente[8],[10],[11]. | |
-
Fármacos que se pueden utilizar en ERC
Es un antipirético y analgésico. Su mecanismo de acción es poco claro. Se piensa que es un inhibidor de la ciclooxigena- sa, especialmente sobre COX3 en el sistema nervioso central. Tendría posible interacción con receptores NMDA, vías sero- toninérgicas y receptores cannabinoides. Su metabolismo es hepático por el citocromo P450 y menos del 5% del fármaco es excretado sin cambios por el riñón. Es removido por la hemo- diálisis, pero no por la peritoneodiálisis. En pacientes con ERC no requiere ajuste de dosis, ya que es seguro independiente de la VFG.
– Dosis habitual: 500 mg – 1g cada 6-8 h vía oral o endovenoso. No superar 3-4 g diarios en pacientes con función hepática normal y 2 g en daño hepático crónico.
-
2. Opioides fuertes
Con respecto al uso de opioides, es preferible el uso de opioides fuertes en dosis bajas por sobre el uso de opioides débiles por su riesgo de acumulación[8],[11].
Es un opioide sintético. Actúa como agonista del receptor p, antagonista del receptor NMDA e inhibidor de recaptura de monoaminas, por lo que podría ser también eficaz en el manejo del dolor neuropático. Tiene metabolismo hepático y excreción principalmente gastrointestinal, con 20% de excreción renal. En pacientes anúricos, la excreción es 100% gastrointestinal. Sus metabolitos no se acumulan en la ERC. La hemodiálisis no disminuye significativamente sus niveles plasmáticos, no requi- riéndose dosis adicionales post diálisis. Se debe ajustar la dosis
en pacientes con ERC etapa 5, disminuyéndola al 50%. Existe el riesgo de prolongación de QT por lo que se debe considerar realizar un electrocardiograma previo a su uso y de seguimiento en 2-4 semanas de iniciado el tratamiento con este opioide.
– Dosis habitual: Iniciar con 1-2 mg cada 12 a 24 h vía oral.
Es un opioide sintético potente de vida media corta. Su mecanismo de acción es por agonismo del receptor p. Es metabo- lizado por el hígado, sin metabolitos activos. Su excreción es principalmente hepática, con 5%-10% de excreción renal. No es removido por la hemodiálisis. Es un fármaco seguro independiente de la VFG por lo que no requiere ajuste de dosis. De todas formas, como margen de seguridad se debiese considerar una reducción al 75% de la dosis en pacientes con VFG 10-50 ml/min y una reducción al 50% en pacientes con VFG menor de 10 ml/min o en diálisis. Tener siempre en cuenta que el fentanyl actúa rápido y deja de actuar rápido, generando muy rápidamente tolerancia.
– Dosis habituales en pacientes que necesitan terapia prolongada con opioides: Iniciar parche transdérmico en dosis de 12 ug/h transdérmico cada 72 h.
Opioide semisintético potente. Es un agonista parcial p y antagonista del receptor k. Tiene metabolismo hepático, siendo la norbuprenorfina su metabolito activo. Su excreción es principalmente gastrointestinal, con 10%-30% de excreción renal sin cambios. No es removida por la hemodiálisis. Es segura independiente de la VFG no requiriéndose ajuste de dosis.
– Dosis habitual: Iniciar con un parche transdérmico de 5 ug/h cada 7 días.
-
3. Gabapentinoides
Pregabalina y Gabapentina[8],[10],[11],[12],[13],[14] Son fármacos análogos del neurotransmisor ácido gamma- aminobutírico (GABA), que actúan bloqueando los canales calcio voltaje dependiente inhibiendo la liberación de múltiples neurotransmisores (ej. sustancia P, glutamato, aspartato, péptido relacionado con el gen de la calcitonina), sin tener acción sobre los receptores GABA. No son metabolizados y su excreción renal no tiene cambios. Ambos son removidos con la hemodiálisis por lo que, se recomienda administrar la dosis del día de la diálisis posterior a esta (Ej: gabapentina 200-300 mg postdiálisis). Estos fármacos son utilizados como primera línea para el manejo del dolor neuropático, siendo útiles también para el manejo del prurito asociado a la uremia. Requieren ajuste de dosis por riesgo de neurotoxicidad y lesión renal aguda secundaria a rabdomiolisis. Idealmente iniciar con dosis bajas (Ej: pregabalina 25 mg/día, gabapentina 100 mg/día) e ir ajustando según tolerancia y eficacia. Algunos autores recomiendan dosis más conservadoras, pudiendo espaciar su uso día por medio (Tabla 4).
-
4. Antidepresivo
Antidepresivo tricíclico (ATC) que actúa como inhibidor de la recaptura de noradrenalina y serotonina, además tiene efecto sobre receptores colinérgicos, NMDA y de sodio. Tiene metabolismo hepático, produciendo múltiples metabolitos, siendo de estos sólo la nortriptilina el único activo. La excreción de metabolitos es a nivel renal, y no es removido por la hemodiá- lisis. El uso de ATC en la ERC se reserva para pacientes en que no han tenido alivio del dolor neuropático con dosis seguras de gabapentina o pregabalina. Su uso es seguro independiente de la VFG, no requiriendo ajuste de dosis. Se recomienda iniciar dosis bajas dado el riesgo de efectos adversos anticolinérgicos. Debemos considerar que la amitriptilina está relativamente contraindicada en pacientes con enfermedad cardiovascular, en especial en trastornos de la conducción.
– Dosis habitual: Iniciar con 12,5-25 mg al día vía oral (VO), hasta dosis máximas de 100-150 mg/d.
Es un anestésico que en dosis subanestésicas tiene acción
analgésica, antiinflamatoria y antidepresiva. Es un antagonista del receptor NMDA principalmente. Sin embargo, también ejerce efectos sobre receptores opioides, noradrenérgicos, colinér- gicos, nicotínicos y muscarínicos. Su metabolismo es hepático, produciendo dos metabolitos, siendo la norketamina su meta- bolito activo. Los metabolitos son excretados por vía renal y son removidos parcialmente con la diálisis. Es un fármaco seguro en la ERC por lo que no requiere ajuste de dosis. Es útil para el manejo de dolor neuropático refractario a fármacos de primera y segunda línea.
– Dosis habitual:
• Oral: 0,5 mg/kg cada 8-12 h.
• Subcutánea: 0,05-0,15 mg/kg por hora hasta por 7 días.
• Endovenosa en bolo: 0,15-0,25 mg/kg.
• Endovenosa en infusión: 0,15-0,5mg/kg/h.
-
Fármacos que es ideal evitar en ERC
Hay fármacos con limitada información para su uso en la ERC. Si bien existen recomendaciones de ajuste de dosis para cada etapa de ERC, la recomendación más frecuente es la de evitar su uso.
-
1. Opioides débiles
Tramadol (acción corta)[8],[10],[11],[12],[16]
Opioide sintético débil. Es un agonista del receptor p, e inhibidor de recaptura de serotonina y norepinefrina. Su metabolismo es hepático por CYP2D6, produciendo un metabolito activo (M1) y uno inactivo (M2). Su excreción es 90% vía renal (60% como metabolitos, 30% sin cambios), y es removido por la he- modiálisis. Corresponde a un fármaco controversial en su uso en la ERC. Suele ser indicado para dolor crónico leve a moderado. Dado su eliminación principalmente renal, en los pacientes con ERC la vida media de eliminación aumenta, con riesgo de acumulación de metabolitos, lo que conlleva a un mayor riesgo de convulsiones, depresión respiratoria y síndrome serotoninér- gico. Algunos autores recomiendan evitar su uso sobre todo en la ERC avanzada (etapa 4 y 5), mientras que otros recomiendan su uso con precaución y ajuste de dosis. No se recomienda la presentación de liberación prolongada, ya que no ha sido estudiado en ERC y puede presentarse un mayor riesgo de toxicidad.
– Dosis habitual: Tramadol de liberación inmediata 50 – 100 mg cada 6 a 8 h VO.
Tabla 4. Dosis máxima de gabapentinoides ajustada por VFG
| VFG (ml/min/1,73m2) | Dosis máxima recomendada | |
| Pregabalina | 30 – 60 | 150 mg cada 12 h VO |
| 15 – 30 | 150 mg día VO – día por medio | |
| < 15 | 75 mg día VO – día por medio | |
| Gabapentina | 50 – 80 | 600 mg cada 8 h VO |
| 30 – 50 | 300 mg cada 8 h VO | |
| 15 – 30 | 300 mg cada 12 h VO | |
| < 15 | 300 mg al día VO (post diálisis) |
Tabla 5. Resumen fármacos recomendados en ERC.
| Recomendado | Uso con precaución | No usar |
| Paracetamol | AINEs (incluye COX-2 selectivos) | |
| Fentanyl | Tramadol | Codeína – Tramadol |
| Metadona | Morfina | |
| Buprenorfina | Hidrocodona | |
| Gabapentina | Tapentadol | |
| Pregabalina | Meperidina | |
| Amitriptilina | Duloxetina | Duloxetina |
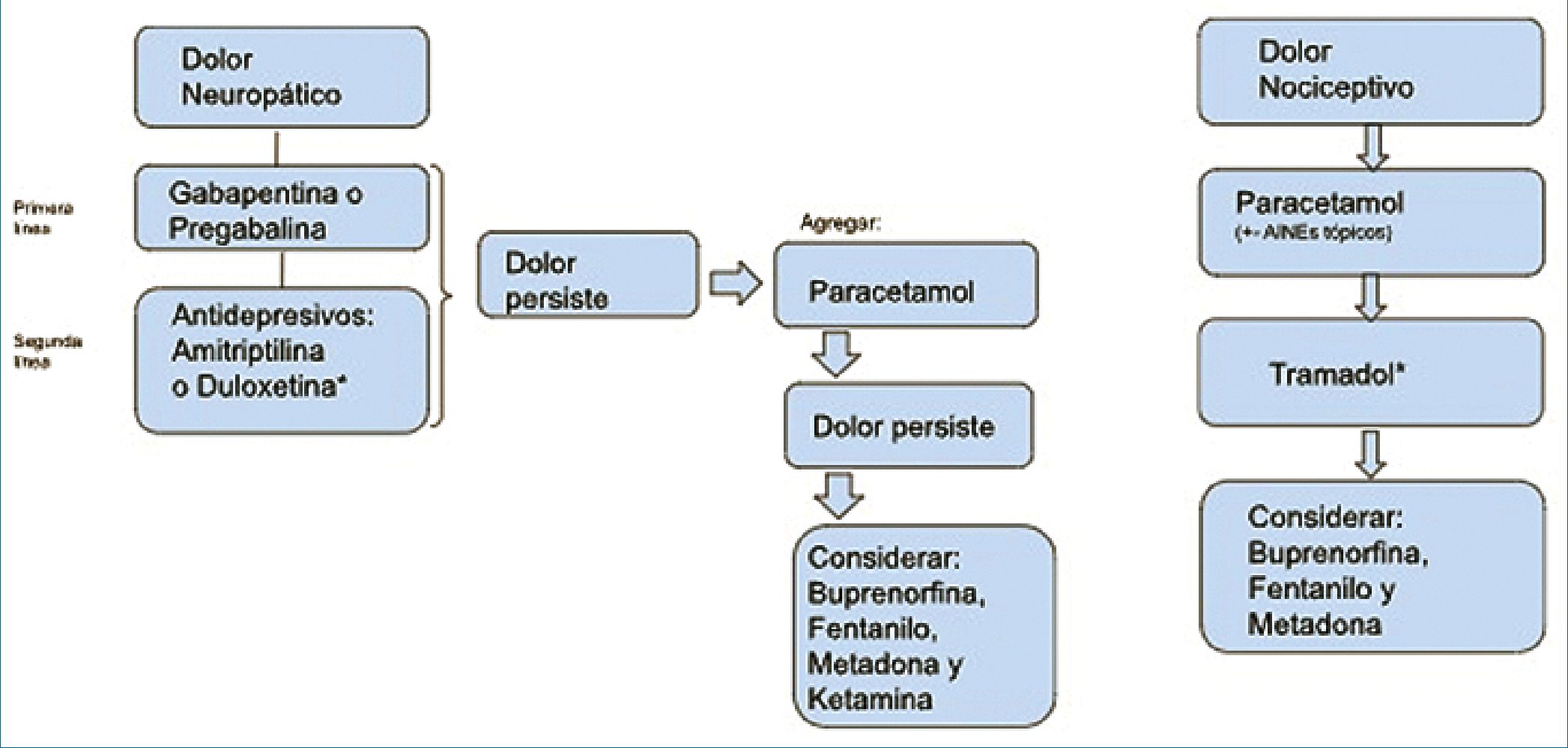
Figura 1. Pasos a seguir en manejo de dolor neuropático y nociceptivo.
– Ajuste de dosis:
• En la ERC avanzada (VFG <30 mL/min/1,73m2).
• Espaciar dosis cada 12 h.
• Dosis inicial sugerida: 25 mg cada 12 h VO.
• Dosis máxima diaria: 100 mg VO cada 12 h.
• Pacientes en diálisis:
• Dosis máxima: 50 mg cada 12 h VO (dosis post diálisis).
-
2. Antidepresivos
El mecanismo de acción de la duloxetina es mediante la inhibición de la recaptura noradrenalina y serotonina. Tiene metabolismo hepático. La excreción de sus metabolitos es renal (70%) y gastrointestinal (20%), y no se elimina importantemente con hemodiálisis. Es un fármaco útil en el manejo del dolor neuropático.
– Dosis habitual: Iniciar con dosis 30 mg/día VO, máximo 60 mg/día.
– Ajuste de dosis:
• No es necesario ajustar dosis con VFG > 30 ml/min/1,73m2.
• Evitar en pacientes con VFG < 30 ml/min/1,73 m2.
-
Conclusión
El 60% de la población con ERC vive con dolor crónico, por lo que, el conocer sus características y los fármacos seguros de usar se torna esencial para su adecuado manejo. Además, debemos considerar el ajuste de dosis correspondiente según la función renal del paciente. En la Tabla 5 se resumen los fármacos mencionados en esta revisión. En la Figura 1 se resumen los pasos a seguir dependiendo del tipo de dolor.
Conflictos de intereses: ninguno.
-
Referencias
1. de Salud M. Estrategia para el Abordaje de la Salud Renal en Red, 2021 [Internet]. 2022. Available from: https://redcronicas.minsal.cl/estrategia-para-el-abordaje-de-la-salud-renal-en-red-2021/
2. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. [Internet]. Disponible en: https://kdigo.org/wp-content/uploads/2017/02/KDIGO_2012_CKD_GL.pdf
3. Durán J, Tejos-Bravo M, Cid V, Ferreccio C, Calvo M. Chronic pain in Chile: first prevalence report of noncancer chronic pain, fibromyalgia, and neuropathic pain and its associated factors. Pain. 2023 Aug;164(8):1852–9. https://doi.org/10.1097/j.pain.0000000000002886 PMID:36893316
4. Davison SN, Rathwell S, Ghosh S, George C, Pfister T, Dennett L. The Prevalence and Severity of Chronic Pain in Patients With Chronic Kidney Disease: A Systematic Review and Meta-Analysis. Can J Kidney Health Dis. 2021 Feb;8:2054358121993995. https://doi.org/10.1177/2054358121993995 PMID:33680484
5. Davison SN, Koncicki H, Brennan F. Pain in chronic kidney disease: a scoping review. Semin Dial. 2014 Mar;27(2):188–204. https://doi.org/10.1111/sdi.12196 PMID:24517512
6. Lambourg E, Colvin L, Guthrie G, Murugan K, Lim M, Walker H, et al. The prevalence of pain among patients with chronic kidney disease using systematic review and meta-analysis. Kidney Int. 2021 Sep;100(3):636–49. https://doi.org/10.1016/j.kint.2021.03.041 PMID:33940112
7. Pham PC, Dewar K, Hashmi S, Toscano E, Pham PM, Pham PA, et al. Pain prevalence in patients with chronic kidney disease. Clin Nephrol. 2010 Apr;73(4):294–9. PMID:20353737
8. Davison SN. Clinical Pharmacology Considerations in Pain Management in Patients with Advanced Kidney Failure. Clin J Am Soc Nephrol. 2019 Jun;14(6):917–31. https://doi.org/10.2215/CJN.05180418 PMID:30833302
9. Davison SN, Jhangri GS, Johnson JA. Cross-sectional validity of a modified Edmonton symptom assessment system in dialysis patients: a simple assessment of symptom burden. Kidney Int. 2006 May;69(9):1621–5. https://doi.org/10.1038/sj.ki.5000184 PMID:16672923
10. Coluzzi F. Assessing and Treating Chronic Pain in Patients with End-Stage Renal Disease. Drugs. 2018 Sep;78(14):1459–79. https://doi.org/10.1007/s40265-018-0980-9 PMID:30206801
11. Davison SN. Management of chronic pain in advanced chronic kidney disease. En: UpToDate online. 2023
12. Koncicki HM, Unruh M, Schell JO. Pain Management in CKD: A Guide for Nephrology Providers. Am J Kidney Dis. 2017 Mar;69(3):451–60. https://doi.org/10.1053/j.ajkd.2016.08.039 PMID:27881247
13. Roy PJ, Weltman M, Dember LM, Liebschutz J, Jhamb M, Consortium H. Pain management in patients with chronic kidney disease and end-stage kidney disease. Curr Opin Nephrol Hypertens. 29. England 2020. p. 671-80. https://doi.org/10.1097/MNH.0000000000000646.
14. Hebbes C. Non-opioid analgesics. Anaesth Intensive Care Med. 2016;17(9):469–72. https://doi.org/10.1016/j.mpaic.2016.06.013.
15. Barash PG, Cullen BF, Stoelting RK, Cahalan MK, Stock MC, Ortega R, et al. Clinical anesthesia. 8th ed. Philadelphia: Lippincott Williams & Wilkins; 2017.
16. Bravo L, Mico JA, Berrocoso E. Discovery and development of tramadol for the treatment of pain. Expert Opin Drug Discov. 2017 Dec;12(12):1281–91. https://doi.org/10.1080/17460441.2017.1377697 PMID:28920461
17. Nagar VR, Birthi P, Salles S, Sloan PA. Opioid Use in Chronic Pain Patients with Chronic Kidney Disease: A Systematic Review. Pain Med. 2017 Aug;18(8):1416–49. https://doi.org/10.1093/pm/pnw238 PMID:28339928
18. Lobo ED, Heathman M, Kuan HY, Reddy S, O’Brien L, Gonzales C, et al. Effects of varying degrees of renal impairment on the pharmacokinetics of duloxetine: analysis of a single-dose phase I study and pooled steady-state data from phase II/III trials. Clin Pharmacokinet. 2010 May;49(5):311–21. https://doi.org/10.2165/11319330-000000000-00000 PMID:20384393

 ORCID
ORCID