Ricardo Fuentealba Ramírez1,2, Luciano Bravo3, Carolina Tejo Toledo4, Sofía Giovine López4, Valentina Maldonado Giadalah4
Recibido: —
Aceptado: —
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 3 pp. 224-229|https://doi.org/10.25237/revchilanestv53n3-04
PDF|ePub|RIS
Use of lipid emulsion for treatment of intoxication by lipophilic drugs, not local anesthetics. From theory to practice
Abstract
Lipid emulsion is an intravenous solution composed of a mixture of oils and medium chain lipids. Initially used to provide parenteral nutritional support, lipid emulsion has been the subject of studies since 1998, where its efficacy in the rescue of patients intoxicated with lipophilic drugs has been documented. Due to its various mechanisms of action, it has been observed to produce positive results in terms of both recovery and mortality in several groups of patients. However, caution should be taken in their use, and early detection of possible adverse effects is necessary. In this work, our objective is to present a review of the use of lipid emulsion for the treatment of intoxication by drugs other than the family of local anesthetics, used in routine clinical practice. We will also describe three clinical cases of patients intoxicated with different classes of drugs, all in toxic doses, in which lipid emulsion was used in association with the usual treatment, obtaining favorable results despite the limited evidence that makes a higher number of studies necessary.
Resumen
La emulsión lipídica es una solución intravenosa, compuesta por una mezclas de aceites y lípidos de cadena media. Inicialmente utilizada para brindar soporte nutricional parenteral, la emulsión lipídica ha sido objeto de estudios desde 1998, donde se ha documentado su eficacia en el rescate de pacientes intoxicados con fármacos lipofílicos. Gracias a sus diversos mecanismos de acción se ha observado que produce resultados positivos en términos de recuperación y mortalidad en varios grupos de pacientes. Sin embargo, se debe tener precaución en su administración y estar atentos a la detección temprana de posibles efectos adversos. En este trabajo, nuestro objetivo es presentar una revisión del uso de emulsión lipídica para el tratamiento de la intoxicación por medicamentos distintos a la familia de los anestésicos locales usados en la práctica clínica habitual. Describiremos además, tres casos clínicos de pacientes intoxicados con diferentes clases de fármaco, todos en dosis tóxicas, en los cuales se utilizó la emulsión lipídica asociado al tratamiento habitual, obteniendo resultados favorables a pesar de la escasa evidencia que hacen necesaria una mayor cantidad de estudios.
-
Introducción
En la década de los sesenta la emulsión lipídica (EL) encontraba su utilidad fundamentalmente en el soporte nutricional parenteral para pacientes en estado crítico[1], esto hasta que en 1998, Weinberg, demostró por primera vez su beneficio en la reanimación cardiovascular avanzada, en contexto de colapso circulatorio secundario a sobredosis de bupivacaína en roedores[2]. Posteriormente en el año 2006, Rosenblatt, reportó los primeros casos de empleo exitoso de EL, en humanos con paro cardiorrespiratorio secundario a intoxicación con anestésicos locales[3]. La EL también es un útil transportador de fármacos lipofílico por tanto se utiliza para administrar fármacos como el propofol, el etomidato, el diazepam y la anfoteri- cina B y, más recientemente, como sistemas de administración altamente eficientes y selectivos para la terapia del cáncer[4].
En cuanto al manejo de pacientes con intoxicación medicamentosa, el enfoque convencional consiste en brindar soporte orgánico para mantener la función metabólica y también promover eliminación del agente tóxico. Si bien la descontaminación gastrointestinal aplicada de forma temprana teóricamente puede disminuir la absorción, sus resultados son escasos y cuestionables, cuando se lleva a cabo después de las 2 h de la ingesta. Por otro lado, las técnicas extracorpóreas, como la terapia de reemplazo renal, son de resultado incierto cuando se aplican en pacientes intoxicados, especialmente con fármacos o tóxicos que tienen un amplio volumen de distribución y una alta afinidad por las proteínas plasmáticas, como es el caso de la quetiapina. Esto subraya la necesidad de contar con un antídoto que, junto con las medidas de soporte habituales, pueda mejorar la modesta supervivencia y los resultados observados en pacientes expuestos a dosis letales del tóxico independiente del mecanismo de acción o familia farmacológica y que tenga un aceptable perfil de seguridad y que pueda estar ampliamente disponible en los servicios de urgencia, pabellón o de paciente crítico[4].
-
Farmacología del tratamiento con emulsión lipídica
-
Características físico – químicas
La EL son gotitas estériles nanométricas (entre 200-600 nm) de aceites en agua estabilizadas por un emulsionante para separar la fase lipídica interior de la fase acuosa exterior. Tienen un pH entre 6,9 y 9,0 y osmolalidad de aproximadamente 270 – 350 mOsm/kg[4]. Se compone de aceites que contienen triglicéridos, un emulsionante fosfolipídico y glicerina. La emulsión de aceite de soja puro fue la primera disponible comercialmente y sigue siendo la fuente de grasa predominante en nutrición parenteral. Las emulsiones lipídicas mixtas que contienen aceite de soja, triglicéridos de cadena media, aceite de oliva y aceite de pescado, así como la emulsión pura de aceite de pescado, constituyen emulsiones grasas de reciente desarrollo disponibles para uso parenteral[5], un ejemplo de ellas es SMOFlipid 20%, la cual fue usada para el tratamiento de intoxicación medicamentosa en los casos que se describirán posteriormente.
El agente emulsionante usualmente es un fosfolípido de yema de huevo al 1% y proporciona estabilidad al compartimiento lipídico que se forma a partir de estas gotitas de grasa mediante la formación de una barrera electromecánica. La interfaz aceite – agua con carga negativa provoca una fuerza de repulsión electrostática entre las gotitas de aceite dispersas en la fase interna de la emulsión y evita la coalescencia y el aumento del tamaño de las gotitas[6].
Cuando se administra una emulsión lipídica por vía intravenosa, se forma una fase lipídica intravascular expandida. La partición de una sustancia lipofílica, como los anestésicos locales, dentro de esta fase lipídica conduce a la reducción de su concentración plasmática, lo que genera una diferencia gradual en la concentración de la sustancia lipofílica entre los tejidos objetivos y la fase acuosa plasmática, lo que da lugar a la redistribución de la sustancia hacia el plasma y posteriormente a la fase lipídica plasmática, así se produce el fenómeno denominado «sumidero lipídico», este constituye el mecanismo predominante que respalda el uso de la EL como antídoto contra la toxicidad farmacológica y que desarrollaremos más adelante[7]
-
Teorias farmacológicas
Al analizar los mecanismos de acción de la EL, se han propuesto varias explicaciones fundamentadas en la fisiopatología y la farmacología, se describen en la litaratura de la siguiente manera.
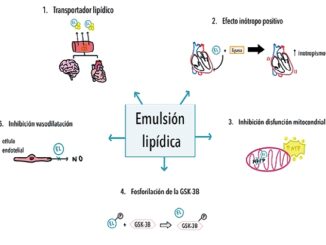
Trasportador lípidico
La EL crea una fase lipídica que actúa como un «transportador lipídico». Esta fase lipídica tiene la capacidad de secuestrar fármacos desde los órganos con alto flujo sanguíneo como el corazón y cerebro de manera proporcional a su grado de liposolubilidad lo que genera disminución de su concentración plasmática y en consecuencia aumenta su redistribución hacia el compartimento central, músculos, hígado y tejido adiposo para almacenamiento y detoxificación. La capacidad de unión de la EL está estrechamente relacionada con el coeficiente de distribución octanol/agua (log P) de un fármaco, una relación que se usa generalmente para medir la solubilidad de una sustancia química, siendo los anestesicos locales de alta liposolubilidad tales como bupivacaína y levobupivacaína eran los más rapidamente eliminados, sin embargo, esto también aplica a otros fármacos no pertenencientes a los anestésicos locales, pero que comparten la característica de ser altamente liposolubles (Log P > 2) tales como bloqueadores de canales de calcio, betabloqueadores, antidepresivos tricíclicos, antipsicóticos, antihistamínicos y herbicidas, entre otros. French y cols., describieron que la magnitud de la reducción de concentración de un fármaco o droga es principalmente dependiente de su liposolubilidad (Log P 75%) y parcialmente dependiente de su volumen de distribución, los cuales sirven como predictores de la eficacia clinica de la EL para revertir la toxicidad[4],[8],[9],[10].
Inotropismo positivo
Desde que se planteó y determinó que los lípidos, como molécula, son la fuente primaria de energía para los cardiomiocitos, se ha profundizado en su influencia en el metabolismo del corazón, revelando también otros efectos notables, como su relevancia en la protección cardíaca y la inducción de hipertrofia cardíaca mediante la activación de vías de crecimiento celular. Sin embargo, su influencia en variables hemodinamicas, como la presión sistólica o diastólica no estaba completamente comprendida hasta que Fettilace y cols., en 2013 publicaron sobre los efectos hemodinámicos agudos de la EL para revertir la toxicidad cardíaca inducida por fármacos[11]. Sus principales hallazgos demostraron un aumento del flujo sanguineo aórtico, de la presión sistólica y efectos cardiotónicos positivos al mejorar directamente tanto la contractilidad biventricular así como la relajación de estos. Los efectos inotrópicos y lusitrópicos positivos son explicados por que los ácidos grasos libres en plasma, generados por la interacción de las gotas de lípidos con la lipasa endotelial, proporcionan sustrato metabólico adicional para la fosforilación oxidativa del músculo cardíaco. Lo interesante es que estos cambios hemodinámicos se produjeron de manera ultrarrapida, velocidad necesaria para revertir los efectos car- diotóxicos, lo que es sugerente de una vía de señalización celular rápida independiente de los cambios metabólicos. Los tri- glicéridos de cadena larga y media presentes en la EL estimulan la activación de canales de calcio dependientes del voltaje en el músculo cardíaco y de los canales de sodio. Esto incrementa la concentración de calcio ionizado citosólico en los cardiomiocitos, lo que resulta en un efecto inotrópico positivo directo[9], mecanismo especialmente relevante en el caso de intoxicación por bloqueadores de los canales de calcio como verapamilo, diltiazem, amlodipino, y en medicamentos antagonistas de canales de sodio como anestésicos locales, cocaína, antipsicóticos y otros[4],[10].
Inhibición de la disfunción mitocondrial
El tratamiento con EL por un lado, contrarresta la inhibición de la carnitina-acilcarnitina translocasa causada por dosis tóxicas de bupivacaína y además, inhibe la producción de especies reactivas de oxígeno (ROS). Esto, junto con el aporte y prevención de la oxidación de ácidos grasos, la inhibición de la apertura del poro de transición de permeabilidad mitocondrial (MPTP) y la producción de ATP, logran atenuar la cardiotoxicidad inducida especialmente por anestésicos locales pero también la inducida por fármacos como la cloroquina, proporanolol, entre otros. Estos hallazgos sugieren que el EL, ofrece una protección significativa contra la toxicidad cardíaca al mejorar la función mitocondrial y reducir el estrés oxidativo[4],[9],[12].
Fosforilación de la glucógeno sintasa quinasa-3 p (GSK- 3 P ).
Otro efecto descrito del tratamiento con EL, es la fosforilación de la glicógeno sintasa quinasa-3p, este fenómeno, permite la inhibición de la apertura del MPTP, lo que finalmente conlleva a la atenuación de la apoptósis del músculo cardíaco y protección contra lesiones de isquemia – reperfusión, por las vías del fosfoinositol-3 kinasa, Akt y GSK-3p. Mecanismo especialmente importante en la cardiotoxicidad inducida por amlodipino, verapamilo, bupivacaina, doxorrubicina entre otros[4],[9].
Inhibición de la vasodilatación inducida por óxido nítrico (NO)
Mediante la supresión de su liberación. Esto contribuye a un efecto hemodinámico directo vasoconstrictor, lo que se traduce en un aumento de la presión arterial y la resistencia vascular, reduce la distensibilidad vascular y la vasodilatación mediada por el flujo. Esto cobra una gran relevancia clínica para sostener la macrohemodinámia durante la intoxicación medicamentosa por fármacos como bloqueadores de canales de calcio y anestésicos locales[4],[9]. Para el rescate de estados hemodinámicos distributivos, como es el shock séptico profundo, no se ha descrito su uso y por lo tanto, desaconsejamos la utilización de EL, entendiendo la relevancia que puede significar esta vía de acción, en este grupo de pacientes.
-
Esquema propuesto
La dosis recomendada por La Sociedad Estadounidense de Anestesia Regional y Medicina del Dolor (ASRA) es inicialmente un bolo de 1,5 ml/kg ev seguido de una infusión rápida 0,25 ml/kg/min en 3 minutos, y luego una infusión lenta 0,025 ml/ kg/min en 6-12 h de emulsión lipidica al 20% en pacientes he- modinámicamente inestables[13] considerando la dosis máxima recomendada de 3 g/kg/24h en pacientes pediatricos y de 2,5 g/kg/24h en adultos.
Las Guías de la European Resuscitation Council (ERC) sobre Reanimación del año 2015 sugieren una administración inicial de 1,5 ml/kg por vía intravenosa en un lapso de 1 minuto, seguida de una infusión continua de 15 ml/kg/h. En caso de un colapso cardiovascular persistente, el bolo debería repetirse dos veces más con intervalos de 5 minutos. La infusión debe mantenerse, al menos hasta que se haya logrado una recuperación hemodinámica o hasta alcanzar la dosis máxima de 12 ml/kg. La reanimación estándar debe llevarse de acuerdo a las directrices del Soporte Vital Avanzado (ACLS)[14]. Recomendamos tener en cuenta que el uso de EL sobre todo, en el contexto del paciente con inestabilidad hemodinámica, puede alterar la vida media de drogas lipofílicas vasoactivas; como adrenalina, noradrenalina, fenilefrina, vasopresina y dopamina, las cuales son recomendadas en el soporte de estos pacientes. Es por esto que el uso de EL debe ser monitorizado estrechamente en una unidad de paciente crítico por un equipo multidisciplinario que incluya un anestesiólogo o intensivista y otros profesionales según los requerimientos de cada paciente.
-
Efectos adversos y seguridad
En cuanto a los efectos adversos (Tabla 1), se ha observado que su incidencia es baja. Sin embargo, es importante mantener una vigilancia periódica durante la administración de la EL, siempre considerando la relación riesgo-beneficio de su indicación. Es fundamental sensibilizar al personal clínico para que
Tabla 1. Efectos adversos más frecuentes[4],[7]
| Dislipdemia |
| Pancreatitis |
| Anafilaxia |
| Síndrome de distrés respiratorio del adulto |
| Hipertensión pulmonar |
| Tromboflebitis |
| Trombocitopenia |
| Aumento de riesgo de infección |
estén alerta a la detección temprana de posibles efectos secun- darios[7].
-
Lista de fármacos para potencial uso
Se ha investigado particularmente su efectividad en intoxicaciones por anestésicos locales, especialmente por la bupivacaína, y se ha reportado el uso en intoxicaciones con fármacos que tengan un LogP mayor a 2. Distintas familias cumplen este requisito (Tabla 2) como beta-bloqueadores, bloqueadores de canales de calcio, quetiapina, antidepresivos tricíclicos y cocaína. Aunque los resultados han sido controvertidos y la evidencia es escasa, recomendamos que el uso de EL, no debe reemplazar el manejo tradicional en las intoxicaciones por estos fármacos, a pesar de lo anterior, existe una creciente evidencia, aunque de calidad limitada, que sugiere una mayor supervivencia y mejoras en escalas de evaluación neurológica (como la escala de Coma de Glasgow), arritmias supraventriculares y ventriculares, ritmos letales como la taquicardia ventricular, así como variables hemodinámicas como el gasto cardíaco y las resistencias vasculares periféricas[15]. Resumimos la evidencia en la Tabla 3.
En el caso de la cocaína, la evidencia es muy controvertida y solo se recomienda su uso excepcional en situaciones de paro cardiorrespiratorio o angina que no responde al tratamiento habitual[16].
-
De la teoria a la practica
A modo de dar una visión clínica complementaria, describiremos 3 casos ocurridos en una unidad de Paciente Crítico general, en los cuales, por la gravedad de la intoxicación, y en discusión multiestamento, de decidió se uso EL dentro del manejo global.
Tabla 2. Log P ejemplos[17], mayor a 2, potencial beneficio en el uso de AL
Tabla 3. Resumen de las recomendaciones internacionales relativas al tratamiento con EL en intoxicaciones. Se insiste en la escasa evidencia en farmacos no anestesicos locales
| Fármacos | Paro cardíaco | Toxicidad parcialmente mortal | Toxicidad no mortal |
| Bupivacaina | Fuerte | Fuerte si refractaria | Neutro |
| Otros anestésicos locales | Neutro | Baja si es refractaria | Neutro |
| Antiarrítmicos clase 1 | Neutro | Neutro | No recomendado |
| Betabloqueadores liposolubles | Neutro | Neutro | No recomendado |
| Betabloqueadores no liposolubles | Neutro | No recomendado | No recomendado |
| Olanzapina | Neutro | Neutro | No recomendado |
| Otros antipsicoticos | Neutro | No recomendado | No recomendado |
| Diltiazem y verapamilo | Neutro | Neutro | No recomendado |
| Bupropión | Neutro | Baja si es refractaria | No recomendado |
| Cocaína | Neutro | Caso severo | No recomendado |
| Lamotrigina | Neutro | Caso severo | No recomendado |
| Amitriptilina | Neutro | Bajo si es refractario | No recomendado |
| Otros antidepresivos tricíclicos | Neutro | No recomendado | No recomendado |
| ISRS | Neutro | Neutro | No recomendado |
Paciente 1
Paciente de sexo masculino de 53 años, con antecedentes de
cáncer de testículo, dislipidemia, hipertensión arterial, trastorno por consumo de sustancias estimulantes y depresión. Consultó en el servicio de urgencias (SU) por dolor torácico opresivo, síntomas neurovegetativos y pérdida de consciencia tras la ingesta de 8 g de cocaína. Ingreso vigil, hipertenso, taquicárdico, dolor torácico opresivo no irradiado, agitación psicomotora y crisis de ausencia de segundos de duración que se hacían repetitivas en el tiempo. El electrocardiograma destacó un hemibloqueo fascicular anterior izquierdo. Sin elementos que demostraran isquemia. Sin hallazgos significativos al examen físico segmentario y sin focalidad neurológica. Por gran agitación psicomotora se indicó lorazepam 6 mg ev en bolo y una BIC de midazolam 0,1 mg/kg/h, se ingresó a UPC para monitorización continua. Se decidió administrar emulsión lipídica al 20% 1,5 ml/kg seguido de 0,25 ml/kg/min a pasar en 3 minutos, luego 0,025 ml/kg/ min continuo por 6 h, debido a la persistencia de dolor to-
| Fármaco o droga | Log p |
| Sertralina | 5,51 |
| Ciclobenzaprina | 5,2 |
| Amitriptilina | 4,92 |
| Ibuprofeno | 3,97 |
| Bupropion | 3,6 |
| Propranolol | 3,48 |
| Bupivacaina | 3,41 |
| Amlodipino | 3,2 |
| Quetiapina | 2,81 |
| Lamotrigina | 2,57 |
| Cocaína | 2,3 |
racico y taquicardia sinusal con extrasístoles supraventriculares que mejoraron posteriormente, además se complementó con infusión de bicarbonato de sodio 2/3 molar 0,2 meq/kg/h.
Durante monitoreo continuo en UPC, se mantuvo normo- tenso, normocárdico, el ECG evolucionando a un bloqueo completo de rama izquierda y QTc prolongado (550 ms).
Durante su estadía y posterior a la administración de lípidos, paciente persistió sin focalidad neurológica, isocórico, sin convulsiones niclonías, con macrohemodinamia sostenida, sin palpitaciones ni angina y corrección del QTc. Se realizó ecocardiograma transtorácico que resultó normal, y un electroencefalograma que en su informe describió, lentitud generalizada con atenuación de voltaje y signos de impregnación farmacológica. Debido a su buena evolución, a las 48 h de su ingreso a UPC paciente se traslada a unidad de menor complejidad para su seguimiento por psiquiatría.
Paciente
Paciente de sexo femenino de 32 años, con antecedentes psiquiátricos, ingresó al SU luego de 9 h de ingesta de 2.500 mg de sertralina, 80 mg de ciclobenzaprina, 4 g de ibuprofeno y alcohol no cuantificado. Ingresó normotensa, taquicárdica, saturando 98%, 37°C de temperatura, Glasgow (GCS)[15], pupilas midriáticas normorreactivas, nistagmus lateral no agotable, temblor intermitente e hiperreflexia, sin otros hallazgos. El ECG informó taquicardia sinusal de 130 lpm, con QTc prolongado (530 ms). Se decide ingreso a UPC.
Se indicó infusión lipídica 1,5 ml/kg en bolo seguido de una infusión rápida 0,25 ml/kg/min a pasar en 3 minutos, luego 0,025 ml/kg/min continuo por 6 h. El ECG de control muestra un QTc 443 s que luego de bolo de rescate de 1,5 ml/kg de EL se corrige a 387 s.
Durante su estadía se mantiene sin focalidad neurológica, hemodinamia autosostenida y ECG seriados normales. En este contexto, por su favorable evolución, sin presentar arritmias ni focalidades neurológicas, se decide ser dada de alta médica con estricto control psiquiátrico.
Paciente
Paciente femenino de origen chino, 38 años, 65 kg, puérpera reciente, con antecedente de trastorno depresivo, dependencia al alcohol y drogas, con intentos previos de autolisis, ingresó al SU por presentar compromiso de conciencia en domicilio, post-ingesta de 9 g de quetiapina (dosis letal 100 mg/ kg). Ingresa en sopor medio, eupneica, taquicárdica, bien per- fundida, reactiva a estímulos dolorosos, pupilas mióticas reactivas, movilizando 4 extremidades con aliento etílico. Se administra SF 0,9% 500 cc más 3 ampollas de tiamina y se instala sonda nasogástrica para lavado gástrico sin carbón activado y se traslada a UPC. Fue admitida a UPC 5 h posterior a ingesta, en GCS[11], con hemodinamia sostenida con noradrenalina. Evolucionó con caída de GCS, por lo cual se decidió intubación para protección de vía aérea y ventilación mecánica invasiva y administración de emulsión lipídica 20% a la brevedad a 1,5 ml/kg, luego 0,25 ml/kg/min a pasar en 3 minutos, luego 0,025 ml/kg/min continuo por 12 h y se descartó terapia dialítica, por equipo de nefrología, debido a la unión a proteínas plasmáticas de la quetiapina (83%) y volumen de distribución de 10 L/kg que resultaría en terapia de reemplazo renal inefectiva.
Se realizó ecocardiograma trastorácico que informó, VI, no dilatado, levemente deprimido con FEVI 49%, sin otras alteraciones.
Evoluciona a las 36 h con alargamiento de QTc hasta 542 ms, por lo que se indicó, nuevo bolo de rescate de 1,5 ml/kg de emulsión lipídica con posterior acortamiento de QT a 470 ms y luego bajo 400 ms, un nuevo ecocardiograma evidenció un aumento de la FEVI a 66%.
Luego de 7 días, debido a la buena respuesta al tratamiento, sin nuevos alargamientos de QT y sin arritmias, se decide extubación, tras la cual la paciente se mantiene en GCS[15], en seguimiento neurológico y psiquiátrico estricto evidenciando mejoría clínica por lo que se decidió alta médica y controles por psiquiatría.
-
Conclusión
La EL ha demostrado ser una opción beneficiosa, de escasa evidencia aún, en el manejo de pacientes intoxicados con fármacos lipofílicos y en un escenario clínico altamente desfavorable. Sus múltiples mecanismos de acción, que incluyen el transporte lipídico, el efecto inotrópico positivo, la atenuación de la toxicidad cardíaca, la inhibición de la disfunción mitocondrial y la inhibición de la vasodilatación inducida por NO, han mostrado resultados positivos en la recuperación y mortalidad de diferentes grupos de pacientes.
Si bien existen controversias y limitaciones en la evidencia disponible, los estudios clínicos y experimentales han destacado la utilidad de la EL en casos de intoxicación por anestésicos locales, beta-bloqueadores, bloqueadores de canales de calcio y antidepresivos tricíclicos. Además, su perfil de efectos adversos es generalmente bajo, aunque se recomienda una vigilancia periódica para la detección precoz de posibles complicaciones.
Es importante destacar que el uso de la EL, jamás reemplaza al manejo tradicional y las medidas de soporte habituales en intoxicaciones por fármacos y recomendamos que su uso sea decidido en conjunto a un equipo multidisciplinario que realice una evaluación individualizada de cada caso, teniendo en cuenta la relación riesgo-beneficio de su indicación.
En definitiva, la emulsión lipídica ha mostrado resultados favorables en la recuperación de pacientes intoxicados, aunque se requiere de una mayor investigación y evidencia de calidad para respaldar su uso en diferentes contextos clínicos. Invitamos a seguir reportando exitosas experiencias.
-
Referencias
1. Vanek VW, Seidner DL, Allen P, Bistrian B, Collier S, Gura K, et al.; Novel Nutrient Task Force, Intravenous Fat Emulsions Workgroup; American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. A.S.P.E.N. position paper: clinical role for alternative intravenous fat emulsions. Nutr Clin Pract. 2012 Apr;27(2):150–92. https://doi.org/10.1177/0884533612439896 PMID:22378798
2. Weinberg GL, VadeBoncouer T, Ramaraju GA, Garcia-Amaro MF, Cwik MJ. Pretreatment or resuscitation with a lipid infusion shifts the dose-response to bupivacaine-induced asystole in rats. Anesthesiology. 1998 Apr;88(4):1071–5. https://doi.org/10.1097/00000542-199804000-00028 PMID:9579517
3. Rosenblatt MA, Abel M, Fischer GW, Itzkovich CJ, Eisenkraft JB. Successful use of a 20% lipid emulsion to resuscitate a patient after a presumed bupivacaine-related cardiac arrest. Anesthesiology. 2006 Jul;105(1):217–8. https://doi.org/10.1097/00000542-200607000-00033 PMID:16810015
4. Jaffal K, Chevillard L, Mégarbane B. Lipid emulsion to treat acute poisonings: mechanisms of action, indications, and controversies. Pharmaceutics. 2023 May;15(5):1396. https://doi.org/10.3390/pharmaceutics15051396 PMID:37242638
5. Fell GL, Nandivada P, Gura KM, Puder M. Intravenous lipid emulsions in parenteral nutrition. Adv Nutr. 2015 Sep;6(5):600–10. https://doi.org/10.3945/an.115.009084 PMID:26374182
6. Mirtallo JM, Dasta JF, Kleinschmidt KC, Varon J. State of the art review: Intravenous fat emulsions: Current applications, safety profile, and clinical implications. Ann Pharmacother. 2010 Apr;44(4):688–700. https://doi.org/10.1345/aph.1M626 PMID:20332339
7. Tampakis K, Vogiatzakis N, Kontogiannis C, Spartalis M, Ntalianis A, Spartalis E, et al. Intravenous lipid emulsion as an antidote in clinical toxicology: a systematic review. Eur Rev Med Pharmacol Sci. 2020 Jun;24(12):7138–48. https://doi.org/10.26355/eurrev_202006_21708 PMID:32633409
Crossref reports that the DOI “10.26355/eurrev_202006_21708” is registered at mEDRA. (Ref. 7 “Tampakis, Vogiatzakis, Kontogiannis, Spartalis, Ntalianis, Spartalis, et al., 2020”)
8. French D, Smollin C, Ruan W, Wong A, Drasner K, Wu AH. Partition constant and volume of distribution as predictors of clinical efficacy of lipid rescue for toxicological emergencies. Clin Toxicol (Phila). 2011 Nov;49(9):801–9. https://doi.org/10.3109/15563650.2011.617308 PMID:21981684
9. Lee SH, Kim S, Sohn JT. Lipid emulsion treatment for drug toxicity caused by nonlocal anesthetic drugs in pediatric patients. Pediatr Emerg Care. 2023 Jan;39(1):53–9. https://doi.org/10.1097/PEC.0000000000002828 PMID:35981328
Crossref reports the DOI should be “10.1097/PEC.0000000000002828”, not “10.1097/pec.0000000000002828”. Edifix has used the Crossref-supplied DOI. (Ref. 9 “Lee, Kim, Sohn, 2023”)
Edifix has not updated the article title because PubMed’s is slightly different and Title Case. The PubMed article title is Lipid Emulsion Treatment for Drug Toxicity Caused by Nonlocal Anesthetic Drugs in Pediatric Patients: A Narrative Review. (Ref. 9 “Lee, Kim, Sohn, 2023”)
10. Cave G, Harvey M. Intravenous lipid emulsion as antidote beyond local anesthetic toxicity: a systematic review. Acad Emerg Med. 2009 Sep;16(9):815–24. https://doi.org/10.1111/j.1553-2712.2009.00499.x PMID:19845549
11. Fettiplace MR, Ripper R, Lis K, Lin B, Lang J, Zider B, et al. Rapid cardiotonic effects of lipid emulsion infusion. Crit Care Med. 2013 Aug;41(8):e156–62. https://doi.org/10.1097/CCM.0b013e318287f874 PMID:23531591
Crossref reports the DOI should be “10.1097/CCM.0b013e318287f874”, not “10.1097/ccm.0b013e318287f874”. Edifix has used the Crossref-supplied DOI. (Ref. 11 “Fettiplace, Ripper, Lis, Lin, Lang, Zider, et al., 2013”)
12. Raman M, Almutairdi A, Mulesa L, Alberda C, Beattie C, Gramlich L. Parenteral nutrition and lipids. Nutrients. 2017 Apr;9(4):388. https://doi.org/10.3390/nu9040388 PMID:28420095
13. Neal JM, Barrington MJ, Fettiplace MR, Gitman M, Memtsoudis SG, Mörwald EE, et al. The Third American Society of Regional Anesthesia and Pain Medicine Practice Advisory on Local Anesthetic Systemic Toxicity: executive Summary 2017. Reg Anesth Pain Med. 2018 Feb;43(2):113–23. https://doi.org/10.1097/AAP.0000000000000720 PMID:29356773
14. Truhlář A, Deakin CD, Soar J, Khalifa GE, Alfonzo A, Bierens JJ, et al.; Cardiac arrest in special circumstances section Collaborators. European Resuscitation Council Guidelines for Resuscitation 2015: Section 4. Cardiac arrest in special circumstances. Resuscitation. 2015 Oct;95:148–201. https://doi.org/10.1016/j.resuscitation.2015.07.017 PMID:26477412
Edifix has not found an issue number in the journal reference. Please check the volume/issue information. (Ref. 14 “Truhlár, Deakin, Soar, Khalifa, Alfonzo, Bierens, et al., 2015”)
15. García-Ramos S, Fernandez I, Zaballos M. Lipid emulsions in the treatment of intoxications by local anesthesics and other drugs. Review of mechanisms of action and recommendations for use. Rev Esp Anestesiol Reanim (Engl Ed). 2022;69(7):421–32. https://doi.org/10.1016/j.redare.2021.03.018 PMID:35871141
16. Gosselin S, Hoegberg LC, Hoffman RS, Graudins A, Stork CM, Thomas SH, et al. Evidence-based recommendations on the use of intravenous lipid emulsion therapy in poisoning. Clin Toxicol (Phila). 2016 Dec;54(10):899–923. https://doi.org/10.1080/15563650.2016.1214275 PMID:27608281
17. Internet U.S. National Library of Medicine; [cited 2023 Oct 12]. Available from: https://www.ncbi.nlm.nih.gov/

 ORCID
ORCID