Adrián Gallardo RT. MSc.1,2,6, Melina Alcaraz RT.1, Cristian Rosales-Antequera RT. MSc.3, Juan Martín Núñez Silveira RT.5, Patrick Sepúlveda RT. MSc.4,6
Recibido: 23-10-2023
Aceptado: 11-01-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 3 pp. 244-249|https://doi.org/10.25237/revchilanestv53n3-07
PDF|ePub|RIS
Conditioning factors of inspiratory drive
Abstract
The respiratory center, located in the medulla oblongata, comprises a complex network of neuronal nuclei that regulate the frequency, depth, and intensity of respiratory cycles. This system responds to multiple stimuli, such as lung irritation, chemical changes in the blood, and/or emotional factors, automatically adapting to metabolic and respiratory demands. Here, voluntary and involuntary controls play a determining role, such as the pre-Botzinger complex, identified as responsible for establishing the rhythm and cadence of respiratory cycles. These adaptations are particularly complex in clinical situations such as acute respiratory failure due to acute respiratory distress syndrome, where the combination of all neuronal groups can be observed as not only inspiratory but also expiratory muscles are activated. The combined action of these centers aims to maintain respiratory homeostasis, even in clinical situations that alter respiratory drive. Therefore, it will be crucial to evaluate and quantify respiratory drive, especially in critically ill patients undergoing mechanical ventilation, to optimize clinical outcomes.
Resumen
El centro respiratorio, ubicado en la médula oblonga, comporta una compleja red de núcleos neuronales que regulan la frecuencia, profundidad e intensidad de los ciclos respiratorios. Este sistema responde a múltiples estímulos, como la irritación pulmonar, cambios químicos en la sangre y/o factores emocionales, adaptándose automáticamente a las demandas metabólicas y respiratorias. Aquí juegan un rol determinante los controles voluntarios e involuntarios, como el complejo pre Botzinger, señalado como el responsable de establecer el ritmo y la cadencia de los ciclos respiratorios. Estas adaptaciones son, particularmente, complejas en situaciones clínicas como la insuficiencia respiratoria aguda por síndrome de distrés respiratorio, donde puede observarse la combinación de todos los grupos neuronales al activarse no solo los músculos inspiratorios sino también los espiratorios. La acción conjunta de estos centros tiene como objetivo primordial mantener la homeostasis respiratoria, incluso en situaciones clínicas que alteren el impulso respiratorio. Para ello será de crucial importancia evaluar y cuantificar el impulso respiratorio, sobretodo en pacientes críticamente enfermos sometidos a ventilación mecánica, a fin de optimizar los resultados clínicos.
-
Introducción
El centro respiratorio, ubicado en la médula oblonga, engloba un conjunto de células especializadas encargadas de generar los ciclos respiratorios a través de una red de neuronas interconectadas con otras áreas del sistema nervioso central (SNC). Estas conexiones son estimuladas por múltiples aferencias provenientes de: 1) receptores de irritación y estiramiento, alojados en el pulmón; 2) quimiorreceptores, centrales y periféricos, susceptibles a las modificaciones en las concentraciones de dióxido de carbono y, puntualmente, del pH sanguíneo; 3) estímulos sensoriales y/o emocionales, que determinan una respuesta respiratoria ante la ansiedad, dolor o miedo (Figura 1). Este sistema de control se caracteriza por adaptarse automáticamente a las distintas demandas a pesar de que el sujeto no es consciente de tal adaptación. Estas modificaciones pueden llegar, incluso, al cese completo de los ciclos respiratorios por actividad volitiva, interrupciones periódicas como sucede durante la deglución, estornudos, eructos, bostezos o suspiros. Las respuestas del centro respiratorio, secundarias a la integración de las aferencias, determinarán un patrón neuronal que modificará la frecuencia, duración y profundidad de las diferentes fases de cada ciclo respiratorio[1].
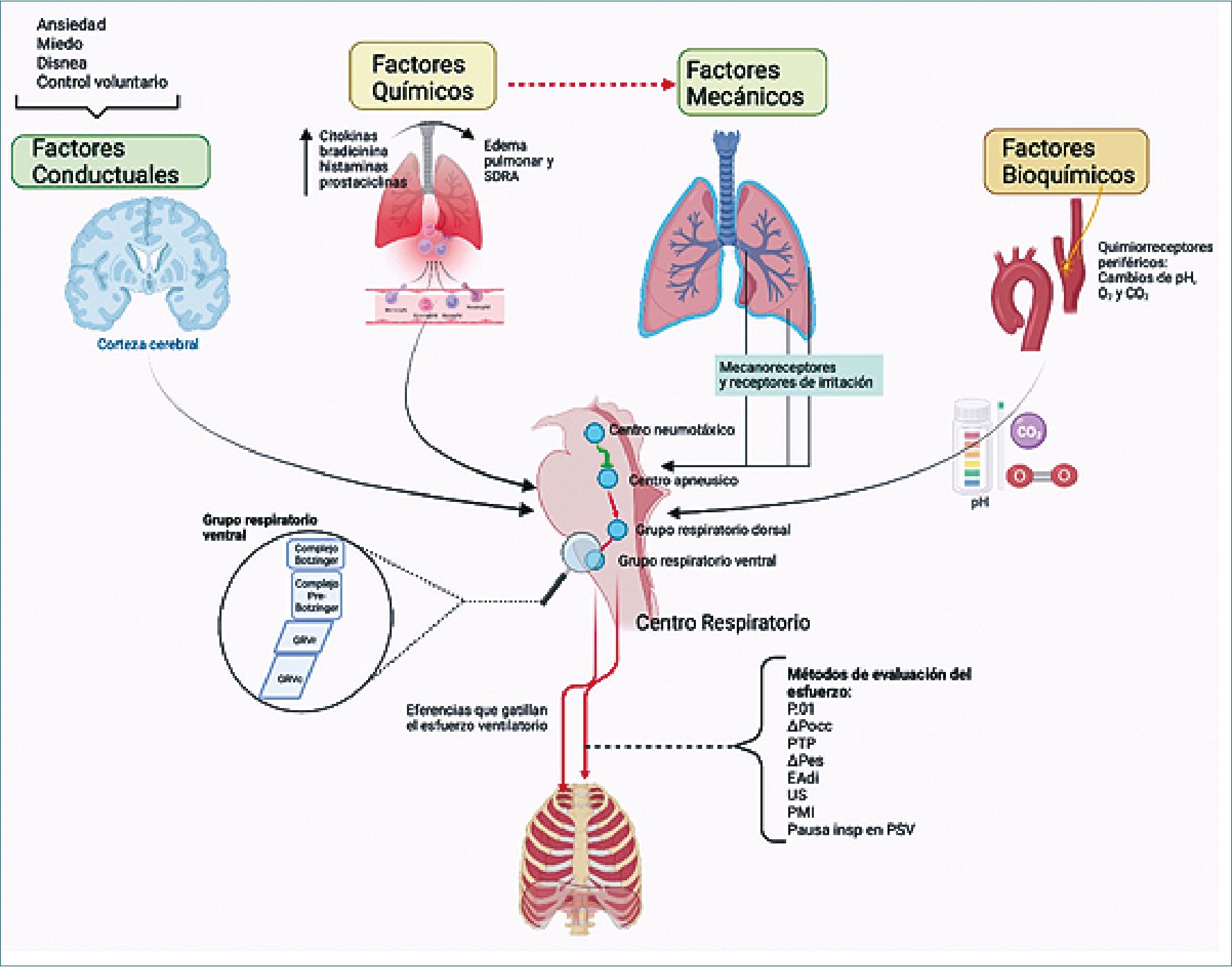
Figura 1. Condicionantes del impulso respiratorio y métodos de medición del esfuerzo respiratorio durante la ventilación espontánea.
Actualmente, no hay un consenso global sobre los mecanismos de regulación de la ventilación. Distintos estudios han logrado mostrar cambios en el patrón ventilatorio si es que se ve afectado alguno de los centros respiratorios[2]. Esta intrincada red reguladora tiene un control voluntario, dado principalmente por acción de la corteza cerebral y que influye en el centro respiratorio de manera directa, y un control involuntario que está regulado por los centros respiratorios bulbares y del puente[3]. Dentro de estos centros respiratorios bulbares destacan el centro apnéusico y el centro neumotáxico; mientras que en el puente se encuentra el grupo dorsal y el grupo ventral. Además de estos centros, en el último tiempo ha tomado relevancia el complejo pre Botzinger. Estos centros reciben distintos tipos de señales para ajustar su función[4]. Así, el grupo respiratorio dorsal está a cargo de generar el ritmo inspiratorio y recibe información sensorial que proviene de los quimiorreceptores periféricos a través del nervio glosofaríngeo y del nervio vago, sumada a la información mecánica enviada también a través del nervio vago. Por otro lado, el grupo respiratorio ventral refuerza tanto la fase inspiratoria como la espiratoria cuando se requiere una ventilación de mayor volumen[5]. En cuanto a los centros superiores ubicados en el puente, el centro apnéusico actúa estimulando la actividad inspiratoria, aumentando el volumen gracias a un aumento del tiempo inspiratorio. El centro neumotáxico actúa inhibiendo el centro apnéusico y promoviendo un patrón ventilatorio rápido y superficial. Por último, el mencionado complejo pre Botzinger corresponde a una red neuronal ubicada en la porción ventral y caudal del grupo respiratorio ventral. Se ha observado que tiene implicancias rítmicas en la ventilación. Las investigaciones actuales proponen que estas neuronas tienen una especie de propiedad de automatismo que estimula de manera rítmica el grupo respiratorio dorsal a través del nervio glosofaríngeo, para que éste envíe señales, a través del nervio frénico, al diafragma[6]-[9]. Esta compleja interacción de centros que reciben abundante información del estado metabólico periférico permite responder de manera eficiente para mantener la homeostasis.
Este impulso respiratorio puede estar alterado en distintas situaciones clínicas. Tal es el caso del síndrome de dificultad respiratoria aguda (SDRA), donde la fisiopatología propia de la entidad suele resultar en un incremento del drive respiratorio, pudiendo llegar a una lesión autoinducida (P-SILI) secundaria al esfuerzo[10]. Aunque la ventilación espontánea ha mostrado tener beneficios en pacientes sometidos a ventilación mecánica, la asincronía paciente-ventilador, la reducción de la sedación y analgesia o los esfuerzos desmedidos pueden llegar a ser potencialmente injuriantes.
El objetivo de este texto es proponer un resumen sobre los factores condicionantes del impulso respiratorio y la importancia de su evaluación y cuantificación en pacientes críticamente enfermos para optimizar el cuidado y soporte respiratorio.
-
Factores químicos
El control de la respiración, en condiciones fisiológicas, se lleva a cabo a través del trabajo conjunto de los centros respiratorios (grupos de interneuronas ubicadas en el tronco del encéfalo) ya mencionados. Estos grupos reciben información continua de fuentes sensibles a estímulos e integran esta información, generando una señal que tendrá una amplitud, frecuencia y patrón neuronal que condicionarán la frecuencia respiratoria, ritmo y duración de las diferentes fases del ciclo respiratorio[1].
Este sistema depende de la retroalimentación química, susceptible a las variaciones en los gases sanguíneos y el pH. La información se recibe principalmente de la entrada quimio- sensorial, donde participan los quimiorreceptores centrales y periféricos, que generan una fuente de activación destinada a minimizar las fluctuaciones de la PaCO2 y pH, y a corregir la hipoxemia. Es de notar que la producción de los quimiorreceptores periféricos aumenta gradualmente cuando PaO2 < 80 mmHg, siendo más acentuada cuando PaO2 < 60 mmHg[11]. Por esta vía se media la respuesta ventilatoria ante la hipoxemia por acción de los cuerpos carotideos ubicados en la bifurcación de las carótidas[1],[12]. Adicionalmente, se observa acción de receptores torácicos que proporcionan información sobre condiciones químicas y mecánicas (ver Factores Mecánicos). Estos receptores están ubicados en la pared torácica, pulmones, músculos respiratorios y vías respiratorias y contribuyen a la protección del volumen pulmonar, mediando el reflejo de Hering-Breuer y poniendo fin a la inspiración (control inhibitorio) o limitando la espiración a fin de conservar un volumen pulmonar mínimo[13].
Es de mencionar la acción de las drogas depresoras del impulso respiratorio, habitualmente empleadas en escenarios quirúrgicos. Los efectos de los opioides y las benzodiacepinas han sido bien documentados. A modo de resumen: los opiáceos han mostrado efectos sobre el complejo de pre Botzinger en modelos experimentales[14]; sin embargo, en humanos la situación no es tan clara ya que la administración de naloxona (con acción sobre los receptores opiáceos) no mostró efecto sobre la respiración[15], por lo que un paciente podría modificar su estado de conciencia pero no modificaría la acción del centro respiratorio. El caso del remifentanilo es de particular mención ya que ha mostrado no afectar el impulso pero sí el tiempo respiratorio; en consecuencia, la aparición de asincronías de ciclado y la desadaptación del paciente podría ser más frecuente[16]. En cuanto a las benzodiacepinas, que actúan sobre los receptores GABA (implicados en la generación del patrón respiratorio central), su empleo genera alteración de la respiración dependiente de la dosis, modificando la respuesta ventilatoria a la hipoxemia y la hipercapnia[15]. De manera similar a lo sucedido con los opiáceos, la reversión de la acción de las ben- zodiacepinas (flumazenilo) podría no modificar las alteraciones sobre el centro respiratorio y las respuestas ante la hipoxemia e hipercapnia pueden seguir siendo anormales independientemente del nivel de conciencia que presente el paciente[17]. Finalmente, la diferencia entre ambos radica en el “efecto techo” que presentan las benzodiacepinas cuya depresión respiratoria no es tan severa (siempre que no sea combinada con otros depresores del SNC).
-
Factores conductuales
La entrada descendente o conductual condiciona cambios adaptativos del patrón respiratorio durante actividades complejas como el ejercicio físico o mental, mostrando aumentos significativos en la frecuencia respiratoria, predominantemente durante tareas cognitivas[18],[19]. Su acción tiene origen en los centros cerebrales corticales[20],[21]. El dolor, delirio, ansiedad o miedo, producen respuestas que se originan en la corteza cerebral y el hipotálamo, y que pueden alterar el impulso respiratorio en aquellos pacientes con insuficiencia respiratoria[22],[23].
Estas señales pueden verse alteradas en presencia de patología pulmonar. La intensidad con la que se transmita la señal neuronal modulará el esfuerzo inspiratorio, el cual también estará asociado a los requerimientos ventilatorios del paciente. En escenarios de patología respiratoria y ventilación mecánica, la integridad de esta vía de transmisión suele estar alterada como consecuencia de la infusión de agentes sedantes, analgésicos y/o bloqueantes, generando una interrupción entre el drive respiratorio y la ventilación real[24]. Otro escenario frecuente de acción de los factores conductuales suele verse durante el “despertar” postquirúrgico y el pasaje de ventilación controlada a ventilación espontánea. Aquí, será necesario ajustar correctamente el nivel de sedación y analgesia, conjuntamente con la programación de la ventilación mecánica, para evitar una alteración de la acción de los centros respiratorios y optimizar la sincronía paciente-ventilador para reducir los tiempos de destete.
-
Factores inflamatorios
El impulso respiratorio también puede verse modulado por la presencia de factores inflamatorios[25]. En el síndrome de distrés respiratorio agudo (SDRA), por ejemplo, se produce un aumento de la información quimiosensorial como consecuencia del edema pulmonar, intersticial y alveolar, el incremento del espacio muerto, el colapso alveolar y el deterioro del intercambio gaseoso[26]. Además, en el SDRA se genera una inflamación local y sistémica, que genera una activación de los mecanorreceptores (receptores de estiramiento) que inhiben a los quimiorreceptores centrales y sensibiliza los quimiorreceptores periféricos, activando constantemente las fibras nerviosas tipo C pulmonares, sensibles a mediadores inflamatorios. La sumatoria de estos factores modifica la mecánica respiratoria y podrían afectar el impulso respiratorio neural[27],[28]. A su vez, la disminución de la distensibilidad de los pulmones y de la pared torácica aumenta la carga elástica y puede alterar el acoplamiento neuromecánico entre el esfuerzo y la excursión diafragmática[29], lo que en última instancia determina inflamación de los músculos respiratorios secundaria al esfuerzo desmedido.
Estos incrementos en el esfuerzo respiratorio podrían producir efectos sobre la interacción paciente-ventilador, generando asincronías[30] a través de esfuerzos ineficaces, flujos o ciclado inadecuados, entre otras. Las asincronías pueden aumentar el impulso respiratorio al causar malestar y aumento de la carga respiratoria.
Tabla 1. Evaluaciones para cuantificar el impulso y esfuerzo respiratorios
| Evalúa | Ventajas | Limitaciones | Valores referencia | |
| P.01 | Presión en la vía aérea en los primeros 100ms del ciclo | Evaluación sencilla, disponible en la mayoría de los respiradores | Discrepancias en los métodos de medición continua. AutoPEEP. Desacople neuromecánico | -1 a -3,5 cmH2O |
| APocc | Presión generada por los músculos respiratorios en un ciclo respiratorio aleatorio | Evaluación sencilla. Permite seguimiento del esfuerzo inspiratorio. | No disponible en todos los respiradores (pausa en modos espontáneos) | Pmus
7-15 cmH2O |
| PTP | Presión generada por los músculos inspiratorios en la fase inspiratoria | Evaluación sencilla. Permite seguimiento del esfuerzo | No disponible en los ventiladores. Requiere software específico | 50-150 cmH2O |
| APes | Subrogado de la presión pleural | Evalúa la presión de los músculos inspiratorios cercana a la pleura Medición continua | Invasiva
Requiere equipamiento extra Riesgo de lesiones |
7-15 cmH2O |
| EAdi | Actividad eléctrica del diafragma | Refleja el impulso eléctrico con gran precisión | Invasivo
Requiere equipamiento Riesgo de lesiones |
Desconocido
Mínimo para monitoreo 1,2 pV Para evitar atrofia 5 pV |
| US | Excursión
Engrasamiento |
Técnica directa, no invasiva, a pie de cama
Técnica directa, no invasiva, a pie de cama |
Requiere equipamiento. Limitado en pacientes obesos
Requiere equipamiento. Limitado en pacientes obesos. |
2 – 8 cm
15-30% |
| PMI | Presión ejercida por los músculos respiratorios durante la asistencia con PSV | Aplicable sin equipamiento extra No invasiva, a pie de cama | No disponible en todos los respiradores (pausa insp. en modos espontáneos) | < 3 cmH2O |
-
Factores mecánicos
En pacientes ventilados mecánicamente, si el esfuerzo respiratorio espontáneo es desmedido (por ejemplo, pacientes en el período postanestesia y con despertar agitado), el ingreso de grandes volúmenes corrientes puede causar estrés pulmonar excesivo, aumento de la tensión pulmonar y carga muscular incrementada, a la vez que generan asincronías paciente-ventilador[1]. En este sentido, las “aferencias mecánicas” por esfuerzos elevados o leves pueden inducir miotrauma diafragmático y efecto pendelluft oculto. Una asistencia respiratoria excesiva, alcalosis metabólica o la sedación, pueden generar un impulso respiratorio bajo, atrofia miofibrilar, debilidad diafragmática y esfuerzos inspiratorios débiles (seguidos de asincronías) empeorando la lesión pulmonar[24],[31],[32].
Por otro lado, un esfuerzo excesivo también puede generar lesión de los músculos respiratorios y miotraumatismo del diafragma inducido por incremento de la carga de trabajo[23],[31]. La lesión que se genera en el diafragma inducida por aumento de la carga genera un engrosamiento de su pared, evidenciable a través de un examen ecográfico en las zonas de aposición[33]. El aumento de la presión negativa durante el esfuerzo respiratorio forzado también aumenta la presión vascular trasmural, lo que promueve un edema pulmonar adicional debido al aumento de la perfusión pulmonar y una presión alveolar reducida[34]. La presencia de un esfuerzo inspiratorio intenso puede provocar una sobredistensión del pulmón dependiente como consecuencia del efecto pendelluft[35].
El uso de sedantes, opioides y/o drogas anestésicas, pueden actuar directamente sobre los centros respiratorios o modular las señales que contribuyen al impulso respiratorio a través de modificaciones en la deformación mecánica de los pulmones y el tórax. Igualmente, la ventilación mecánica puede influir sobre el volumen de reposo del sistema, la distribución del volumen tidal, el grado de stress y strain pulmonar y sobre las concentraciones de PaO2 y PaCO2. Durante la ventilación de soporte, por ejemplo, la distribución del volumen corriente suele ser más homogénea y mostrar menor porcentaje de efecto pendelluft[36]; aunque es esperable que un esfuerzo demasiado elevado pu
da provocar una heterogeneidad en esta distribución hacia las regiones más dependientes[34].
-
Como evaluar el impulso y el esfuerzo respiratorios
Como la actividad de los centros respiratorios no puede ser cuantificada directamente suelen emplearse sus “consecuencias fisiológicas” como subrogados. Dentro de las evaluaciones más empleadas se encuentran la presión de oclusión en los primeros 100 ms del ciclo respiratorio (P.01), la actividad eléctrica del diafragma (EAdi), el delta de presión esofágica (ΔPes) y el producto presión tiempo (PTP), la relajación de los músculos inspiratorios aplicando una pausa inspiratoria durante la ventilación con presión de soporte, el índice de presión muscular (PMI), el delta de presión de oclusión de la vía aérea (ΔPocc) y la evaluación ecográfica (US) de la fracción de engrosamiento y desplazamiento del diafragma. Algunas de estas evaluaciones requieren de equipamiento adicional (US, EAdi, ΔPes y PTP), mientras que otras pueden realizarse a pie de cama sin equipamiento especializado (P.01, ΔPocc, PMI).
Considerando las ventajas y limitaciones de cada técnica cualquiera de ellas puede ser aplicada a fin de conocer las características del impulso y el esfuerzo realizado por el paciente. Distintos estudios han mostrado su fiabilidad, características y aplicación[1],[30],[31],[37]-[44]. Los valores de referencia para cada una pueden verse en la Tabla 1.
-
Conclusión
El impulso respiratorio es una variable de vital importancia durante el pasaje de la ventilación mandatoria controlada a la ventilación espontánea y durante el proceso de destete de la ventilación mecánica. Los factores que influyen sobre su funcionamiento son múltiples y pueden accionar asociados o de modo independiente. Así, el fallo en la transición a la ventilación espontánea, por alteración del drive respiratorio, puede ser consecuencia de una asistencia inadecuada, de un proceso inflamatorio o químico, o puede estar relacionado al temor, ansiedad o dolor del paciente ante la nueva situación clínica. En cualquier caso, su cuantificación y encuadre dentro de los rangos fisiológicos determinará mejores resultados y optimización de los tiempos de ventilación mecánica y destete.
Conflicto de intereses: ninguno.
-
Referencias
1. Annemijn H, Jonkman H. J de Vries, L. M A Heunks [Physiology of the Respiratory Drive in ICU Patients: Implications for Diagnosis and Treatment]. Crit Care. 2020 Mar;24(1):104. PMID:32204710
2. Nattie E. CO2, brainstem chemoreceptors and breathing. Prog Neurobiol. 1999 Nov;59(4):299-331. // Guyenet PG, Bayliss DA. Neural Control of Breathing and CO2 Homeostasis. Neuron. 2015 Sep 2;87(5):946-61. https://doi.org/10.1016/S0301-0082(99)00008-8.
3. Mitchell RA, Berger AJ. Neural regulation of respiration. Am Rev Respir Dis. 1975 Feb;111(2):206–24. PMID:1089375
4. Isik EG, Hernandez-Miranda LR. Early development of the breathing network. Handb Clin Neurol. 2022;188:125–49. https://doi.org/10.1016/B978-0-323-91534-2.00002-3 PMID:35965024
5. Ghali MGZ. Respiratory rhythm generation and pattern formation: oscillators and network mechanisms. J Integr Neurosci. 2019 Dec 30;18(4):481-517. // Urfy MZ, Suarez JI. Breathing and the nervous system. Handb Clin Neurol. 2014;119:241-50.
6. Smith JC, Ellenberger HH, Ballanyi K, Richter DW, Feldman JL. Pre-Bötzinger complex: a brainstem region that may generate respiratory rhythm in mammals. Science. 1991 Nov;254(5032):726–9. https://doi.org/10.1126/science.1683005 PMID:1683005
7. Muñoz-Ortiz J, Muñoz-Ortiz E, López-Meraz ML, Beltran-Parrazal L, Morgado-Valle C. Pre-Bötzinger complex: Generation and modulation of respiratory rhythm. Neurologia (Engl Ed).
8. Ramirez JM, Zuperku EJ, Alheid GF, Lieske SP, Ptak K, McCrimmon DR. Respiratory rhythm generation: converging concepts from in vitro and in vivo approaches? Respir Physiol Neurobiol. 2002 Jul;131(1-2):43–56. https://doi.org/10.1016/S1569-9048(02)00036-8 PMID:12106994
9. Ikeda K, Kawakami K, Onimaru H, Okada Y, Yokota S, Koshiya N, et al. The respiratory control mechanisms in the brainstem and spinal cord: integrative views of the neuroanatomy and neurophysiology. J Physiol Sci. 2017 Jan;67(1):45–62. https://doi.org/10.1007/s12576-016-0475-y PMID:27535569
10. Brochard L, Slutsky A, Pesenti A. Mechanical Ventilation to Minimize Progression of Lung Injury in Acute Respiratory Failure. Am J Respir Crit Care Med. 2017 Feb;195(4):438–42. https://doi.org/10.1164/rccm.201605-1081CP PMID:27626833
11. Tobin MJ, Gardner WN. Monitoring of the control of ventilation. In: Tobin MJ, editor. Principles and practice of intensive care monitoring. New York: McGraw-Hill, Inc.; 1998. pp. 415–64.
12. Hall JE. Guyton y Hall. Tratado de Fisiología Médica. Capítulo 42. Regulación de la respiración. Decimotercera edición. Editorial Elsevier; 2016.
13. Lumb AB. Nunn’s Applied Respiratory Physiology. Chapter 4. Control of Breathing. Reflexes Arising in the Lung. Pulmonary Stretch Receptors and Their Associated Reflexes. Eighth Edition. Ed. Elsevier. págs 57-58.
14. Pattinson KT. Opioids and the control of respiration. Br J Anaesth. 2008 Jun;100(6):747–58. https://doi.org/10.1093/bja/aen094 PMID:18456641
15. Shook JE, Watkins WD, Camporesi EM. Differential roles of opioid receptors in respiration, respiratory disease, and opiate-induced respiratory depression. Am Rev Respir Dis. 1990 Oct;142(4):895–909. https://doi.org/10.1164/ajrccm/142.4.895 PMID:2171388
16. Costa R, Navalesi P, Cammarota G, Longhini F, Spinazzola G, Cipriani F, et al. Remifentanil effects on respiratory drive and timing during pressure support ventilation and neurally adjusted ventilatory assist. Respir Physiol Neurobiol. 2017 Oct;244:10–6. https://doi.org/10.1016/j.resp.2017.06.007 PMID:28673877
17. Gross JB, Blouin RT, Zandsberg S, Conard PF, Häussler J. Effect of flumazenil on ventilatory drive during sedation with midazolam and alfentanil. Anesthesiology. 1996 Oct;85(4):713–20. https://doi.org/10.1097/00000542-199610000-00005 PMID:8873540
18. Shea SA. Behavioural and arousal-related influences on breathing in humans. Exp Physiol. 1996 Jan;81(1):1–26. https://doi.org/10.1113/expphysiol.1996.sp003911 PMID:8869137
19. Shea SA, Walter J, Murphy K, Guz A. Evidence for individuality of breathing patterns in resting healthy man. Respir Physiol. 1987 Jun;68(3):331–44. https://doi.org/10.1016/S0034-5687(87)80018-X PMID:3616179
20. Eldridge FL. Central integration of mechanisms in exercise hyperpnea. Med Sci Sports Exerc. 1994 Mar;26(3):319–27. https://doi.org/10.1249/00005768-199403000-00008 PMID:8183096
21. Tobin MJ, Pérez W, Guenther SM, D’Alonzo G, Dantzker DR. Breathing pattern and metabolic behavior during anticipation of exercise. J Appl Physiol (1985). 1986 Apr;60(4):1306-12. https://doi.org/10.1152/jappl.1986.60.4.1306.. PMID: 3700308.
22. Tipton MJ, Harper A, Paton JF, Costello JT. The human ventilatory response to stress: rate or depth? J Physiol. 2017 Sep;595(17):5729–52. https://doi.org/10.1113/JP274596 PMID:28650070
23. Bertoni M, Telias I, Urner M, Long M, Del Sorbo L, Fan E, et al. A novel non-invasive method to detect excessively high respiratory effort and dynamic transpulmonary driving pressure during mechanical ventilation. Crit Care. 2019 Nov;23(1):346. https://doi.org/10.1186/s13054-019-2617-0 PMID:31694692
24. Vaporidi K, Akoumianaki E, Telias I, Goligher EC, Brochard L, Georgopoulos D; Pathophysiology and Clinical Implications. Respiratory drive in critically ill patients. Pathophysiology and clinical implications. Am J Respir Crit Care Med. 2020 Jan;201(1):20–32. https://doi.org/10.1164/rccm.201903-0596SO PMID:31437406
25. Hsieh YH, Litvin DG, Zaylor AR, Nethery DE, Dick TE, Jacono FJ. Brainstem inflammation modulates the ventilatory pattern and its variability after acute lung injury in rodents. J Physiol. 2020 Jul;598(13):2791–811. https://doi.org/10.1113/JP279177 PMID:32378188
26. Takakura AC, Moreira TS, Colombari E, West GH, Stornetta RL, Guyenet PG. Peripheral chemoreceptor inputs to retrotrapezoid nucleus (RTN) CO2-sensitive neurons in rats. J Physiol. 2006 Apr;572(Pt 2):503–23. https://doi.org/10.1113/jphysiol.2005.103788 PMID:16455687
27. Bauer TT, Montón C, Torres A, Cabello H, Fillela X, Maldonado A, et al. Comparison of systemic cytokine levels in patients with acute respiratory distress syndrome, severe pneumonia, and controls. Thorax. 2000 Jan;55(1):46–52. https://doi.org/10.1136/thorax.55.1.46 PMID:10607801
28. Lin S, Walker J, Xu L, Gozal D, Yu J. Behaviours of pulmonary sensory receptors during development of acute lung injury in the rabbit. Exp Physiol. 2007 Jul;92(4):749–55. https://doi.org/10.1113/expphysiol.2006.036673 PMID:17392336
29. Evans KC, Dougherty DD, Schmid AM, Scannell E, McCallister A, Benson H, et al. Modulation of spontaneous breathing via limbic/paralimbic-bulbar circuitry: an event-related fMRI study. Neuroimage. 2009 Sep;47(3):961–71. https://doi.org/10.1016/j.neuroimage.2009.05.025 PMID:19450692
30. Mauri T, Yoshida T, Bellani G, Goligher EC, Carteaux G, Rittayamai N, et al.; PLeUral pressure working Group (PLUG—Acute Respiratory Failure section of the European Society of Intensive Care Medicine). Esophageal and transpulmonary pressure in the clinical setting: meaning, usefulness and perspectives. Intensive Care Med. 2016 Sep;42(9):1360–73. https://doi.org/10.1007/s00134-016-4400-x PMID:27334266
31. Goligher EC, Jonkman AH, Dianti J, Vaporidi K, Beitler JR, Patel BK, et al. Clinical strategies for implementing lung and diaphragm-protective ventilation: avoiding insufficient and excessive effort. Intensive Care Med. 2020 Dec;46(12):2314–26. https://doi.org/10.1007/s00134-020-06288-9 PMID:33140181
32. de Vries H, Jonkman A, Shi ZH, Spoelstra-de Man A, Heunks L. Assessing breathing effort in mechanical ventilation: physiology and clinical implications. Ann Transl Med. 2018 Oct;6(19):387. https://doi.org/10.21037/atm.2018.05.53 PMID:30460261
33. Goligher EC, Fan E, Herridge MS, Murray A, Vorona S, Brace D, et al. Evolution of Diaphragm Thickness during Mechanical Ventilation. Impact of Inspiratory Effort. Am J Respir Crit Care Med. 2015 Nov;192(9):1080–8. https://doi.org/10.1164/rccm.201503-0620OC PMID:26167730
34. Yoshida T, Amato MB, Kavanagh BP, Fujino Y. Impact of spontaneous breathing during mechanical ventilation in acute respiratory distress syndrome. Curr Opin Crit Care. 2019 Apr;25(2):192–8. https://doi.org/10.1097/MCC.0000000000000597 PMID:30720482
35. Yoshida T, Torsani V, Gomes S, De Santis RR, Beraldo MA, Costa EL, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation. Am J Respir Crit Care Med. 2013 Dec;188(12):1420–7. https://doi.org/10.1164/rccm.201303-0539OC PMID:24199628
36. Arellano DH, Brito R, Morais CC, Ruiz-Rudolph P, Gajardo AI, Guiñez DV, et al. Pendelluft in hypoxemic patients resuming spontaneous breathing: proportional modes versus pressure support ventilation. Ann Intensive Care. 2023 Dec;13(1):131. https://doi.org/10.1186/s13613-023-01230-w PMID:38117367
37. Luo YM, Moxham J, Polkey MI. Diaphragm electromyography using an oesophageal catheter: current concepts. Clin Sci (Lond). 2008 Oct;115(8):233–44. https://doi.org/10.1042/CS20070348 PMID:18782085
38. Rozé H, Lafrikh A, Perrier V, Germain A, Dewitte A, Gomez F, et al. Daily titration of neurally adjusted ventilatory assist using the diaphragm electrical activity. Intensive Care Med. 2011 Jul;37(7):1087–94. https://doi.org/10.1007/s00134-011-2209-1 PMID:21424827
39. Thille AW, Rodriguez P, Cabello B, Lellouche F, Brochard L. Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Med. 2006 Oct;32(10):1515–22. https://doi.org/10.1007/s00134-006-0301-8 PMID:16896854
40. Yoshida T, Amato MB, Grieco DL, Chen L, Lima CA, Roldan R, et al. Esophageal manometry and regional transpulmonary pressure in lung injury. Am J Respir Crit Care Med. 2018 Apr;197(8):1018–26. https://doi.org/10.1164/rccm.201709-1806OC PMID:29323931
41. Tuinman PR, Jonkman AH, Dres M, Shi ZH, Goligher EC, Goffi A, et al. Respiratory muscle ultrasonography: methodology, basic and advanced principles and clinical applications in ICU and ED patients-a narrative review. Intensive Care Med. 2020 Apr;46(4):594–605. https://doi.org/10.1007/s00134-019-05892-8 PMID:31938825
42. Carteaux G, Mancebo J, Mercat A, Dellamonica J, Richard JC, Aguirre-Bermeo H, et al. Bedside adjustment of proportional assist ventilation to target a predefined range of respiratory effort. Crit Care Med. 2013 Sep;41(9):2125–32. https://doi.org/10.1097/CCM.0b013e31828a42e5 PMID:23787397
43. Rittayamai N, Beloncle F, Goligher EC, Chen L, Mancebo J, Richard JM, et al. Effect of inspiratory synchronization during pressure-controlled ventilation on lung distension and inspiratory effort. Ann Intensive Care. 2017 Oct;7(1):100. https://doi.org/10.1186/s13613-017-0324-z PMID:28986852
44. Alberti A, Gallo F, Fongaro A, Valenti S, Rossi A. P0.1 is a useful parameter in setting the level of pressure support ventilation. Intensive Care Med. 1995 Jul;21(7):547–53. https://doi.org/10.1007/BF01700158 PMID:7593895

 ORCID
ORCID