Gerardo Alberto Solís Pérez1, Jorge Mario Antolinez Motta2, Diego Escarramán Martínez3, Manuel Alberto Guerrero Gutiérrez4, Arturo Vázquez Peralta5
Recibido: 12-05-2024
Aceptado: 04-07-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 4 pp. 303-312|https://doi.org/10.25237/revchilanestv53n4-03
PDF|ePub|RIS
Pulmonary complications in bariatric surgery
Abstract
establish the bases of the pathophysiology of postoperative pulmonary complications (PPC) focused on patients with obesity. PPC are a common entity in both the population with normal weight and patients with obesity. Its definition and incidence have not been standardized, although concessions have already been made in this regard. Knowing its pathophysiology will help the anesthesiologist develop strategies to mitigate its appearance. A non-systematic search of the literature on CPPs focused on patients with obesity was carried out; definition, pathophysiology, prevention strategies and ventilator programming were considered as central axes of the search. PPC are an entity that impacts the immediate postoperative period of patients. Intervening on patients with obesity is increasingly common, therefore, the anesthesiologist must master this topic to provide the best strategy to avoid the appearance of CPP.
Resumen
Establecer las bases de la fisiopatología de las complicaciones pulmonares postoperatorias (CPP) enfocadas al paciente con obesidad. Las CPP son una entidad frecuente tanto en la población con peso normal y pacientes con obesidad. Su definición e incidencia no se han estandarizado, aunque ya se han hecho concesos al respecto. Conocer su fisiopatología ayudará al médico anestesiólogo a desarrollar estrategias para mitigar su aparición. Se realizó una búsqueda no sistemática de la literatura sobre las CPP enfocadas en el paciente con obesidad, se consideró definición, fisiopatología, estrategias de prevención y programación del ventilador como ejes centrales de búsqueda. CPP son una entidad que impacta el posoperatorio inmediato de los pacientes. Intervenir pacientes con obesidad es cada vez más común, por lo cual, el anestesiólogo debe dominar este tema para brindar la mejor estrategia para evitar la aparición de CPP.
Introducción
Globalmente, las Complicaciones Pulmonares Posoperatorias (CPP) son la segunda causa de morbilidad posquirúrgica después de la infección de herida quirúrgica[1], aunque algunos estudios en población de pacientes con obesidad han encontrado que estas son la primer causa[2], su incidencia varía según el entorno de tratamiento clínico, el tipo de cirugía y la definición utilizada, oscilando entre el 1% y el 23%[3]. La obesidad se clasifica por medio
del índice de masa corporal (IMC). Se asocia con múltiples comorbilidades pulmonares, que incluyen asma, hiperreacti- vidad de las vías respiratorias, apnea obstructiva del sueño (AOS), síndrome de hipoventilación por obesidad, hipertensión pulmonar, riesgo de reintubación, atelectasias pulmo- nares[4],[5]. El IMC parece tener una relación directa con la aparición de CPP. Covarrubias y colaboradores, encontraron una relación entre el aumento del IMC y el riesgo de presentar alguna CPP (Tabla 1)[6].
Por tal motivo, es de suma importancia conocer a fondo la fisiopatología de las CPP y su relación con la obesidad para tomar medidas desde el preoperatorio hasta postoperatorio y de esa manera disminuir su incidencia.
Tabla 1. Relación entre obesidad y riesgo de complicaciones pulmonares postoperatorias
| IMC | Grado de Obesidad | OR | Valor de p |
| 25 – 29,9 | Sobrepeso | 1,37, IC (1,07-1,74) | p = 0,012 |
| 30 – 34,9 | Obesidad grado I | 1,44 (IC1,08-1,92) | p = 0,014 |
| 35 – 39,9 | Obesidad grado II | 2,20 (IC1,55-3,14 | p < 0,001 |
| > 40 | Obesidad grado III | 2,42 (IC1,67-3.51) | p < 0,001 |
IMC: Índice de masa corporal.
Tabla 2. Definición de Complicaciones Pulmonares Posoperatorias (CPP) de la European Perioperative Clinical Outcome (EPCO)
| Medida de resultado | Definición EPCO |
| Infección Respiratoria | Paciente que reciba antibióticos para sospecha de infección con uno o más de los siguientes: esputo nuevo o modificado, opacidades pulmonares nuevas o modificadas, fiebre, recuento de glóbulos blancos >12 x 109 litros-1. |
| Falla respiratoria | PaO2 posoperatoria < 8 kPa (60 mm Hg) con aire ambiente, una relación PaO2:FIO2 < 40 kPa (300 mm Hg) o saturación de oxihemoglobina arterial medida con pulsioximetría < 90% y que requiere oxigenoterapia |
| Derrame pleural | Radiografía de tórax con reducción del ángulo costofrénico, pérdida de la silueta nítida del hemidiafragma ipsolateral en posición erguida, desplazamiento de estructuras anatómicas adyacentes o (en posición supina) opacidad borrosa en un hemitórax con sombras vasculares preservadas |
| Atelectasia | Opacificación pulmonar con desplazamiento del mediastino, desplazamiento del hilio o hemidiafragma hacia el área afectada, con hiperinsuflación compensatoria en pulmón adyacente no atelectásico |
| Neumotorax | Aire en el espacio pleural sin lecho vascular que rodee la pleura visceral |
| Broncoespasmo
Neumonitis por aspiración Neumonía | Sibilancias espiratorias recién detectadas tratadas con broncodilatadores
Lesión pulmonar aguda tras la aspiración de contenido gástrico regurgitado Radiografía de tórax con al menos uno de los siguientes: infiltrado, consolidación, cavitación; más al menos uno de los siguientes: fiebre > 38°C sin otra causa, recuento de glóbulos blancos < 4 o > 12 x109 litros-1, > 70 años y estado mental alterado sin otra causa; más al menos dos de los siguientes: nuevo esputo purulento/cambiado, aumento de secreciones/succión, nuevo episodio o empeoramiento de tos/disnea/taquipnea, estertores/ruidos respiratorios bronquiales, empeoramiento del intercambio gaseoso |
Definición
En la literatura no existe una definición unificada del concepto en sí de CPP. La American College of Physicians utiliza una combinación de neumonía e insuficiencia respiratoria para definir las CPP acorde a una revisión sistemática de 16 estudios[7]. La definición depende del estudio consultado, la patología del paciente, el tiempo de aparición y tipo de cirugía y la CPP que se busque como desenlace[8],[9]. Por lo cual, nosotros proponemos la siguiente definición como grupo de trabajo: “cualquier anomalía pulmonar que ocurre en el período posoperatorio, la cual, produce una enfermedad o disfunción identificable, y clínicamente significativa, que afecta negativamente el curso clínico después de la cirugía”[10].
En el 2015, el grupo de trabajo European Perioperative Clinical Outcome (EPCO) publicó las definiciones de los principales desenlaces respiratorios que pueden considerarse como CPP[11] (Tabla 2).
Al analizar la tabla de las definiciones CPP, observamos que las atelectasias son una de las principales, y en la cual el aneste- siólogo juega un papel importante para su prevención. Éstas se pueden definir como la expansión incompleta de los alvéolos y bronquiolos terminales[12]. Los pacientes con obesidad tienen mayor prevalencia de atelectasias cuando se someten a anestesia general y está oscila hasta 34%[13].
Fisiopatología de las CPP y su relación con la obesidad
La Anestesia General (AG) condiciona depresión del impulso respiratorio central y periférico con posterior retorno de la ventilación espontánea y aumento de la ventilación minuto. Todo esto dependiente de las concentraciones plasmáticas de algunos fármacos. Una de las principales CPP, las atelectasias, tienen relación con la alteración de la actividad normal de los músculos respiratorios (impulso respiratorio periférico), la cual inicia con la inducción anestésica y puede continuar durante el período postoperatorio. La respiración es un fenómeno complejo que requiere la actividad coordinada de varios grupos de músculos, tanto en las vías respiratorias superiores como en la pared torácica[14]. Esta coordinación se ve perjudicada, en diferente medida, por los anestésicos usados, afectando la regulación central de la respiración por desensibilización de los quimiorreceptores a la presión arterial de CO2, cambiando el impulso neural hacia los músculos respiratorios como el diafragma y de igual forma, por acción directa sobre la placa motora de estos[15].
El paciente con obesidad presenta características muy particulares. Una de ellas es el exceso de tejido adiposo en el abdomen y pared torácica, que reducen la capacidad residual funcional (CRF) y el volumen de reserva espiratoria como consecuencia[16]. Esta condición hace que el paciente con obesidad maneje volúmenes tidales bajos con flujo espiratorio limitado, particularmente, en decúbito supino y durante el sueño[17]. El aumento de la presión intraabdominal secundaria al depósito de grasa abdominal produce cefalización del diafragma, así mismo, los depósitos de grasa torácica conducen a una reducción en la distensibilidad pulmonar generando mayor resistencia de las vías respiratorias y generando atrapamiento de aire debido al cierre prematuro de las vías respiratorias, lo cual genera presión positiva intrínseca al final de la espiración (PEEPi) y favorece el desajuste ventilación-perfusión (V/Q) con el desarrollo de atelectasias[18], por ende, aumenta el trabajo respiratorio total y los hace más propensos a presentar CPP[19].
Hay varios factores claramente reconocidos que permiten la perpetuación de las CPP en el posoperatorio. Primero, la alteración funcional de los músculos respiratorios por incisiones y puertos de laparoscopia; segundo, el dolor posoperatorio puede provocar una limitación voluntaria del movimiento respiratorio; tercero, la estimulación visceral por tracción mecánica cercana al diafragma (como sucede en la cirugía bariátrica) disminuye notoriamente la producción de motoneuronas frénicas con la consecuente limitación del movimiento normal del diafragma en el posoperatorio[20]. El uso de técnicas endoscópicas para minimizar el trauma quirúrgico ha demostrado mejorar la mecánica pulmonar[21]. En la Figura 1 se resumen los principales efectos de la obesidad y la anestesia que alteran la mecánica ventilatoria.
Factores de riesgo asociados a la aparición de CPP
Existe en la literatura reportes de diversos factores de riesgo asociados con la aparición de CPP. Una manera práctica de englobar estos factores es mediante la categorización en tres grupos: relacionados al paciente, relacionados al procedimiento quirúrgico (modificables y no modificables) y relacionados con las pruebas de laboratorio y gabinete. En la Tabla 3 se resumen estos factores[22].
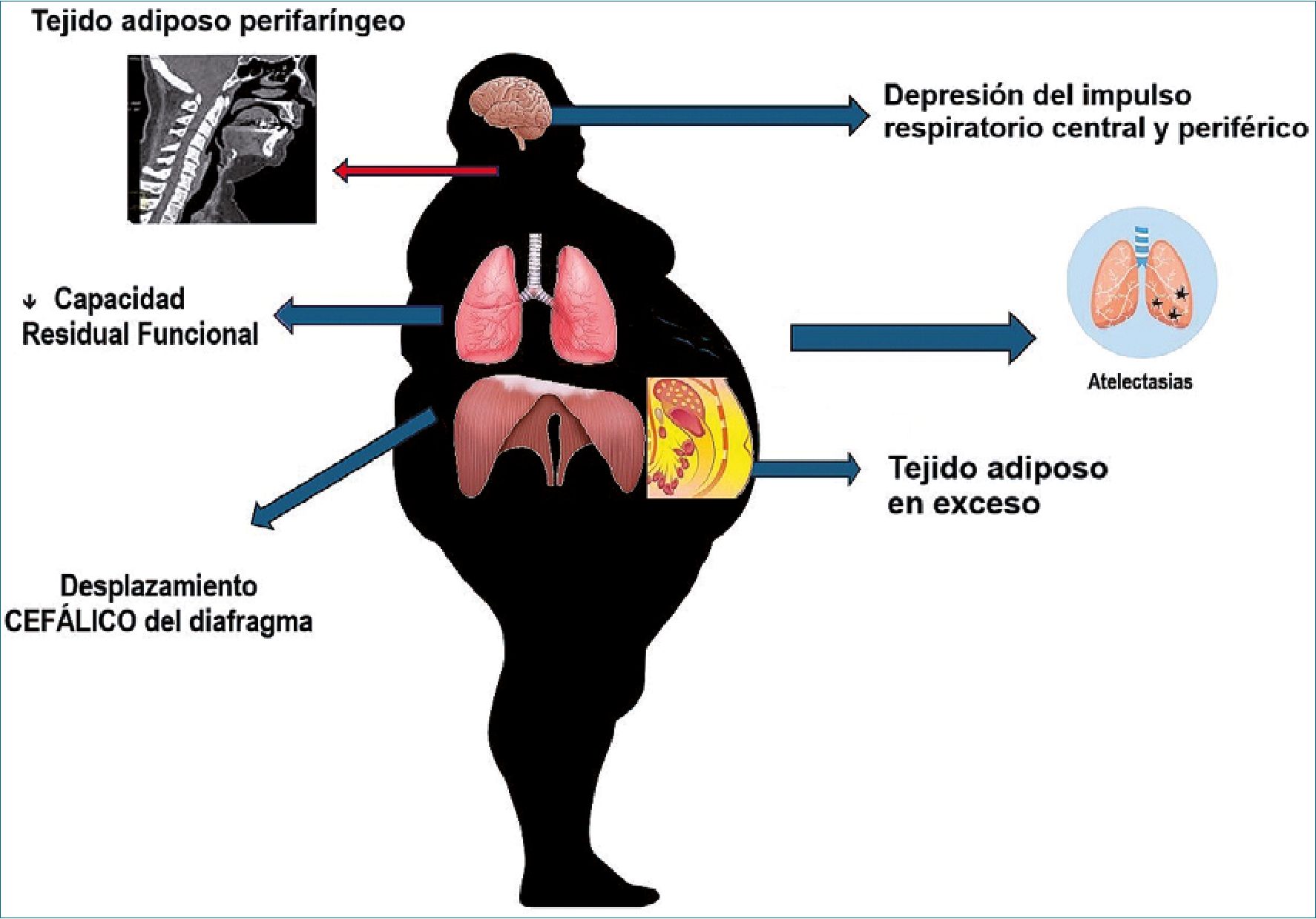
Figura 1.
Tabla 3. Factores de Riesgo asociados a la aparición de CPP

Abreviaturas: ASA = Estado Físic de la American Society of Anesthesiologisth; EPOC = Enfermedad Obstructiva Crónica; AOS = Apnea Obstructiva del Sueño; IMC = Índice de Masa Corporal; HAS = Hipertensión Arterial Sistémica; FEV1 = Volumen Espiratorio Forzado en 1 segundo; FVC = Capacidad Vital Forzada.
Tabla 4. Principales escalas para la predicción de complicaciones pulmonares posoperatorias

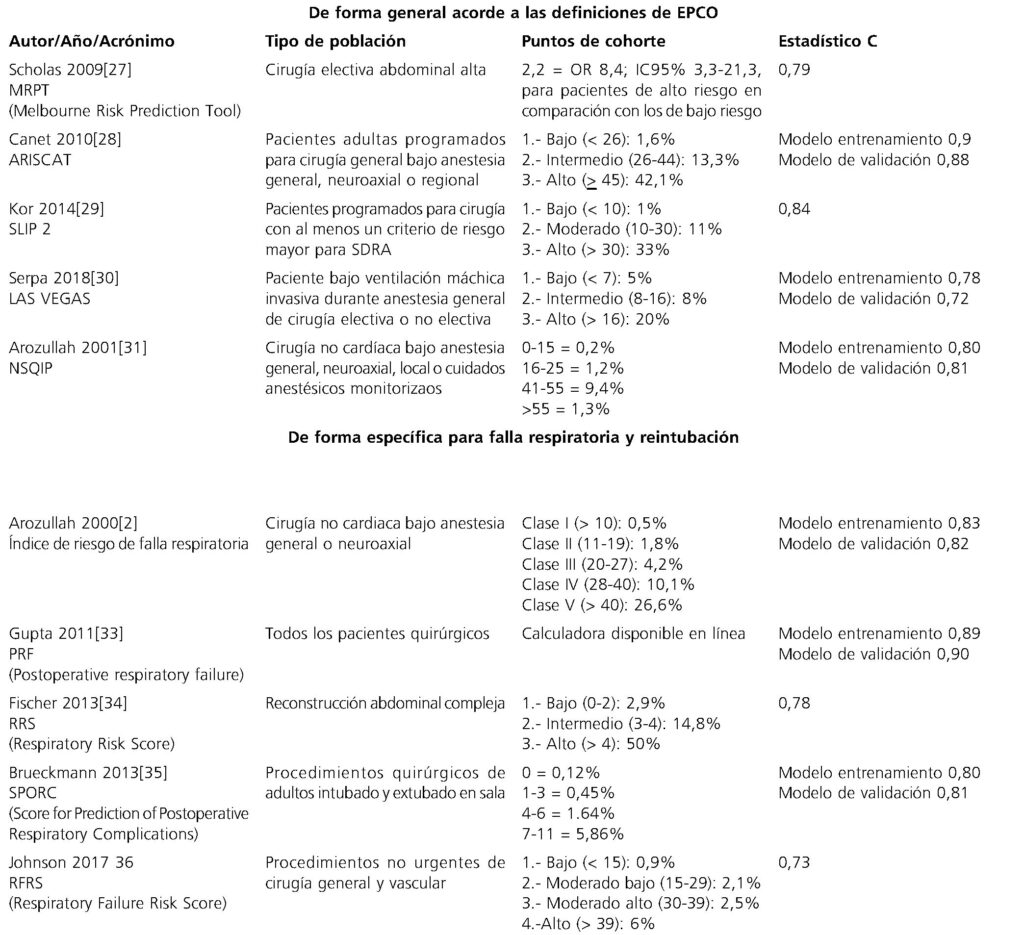
Escalas para la estratificación de riesgo
El cambio demográfico y la mejora continua en atención médica han conducido a un número cada vez mayor de pacientes programados para cirugía electiva, pacientes que cuentan con una complejidad cada vez más alta, debido principalmente a sus comorbilidades y edades más avanzadas. Las escalas de predicción se utilizan para medir la incertidumbre de algún evento, en otras palabras, tratan de predecir la probabilidad de dicho evento, reflejan un continuo entre la certeza y la imposibilidad absolutas de que ocurra el evento estudiado, las condiciones que modifican este continuo se denominan “factores de riesgo”[23].
Las escalas de riesgo se pueden dividir en dos grandes grupos: aquellas que predicen riesgos en general: complicaciones pulmonares postoperatorias (CPP) y aquellas que predicen riesgos en específicos: riesgo para falla respiratoria y reintubación[22]. Actualmente, existen un gran repertorio de herramientas destinadas para la predicción de CPP, pero ¿cómo decidir cuál utilizar? ¿O existe una mejor que otra? Para tomar estas decisiones lo que debemos realizar es contestar las siguientes preguntas[24]:
• ¿La escala cuanta con validación externa?: Las escalas tienden a funcionar mejor en la muestra en la que se crearon. La única medida de su rendimiento es qué tan bien predice el resultado en una muestra nueva y separada.
• ¿Esta validación se ha realizado en una población de interés?: La población de la muestra de validación debe tener características, factores de riesgo y riesgo de referencia similares a los de la muestra de derivación.
• ¿La escala se basa en una metodología sólida?: Los estudios de predicción de riesgos deben basarse en un protocolo.
• ¿Reporta información esencial?: Todas las escalas deben informar tanto las medidas de discriminación como de calibración.
• ¿Es útil, factible y aceptable?: La escala debe proporcionar información útil, incluidas categorías de riesgo claramente definidas y riesgos absolutos.
• ¿La escala sigue un protocolo?: Un componente clave para que el estudio proporcione una representación precisa de su desempeño.
• ¿Cómo se seleccionaron las variables candidatas?: Las variables deben de tener un respaldo de por qué se incluyeron en el modelo, no se trata de incluir variables de manera indiscriminada.
• ¿Cómo se ponderan las variables?: No todas las variables se asocian de la misma manera en términos de riesgo con el desenlace.
• ¿Cómo se seleccionaron otros parámetros?: Se debe tener siempre en consideración aquellas variables que pudieran impactar en el desenlace, pero que de primera instancia no fueron tomadas en cuanta.
• ¿Se ha realizado una validación interna?: Siempre se debe de describir la estadística utilizada para este fin, por ejemplo: bootstrapping.
Cuando se responden estas preguntas lo primero que se observa es que las principales escalas para determinar los factores de riesgo de CPP es que su población objetivo no supera el IMC mayor de 30 kg/m2, por lo que su aplicabilidad y probable ajuste, debe ser probado en cohortes de pacientes con obesidad.
Una vez conocido el método para evaluar la escala a utilizar, también es importante saber interpretar las pruebas estadísticas utilizadas para medir el desempeño de dicha escala, siendo el valor estadístico C el más ampliamente utilizado. Este valor mide la capacidad de los modelos de ajuste de riesgo para predecir con precisión resultados binarios en un modelo de regresión logística[25], en otras palabras, da la probabilidad de que un paciente seleccionado al azar que experimentó el evento tuviera una puntuación de riesgo más alta que un paciente que no experimentó el evento. Por último, pero no menos importante, para la correcta elección de una herramienta también se debe de tomar en cuenta el desenlace buscado (mortalidad, falla respiratoria, etc.) y el tipo de población utilizada (cirugía de cadera y cuello, cirugía de tórax, cirugía robótica, etc.), esto porque, si desde que se concibió la creación de la herramienta no fueron especificadas estas características, dicha herramienta disminuirá de manera importante su desempeño en la vida real[26].
En la Tabla 4 se muestran las principales escalas utilizadas para la predicción de forma general de las CPP (parte superior) y las escalas utilizadas para predicción especifica: riesgo de falla respiratoria y reintubación (parte inferior). En ambas se detallan sus principales características a tomar en cuanta al momento de decidir cuál utilizar. Un detalle para tomar en cuenta al momen to de seleccionar la escala es que ninguna fue validada para población con sobrepeso u obesidad como se mencionó anteriormente.
Estrategias de prevención
Las escalas de riesgo ayudan a predecir la probabilidad y el riesgo de desencadenar alguna CPP, pero parte del trabajo del anestesiólogo es brindar estrategias encaminadas a reducir lo más posible esa probabilidad. Se ha demostrado que los antecedentes preoperatorios de tabaquismo, asma, enfermedad pulmonar obstructiva crónica o apnea obstructiva del sueño, si bien están asociados al desarrollo de CPP, no son en sí mismos lo que conduce a las CPP, sino sus efectos sobre los pulmones al momento de la cirugía. Para el paciente con obesidad y sin obesidad[37], determinadas estrategias preoperatorias han demostrado un impacto significativo en la reducción de CPP. Vamos a numerar las más significativas separándolas en estrategias preoperatorias, intraoperatorias y posoperatorias:
A) Preoperatorias
La valoración preanestésica debe hace énfasis en reportar el IMC, tamaño de la lengua, comorbilidades, oxigenación al aire ambiente, circunferencia del cuello, datos de insuficiencia cardiaca, valoración de la vía aérea, así como cuestionarios de tamizaje: ARISCAT, American College of Physicians y STOPBANG.
1. Fomentar pérdida de peso: una reducción de peso de aproximadamente 7,4 kg contribuye a la reducción de las cifras tensionales, mejoran los niveles de lípidos en sangre y mejora la resistencia a la insulina[38]. La manipulación del hígado en la cirugía bariátrica es esencial y con la pérdida de peso se reducen los niveles de grasa intrahepática, lo que permite un mejor acceso a la unión gastroesofágica durante la cirugía bariátrica laparoscópica[39]. Las guías ERAS para el manejo del paciente sometido a cirugía bariátrica respecto a esta recomendación tiene un nivel de evidencia: alto con un grado de recomendación: fuerte[40].
2. Prehabilitación con CPAP: los pacientes que cuentan con diagnóstico de Apnea Obstructiva del Sueño (AOS) y serán programados para cirugía bariátrica la evidencia sugiere el uso de CPAP (Presión Continúa de la Vía Aérea, por sus siglas en inglés) mínimo 8 semanas previas a la cirugía, con lo cual disminuye la incidencia de complicaciones cardiacas, falla respiratoria postoperatoria, atelectasias, y riesgo de reintubación[41]. Las guías ERAS para cirugía bariátrica no recomienda su uso de manera rutinaria con un nivel de evidencia moderado y un grado de recomendación dé- bil40.
B) Intraoperatorio
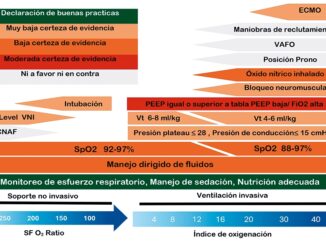
1. Ventilación de protección: la evolución de la ventilación mecánica invasiva ha permitido ajustar los parámetros ventilatorios y sus consecuentes metas para lograr el mejorar desenlace acorde a cada escenario quirúrgico y la cirugía bariátrica no es la excepción. En la Figura 2, se resumen la evidencia más reciente para el manejo intraoperatorio del paciente sometido a cirugía bariátrica y con obesidad.
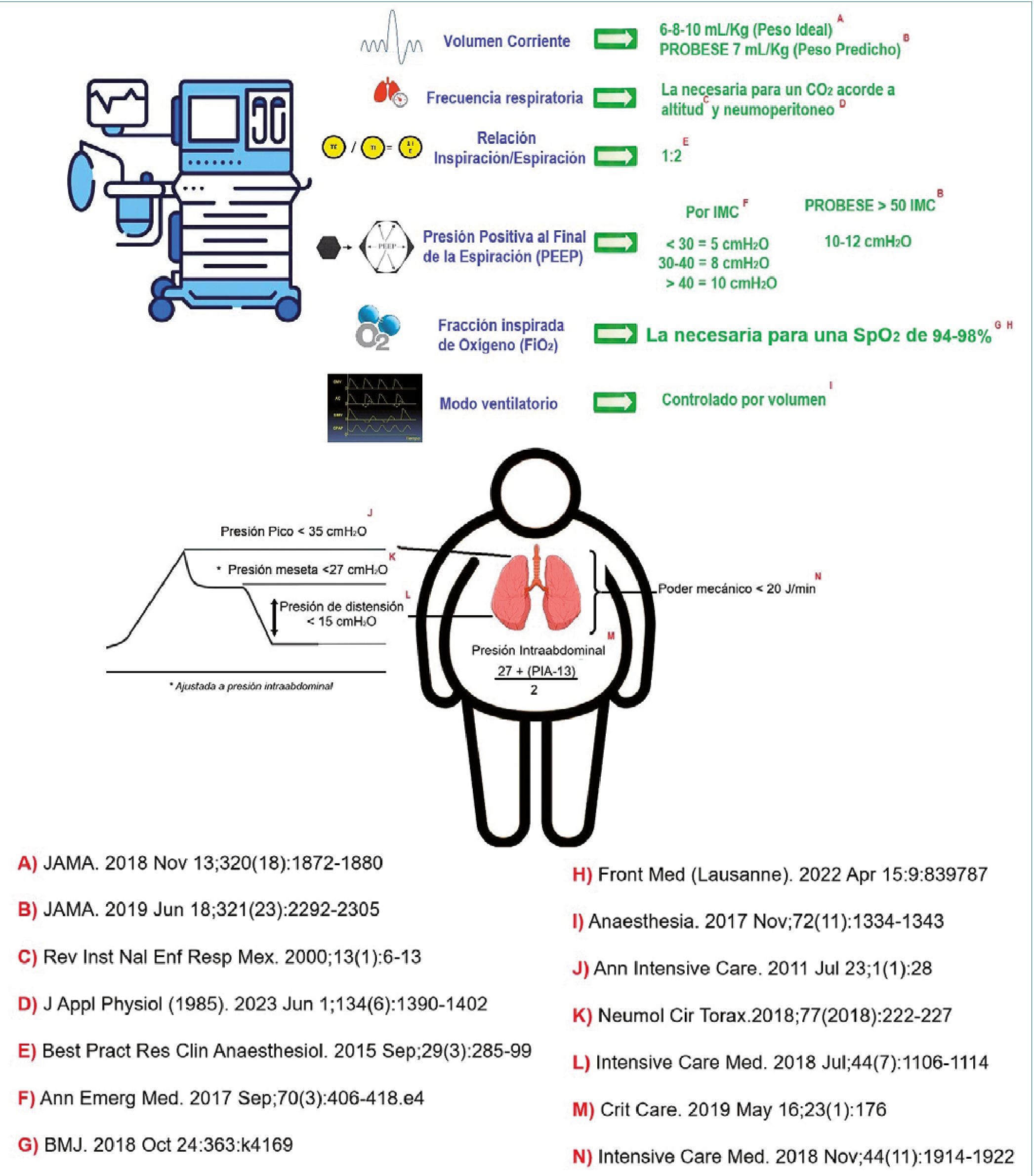
Figura 2. Programación del ventilador y metas de protección pulmonar en el paciente con obesidad. Tomado y modificado de: Guerrero-Gutiérrez MA, Escarramán-Martínez D, Solís-Pérez GA. Ventilación Mecánica en el Paciente con Obesidad. En: Guerrero-Gutiérrez MA, coordinador. Anestesiología Bariátrica y para el paciente con obesidad. 1ra ed. México: Ediciones Prado; 2024.
C) Posoperatorio
Las recomendaciones más importantes en este rubro son: analgesia adecuada, movilización precoz, tromboprofilaxis, uso de CPAP en la unidad de cuidados postanestésicos. Dos acciones tienen un peso mayor en cuanto a la evidencia:
1. Extubación por presión soporte: el retiro de la ventilación mecánica por presión soporte comparado con el bolseo intermitente demostró una reducción en los niveles de ate- lectasias (33% vs 57%, mejora los niveles de saturación periférica de oxígeno (SpO2) en la unidad de cuidados postanestésicos (19% vs 22%) y un aumento en los niveles de presión arterial de oxígeno (PaO2) 92 ± 26 mmHg vs 83 ± 13 mmHg.
2. Oxigenoterapia en unidad de cuidado post anestésico: los objetivos de la oxigenoterapia posoperatoria deben ser mantener la normoxemía y evitar la administración innecesaria de oxígeno. Las pautas actuales para el uso de oxígeno recomiendan, encarecidamente, que la saturación de oxígeno no se mantenga por encima del 96% para la mayoría de los pacientes en entornos de cuidados intensivos, incluidos los pacientes postoperatorios. La administración de oxígeno suplementario debe iniciarse cuando la SpO2 es menor de 92% en la unidad de cuidados posanestésicos. Por desgracia, aún no existe un estudio con la adecuada metodología que indique una recomendación en la población sometida a cirugía bariátrica.
3. Ventilación No Invasiva postoperatoria: debido a la alta prevalencia de transtornos respiratorios del sueño en esta cohorte, el uso de ventilación no invasiva (CPAP, BiPAP, Canulas Nasales de Alto Flujo) ha mostrado beneficios en diferentes metaanalisis. La identificación de riesgos preoperatorios puede guiar la decisión de su inicio en el postoperatorio.
Conclusión
Debido a la epidemia de obesidad, es cada vez más frecuente que el anestesiólogo se enfrente a este tipo de pacientes, no solo para cirugía bariátrica, si no de manera rutinaria para cualquier otro tipo de intervención o cirugía. Las CPP es la complicación más frecuente dentro del ámbito de la anestesiología. Probablemente, las atelectasias con la CPP principal para los anestesiólogos. Es por ello por lo que es un tema medular para la formación de todo anestesiólogo. Su comprensión es fundamental para brindar las mejores estrategias para reducir su incidencia.
Referencias
1. Yang CK, Teng A, Lee DY, Rose K. Pulmonary complications after major abdominal surgery: National Surgical Quality Improvement Program analysis. J Surg Res. 2015 Oct;198(2):441–9. https://doi.org/10.1016/j.jss.2015.03.028 PMID:25930169
2. Smith NA, Martin G, Marginson B. Preoperative assessment and prehabilitation in patients with obesity undergoing non-bariatric surgery: A systematic review. J Clin Anesth. 2022 Jun;78:110676. https://doi.org/10.1016/j.jclinane.2022.110676 PMID:35152081
3. Miskovic A, Lumb AB. Postoperative pulmonary complications. Br J Anaesth. 2017 Mar;118(3):317–34. https://doi.org/10.1093/bja/aex002 PMID:28186222
4. Ortiz VE, Kwo J. Obesity: physiologic changes and implications for preoperative management. BMC Anesthesiol. 2015 Jul;15(1):97. https://doi.org/10.1186/s12871-015-0079-8 PMID:26141622
5. Anderson MR, Shashaty MG. Impact of Obesity in Critical Illness. Chest. 2021 Dec;160(6):2135–45. https://doi.org/10.1016/j.chest.2021.08.001 PMID:34364868
6. Covarrubias J, Grigorian A, Schubl S, Gambhir S, Dolich M, Lekawa M, et al. Obesity associated with increased postoperative pulmonary complications and mortality after trauma laparotomy. Eur J Trauma Emerg Surg. 2021 Oct;47(5):1561–8. https://doi.org/10.1007/s00068-020-01329-w PMID:32088754
7. Smetana GW, Lawrence VA, Cornell JE; American College of Physicians. Preoperative pulmonary risk stratification for noncardiothoracic surgery: systematic review for the American College of Physicians. Ann Intern Med. 2006 Apr;144(8):581–95. https://doi.org/10.7326/0003-4819-144-8-200604180-00009 PMID:16618956
8. Bluth T, Serpa Neto A, Schultz MJ, Pelosi P, Gama de Abreu M, Bluth T, et al.; Writing Committee for the PROBESE Collaborative Group of the PROtective VEntilation Network (PROVEnet) for the Clinical Trial Network of the European Society of Anaesthesiology; PROBESE Collaborative Group. Effect of Intraoperative High Positive End-Expiratory Pressure (PEEP) With Recruitment Maneuvers vs Low PEEP on Postoperative Pulmonary Complications in Obese Patients: A Randomized Clinical Trial [Erratum in: JAMA. 2019 Nov 12;322] [18] [:1829-1830. PMID: 31157366; PMCID: PMC6582260]. JAMA. 2019 Jun;321(23):2292–305. https://doi.org/10.1001/jama.2019.7505 PMID:31157366
9. Hemmes SN, Gama de Abreu M, Pelosi P, Schultz MJ; PROVE Network Investigators for the Clinical Trial Network of the European Society of Anaesthesiology. High versus low positive end-expiratory pressure during general anaesthesia for open abdominal surgery (PROVHILO trial): a multicentre randomised controlled trial. Lancet. 2014 Aug;384(9942):495–503. https://doi.org/10.1016/S0140-6736(14)60416-5 PMID:24894577
10. Solís-Pérez GA, Antolinez-Motta JM. Complicaciones Pulmonares Postoperatorias. En: Guerrero-Gutiérrez MA, coordinador. Anestesiología Bariátrica y para el paciente con obesidad. 1ra ed. México: Ediciones Prado; 2024.
11. Jammer I, Wickboldt N, Sander M, Smith A, Schultz MJ, Pelosi P, et al.; European Society of Anaesthesiology (ESA) and the European Society of Intensive Care Medicine (ESICM); European Society of Anaesthesiology; European Society of Intensive Care Medicine. Standards for definitions and use of outcome measures for clinical effectiveness research in perioperative medicine: European Perioperative Clinical Outcome (EPCO) definitions: a statement from the ESA-ESICM joint taskforce on perioperative outcome measures. Eur J Anaesthesiol. 2015 Feb;32(2):88–105. https://doi.org/10.1097/EJA.0000000000000118 PMID:25058504
12. Zeng C, Lagier D, Lee JW, Vidal Melo MF. Perioperative Pulmonary Atelectasis: Part I. Biology and Mechanisms. Anesthesiology. 2022 Jan;136(1):181–205. https://doi.org/10.1097/ALN.0000000000003943 PMID:34499087
13. Serin SO, Işıklar A, Karaören G, El-Khatib MF, Caldeira V, Esquinas A. Atelectasis in Bariatric Surgery: Review Analysis and Key Practical Recommendations [Erratum in: Turk J Anaesthesiol Reanim. 2020 Dec;48] [6] [:520. PMID: 31828239; PMCID: PMC6886827]. Turk J Anaesthesiol Reanim. 2019 Dec;47(6):431–8. https://doi.org/10.5152/TJAR.2019.66564 PMID:31828239
14. Warner DO, Weiskopf RB. Preventing postoperative pulmonary complications: the role of the anesthesiologist. Anesthesiology. 2000 May;92(5):1467–72. https://doi.org/10.1097/00000542-200005000-00037 PMID:10781293
15. Ramachandran SK, Nafiu OO, Ghaferi A, Tremper KK, Shanks A, Kheterpal S. Independent predictors and outcomes of unanticipated early postoperative tracheal intubation after nonemergent, noncardiac surgery. Anesthesiology. 2011 Jul;115(1):44–53. https://doi.org/10.1097/ALN.0b013e31821cf6de PMID:21552116
16. Rivas E, Arismendi E, Agustí A, Sanchez M, Delgado S, Gistau C, et al. Ventilation/Perfusion distribution abnormalities in morbidly obese subjects before and after bariatric surgery. Chest. 2015 Apr;147(4):1127–34. https://doi.org/10.1378/chest.14-1749 PMID:25317652
17. Hodgson LE, Murphy PB, Hart N. Respiratory management of the obese patient undergoing surgery. J Thorac Dis. 2015 May;7(5):943–52. https://doi.org/10.3978/j.issn.2072-1439.2015.03.08 PMID:26101653
18. Pépin JL, Timsit JF, Tamisier R, Borel JC, Lévy P, Jaber S. Prevention and care of respiratory failure in obese patients. Lancet Respir Med. 2016 May;4(5):407–18. https://doi.org/10.1016/S2213-2600(16)00054-0 PMID:27304558
19. De Jong A, Wrigge H, Hedenstierna G, Gattinoni L, Chiumello D, Frat JP, et al. How to ventilate obese patients in the ICU. Intensive Care Med. 2020 Dec;46(12):2423–35. https://doi.org/10.1007/s00134-020-06286-x PMID:33095284
20. Ford GT, Grant DA, Rideout KS, Davison JS, Whitelaw WA. Inhibition of breathing associated with gallbladder stimulation in dogs. J Appl Physiol (1985). 1988 Jul;65(1):72-9. https://doi.org/10.1152/jappl.1988.65.1.72.. PMID: 3403496.
21. Sharma RR, Axelsson H, Oberg A, Jansson E, Clergue F, Johansson G, et al. Diaphragmatic activity after laparoscopic cholecystectomy. Anesthesiology. 1999 Aug;91(2):406–13. https://doi.org/10.1097/00000542-199908000-00014 PMID:10443603
22. Escarraman MD, Solis PG, Guerrero GM, et al. Manual de escalas para valoración preanestésica. Ediciones Prado; 2022. p. 71.
23. Pace NL, Eberhart LH, Kranke PR. Quantifying prognosis with risk predictions. Eur J Anaesthesiol. 2012 Jan;29(1):7–16. https://doi.org/10.1097/EJA.0b013e32834d9474 PMID:22089517
24. Fazel S, Wolf A. Selecting a risk assessment tool to use in practice:a 10-point guide. Evid Based Ment Health. 2018 May;21(2):41–3. https://doi.org/10.1136/eb-2017-102861 PMID:29269440
25. Wey A, Salkowski N, Kasiske BL, Skeans MA, Gustafson SK, Israni AK, et al. The relationship between the C-statistic and the accuracy of program-specific evaluations. Am J Transplant. 2019 Feb;19(2):407–13. https://doi.org/10.1111/ajt.15132 PMID:30282119
26. Nijbroek SG, Schultz MJ, Hemmes SN. Prediction of postoperative pulmonary complications. Curr Opin Anaesthesiol. 2019 Jun;32(3):443–51. https://doi.org/10.1097/ACO.0000000000000730 PMID:30893115
27. Scholes RL, Browning L, Sztendur EM, Denehy L. Duration of anaesthesia, type of surgery, respiratory co-morbidity, predicted VO2max and smoking predict postoperative pulmonary complications after upper abdominal surgery: an observational study. Aust J Physiother. 2009;55(3):191–8. https://doi.org/10.1016/S0004-9514(09)70081-9 PMID:19681741
28. Canet J, Gallart L, Gomar C, Paluzie G, Vallès J, Castillo J, et al.; ARISCAT Group. Prediction of postoperative pulmonary complications in a population-based surgical cohort. Anesthesiology. 2010 Dec;113(6):1338–50. https://doi.org/10.1097/ALN.0b013e3181fc6e0a PMID:21045639
29. Kor DJ, Lingineni RK, Gajic O, Park PK, Blum JM, Hou PC, et al. Predicting risk of postoperative lung injury in high-risk surgical patients: a multicenter cohort study. Anesthesiology. 2014 May;120(5):1168–81. https://doi.org/10.1097/ALN.0000000000000216 PMID:24755786
30. Neto AS, da Costa LG, Hemmes SN, Canet J, Hedenstierna G, Jaber S, et al.; LAS VEGAS. The LAS VEGAS risk score for prediction of postoperative pulmonary complications: an observational study. Eur J Anaesthesiol. 2018 Sep;35(9):691–701. https://doi.org/10.1097/EJA.0000000000000845 PMID:29916860
31. Arozullah AM, Khuri SF, Henderson WG, Daley J; Participants in the National Veterans Affairs Surgical Quality Improvement Program. Development and validation of a multifactorial risk index for predicting postoperative pneumonia after major noncardiac surgery. Ann Intern Med. 2001 Nov;135(10):847–57. https://doi.org/10.7326/0003-4819-135-10-200111200-00005 PMID:11712875
32. Arozullah AM, Daley J, Henderson WG, Khuri SF; The National Veterans Administration Surgical Quality Improvement Program. Multifactorial risk index for predicting postoperative respiratory failure in men after major noncardiac surgery. Ann Surg. 2000 Aug;232(2):242–53. https://doi.org/10.1097/00000658-200008000-00015 PMID:10903604
33. Gupta H, Gupta PK, Fang X, Miller WJ, Cemaj S, Forse RA, et al. Development and validation of a risk calculator predicting postoperative respiratory failure. Chest. 2011 Nov;140(5):1207–15. https://doi.org/10.1378/chest.11-0466 PMID:21757571
34. Fischer JP, Shang EK, Butler CE, Nelson JA, Braslow BM, Serletti JM, et al. Validated model for predicting postoperative respiratory failure: analysis of 1706 abdominal wall reconstructions. Plast Reconstr Surg. 2013 Nov;132(5):826e–35e. https://doi.org/10.1097/PRS.0b013e3182a4c442 PMID:24165634
35. Brueckmann B, Villa-Uribe JL, Bateman BT, Grosse-Sundrup M, Hess DR, Schlett CL, et al. Development and validation of a score for prediction of postoperative respiratory complications. Anesthesiology. 2013 Jun;118(6):1276–85. https://doi.org/10.1097/ALN.0b013e318293065c PMID:23571640
36. Johnson AP, Altmark RE, Weinstein MS, Pitt HA, Yeo CJ, Cowan SW. Predicting the Risk of Postoperative Respiratory Failure in Elective Abdominal and Vascular Operations Using the National Surgical Quality Improvement Program (NSQIP) Participant Use Data File. Ann Surg. 2017 Dec;266(6):968–74. https://doi.org/10.1097/SLA.0000000000001989 PMID:27607099
37. Lumb AB. Pre-operative respiratory optimisation: an expert review. Anaesthesia. 2019 Jan;74(S1 Suppl 1):43–8. https://doi.org/10.1111/anae.14508 PMID:30604419
38. Edholm D, Kullberg J, Karlsson FA, Haenni A, Ahlström H, Sundbom M. Changes in liver volume and body composition during 4 weeks of low calorie diet before laparoscopic gastric bypass. Surg Obes Relat Dis. 2015;11(3):602–6. https://doi.org/10.1016/j.soard.2014.07.018 PMID:25547052
39. van Wissen J, Bakker N, Doodeman HJ, Jansma EP, Bonjer HJ, Houdijk AP. Preoperative Methods to Reduce Liver Volume in Bariatric Surgery: a Systematic Review. Obes Surg. 2016 Feb;26(2):251–6. https://doi.org/10.1007/s11695-015-1769-5 PMID:26123526
40. Thorell A, MacCormick AD, Awad S, Reynolds N, Roulin D, Demartines N, et al. Guidelines for Perioperative Care in Bariatric Surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations. World J Surg. 2016 Sep;40(9):2065–83. https://doi.org/10.1007/s00268-016-3492-3 PMID:26943657

 ORCID
ORCID