Manuel Alberto Guerrero Gutiérrez MD.’, Jesús Elias Ortiz Gómez MD.2, Carlos Zerrweck López MD.3, Alberto Iván González Barajas MD.3, Adriana Méndez Díaz MD.4, Diego Escarramán Martínez5
Recibido: 05-06-2024
Aceptado: 12-06-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 4 pp. 415-420|https://doi.org/10.25237/revchilanestv53n4-17
PDF|ePub|RIS
Abstract
By recent count, 579,517 bariatric metabolic operations and 14,725 endoluminal procedures are performed annually worldwide, with the most common procedure being laparoscopic sleeve gastrectomy followed by laparoscopic Roux-en-Y gastric bypass. In the bariatric surgery population, postoperative nausea and vomiting (PONV) occurs in 80% compared to 40% in the general surgery population. It has been suggested that prophylactic antiemetic approaches using three or more agents may be more effective than single- or two-agent regimens. The objective of this study is to evaluate the efficacy of Ondansetron 16 mg + Metoclopramide 20 mg + Dexamethasone 8 mg (group 1) vs Ondansetron 8 mg + Dexamethasone 8 mg (group 2) vs Ondansetron 8 mg + Metoclopramide 10 mg + Dexamethasone 8 mg (group 3) for Prevention of postoperative nausea and vomiting (PONV) in patients undergoing laparoscopic gastric sleeve. The main basis for this evaluation will be to evaluate the incidence of PONV during 0, 6,12 and 24 hours. 400 patients with BMI > 30 kg/m and undergoing laparoscopic gastric sleeve were included in this randomized study, during the period of December 2022 until may 2023. In the three groups, a prophylactic scheme for PONV was administered. PONV was evaluated at 0, 6, 12, and 24 postoperative hours. Comparisons of the frequency of nausea at different post-surgical times between the 3 treatment groups are shown. Differences were observed only in nausea in the post-surgical recovery period, where subjects with group 1 treatment presented a lower frequency of nausea at comparison with the subjects in group 3 treatment (p < 0.0001), but not with the subjects in group 2 (p = 0.27), similarly it is observed that the subjects in group 3 have a greater frequency of nausea compared to those in group 2 (p < 0.0001). Using 8 mg of dexamethasone and 8 mg of Ondansetron as PONV for gastric sleeve-type bariatric surgery obtains better results than in the other 2 groups, with fewer side effects and greater savings in supplies.
Resumen
Anualmente se realizan en todo el mundo 579.517 operaciones metabólicas bariátricas y 14.725 procedimientos endoluminales, siendo el procedimiento más común la gastrectomía en manga laparoscópica y seguida del gástrico en Y de Roux laparoscópico. En la población de cirugía bariátrica, las náuseas y vómitos postoperatorios (NVPO) ocurren en el 80% en comparación con el 40% en la población de cirugía general. Se ha sugerido que los enfoques antieméticos profilácticos que utilizan tres o más agentes pueden ser más efectivos que los regímenes de uno o dos agentes. El objetivo de este estudio es evaluar la eficacia de Ondansetron 16 mg+ Metoclopramida 20 mg + Dexametasona 8 mg (grupo 1) vs 8 mg ondansetrón + 8 mg de dexametasona (grupo 2) vs Ondansetron 8 mg + Metoclopramida 10 mg + Dexametasona 8 mg (grupo 3) para la prevención de las náuseas y los vómitos posoperatorios (NVPO) en pacientes sometidos a manga gástrica laparoscópica. La base principal para esta evaluación será evaluar la incidencia de NVPO durante 0, 6,12 y 24 h. En este estudio aleatorizado se incluyeron 400 pacientes con IMC > 30 kg/m y sometidos a manga gástrica laparoscópica, durante el período de diciembre de 2022 hasta mayo de 2023. En los tres grupos se administró un esquema profiláctico para NVPO. Se muestran las comparaciones de la frecuencia de náuseas a distintos tiempos del posquirúrgico entre los 3 grupos de tratamiento, se observaron diferencias, únicamente, en las náuseas en el posquirúrgico de recuperación, donde los sujetos con el tratamiento del grupo 1 presentaron una menor frecuencia de náuseas a comparación con los sujetos en tratamiento grupo 3 (p < 0,0001), pero no así con los sujetos en grupo 2 (p = 0,27), de igual manera se observó que los sujetos en la grupo 3 tienen mayor frecuencia de náuseas en comparación con aquellos en la grupo 2 (p < 0,0001). El utilizar 8 mg de dexametasona y 8 mg de Ondansetron como NVPO para cirugía bariátrica de tipo manga gástrica, obtiene mejores resultados que en los otros 2 grupos, con menos efectos secundarios y mayor ahorro en los insumos.
Introducción
Según datos de la Organización Mundial de la Salud (OMS), en el 2016, más de 1.900 millones de adultos de 18 años o más tenían sobrepeso, de los cuales, más de 650 millones eran obesos[1]. Con el aumento de la obesidad, el número de procedimientos bariátricos ha aumentado en consecuencia. La cirugía bariátrica continúa siendo el tratamiento más efectivo y duradero para la obesidad mórbida y sus comorbilidades relacionadas en comparación con las intervenciones no quirúrgicas.
Según recuento reciente, anualmente se realizan en todo el mundo 579.517 operaciones metabólicas bariátricas y 14.725 procedimientos endoluminales[2], siendo el procedimiento más común la gastrectomía en manga laparoscópica (45,9%) seguida del bypass gástrico en Y de Roux laparoscópico (39,5%)[3].
En la población de cirugía bariátrica, las náuseas y vómitos posoperatorios (NVPO) ocurren a una tasa de casi el 80% en comparación con hasta el 40% en la población de cirugía general. Los procedimientos bariátricos novedosos, como la inserción de un balón intragástrico doble, se pueden asociar con el 98,7% de los pacientes que experimentan NVPO[4]. Esto es mucho más alto que la tasa esperada de menos del 10% para la mayoría de los procedimientos quirúrgicos, a pesar de seguir las recomendaciones actuales.
La gastrectomía en manga laparoscópica parecer ser el más emetógeno de todos los procedimientos quirúrgicos bariátricos estándar. Si bien la tasa de reingreso parece más común con el bypass gástrico que con la gastrectomía en manga laparoscópica, esta última está más asociada con reingresos debido a náuseas y vómitos.
Además del efecto directo sobre la comodidad y satisfacción del paciente, las NVPO prolongan el tiempo de permanencia en la unidad de cuidados postanestésicos y son una causa frecuente de reingreso después de cirugía metabólica y bariátrica.
Aunque la obesidad no es un factor de riesgo de NVPO, los pacientes que se someten a cirugía bariátrica son más propensos a experimentar NVPO en comparación con pacientes normopeso que se someten a procedimientos gástricos, especialmente, en aquellos pacientes con IMC > 40 kg/m2[4],[5]. Así como las condiciones que afectan la unión gastroesofágica, incluida la hernia hiatal y la obesidad, sangre y secreciones en el estómago, la elección de la técnica anestésica y la duración de la cirugía, también pueden colocar a los pacientes de Cirugía bariátrica en mayor riesgo. en comparación con otras poblaciones quirúrgicas. Son especialmente vulnerables a sus secuelas, que en gran medida se derivan de la presión intraabdominal elevada. Éstos incluyen aumento de la tensión de la sutura, dehiscencia de la anastomosis y, en casos graves, rotura esofágica, deshidratación, desequilibrio electrolítico, hipertensión venosa y posible aspiración del contenido gástrico[4]-[6].
La disminución de las NVPO en el período perioperatorio en pacientes de alto riesgo actualmente es rentable. Varios medicamentos ahora son genéricos y el costo de la profilaxis es bajo. Por el contrario, la estancia prolongada en la unidad de cuidados postanestésicos para el tratamiento de las NVPO se asocia con costos elevados[7],[8].
Se ha sugerido que los enfoques antieméticos profilácticos que utilizan tres o más agentes pueden ser más efectivos que los regímenes de uno o dos agentes. Esto es de esperar, ya que ningún antiemético por sí solo ha sido completamente eficaz para la prevención de NVPO en pacientes de alto riesgo, y los fármacos con diferentes mecanismos de acción a menudo tienen un efecto aditivo cuando se usan en combinación. Este último es, especialmente, ventajoso en el contexto de NVPO, que tiene una etiología multifactorial. Sin embargo, las guias ERAS de cirugía bariatrica recomiendan un tratamiento multimodal con Ondansetron y Dexametasona[9] y el cuarto consenso de NVPO recomienda entre sus medicamentos la metoclopramida[10].
Es importante tomar en cuenta que el utilizar más medicamentos en poblaciones de riesgo conlleva a mayores efectos secundarios, más no siempre es mejor[11], así como el uso de más medicamentos confiere mayores gastos en términos de fármaco economía que junto con los efectos secundarios puede llevar a complicaciones como aumento en los días de estancia intrahospitalaria (DEIH)[12].
This study hypothesized that que el uso de una terapia dual con 8 mg de dexamentasona y 8 mg de ondansetron se asocia a menos complicaciones que terapias con 2 o más fármacos para profilaxis de PONV.
Metodología
Desde diciembre de 2022 a mayo de 2023, se realizó un estudio unicéntrico aleatorizado de 400 pacientes sometidos a gastrectomía en manga laparoscópica. El estudio se apegó a las guias CONSORT[13] para informes de juicio. Se aprobó el comité de Etica e Investigación y cuenta con el registro del clinical trials NCT05772676 y todos los pacientes o sus familiares dieron su consentimiento informado por escrito.
Los Criterios de Inclusión fueron los siguientes: 18 a 65 años, no fumadores, obesidad con IMC > 30 kg/m2, sometidos a manga gástrica laparoscópica. Los criterios de exclusión fueron los siguientes: hipersensibilidad documentada a cualquier componente del régimen del estudio, tratamiento actual con: orap (pimozida), seldane (terfenadina), hismanal (astemizol) o propulsid (cisaprida), alergia a los fármacos opioides utilizados en el protocolo anestésico. Abuso de drogas o alcohol, náuseas y vómitos crónicos, procedimientos bariátricos previos.
Aleatorización e intervenciones
Se inscribieron y aleatorizaron un total de 400 pacientes consecutivos en una proporción de 1:1. El grupo de casos recibió un régimen profiláctico de “atención estándar” para las NVPO del grupo 1 (dexametasona 16 mg, ondansetrón 16 mg y metoclopramida 20 mg), frente al grupo 2 (dexametasona 8 mg, ondansetrón 8 mg), frente al grupo 3 (dexametasona 8 mg, ondansetrón 8 mg, metoclopramida 10 mg). Se realizó un análisis comparativo de factores demográficos, antropométricos y perioperatorios. Las NVPO se evaluaron a las 0, 6, 12 y 24 h. La anestesia fue realizada con fentanilo a concentración plasmática de entre 2-5 ng/ml de concentración plasmática y sevoflurano 0,6-1 CAM.
Descripción general y justificación del tamaño de la muestra
El cálculo de la muestra fue diseñado para el estudio principal, el cual comparó estos medicamentos vs Aprepitant. Tomando en cuenta el metaanálisis de Singh PM y colabora- dores[14] en el que 49,1% de los pacientes tratados con Aprepitant experimentaron una respuesta positiva en el control de las náuseas y vómitos en el día 1 posoperatorio y, dado que el objetivo de este estudio es el control de las náuseas y vómitos posoperatorios (NVPO), es razonable suponer para los cálculos
del tamaño de la muestra que la tasa de NVPO es aproximadamente del 50%. La hipótesis estadística que se evaluará es la siguiente:


Donde P1 es la proporción de pacientes tratados con Apre- pitant que no experimentan NVPO (es decir, menor tasa de episodios de nausea y vomito postoperatorio) y P2 es la misma proporción entre los pacientes no tratados con Aprepitant.

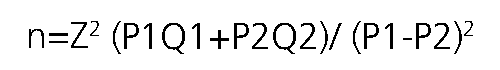
Se utilizará una tasa de falsos positivos de 0,2 para probar esta hipótesis. Con 193 pacientes aleatorizados por brazo (total = 386 pacientes) en este estudio de detección, la potencia de una prueba realizada con un nivel de significancia de 0,2 es 0,8.
Con este análisis, las tasas de error tipo I y II son 0,05 y 0,2, respectivamente.
Análisis estadístico
Se aplicó un análisis de chi cuadrado para la comparación de la presencia de náuseas y vómitos a distintos tiempos del posquirúrgico, para la comparación por pares, se aplicó un ajuste del valor de p por el método de Bonferroni, definiendo a la significancia estadística de las comparaciones por pares en p < 0,01.
Tabla 1. Análisis demográfico, antropométrico y de comorbilidad basal
| Grupo 1 (n = 135) | Grupo 2 (n = 125) | Grupo 3 (n = 140) | p value | |
| Mujeres | 126 (93,5%) | 118 (94,5%) | 131 (94%) | 0,554 |
| Hombres | 9 (6,5%) | 7 (5,5%) | 9 (8%) | 0,554 |
| Edad (años); mean ± SD | 39 ± 9.78 | 37 ± 9,7 | 38 ± 9,83 | 0,758 |
| Peso(kg); mean ± SD | 116,46 ± 21,73 | 116,73 ± 24,22 | 116,59 ± 22,99 | 0,667 |
| Altura (m); mean ± SD | 1,67 ± 0,07 | 1,65 ± 0,1 | 1,66 ± 0,12 | 0,116 |
| IMC (kg/m2); mean ± SD | 42,01 ± 7,29 | 42,22 ± 8,73 | 42,12 ± 8,04 | 0,938 |
| Diabetes | 25 (12,5%) | 31 (15,4%) | 26 (19%) | 0,43 |
| Hipertensión | 40 (20,1%) | 37 (18,4%) | 26 (19,2%) | 0,781 |
| ASA physical status classification, No./total No. (%) | ||||
| 2 | 99 | 88 | 106 | |
| 3 | 35 | 30 | 29 | |
| 4 | 1 | 7 | 5 |
Resultados
Cuatrocientos pacientes cumplieron con éxito los criterios del estudio y se sometieron a una gastrectomía en manga laparoscópica.
En el grupo 1 había 135 pacientes, el grupo 2 era 125 y el grupo 3 era 140. Toda la información demográfica inicial fue homogénea entre los grupos (Tabla 1). El sexo femenino representó el 94% de los casos (375 mujeres, 25 hombres). La edad media fue 38 años, el peso medio 117 kg y la talla media 1,66
Tabla 2. Comparaciones la presencia de náuseas entre los 3 tratamientos a distintos momentos posquirúrgicos
| Sala 1 | Sala 2 | Sala 3 | Valor de p | |
| Ondansetron 16 mg
Metoclopramida 20 mg Dexametasona 8 mg | Onda 8
Dexa 8 | Onda 8
Dexa 8 Metoclopramida 10 | ||
| Tamaño de muestra | 135 | 125 | 140 | |
| Nauseas postqx recuperación | 44 (32,6) | 49 (39.2)c | 79 (56,4)ab | < 0,0001 |
| Nauseas Postqx 6 h | 63 (46,7) | 60 (48,0) | 73 (52,1) | 0,36 |
| Nauseas PostQx 12 h | 5 (3,7) | 10 (8,0) | 5 (3,6) | 0,95 |
| Nauseas PostQx 24 h | 30 (22,2) | 35 (28,0) | 25 (17,9) | 0,38 |
Datos presentados como frecuencia (porcentaje).
Datos comparados por la prueba de chi cuadrado.
Para las pruebas poshoc la significancia estadística fue definida como un valor de p < 0,016.
a: diferencia estadística con respecto a la sala 1.
b: diferencia estadística con respecto a la sala 2.
c: diferencia estadística con respecto a la sala 3.
Tabla 3. Comparaciones la presencia de vómito entre los 3 tratamientos a distintos momentos posquirúrgicos
| Sala 1 | Sala 2 | Sala 3 | Valor de p | |
| Ondansetron 16 mg | Onda 8 | Onda 8 | ||
| Metoclopramida 20 mg | Dexa 8 | Dexa 8 | ||
| Dexametasona 8 mg | Metoclopramida 10 | |||
| Tamaño de muestra | 135 | 125 | 140 | |
| Vómito Postqx recuperación | 1 (0,7) | 4 (3,2) | 3 (2,1) | 0,41 |
| Vómito Postqx 6 h | 4 (3,0)b | 14 (11,2)ac | 6 (4,3)b | 0,01 |
| Vómito PostQx 12 h | 5 (3,7) | 10 (8,0) | 5 (3,6) | 0,95 |
| Vómito PostQx 24 h | 3 (2,2) | 3 (2,4) | 1 (0,7) | 0,33 |
Datos presentados como frecuencia (porcentaje).
Datos comparados por la prueba de chi cuadrado o la prueba exacta de Fisher.
Para las pruebas poshoc la significancia estadística fue definida como un valor de p < 0,016.
a: diferencia estadística con respecto a la sala 1.
b: diferencia estadística con respecto a la sala 2.
c: diferencia estadística con respecto a la sala 3.
m. El IMC medio fue similar en los 3 grupos.
En la Tabla 2 se muestran las comparaciones de la frecuencia de náuseas a distintos tiempos del posquirúrgico entre los 3 grupos de tratamiento. Se observaron diferencias, únicamente, en las náuseas en el posquirúrgico de recuperación, donde los sujetos con el tratamiento del grupo 1 presentaron una menor frecuencia de náuseas en comparación con los sujetos en tratamiento grupo 3 (p < 0,0001), pero no así con los sujetos en grupo 2 (p = 0,27). De igual manera se observó que los sujetos en la grupo 3 tienen mayor frecuencia de náuseas en comparación con aquellos en la grupo 2 (p < 0,0001). En el resto de los momentos del posquirúrgico, no se observaron diferencias significativas entre los grupos de tratamiento.
En la Tabla 3. Se muestran las comparaciones de la frecuencia de vómito entre los tres tratamientos a distintos momentos del posquirúrgico, se observó únicamente que, a las 6 h del posquirúrgico, los sujetos en el grupo 1 tuvieron una mayor frecuencia de vómito que los sujetos en la grupo 2 (p = 0,01) y la grupo 3 (p = 0,03). En el resto de los momentos del posquirúrgico, no se observaron diferencias significativas entre los grupos de tratamiento.
Discusión
Los pacientes sometidos a cirugía bariátrica son, frecuentemente, mujeres y no fumadores y utilizan opioides tanto en el trans como el posoperatorio, otorgando un riesgo de 3 puntos y hasta 61% de desarrollar NVPO[15],[16], como es en la gran mayoría de estos pacientes. La NVPO representa la complicación más frecuente en la PACU, siendo 80% de prevalencia en grupos de alto riesgo[10], esto ha sido tema de investigación sobre si puede o no eliminarse[17]. Tradicionalmente, solo se utilizaba una monoterapia como profilaxis de NVPO, sin embargo, actualmente se recomienda en pacientes de alto riesgo una terapia multimodal, que debe incluir ondansetron, el cual se considera el estándar de oro[18], en dosis de 4-8 mg. Sin embargo, cabe aclarar que no es el más potente de la familia de los antagonistas de receptores 5 HT3[19]-[22], pero es superior a metoclopramida y dexmedetomedina[23],[24]. La eficacia antiemética de una dosis de 10 mg de metoclopramida no está clara[25]. De Oliveira et al[26], concluyeron que una dosis de 10 mg de metoclopramida puede ser eficaz para la prevención de NVPO con un NNT de 8 a 10 (evidencia A1). En el caso de la dexametasona, se recomienda una dosis de entre 4 y 10 mg. Ha habido un aumento en el número de estudios que evalúan el uso de 8 mg (0,01 mg/kg) de dexametasona o dosis superiores con resultados positivos (evidencia A1) [27],[28]. En general, existen datos limitados para los ensayos que utilizan dosis superiores a 8 mg. La terapia multimodal es el nuevo “estándar de oro”, sin embargo, no hay evidencia de que usar 16 mg de Ondansetrón + 16 mg de Dexametasona + 20 mg de metoclopramida, den un mayor beneficio al paciente.
Limitantes
Este estudio presenta como limitantes, que no se pudo estandarizar las técnicas anestésicas de los 3 grupos, así como el uso de opioides en el perioperatorio. Además, que el diseño del estudio fue realizado con 2 estudios a la par, siendo este el secundario. Así como no se pudo estandarizar el tiempo con el que fue administrado el medicamento. En tercer lugar, los investigadores y los médicos tratantes no estaban cegados al grupo de aleatorización del tratamiento.
Conclusiones
En los pacientes que recibieron solo 8 mg de ondansetron y 8 mg de dexametasona presentaron menor frecuencia de PONV comparado con el grupo de 16 mg de ondansetron, 16 de dexametasona y 20 mg de metoclopramida y que el grupo de 8 mg de dexametasona, 8 mg de ondansetron y 10 mg de metoclopramida. Con base en estos resultados podemos concluir que es seguir utilizar 8 mg de dexametasona y 8 mg de ondansetron en el paciente bariatrico sometido a gastric sleeve, además que se utilizo un mayor gasto de recurso económico al gastar más medicamento y mayores efectos secundarios asociados a altas dosis de medicamentos.
Referencias
1. World Health Organization. (June/1/2021) Obesity and overweight https://www.who.int/es/news-room/fact-sheets/detail/obesity-and-overweight
2. Bhandari M, Fobi MA, Buchwald JN; Bariatric Metabolic Surgery Standardization (BMSS) Working Group. Standardization of Bariatric Metabolic Procedures: World Consensus Meeting Statement. Obes Surg. 2019 Jul;29(S4 Suppl 4):309–45. https://doi.org/10.1007/s11695-019-04032-x PMID:31297742
3. Schumann R, Ziemann-Gimmel P, Sultana A, Eldawlatly AA, Kothari SN, Shah S, et al. Postoperative nausea and vomiting in bariatric surgery: a position statement endorsed by the ASMBS and the ISPCOP. Surg Obes Relat Dis. 2021 Nov;17(11):1829–33. https://doi.org/10.1016/j.soard.2021.08.005 PMID:34462224
4. Groene P, Eisenlohr J, Zeuzem C, Dudok S, Karcz K, Hofmann-Kiefer K. Postoperative nausea and vomiting in bariatric surgery in comparison to non-bariatric gastric surgery. Wideochir Inne Tech Malo Inwazyjne. 2019 Jan;14(1):90–5. https://doi.org/10.5114/wiitm.2018.77629 PMID:30766634
5. Naeem Z, Chen IL, Pryor AD, Docimo S, Gan TJ, Spaniolas K. Antiemetic prophylaxis and anesthetic approaches to reduce postoperative nausea and vomiting in bariatric surgery patients: a systematic review. Obes Surg. 2020 Aug;30(8):3188–200. https://doi.org/10.1007/s11695-020-04683-1 PMID:32415635
6. Suh S, Helm M, Kindel TL, Goldblatt MI, Gould JC, Higgins RM. The impact of nausea on post-operative outcomes in bariatric surgery patients. Surg Endosc. 2020 Jul;34(7):3085–91. https://doi.org/10.1007/s00464-019-07058-5 PMID:31388805
7. Therneau IW, Martin EE, Sprung J, Kellogg TA, Schroeder DR, Weingarten TN. The role of aprepitant in prevention of postoperative nausea and vomiting after bariatric surgery. Obes Surg. 2018 Jan;28(1):37–43. https://doi.org/10.1007/s11695-017-2797-0 PMID:28674839
8. Celio A, Bayouth L, Burruss MB, Spaniolas K. Prospective assessment of postoperative nausea early after bariatric surgery. Obes Surg. 2019 Mar;29(3):858–61. https://doi.org/10.1007/s11695-018-3605-1 PMID:30565100
9. Stenberg E, Dos Reis Falcão LF, O’Kane M, Liem R, Pournaras DJ, Salminen P, et al. Guidelines for Perioperative Care in Bariatric Surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations: A 2021 Update. World J Surg. 2022 Apr;46(4):729–51. https://doi.org/10.1007/s00268-021-06394-9 PMID:34984504
10. Gan TJ, Belani KG, Bergese S, Chung F, Diemunsch P, Habib AS, et al. Fourth Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg. 2020 Aug;131(2):411–48. https://doi.org/10.1213/ANE.0000000000004833 PMID:32467512
11. Medication Safety in Polypharmacy. Geneva: World Health Organization; 2019 (WHO/UHC/SDS/2019.11). Licence: CC BY-NC-SA 3.0 IGO.
12. Tonin FS, Aznar-Lou I, Pontinha VM, Pontarolo R, Fernandez-Llimos F. Principles of pharmacoeconomic analysis: the case of pharmacist-led interventions. Pharm Pract (Granada). 2021;19(1):2302. https://doi.org/10.18549/PharmPract.2021.1.2302 PMID:33727994
13. Butcher NJ, Monsour A, Mew EJ, Chan AW, Moher D, Mayo-Wilson E, et al. Guidelines for Reporting Outcomes in Trial Reports: The CONSORT-Outcomes 2022 Extension. JAMA. 2022 Dec;328(22):2252–64. https://doi.org/10.1001/jama.2022.21022 PMID:36511921
14. Singh PM, Borle A, Rewari V, Makkar JK, Trikha A, Sinha AC, et al. Aprepitant for postoperative nausea and vomiting: a systematic review and meta-analysis. Postgrad Med J. 2016 Feb;92(1084):87–98. https://doi.org/10.1136/postgradmedj-2015-133515 PMID:26627976
15. Apfel CC, Läärä E, Koivuranta M, Greim CA, Roewer N. A simplified risk score for predicting postoperative nausea and vomiting: conclusions from cross-validations between two centers. Anesthesiology. 1999 Sep;91(3):693–700. https://doi.org/10.1097/00000542-199909000-00022 PMID:10485781
16. Weilbach C, Rahe-meyer N, Raymondos K, Weissig A, Scheinichen D, Piepenbrock S. Postoperative nausea and vomiting (PONV) : usefulness of the Apfel-score for identification of high risk patients for PONV. Acta Anaesthesiol Belg. 2006;57(4):361–3. PMID:17236637
17. Gan TJ. Postoperative nausea and vomiting—can it be eliminated? JAMA. 2002 Mar;287(10):1233–6. https://doi.org/10.1001/jama.287.10.1233 PMID:11886298
18. Tricco AC, Soobiah C, Blondal E, Veroniki AA, Khan PA, Vafaei A, et al. Comparative efficacy of serotonin (5-HT3) receptor antagonists in patients undergoing surgery: a systematic review and network meta-analysis. BMC Med. 2015 Jun;13(1):136. https://doi.org/10.1186/s12916-015-0371-y PMID:26084277
19. Joo J, Park S, Park HJ, Shin SY. Ramosetron versus ondansetron for postoperative nausea and vomiting in strabismus surgery patients. BMC Anesthesiol. 2016 Jul;16(1):41. https://doi.org/10.1186/s12871-016-0210-5 PMID:27449404
20. Ryu JH, Lee JE, Lim YJ, Hong DM, Park HP, Han JI, et al. A prospective, randomized, double-blind, and multicenter trial of prophylactic effects of ramosetronon postoperative nausea and vomiting (PONV) after craniotomy: comparison with ondansetron. BMC Anesthesiol. 2014 Aug;14(1):63. https://doi.org/10.1186/1471-2253-14-63 PMID:25104916
21. Savant K, Khandeparker RV, Berwal V, Khandeparker PV, Jain H. Comparison of ondansetron and granisetron for antiemetic prophylaxis in maxillofacial surgery patients receiving general anesthesia: a prospective, randomised, and double blind study. J Korean Assoc Oral Maxillofac Surg. 2016 Apr;42(2):84–9. https://doi.org/10.5125/jkaoms.2016.42.2.84 PMID:27162748
22. Kim SH, Hong JY, Kim WO, Kil HK, Karm MH, Hwang JH. Palonosetron has superior prophylactic antiemetic efficacy compared with ondansetron or ramosetron in high-risk patients undergoing laparoscopic surgery: a prospective, randomized, double-blinded study. Korean J Anesthesiol. 2013 Jun;64(6):517–23. https://doi.org/10.4097/kjae.2013.64.6.517 PMID:23814652
23. Wu SJ, Xiong XZ, Cheng TY, Lin YX, Cheng NS. Efficacy of ondansetron vs. metoclopramide in prophylaxis of postoperative nausea and vomiting after laparoscopic cholecystectomy: a systematic review and meta-analysis. Hepatogastroenterology. 2012 Oct;59(119):2064–74. https://doi.org/10.5754/hge11811 PMID:22282127
24. 211. Kamali A, Ahmadi L, Shokrpour M, Pazuki S. Investigation of ondansetron, haloperidol, and dexmedetomidine effi- cacy for prevention of postoperative nausea and vomit- ing in patients with abdominal hysterectomy. Open Access Maced J Med Sci. 2018;6:1659–63. https://doi.org/10.3889/oamjms.2018.366 PMID:30337983
25. Henzi I, Walder B, Tramèr MR. Metoclopramide in the prevention of postoperative nausea and vomiting: a quantitative systematic review of randomized, placebo-controlled studies. Br J Anaesth. 1999 Nov;83(5):761–71. https://doi.org/10.1093/bja/83.5.761 PMID:10690140
26. De Oliveira GS Jr, Castro-Alves LJ, Chang R, Yaghmour E, McCarthy RJ. Systemic metoclopramide to prevent postoperative nausea and vomiting: a meta-analysis without Fujii’s studies. Br J Anaesth. 2012 Nov;109(5):688–97. https://doi.org/10.1093/bja/aes325 PMID:23015617
27. Yamanaga S, Posselt AM, Freise CE, Kobayashi T, Tavakol M, Kang SM. A single perioperative injection of dexameth- asone decreases nausea, vomiting, and pain after laparo- scopic donor nephrectomy. J Transplant. 2017;2017:3518103. https://doi.org/10.1155/2017/3518103 PMID:28210502
28. Yue C, Wei R, Liu Y. Perioperative systemic steroid for rapid recovery in total knee and hip arthroplasty: a systematic review and meta-analysis of randomized trials. J Orthop Surg Res. 2017 Jun;12(1):100. https://doi.org/10.1186/s13018-017-0601-4 PMID:28655354
29. Mihara T, Ishii T, Ka K, Goto T. Effects of steroids on qual- ity of recovery and adverse events after general anesthesia: meta-analysis and trial sequential analysis of randomized clinical trials. PLoS One. 2016 Sep;11(9):e0162961. https://doi.org/10.1371/journal.pone.0162961 PMID:27631490

 ORCID
ORCID