Luciano Deganutti1, Matías Sosa2, Pablo Castellaro2, Lucas Costa3
Recibido: 15-03-2024
Aceptado: 08-04-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 4 pp. 421-428|https://doi.org/10.25237/revchilanestv53n4-18
PDF|ePub|RIS
Abstract
Several strategies have been implemented to reduce the risk of bleeding in bariatric surgery. Recently, the use of tranexamic (TXA) has gained popularity as a preventive tool in this surgical discipline. A longitudinal, observational, analytical retrospective cohort study was carried out, recruiting 510 patients undergoing Sleeve Gastrectomy or Roux-en-Y Gastric By Pass surgery. Patient’s groups were created before and after the implementation of prophylactic TXA administration in the institutional anesthetic protocol (group 1 control N= 250 versus group 2 with TXA N=260). Demographic, clinical, and surgical data were collected. Both groups were statistically equivalent in terms of sex, ASA classification, distribution according to type of surgery, except for age, BMI and time of surgery. Patients who recieved TXA had lower intraoperative blood loss (200,1 ± 31,5 ml versus 270,3 ± 35,4 ml; p = 0,001), less requeriments of hemostatic clip application, 5% versus 14% (p = 0,001), shorter surgical times and length of hospital stay (p = 0,001). There were no reinterventions due to bleeding in the TXA group while there were four patients reoperated in the control group (1,6%), in addition to one patient who presented gastrointestinal bleeding and resolved with clinical treatment (p=0,04). No associated thrombotic events were reported. TXA, in a dose of 1g IV at anesthetic induction, significantly reduced in the use of hemostatic clips, intraoperative blood loss, surgical times and hospital stay and might tend to reduce the reoperation rate for bleeding.
Resumen
Varias estrategias han sido implementadas para reducir la probabilidad de sangrado en cirugía bariátrica. En los últimos años ha adquirido popularidad el empleo del ácido tranexámico (TXA) como herramienta preventiva en dicha disciplina quirúrgica. Estudio longitudinal, observacional, analítico de cohorte retrospectiva, de 510 pacientes sometidos tanto a cirugía de Manga Gástrica como a B Gástrico en Y de Roux, reclutados antes y posterior a la implementación de la administración profiláctica de TXA en el protocolo anestésico institucional (grupo 1 control n = 250 versus grupo 2 con TXA n = 260). Se recopilaron datos demográficos, clínicos y quirúrgicos. Ambos grupos fueron homogéneos en cuanto a sexo, clasificación ASA, distribución según tipo de cirugía, excepto en edad, IMC y duración del acto quirúrgico. Los pacientes que recibieron TXA tuvieron menores pérdidas hemáticas intraoperatorias (200,1 ± 31,5 ml versus 270,3 ± 35,4 ml; p = 0,001), menos necesidad de empleo de clips hemostáticos, 5% versus 14% (p = 0,001), tiempos quirúrgicos y estancia hospitalaria menores (p = 0,001). No hubo reintervenciones por sangrado en el grupo TXA mientras que en 4 pacientes del grupo control si (1,6%), más un paciente que presentó una hemorragia digestiva que resolvió con tratamiento clínico (p = 0,04). No se registraron eventos trombóticos asociados. El TXA, en dosis de 1 g ev en la inducción anestésica, demostró reducir, significativamente, la utilización de clips hemostáticos, pérdidas sanguíneas intraoperatorias, tiempos quirúrgicos y estancia hospitalaria, con una tendencia a reducir la tasa de reoperación por sangrado.
-
Introducción
La gastrectomía en manga laparoscópica (LSG) es, actualmente, la cirugía bariátrica más practicada en el mundo[1]. Aunque parece ser un tratamiento seguro para la obesidad, aún presenta riesgo de complicaciones, de las cuales el sangrado posoperatorio es una de las más preocupantes. La tasa reportada en la literatura es del 2%-4% de los casos, y hasta 3% requiere reintervención[2],[3]. Otros autores reportan tasas de hemorragia posoperatoria de alrededor del 2% de los pacientes sometidos a LSG y entre 1,5% al 4% de los pacientes sometidos a un by pass gástrico en Y de Roux (RYGB)[4],[5]. En series más grandes, se reportaron reoperaciones por hemorragia abdominal de 0,8% a 2,5%[6].
Varias estrategias han sido implementadas para reducir el sangrado intraoperatorio como la colocación de clips hemostáticos, sellantes de fibrina humana, refuerzo de puntos en la línea de sutura mecánica, polímeros sintéticos como el seamguard®, con poca evidencia de superioridad de una técnica sobre las demás, siendo además costosas y no ampliamente disponible en todos los ámbitos quirúrgicos[7]-[10]. En los últimos años aparecieron publicaciones sobre el ácido Tranexámico (TXA) como una herramienta segura, accesible y costo-efectiva para prevención de sangrado en el paciente bariátrico[7],[11].
Varias revisiones de alta calidad en los campos de obstetricia[12], ortopedia[13], trauma[14], y cirugía cardíaca[15], entre otras, han encontrado reducciones significativas en las tasas de hemorragia y transfusiones sin un aumento asociado de eventos tromboembólicos.
El Instituto Nacional de Excelencia Clínica (NICE) recomienda el uso de TXA en cirugías en las que la pérdida de sangre estimada sea mayor a 500 mL[16]. Aunque el volumen de sangrado esperado en cirugía bariátrica no alcanza dichos valores, el sangrado sigue siendo una de las complicaciones más temidas en el período posoperatorio y que conlleva una alta morbilidad[17].
Grandes ensayos aleatorios como el estudio WOMAN de hemorragia postparto y el estudio CRASH 2 de trauma mostraron que el TXA redujo, significativamente, las muertes sin aumentar el riesgo de trombosis[12],[14]. En 2011, la Organización Mundial de la Salud (OMS), en base a los resultados arrojados por el estudio CRASH-2, incluyó al TXA en el listado de medicación “escencial”[18]. Metaanálisis recientes de ensayos clínicos aleatorizados (ECA) tampoco muestran un mayor riesgo de eventos tromboembólicos con TXA, incluyendo análisis de muestras con más de 100.000 pacientes[18],[19].
Grocott y cols., citan que el Colegio de Médicos, el de Cirujanos y Anestesiólogos del Reino Unido han solicitado a la OMS incluir al TXA en la lista de verificación de cirugía segura, para reducir el uso innecesario de sangre y liberar fondos para otros fines dentro del sistema sanitario[20].
Aunque en el campo de la cirugía bariátrica su utilización, actualmente, es objeto de debate, ya existen publicaciones de algunos ECA y estudios observacionales con resultados alentadores, por lo que el empleo de dicha estrategia farmacológica se está expandiendo rápidamente.
Decidimos llevar a cabo un estudio observacional con el fin de poder hacer un análisis retrospectivo y evaluación de eficacia y seguridad al emplear dicha terapéutica analizando nuestra base de datos de práctica clínico-quirúrgica, considerando la
escasa evidencia publicada en esta población y a que sólo se limitan, exclusivamente, a sangrado en SG.
El presente estudio fue diseñado en base a los lineamientos de la versión 2004 de la declaración STROBE (STrengthening the Reporting of OBservational studies in Epidemiology), que fueron utilizados como guía para la formulación del manuscrito.
-
Objetivos
Primarios: comprobar si el uso preventivo del TXA administrado en la inducción anestésica reduce el sangrado intraoperatorio, el empleo de clips hemostáticos y las tasas de reintervención por hemorragia en pacientes sometidos a cirugía bariátrica.
Secundarios: comparar tiempos quirúrgicos, estancia hospitalaria, y riesgo de eventos tromboembólicos postoperatorio entre el grupo tratado con TXA versus el grupo control.
-
Material y Métodos
Estudio longitudinal, observacional, analítico de cohorte retrospectiva, de pacientes sometidos tanto a cirugía de SG como de YRGB. Investigamos los pacientes intervenidos quirúrgicamente, tanto antes como luego de la implementación profiláctica de TXA en el protocolo institucional (grupo 1: sin TXA versus grupo 2: con TXA). Para evitar posibles sesgos debidos a la curva de aprendizaje, la experiencia y el tiempo de tratamiento, el mismo equipo de cirujanos fueron los que realizaron la totalidad de los procedimientos y con el mismo protocolo anestésico-quirúrgico.
Se administró 1 g de TXA vía intravenosa en la inducción anestésica a los pacientes del grupo TXA, cuya dosis fue respaldada en base a la evidencia científica publica- da[7],[11],[14],[19],[21]. Paralelamente, como parte de la profilaxis antitrombótica, se utilizó de manera estándar profilaxis mecánica con dispositivo de compresión neumática intermitente de miembros inferiores durante el intraoperatorio y hasta el comienzo de la deambulación, medias elásticas de compresión graduada y administración de 40 mg de enoxaparina subcutánea, comenzando a las 12 h de finalizada la cirugía y cada 24 h durante los primeros 10 días del posoperatorio. Los pacientes eran dados de alta el primer día cuando pudieran automovilizarse y consumir cantidades adecuadas de líquidos orales, con dolor controlado (escala verbal numérica menor a 4), abdomen blando, sin fiebre y signos vitales estables. En caso contrario, o que existieran complicaciones, permanecían en la clínica el tiempo necesario hasta su alta.
Para un análisis de comparación de diferencias de medias para grupos independientes de pacientes (familia de pruebas t muestras independientes) se plantearon los siguientes valores deseados para los parámetros de error: a = 0,05 (nivel de significancia de 5%), p = 0,20 (poder estadístico 1- p = 0,8 = 80%) y probabilidad a dos colas. Se utilizó un valor de tamaño de efecto d = 0,25 (d de Cohen), el cual es compatible con un tamaño de efecto pequeño. De esta forma, se obtuvo un tamaño muestral mínimo requerido de 250 pacientes por grupo. El software utilizado para el cálculo muestral fue G*Power version 3.1.9.2.
Un total de 510 pacientes fueron evaluados comparativamente, grupo 1 o control (CTR = 250 pacientes), muestra recopilada desde el período de enero de 2017 a abril de 2019 y el grupo 2 o tratado involucró aquellos pacientes a los que se le administró TXA en la inducción anestésica (TXA = 260 pacientes), muestra obtenida del período de mayo de 2019 a agosto de 2023. Se recopilaron datos demográficos, clínicos y quirúrgicos, incluyendo registro del volúmen de sangre en la bomba de succión al finalizar la cirugía y el número de clips hemostáticos para controlar los puntos de sangrado. Dicha información provista a partir del registro de los datos brindados por la entrevista preanestésica, ficha anestésica intraoperatoria, análisis de foja quirúrgica y registro de evolución y hojas de enfermería. Además, se analizaron las siguientes variables: duración del acto quirúrgico, tiempo de estancia hospitalaria, tasa de reoperaciones por sangrado y registros de eventos tromboembólicos hasta 3 meses posteriores a la cirugía.
Los procedimientos fueron llevados a cabo en dos centros de cirugía bariátrica, Clínica Modelo S.A de la ciudad de Paraná, Entre Ríos y Sanatorio Mayo- Santa Fé, Argentina, por el mismo equipo de dos cirujanos especialistas en cirugía metabólica, que pertenecen al grupo interdisciplionario “CITOS” (Centro Integral para el Tratamiento de la Obesidad y el Sobrepeso). El registro, análisis de la base de datos e información recabada fueron evaluados y sometidos a estadística analítica y descriptiva durante el periodo de Diciembre de 2023 a Febrero de 2024.
Criterios de inclusión:
– Ambos sexos.
– Clasificación de la American Society of Anesthesiologist (A.S.A) II-III.
– Índice de masa corporal mayor o igual a 40 o mayor o igual a 35 con presencia de comorbilidades asociadas a la obesidad que tengan indicación de cirugía de reducción de peso.
– Edades comprendida entre 18 a 60 años.
– Gastrectomía en manga o By Pass Gástrico en Y de Roux, según indicación preoperatoria por parte del equipo intervi- niente.
Criterios de exclusión:
– Antecedentes de trombofilia hereditaria o adquirida.
– Antecedente de algún evento tromboembólico padecido en su historial clínico.
– Enfermedad vascular oclusiva.
– Tratamiento preoperatorio con medicación antiagregante y/o anticoagulante.
– Antecedente personal y/o familiar de trastornos hemorragí- paros de origen genético.
– Hipersensibilidad a alguna de las medicaciones utilizadas en el protocolo.
Técnica anestésica
Los pacientes de ambos grupos recibieron anestesia general total endovenosa (TIVA con propofol y remifentanilo), a través de una venoclisis periférica con preoxigenación e intubación orotraqueal en posición de rampa, bajo bloqueo neuromuscular profundo. Se realizó abordaje multimodal utilizando infiltración de portales de laparoscopía más el uso de antihiperalgé- sicos e.v como coadyuvantes a la TIVA, tales como ketamina, sulfato de magnesio, lidocaina y dexmedetomidina. Se adminis
tró profilaxis antibiótica a cada paciente más ketorolac 60 mg, dexametasona 8 mg, paracetamol 1 g, ranitidina 50 mg, meto- clopramida 10 mg y ondansetrón 8 mg, todos por vía endovenosa. La monitorización incluyó pulsioximetría, presión arterial no invasiva, electrocardiograma continuo, capnografía, control de temperatura nasofaríngea, monitoreo de hipnosis y protección de decúbitos. Al finalizar la cirugía y antes de la extubación se realizó la reversión completa del bloqueo neuromuscular con atropina y neostigmina, según la necesidad del caso, guiado por el monitoreo del tren de cuatro (TOF), logrando obtener un cociente T1/T4 = 0,9.
Análisis estadístico
El análisis de datos se realizó con el software SPSS v28.0. Las variables cualitativas se describen con frecuencia absoluta y porcentajes. Las variables cuantitativas se describen con media y desvío estándar. El análisis de comparación de proporciones entre variables cualitativas se realizó mediante el test Chi cuadrado de Pearson o el Test exacto de Fisher, se calcularon OR y su intervalo de confianza del 95% cuando fue necesario. La comparación de medias entre grupos se realizó con Prueba t de muestras independientes. El valor de significancia estadística se fijó en alfa igual a 0,05.
-
Resultados
Un total de 541 pacientes fueron reclutados de la base de datos CITOS bariátrica en el período analizado, el cual luego de aplicar los criterios de elegibilidad detallados previamente, evaluación y pérdidas de pacientes por ausencia correcta de seguimiento e información incompleta en historia clínica, finalmente se incluyó un total de 510 participantes en el presente estudio. El Grupo 1 (CTR) representado por 250 pacientes y el Grupo 2 (TXA) por 260, respectivamente (Figura 1).
Sobre una muestra total de 510, se observó una edad media de 38,6 ± 5,02 años, con un mínimo de 25 y un máximo de 48 años. La proporción mayoritaria fue de sexo femenino con el 78,4% (n = 400). El IMC medio fue de 40,3 ± 2,99, con un percentil 5 de 36 y un percentil 95 de 45,2. La prevalencia de HTA fue del 43,5% (n = 222) y la DM fue de 17,1% (n = 87).
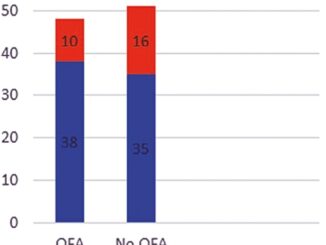
En la Tabla 1 se observa que variables asociadas al sangrado mostraron diferencias significativas. El uso de clips hemostáticos fue, proporcionalmente, menor en el grupo tratado (TXA) que en el grupo control (CTR), 5% vs. 14%, siendo esta diferencia significativa (x2 = 12,1; gl = 1, p = 0,001) y mostrando una protección del tratamiento frente al uso de clips con un OR = 0,32 e IC95% = (0,17 – 0,63). Por su parte, el sangrado intraoperatorio en mililitros mostró una diferencia de medias entre grupos, siendo, significativamente, menor en el grupo tratado (t = 23,6; gl = 508, p = 0,001); la diferencia en las distribuciones se puede visualizar en la Figura 2. Por último, las reoperaciones por sangrado fueron 4, el total de la cuales se realizaron en el grupo control, con una proporción de 1,6% en dicho grupo y de 0% en el grupo tratado, esta diferencia fue significativa (x2 = 4,2; gl = 1, p = 0,04). Cabe mencionar que la estancia hospitalaria fue en promedio, significativamente, menor (t = 23,6; gl = 508, p = 0,001) en el grupo TXA frente al grupo CTR, 24 h vs. 33,5 h respectivamente. No se observaron eventos tromboembólicos en el seguimiento posoperatorio de 3 meses en ninguno de los grupos.
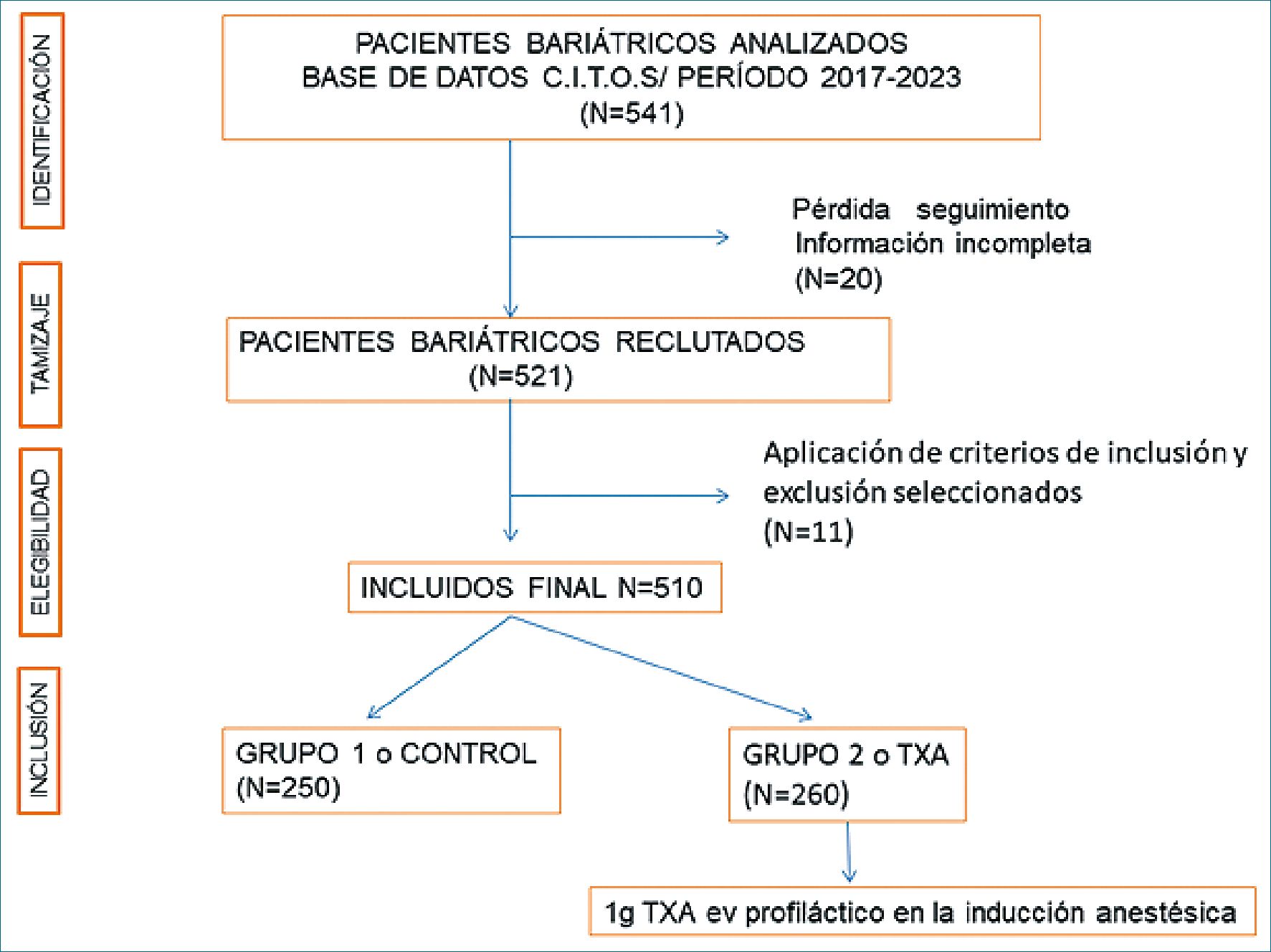
Figura 1. Diagrama de flujo de inclusión de pacientes.
Tabla 1. Comparación de variables de inclusión y de resultados quirúrgicos según grupo
| G1 – CTR | G2-TXA | Valor p | |
| (n = 250) | (n = 260) | ||
| Sexo % (n) | |||
| Femenino | 82 (205) | 75 (195) | NS¥ |
| Masculino | 18 (45) | 25 (65) | |
| IMC [kg/m2] x ± DE | 41,0 ± 2,9 | 39,5 ± 2,9 | 0,001 § |
| Tipo de cirugía % (n) | |||
| Manga gástrica | 62 (155) | 70 (182) | NS¥ |
| By pass gástrico | 38 (95) | 30 (70) | |
| Clasificacion A.S.A. % (n) | |||
| ii | 88 (220) | 85 (221) | NS¥ |
| iii | 12 (30) | 15 (39) | |
| Uso de clips hemostaticos % (n) | 14 (35) | 5 (13) | 0,001¥ |
| Sangrado intraopertorio [ml] x ± DE | 270,3 ± 35,4 | 200,1 ± 31,5 | 0,001 § |
| Reoperación por sangrado % (n) | 1,6 (4) | 0 (0) | 0,04¥ |
| Eventos tromboembolicos a 3 meses % (n) | 0 (0) | 0 (0) | NS¥ |
| Duración estancia hospitalaria [h] x ± DE | 33,5 ± 11,6 | 24,0 ± 7,6 | 0,001 § |
x: media aritmética; DE: desvío estándar; §: valor p de prueba t para muestras independientes; ¥: valor p de prueba Chi cuadrado o test exacto de Fisher. En negrita valores p estadísticamente significativos.
Tabla 2. Comparación de factores pronósticos de sangrado según grupo
| G1 – CTR (n = 250) | G2 – TXA (TXA n = 260) | Valor p | |
| Edad [años] x ± DE | 40,0 ± 3,3 | 37,2 ± 5,9 | 0,001 § |
| HTA % (n) | 42 (105) | 45 (117) | NS¥ |
| DM % (n) | 20 (50) | 14,2 (37) | NS¥ |
| Dsfunsion renal y/o hepática % (n) | 6 (15) | 3 (13) | NS¥ |
| síndrome de apnea-hipopnea del sueño % (n) | 20 (50) | 25 (65) | NS¥ |
| Duración de cirugia [min] x ± DE | 89,3 ± 21,4 | 74,6 ± 19,9 | 0,001 § |
| En manga gástrica [min] x ± DE | 73,8 ± 5,8 | 62,3±5,2 | 0,001 § |
| en by pass gástrico [min] x ± DE | 114,6 ± 10,8 | 103,4 ± 9,1 | 0,001 § |
| Refuerzo de linea de sutura % (n) | 100 (250) | 100 (260) | NS¥ |
HTA: hipertensión arterial; DM: diabetes millitus; x: media aritmética; DE: desvío estándar; §: valor p de prueba t para muestras independientes; ¥: valor p de prueba Chi cuadrado o test exacto de Fisher. En negrita valores p estadísticamente significativos.
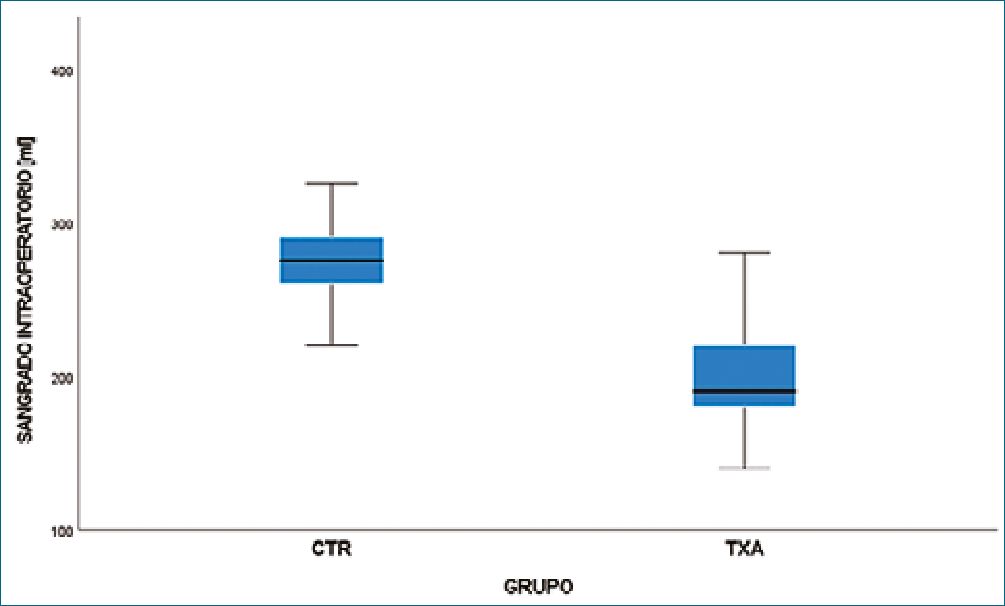
Figura 2. Diferencias de distribución del sangrado intraoperatorio entre grupos.
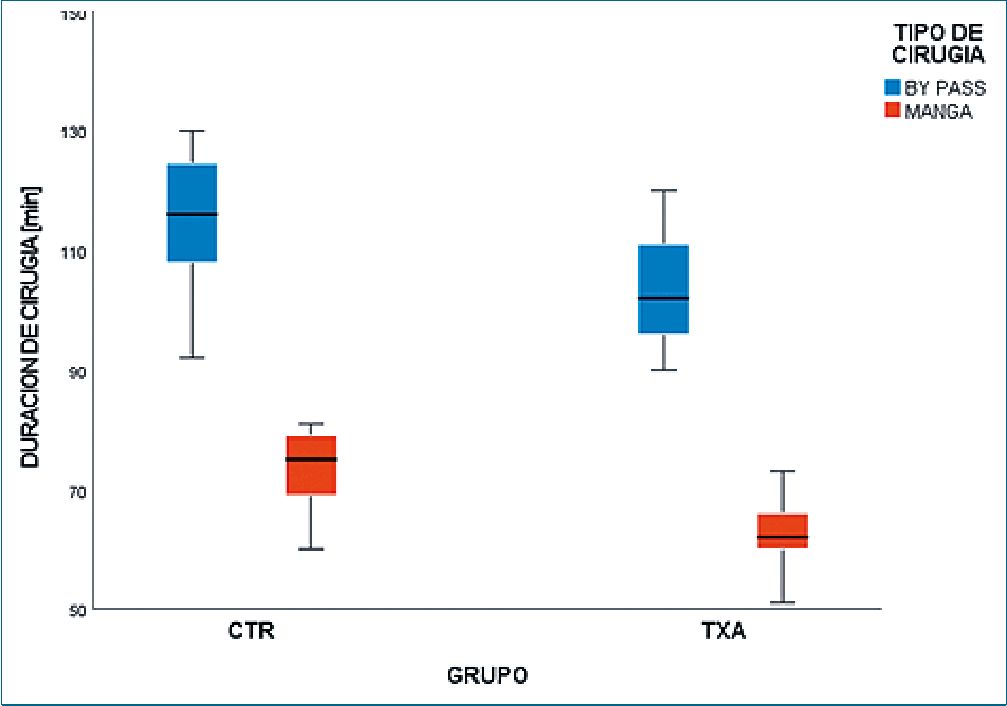
Figura 3. Diferencias en tiempos según cirugía y grupos.
En la Tabla 2 se presenta el análisis de posibles predicto- res de sangrado analizados según grupos. Ni la edad, ni las comorbilidades analizadas mostraron diferencias entre grupo CTR y Grupo TXA (p > 0,05). Sin embargo, la variable duración de la cirugía sí mostró un patrón de diferencias entre grupos, siendo la duración, significativamente, menor en el grupo TXA frente al grupo CTR en cirugía de manga gástrica, 62,3 minutos vs. 73,8 minutos (t = 19,0; gl = 335, p = 0,001) y también en cirugía de by pass gástrico, 103,4 minutos vs. 114,6 minutos (t = 7,3; gl=171, p = 0,001). Las diferencias se pueden visualizar en la Figura 3.
-
Discusión
La hemorragia posoperatoria en cirugía bariátrica es una complicación poco común. Sin embargo, sigue siendo la causa más frecuente de reintervención en los primeros 30 días del postquirúrgico[6]. Respecto al sangrado en SG el estómago es un órgano ricamente vascularizado en el que las arterias gástricas izquierda y derecha, los vasos gastroepiploicos y las arterias gástricas cortas irrigan una abundante red de plexos submucosos. Por lo tanto, dicha complicación puede originarse por la división de pequeñas ramas de las arterias gastroepiploicas y gástricas cortas después de que la sutura mecánica no logra sellar eficazmente dichos vasos[5]. El trabajo de Mocanu y cols., identificaron cuáles son aquellos predictores independientes de generar sangrado en pacientes sometidos a SG, los factores mencionados son: el tamaño de la sonda de calibración utilizada (en todos los pacientes se empleó la misma sonda oro- gástrica de calibre 34F), la edad, antecedente de hipertensión arterial y diabetes, disfunción renal y/o hepática (hígado graso no alcohólico), terapia anticoagulante y/o antiagregante previa, apnea obstructiva del sueño, duración del acto quirúrgico y experticia del equipo de cirujanos bariátricos[3]. Se demostró además que el refuerzo de la línea de grapas y un IMC más alto serían, por el contrario, factores de protección[4],[5]. De la base de datos analizada en el presente estudio observacional, ambos grupos presentaron características, antecedentes y factores de riesgo similares sin diferencias significativas entre las partes, por lo que, dichos predictores independientes no pudieron haber contribuido a influir en los resultados entre los grupos. Una excepción a ello fueron la variable edad, IMC y duración de cirugía que, si bien arrojaron diferencias estadísticamente significativas, no consideramos que hallan influido en los resultados clínicos ya que dicha diferencia, en términos absolutos, es robusta. Además, todas las gastrectomías longitudinales fueron reforzadas con puntos de sutura hemostáticos, siendo dicha estrategia equivalente para ambos grupos.
El sangrado después de una RYGB puede originarse en una de cinco posibles líneas de grapas: la bolsa gástrica, el estómago excluido, la línea de grapas de la extremidad de Roux, la gastroyeyunostomía (G-J) y la yeyunoyeyunostomía. Se han observado dos tipos de hemorragia postoperatoria después de un procedimiento bariátrico: intraperitoneal o intraluminal. Esta última suele ocurrir como una complicación tardía, mientras que el sangrado intraperitoneal ocurre en el postoperatorio temprano[4],[5],[9]. En nuestra base de datos se reportaron 4 casos de reoperación por hemoperitoneo y un caso de hemorragia digestiva (melena) que fue tratado con conducta clínica expectante en el CTR, mientras que no hubo reporte en el GTXA, lo que arroja una tendencia a la significancia estadística, que podría ser atribuido a la baja tasa de dicha complicación en un amplio tamaño muestral.
Klaassen y cols., describieron un protocolo de tratamiento con TXA para prevenir reintervenciones por sangrado en cirugía bariátrica mediante la administración posoperatoria de dicha droga en caso de sospecha de una complicación hemorrágica y con paciente en condiciones de estabilidad hemodinámi- ca. Mencionan los autores en dicho trabajo que efectúan 500 procedimientos bariátricos anualmente y que, actualmente, lo utilizan como protocolo de tratamiento para la hemorragia postoperatoria. La tasa de reoperaciones reportada por dichos autores es de 0,4%, sin ningún episodio trombótico registrado en 1.388 cirugías efectuadas[22].
Existen múltiples estudios empleando un amplio rango de dosis, variando de 100 mg/kg para cirugía cardíaca, a 10-20 mg/kg en dosis única o múltiples, en diferentes tipos de especialidades quirúrgicas. En el estudio Aspirin and Tranexamic Acid for Coronary Artery Surgery (ATACAS Trial), 4.661 pacientes fueron randomizados a recibir TXA o placebo, concluyendo que su empleo redujo sangrado, tasas de transfusión y reintervenciones, mientras que las tasas de mortalidad, ictus, embolismo pulmonar e infarto intestinal fueron similares al grupo placebo, siendo que la dosis utilizada en dichas cirugías fueron superiores a las empleadas en el trabajo actual[15]. Resultados similares se obtuvieron del estudio multicéntrico Perioperative ischemic evaluation 3 (POISE 3), con el empleo de TXA pero en cirugía no cardíaca, en 9.538 pacientes en diferentes disciplinas quirúrgicas, sin evidencia de que aumente los eventos cardiovasculares ni tromboembólicos a 30 días de la cirugía, comparado con el grupo placebo. Además demostró reducir, significativamente, el sangrado alrededor del 25% y las tasas transfusionales, por lo que merece una atención especial sus resultados en cuanto a balance riesgo/beneficio del uso de TXA en cirugía[21].
La mayoría de los autores que han publicado sobre el TXA en dosis profiláctica para cirugía no cardíaca lo han hecho empleando 1 g ev[19],[21],[23]. La dosis de TXA se recomienda utilizarla en función del peso corporal magro, ya que en experimentos en voluntarios sanos de 1 g ev, éste presentó bajo volumen de distribución (9 a 12 lts) y una vida media de eliminación de 1,9 a 2,7 h, con escasa penetrancia a tejido graso y eliminación casi inalterada por filtración glomerular[24],[25].
El metaanálisis de Ker y cols., remarcaron que una dosis de 1 g produjo una reducción en el sangrado que no mejoró al administrar dosis mayores, sin encontrar evidencia que respalde dosis más elevadas, al igual que lo menciona el artículo de Hundt[19],[23].
En el contexto de cirugía bariátrica el uso del TXA es poco común y aún existe en la actualidad incertidumbre sobre el potencial riesgo aumentado de tromboembolismo, lo cual limita su uso generalizado, ya que la obesidad per se cursa con un estado proinflamatorio-protrombótico. Sin embargo, existen algunos reportes del empleo del TXA para prevención de complicaciones hemorrágicas en dicho campo, todos ellos limitados a SG exclusivamente, a diferencia de nuestro análisis donde incluimos los dos tipos de cirugías más frecuentes para la obesidad.
Chakravartty y Hussain, fueron los primeros en emplear dosis profiláctica de 1g ev en SG y reportaron reducción del sangrado intraoperatorio y de los tiempos quirúrgicos, con menos necesidad de utilizar puntos hemostáticos en la línea de grapas y sin reportes de eventos tromboembólicos asociados, resultados similares a los reportados en el presente trabajo. Hussain y cols., en su artículo describen que previo al uso protocolar del TXA la tasa de transfusión post cirugía bariátrica era del 1% y la tasa de reintervenciones en SG del 0,15% (en 1.000 pacientes registrados) y que desde el uso del TXA la necesidad de reintervención por sangrado y transfusión bajo a cero (en 750 pacientes reportados), concluyendo que es una estrategia simple y costo-efectiva[7],[11]. Cabe considerar con los resultados obtenidos se podría inferir una reducción de costos sanitarios, al necesitar menos el empleo de materiales hemostáticos como el seamguard®, dato a corroborar para futuras investigaciones.
De Brito y cols., presentaron un ECA utilizando 1 g ev de TXA en SG y encontraron reducción de sangrado intraoperatorio, estancias hospitalarias más cortas y valores de hemoglobina (Hb) y hematocrito (Hto) más altos en el posoperatorio en el grupo tratado comparado al grupo control, sin reportar ningún evento trombótico[26]. Pawel Lech y cols., en su estudio de cohorte con TXA en SG, también empleando 1 g ev de TXA reportaron reducción significativa de sangrado intraopera- torio, reducción de tiempos quirúrgicos, estancia hospitalaria menor, menos necesidad de refuerzo en líneas de sutura, sin registro de eventos trombóticos. En dicho trabajo en el GC se efectuaron 3 reintervenciones por sangrado y ninguna en el grupo tratado con TXA[27]. Mocanu y cols., publican en 2023 la primera revisión sistemática con metaanálisis, sobre un total de 475 pacientes sometidos a SG (dos ensayos clínicos y dos estudios de cohortes analizados) y empleando 1 g de TXA en la inducción anestésica se informó una diferencia estadísticamente significativa en reducción de sangrado para el grupo TXA, sin reportes de mortalidad ni de eventos vasculares adversos. Dichos autores concluyen aún no se conoce con precisión dosis ni timing más apropiado de TXA para la población bariátrica[28]. Posterior a dicha publicación, en el mismo año, Sermet y Ozsoy presentan un ECA donde concluyen que no existe diferencia entre administrar el TXA en la inducción anestésica o al final de la cirugía de SG y, al igual que los resultados encontrado por De Brito y cols, los pacientes a los que se administraron TXA en SG también presentaron reducción de sangrado postoperatorio, con valores más altos de Hto y Hb, respecto al grupo place bo. A pesar de ello no encontraron diferencias en reducción de tiempos quirúrgicos y no hubo reportes de eventos trombóticos entre los participantes del estudio[29]. Cabe resaltar que los resultado de los marcadores inflamatorios en el grupo tratado con TXA fueron más bajos, por lo que existe la hipótesis del posible rol antiinflamatorio, también descripto por Mocanu, que tendría dicha droga y que también podría explicar en parte la reducción de la mortalidad no asociada a hemorragia que se observaron en los paciente en el estudio CRASH 2. Siendo que la obesidad es un estado proinflamatorio, es de esperar que se lograrían efectos beneficiosos con el empleo de TXA por tal razón.
Luego de la publicación de Mocanu y cols., Hart y Noordman publican un ECA de 101 pacientes bariátricos sometidos a SG, utilizando una dosis mayor de TXA (1,5 g ev). Si bien los pacientes tratados con TXA tuvieron menos caída de niveles de Hb y Hto postquirúrgicos comparado al placebo (igual resultado al obtenido en el trabajo de De Brito y Sermet) y una menor estancia hospitalaria (como la reportada por Pawel Lech, De Brito y nuestro grupo de trabajo) pero, a diferencia de los estudios mencionados más arriba, no encontraron una reducción estadísticamente significativa, ni en sangrado ni en las estrategias aplicadas para lograr la hemostasia quirúrgica entre los grupos estudiados (a diferencia de nuestros resultados). Un sólo paciente fue reintervenido por hemorragia en el grupo placebo y ninguno en el grupo tratado con TXA. Tampoco hubo reporte de episodios de trombosis ni mortalidad asociada[30].
Recientemente, Hossain y cols., publicaron un estudio de cohorte retrospectivo sobre 400 pacientes sometidos a SG y empleando 1 g de TXA no reportaron reoperaciones por sangrado en el grupo tratado, versus el GC donde presentaron una tasa de reintervención de 1,6%[31], mismo resultado que arrojó nuestra base de datos analizada. Dichos autores recomiendan administrar el TXA al final de la cirugía para maximizar el efecto antifibrinolítico en el postquirúrgico inmediato, debido a su corta vida media, resultado que discrepa de lo publicado por Sermet y Ozsoy[29].
Si consideramos que en el campo de la cirugía obstétrica como en la cirugía ortopédica existe un incremento del riesgo de episodios tromboembólicos y la evidencia demuestra que el empleo profiláctico de TXA es beneficioso en términos de reducción de pérdidas hemáticas y necesidad de transfusión, sin incrementar el riesgo vascular, nos deberíamos preguntar por qué no utilizarlo en la población bariátrica que, al igual que los casos mencionados anteriormente, se acompañan de un estado protrombótico.
Nuestro estudio tiene varias limitaciones como la definición subjetiva de eventos hemorrágicos, el carácter obervacional y retrospectivo del estudio, falta de cegamiento de los cirujanos puede haber influido en la decisión de utilizar más o menos clips hemostáticos y además no todos los pacientes fueron sometidos a screening ultrasonográfico para detectar posibles eventos trombóticos asintomáticos. Sin embargo, en cuanto a fortalezas, el análisis estadístico sobre la cuantificación de las pérdidas hemáticas contabilizadas en la bomba de succión y el número de reoperaciones reportadas en el registro de historias clínicas fueron absolutos, un tamaño muestral representativo y la estandarización de la técnica quirúrgica, efectuadas todas ellas por el mismo equipo quirúrgico.
-
Conclusión
El empleo de TXA, en dosis de 1 g ev en la inducción anestésica para cirugía bariátrica, demostró reducir la necesidad de utilización de clips hemostáticos, menores pérdidas de sangre intraoperatorias, tiempos quirúrgicos más cortos como así también estancia hospitalaria menores comparados al grupo control. No hubo necesidad de reintervención por sangrado en el grupo tratado con TXA ni se observó un incremento del riesgo trombótico. Se necesitan futuras revisiones sistemáticas con metaanálisis y ECA con mayor tamaño muestral que permitan confirmar los resultados de los hallazgos obtenidos.
Conflicto de intereses: Los autores declararon no tener conflicto de interés.
-
Referencias
1. Welbourn R, Hollyman M, Kinsman R, Dixon J, Liem R, Ottosson J, et al. Bariatric Surgery Worldwide: Baseline Demographic Description and One-Year Outcomes from the Fourth IFSO Global Registry Report 2018. Obes Surg. 2019 Mar;29(3):782–95. https://doi.org/10.1007/s11695-018-3593-1 PMID:30421326
2. Zellmer JD, Mathiason MA, Kallies KJ, Kothari SN. Is laparoscopic sleeve gastrectomy a lower risk bariatric procedure compared with laparoscopic Roux-en-Y gastric bypass? A meta-analysis. Am J Surg. 2014 Dec;208(6):903–10. https://doi.org/10.1016/j.amjsurg.2014.08.002 PMID:25435298
3. Mocanu V, Dang J, Ladak F, Switzer N, Birch DW, Karmali S. Predictors and outcomes of bleed after sleeve gastrectomy: an analysis of the MBSAQIP data registry. Surg Obes Relat Dis. 2019 Oct;15(10):1675–81. https://doi.org/10.1016/j.soard.2019.07.017 PMID:31590999
4. Zafar SN, Miller K, Felton J, Wise ES, Kligman M. Postoperative bleeding after laparoscopic Roux en Y gastric bypass: predictors and consequences. Surg Endosc. 2019 Jan;33(1):272–80. https://doi.org/10.1007/s00464-018-6365-z PMID:30232617
5. Silecchia G, Iossa A. Complications of staple line and anastomoses following laparoscopic bariatric surgery. Ann Gastroenterol. 2018;31(1):56–64. https://doi.org/10.20524/aog.2017.0201 PMID:29333067
6. Augustin T, Aminian A, Romero-Talamás H, Rogula T, Schauer PR, Brethauer SA. Reoperative surgery for management of early complications after gastric bypass. Obes Surg. 2016 Feb;26(2):345–9. https://doi.org/10.1007/s11695-015-1767-7 PMID:26140855
7. Chakravartty S, Sarma DR, Chang A, Patel AG. Staple line bleeding in sleeve gastrectomy—a simple and cost-effective solution. Obes Surg. 2016 Jul;26(7):1422–8. https://doi.org/10.1007/s11695-015-1986-y PMID:26694209
8. Gagner M, Deitel M, Erickson AL, Crosby RD. Survey on laparoscopic sleeve gastrectomy (LSG) at the Fourth International Consensus Summit on Sleeve Gastrectomy. Obes Surg. 2013 Dec;23(12):2013–7. https://doi.org/10.1007/s11695-013-1040-x PMID:23912263
9. Rabl C, Peeva S, Prado K, James AW, Rogers SJ, Posselt A, et al. Early and late abdominal bleeding after Roux-en-Y gastric bypass: sources and tailored therapeutic strategies. Obes Surg. 2011 Apr;21(4):413–20. https://doi.org/10.1007/s11695-011-0354-9 PMID:21240659
10. Lee MG, Provost DA, Jones DB. Use of fibrin sealant in laparoscopic gastric bypass for the morbidly obese. Obes Surg. 2004;14(10):1321–6. https://doi.org/10.1381/0960892042583824 PMID:15603645
11. Hussain A, Al-Shoek I, El-Hasani S. The use of tranexamic acid in sleeve gastrectomy. Obes Surg. 2017 Jan;27(1):198–9. https://doi.org/10.1007/s11695-016-2409-4 PMID:27718174
12. Effect of early administration of tranexamic acid on mortality, hysterectomy, other morbidities in women with postpartum haemorrhage (The WOMAN trial): a randomised, placebo-controlled trial. Lancet. 2017;389(10084):2105–16. https://doi.org/10.1016/S0140-6736(17)30638-4 PMID:28456509
13. Haj-Younes B, Sivakumar BS, Wang M, An VV, Lorentzos P, Adie S. Tranexamic acid in hip fracture surgery: A systematic review and meta-analysis. J Orthop Surg (Hong Kong). 2020;28(1):2309499019887995. https://doi.org/10.1177/2309499019887995 PMID:31835969
14. Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, et al.; CRASH-2 trial collaborators. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet. 2010 Jul;376(9734):23–32. https://doi.org/10.1016/S0140-6736(10)60835-5 PMID:20554319
15. Myles PS, Smith JA, Forbes A, Silbert B, Jayarajah M, Painter T, et al.; ATACAS Investigators of the ANZCA Clinical Trials Network. Tranexamic Acid in Patients Undergoing Coronary-Artery Surgery. N Engl J Med. 2017 Jan;376(2):136–48. https://doi.org/10.1056/NEJMoa1606424 PMID:27774838
16. NHS Blood & Transplant. National comparative audit of NICE quality standards for transfusion. Available from: https://hospital.blood.co.uk/audits/national-comparativeaudit/national-comparative-audit-reports/
17. Janik MR, Walędziak M, Brągoszewski J, Kwiatkowski A, Paśnik K. Prediction model for hemorrhagic complications after laparoscopic sleeve gastrectomy: development of SLEEVE BLEED calculator. Obes Surg. 2017 Apr;27(4):968–72. https://doi.org/10.1007/s11695-016-2417-4 PMID:27730461
18. Taeuber I, Weibel S, Herrmann E, Neef V, Schlesinger T, Kranke P, et al. Association of Intravenous Tranexamic Acid With Thromboembolic Events and Mortality: A Systematic Review, Meta-analysis, and Meta-regression. JAMA Surg. 2021 Apr;156(6):e210884. https://doi.org/10.1001/jamasurg.2021.0884 PMID:33851983
19. Ker K, Prieto-Merino D, Roberts I. Systematic review, meta-analysis and meta-regression of the effect of tranexamic acid on surgical blood loss. Br J Surg. 2013 Sep;100(10):1271–9. https://doi.org/10.1002/bjs.9193 PMID:23839785
20. Grocott MP, Murphy M, Roberts I, Sayers R, Toh CH; UK Royal Colleges Tranexamic Acid in Surgery Implementation Group. Tranexamic acid for safer surgery: the time is now. Br J Anaesth. 2022 Oct;129(4):459–61. https://doi.org/10.1016/j.bja.2022.06.024 PMID:36070986
21. Devereaux PJ, Marcucci M, Painter TW, Conen D, Lomivorotov V, Sessler DI, et al.; POISE-3 Investigators. Tranexamic Acid in Patients Undergoing Noncardiac Surgery. N Engl J Med. 2022 May;386(21):1986–97. https://doi.org/10.1056/NEJMoa2201171 PMID:35363452
22. Klaassen RA, Selles CA, van den Berg JW, Poelman MM, van der Harst E. Tranexamic acid therapy for postoperative bleeding after bariatric surgery. BMC Obes. 2018 Dec;5(1):36. https://doi.org/10.1186/s40608-018-0213-5 PMID:30524741
23. Hunt BJ. The current place of tranexamic acid in the management of bleeding. Anaesthesia. 2015 Jan;70(s1 Suppl 1):50–3. https://doi.org/10.1111/anae.12910 PMID:25440395
24. Pilbrant A, Schannong M, Vessman J. Pharmacokinetics and bioavailability of tranexamic acid. Eur J Clin Pharmacol. 1981;20(1):65–72. https://doi.org/10.1007/BF00554669 PMID:7308275
25. Eriksson O, Kjellman H, Pilbrant A, Schannong M. Pharmacokinetics of tranexamic acid after intravenous administration to normal volunteers. Eur J Clin Pharmacol. 1974 Aug;7(5):375–80. https://doi.org/10.1007/BF00558210 PMID:4422030
26. De Brito RM, de Oliveira CMB, Moura ECR, y cols. Tranexamic acid efects in postoperative bleeding outcomes in laparoscopic sleeve gastrectomy: a controlled study. Acta Cir Bras. 2022;37(7):e370702. https://doi.org/10.1590/acb370702 PMID:36228297
27. Lech P, Michalik M, Waczyński K, Osowiecka K, Dowgiałło-Gornowicz N. Effectiveness of prophylactic doses of tranexamic acid in reducing hemorrhagic events in sleeve gastrectomy. Langenbecks Arch Surg. 2022 Nov;407(7):2733–7. https://doi.org/10.1007/s00423-022-02630-5 PMID:35920900
28. Mocanu V, Wilson H, Verhoeff K, Kung J, Walsh C, Koloszvari N, et al. Role of Tranexamic Acid (TXA) in Preventing Bleeding Following Sleeve Gastrectomy: a Systematic Review and Meta-analysis. Obes Surg. 2023 May;33(5):1571–9. https://doi.org/10.1007/s11695-023-06563-w PMID:36977890
29. Sermet M, Ozsoy MS. Effect of Tranexamic Acid on Postoperative Bleeding in Sleeve Gastrectomy: a Randomized Trial. Obes Surg. 2023 Dec;33(12):3962–70. https://doi.org/10.1007/s11695-023-06902-x PMID:37857939
30. ’t Hart JW, Noordman BJ, Wijnand JM, Biter LU, Verbrugge SJ, Birnie E, et al.; T Hart JWH. Peroperative administration of tranexamic acid in sleeve gastrectomy to reduce hemorrhage: a double-blind randomized controlled trial. Surg Endosc. 2023 Oct;37(10):7455–63. https://doi.org/10.1007/s00464-023-10232-5 PMID:37400687
31. Hossain N, Kaur V, Mahran M, Quddus A, Mukhopadhyay S, Shah A, et al. Intra-operative Tranexamic Acid Administration Significantly Decreases Incidence of Postoperative Bleeding Without Increasing Venous Thromboembolism Risk After Laparoscopic Sleeve Gastrectomy: a Retrospective Cohort Study of Over 400 Patients. Obes Surg. 2024 Feb;34(2):396–401. https://doi.org/10.1007/s11695-023-07021-3 PMID:38168716

 ORCID
ORCID