Gregory Contreras Pérez1, Carolina Frederico Avendaño2, Alex Carví2, José Giménez Crouseilles3
Recibido: 25-03-2024
Aceptado: 16-04-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 4 pp. 437-439|https://doi.org/10.25237/revchilanestv53n4-21
PDF|ePub|RIS
Abstract
The obese patient undergoing bariatric and metabolic surgery poses significant challenges, especially in the field of anesthesia. Not only because of the potential difficulties in the airway approach and mechanical ventilation, but also because of the risks associated with possible errors in drug dosing that can occur when using a weight descriptor that does not fit the patient’s measurement. Herein, we present the report of a case of extreme morbid obesity, scheduled for intestinal transit bipartition, a technique recommended in patients with BMI > 50 kg/m, under total intravenous anesthesia, without opioids in the anesthetic maintenance phase, in which the use of postoperative morphine salvage was avoided. This is an anesthetic protocol, with a multimodal approach, that we have been developing for the last two years at the Hospital HM Nou Delfos, in Barcelona, Spain.
Resumen
El paciente obeso sometido a Cirugía Bariátrica y Metabólica plantea desafíos significativos, especialmente en el ámbito de la anestesia. No solo por las potenciales dificultades en el abordaje de la vía aérea y la ventilación mecánica, sino también por los riesgos asociados a los posibles errores en la dosificación de fármacos que pueden presentarse al utilizar un descriptor de peso que no se ajuste a la medida del paciente. A continuación, presentamos el reporte de un caso de obesidad mórbida extrema, programado para bipartición de tránsito intestinal, una técnica recomendada en pacientes con IMC > 50 kg/m, bajo anestesia total intravenosa, sin opioides en la fase de mantenimiento anestésico, en el cual se logró evitar el uso de rescates de morfina en el postoperatorio. Se trata de un protocolo anestésico, con un abordaje multimodal, que venimos desarrollando desde hace dos años en el Hospital HM Nou Delfos, en Barcelona, España.
-
Introducción
Una de las mayores preocupaciones del anestesiólogo al enfrentarse a un paciente obeso[1], especialmente en su forma más extrema, se encuentra relacionada, en un gran porcentaje, a la dificultad del abordaje de la vía aérea y al manejo de la ventilación. Sin embargo, existen otros desafíos asociados a esta condición específica en el contexto del protocolo de recuperación mejorada (ERAS[2], por sus siglas en inglés Enhance Recovery After Surgery), cuyas estrategias pueden ser consideradas de difícil ejecución, como sería, la implementación de la anestesia libre de opioides (OFA, por sus siglas en inglés, Opiod Free Anesthesia) en obesos sometidos a cirugía bariátrica. En la actualidad, pese a la evidencia clínica publicada que la respalda, la ejecución exitosa de la OFA sigue siendo limitada[3]. En el contexto del obeso mórbido puede ser debido a la complejidad en la elección de la escala de peso más adecuada para el ajuste de dosis de agentes hipnóticos y analgésicos, así como también por la falta de incorporación de los nuevos modelos farmacocinéticos alometricos en los dispositivos de perfusión controlados por objetivo.
A continuación, les presentamos un caso de OFA en un paciente con obesidad extrema sometido a Bipartición Intestinal, descrita por Santoro[4], en la cual se evita la exclusión parcial del intestino proximal, manteniendo los mecanismos protectores contra la hipoglicemia y la capacidad de absorción de mi- cronutrientes. El procedimiento, normalmente, se realiza en un solo tiempo quirúrgico y se encuentra indicado en pacientes con índice de masa corporal (IMC) mayor de 50 kg/m2, siendo considerado el más efectivo para perder peso, y con menos complicaciones que la derivación biliopancreática con cruce duodenal.
-
Caso clínico
Hombre de 22 años, con índice de masa corporal de 77,20 kg/m2 (223 kg de peso y 170 cm de estatura), programado para bipartición de tránsito intestinal[4], procedimiento de cirugía metabólica, en diciembre de 2023. Entre sus antecedentes personales destacaban tabaquismo (3 paquetes/año), Síndrome de Apnea-Hipoapneas del sueño (SAHS), y obesidad mórbida/gra- ve Grado III (según la OMS, Organización Mundial de la Salud) y obesidad extrema tipo IV (según la SEEDO, Sociedad Española para el Estudio de la Obesidad).
Durante la visita preanestésica, se aplica la prueba predicti- va de Arné modificado[5] para evaluar y descartar la vía aérea difícil, obteniéndose una puntuación menor a 11 puntos: Ma- llampati II, distancia tiromentoniana mayor de 6,5 cm, apertura oral > 5 cm, máximo rango de movimiento de la cabeza-cuello > 100° (circunferencia de cuello < 42 cm), sin antecedentes ni patologías asociadas a intubación difícil, con 2 criterios asociados a ventilación difícil (IMC y SAHS). Se le explica la técnica anestésica y se obtiene el consentimiento informado para realizar la OFA.
El día de la cirugía, el equipo de acogida realiza el checklist prequirúrgico, revisando historia clínica, consentimientos, analítica, y ayuno. En el área de preanestesia se realiza la primera toma de constantes, se canalizan 2 vías venosas periféricas, se administra profilaxis antibiótica y 2 mg de midazolam intravenoso. Se canaliza vía arterial radial izquierda. Se traslada a quirófano, en el que se adecuaron las condiciones para garantizar la seguridad del paciente uniendo dos mesas quirúrgicas en posición de rampa. Se monitoriza la pulsioximetría (SpO2), el registro electrocardiográfico (DII, V5), presión arterial invasiva, profundidad anestésica y la nocicepción mediante sus respectivos índices: qCON y qNOX (Quantium Medical, Barcelona, España), bloqueo neuromuscular con TOF (Tren de cuatro, TOF-Watch®) y compresión neumática de miembros inferiores. Se registraron los valores basales de presión arterial (138/82 mmHg), frecuencia cardíaca (89 lpm), y pulsioximetria (98%).
En cuanto a las escalas de peso utilizadas, se decide ajustar las dosis de los agentes anestésicos según el peso corporal corregido (PCC) del paciente, calculado en 127,4 kg con la fórmula de Servín[6] (Peso Ideal + (0,4 x (Peso Real – Peso Ideal)). Y la ventilación mecánica según el peso ideal (22 x (Altura en metros2)).
Previa inducción anestésica se cumple pauta de dexketopro- feno 50 mg, dexametasona 12 mg, ondasentrón 8 mg y paracetamol 1 g vía intravenoso. Se preoxigenó durante 5 minutos, se administró fentanilo 3 mcg/kg, lidocaína 2 mg/kg, ketamina 300 mcg/kg y sulfato de magnesio 50 mg/kg en forma de bolos intravenosos, tras ello las perfusiones de dexmedetomidine 1 mcg/kg/h y propofol con el modelo de Schnider (aceptando la corrección del IMC a 121,3 kg calculada por el modelo), a una concentración de 5 mcg/ml dirigido a sitio efecto. Una vez confirmada la pérdida de respuesta verbal, se comprobó satisfactoriamente la ventilación manual con mascarilla facial y se administra rocuronio 1,2 mg/kg. Tras 60 segundos con TOF de 0, se procede al abordaje de la VA con tubo anillado calibre 9, usando la hoja 4 del Glidescope® al primer intento y sin incidencias.
Se inicia ventilación mecánica controlada por volumen. Las estrategias de ventilación protectora se centraron en mantener presiones alveolares < 30 cmH2O, con un volumen corriente de 8 ml/kg, FiO2 de 0,65, 14 rpm. PEEP óptima calcula de 10, posterior a maniobras de reclutamiento alveolar. El mantenimiento anestésico se realizó con perfusiones de propofol guiado por índice qCON (entre 40-60), ketamina 300 mcg/kg/h, lidocaína 2 mg/ kg/h, dexmedetomidine en 0,3 mcg/kg/h y bolos de rocuronio con el objetivo de mantener el conteo post-tetánico entre 0 y 2.
El paciente permaneció hemodinámicamente estable durante toda la cirugía. No se registraron elevaciones de la presión arterial tras iniciar el neumoperitoneo ni con los cambios de posición. La saturación se mantuvo por encima de 94%, el CO2 telespirado entre 45 y 52 mmHg. El sangrado fue escaso, sin repercusión clínica. Las perfusiones de dexmedetomidine, keta- mina y lidocaína se conservaron hasta el momento de la retirada de los trocares, la de propofol se disminuyó, escalonadamente, a partir de este momento hasta el fin de la cirugía. El tiempo de respuesta verbal fue de 5 minutos tras finalizar perfusión de propofol y administrar sugammadex 400 mg, extubando al pa- cíente con TOF > 0,9, encontrándose tranquilo y colaborador. La duración total del procedimiento fue de 160 minutos.
El paciente se trasladó a la Unidad de Cuidados Intensivos para vigilancia estricta durante las primeras 24 h, con una pauta analgésica que incluía dexketoprofeno (50 mg c/8 h IV), metamizol (2 g c/12 IV), paracetamol (1 g c/8 h IV y rescates de morfina según la Escala Visual Análoga (EVA) > 3. Durante este periodo se mantuvo consciente, orientado, eupneico, saturando 100% con gafas nasales a 3 l/min, hemodinámicamente estable (sin vasopresores), algias controladas. En el área de hospitalización permaneció estable, buena tolerancia a la vía oral, sin episodios de náuseas ó vómitos, manteniendo valores en la EVA de dolor entre 0 y 2, sin requerir rescates de morfina durante todo el posoperatorio, la diuresis espontanea fue superior a 0,5 ml/kg/hora, y es dado de alta a las 72 h.
-
Discusión
La singularidad de este este tipo de casos plantea desafíos únicos en el ámbito de la anestesia y la cirugía. Las estrategias implementadas por el equipo multidisciplinario no solo garantizaron la seguridad del paciente, sino también permitieron la adaptación de medidas al contexto clínico excepcional.
La elección de la técnica OFA, como alternativa para reducir los riesgos asociados al uso de opioides en el intraoperatorio estaba claramente justificada[7]. Sin embargo, en lugar de optar por el preparado multimix descrito por Mulier[8] en la inducción y mantenimiento, se decidió implementar un protocolo libre de opioides que venimos desarrollando desde hace 2 años en la institución, basado en perfusiones independientes de propofol como agente hipnótico, y dexmedetomidine, lidocaína y ketamina como coadyuvantes en perfusión continua. Respetando la variabilidad de los perfiles farmacocinéticos de cada fármaco y evitando el uso de opioides en la fase de mantenimiento anestésico.
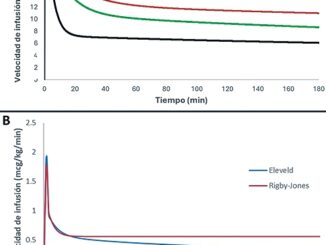
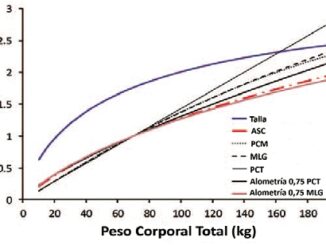
Para el cálculo de las dosis, se utilizó el peso corporal ajustado del paciente, no solo por tratarse de un descriptor validado en la población obesa, sino también porque mejora el rendimiento predictivo del modelo de Schnider al corregir el error del clearance debido a la estimación inapropiada de la masa corporal magra que genera la ecuación de James en el obeso mórbido. Es importante destacar que el uso del peso ajustado con los modelos de Marsh y Schnider está recomendado siempre y cuando se disponga de monitorización del EEG para evitar consecuencias debidas a infra o sobredosificación[9].
Otro hecho llamativo fue que el paciente no requirió rescates de morfina en el posoperatorio a pesar de presentar factores de riesgo asociados al mal control del dolor posterior a cirugía bariátrica, como ser joven y fumador[10]. La reducción del dolor y los requerimientos de opioides se logró con los coadyuvantes antihiperalgésicos utilizados: lidocaína, ketamina y dexmedetomidine, que permitieron controlar los mecanismos pro nociceptivos en distintos niveles de las vías del dolor.
Hasta la fecha, no existen protocolos estandarizados, universalmente, sobre anestesia libre de opioides que incluyan pautas específicas de analgesia postoperatoria en pacientes con obesidad mórbida extrema. Sin embargo, existe evidencia y recomendaciones de ciertas técnicas[8] que se han ido modificando a lo largo de los años entre distintos grupos de investigación que han permitido adaptarnos al contexto clínico de cada paciente y a los recursos tecnológicos de las instituciones, mejorando la calidad y seguridad en el manejo anestésico. Por lo tanto, debemos mantenernos actualizados sobre las diferentes alternativas disponibles en el abordaje del obeso mórbido a pesar de las limitaciones que puedan presentarse. En nuestro caso, logramos mantener un estado hipnótico adecuado, mejorando el rendimiento predictivo del modelo de Schnider de propofol, modificando la escala de peso con la que fue diseñado, inicialmente, y utilizando un monitor de EEG procesado para titular la perfusión.
Con respecto a la anestesia libre de opioides, es claro que se requieren más estudios para definir sus indicaciones y determinar sus posibles complicaciones, sin embargo, parece ser una técnica beneficiosa en ciertos casos como lo es el obeso mórbido.
-
Referencias
1. Wynn-Hebden A, Bouch DC. Anaesthesia for the obese patient. BJA Educ. 2020 Nov;20(11):388–95. https://doi.org/10.1016/j.bjae.2020.07.003 PMID:33456923
2. Stenberg E, Dos Reis Falcão LF, O’Kane M, Liem R, Pournaras DJ, Salminen P, et al. Guidelines for Perioperative Care in Bariatric Surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations: A 2021 Update. World J Surg. 2022 Apr;46(4):729–51. https://doi.org/10.1007/s00268-021-06394-9 PMID:34984504
3. E, Díaz-Crespo J, Escalona-Belmonte JJ, Guerrero-Orriach JL. Opioid-free anesthesia for open radical cystectomy in morbid obesity. Rev Esp Anestesiol Reanim (Engl Ed). 2021 Sep 23:S0034-9356(21)00134-1.
4. Godoy EP, Pereira SS, Coelho D, Pinto IM, Luz VF, Coutinho JL, et al. Isolated intestinal transit bipartition: a new strategy for staged surgery in superobesity [Portuguese, English.]. Rev Col Bras Cir. 2019 Dec;46(5):e20192264. https://doi.org/10.1590/0100-6991e-20192264 PMID:31859724
5. Arné J, Descoins P, Fusciardi J, Ingrand P, Ferrier B, Boudigues D, et al. Preoperative assessment for difficult intubation in general and ENT surgery: predictive value of a clinical multivariate risk index. Br J Anaesth. 1998 Feb;80(2):140–6. https://doi.org/10.1093/bja/80.2.140 PMID:9602574
6. Cortínez LI, Anderson BJ. Advances in pharmacokinetic modeling: target controlled infusions in the obese. Curr Opin Anaesthesiol. 2018 Aug;31(4):415–22. https://doi.org/10.1097/ACO.0000000000000619 PMID:29794852
7. Ulbing S, Infanger L, Fleischmann E, Prager G, Hamp T. The Performance of Opioid-Free Anesthesia for Bariatric Surgery in Clinical Practice. Obes Surg. 2023 Jun;33(6):1687–93. https://doi.org/10.1007/s11695-023-06584-5 PMID:37106268
8. Mulier JP, Zadonsky I. 2018. Mulier Mulimix keep it simple protocol developed by Jan Mulier MD & Igor Zadonsky MD, https://www.researchgate.net/publication/325105959_2018_Mulier_Mulimix_keep_it_simple_protocol_developed_by_Jan_Mulier_MD_Igor_Zadonsky_MD
9. Cortínez LI, De la Fuente N, Eleveld DJ, Oliveros A, Crovari F, Sepulveda P, et al. Performance of propofol target-controlled infusion models in the obese: pharmacokinetic and pharmacodynamic analysis. Anesth Analg. 2014 Aug;119(2):302–10. https://doi.org/10.1213/ANE.0000000000000317 PMID:24977639
10. Eipe N, Budiansky AS. Perioperative Pain Management in Bariatric Anesthesia. Saudi J Anaesth. 2022;16(3):339–46. https://doi.org/10.4103/sja.sja_236_22 PMID:35898528

 ORCID
ORCID