Edgardo Banille1,3,4 Alejandro Contreras1, Silvina Longo2, Javier Urbano Villascusa5, Gabriel Paz3, Marco Jiménez Texcalpa6, Alejandro Peirone1.
Recibido: 05-04-2024
Aceptado: 12-05-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 5 pp. 453-463|https://doi.org/10.25237/revchilanestv53n5-04
PDF|ePub|RIS
Noninvasive hemodinamic monitoring echodinamic: Part 1
Abstract
The incorporation of bedside ultrasound with the Point of Care Ultrasound (POCUS) approach generated a paradigm shift in the management of critically ill patients with hemodynamic instability/shock. Ultrasounds are a non-invasive, modern, fast, repeatable monitoring tool, they do not generate radiation, they avoid the transfer of critical patients and offer a clinical response to a specific hemodynamic scenario. For the diagnosis and management of the child in shock we will use a simplified eco-physiological approach, amalgamating the algorithm published by Mercadal MD, with the 5 “E” approach proposed by Koratala MD. For educational purposes, they evaluate cardiac function (PUMP), the dimensions of the cardiac cavities and the inferior vena cava (TANK) and the pipes that involve the large arteries: abdominal aorta, femoral and popliteal and the abdominal veins: inferior vena cava, suprahepatic, portal and renal (PIPES), to then characterize a phenotype of the different types of shock. In what is currently called the Tri-POCUS approach, on the one hand it evaluates cardiac function and on the other hand congestion, with lung ultrasound and flow profiles of the abdominal vessels. In a second part we will deal with the 5 “Ps”: right atrial pressure (RAP), left atrial pressure (LAP), pulmonary pressure (PP), lungs, intra-abdominal pressure (IAP) and finally the ultrasound evaluation of the pleura/ peritoneum to evaluate extravascular water.
Resumen
La incorporación de la ecografía a pie de cama “bedside” con el enfoque (POCUS) “Point of Care Ultrasound”, generó un cambio de paradigma en el manejo de los pacientes críticos con inestabilidad hemodinámica/shock. Los ultrasonidos son una herramienta de monitoreo no invasiva, moderna, rápida, repetible, no generan radiación, evitan el traslado de pacientes críticos y ofrecen una respuesta clínica a un escenario hemodinámico concreto. Para el diagnóstico y manejo del niño en shock utilizaremos un enfoque eco-fisiológico simplificado, amalgamando el algoritmo publicado por el Dr. Mercadal, con el enfoque de las 5 “E” propuesto por el Dr. Koratala. A fines didácticos evalúan la función cardíaca (BOMBA), las dimensiones de las cavidades cardíacas y de la vena cava inferior (TANQUE) y las tuberías que involucran a grandes arterias: aorta abdominal, femoral y poplítea y a las venas abdominales: vena cava inferior, suprahepáticas, porta y renales (PIPES), para luego caracterizar un fenotipo de los diferentes tipos de shock. En lo que actualmente, se denomina enfoque Tri-POCUS, por un lado, evalúa la función cardíaca y por otro lado la congestión, con la ecografía pulmonar y los perfiles de flujo de los vasos abdominales. En una segunda parte nos ocuparemos de las 5 “P”: presión de aurícula derecha (PAD), presión de aurícula izquierda (PAI), presión pulmonar (PAP), pulmones, presión intraabdominal (PAI) y por último la evaluación ecográfica de pleura/peritoneo para evaluar el agua extravascular.
-
Introducción
Los escenarios de shock en pacientes pediátricos se pueden presentar en cardiopatías congénitas y adquiridas, perioperatorio cardiovascular, infecciones cardíacas, intoxicaciones, hipovolemia, patología respiratoria, traumatismos, escenarios que se encuentran con un huésped muy vulnerable debido a la inmadurez del sistema cardiorrespiratorio, especialmente los pacientes recién nacidos[1],[2].
Entre los protocolos eco-clínicos más utilizados en pacientes adultos se destacan: Rapid ultrasound in shock (RUSH), Bedside Lung Ultrasound in Emergency) BLUE, Fluid administration limited by lung sonography (FALLS), y Venous Excess Ultrasound (VExUS), este último generó un cambio en el manejo hemodi- námico, al poner en consideración la importancia de la presión venosa en la perfusión de órganos[3],[4],[5].
Las Guías publicadas por sociedades científicas: The American Society of Echocardiography (ASE)[6],[7]; The European Society of Paediatric and Neonatal Intensive Care (ESPNIC)[8], y el grupo de trabajo de ecografía de la Sociedad Española de Cuidados Críticos (SECIP)[9], han contribuido de gran manera a desarrollar y difundir el POCUS multisistémico.
También ocurrió una verdadera explosión bibliográfica, con aparición de artículos y libros de texto, cursos, congresos, plataformas científicas, utilización de simuladores y últimamente el advenimiento de la inteligencia artificial en los equipos de ultrasonidos.
-
Objetivo
Nuestro objetivo es mostrar una “Hoja de Ruta” práctica utilizando un enfoque POCUS extendido “Ecodinamia”, con una interpretación funcional para identificar los escenarios de shock en pacientes pediátricos.
-
Ecodinamia. Primera parte las 5 “E”
-
1-Exit, 2- Efussion, 3-Ejection, 4- Equality, 5- Entrance
A diferencia del protocolo RUSH (evaluación cualitativa), el abordaje que realizamos es funcional, fundamentalmente cualitativo con una impresión visual y parcialmente cuantitativo con escasas mediciones (VTI, MAPSE, punto E/septal y TAPSE), pero necesarias para interpretar las imágenes desde el punto de vista eco-fisiológico y comprender las interacciones sisto-diastólicas, las interacciones ventrículo-ventriculares y cardiopulmonares- abdominales para una visión integral del paciente[10],[11].
Algoritmo
1- EXIT: El gasto cardíaco (GC), es el volumen de sangre expulsado por el ventrículo por minuto y el volumen sistólico (VS) es la cantidad de sangre expulsada en cada latido. Es un indicador de eficiencia mecánica ventricular. El VS se obtiene por el producto del área del tracto de salida del ventrículo izquierdo (TSVI) por la integral velocidad tiempo (VTI) estimada al mismo nivel.
Se utiliza el modo bidimensional para la medición del área y el eco Doppler pulsado para medir la velocidad de la sangre que transcurre por dicho orificio. (VTI)[12],[13].
A- Medición del área aórtica: se realiza desde la vista paraesternal eje largo por debajo del plano valvular aórtico, en el momento de máxima apertura (al final de la sístole), utilizando la función zoom de alta definición. El área de sección transversal se relaciona con el cuadrado del vaso o el radio del orifico aórtico, por lo que pequeñas variaciones en la medición del área producen grandes cambios en el volumen sistólico (área x VTI). Para un flujo constante, la velocidad Doppler es inversamente proporcional al área de sección transversal.
B- Medición de la integral velocidad/tiempo (VTI): se realiza desde la vista apical 5 cámaras con Doppler espectral pulsado. La muestra Doppler se coloca paralela a la dirección del flujo en el TSVI con la menor angulación posible, preferentemente < 20°[12],[13].
Fórmula para obtener el volumen sistólico (VS) = w x radio2 x VTI.
Otra manera, es tomar el valor del área x la constante 0,785 x VTI.
Para obtener el gasto cardíaco (GC), se multiplica este valor por la frecuencia cardíaca (FC). Por las diferencias antropométricas e inter etarias, es necesario indexar el valor obtenido por el área de superficie corporal (índice cardíaco).
Conociendo que el diámetro del TSVI suele ser constante, con el enfoque POCUS, los cambios en el volumen sistólico pueden inferirse de los valores de la INTEGRAL VELOCIDAD TIEMPO (VTI) para evitar el error de la medición del área.
Los valores normales de VTI tienen un rango de 16-22 cm o un valor de: 20,5 ± 4,5 cm.
Valores < 16 cm sugieren una disminución del volumen sis- tólico, mientras que valores > 22 cm sugieren gasto cardíaco elevado (vasoplejía).
Debe medirse en varios ciclos (5 ciclos) y obtener un promedio, especialmente en casos de arritmias. Las mediciones seriadas también son útiles para evaluar respuesta a estrategias terapéuticas aplicadas como infusión de drogas vasoactivas o para evaluar respuesta a fluidos.
Pueden presentarse factores confundidores en la medición como: cardiopatías congénitas con sobrecarga volumétrica de cavidades izquierdas o derechas que generan interdependencia ventricular, obstrucciones anatómicas en el TSVI, como la hipertrofia septal asimétrica, diferentes subtipos de estenosis aórtica, o insuficiencia aórtica y causas funcionales (movimiento anormal de la válvula mitral (SAM) o niños deshidratados que disminuyen el área ventricular y del TSVI y en casos de pacientes reciben drogas inotrópicas[12]-[16].
El principio de conservación de la masa explica que el volumen sistólico y el gasto cardíaco son similares cuando atraviesa las diferentes válvulas cardíacas. En los casos antemencionados donde están presentes factores confundidores, puede utilizarse el VTI obtenido a nivel de la válvula mitral o en el tracto de salida de ventrículo derecho[17].
Con el enfoque POCUS, utilizamos el valor directo publicado por Mercadal[10]que calcula el volumen sistólico en relación con el VTI obtenido para identificar el tipo de shock y lo combinamos con la ecografía pulmonar para identificar edema pulmonar[4],[18],[19].
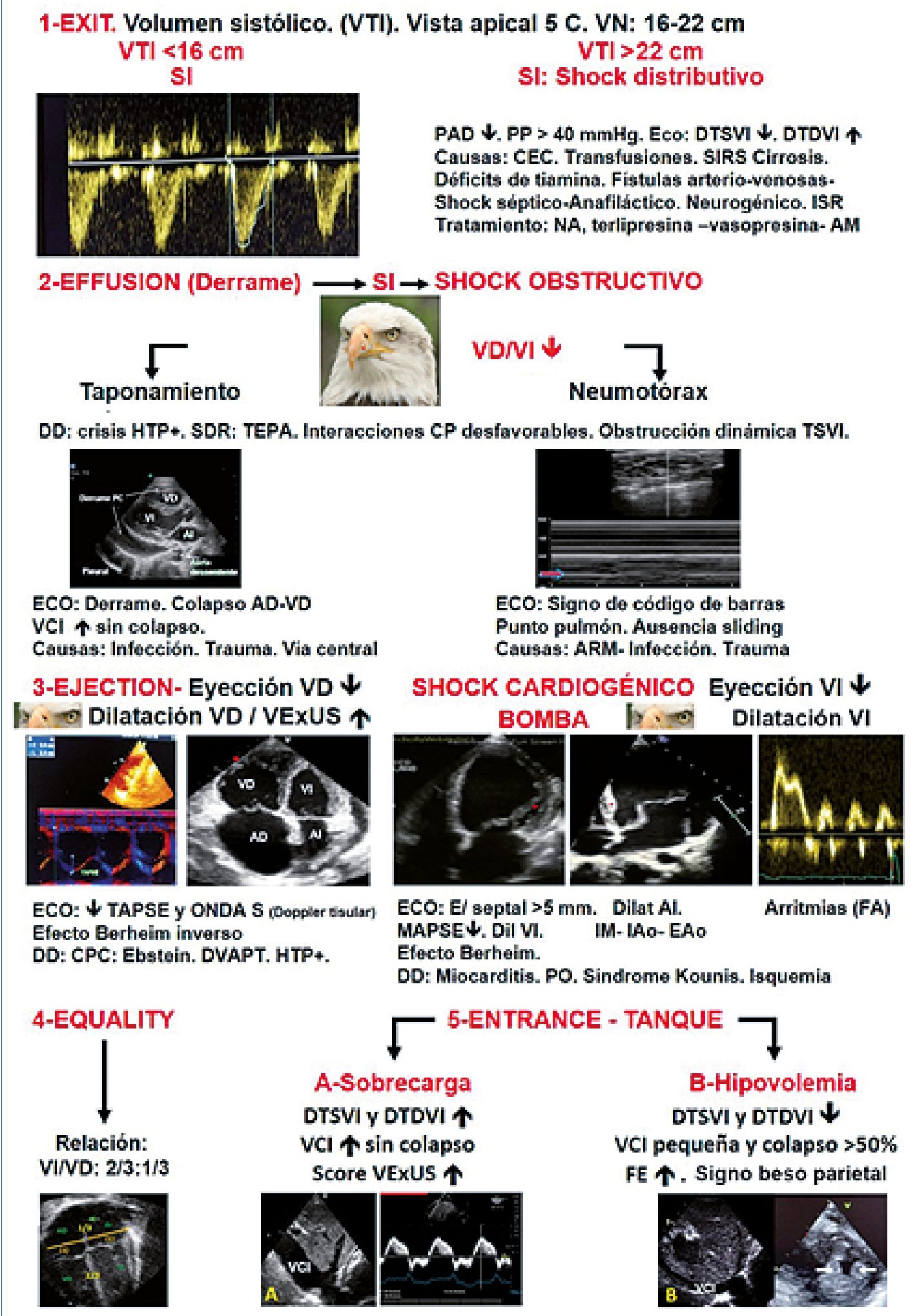
Algoritmo. Banille E. Referencias: VTI: integral velocidad tiempo. PAD: presión arterial diastólica. PP: presión del pulso. VI: ventrículo izquierdo. VD: ventrículo derecho. DTDVI: diámetro telediastólico VI. DTSVI: diámetro telesistólico VI. TAPSE: excursión sistólica anillo tricúspideo. MAPSE. Excursión sistólica anillo mitral. Onda S: onda sistólica (Doppler tisular). VCI: vena cava inferior. SIRS: respuesta inflamatoria sistémica. ISR: insuficiencia suprarrenal. AM: azul de metileno. ARM: asistencia respiratoria mecánica. CPC: cardiopatias congénitas. IM: insuficiencia mitral. IAo: insuficiencia aórtica. FA: fibrilación auricular. FE: fracción de eyección. TEPA: tromboembolismo pulmonar. CPC: cardiopatías congénitas. DVAPT: drenaje venoso pulmonar total. HPT+: hipertensión pulmonar.
-
2- Effusion (derrame pericárdico). Típico ejemplo de shock obstructivo
Se puede observar en vistas paraesternal eje largo bidimensional y modo M, también son útiles las vistas subcostal y apical 4 cámaras. En el enfoque cualitativo observaremos los 2
ventrículos pequeños rodeados de la colección que se visualiza como un espacio anecoico en el interior del saco pericárdico. Las mejores ventanas de exploración son las vistas paraesternal eje largo y subcostal. Se debe tener en cuenta el escenario clínico del paciente. Se evidencia incremento de la presión de
llenado de ambos ventrículos, aumento de la presión de AD, la presión pulmonar es normal y clínicamente se evidencia pulso paradojal[20]-[22].
El taponamiento cardíaco es una condición con riesgo vital, el incremento de la presión intra pericárdica deteriora el llenado diastólico y disminuye el volumen sistólico. No existe una relación directa entre el volumen de líquido pericárdico y el compromiso hemodinámico, también influye la velocidad de instauración. Los derrames pueden ser leves (< 1 cm), de
rrame pericárdico moderado (1 a 2 cm) a severo (> 2 cm). No siempre se requiere un derrame severo para provocar signos de taponamiento, a veces lo pueden generar compresiones tumorales o derrames localizados en la región anterior (coágulos) observado sobre todo en pacientes postquirúrgicos cardiovascular. Derrames pleurales pueden también provocar taponamiento cardíaco. Es importante destacar que los hallazgos ecográficos preceden al compromiso hemodinámico clínico[20]-[22].
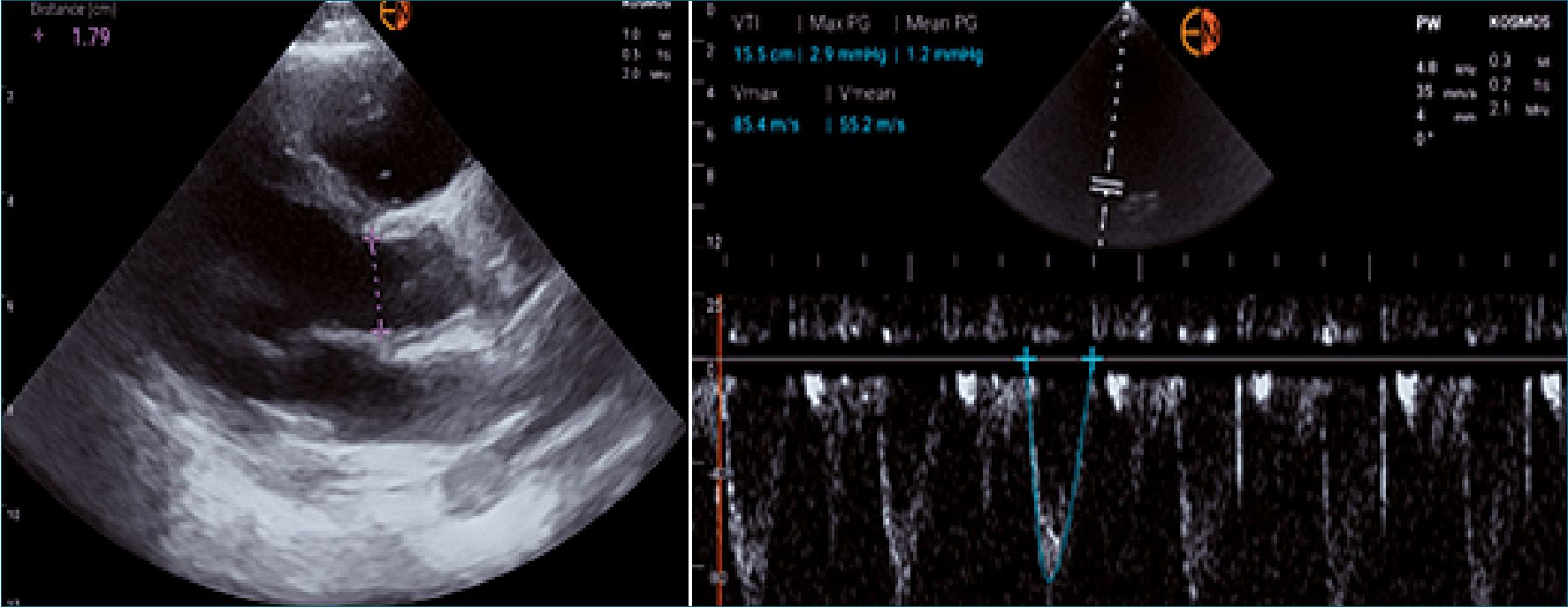
Figura 1. A. Medición del área Aórtica; B. Estimación del VTI en TSVI. Imágenes. Dr Marco Jimenez Texcalpa. (Con permiso).
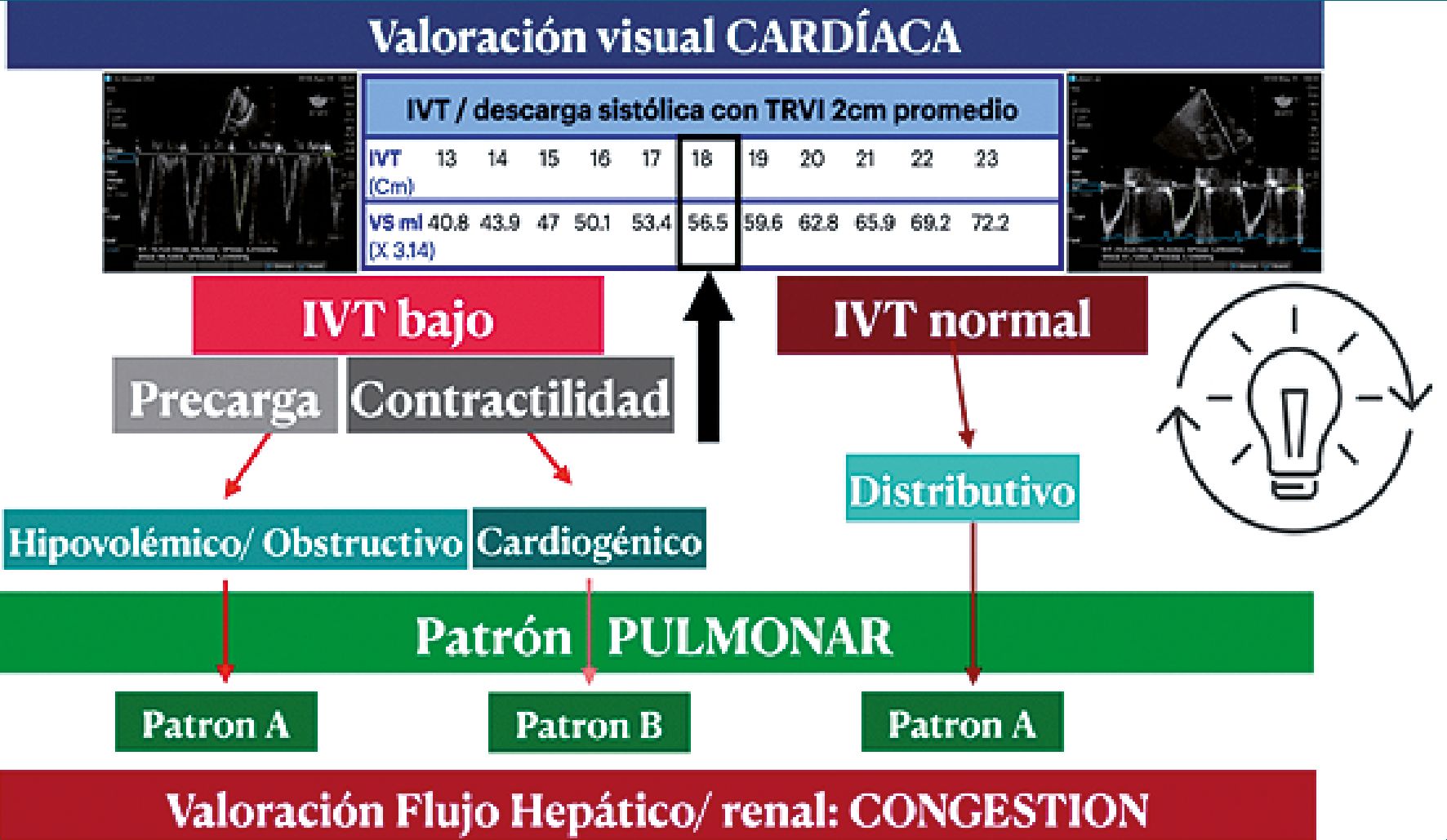
Figura 2. Enfoque Tri-POCUS: VTI- ecografía pulmonar- score VExUS. Comunicación personal. Dra. Silvina Longo.
Tabla 1. Criterios de taponamiento cardiaco[21],[22]

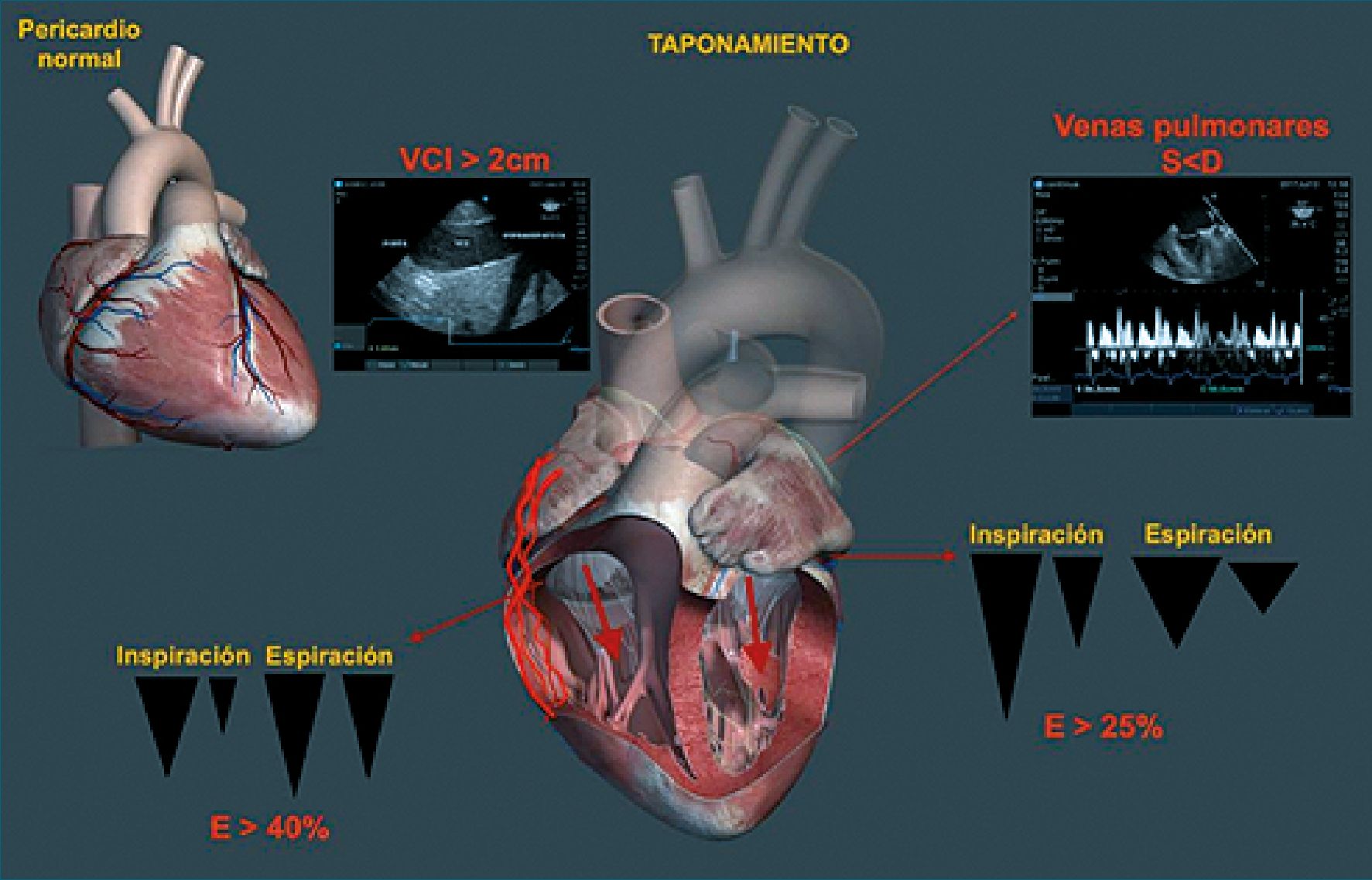
Figura 3. Signos de taponamiento cardíaco. A la izquierda se muestran las variaciones del flujo tricúspideo y a la derecha las de flujo mitral. Comunicación Dra. Silvina Longo (con permiso).
-
3- Ejection ventrículo izquierdo (eyección VI)
El ventrículo izquierdo (VI) ejecuta 4 movimientos en cada contracción: radial, circunferencial, longitudinal y de torsión oposicional entre el ápex y la base. La sinergia de estos movi
mientos genera el volumen sistólico del VI.
Desde hace muchos años la fracción de eyección del (VI) es considerada un parámetro de referencia para la evaluación de la función sistólica, demostrando la eficiencia cardíaca en su
función de bomba. En los pacientes en shock presenta limitaciones. La contractilidad no es sinónimo de función cardíaca ya que es afectada por el estado de la precarga, la poscarga, el lu- sitropismo y el volumen absoluto de la cavidad ventricular. Además, no refleja adecuadamente la función en casos de retardo de la contracción como ocurre en las disincronías ventriculares propias de los bloqueos de rama, arritmias, isquemia, infarto, cardiomiopatía por estrés, o de origen séptico o embolia pulmonar aguda. En definitiva, es un reflejo entre el acoplamiento de la contractilidad y la poscarga[23],[24]
La FE generada por las fibras circunferenciales y radiales se evalúan habitualmente por los métodos Simpson y de Teicholz, Por su parte las fibras longitudinales reducen la dimensión del VI desde la base hasta el ápex durante la sístole y contribuye hasta 30% de la función contráctil, se pueden evaluar con ecografía modo M (MAPSE) o con imágenes de Doppler tisular (TDI)[23],[24].
Evaluación ecocardiográfica. Enfoque POCUS ampliado
A- Impresión visual- Eyeballing- de una mirada – ojo %
Con el enfoque POCUS, determinar la fracción de eyección es un verdadero desafío, se trata de evaluar en base a la impresión visual algunas estructuras cardíacas relacionadas con la contractilidad ventricular como el movimiento del tabique interventricular, de las paredes ventriculares o la excursión de la valva mitral anterior. Si bien carece de la precisión de los métodos clásicos de medición de la FE, brinda información valiosa especialmente en los entornos clínicos de inestabilidad hemodi- námica/shock.
En nuestro esquema mental, nos debemos preguntar:
1. ¿cómo se ven las cavidades?: ¿normales, pequeñas, dilatadas?
2. ¿cómo impresiona la contractilidad? (evaluación cualitativa inmediata): ¿Normal, disminuida, aumentada?
Para la evaluación global marcamos con el calibrador una muesca en el centro de la cavidad del VI en el eje paraesternal corto y observamos cómo se aproximan el tabique interventricular y la pared posterior.
Para la evaluación regional también en eje corto paraesternal utilizamos la nemotecnia: SALPI para identificar las paredes del ventrículo izquierdo: septal, anterior, lateral, posterior e inferior.
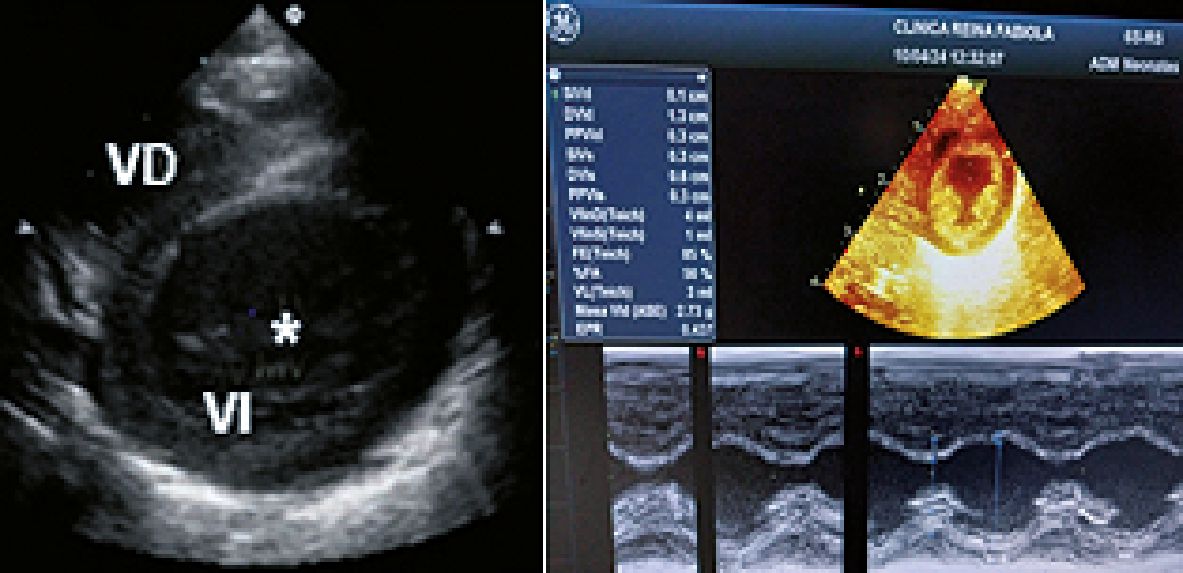
A: Normal; B: cavidades pequeñas / hipercontractilidad.

Se evalúa en la vista paraesternal eje largo. Se corta con modo M a nivel de la valva anterior mitral y se mide la distancia entre el pico de la onda E mitral durante la diástole ventricular (válvula abierta) hasta el tabique interventricular. Una buena excursión de la válvula se correlaciona con buena contractilidad, en cambio un movimiento reducido sugiere disfunción contráctil. Es muy útil para evaluar la contractilidad en forma rápida. Un valor > 5 mm en niños y > 7 mm en adultos, sugiere una disminución de la FEVI. Guarda relación inversa con la FE siempre y cuando no existan alteraciones del tabique interventricular, bloqueo de rama izquierda, cirugía de comunicación interventricular, necrosis septal, isquemia[25].
Para obtenerla se utiliza la siguiente fórmula:
FE Rápida 75,5 – (2,5 x PES mm) = % FE. E/septal: 5 mm= FEVI: 63%
Un valor de 10 mm se estima una FE: 50%, y 18 mm: FE: 30%
C- MAPSE. Excursión sistólica del plano anular mitral
Desde el plano apical de 4 cámaras, el MAPSE mide el desplazamiento del anillo mitral lateral hacia el ápex desde fin de diástole a fin de sístole. En pacientes adultos valores entre 1113 mm se correlacionan con FE > 50% (S 92% y E 72%) y valores < 7 mm con FE < 30%. En niños los valores normales: son Recién nacidos: 0,57 cm (z-score ± 2:0,38-0,76 cm hasta 1,63 cm (z-score ± 2:1,31-1,95 cm a los 18 años[28].
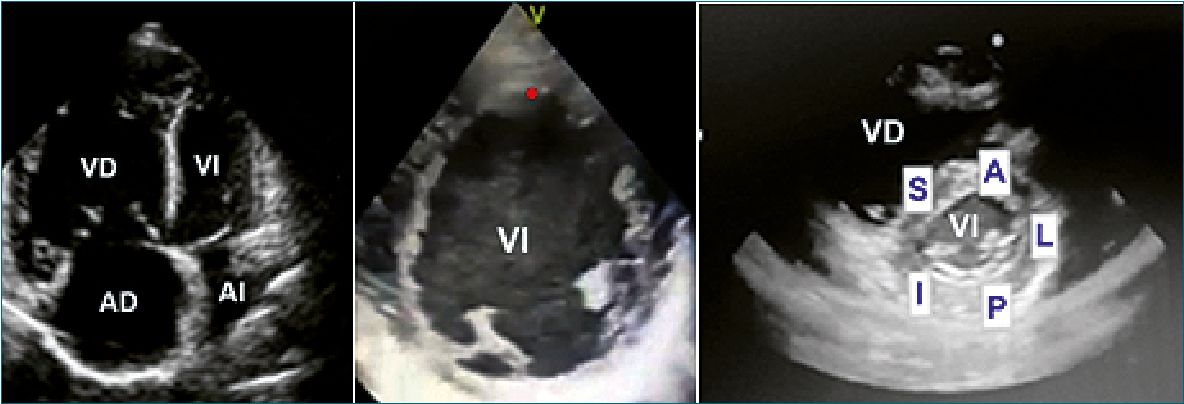
Figura 4. A-E. Impresión visual de cavidades cardíacas[27],[28]. C: Dilatación AD/VD; D: Dilatación VI.; E: Contractilidad regional (SALPI).
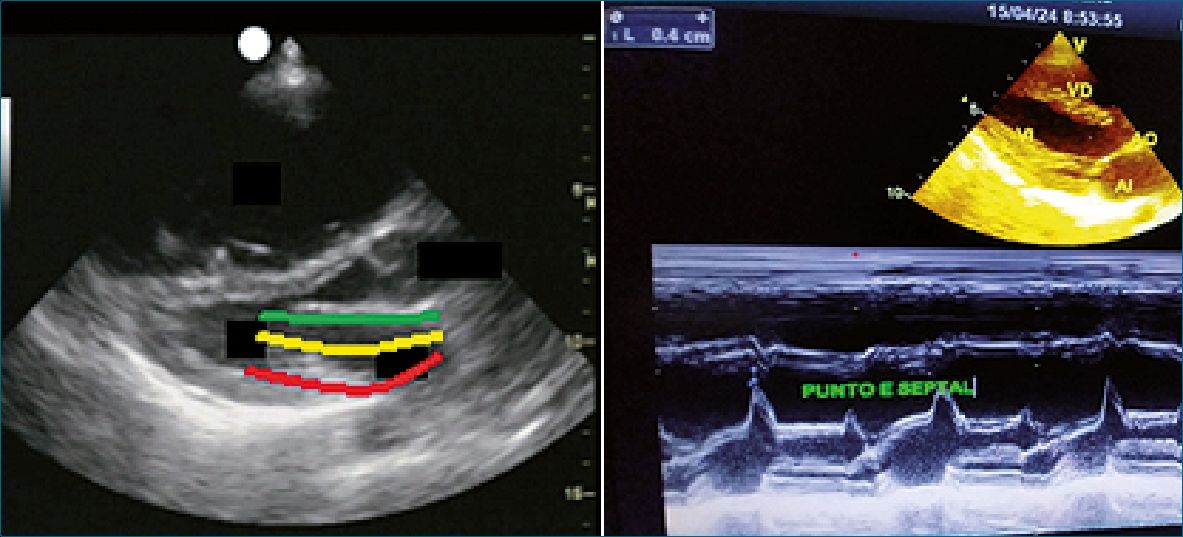
Figura 5. Punto E/mitral. Imágenes. Dr. E. Banille[27].
Es un parámetro particularmente sensible a la hipoperfu- sión coronaria debido a que las fibras longitudinales se distribuyen por la zona subendocárdica. Estas fibras son afectadas en casos de isquemia (infartos en adultos) o en niños posterior a la corrección de D-transposición de los grandes vasos (Switch arterial) o en casos de anomalías del origen (ALCAPA) o en el trayecto de las arterias coronarias, en el eco se evidencia reducción de sus valores y además prolongación de la duración de la sístole (desacoplamiento de la interacción sisto-diastólica) que reduce el volumen sistólico.
El MAPSE se puede medir aún con ventanas subóptimas, tiene relación directa con el volumen sistólico y el gasto cardíaco[20],[23],[24].
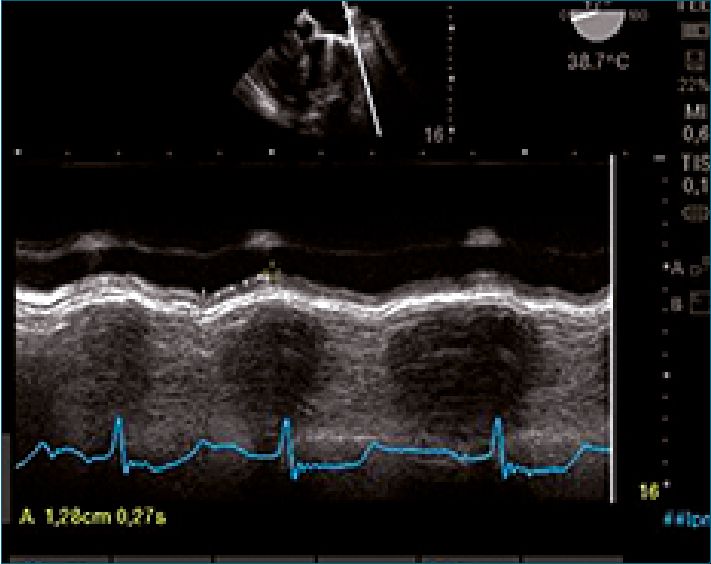
Figura 6. MAPSE. Referencias. Figura. Comunicación personal. Dra. Silvina Longo. En el análisis del MAPSE el pico de la contracción debe realizarse al final de la onda T (fin de sístole):correcta interacción sisto diastólica. Si la contracción se prolonga más allá de la onda T (acortamiento post- sistólico), se suprime el llenado rápido (onda E) alterando el lleno diastólico. Completar el análisis con la evaluación del flujo transmitral.
Tabla 2. Correlación TAPSE/fracción de eyección
| 5 mm | FE: 20% |
| 10 mm | FE: 30% |
| 15 mm | FE: 40% |
| 20 mm | FE: 50% |
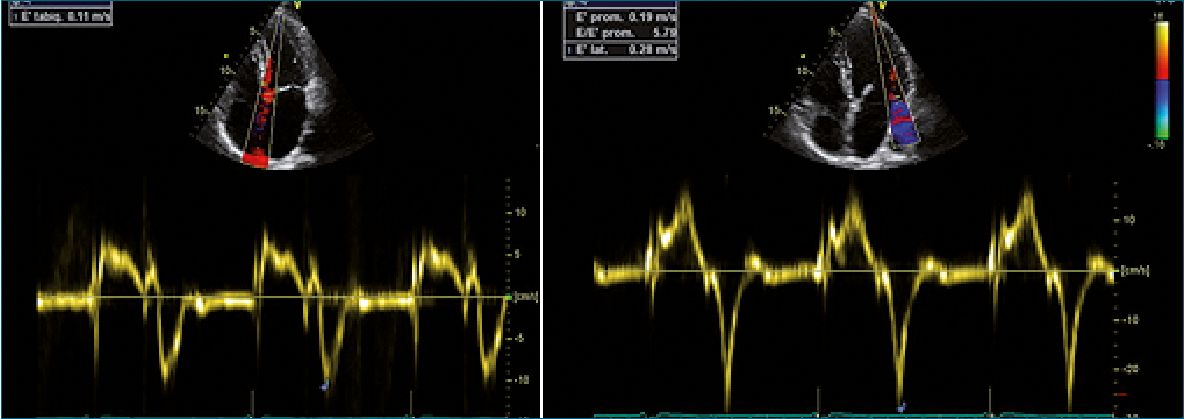
Figura 7. A: Doppler tisular septal; S: onda sistólica; onda e’: llenado rápido; B: Doppler tisular lateral. (Imágenes Dr. Alejandro Contreras) (con permiso).
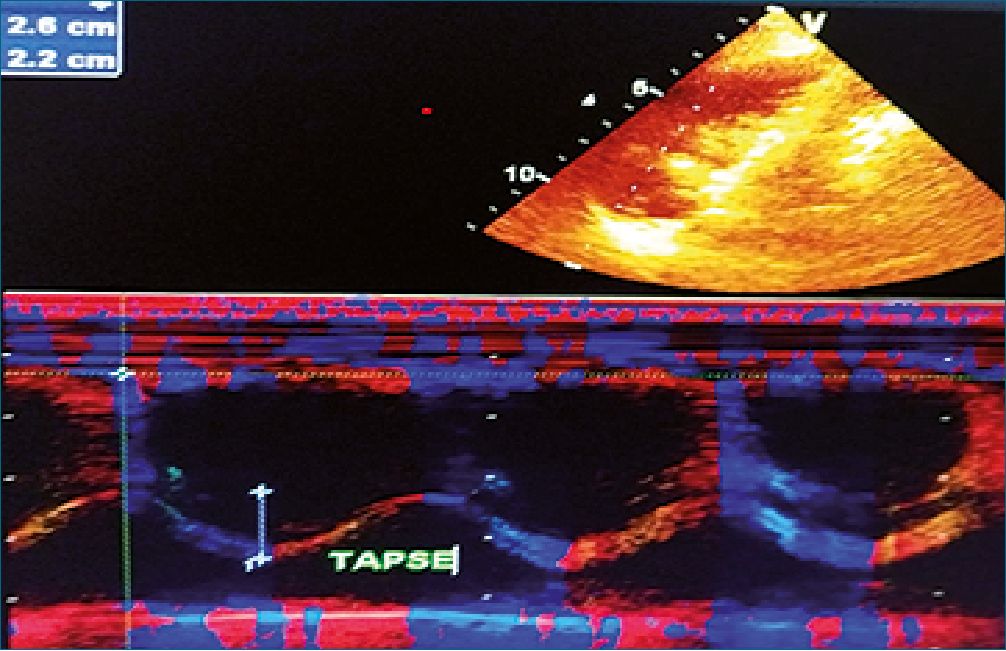
Figura 8. Excursión sistólica del anillo tricúspideo. TAPSE. (Imagen Dr.
Edgardo Banille).
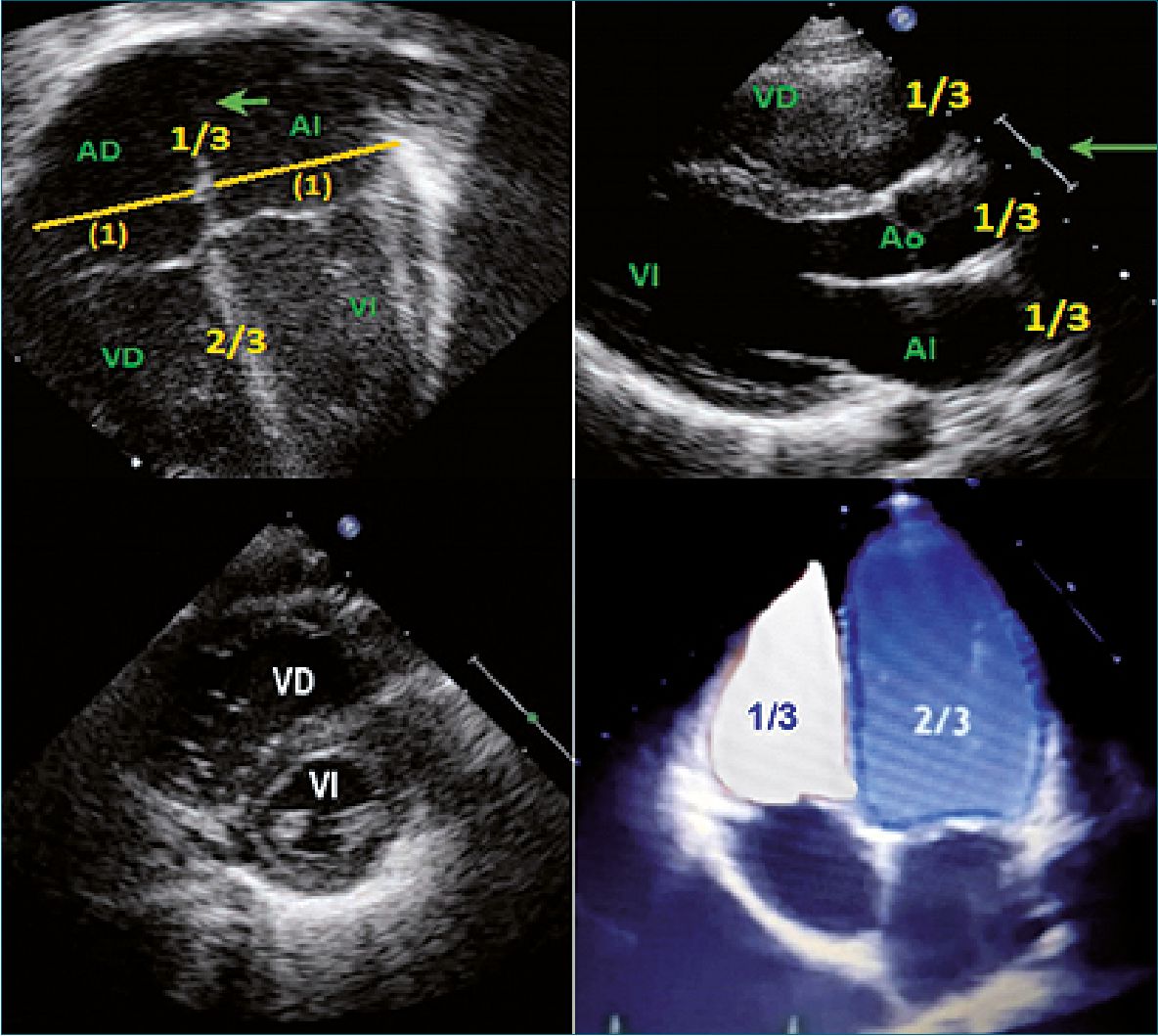
Figura 9. Evaluación cualitativa. Relación VD/VI.
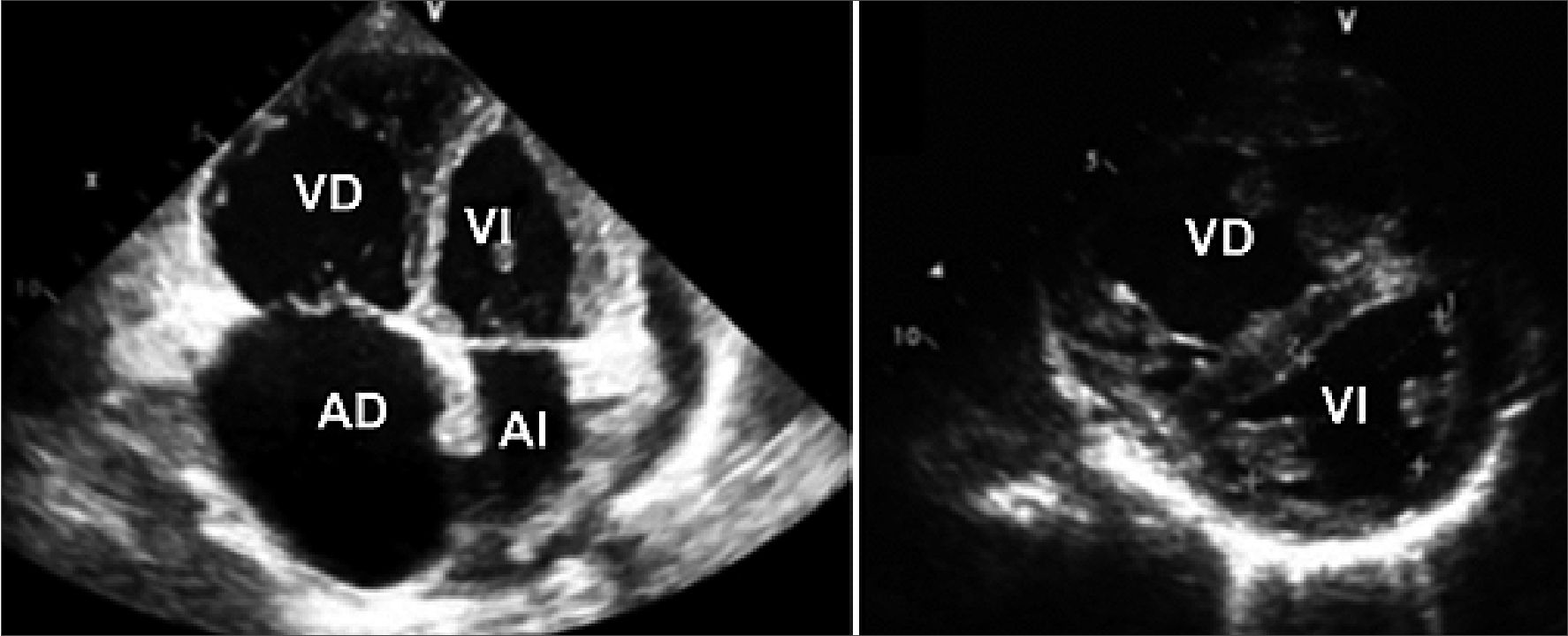
Figura 10. VD. Vista 4 cámaras; VI forma de “D”. Vista eje corto paraesternal.
D- Onda sistólica “S” con imagen Doppler Tisular (TDI)
Evalúa el movimiento de las fibras longitudinales que se extienden desde el plano valvular mitral hasta el ápex del VI, codificándose en color azul la sístole (se aleja) y rojo la diástole (se acerca), las señales de alta velocidad de la sangre son debidamente filtradas y eliminadas. Se obtienen 3 ondas: 1- positiva onda S, indica la velocidad sistólica; 2- ondas negativas, una
precoz de llenado rápido (onda e’) y otra tardía, que corresponde a la contracción auricular (onda a’).
Los valores normales de la onda sistólica S en pediatría: son:
En menores de 1 año: onda S: 5,7 ± 1,6-, 5 años: onda S: 7,7 ± 2,1; 6-9 años: 9,5 ± 2,1, y entre 10-13 años: 10,6 ± 2,9
Aplican los mismos fundamentos fisiológicos que el MAP- SE, cuando se realiza a nivel del anillo mitral lateral, muestra correlación con la derivada presión/tiempo (dP/dT) y es independiente de las condiciones de carga. Es un marcador precoz de isquemia miocárdica, la reducción de su velocidad se detecta a los 15 minutos de iniciada la misma y la presencia de ondas S post-sistólicas están asociadas a remodelamiento adverso[20],[25],[26].
Los valores bajos de MAPSE y de la onda S se asocian a mal pronóstico en shock séptico y en el destete (weaning) del soporte ECMO. También se puede identificar el período de contracción isovolumétrica (PCIV), se evidencia como una espiga por delante de la onda S. Actualmente, se considera la aceleración miocárdica y el pico de velocidad del PCIV como un índice de contracción no dependiente de precarga[20],[25],[26].
-
Ejection ventrículo derecho
La contracción del VD se realiza por los siguientes mecanismos:
1- La contracción del ventrículo izquierdo (VI) contribuye a la génesis de la presión sistólica del ventrículo derecho (VD), debido a la presencia de una capa superficial de fibras circulares (epicárdicas) que comparten ambos ventrículos a nivel del tabique interventricular (interdependencia ventricular) [29],[30].
2- Contracción de la pared libre. Ejecutan este movimiento el binomio conformado por la banda moderadora/trabécula septo marginal, provocan un movimiento similar a un fuelle (30% del efecto contráctil). Se evalúa con eco strain y con eco M y Doppler tisular desde vista subcostal.
3- El desplazamiento del anillo tricúspideo desde la base al ápex (TAPSE). Se mide en vista apical 4 cámaras con modo M a nivel del anillo lateral tricúspideo. Está provocado por la contracción de las fibras longitudinales del VD (suben- docárdicas), están generan el 75% del efecto contráctil del VD.
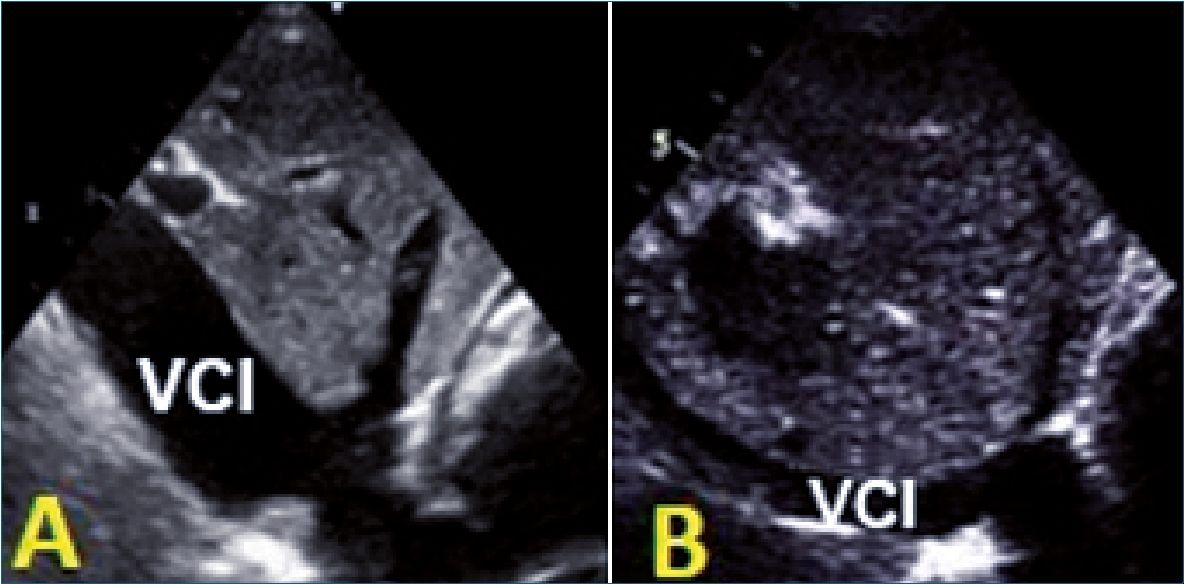
Figura A. VCI dilatada sin colapso; B: VCI pequeña con colapso. ¿Hipervolemia/Disfunción VD?; ¿Hipovolemia/Compresión?
En la arquitectura miofibrilar del VD, el predominio de las fibras longitudinales genera una contracción secuencial tipo peristáltica con efecto de torsión, desde la porción de entrada, se continúa en la porción trabecular y finalmente la vía de salida. El Doppler tisular y eco strain global y de la pared libre del VD son más sensibles que el TAPSE en la evaluación de la función de VD[27],[28].
Es conocido que contractilidad no es sinónimo de “Función Cardíaca”, también intervienen la poscarga del VD (presión pulmonar), la interdependencia ventricular (efecto de Bernheim inverso), y acoplamiento ventrículo-arterial (relación elastancia ventricular-elastancia arterial[27],[28].
Evaluación ecográfica
La evaluación ecográfica del VD con enfoque POCUS realizada por médicos no cardiólogos, comprende la impresión visual (tamaño de VD y relación con VI: interdependencia ventricular), evaluación de las fibras longitudinales (TAPSE) y onda S en TDI. No se evalúa en POCUS la fracción de acortamiento circunferencial, el índice de performance cardíaca, eco strain y la estimación de la presión de arteria pulmonar y del acoplamiento ventrículo-arterial.
A- Excursión sistólica del anillo tricuspideo-tapse
(Tricuspid Annular Plane Systolic Excursion): se obtiene con modo M.
Adultos. VN: 15-17 mm.
Niños: 0-30 días: 10,5 ± 6,6; 1-3 meses: 12,9 ± 9,2[1],[2],[9].
Se mide en modo M y representa la distancia que se desplaza el anillo lateral tricúspideo hacia el ápex, desde el final de la diástole hasta el final de la sístole. Se utiliza la vista apical de 4 cámaras, a nivel de la pared libre del ventrículo derecho. Se debe alinear el cursor con la excursión longitudinal del VD[24]- [28].
Ventajas: es una medición sencilla, tiene valor pronóstico. Tiene buena correlación con la fracción de eyección.
Limitaciones: refleja solamente la función, longitudinal, no tiene en cuenta en la medición al tabique interventricular y el tracto de salida del VD.
También influye el ángulo de medición y las condiciones de carga del VD.
No es de valor en pacientes postquirúrgicos cardiovasculares porque la apertura y pericárdica alteran la función del ci-
toesqueleto cardíaco[24],[28].
En pacientes adultos sus valores fueron correlacionados con las cifras de la fracción de eyección:
En pediatría. Utilizar Z score[29].
Nota: en pacientes con ventanas ecográficas de dificil acceso (postquirúrgicos, obesos, patología pulmonar, asistencia respiratoria mecánica), se puede obtener las variantes del TAPSE desde vista subcostal: s-TAPSE), En adultos existe buena correlación con TAPSE: S 97,8% y E: 87,5%.
La variante SEATAK (subcostal echocardiographic assessment of tricuspid anular Kick). Un valor de corte de 16 mm predice una función normal del VD: sensibilidad: 86% y especificidad: 67%.
B- Doppler pulsado tisular (DTI)
Evalúa la velocidad máxima de la onda sistòlica (S’) producto del movimiento de las fibras miocárdicas longitudinales que van desde el anillo tricúspideo lateral hasta el ápex. Es importante alinear el segmento basal y el anillo tricúspideo con:
Onda S: En adulto los valores normales son nivel septal > 8 cm/segundos, a nivel lateral > 10 cm/segundos. En recién nacidos utilizando el Z score la onda S tiene un valor de: 8 ± 2,7) cm/segundos.
Onda e’: es la primera onda negativa y refleja el llenado ventricular rápido, con valores de: 9,6 ± 2,4 cm/segundos, la onda a’: corresponde a la contracción auricular con valores de 6,9 ± 1,2 segundos[24]-[28].
-
4- Equality
La medición del VD por ecocardiografía, es muy dificultosa debido a su forma geométrica (trapezoidal). La relación super- ficie/volumen del VD es elevada sin embargo, una pared libre pequeña con su movimiento hacia adentro eyecta el mismo volumen sistólico que el VI. La posición del tabique interventricular (TIV) es crucial para la función del VD, si es intermedia (tipo 1), sugiere presión de VD normal, mientras que un aplanamiento (Tipo 2) o abombamiento hacia la izquierda (tipo 3), sugieren una incremento de la presión sistólica del VD entre 50% a 100% en relación a la presión arterial sistémica. Se recomienda inicialmente realizar una evaluación visual de su tamaño, en adultos la relación VD/VI es < 0,66[27],[28].
Dilatación leve si es de 0,7-1, moderada de 1-1,5 y severa > 1,5.
En recién nacidos el VD > VI hasta el mes de vida aproximadamente.
Con el enfoque “POCUS” se, utiliza una rápida secuencia cuali-cuantitativa para ubicarse en el contexto clínico del paciente. El esquema mental es el siguiente:
¿El ventrículo derecho se encuentra dilatado y el ventrículo izquierdo disminuido? SI. EQUALITY.
¿El ventrículo izquierdo tiene forma de D en eje corto esternal? SI.
Sugiere hipertensión pulmonar. Estimar la misma con análisis de la insuficiencia tricúspidea en vista apical de 4 cámaras.
-
5- Entrance
Se considera a la vena cava inferior como una extensión fisiológica de la aurícula derecha. Se desarrollará el tema en la
segunda 2 parte de Ecodinamia (las 5 “P”), en forma conjunta a la presión de la aurícula derecha y al score VExUS[27].
¿Cómo se observa la vena cava inferior? ¿y la aurícula derecha?
Agradecimiento: las imágenes ecográficas fueron obtenidas por los autores del trabajo en su práctica diaria. La edición de las figuras, gráficas y tablas fueron elaboradas por el Sr. Alfredo Benito. Editorial RECFOT.
-
Referencias
1. Ranjit S, Kissoon N, Argent A, Inwald D, Ventura AM, Jaborinsky R, et al. Haemodynamic support for paediatric septic shock: a global perspective. Lancet Child Adolesc Health. 2023 Aug;7(8):588–98. https://doi.org/10.1016/S2352-4642(23)00103-7 PMID:37354910
2. Nikravan S, Song P, Bughrara N, Díaz-Gómez JL. Focused ultrasonography for septic shock resuscitation. Curr Opin Crit Care. 2020 Jun;26(3):296–302. https://doi.org/10.1097/MCC.0000000000000730 PMID:32332287
3. Blanco P, Aguiar FM, Blaivas M. Rapid Ultrasound in Shock (RUSH) Velocity-Time Integral: A Proposal to Expand the RUSH Protocol. J Ultrasound Med. 2015 Sep;34(9):1691–700. https://doi.org/10.7863/ultra.15.14.08059 PMID:26283755
4. Lichtenstein DA, Mauriat P. Lung Ultrasound in the Critically Ill Neonate. Curr Pediatr Rev. 2012 Aug;8(3):217–23. https://doi.org/10.2174/157339612802139389 PMID:23255876
5. Argaiz E, et al. Comprehensive Assessment of Fluid Status by Point of Care Ultrasonography 2021; Kidney 360. Doi 0006482020 https://doi.org/10.34067/KID.0006482020.
6. Lopez L, Saurers DL, Barker PC, Cohen MS, Colan SD, Dwyer J, et al. Guidelines for Performing a Comprehensive Pediatric Transthoracic Echocardiogram: Recommendations From the American Society of Echocardiography. J Am Soc Echocardiogr. 2024 Feb;37(2):119–70. https://doi.org/10.1016/j.echo.2023.11.015 PMID:38309834
7. McNamara PJ, Jain A, El-Khuffash A, Giesinger R, Weisz D, Freud L, et al. Guidelines and Recommendations for Targeted Neonatal Echocardiography and Cardiac Point-of-Care Ultrasound in the Neonatal Intensive Care Unit: An Update from the American Society of Echocardiography [SECIP]. J Am Soc Echocardiogr. 2024 Feb;37(2):171–215. https://doi.org/10.1016/j.echo.2023.11.016 PMID:38309835
8. Singh Y, Tissot C, Fraga MV, Yousef N, Cortes RG, Lopez J, et al. international evidence-based guidelines on Point of Care Ultrasound (POCUS) for critically ill neonates and children issued by the POCUS Working Group of the European Society of Pediatrics and Neonatal Intensive Care (ESPNIC). Crit Care. 2020;24(1):1–16. https://doi.org/10.1186/s13054-020-2787-9.
9. Ramos Casado MV, Granados Ruiz MA, Menendez Suso JJ. Ecografía functional en el paciente pediátrico crítico. Grupo de Trabajo de Ecografía. Sociedad Española de Cuidados Intensivos Pediátricos. Año; 2022.
10. Mercadal J, Borrat X, Hernández A, Denault A, Beaubien-Souligny W, González-Delgado D, et al.; Spanish Critical Care Ultrasound Network Group. A simple algorithm for differential diagnosis in hemodynamic shock based on left ventricle outflow tract velocity-time integral measurement: a case series. Ultrasound J. 2022 Aug;14(1):36. https://doi.org/10.1186/s13089-022-00286-2 PMID:36001157
11. Koratala A, Kazory A. Point of Care Ultrasonography for Objective Assessment of Heart Failure: Integration of Cardiac, Vascular, and Extravascular Determinants of Volume Status. Cardiorenal Med. 2021;11(1):5–17. https://doi.org/10.1159/000510732 PMID:33477143
12. Blanco P. Rationale for using the velocity-time-integral and the minute distance for assessing the stoke volume and cardiac output in point-of-care settings. Ultrasound J. 2020;•••:12–21.
13. Díaz A, Zócalo Y, Cabrera-Fischer E, Bia D. Reference intervals and percentile curve for left ventricular outflow tract (LVOT), velocity time integral (VTI), and LVOT-VTI-derived hemodynamic parameters in healthy children and adolescents: analysis of echocardiographic methods association and agreement. Echocardiography. 2018 Dec;35(12):2014–34. https://doi.org/10.1111/echo.14176 PMID:30376592
14. Soliman-Aboumarie H, Pastore MC, Galiatson E, et al. Echocardiography in the intensive care unit: an essential tool for diagnosis, monitoring and guiding clinical decision-making. https://orcid.org/0000-0002-3254-6820 https://doi.org/10.1556/1647.2021.00055.
15. Rahde BischotA; Bhombai S, Altman C, et al. Targeted Neonatal Echocardiography in Patients With Hemodynamic Inestability. Pediatrics 2022; 150 Suppl S1-S17.
16. Zhou L, Wiley BM. Current and Future Role of Ultrasonography in the Cardiac Intensive Care Unit. Crit Care Clin. 2024 Jan;40(1):15–35. https://doi.org/10.1016/j.ccc.2023.06.001 PMID:37973351
17. Chew MS, Aissaoui N, Balik M. Echocardiography in shock. Curr Opin Crit Care. 2023 Jun;29(3):252–8. https://doi.org/10.1097/MCC.0000000000001041 PMID:37078626
18. Kameda T, Kimura A. Basic point-of-care ultrasound framework based on the airway, breathing, and circulation approach for the initial management of shock and dyspnea. Acute Med Surg. 2020 Jan;7(1):e481. https://doi.org/10.1002/ams2.481 PMID:31988793
19. Banille E (Cardiopul M, editor). Ecografia Pulmonar. Cap 4 en: Banille E.
20. Vásquez Martínez JL, Cazzaniga M. Ecocardiograma en el paciente crítico. [aut. libro] E Banille. en Cardiointensivismo Pediátrico II. Una Mirada Ampliada. RECFOT, 2015.
21. Banille E. Ecografía más allá del Corazón. Cap 5 en: Banille E. Ed. Monitoreo Cardiopulmonar Pediátrico. De la Teoría a la Práctica. Edit.RECFOT. Año 2019
22. Echocardiographic Evaluation of Pericardial Effusion and Cardiac Tamponade. Perez-Casares A, Cesar S, Brunet-Garcia L. Sanchez de Toleda J. From Pediatr. 2017;5:79.
24. Tavazzi G, Corradi F, Vandenbriele C and Alviar CL. Multimodality imaging in cardiogenic shock: state-of-the-art. Curr Opin Crit Care 2023;29:000-000 https://doi.org/10.1097/MCC.0000000000001068.
25. Tavazzi G, Spiegel R, Rola P, et al. Multi-organ evaluation of Perfusion and Congestion Using Ultrasound in Patient with shock. Published by Oxford University. Press of the European Society of Cardiology. 2023
26. Banille E. Evaluación del ventrículo izquierdo. Cap 1. In: Banille E, editor. Monitoreo Cardiopulmonar Pediátrico. De la Teoría a la Práctica. Editorial RECFOT. Año. 2019.
27. Kostember M, et al. TAPSE. Z-score. J Am Soc Echocardiogr. 2009;6:715–9. PMID:19423286
28. Banille E. Evaluación del ventrículo derecho. Cap 2 en: Banille E. Ed. Monitoreo Cardiopulmonar Pediátrico. De la Teoría a la Práctica. Editorial. RECFOT. Año 2019 VD
29. Martini S, Corsini I, Corvaglia L, Suryawanshi P, Chan B, Singh Y. A scoping review of echocardiographic and lung ultrasound biomarkers of bronchopulmonary dysplasia in preterm infants. Front Pediatr. 2023 Feb;11:1067323. https://doi.org/10.3389/fped.2023.1067323 PMID:36846161

 ORCID
ORCID