Manuel Alberto Guerrero Gutiérrez MD.1, Antonio de Jesús Granados Martínez MD.2, Diego Escarramán Martínez MD, MSc.3, Gerardo Alberto Solís Pérez4, Jorge Manuel Antolinez Motta5, Marissa Minutti Palacios MD.6
Recibido: 02-10-2024
Aceptado: 16-10-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 6 pp. 545-548|https://doi.org/10.25237/revchilanestv53n6-02
PDF|ePub|RIS
Reply to mechanical ventilation in the perioperative obese patient: Evaluation of current paradigms and proposals for new hypotheses
Hemos leído con gran interés la carta de Roberto González[1], que sin duda presenta argumentos dignos de consideración. No obstante, nos gustaría aprovechar la oportunidad para aclarar algunos puntos relevantes.
-
Frecuencia respiratoria
Establecer una frecuencia respiratoria (FR) en el límite superior del rango normal, ajustada al índice de masa corporal (IMC), tiene una sólida justificación fisiológica, la cual detallamos a continuación. A medida que el peso corporal aumenta, la oxigenación celular disminuye, lo que inevitablemente conlleva a un incremento en el consumo de oxígeno (aproximadamente 1,5 veces mayor) y, en consecuencia, a un aumento en el trabajo ventilatorio. Este fenómeno se traduce en una mayor producción de dióxido de carbono[2],[3]. Además, es importante considerar el componente restrictivo provocado por el aumento de la presión intraabdominal debido al depósito excesivo de tejido graso, el cual desplaza el diafragma en sentido cefálico, disminuyendo el volumen tidal (Vt) y provocando un aumento compensatorio de la FR[3].
Por otro lado, aunque realizar ajustes basados en la medición del dióxido de carbono al final de la espiración (EtCO2) es una estrategia adecuada, limitarse únicamente a modificar la FR sería un error. La programación inicial de la ventilación debe basarse en la somatometría del paciente, tomando como punto de partida el volumen minuto (Vm) necesario. En pacientes con obesidad, cuando sea necesario reajustar tanto el Vt como la FR, esta última debe ser el primer parámetro a adaptar para alcanzar el Vm esperado. Sin embargo, este enfoque no es aplicable de manera universal a otras poblaciones[2].
Modos ventilatorios: Limitado por flujo, ciclado por volumen o limitado por presión, ciclado por tiempo inspiratorio
Un abordaje tradicional ha sido la programación de un volumen tidal (Vt) elevado, lo que resulta en presiones pico y de meseta incrementadas, sin un aumento significativo en la curva de saturación de hemoglobina. Este enfoque puede generar estrés excesivo en las regiones pulmonares no dependientes, favoreciendo la aparición de volutrauma. En contraste, la venti-
lación limitada por presión, ofrece un flujo decreciente con una aceleración inicial rápida, lo que permite una apertura alveolar máxima en un corto período de tiempo, mejorando la redistribución de la presión. Esto contribuye a una optimización del cociente ventilación/perfusión (V/Q) y reduce el riesgo tanto de volutrauma como de barotrauma, siendo el modo de elección en pacientes sin patología pulmonar preexistente[4].
En relación al metaanálisis citado por González et al., es importante destacar que fue realizado hace más de una década. En él, se incluyen tres diagramas de Forest-Plots que comparan modos de ventilación controlados por presión y volumen en términos de metas intraoperatorias, como la relación PaO2/ FiO2 (con un I2 del 83%), el impacto del Vt y la influencia de la presión media de la vía aérea. No obstante, estos parámetros intraoperatorios pueden verse afectados por la correcta o incorrecta programación del ventilador. Es cierto que en el pasado la elección del modo ventilatorio estaba influenciada por la experiencia clínica del operador, pero en la actualidad se debe seleccionar el modo que mejor se adapte a las necesidades específicas del paciente.
Dado que el contexto de este análisis es perioperatorio, es relevante mencionar las guías de Young[5)], publicadas en 2019, que comparan los modos controlados por volumen y por presión en pacientes sometidos a cirugía. Aunque existe una ligera preferencia hacia el modo controlado por volumen, debido a la falta de evidencia concluyente, las guías sugieren utilizar el modo que minimice el daño pulmonar y mantenga las metas de presión pulmonar dentro de rangos aceptables.
Adicionalmente, es pertinente señalar que el artículo de Lorenzo Ball y Pelosi[6], hace referencia al estudio de Bagchi, el cual, a pesar de ser un estudio retrospectivo con una muestra considerable, mostró una menor incidencia de complicaciones pulmonares postoperatorias y una reducción en la elevación de la presión de distensión alveolar.
-
Titulación de la presión positiva al final de la espiración (PEEP) en pacientes con obesidad
En relación con el estudio LOV-ED, si bien se presentan argumentos sólidos, es importante destacar que, durante el perioperatorio, el comportamiento del pulmón puede verse afectado por diversas circunstancias, como la posición del paciente y la presencia de neumoperitoneo, lo que puede mimetizar un síndrome de distrés respiratorio agudo durante la cirugía (Acute Respiratory Distress During Surgery Syndrome) ARDSS por sus siglas en inglés. Este fenómeno es, particularmente, relevante en pacientes con obesidad, especialmente cuando la cirugía se realiza mediante técnicas laparoscópicas o robóticas y se imple- mentan cambios en la posición del paciente (como en la posición de Trendelenburg), lo que impacta en parámetros clave como la distensibilidad pulmonar, la presión de conducción (driving pressure), la presión meseta y el índice PaO2/FiO2.
Tal como hemos expuesto en nuestra investigación pre- via[7], existe evidencia de que los pacientes obesos a menudo presentan atelectasias preexistentes al llegar al quirófano, lo que constituye un factor relevante a considerar. Este hecho refuerza la importancia de tomar en cuenta el índice de masa corporal (IMC) en la titulación de la PEEP, como lo demostraron Erland et al., en 2024[8], donde establecieron un PEEP inicial basado en el IMC de los pacientes con obesidad. En este con
texto, fijar un PEEP inicial basado en el IMC es aceptado como un punto de partida razonable, no obstante la determinación del valor final de la PEEP dependerá de factores adicionales, tales como los efectos sobre la interacción entre el corazón y los pulmones, así como del contexto clínico específico del pacien- te[9].
Encontrar la presión positiva al final de la espiración (PEEP) adecuada en cualquier paciente representa un desafío clínico considerable. Si bien el método más exacto para determinar el PEEP, ideal es la tomografía por impedancia eléctrica, su uso en quirófano es limitado debido a la falta de disponibilidad de esta tecnología en el contexto perioperatorio. Por este motivo, se emplean métodos más accesibles, que no requieren equipo adicional para realizar la titulación de manera adecuada. Las recomendaciones más recientes sugieren llevar a cabo este proceso mediante la evaluación de la compliance pulmonar o la presión de conducción (driving pressure), sin necesidad de realizar maniobras de reclutamiento alveolar[10]. En este contexto, consideramos apropiado sugerir dichas maniobras sólo en casos de hipoxemia refractaria, ya que la evidencia disponible no respalda de manera consistente un beneficio significativo asociado a su aplicación. De hecho, un metaanálisis reciente sugiere que la titulación de la PEEP a valores superiores a 10 cmH2O, sin realizar maniobras de reclutamiento, podría reducir las complicaciones pulmonares posoperatorias en comparación con niveles de PEEP de 8-10 cmH2O o con PEEP 0 (ZEEP)[11].
-
Conclusiones y generación de hipótesis
La ventilación mecánica en el contexto intraoperatorio y perioperatorio en pacientes sin síndrome de distrés respiratorio agudo (SDRA), presenta desafíos significativos. Durante el intraoperatorio, el pulmón, incluso sin cumplir con todos los criterios del SDRA, puede exhibir un comportamiento similar, lo que nos lleva a proponer la existencia de una nueva entidad clínica: el “Síndrome de Distrés Respiratorio Agudo Durante la Cirugía” (Acute Respiratory Distress During Surgery Syndrome, ARDSS). Esta entidad se caracteriza por tres etapas distintas (Tabla 1):
1. Fase preoperatoria: Antes de cualquier cambio de posición o la instauración del neumoperitoneo, el pulmón debe mantenerse en metas de protección pulmonar para preservar su funcionalidad.
2. Fase intraoperatoria: Con la colocación del paciente en la posición quirúrgica requerida y la insuflación del neumo- peritoneo, se observa un aumento en las presiones pulmonares y una disminución en la compliance pulmonar. Esta situación simula un SDRA sin cumplir todos los criterios diagnósticos convencionales, ya que no se desarrollan nuevos infiltrados pulmonares y la relación SaFiO2 o PaO2/FiO2 puede no estar alterada de manera significativa.
3. Fase posoperatoria: Al finalizar el acto quirúrgico, con el retorno del paciente a la posición habitual y el cese del neumoperitoneo, se espera que las presiones pulmonares regresen a sus valores basales o incluso mejoren, siempre que se haya implementado una estrategia de ventilación mecánica protectora adecuada. Es importante recordar que hasta 30% de los pacientes obesos ingresan al quirófano con atelectasias preexistentes, lo que debe considerarse al planificar la ventilación mecánica.
Tabla 1. Consideraciones del comportamiento pulmonar durante la cirugía o Síndrome de Distress Respiratorio Agudo durante la Cirugía (Acute Respiratory Distress During Surgery Syndrome) o ARDDSS
| Etapa | Descripción | Características clave |
| 1. Prequirúrgico | Estado previo a la colocación en posición quirúrgica y a la insuflación del neumoperitoneo | – Presiones pulmonares normales
– Compliance pulmonar dentro de los valores normales – Saturación de oxígeno (SpO2) normal |
| 2. Transanestésico | Se produce cuando el paciente está en posición quirúrgica y con neumoperitoneo insuflado | – Elevación de las presiones pulmonares
– Disminución drástica de la compliance pulmonar – SpO2 puede disminuir o mantenerse |
| 3. Postquirúrgico | Ocurre tras la retirada de la posición quirúrgica y la desinsuflación del neumoperitoneo | – Retorno de las presiones pulmonares a niveles normales – Recuperación de la compliance pulmonar a valores normales – SpO2 normal |
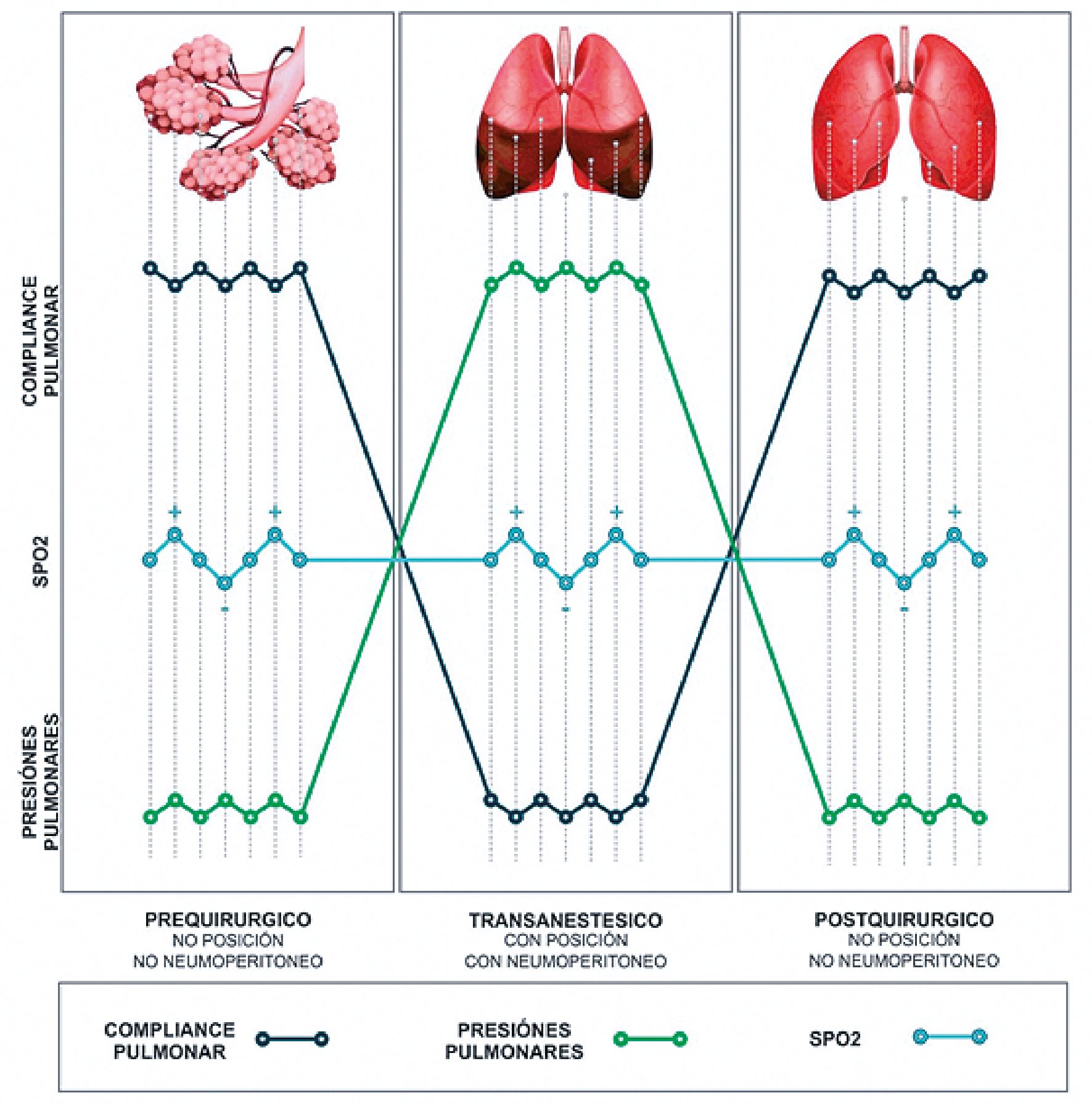
Figura 1. Síndrome de Distrés Respiratorio Agudo Durante la Cirugía (ARDSS) y sus comportamiento durante la cirugía.
Hipótesis a explorar: La propuesta del ARDSS como una entidad diferenciada del SDRA convencional en el contexto perioperatorio plantea varias interrogantes e hipótesis de investigación:
1. Impacto del ARDSS en la morbilidad y mortalidad posoperatoria: Evaluar si la aparición de ARDSS durante la cirugía contribuye a un mayor riesgo de complicaciones pulmonares posoperatorias en comparación con aquellos pacientes que no desarrollan este síndrome.
2. Estrategias ventilatorias óptimas para la prevención del ARDSS: Investigar si las estrategias de ventilación protectora, ajustadas según el IMC y la fisiología individual del paciente, son eficaces para prevenir la aparición de ARDSS en pacientes sometidos a procedimientos quirúrgicos que implican cambios en la posición y neumoperitoneo.
3. Rol de la PEEP personalizada en la prevención del ARDSS: Determinar si la titulación de la presión positiva al final de la espiración (PEEP), basada en características individuales, como el IMC y la función pulmonar basal, puede reducir la incidencia y severidad del ARDSS.
4. Biomarcadores de estrés pulmonar en ARDSS: Explorar el uso de biomarcadores de estrés pulmonar y daño alveolar como herramientas predictivas para identificar pacientes en riesgo de desarrollar ARDSS, lo que permitiría una intervención temprana y más efectiva.
Este Síndrome de Distrés Respiratorio Agudo Durante la Cirugía (ARDSS) debe abordarse con las mismas estrategias terapéuticas que el síndrome de distrés respiratorio agudo (SDRA), aplicando ventilación mecánica protectora basada en la mejor evidencia disponible. La comprensión profunda del comportamiento pulmonar ante los cambios derivados del procedimiento quirúrgico es fundamental para optimizar el manejo ventilato- rio y reducir el riesgo de complicaciones posoperatorias. Por ello, es crucial conocer cómo responden los pulmones a estos cambios intraoperatorios (Figura 1).
En conclusión, el comportamiento pulmonar durante la cirugía, especialmente en pacientes con obesidad y en aquellos sometidos a procedimientos laparoscópicos o robóticos, sugiere la existencia de un síndrome específico que debe ser abordado mediante estrategias de ventilación personalizadas. Esta hipótesis abre la puerta a futuras investigaciones que permitan validar la existencia del ARDSS y optimizar las intervenciones ventilatorias en este contexto.
-
Referencias
1. González R, Saldaña Á. Ventilación mecánica en paciente con obesidad. Revista Chilena de Anestesia [Internet]. 2024;53(5):450–1. https://doi.org/10.25237/revchilanestv53n5-03.
2. Sánchez SJ, Alvarado EA, Cárdenas HJ, Solís ED. Monitorización de la ventilación mecánica en el enfermo obeso: una tarea de peso. Med Crit. 2023;37(4):348–55. https://doi.org/10.35366/112170.
3. De Jong A, Chanques G, Jaber S. Mechanical ventilation in obese ICU patients: from intubation to extubation. Crit Care. 2017 Mar;21(1):63. https://doi.org/10.1186/s13054-017-1641-1 PMID:28320439
4. Gupta SD, Kundu SB, Ghose T, Maji S, Mitra K, Mukherjee M, et al. A comparison between volume-controlled ventilation and pressure-controlled ventilation in providing better oxygenation in obese patients undergoing laparoscopic cholecystectomy. Indian J Anaesth. 2012 May;56(3):276–82. https://doi.org/10.4103/0019-5049.98777 PMID:22923828
5. Young CC, Harris EM, Vacchiano C, Bodnar S, Bukowy B, Elliott RR, et al. Lung-protective ventilation for the surgical patient: international expert panel-based consensus recommendations. Br J Anaesth. 2019 Dec;123(6):898–913. https://doi.org/10.1016/j.bja.2019.08.017 PMID:31587835
6. Ball L, Pelosi P. How I ventilate an obese patient. Crit Care. 2019 May;23(1):176. https://doi.org/10.1186/s13054-019-2466-x PMID:31097006
7. Mancilla-Galindo J, Ortiz-Gomez JE, Pérez-Nieto OR, De Jong A, Escarramán-Martínez D, Kammar-García A, et al. Preoperative Atelectasis in Patients with Obesity Undergoing Bariatric Surgery: A Cross-Sectional Study. Anesth Analg. 2024 Aug;•••: https://doi.org/10.1213/ANE.0000000000007166 PMID:39178161
8. Östberg E, Larsson A, Wagner P, Eriksson S, Edmark L. Positive end-expiratory pressure and emergence preoxygenation after bariatric surgery: A randomised controlled trial on postoperative oxygenation. Eur J Anaesthesiol. 2024 Sep;•••: https://doi.org/10.1097/EJA.0000000000002071; Epub ahead of print. PMID:39325031
9. Millington SJ, Cardinal P, Brochard L. Setting and Titrating Positive End-Expiratory Pressure. Chest. 2022 Jun;161(6):1566–75. https://doi.org/10.1016/j.chest.2022.01.052 PMID:35131298
10. Menga LS, Subirà C, Wong A, Sousa M, Brochard LJ. Setting positive end-expiratory pressure: does the ‘best compliance’ concept really work? Curr Opin Crit Care. 2024 Feb;30(1):20–7. https://doi.org/10.1097/MCC.0000000000001121 PMID:38085857
11. Chen C, Shang P, Yao Y; Evidence in Cardiovascular Anesthesia (EICA) Group. Positive end-expiratory pressure and postoperative pulmonary complications in laparoscopic bariatric surgery: systematic review and meta-analysis. BMC Anesthesiol. 2024 Aug;24(1):282. https://doi.org/10.1186/s12871-024-02658-8 PMID:39123102

 ORCID
ORCID