Fernando Peralta-Echeverría1, Víctor Fuentes Figueroa1, Fernando Tirapegui Sanhueza2,*, Boris Fuentealba Contreras1, Igor Cigarroa3
Recibido: 14-04-2024
Aceptado: 20-05-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 1 pp. 82-90|https://doi.org/10.25237/revchilanestv54n1-10
PDF|ePub|RIS
Abstract
Objectives: a) Compare ventilatory mechanics and blood gas parameters based on the inspiratory recruitability index (R/I) and b) To associate segmental lung severity and the R/I index in patients with COVID-19 respiratory distress syndrome(C-ARDS). Patients and Methods: Analytical, cross-sectional study with non-probabilistic sampling developed in a Critical Patient Unit (ICU) of a Care Forty-two patients with C-ARDS admitted to the ICU were dichotomized based on alveolar recruitment potential (ARP); in the high PRA (R/I Index > 0.35; PRA-A) and the low PRA (R/I Index < 0.35; PRA-B), segmental pulmonary severity was determined with chest computed tomography and subsequent to an alveolar recruitment maneuver, ventilatory mechanics parameters were evaluated and arterial blood gases. Results: Patients in the PRA-A group have greater expired tidal volume (541.4 (491.5-591.3); p < 0.001), higher PEEP (12 (12-14) vs 10 (8-12); p = 0.010), lower distension pressure (7 (6-9) vs 8 (8-11); p = 0.018), higher PaO2/FiO2 (226 (201-267) vs 195 (169-230); p = 0.024) compared to the PRA-B group. Furthermore, less pulmonary severity was observed in the PRA-A group in the anterior segment (Right lung, p = 0.002; V = 0.534; Left lung, p = 0.004; V = 0.511) and apical segment (Right lung, p < 0.001; V = 0,6,18; Left lung, p = 0.004; V = 0.511) compared to the PRA-B group. Conclusions: Patients with C-ARDS in the ICU with a low PRA had lower ventilatory mechanics, blood gas parameters and greater lung severity compared to those with a high PRA. PRA could be used to identify patients who benefit from alveolar recruitment strategies to promote their lung protection.
Resumen
Objetivos: a) Comparar los parámetros de mecánica ventilatoria y gasométricos en función del índice de reclutabilidad inspiratoria (R/I) y b) Asociar la severidad pulmonar segmentaria y el índice R/I en pacientes con Síndrome Distrés Respiratorio por COVID-19 (C-ARDS). Pacientes y Métodos: Estudio analítico, de corte transversal con un muestreo no probabilístico desarrollado en una Unidad de Paciente Crítico (UCI) de un Complejo Asistencial en Chile. Cuarenta y dos pacientes con C-ARDS ingresados a UCI se dicotomizaron en función del potencial de reclutamiento alveolar (PRA); en el PRA alto (Índice R/I > 0,35; PRA-A) y el PRA bajo (Índice R/I < 0,35; PRA-B), se determinó la severidad pulmonar segmentaria con tomografía computarizada de tórax y posterior a una maniobra de reclutamiento alveolar, se evaluaron parámetros de mecánica ventilatoria y gasometría arterial. Resultados: Los pacientes del grupo PRA-A presentan mayor volumen tidal espirado (541,4 (491,5-591,3); p < 0,001), mayor PEEP (12 (12-14) vs 10 (8-12); p = 0,010), menor presión distensión (7 (6-9) vs 8 (8-11); p = 0,018), una mayor PaO2/FiO2 (226 (201-267) vs 195 (169-230); p = 0,024) en comparación con el grupo PRA-B. Además, se observó en el grupo PRA-A una menor severidad pulmonar en el segmento anterior (Pulmón derecho, p = 0,002; V = 0,534; Pulmón izquierdo, p = 0,004; V = 0,511) y apical (Pulmón derecho, p < 0,001; V = 0,6,18; Pulmón izquierdo, p = 0,004; V = 0,511) en comparación con el grupo PRA-B. Conclusiones: Los pacientes con C-ARDS en UCI con un PRA bajo presentaron una menor mecánica ventilatoria, parámetros gasométricos y una mayor severidad pulmonar con respecto a quienes tenían un PRA alto. EL PRA podría ser utilizado para identificar a pacientes que se beneficien de estrategias de reclutamiento alveolar para favorecer su protección pulmonar.
-
Introducción
El coronavirus tipo 2 (COVID-19) produce una enfermedad asintomática o leve y en menores circunstancias enfermedad grave[1],[2], necesitando hospitalización en unidad de cuidados intensivos (UCI) y conexión temprana a ventilación mecánica invasiva (VMI) que varía en tiempo, siendo esta muchas veces prolongada[3] a causa del síndrome de distrés respiratorio agudo (SDRA) por COVID-19 (C-ARDS), shock séptico y falla multiorgánica[4], con niveles de mortalidad superiores a las de otras enfermedades respiratorias[5],[6].
El C-ARDS coincide con la definición de Berlin[7], presentando como características el daño alveolar difuso (DAD)[8], alta heterogeneidad de mecánica respiratoria, hipoxemia grave y variabilidad en el potencial de reclutamiento alveolar (PRA) [9]. Estudios recientes sugieren evaluar la mecánica respiratoria (MR) y PRA al lado de la cama del paciente, para optimizar y personalizar la programación del ventilador mecánico (VM) [9],[10]. Recientemente, PRA es definido como la relación entre la distensibilidad del pulmón reclutado y la distensibilidad de la fracción de parénquima pulmonar que con SDRA aún mantiene una inflación normal (baby lung)[11].
Desde la definición inicial del SDRA la presión positiva al final de la espiración (PEEP) se ha descrito como un componente esencial del tratamiento[12], asegurar su uso en el reclutamiento alveolar (RA), mientras se limita la hiperinflación pulmonar, continúa siendo un desafío[13],[14]. La PEEP difiere entre pacientes dependiendo de la cantidad de parénquima pulmonar no aireado y mal aireado, observado desde una To- mografía Computarizada de tórax (CTT); que pueda reabrirse o recuperarse[15],[16]. El no evaluar oportunamente el PRA y el aumento de la PEEP indiferenciado podría no ser beneficioso e incluso desfavorable generando mayor estrés y tensión a nivel en las regiones consolidadas y colapsadas, siendo el principal responsable del deterioro de la oxigenación e intercambio ga- seoso[15],[17],[18].
La CTT se ha determinado insustituible para describir y evaluar el PRA dada su contribución al conocimiento anatomofun- cional y fisiopatológico para establecer un modelo de referencia cuantitativo del PRA en los pacientes con SDRA[15],[19]; no obstante, su uso ha resultado controversial para poder establecer un método simple, seguro y de bajo costo que permita evaluar el PRA al lado de la cama del paciente en un entorno restringido[16],[20]. El interés por lograr obtener una evaluación del PRA ha aumentado; sin embargo, las técnicas para establecer un método optimo hasta hace poco eran complejas y limitadas[21],[22].
Recientemente, se ha descrito una nueva forma para objetivar la gravedad de C-ARDS, esta consiste en la evaluación de imágenes de tórax mediante el índice de severidad por CTT (CT-SS), permitiendo una evaluación en un ambiente limitado como el existente en la actual pandemia[23]. Esto se suma a un nuevo método cuantitativo que logra determinar el PRA basado en la mecánica ventilatoria llamado índice de reclutabilidad inspiratoria (índice R/I) el que consiste en la evaluación de la distensibilidad del pulmón reclutado y la del sistema respiratorio mediante una maniobra simplificada de respiración única sin necesidad de desconectar al paciente del VM[11].
La evaluación de estos nuevos métodos complementarios en función del índice R/I y su influencia en el posterior manejo clínico en relación con estrategias de ventilación protectora en SADR aún no están determinados. Se han propuesto dos objetivos: a) Comparar la mecánica ventilatoria (MV) y parámetros gasométricos en función del índice de reclutabilidad inspiratoria (índice R/I) y b) Asociar la severidad pulmonar segmentaria y el índice R/I en pacientes admitidos en UCI con C-ARDS.
-
Pacientes y Métodos
-
Diseño del estudio
El estudio tuvo un diseño observacional, analítico, de corte transversal. El estudio se adscribió a las directrices de Strengthening the Reporting of Observational studies in Epidemiology (STROBE) para publicación de estudios transversales. Mediante un muestreo no probabilístico por conveniencia, durante cuatro meses se evaluó la severidad pulmonar en función del PRA, así como también la mecánica ventilatoria posterior a una MRA y titulación de PEEP en pacientes con C ARDS al ingreso a UCI.
-
Centro donde se realizó la investigación y muestra
El estudio se realizó en la UCI de un complejo asistencial de Chile, entre los meses de mayo de 2021 a septiembre de 2021. Se evaluaron pacientes con C-ARDS al ingreso a la UCI (n = 55) que cumplieran los siguientes criterios de inclusión: a) edad mayor o igual a 18 años; b) test de detección de ácido nucleico (RT-PCR, reacción en cadena de la polimerasa con transcriptasa inversa) procesado en laboratorio de CAVRR con resultado positivo para COVID-19; c) CTT previo ingreso a UCI (sin vía aérea artificial ni conexión a VM) y d) indicación médica de MRA, previo evaluación del PRA por índice R/I. Se excluyeron a pacientes (n = 9) por: a) neumotórax no drenado o fuga de aire en curso; b) inestabilidad hemodinámica (norepinefrina mayor a 0,3 pg/kg/min, según directrices de protocolo de UCI del CAV- RR); c) presión de apertura de las vías respiratorias (AOP) mayor a 8 cmH2O[11]; d) enfermedad pulmonar obstructiva crónica (EPOC) grave clasificación de la Iniciativa Global mayor o igual a C[24]; e) antecedentes de asma grave no compensada; f) fibrosis pulmonar o quística y g) embarazo.
La muestra final fue de cuarenta y dos pacientes, los cuales fueron divididos en dos grupos de acuerdo con el valor del índice R/I (mediana 0,35); grupo con potencial de reclutamiento alveolar alto (PRA-A; n = 21) y grupo con potencial de reclutamiento alveolar bajo (PRA-B; n = 21). Esta forma de segmentar y analizar a los pacientes con C-ARDS ya ha sido utilizando en estudios previos[11],[25]. El proyecto fue aprobado por el Comité de Ética del Servicio de Salud Biobío aprobó el protocolo de estudio (número 135 – 2021), y todos los procedimientos se realizaron de acuerdo con la Declaración de Helsinki para la investigación médica en seres humanos siguiendo las normativas de la 64° asamblea general, Fortaleza, Brasil 2013.
-
Procedimientos
Una vez ingresados a UCI a todos los pacientes se les instaló un catéter venoso central (CVC) y línea arterial como parte de los procedimientos habituales, sedación según la escala de sedación-agitación (SAS) con meta de SAS 1, con dosificación de fentanilo, propofol y/o midazolam en función del peso del paciente de acuerdo a protocolo de UCI del CAVRR, más la administración de bolo de bloqueo neuromuscular (rocuronio 1,2 mg/Kg), además fueron conectados a VM (Servo I; Getinge AB, Göteborg, Suecia) en un modo asistido controlado por volumen control (AC/VC) con ventilación protectora ajustada por peso ideal a 6 ml/kg.
Luego de un control por radiografía de tórax portátil, estabilización y previo a fisioterapia torácica más permeabilización de vía aérea, se evaluó el PRA con el índice R/I. Para obtener el valor del índice de R/I es necesario determinar previamente la AOP, se modificaron parámetros iniciales en el VM en modo AC/VC como PEEP, frecuencia respiratoria (Fr), retardo y tiempo inspiratorios para la obtención de un flujo de 5 L/min, a continuación se realizó una pausa espiratoria sostenida entre 15 a 20 s, con necesidad de guardar curva de presión (P), flujo y volumen (V) en función del tiempo para identificar valor de AOP[26]. Conocida la AOP es necesario sumar 10 cmH2O (PEEP alta), modificar Fr, tiempo inspiratorio y tiempo de pausa inspi- ratoria para obtención de flujo entre 50 a 60 L/min. Se evaluó el volumen exhalado medido durante una caída abrupta de PEEP hasta el valor de AOP (PEEP baja), que está compuesto por el volumen corriente espirado (Vte) a una PEEP alta, y el volumen reclutado a PEEP baja, los valores resultantes se introdujeron en calculadora online para conocer el índice R/I[11].
Posteriormente, se realizó a una MRA escalonada en modo asistido controlado por presión control (AC/PC), con parámetros iniciales de PEEP entre 10 a 15 cmH2O, presión soporte (PS) de 15 cmH2O, con incrementos de PEEP en 5 cmH2O cada 2 min[27], maniobra limitada por inestabilidad hemodinámica sostenida refractaria a vasos activos y por presión meseta (Pplat) mayor o igual a 45 cmH2O[28]. En modo AC/VC se realizó la titulación de PEEP un valor inicial de 25 cmH2O decreciendo en 2 cmH2O cada 2 min, con un volumen corriente para 6 ml/kg[27].
Los valores del índice R/I y de mecánica ventilatoria se registraron las en una única planilla diseñada para el estudio por el equipo de investigadores, con experiencia en cuidados intensivos entre 5 y 10 años. Todas las mediciones se realizaron en decúbito supino, con la cabecera de la cama elevada a 30° en margen a los protocolos de la UCI del CAVRR. Ninguno de los pacientes fue excluido por presentar efectos adversos al desarrollar las evaluaciones.
-
Variables de interés y técnicas de medición utilizadas
Parámetros de mecánica ventilatoria
Estos parámetros corresponden PEEP, PEEP total, presión media de vía aérea (PVAm), presión máxima de vía aérea (PIP), Pplat, distensibilidad estática (Cst), elastancia (Est), volumen corriente (Vt), volumen minuto (Vmin), Fr, flujo. La Pplat se obtendrá al realizar una breve pausa inspiratoria en el VM, registrando el valor observado en el primer segundo. El PEEP total, la Cst y Est se medirán al realizar una pausa espiratoria en el VM, los demás parámetros mencionados se obtuvieron tras vi- sualización de VM. Además, mediante algoritmos matemáticos conocidos se evaluó presión de distensión (DP)[29], poder mecánica (MP)[30] e índice de ventilación (Vr)[31].
Parámetros gasométricos
Resultados de gasometría en sangre arterial (GSA) mediante dispositivo RAPIDPoint® 500, SIEMENS, obteniendo la presión parcial de dióxido de carbono (PaCO2), la presión parcial de oxígeno (PaO2), saturación de oxígeno (SatO2). A su vez del VM registramos la fracción inspirada de oxígeno (FiO2). Con los valores obtenidos se calculó la presión parcial de oxígeno a fracción inspirada de oxígeno (PaFiO2) y el índice de oxigenación (IOX) (Tabla 2).
Severidad pulmonar
Esta variable se midió a través del CT-SS, el que fue evaluado por Neumólogo intensivista, quien asignó un puntaje de acuerdo con la severidad de cada segmento pulmonar (0 sin afección, 1 menos del 50% y 2 más del 50%) obteniendo un puntaje total entre 0 y 40 puntos para los 20 segmentos pul- monares[23]. Esta valoración se realizó en ciego a los resultados previos del índice R/I y evaluación de mecánica ventilatoria.
Adicionalmente, las características sociodemográficas y clínicas de los pacientes se obtuvieron desde Sistema de Administración Clínica (SAC) Biobío y se registraron en una tabla electrónica especialmente creado para este estudio.
-
Análisis estadístico
Todos los análisis de datos se realizaron con el software R versión 4.1.0 (R Core Team, 2018). Se determinaron variables sociodemográficas y clínicas mediante estadística descriptiva básica sin cálculo previo del tamaño muestral. Se estimaron las medias (intervalo de confianza al 95%) y medianas (rango intercuartílico) para variables cuantitativas con distribuciones normales y no normales. Se utilizó la prueba de Shapiro-Wilk para analizar la normalidad de las distribuciones. Las pruebas adecuadas establecieron diferencias entre los grupos: prueba t (para variables paramétricas), prueba U de Mann-Whitney (para variables no paramétricas), la prueba de Chi-Cuadrado de Pear-
Tabla 1. Características sociodemográficas y clínicas

Abreviaturas: IMC: índice de masa corporal; índice R/I: índice de reclutabilidad inspiratoria; CT-SS: severidad pulmonar por tomografía computarizada de tórax; SDRA: síndrome de distrés respiratorio agudo; COVID-19: coronavirus tipo 2; TC: tomografía computarizada; PRA-B: grupo potencial de reclutamiento alveolar bajo; PRA-A: grupo potencial de reclutamiento alveolar alto. ◊ Variables con distribución normal presentadas como media y su IC al 95% con prueba t de Student para comparar PRA-B y PRA-A. Variables sin distribución normal presentadas como mediana y su RIQ con prueba U de Mann-Whitney para comparar PRA-B y PRA-A. Variables de naturaleza dicotómica presentadas en frecuencia absoluta y porcentaje con prueba de McNemar. El nivel de significancia utilizado fue p < 0,05.
son se utilizó para determinar la dependencia de las variables categóricas en función del PRA, contrastando la relación de las variables con la fuerza de asociación de Cramer’s V. La fuerza de asociación se caracterizó de la siguiente manera. 0 a 0,1: poca o ninguna asociación; 0,1 a 0,3: asociación baja; 0,3 a 0,5: asociación moderadamente fuerte; mayor a 0,5: asociación muy fuerte32. El nivel de significancia utilizado fue p < 0,05.
-
Resultados
Cuarenta y dos pacientes con C-ARDS cumplieron con los criterios de inclusión y subdivididos en dos grupos (PRA-A; n = 21 y PARA-B; n = 21). En la Tabla 1 se presentan sus principales características sociodemográficas y clínicas.
En la Tabla 2 se presentan los parámetros de mecánica ven- tilatoria. Se observó que los pacientes del grupo PRA-A presentan significativamente mayor Vte obtenido entre la diferencia de PEEP alto y PEEP bajo (376,0 (323,2-428,8) vs 541,4 (491,5-591,3); p = < 0,001). Posterior a una MRA más titulación de PEEP se observó que el grupo PRA-A y grupo PRA-B presentan diferencias significativas al comparar variables de PEEP (12 (1214) vs 10 (8-12); p = 0,010) PEEP total (14 (13-16) vs 13 (1114); p = 0,026), PVAm (16,3 (15,3-17,2) vs 13,9 (12,6-15,2); p = 0,024) y DP (7 (6-9) vs 8 (8-11); p = 0,018). No se evidenciaron en los demás parámetros de mecánica ventilatoria diferencias significativas (Tabla 2).
En la Tabla 3, se presentan los parámetros gasométricos evaluados. Se evidenció que los pacientes del grupo PRA-A tuvieron significativamente un mayor PaO2/FiO2 en comparación con el grupo PRA-B (226 (201-267) vs 195 (169-230); p = 0,024). Los demás parámetros gasométricos no se evidenciaron diferencias significativas (Tabla 3).
Al determinar la asociación entre el CTT-SS y el grupo de PRA se observó que existe menor severidad pulmonar en grupo PRA-A (Tabla 4), con significancia estadística en segmentos anteriores y apicales de ambos pulmones, con un tamaño de asociación Cramer’s V muy fuerte.
Tabla 2. Parámetros de mecánica ventilatoria
| Variables | Total (n = 42) media (95% IC) mediana (RIQ) | PRA-B (n = 21) media (95% IC) mediana (RIQ) | PRA-A (n = 21) media (95% IC) mediana (RIQ) | Prueba-T (◊) o Wilcoxon Valor P |
| AOP, cmH2O | 6(5-6) | 6 (5-7) | 5 (5-6) | ,064 |
| Dif Vte (Pa-Pb), ml ◊ | 458,7 (415,2-502,1) | 376,0 (323,2-428.,8) | 541,4 (491,5-591,3) | < ,001 |
| Vt6, ml | 380 (330-400) | 390 (330-400) | 370 (320-405) | ,631 |
| Fr, rpm | 28 (28-30) | 30 (28-30) | 28 (28-30) | ,191 |
| PEEP, cmH2O | 12 (10-14) | 10 (8-12) | 12 (12-14) | ,010 |
| PEEP total, cmH2O | 14 (12-16) | 13 (11-14) | 14 (13-16) | ,026 |
| P° máx, cmH2O ◊ | 27,2 (26,2-28,3) | 26,6 (25,1-28,1) | 27,9 (26,4-29,3) | ,229 |
| P° media, cmH2O ◊ | 15,1 (14,2-16,0) | 13,9 (12,6-15,2) | 16,3 (15,3-17,2) | ,004 |
| DP, cmH2O | 8(6-9) | 8 (8-11) | 7 (6-9) | ,018 |
| C st, ml/cmH2O ◊ | 49,3 (44,9-53,7) | 47,0 (40,0-54,0) | 51,6 (45,7-57,5) | ,298 |
| Elastancia, cmH2O | 22 (17-25) | 23 (17-26) | 20 (17-26) | ,427 |
| C din, ml/cmH2O | 27,2 (21-33) | 26,6 (22-30) | 27,9 (21-34) | ,580 |
| Flujo, L/min ◊ | 31,9 (30,5-33,3) | 32,2 (29,9-34,6) | 31,5 (29,7-33,3) | ,614 |
| MP ◊ | 25,0 (23,2-26,8) | 26,0 (23,0-29,0) | 24,0 (21,8-26,2) | ,262 |
| Vr ◊ | 4,1 (3,7-4,4) | 4,2 (3,7-4,8) | 3,9 (3,4-4,4) | ,370 |
Abreviaturas: AOP: presión de apertura de las vías respiratorias; PEEP: presión positiva al final de la espiración; Dif Vte (Pa-Pb): Diferencia de volumen espirado a PEEP alta y a PEEP baja; Vt6: volumen corriente para seis ml/kg (Peso ideal); Fr: frecuencia respiratoria; P°: máx, presión máxima; P°: media, presión media; DP: driving presión; C st: distensibilidad estática; C din: distensibilidad dinámica; MP: energía mecánica; Vr: índice de ventilación; PRA-B: grupo potencial de reclutamiento alveolar bajo; PRA-A: grupo potencial de reclutamiento alveolar alto; ◊: Variables con distribución normal presentadas como media y su IC al 95% con prueba t de Student. Variables sin distribución normal presentadas como mediana y su RIQ con prueba U de Mann-Whitney. El nivel de significancia utilizado fue p < 0,05.
Tabla 3. Parámetros gasométricos
| Variables | Total (n=42) media (95% IC) mediana (RIQ) | PRA-B (n = 21) media (95% IC) mediana (RIQ) | PRA-A (n = 21) media (95% IC) mediana (RIQ) | Prueba-T (◊) o Wilcoxon Valor P |
| FO | 0,45 (0,40-0,50) | 045 (0,40-0,54) | 0,48 (0,40-0,55) | ,401 |
| SatO2 | 96 (96-97) | 96 (96-97) | 96 (96-98) | ,597 |
| IOX, cmH2O/mmHg | 7,2 (5,6-8,7) | 7,2 (5,9-8,3) | 7,3 (5,4-9,1) | ,842 |
| PaO2/FiO2, mmHg ◊ | (175-240) | 195 (169-230) | 226 (201-267) | ,024 |
| PaCO2, mmHg ◊ | 44,7 (40,1-51,6) | 45,6 (41,5-52,5) | 43,5 (39,1-52,4) | ,529 |
Abreviaturas: FiO2: presión parcial de oxígeno a fracción inspirada de oxígeno; SatO2: oximetría de pulso; IOX: índice de oxigenación; PaO2 / FiO2: presión parcial de oxígeno a fracción inspirada de oxígeno; PaCO2: presión parcial de dióxido de carbono. ◊: Variables con distribución normal presentadas como media y su IC al 95% con prueba t de Student. Variables sin distribución normal presentadas como mediana y su RIQ con prueba U de Mann-Whitney. El nivel de significancia utilizado fue p < 0,05.
-
Discusión
-
Hallazgos relevantes del estudio
Los principales resultados de este estudio sugieren que el grupo PRA-A presenta mejores resultados en parámetros de mecánica ventilatoria y gasometría arterial en comparación con grupo PRA-B, independiente de las variables sociodemográficas y clínicas. Además, se observó una asociación muy fuerte entre la severidad pulmonar y el índice R/I en pacientes con C-ARDS
admitidos en UCI, con menor severidad pulmonar segmentaria en grupo PRA-A.
-
Relación con publicaciones similares
La mediana del índice R/I previo a una MRA con titulación de PEEP en pacientes con C-ARDS fue 0,35. Hubo significancia estadística al comparar los dos grupos en parámetros de mecánica ventilatoria y CT-SS. Este resultado difiere con las medianas del índice R/I de otros estudios (índice R/I = 0,50)11, (índice R/I = 0,73)33 y (índice R/I = 0,70)[25]. Estas diferencias podrían estar explicadas por el tiempo entre el inicio de los síntomas e ingreso a UCI y la severidad del C-ARDS, además existen variaciones antropométricas que justificaría un menor índice R/I, dado que la estatura promedio de los pacientes es menor en comparación a la observada en los estudios recién mencionados, reflejándose en el volumen pulmonar al final de una espiración en presencia de PEEP (EELV).
Tabla 4. Severidad pulmonar segmentaria entre los dos grupos
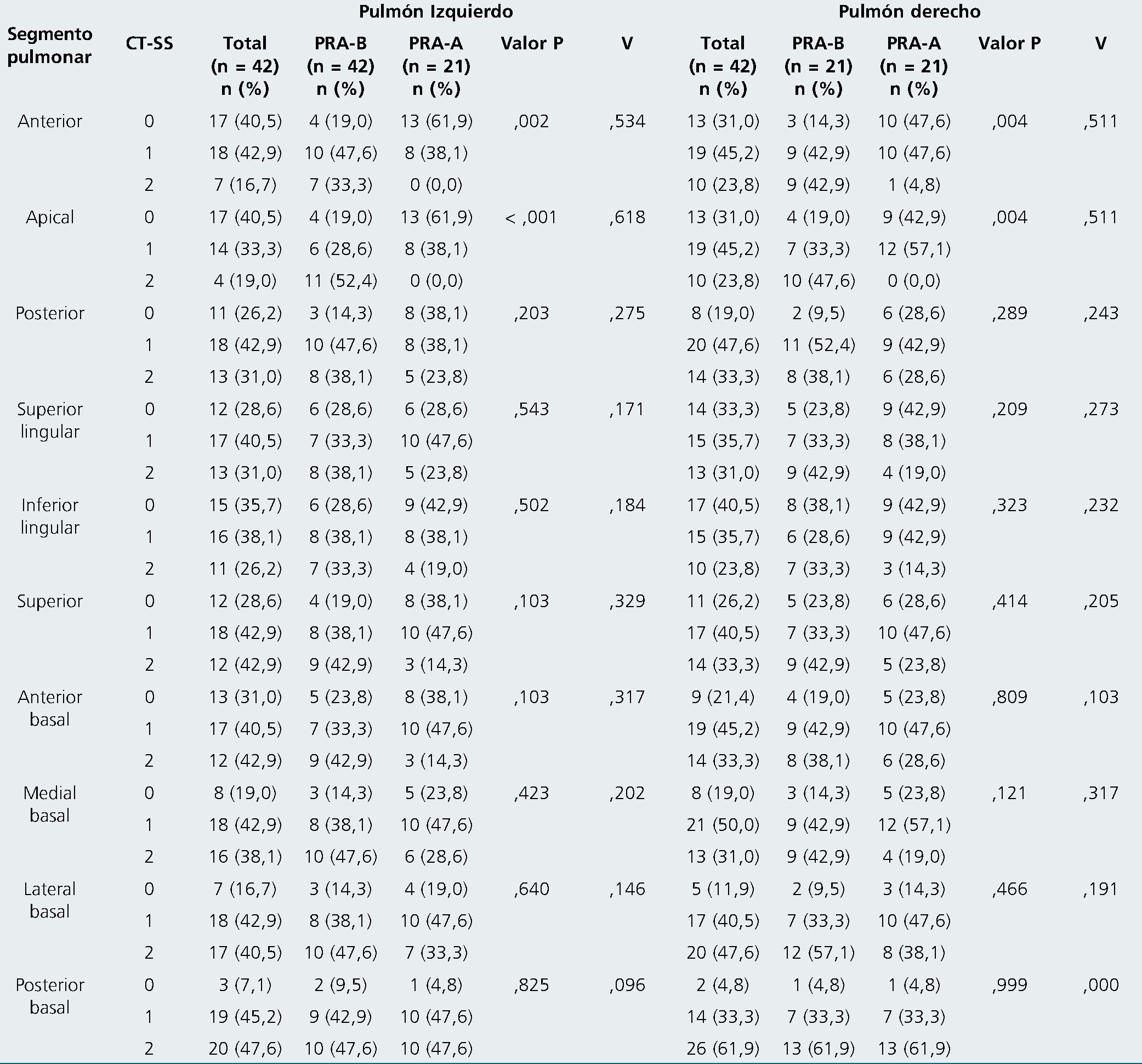
Abreviaturas: V: fuerza de asociación de Cramer’s V; PRA-B: grupo potencial de reclutamiento alveolar bajo; PRA-A: grupo potencial de reclutamiento alveolar alto. Variables categóricas presentadas en frecuencia absoluta y porcentaje con prueba de Chi-Cuadrado de Pearson. La fuerza de asociación de Cramer’s V para variables nominales se caracterizó de la siguiente manera. 0 a 0,1: poca o ninguna asociación; 0,1 a 0,3: asociación baja; 0,3 a 0,5: asociación moderadamente fuerte; mayor a 0,5: asociación muy fuerte. El nivel de significancia utilizado fue p < 0,05.
CT-SS
La puntuación de CT-SS se realizó en pulmones que no presentaron presión positiva previo al ingreso a UCI. Se logro determinar que en los segmentos pulmonares anteriores y apicales la severidad es significativamente menor en el grupo PRA- A con asociación muy fuerte. Posterior a realizar una MRA con titulación de PEEP, las mejoras clínicas en este grupo pueden ser explicadas por un RA en las regiones pulmonares dependientes, siendo este resultado similar a lo reportado por Stevic y colaboradores[25]. A diferencia de lo observado en las zonas no dependientes, donde la puntación de CT-SS es mayor en grupo PRA-B, una MRA podría generar mayor sobredistensión y/o hiperinsuflación alveolar[34], lo que también podría estar determinado por la altura pulmonar y el peso de la pared torácica[35] con resultados clínicos poco favorables. Sin embargo, estas zonas podrían verse mejoradas clínicamente al evaluar la mecánica ventilatoria considerando el grado de inclinación de la cama y posicionamiento del tronco[36],[37].
Mecánica ventilatoria
Los hallazgos de este estudio muestran significativamente un nivel de PEEP mayor (posterior a MRA) en el grupo PRA- A con mejor respuesta en la oxigenación al igual que estu- dios[11],[38]; Los pacientes se ventilaron con estrategias de ventilación (VM protectora) protectoras independiente del PRA, sin evidencia de sobredistensión alveolar[33], cumpliéndose el objetivo de protección pulmonar para ambos grupos[39], manteniendo muy baja mortalidad al egreso de UCI y alta hospitalaria.
-
Limitaciones del estudio
Las limitaciones son propias de estudios observacionales, con un número de pacientes reducido, (esto dado principalmente a que estas nuevas maniobras de medición) no estaban estandarizadas en el equipo y no eran de la práctica habitual, por lo que hubo que generar instancias de capacitación para heterogeneidad de la toma de datos.
-
Aportes a la ciencia, implicancias clínicas y futuras líneas de investigación
Es el primer estudio que compara la severidad pulmonar por CTT y la mecánica ventilatoria en función del índice R/I en pacientes chilenos y latinoamericanos con C-ARDS. El índice R/I es un método seguro, rápido y reproducible, de estimación del PRA, evaluando la respuesta inicial a la PEEP y precisando la MRA con titulación de PEEP al lado de la cama. El CT-SS es un score que permite rápidamente determinar la gravedad pulmonar, en entornos restringidos como el existente en una UCI, logrando objetivar los segmentos pulmonares más afectados permitiendo optimizar estrategias de abordaje tempranas como el posicionamiento clínico en cama. La severidad pulmonar medida por CT-SS más la medición de PRA (índice R/I), son métodos complementarios que identifican a pacientes que se benefician de estrategias de PEEP alto, favoreciendo la protección pulmonar. En futuras investigaciones se analizarán estas maniobras diagnosticas de manera multicéntricas y con diferentes patologías respiratorias que desarrollen un SDRA en pacientes ingresados a distintas UCI.
-
Conclusión
Los pacientes con Falla Respiratoria Aguda por COVID-19 admitidos en UCI con un Índice R/I alto presentan una mejor mecánica ventilatoria y parámetros gasométricos con respecto a quienes tienen un índice R/I bajo. Además, se observó una menor severidad pulmonar en los segmentos anteriores y api
cales en pulmón derecho e izquierdo en los pacientes con un Índice R/I alto, por lo tanto, se puede afirmar que el potencial de reclutabilidad alveolar está asociado a la severidad pulmonar.
Contribución de los autores: F.P.E., V.F.F. Concepto. F.P.E; V.F.F., F.T.S.; B.F.C. Recogida de datos. V.F.F., I.C Análisis estadístico. F.P.E; V.F.F., F.T.S.; B.F.C.; I.C. Elaboración del manuscrito.
Agradecimientos: Se agradece al Complejo Asistencial Dr. Víctor Ríos Ruiz y su centro de costo UPC adulto por permitirnos realizar este estudio junto al apoyo del equipo profesional; médicos, kinesiólogos, enfermeros y técnicos. De manera honorable se agradece a todos los pacientes ingresados UCI adulto durante la pandemia por COVID-19, por permitirnos identificar nuevos métodos de evaluación optimizando nuestras intervenciones y tratamientos.
Financiación: El estudio no recibió financiamiento para su realización.
Conflicto de intereses: No se declara conflicto de interés por ningún autor.
-
Referencias
1. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb;395(10223):497–506. https://doi.org/10.1016/S0140-6736(20)30183-5 PMID:31986264
2. Kim C, Kim W, Jeon JH, Seok H, Kim SB, Choi HK, et al. COVID-19 infection with asymptomatic or mild disease severity in young patients: clinical course and association between prevalence of pneumonia and viral load. PLoS One. 2021 Apr;16(4):e0250358. https://doi.org/10.1371/journal.pone.0250358 PMID:33882097
3. Marini JJ, Gattinoni L. Management of COVID-19 respiratory distress. JAMA. 2020 Jun;323(22):2329–30. https://doi.org/10.1001/jama.2020.6825 PMID:32329799
4. Zaim S, Chong JH, Sankaranarayanan V, Harky A. COVID-19 and multiorgan response. Curr Probl Cardiol. 2020 Aug;45(8):100618. https://doi.org/10.1016/j.cpcardiol.2020.100618 PMID:32439197
5. Cobb NL, Sathe NA, Duan KI, Seitz KP, Thau MR, Sung CC, et al. Comparison of clinical features and outcomes in critically ill patients hospitalized with COVID-19 versus influenza. Ann Am Thorac Soc. 2021 Apr;18(4):632–40. https://doi.org/10.1513/AnnalsATS.202007-805OC PMID:33183067
6. Hernández-Cárdenas C, Lugo-Goytia G, Hernández-García D, Pérez-Padilla R. Comparación de las características clínicas y mortalidad debidas a Síndrome de Distrés Respiratorio Agudo debido a COVID-19 versus Influenza A-H!N!pdm09. Med Intensiva. 2022;46(6):345–7. https://doi.org/10.1016/j.medin.2021.05.014.
7. Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, et al.; ARDS Definition Task Force. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012 Jun;307(23):2526–33. https://doi.org/10.1001/jama.2012.5669 PMID:22797452
8. Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020 Apr;8(4):420–2. https://doi.org/10.1016/S2213-2600(20)30076-X PMID:32085846
9. Grasselli G, Tonetti T, Protti A, Langer T, Girardis M, Bellani G, et al.; collaborators. Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicentre prospective observational study. Lancet Respir Med. 2020 Dec;8(12):1201–8. https://doi.org/10.1016/S2213-2600(20)30370-2 PMID:32861276
10. Somhorst P, Gommers D, Endeman H. Advanced respiratory monitoring in mechanically ventilated patients with coronavirus disease 2019-associated acute respiratory distress syndrome. Curr Opin Crit Care. 2022 Feb;28(1):66–73. https://doi.org/10.1097/MCC.0000000000000905 PMID:34772836
11. Chen L, Del Sorbo L, Grieco DL, Junhasavasdikul D, Rittayamai N, Soliman I, et al. Potential for lung recruitment estimated by the recruitment-to-inflation ratio in acute respiratory distress syndrome. A clinical trial. Am J Respir Crit Care Med. 2020 Jan;201(2):178–87. https://doi.org/10.1164/rccm.201902-0334OC PMID:31577153
12. Ashbaugh DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet. 1967 Aug;2(7511):319–23. https://doi.org/10.1016/S0140-6736(67)90168-7 PMID:4143721
13. Turbil E, Terzi N, Cour M, Argaud L, Einav S, Guérin C. Positive end-expiratory pressure-induced recruited lung volume measured by volume-pressure curves in acute respiratory distress syndrome: a physiologic systematic review and meta-analysis. Intensive Care Med. 2020 Dec;46(12):2212–25. https://doi.org/10.1007/s00134-020-06226-9 PMID:32915255
14. Schultz MJ. High versus low PEEP in non-recruitable collapsed lung tissue: possible implications for patients with COVID-19. Lancet Respir Med. 2020 Jun;8(6):e44. https://doi.org/10.1016/S2213-2600(20)30180-6 PMID:32325016
15. Gattinoni L, Caironi P, Cressoni M, Chiumello D, Ranieri VM, Quintel M, et al. Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med. 2006 Apr;354(17):1775–86. https://doi.org/10.1056/NEJMoa052052 PMID:16641394
16. Chiumello D, Marino A, Brioni M, Cigada I, Menga F, Colombo A, et al. Lung recruitment assessed by respiratory mechanics and computed tomography in patients with acute respiratory distress syndrome. What is the relationship? Am J Respir Crit Care Med. 2016 Jun;193(11):1254–63. https://doi.org/10.1164/rccm.201507-1413OC PMID:26699672
17. Gattinoni L, Marini JJ, Pesenti A, Quintel M, Mancebo J, Brochard L. The “baby lung” became an adult. Intensive Care Med. 2016 May;42(5):663–73. https://doi.org/10.1007/s00134-015-4200-8 PMID:26781952
18. Chen L, Chen GQ, Shore K, Shklar O, Martins C, Devenyi B, et al. Implementing a bedside assessment of respiratory mechanics in patients with acute respiratory distress syndrome. Crit Care. 2017 Apr;21(1):84. https://doi.org/10.1186/s13054-017-1671-8 PMID:28372575
19. Chiumello D, Sferrazza Papa GF, Artigas A, Bouhemad B, Grgic A, Heunks L, et al. ERS statement on chest imaging in acute respiratory failure [abstract]. Eur Respir J. 2019 Sep;54(3):1900435. Available from: http://erj.ersjournals.com/content/54/3/1900435 https://doi.org/10.1183/13993003.00435-2019 PMID:31248958
20. Gattinoni L, Collino F, Maiolo G, Rapetti F, Romitti F, Tonetti T, et al. Positive end-expiratory pressure: how to set it at the individual level. Ann Transl Med. 2017 Jul;5(14):288. https://doi.org/10.21037/atm.2017.06.64 PMID:28828363
21. Chiumello D, Cressoni M, Chierichetti M, Tallarini F, Botticelli M, Berto V, et al. Nitrogen washout/washin, helium dilution and computed tomography in the assessment of end expiratory lung volume. Crit Care. 2008;12(6):R150. https://doi.org/10.1186/cc7139 PMID:19046447
22. Bouhemad B, Brisson H, Le-Guen M, Arbelot C, Lu Q, Rouby JJ. Bedside ultrasound assessment of positive end-expiratory pressure-induced lung recruitment. Am J Respir Crit Care Med. 2011 Feb;183(3):341–7. https://doi.org/10.1164/rccm.201003-0369OC PMID:20851923
23. Yang R, Li X, Liu H, Zhen Y, Zhang X, Xiong Q, et al. Chest CT severity score: an imaging tool for assessing severe COVID-19. Radiol Cardiothorac Imaging. 2020 Mar;2(2):e200047. https://doi.org/10.1148/ryct.2020200047 PMID:33778560
24. Vestbo J, Hurd SS, Agustí AG, Jones PW, Vogelmeier C, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med. 2013 Feb;187(4):347–65. https://doi.org/10.1164/rccm.201204-0596PP PMID:22878278
25. Stevic N, Chatelain E, Dargent A, Argaud L, Cour M, Guérin C. Lung recruitability evaluated by recruitment-to-inflation ratio and lung ultrasound in COVID-19 acute respiratory distress syndrome. Am J Respir Crit Care Med. 2021 Apr;203(8):1025–7. https://doi.org/10.1164/rccm.202012-4447LE PMID:33560931
26. Chen L, Del Sorbo L, Grieco DL, Shklar O, Junhasavasdikul D, Telias I, et al. Airway closure in acute respiratory distress syndrome: an underestimated and misinterpreted phenomenon. Am J Respir Crit Care Med. 2018 Jan;197(1):132–6. https://doi.org/10.1164/rccm.201702-0388LE PMID:28557528
27. Borges JB, Okamoto VN, Matos GF, Caramez MP, Arantes PR, Barros F, et al. Reversibility of lung collapse and hypoxemia in early acute respiratory distress syndrome. Am J Respir Crit Care Med. 2006 Aug;174(3):268–78. https://doi.org/10.1164/rccm.200506-976OC PMID:16690982
28. Cressoni M, Chiumello D, Algieri I, Brioni M, Chiurazzi C, Colombo A, et al. Opening pressures and atelectrauma in acute respiratory distress syndrome. Intensive Care Med. 2017 May;43(5):603–11. https://doi.org/10.1007/s00134-017-4754-8 PMID:28283699
29. Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi-Filho G, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998 Feb;338(6):347–54. https://doi.org/10.1056/NEJM199802053380602 PMID:9449727
30. Gattinoni L, Tonetti T, Cressoni M, Cadringher P, Herrmann P, Moerer O, et al. Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med. 2016 Oct;42(10):1567–75. https://doi.org/10.1007/s00134-016-4505-2 PMID:27620287
31. Sinha P, Fauvel NJ, Singh S, Soni N. Ventilatory ratio: a simple bedside measure of ventilation. Br J Anaesth. 2009 May;102(5):692–7. https://doi.org/10.1093/bja/aep054 PMID:19346233
32. Cramer H. Mathematical methods of statistics (PMS-9). Volume 9. Princeton (NJ): Princeton University Press; 1946. https://doi.org/10.1515/9781400883868.
33. Grieco DL, Bongiovanni F, Chen L, Menga LS, Cutuli SL, Pintaudi G, et al. Respiratory physiology of COVID-19-induced respiratory failure compared to ARDS of other etiologies. Crit Care. 2020 Aug;24(1):529. https://doi.org/10.1186/s13054-020-03253-2 PMID:32859264
34. Rezoagli E, Bastia L, Grassi A, Chieregato A, Langer T, Grasselli G, et al. Paradoxical effect of chest wall compression on respiratory system compliance: A multicenter case series of patients with ARDS, with multimodal assessment. Chest. 2021 Oct;160(4):1335–9. https://doi.org/10.1016/j.chest.2021.05.057 PMID:34118247
35. Cressoni M, Chiumello D, Carlesso E, Chiurazzi C, Amini M, Brioni M, et al. Compressive forces and computed tomography-derived positive end-expiratory pressure in acute respiratory distress syndrome. Anesthesiology. 2014 Sep;121(3):572–81. https://doi.org/10.1097/ALN.0000000000000373 PMID:25050573
36. Marrazzo F, Spina S, Forlini C, Guarnieri M, Giudici R, Bassi G, et al. Effects of trunk inclination on respiratory mechanics in patients with COVID-19-associated acute respiratory distress syndrome: let’s always report the Angle! Am J Respir Crit Care Med. 2022 Mar;205(5):582–4. https://doi.org/10.1164/rccm.202110-2360LE PMID:34982652
37. Pan C, Chen L, Lu C, Zhang W, Xia JA, Sklar MC, et al. Lung recruitability in COVID-19-associated acute respiratory distress syndrome: A single-center observational study. Am J Respir Crit Care Med. 2020 May;201(10):1294–7. https://doi.org/10.1164/rccm.202003-0527LE PMID:32200645
38. Ball L, Robba C, Maiello L, Herrmann J, Gerard SE, Xin Y, et al.; GECOVID (GEnoa COVID-19) group. Computed tomography assessment of PEEP-induced alveolar recruitment in patients with severe COVID-19 pneumonia. Crit Care. 2021 Feb;25(1):81. https://doi.org/10.1186/s13054-021-03477-w PMID:33627160
39. Amato MBP, Meade MO, Slutsky AS, Brochard L, Costa ELV, Schoenfeld DA, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015;372(8):747–55. http://dx.doi.org/10.1056/NEJMsa1410639

 ORCID
ORCID