Arian Jesús Cuba Naranjo1, Ariel Sosa Remón2,* Yudiel Pérez Yero3, Ana Esperanza Jeréz Alvarez1, Cristians Auza-Santivañez4, Héctor Regino Díaz Águil5
Recibido: 05-08-2024
Aceptado: 11-10-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 2 pp. 111-119|https://doi.org/10.25237/revchilanestv54n2-02
PDF|ePub|RIS
Abstract
Pulmonary monitoring during invasive artificial ventilation by means of diaphragmatic ultrasound has become a valuable tool as a predictor of ventilatory weaning, and its use is currently being expressed beyond this process. The aim of this review was to describe current elements on the role of ultrasound in the follow-up of diaphragmatic dysfunction in critically ill patients. A narrative review of the literature available in Google Scholar, Pumed/Medline, regional SciELO, and academic Google was performed under the terms: diaphragmatic function-diaphragmatic dysfunction in ventilated patients/diaphragmatic ultrasound in ventilated patients: importance/diaphragmatic ultrasound variables. The present manuscript focuses on the current evidence on the main clinical scenarios in which diaphragmatic ultrasound has been used. It has the novelty of showing other scopes of the procedure outside the classically used. For this part, 40 references that met the selection criteria were selected. Diaphragmatic ultrasound at the patient’s bedside is an important pillar of great current validity in the evaluation of ventilated patients, providing real-time information on the function and progressive behavior of the diaphragm. It allows estimating the need for ventilatory assistance, the risk of prolonged hospital stay and mortality. It also represents a tool for successful disconnection.
Resumen
La monitorización pulmonar durante la ventilación mecánica artificial invasiva a través de la ecografía diafragmática se ha convertido en una herramienta valiosa como predictor del destete ventilatorio, actualmente, su uso se expresa más allá de dicho proceso. El objetivo de esta revisión fue describir elementos de actualidad sobre el papel de la ecografía en el seguimiento de la disfunción diafragmática en pacientes críticos. Se realizó una revisión narrativa de la literatura disponible en Google Scholar, Pumed/Medline, SciELO regional, y Google académico bajo los términos: función-disfunción diafragmática en pacientes ventilados/ecografia diafgramática en pacientes ventilados: importancia/ variables ecográficas diafragmática. El manuscrito presente centra en la evidencia de actualidad sobre los principales escenarios clínicos en los cuales la ecografía diafragmática ha sido utilizada. Tiene la novedad de mostrar otros alcances del proceder fuera de lo clásicamente utilizado. Para esta parte se seleccionaron 40 referencias que cumplieron con los criterios de selección. La ecografía diafragmática a la cabecera del paciente constituye un pilar de importancia y de gran validez actual en la evaluación de pacientes ventilados, brinda información en tiempo real de la función y comportamiento progresivo del diafragma. Permite estimar la necesidad de asistencia ventilatoria, el riesgo de una estancia hospitalaria prolongada y la mortalidad. Además de representar una herramienta para la desconexión exitosa.
-
Introducción
La presencia de debilidad muscular generalizada de extremidades y músculos respiratorios en pacientes admitidos a la unidad de cuidados intensivos (UCI) es un fenómeno altamente prevalente. Ha sido asociado con un peor pronóstico y es considerada actualmente como un factor de riesgo para ventilación mecánica (VMA) prolongada, alto riesgo de readmisión y mortalidad[1].
El diafragma es el principal músculo de la respiración y resulta ser un órgano diana en la debilidad muscular desde un punto de vista fisiopatológico y clínico. La disfunción muscular diafragmática (DMD) como entidad clínica puede ocurrir secundario a numerosas condiciones patológicas y suele ser infradiagnósticada en la práctica clínica. Debido a su gran importancia y su asociación con el desenlace de los pacientes, una adecuada evaluación del diafragma, es crucial para realizar el diagnóstico y, de este modo, adoptar estrategias que puedan optimizar su manejo[1],[2].
La ecografía diafragmática (ED) ha ganado importancia debido a sus múltiples ventajas y aplicaciones clínicas. Su utilidad como predictor de destete exitoso de la VMA ha sido estandarizada y se continúa estudiando. Sin embargo, la utilidad de la ED se expresa más allá de dicho proceso y un incipiente cuerpo de conocimientos sustenta la evidencia actual para su utilización como predictor de intubación orotraqueal (IOT), monitorización en la EPOC o durante la VMA.
El objetivo de esta revisión fue describir elementos de actualidad sobre el papel de la ED en el seguimiento de la DMD en pacientes críticos.
-
Método
Se realizó una revisión narrativa de la literatura mediante una búsqueda sin restricciones en idiomas español e inglés. El período de búsqueda incluyó los recientes 10 años.
Se realizó una pesquisa en las bases de datos de Scielo, PubMed/Medline, Google académico, en los idiomas en español e inglés. Se utilizaron como descriptores los consignados en las palabras clave del artículo.
Los criterios de inclusión fueron: artículos de acceso libre, originales, revisiones narrativas y sistemáticas (con/sin meta- análisis), ensayos clínicos, editoriales, casos clínicos, cartas al editor/director y documentos de consenso. Se excluyeron para la presente revisión, artículos resúmenes y aquellos que describen el tema en la población pediátrica.
El manuscrito presente se centra en la evidencia de actualidad sobre los principales escenarios clínicos en los cuales la ED ha sido utilizada. Tiene la novedad de mostrar otros alcances
del proceder fuera de lo clásicamente utilizado: como predictor del destete de la VMA y en el diagnóstico de la DMD.
Para esta parte se seleccionaron 46 referencias que cumplieron con los criterios de selección. De ellas, el 91,3% corresponde a los recientes 5 años.
-
Discusión
El diafragma es una membrana músculo-fibrosa, su evaluación por ecografía se basa en su anatomía y función. Durante la inspiración, cuando el diafragma se contrae, las fibras musculares se acortan, se espesan y se endurecen, desplazando toda la estructura músculo-tendinosa del diafragma, bajando su cúpula, moviendo el contenido abdominal caudalmente y expandiendo la cavidad torácica inferior[2].
El principal músculo inspiratorio puede ser visualizado mediante dos ventanas, la subcostal e intercostal, es la ventana subcostal derecha la que ha mostrado menor error inter e intra-observador en la apreciación de la Excursión diafragmática (ExD) y la ventana intercostal es usada para la valoración del grosor diafragmático. La fracción de engrosamiento diafragmático (FED) es un estimador indirecto del esfuerzo inspiratorio.
Ambas medidas se deben de realizar con la menor asistencia ventilatoria y de ser posible bajo presión positiva continua en vías aéreas (CPAP, por sus siglas en inglés) cero o con un tubo en T, para evitar subestimar la evaluación debido al efecto de la presión positiva sobre el aplanamiento del diafragma[1],[3].
La apreciación cualitativa y cuantitativa del diafragma por ecografía provee una estimación del esfuerzo respiratorio del paciente; son dos las variables medidas: FED y ExD, proporcionan una apreciación de la movilidad y contractilidad muscular respectivamente[4].
-
Evaluación del engrosamiento diafragmático
Se coloca el transductor de alta frecuencia (6-13 MHz) en la zona de aposición del diafragma (zona donde el contenido abdominal alcanza la caja torácica inferior, en el octavo o noveno espacio intercostal, entre las líneas axilar anterior y medio- axilar) apreciándose 3 capas: una capa central hipoecógenica (el diafragma) la cual está rodeada por 2 capas hiperecógenicas (peritoneo y pleura (Figura 1A)[5],[6],[7].
Se harán 3 medidas:
-
Desde el punto medio de la capa pleural al punto medio de la capa peritoneal.
-
Desde la superficie externa de ambas capas.
-
Desde la superficie interna de ambas capas y estas se harán tanto en inspiración como en espiración.
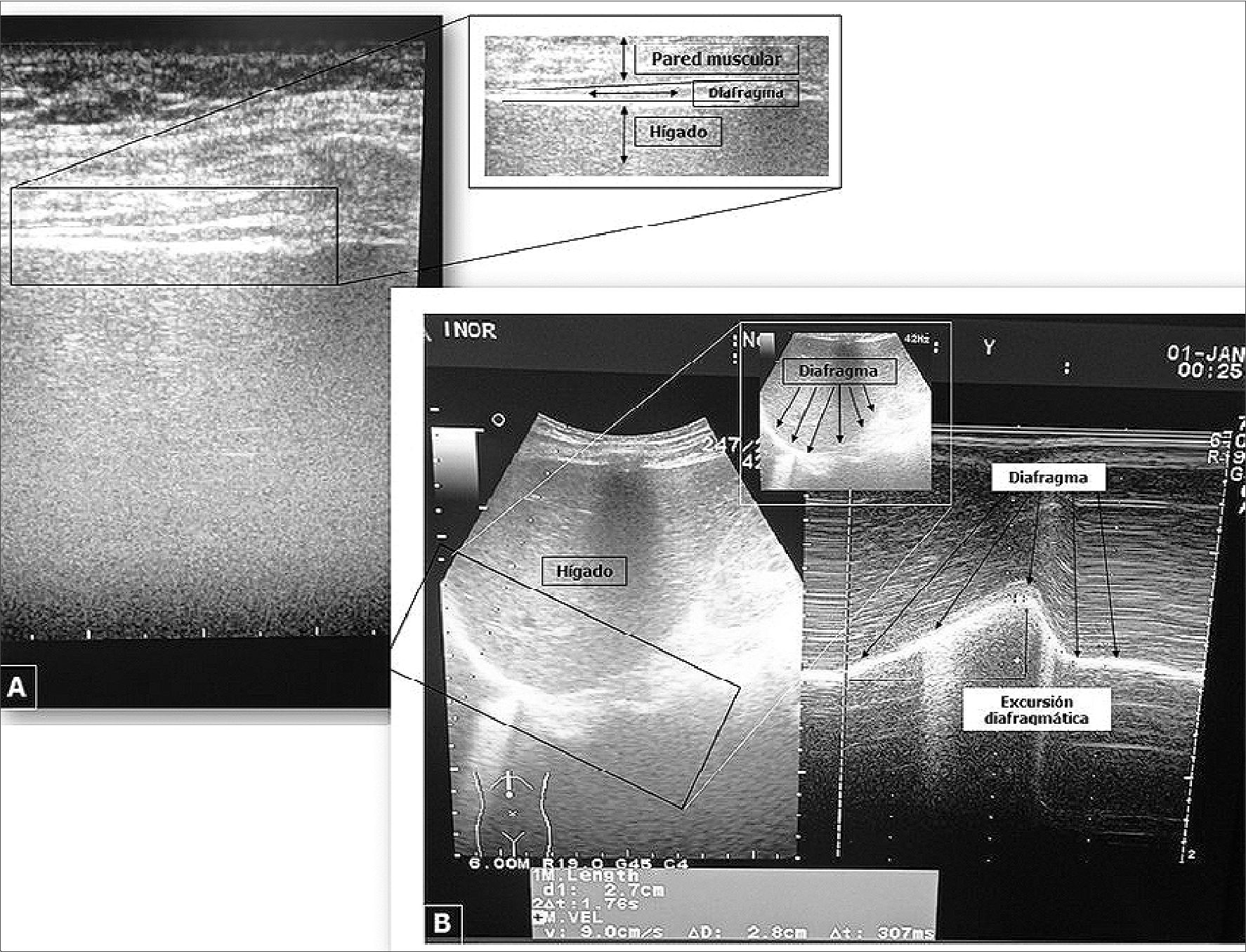
Figura 1. Vista ecográfica del diafragma. A: Engrosamiento diafragmático en modo B; B: Vista subcostal anterior, a la izquierda visualización del diafragma en modo B, a la derecha medición de la ExD en modo M.
Una afirmación crucial en el consenso de experto es que el engrosamiento diafragmático (EgD) debe medirse entre la pleura y el peritoneo, sin incluirlos en el espesor total. Los cambios en el EgD se evalúan a través de la FED: se toman los datos del EgD, individualizando el sitio de medida (externa, media o interna) y se utiliza la siguiente fórmula[2],[5],[8],[9].

-
Evaluación de la ExD
Se coloca el transductor de baja frecuencia (2-6 MHz) en la línea medio clavicular derecha anterior, dirigiéndose medial- craneal y dorsalmente, siguiendo el tercio posterior del hemidiafragma derecho, se evalúa con el modo B, observando el desplazamiento de las ondas realizadas con la respiración espontánea[5],[6].
Posteriormente, se posiciona la línea de exploración en modo M lo más perpendicular posible con relación al domus del diafragma, con el fin de medir el movimiento de las estructuras anatómicas a lo largo del tiempo y, por tanto, medir la movilidad del diafragma colocando calibradores en la parte inferior y superior del diafragma[10] (Figura 1B)[7].
La ventaja del modo M es que permite una sincronización más precisa del ciclo respiratorio, mientras que el modo B resulta una mejor orientación espacial y facilidad de uso. Por ahora, no hay evidencia a favor de ninguno de los métodos y no hay ventajas claras directamente evidentes[11],[12].
En pacientes con soporte ventilatorio, es necesaria una breve desconexión del respirador artificial (tubo en T) o mantener niveles mínimos de CPAP para evaluar el movimiento diafragmático y así eliminar el sesgo de inflado pasivo por la presión del ventilador. El desplazamiento hacia abajo del diafragma puede ser el resultado de la fuerza de la contracción del diafragma por sí misma, y también de la inflación pulmonar pasiva realizada por el ventilador, lo que indica que la excursión del diafragma solo debe evaluarse durante las respiraciones sin ayuda[9].
Los valores de referencia reportados oscilan entre 1,5 a 2,0 cm con límite inferior en varones sanos de 1 cm, y en mujeres sanas de 0,9 cm. Se define la DMD a una excursión menor a la mencionada o a una ausencia de excursión (Tabla 1) [5],[13],[14].
Utilizando el modo M es posible medir la VCD a través de la ventana subcostal. La misma se calcula mediante el cociente entre la ExD durante la inspiración y el tiempo inspiratorio (Ti) y se expresa en cm/segundos. Durante una ventilación normal la VCD es de 1,5 cm/seg[10].

Tabla 1. Valores de referencia para el diagnóstico ecográfico de DMD
| Variables |
Valores |
IC 95 % |
| ExD |
< 1cm |
9,4-29,93 |
| EgD en inspiración |
< 2 cm |
1,11-15,28 |
| EgD espiratorio |
< 2 cm |
14,87-37,58 |
| FED |
< 30% |
10,73-31,88 |
ExD: excursión diafragmática; EgD: engrosamiento diafragmático; FED: fracción de engrosamiento diafragmático.
Tabla 2. Valor de corte de ExD y FED de éxito en la VMA. Diversos estudios
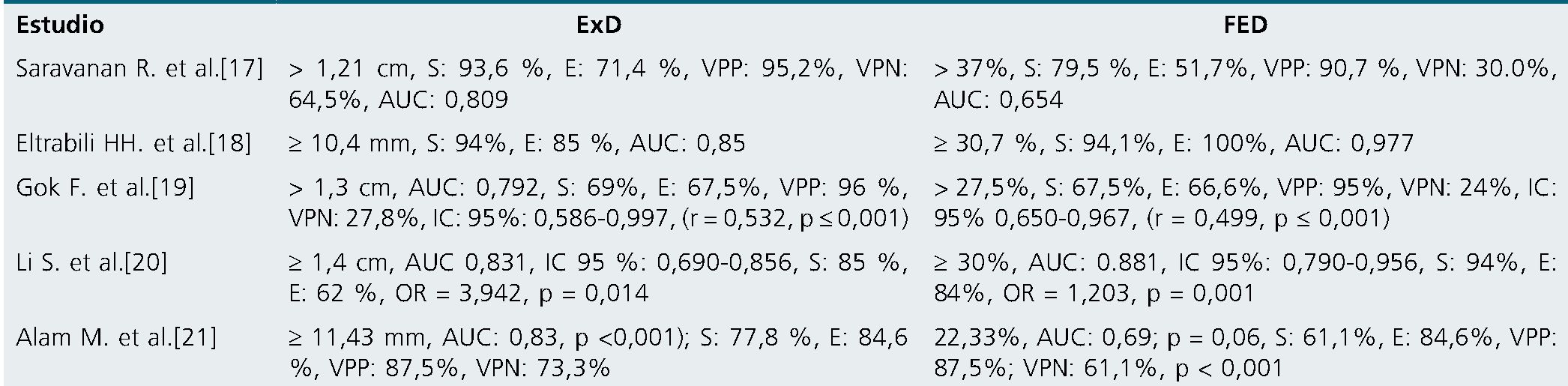
S: sensibilidad.; E: especificidad.; VPP: valor predictivo positivo; VPN: valor predictivo negativo; AUC: área bajo la curva operador-receptor.
Persisten las controversias respecto a la contracción diafragmática fisiológica y el momento óptimo del ciclo respiratorio para tomar mediciones, por ejemplo, la inspiración máxima vs la inspiración final, aún está por investigarse si estas diferencias sutiles afectan las mediciones finales. Hasta entonces, un enfoque pragmático sería medir el estado más grueso y más fino del diafragma[8].
-
Valores ecográficos de referencias
Dado el rápido crecimiento de la ED como herramienta en la práctica clínica diaria y en la investigación, un gran grupo de especialistas internacionales, realizaron un consenso, expertos sobre ED en pacientes críticos (EXODUS, por sus siglas en inglés), y se establecieron medidas vitales hacia un protocolo de medición de la ExD y el GD en críticos. Con respecto a la anatomía ecográfica del diafragma, se estableció una disminución > 10% respecto al espesor inicial, como punto de corte relevante para definir la atrofia diafragmática. Esto es muy relevante ya que se ha demostrado que la atrofia del diafragma afecta los resultados clínicos, como la duración de la VMA[10].
Sin embargo, para un aumento del espesor, que es igualmente interesante en términos de posible impacto clínico, no se estableció ningún punto de corte. Se consideró imposible distinguir la causa del aumento de espesor, por ejemplo, una verdadera hipertrofia muscular de una inflamación, edema o fibrosis. En este sentido, se acordó que la evaluación de la ecogenicidad del diafragma y, por lo tanto, potencialmente de la calidad del diafragma, era un área de especial interés para futuras investigaciones[15].
Son varios los puntos de corte encontrados en la ExD y la FED en el paciente con asistencia ventilatoria, y tienen alta variabilidad en el desempeño de la prueba[16] (Tabla 2).
-
Uso clínico de la ED en pacientes críticos
La evaluación diafragmática por ecografía puede ayudar a estimar la necesidad de asistencia ventilatoria, así como el riesgo de una estancia hospitalaria más prolongada y una mayor tasa de mortalidad[22].
-
EPOC
Un estudio realizado por Elsayed AA et al.[23], evaluaron el impacto de la DMD por ecografía en la predicción de necesidad de VMA, en pacientes con exacerbación aguda de la EPOC tratados con ventilación no invasiva (VNI). De acuerdo con el destino de la VNI, los pacientes se clasificaron en grupos de VNI exitosas y fracasadas. La FED en ambos grupos fue > 33%-38% y < 16%-18% respectivamente. La FED con un valor de corte < 26%-29% en ambos lados fue capaz de predecir el fracaso de la VNI con una sensibilidad del 96,67% y una especificidad del 80%-82,22%.
La ExD en la EPOC con IRA hipercápnica aguda podría predecir el fracaso de la VNI con mayor precisión que el pH arterial y la PaCO2[3].
-
Necesidad de VMA
Suttapanit K et al.[24], evaluaron la capacidad de la ExD derecha (ExDd) para predecir la necesidad de VMA. El 38,9% requirieron VMA, se identificó que un aumento del valor de ExDd por cada 0,1 cm era un predictor independiente de VMA (OR ajustado: 0,08, IC 95%: 0,04-0,17, p < 0,001; AUROC 0,850; IC 95%: 0,807-0,894). El valor de corte de ExDd fue de 1,2 cm (sensibilidad 82,3%, IC 95% 74,0-88,8; especificidad 78,1%, IC 95% 71,7-83,6). El tiempo de VMA fue significativamente mayor cuando la ExDd fue < 1,2 cm (13 días versus 5 días, p = 0,006).
La evaluación diafragmática se puede considerar en la monitorización para elegir soporte ventilatorio, para evitar el empeoramiento de los resultados en la intubación retrasada y la debilidad diafragmática en la VMA. Un estudio previo que evaluó el desempeño de la función diafragmática encontró que los valores bajos de ExD se asociaban con la necesidad de VMA, VMA prolongada y mortalidad en la sepsis[25],[26].
Los pacientes que acuden al servicio de urgencias con IRA y una ExD < 1,2 cm podrían ser admitidos en la UCI para una monitorización estrecha y una intubación temprana a fin de prevenir condiciones adversas. Por el contrario, los pacientes con una ExD > 2 cm podrían recibir de forma segura VNI y atención de rutina fuera de la UCI. Monitorear la ExD durante el proceso de desconexión de la VMA podría ayudar a predecir los resultados del destete. El uso de la ExD con parámetros clínicos que indicaran los criterios de intubación podría beneficiar la decisión de intubación temprana para prevenir resultados adversos. Sin embargo, integrar la ExD en POCUS para guiar el entorno de reanimación requiere más estudios para confirmar el valor de corte y el beneficio de implementar la atención[24].
Burgos et al.[27], evaluaron 15 pacientes con insuficiencia respiratoria por sospecha de SARS-COVID-19, a quienes se les realizó la medición de la ExD, la FED y el delta del grosor diafragmático (AD) para realizar las correlaciones, teniendo como punto de cohorte un valor de < 1,5 cm de ExD. El promedio de ExD fue de 1,29 cm. Existió un descenso marcado de la ExD en pacientes con mayor compromiso de oxigenación y perfusión, demostrando la DMD en presencia de hipercapnia e hipoxia con un coeficiente de correlación inversa de – 0,841. Se evidenció que los pacientes con mayores patrones de aireación pulmonar que tenían menor ExD y poca variabilidad en AD, terminaron en IOT, por lo que este parámetro puede ser considerado al momento de valorar la gravedad de los pacientes con SARS-COVID-19.
Tabla 3. Ecografía diafragmática en el monitoreo de la VMA. Diferentes estudios
| Autores | Características del estudio – Principales resultados |
| Janssen et al.[28] | Evaluar si la ExD puede sustituir el VC en la IRA en 2 grupos de pacientes (VMI: 21 y voluntarios: 20)
Estabilidad de la relación de ExD-VC en respiraciones consecutivas (coeficiente de correlación intraclase [ICC]: 0,86) Relación ExD-VC: 201 ml/cm en pacientes de UCI (IC 95 %: 161-240 ml/cm); p < 0,001, y 361 (IC 95 %: 294-428) ml/ cm, p < 0,001 en voluntarios |
| Goligher et al.[30]. | La disminución del ED se asoció con menor probabilidad diaria de liberación de la ventilación (índice de riesgo ajustado [iRA]: 0,69; IC 95 %: 0,54-0,87; por disminución del 10 %), ingreso prolongado (iRA: 1,71; IC 95 %: 1,29-2,27) y riesgo de complicaciones (OR ajustado: 3,00; IC 95 %: 1,34-6,72). |
| Sklar et al.[31]. | Evaluar el GD mediante ecografía dentro de las 36 horas posteriores a la intubación y luego diariamente
EgD inicial más bajo se asoció con complicaciones de IRA (OR ajustado: 1,77; IC 95 %: 1,20-2,61 por disminución de 0,5 mm), destete prolongado (OR ajustado: 2,30; IC 95 %: 1,42- 3,74) y muerte hospitalaria (OR ajustado: 1,47; IC 95 %: 1,00-2,16 por disminución de 0,5 mm), particularmente después del alta de la UCI (OR ajustado: 2,68; IC 95 %: 1,35-5,32 por decremento de 0,5 mm) |
-
Monitorización durante la VMA
Monitorear el volumen corriente (VC) en pacientes críticamente enfermos con IRA es importante, dada su relación con el resultado clínico adverso. Sin embargo, la cuantificación del VC en pacientes no intubados es un desafío. La atrofia del diafragma es un componente de la DMD inducida por la ventilación (DMDIV) y se ha verificado en estudios experimentales y clínicos la presencia de atrofia histológica (disminución en el área transversal de la fibra del diafragma) incluso después de unas pocas horas de VMA[7],[28],[29].
Los estudios consultados (Tabla 3) muestran que una ExD de 1,5 cm podría corresponder a un VC entre 250 y 750 ml en pacientes en la UCI. Las características de los participantes (edad, sexo, altura, peso corporal ideal, IMC, circunferencia torácica y días en VMA) no afectarían la relación entre la ExD y el VC.
Se han evidenciado, que la atrofia diafragmática debida al desuso puede ocurrir incluso en VMA en modalidad asistida, lo que indica que el simple accionamiento del ventilador no es suficiente para prevenir la atrofia del diafragma. Además, las variables clínicas y los ajustes del ventilador no son capaces de detectar la contractilidad y el riesgo de atrofia del diafragma[29],[32],[33].
-
Asincronía ventilatoria
Una interacción óptima paciente-ventilador, sin asincronía, sería teóricamente ideal para el diafragma. Recientemente, se ha establecido que, durante la VMA, con protección pulmonar y diafragmática, se requiere la monitorización del esfuerzo respiratorio. Por lo tanto, el ED puede ser una herramienta valiosa para proporcionar la evaluación del esfuerzo respiratorio (midiendo la actividad contráctil del diafragma representada por la FED), además de proporcionar la identificación de alteraciones estructurales en el músculo[34],[35].
La titulación del esfuerzo inspiratorio y la sincronización en la interacción paciente-ventilador parecen proporcionar la mejor evidencia en la protección simultánea del pulmón y el diafragma, aunque la eficacia de tales estrategias está respaldada principalmente por datos fisiológicos y epidemiológicos[36],[37],[38].
La lesión muscular asociada a la asincronía paciente-ventilador (APV) se relaciona principalmente con la contracción excéntrica. En ciertos tipos de asincronía, los esfuerzos inspiratorios del paciente (como el esfuerzo ineficaz) pueden ocurrir durante la fase espiratoria, determinando contracciones excéntricas o pliométricas (contracciones que ocurren durante el estiramiento de las fibras), causando lesiones en las fibras musculares del diafragma[34].
Teniendo en cuenta que la actividad diafragmática inspira- toria (contracción) determina los cambios en la presión pleural, se ha argumentado que la ED puede utilizarse para monitorizar simultáneamente la función del diafragma y el patrón respiratorio con el fin de detectar APV[5],[36].
Los registros simultáneos de la presión y el flujo de las vías aéreas (FVA), junto con la presión esofágica (PE), se consideran el estándar de oro para comprender las formas de asincronía. Los registros simultáneos de la Paw y FVA, junto con la PE, se consideran el estándar de oro para comprender las formas de asincronía[39]
Soilemezi et al.[39], constataron una concordancia entre la PE y la ExD en modo M, proporcionando evidencia para el uso de la ED en la evaluación de la APV. Los autores describen en este método tres casos representativos de detección de asincronía (Tabla 4).
La observación simultánea de FED y Paw puede indicar un APV por auto-activado, cuando se observa un ciclo de respiración asistida sin detectar engrosamiento inspiratorio[8],[36].
Vivier et al.[40], describen dos nuevos métodos para detectar APV, basados en la ExD o EgD combinado con la Paw. La activación automática diafragmática se identificó mediante electromiografía continua, ExD, EgD y trazados de flujo/presión con sensibilidad del 93% (IC 95%: 89%-97%), 94% (IC 95%: 91%-98%), 91% (IC 95%: 87%-96%) y 79% (IC 95%: 75%- 84%), respectivamente. La detección del retraso en el ciclo con una sensibilidad del 84% (IC 95%: 77%-90%), 86% (IC 95%: 80%-93%), 89% (IC 95%: 83%-94%) y 67% (IC 95%: 61%- 73%). La detección por ecografía de activación automática y ciclos retardados es más precisa que la observación aislada de los trazados de presión y flujo, y más factible que el electromio- grama.
-
Destete de la VMA
El destete es la reducción gradual del soporte ventilatorio y representa entre el 40% y el 50% del tiempo total en VMA. En este lapso, al paciente se le da tiempo de hacer respiraciones espontáneas para intentar un intercambio gaseoso aceptable. Los criterios clínicos para el destete se basan en el control o resolución de la causa de la insuficiencia respiratoria, un adecuado intercambio gaseoso con una presión positiva al final de la espiración (PEEP) < 8 cmH2O y una fracción de oxígeno inspirado (FiO2) < 0,5, suspensión de la sedación y relajantes musculares, ausencia de signos clínicos de sepsis, presencia de reflejo tusígeno, corrección de alteraciones metabólicas y elec- trolíticas[39].
Hasta la fecha, no existe ningún parámetro de referencia que logre predecir el éxito en la extubación. Las variables clínicas más utilizadas son el índice de respiraciones rápidas superficiales, la capacidad vital o la presión inspiratoria máxima entre otras, sin embargo, existe una heterogeneidad significativa, gran variabilidad en los puntos de corte y en su precisión diagnóstica. La ED se ha convertido en una prioridad actual para suspender la VMA en pacientes gravemente enfermos, proporcionando una herramienta no invasiva y eficaz para evaluar la función diafragmática y predecir una extubación exitosa. Se han descrito parámetros sensibles para correlacionar grado de DMD y éxito para el destete, tal es el caso de la ExD, FED, otro parámetro útil valorado en la ultrasonografía es la VCD o fracción de acortamiento, la cual es dependiente de la ExD y del tiempo inspiratorio[42],[43],[44],[45].
En este contexto, Hernández-Plata et al.[46], diseñaron un score ecográfico predictor para destete ventilatorio. Tras la aplicación y análisis estadístico se obtuvo una sensibilidad de 91% y especificidad de 69%, con valor predictivo positivo y negativo de 89% y 75% respectivamente, con un área bajo la curva de 0,80, lo que refleja ser una herramienta predictiva valiosa para la toma de decisión clínica en el contexto de destete ventila- torio. Dicho score puede llegar a formar parte de los bundles para el cuidado y monitoreo integral no invasivo del paciente en estado crítico, aunque, hasta la fecha debe ser validado ampliamente.
-
Conclusiones
La ecografía diafragmática a la cabecera del paciente constituye un pilar de importancia y de gran validez actual en la monitorización de pacientes ventilados, brinda información en tiempo real de la función y comportamiento progresivo del principal músculo respiratorio, el diafragma, permite el diagnóstico de su disfunción y complicaciones letales durante la ventilación mecánica y representa herramienta para una desconexión exitosa.
Tabla 4. ED en la evaluación de la AVP. Casos representativos
| Caso 1 |
Asincronía de doble disparo, (Ti neurológico [1,28 seg] > Ti mecánico [0,810 seg]). El ventilador permite la espiración, mientras el paciente presentaba un esfuerzo inspiratorio significativo en curso (ExD: 1,77 cm) |
| Caso 2 |
Asincronía de esfuerzos ineficaces, debido a una asistencia ventilatoria excesiva y largos tiempos de insuflación con acortamiento de la fase espiratoria del paciente Se observó alternancia en ExD pequeña (esfuerzo ineficaz) y pronunciado, cada desplazamiento diafragmático se corresponde a un gatillado y una insuflación del paciente |
| Caso 3 | Asincronía de activación inversa
La ED reveló dos partes distintas en la señal de desplazamiento inspiratorio de las respiraciones desencadenadas de manera inversa: la insuflación mecánica induce el desplazamiento pasivo inicial de la ExD Se proporcionó registro simultáneo con la PE, evidenciándose un paso discreto en la ExD que separó el desplazamiento pasivo debido a la ExD adicional inducido por la activación diafragmática secundario a la insuflación mecánica anterior
Conflictos de intereses: No existió. Financiación: No hubo. Revisión por pares abierta: De acuerdo.
|
-
Referencias
1. Damiani LF, Jalil Y, Dubo S. Disfunción Diafragmática en Ventilación Mecánica: Evaluación e Implicancias Clínicas. Kinesiología [internet]. 2020 [acceso: 01/07/2022];39(2):8-18. Disponible en: https://www.researchgate.net/profile/SebastianDubo/publication/346550932_Disfuncion_Diafragmatica_en_Ventilacion_Mecanica_Evaluacion_e_Implicancias_Clinicas/links/5fc6cecd299bf188d4e8ddf0/DisfuncionDiafragmatica-en-Ventilacion-Mecanica-Evaluacion-e-Implicancias-Clinicas.pdf
2. Santana PV, Cardenas LZ, Albuquerque ALP, Carvalho CRR, Caruso P. Diaphragmatic ultrasound: a review of its methodological aspects and clinical uses. J Bras Pneumol [Internet]. 2020 [consultado: 01/03/2024];46(6):e20200064. Disponible en: https://doi.org/10.36416/1806-3756/e20200064..
3. Cammarota G, Sguazzotti I, Zanoni M, Messina A, Colombo D, Vignazia GL, et al. Diaphragmatic Ultrasound Assessment in Subjects With Acute Hypercapnic Respiratory Failure Admitted to the Emergency Department. Respiratory Care [Internet]. 2019 [consultado: 01/03/2024];64(12): 1469-77. Disponible en: https://rc.rcjournal.com/content/64/12/1469/tab-pdf https://doi.org/10.4187/respcare.06803.
4. Le Neindre A, Philippart F, Luperto M, Wormser J, Morel-Sapene J, L. Aho S et al. Diagnostic accuracy of diaphragm ultrasound to predict weaning outcome: A systematic review and meta-analysis. Int J NursStud [Internet]. 2021 [consultado: 01/03/2024];117:1-11. Disponible en: https://doi.org/10.1016/j.ijnurstu.2021.103890.
5. Avilán R, Liliana S. Variables clínicas y ecográficas de posible disfunción diafragmática asociadas con el fracaso de extubación en el paciente crítico [Tesis de especialización]. 2023 [consultado: 01/03/2024]. Universidad de Bucaramanga, Colombia. Disponible en: http://hdl.handle.net/20.500.12749/20473
6. Acosta CM, Urbano MS, Tusman G. Estudio sonográfico del diafragma. Una nueva herramienta diagnostica para el anestesiólogo. Rev Chil Anest [Internet]. 2018 [consultado: 01/03/2024]; 47: 110-124. Disponible en: https://doi.org/10.25237/revchilanestv47n02.08.
7. Cuba-Naranjo AJ, Sosa-Remón A, Auza-Santivañez JC, Jeréz-Alvarez AE, Pérez-Yero Y, Díaz-Águila, Arteaga-Iriarte O. Diaphragmatic muscle dysfunction associated with artificial mechanical ventilation: a narrative review of the literature. Journal Salud, Ciencia y Tecnología [En prensa]. 2024 [consultado: 01/03/2024]. Disponible en: https://doi.org/10.56294/saludcyt20241362.
8. Haaksma ME, Smit JM, Boussuges A, Demoule A, Dres M, Ferrari G et al. Expert consensus On Diaphragm Ultrasonography in the critically ill (EXODUS): a Delphi consensus statement on the measurement of diaphragm ultrasound-derived parameters in a critical care setting. Crit Care [Internet]. 2022 [consultado: 01/03/2024];26(1):99. Disponible en: https://doi.org/10.1186/s13054-022-03975-5.
9. Schepens T, Fard S, Goligher EC. Assessing Diaphragmatic Function. Respir Care [Internet]. 2020 [consultado: 01/03/2024];65(6):807-819. Disponible en: https://doi.org/10.4187/respcare.07410.
10. Mawla DSA, Fattah SRA, Halim AMA, Elhefeny RA. Diaphragmatic Function Assessment Using Chest Ultrasonography as a Predictor for Weaning from Mechanical Ventilation. The Egypt Journal of Critical Care Medicine [Internet]. 2022 [consultado: 01/03/2024];9(1):1-9. Disponible en: https://doi.org/10.1097/EJ9.0000000000000039.
11. Cappellini I, Picciafuochi F, Bartolucci M, Matteini S, Virgili G, Adembri C. Evaluation of diaphragm thickening by diaphragm ultrasonography: a reproducibility and a repeatability study. J Ultrasound [Internet]. 2021 [consultado: 01/03/2024];24(4):411-416. Disponible en: https://doi.org/10.1007/s40477-020-00462-x.
12. Kalın BS, Gürsel G. Does it make difference to measure diaphragm function with M mode (MM) or B mode (BM)? J Clin Monit Comput [Internet]. 2020 [consultado: 01/03/2024];34(6):1247-1257. https://doi.org/10.1007/s10877-019-00432-7.
13. Laguado-Nieto MA, Roberto-Avilán SL, Naranjo-Junoy F, Meléndez-Flórez HJ, Lozada-Martinez ID, Domínguez-Alvarado GA et al. Diaphragmatic Dynamics and Thickness Parameters Assessed by Ultrasonography Predict Extubation Success in Critically Ill Patients. Clin Med Insights Circ Respir Pulm Med [Internet]. 2023 [consultado: 01/03/2024];17:11795484231165940. Disponible en: https://doi.org/10.1177/11795484231165940.
14. Vivier E, Muller M, Putegnat JB, Steyer J, Barrau S, Boissier F et al. Inability of Diaphragm Ultrasound to Predict Extubation Failure: A Multicenter Study. Chest [Internet]. 2019 [consultado: 01/03/2024];155(6):1131-1139. Disponible en: https://doi.org/10.1016/j.chest.2019.03.004..
15. Coiffard B, Riegler S, Sklar MC, Dres M, Vorona S, Reid WD et al. Diaphragm echodensity in mechanically ventilated patients: a description of technique and outcomes. Crit Care [Internet]. 2021 [consultado: 01/03/2024];25(1):64. Disponible en: https://doi.org/10.1186/s13054-021-03494-9.
16. Supinski GS, Morris PE, Dhar S, Callahan LA. Diaphragm Dysfunction in Critical Illness. Chest [internet]. 2018 [consultado: 01/03/2024];153(4):1040-1051. Disponible en: https://doi.org/10.1016/j.chest.2017.08.1157.
17. Saravanan R, Nivedita K, Karthik K, Venkatraman R. Role of diaphragm ultrasound in weaning mechanically ventilated patients: A prospective observational study. Indian J Anaesth [internet]. 2022 [consultado: 01/03/2024];66(8):591-598. Disponible en: https://doi.org/10.4103/ija.ija_229_22.
18. Eltrabili HH, Hasanin AM, Soliman MS, Lotfy AM, Hamimy WI, Mukhtar AM. Evaluation of diaphragmatic ultrasound indices as predictors of successful liberation in subjects with abdominal sepsis. Respir Care [internet]. 2019 [consultado: 01/03/2024];64(5):564-569. Disponible en: https://doi.org/10.4187/respcare.06391.
19. Gok F, Mercan A, Kilicaslan A, Sarkilar G, Yosunkaya A. Ecografía de diafragma y pulmón durante el destete de la ventilación mecánica en pacientes críticos. Cureus [Internet]. 2021 [consultado: 01/03/2024];13(5):E15057. Disponible en: https://doi.org/10.7759/cureus.15057.
20. Li S, Chen Z, Yan W. Application of bedside ultrasound in predicting the outcome of weaning from mechanical ventilation in elderly patients. BMC Pulm Med [Internet]. 2021 [consultado: 01/03/2024];21(1):217. Disponible en: https://doi.org/10.1186/s12890-021-01605-4..
21. Alam MJ, Roy S, Iktidar MA, Padma FK, Nipun KI, Chowdhury S, Nath RK, Rashid HO. Diaphragm ultrasound as a better predictor of successful extubation from mechanical ventilation than rapid shallow breathing index. Acute Crit Care [Internet]. 2022 [consultado: 01/03/2024];37(1):94-100. Disponible en: https://doi.org/10.4266/acc.2021.01354.
22. Saad M, Pini S, Danzo F, Mandurino Mirizzi F, Arena C, Tursi F, Radovanovic D, Santus P. Ultrasonographic Assessment of Diaphragmatic Function and Its Clinical Application in the Management of Patients with Acute Respiratory Failure. Diagnostics [Internet]. 2023 [consultado: 01/03/2024];13(3):411. Disponible en: https://doi.org/10.3390/diagnostics13030411.
23. Elsayed AA, Mohamed-Neanaa EH, Beshey AN. “Diaphragmatic impairment as a predictor of invasive ventilation in acute exacerbation of chronic obstructive pulmonary disease patients.” Egyptian Journal of Anaesthesia [Internet]. 2022 [consultado: 01/03/2024];38(1):334-341. Disponible en: https://doi.org/10.1080/11101849.2022.2085975.
24. Suttapanit K, Wongkrasunt S, Savatmongkorngul S, Supatanakij P. Ultrasonographic evaluation of the diaphragm in critically ill patients to predict invasive mechanical ventilation. J Intensive Care [Internet]. 2023 [consultado: 01/03/2024];11(1):40. Disponible en: https://doi.org/10.1186/s40560-023-00690-3.
25. Darreau C, Martino F, Saint-Martin M, Jacquier S, Hamel JF, Nay MA et al. Use, timing and factors associated with tracheal intubation in septic shock: a prospective multicentric observational study. Ann Intensive Care [Internet]. 2020 [consultado: 01/03/2024];10(1):62. Disponible en: https://doi.org/10.1186/s13613-020-00668-6..
26. Zaki A, El Ghawaby HH, Gad MMM, Ismail AM, Nawar AS. Diaphragmatic function assessed by bedside ultrasound in patients with sepsis or septic shock admitted to the intensive care unit. Open acces Maced J Med Sci [Internet]. 2021 [consultado: 01/03/2024];9(B):1417-1423. Disponible en: https://doi.org/10.3889/oamjms.2021.7060.
27. Burgos J, Salazar F, Mawyin C, Zaldivar Y, Aroca F, Palacios N. Valoración ecográfica de la disfunción diafragmática en pacientes con SARS-COVID-19 como parámetro de intubación orotraqueal. Rev Chil Anest [Internet]. 2022 [consultado: 01/03/2024];51(3):320-326. Disponible en: https://doi.org/10.25237/revchilanestv5117031646.
28. Janssen ML, Jonkman AH, Wennen M, Wils EJ, Endeman H, Heunks L. Diaphragm excursions as proxy for tidal volume during spontaneous breathing in invasively ventilated ICU patients. Intensive Care Med Exp [Internet]. 2023 [consultado: 01/03/2024];11(1):73. Disponible en: https://doi.org/10.1186/s40635-023-00553-z.
29. Marin-Corral J, Dot I, Boguña M, Cecchini L, Zapatero A, Gracia MP et al. Structural differences in the diaphragm of patients following controlled vs assisted and spontaneous mechanical ventilation. Intensive Care Med [Internet]. 2019 [consultado: 01/03/2024];45(4):488-500. https://doi.org/10.1007/s00134-019-05566-5.
30. Goligher EC, Dres M, Fan E, Rubenfeld GD, Scales DC, Herridge MS et al. Mechanical Ventilation-induced Diaphragm Atrophy Strongly Impacts Clinical Outcomes. Am J Respir Crit Care Med [Internet]. 2018 [consultado: 01/03/2024];197(2):204-213. Disponible en: https://doi.org/10.1164/rccm.201703-0536OC.
31. Sklar MC, Dres M, Fan E, Rubenfeld GD, Scales DC, Herridge MS et al. Association of Low Baseline Diaphragm Muscle Mass With Prolonged Mechanical Ventilation and Mortality Among Critically Ill Adults. JAMA Netw Open [Internet]. 2020 [consultado: 01/03/2024];3(2):e1921520. Disponible en: https://doi.org/10.1001/jamanetworkopen.2019.21520.
32. Grassi A, Ferlicca D, Lupieri E, Calcinati S, Francesconi S, Sala V et al. La ventilación mecánica asistida promueve la recuperación del grosor diafragmático en pacientes críticos: un estudio observacional prospectivo. Cuidado de críticos [Internet]. 2020 [consultado: 01/03/2024];24(1):85. Disponible en: https://doi.org/10.1186/s13054-020-2761-6..
33. Urner M, Mitsakakis N, Vorona S, Chen L, Sklar MC, Dres M et al. Identifying Subjects at Risk for Diaphragm Atrophy During Mechanical Ventilation Using Routinely Available Clinical Data. Respir Care [Internet]. 2021 [consultado: 01/03/2024];66(4):551-558. https://doi.org/10.4187/respcare.08223.
34. Goligher EC, Brochard LJ, Reid WD, Fan E, Saarela O, Slutsky AS, Kavanagh BP, Rubenfeld GD, Ferguson ND. Miotrauma diafragmático: un mediador de la ventilación prolongada y los malos resultados de los pacientes en la insuficiencia respiratoria aguda. Lancet Respir Med [Internet]. 2019 [consultado: 01/03/2024]; 7(1):90-98. https://doi.org/10.1016/S2213-2600(18)30366-7.
35. Peñuelas O, Keough E, López-Rodríguez L, Carriedo D, Goncalves E, Barreiro E et al. Ventilator-induced diaphragm dysfunction: translational mechanisms lead to therapeutical alternatives in the critically ill. Intensive Care Med Exp [internet]. 2019 [consultado: 01/03/2024];7(1):48. Disponible en: https://doi.org/10.1186/s40635-019-0259-9.
36. Goligher EC, Dres M, Patel BK, Sahetya SK, Beitler JR, Telias I et al. Lung- and Diaphragm-Protective Ventilation. Am J Respir Crit Care Med [internet]. 2020 [consultado: 01/03/2024];202(7):950-961. Disponible en: https://doi.org/10.1164/rccm.202003-0655CP.
37. Goligher EC, Jonkman AH, Dianti J, Vaporidi K, Beitler JR, Patel BK et al. Clinical strategies for implementing lung and diaphragm-protective ventilation: avoiding insufficient and excessive effort. Intensive Care Med [Internet]. 2020 [consultado: 01/03/2024];46(12):2314-2326. Disponible en: https://doi.org/10.1007/s00134-020-06288-9.
38. Telias I, Spadaro S. Techniques to monitor respiratory drive and inspiratory effort. Curr Opin Crit Care [Internet]. 2020 [consultado: 01/03/2024];26(1):3-10. Disponible en: https://doi.org/10.1097/MCC.0000000000000680..
39. Soilemezi E, Vasileiou M, Spyridonidou C, Tsagourias M, Matamis D. Understanding Patient-Ventilator Asynchrony Using Diaphragmatic Ultrasonography. Am J Respir Crit Care Med [Internet]. 2019 [consultado: 01/03/2024];200(4):e27-e28. Disponible en: https://doi.org/10.1164/rccm.201901-0054IM.
40. Vivier E, Haudebourg AF, Le Corvoisier P, Mekontso Dessap A, Carteaux G. Diagnostic Accuracy of Diaphragm Ultrasound in Detecting and Characterizing Patient-Ventilator Asynchronies during Noninvasive Ventilation. Anesthesiology [Internet]. 2020 [consultado: 01/03/2024];132(6):1494-1502. Disponible en: https://doi.org/10.1097/ALN.0000000000003239.
41. Saeed F, Lasrado S. Extubation. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 [consultado: 01/03/2024]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK539804/
42. Parada-Gereda HM, Tibaduiza AL, Rico-Mendoza A, Molano-Franco D, Nieto VH, Arias-Ortiz WA, Perez-Terán P, Masclans JR. Effectiveness of diaphragmatic ultrasound as a predictor of successful weaning from mechanical ventilation: a systematic review and meta-analysis. Crit Care [Internet]. 2023 [consultado: 01/03/2024];27(1):174. Disponible en: https://doi.org/10.1186/s13054-023-04430-9.
43. Song J, Qian Z, Zhang H, Wang M, Yu Y, Ye C, Hu W, Gong S. Diaphragmatic ultrasonography-based rapid shallow breathing index for predicting weaning outcome during a pressure support ventilation spontaneous breathing trial. BMC Pulm Med [Internet]. 2022 [consultado: 01/03/2024];22(1):337. Disponible en: https://doi.org/10.1186/s12890-022-02133-5.
44. Zhang P, Jiang HJ, Zhou Q, Ye XM, Li Z, Yuan LP, Wu JF, Zhang LY, Jiang XG, Wu JY, Lu WH, Tao XB. [The predictive value of ultrasonic measurement of the diaphragmatic thickening fraction combined with the maximal inspiratory pressure in mechanical ventilation patients]. Zhonghua Jie He He Hu Xi Za Zhi [Internet]. 2020 [consultado: 01/03/2024];43(9):778-783. Chinese. Disponible en: https://doi.org/10.3760/cma.j.cn112147-20200417-00513.
45. Zhang L, Chen G, Wang H, Yu W. [Valor predictivo de la evaluación combinada de la ecografía diafragmática y pulmonar para los resultados del destete en pacientes con ventilación mecánica con insuficiencia respiratoria aguda]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue [Internet]. 2022 [consultado: 01/03/2024];34(9):941-946. Chino. Disponible en: https://doi.org/10.3760/cma.j.cn121430-20220303-00200..
46. Hernández-Plata AP, Gómez-González MN, Soriano-Orozco R, Díaz-Rodríguez JA, González-Carrillo PL. Score sonográfico predictor de éxito en el destete ventilatorio en la Unidad de Cuidados Intensivos. Med. crít [Internet]. 2018 [consultado: 01/03/2024];32(5):253-257. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2448-89092018000500253&lng=es https://doi.org/10.35366/TI185B.

 ORCID
ORCID