Raúl Maureira Araneda MD.1, Verónica Maureira Moreno MD., MSc.1,2, Anamaría Correa Bustillos MD.1,2, Felipe Verscheure Peralta MD.3,4
Recibido: 12-02-2025
Aceptado: 27-03-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 479-493|https://doi.org/10.25237/revchilanestv54n5-02
PDF|ePub|RIS
Pediatric septic shock, key points for the anesthesiologist: a narrative review of the literature
Abstract
Pediatric septic shock continues to be one of the most important causes of morbidity and mortality worldwide. In 2024, an international consensus updated the criteria to define sepsis and septic shock in children, introducing the Phoenix Sepsis Score, thus supporting global collaborative efforts to identify and treat this complex clinical entity in this at-risk population. There are few publications that address the role of the anesthesiologist in the management of pediatric patients with sepsis or septic shock. The present review aims to be an approach for the anesthesiologist who faces these patients, assuming an active role as a member of a multidisciplinary team, which ensures the adequate management of local resources, application of monitoring and advanced perioperative therapies, along with adherence to specific updated protocols; all essential elements to improve outcomes for this vulnerable population.
Resumen
El shock séptico pediátrico sigue siendo una de las causas más importantes de morbimortalidad a nivel mundial. En el año 2024, un consenso internacional actualizó los criterios para definir la sepsis y el shock séptico en niños, introduciendo el Phoenix Sepsis Score, apoyando de esta forma los esfuerzos colaborativos a nivel mundial para identificar y tratar esta compleja entidad clínica en esta población de riesgo. Existen escasas publicaciones que aborden el rol del anestesiólogo en el manejo de pacientes pediátricos cursando sepsis o shock séptico. La presente revisión pretende ser una aproximación para el anestesiólogo que se enfrenta a estos pacientes, asumiendo un rol activo como miembro de un equipo multidisciplinario, que vele por la adecuada gestión de los recursos locales, aplicación de monitorización y terapias avanzadas perioperatorias, junto a la adherencia de protocolos específicos actualizados; todos elementos esenciales para mejorar los resultados de esta población vulnerable.
-
Introducción
La sepsis continúa siendo una de las causas más importantes de morbimortalidad en la población pediátrica. En países de ingresos altos, se estima que su prevalencia es de alrededor de 10%, pudiendo alcanzar cifras hasta tres veces mayor en países de ingresos bajos[1]. El riesgo de desarrollar sepsis durante los primeros años de vida supera al de cualquier otro grupo etario. Durante el año 2017, se estimó que 25 millones de niños experimentaron sepsis en todo el mundo, lo que provocó más de tres millones de muertes[1]. La mortalidad en pacientes con shock séptico que ingresan a unidades de cuidados intensivos pediátricos varía entre 17% a 23%[2],[3],[4]. Muchos de los sobrevivientes, experimentan secuelas físicas, cognitivas, emocionales y psicológicas que pueden afectar a largo plazo al paciente o al grupo familiar. La Organización Mundial de la Salud (OMS) ha realizado un llamado a realizar esfuerzos en la identificación de niños con riesgo de sepsis y alta probabilidad de mortalidad, siendo prioritario el reconocimiento precoz, diagnóstico y manejo oportuno[4],[5]. El desarrollo de las directrices actuales para el manejo del paciente pediátrico con shock séptico apunta a un enfoque multidisciplinario y continuo, abordando el proceso hospitalario en su totalidad, considerando unidades de emergencia infantil, unidades críticas y quirófano. Existe escasa evidencia acerca del rol del anestesiólogo en el manejo de pacientes con shock séptico pediátrico y sus escenarios clínicos; pero con la mirada actual es relevante incorporarlo ya que su rol activo tendrá impacto en la morbimortalidad en los diferentes momentos de atención en que se verá enfrentado, como: manejo avanzado de la vía aérea, instalación de accesos venosos centrales o periféricos, quirófano de urgencia y múltiples intervenciones en diferentes estadios de la enfermedad. La presente revisión pretende ser una aproximación para el anestesiólogo general frente al paciente séptico pediátrico, asumiendo una participación activa como miembro de un equipo multidisciplinario, haciendo énfasis en el reconocimiento precoz, manejo individualizado y la adecuada gestión de los recursos locales, todos elementos esenciales para mejorar los resultados de esta población vulnerable.
-
Metodología
Se realizó una búsqueda sistemática de la literatura en las bases de datos PubMed, Cochrane Library, SciELO y Science Citation Index Expanded. Se utilizaron las siguientes palabras clave: “sepsis”, “septic shock”, “pediatrics”, “anesthesiology”, “perioperative management”, combinadas con operadores booleanos. La búsqueda se limitó a artículos publicados entre 2014 y 2024, en inglés y español. Adicionalmente, se incluyeron seis artículos seminales fuera del rango de búsqueda por su impacto y valor en citas. Se seleccionaron revisiones sistemáticas, metaanálisis, ensayos clínicos, estudios observacionales y guías de práctica clínica.
Se excluyeron reportes de casos, cartas al editor y artículos de opinión, además del segmento etario correspondiente a neonatología. En total, se incluyeron 39 artículos que fueron incorporados en esta revisión narrativa.
-
Epidemiología
La sepsis continúa siendo una de las causas más importantes de morbimortalidad en la población pediátrica. En países de ingresos altos, se estima que su prevalencia es de alrededor de 10%, pudiendo alcanzar cifras hasta tres veces mayor en países de ingresos bajos[1]. El riesgo de desarrollar sepsis durante los primeros años de vida supera al de cualquier otro grupo etario.
Durante el año 2017, se estimó que 25 millones de niños experimentaron sepsis en todo el mundo, lo que provocó más de tres millones de muertes[1]. La mortalidad en pacientes con shock séptico que ingresan a unidades de cuidados intensivos pediátricos varía entre 17% a 23%[2],[3],[4]. Muchos de los sobrevivientes, experimentan secuelas físicas, cognitivas, emocionales y psicológicas que pueden afectar a largo plazo al paciente o al grupo familiar.
La Organización Mundial de la Salud (OMS) ha realizado un llamado a realizar esfuerzos en la identificación de niños con riesgo de sepsis y alta probabilidad de mortalidad, siendo prioritario el reconocimiento precoz, diagnóstico y manejo oportuno[4],[5].
El desarrollo de las directrices actuales para el manejo del paciente pediátrico con shock séptico apunta a un enfoque multidisciplinario y continuo, abordando el proceso hospitalario en su totalidad, considerando unidades de emergencia infantil, unidades críticas y quirófano.
Existe escasa evidencia acerca del rol del anestesiólogo en el manejo de pacientes con shock séptico pediátrico y sus escenarios clínicos; pero con la mirada actual es relevante incorporarlo ya que su rol activo tendrá impacto en la morbimortalidad en los diferentes momentos de atención en que se verá enfrentado, como: manejo avanzado de la vía aérea, instalación de accesos venosos centrales o periféricos, quirófano de urgencia y múltiples intervenciones en diferentes estadios de la enfermedad.
La presente revisión pretende ser una aproximación para el anestesiólogo general frente al paciente séptico pediátrico, asumiendo una participación activa como miembro de un equipo multidisciplinario, haciendo énfasis en el reconocimiento precoz, manejo individualizado y la adecuada gestión de los recursos locales, todos elementos esenciales para mejorar los resultados de esta población vulnerable.
-
¿Cuáles son los criterios actuales en pediatría para sepsis y shock séptico?
Sepsis se define como una infección asociada a una disfunción orgánica potencialmente mortal, causada por una respuesta desregulada del huésped frente a un patógeno. Esto implica una respuesta cardiovascular, inmunológica, metabólica y hormonal compleja, junto a la activación de fenómenos de la coagulación y mediadores inflamatorios[2],[8].
El año 2016, la Tercera Conferencia Internacional de Consenso sobre Sepsis y Shock Séptico (Sepsis-3) en adultos[8] modificó el concepto de sepsis, desde infección no controlada a la presencia de disfunción orgánica potencialmente mortal, causada por una respuesta no regulada del huésped frente a un patógeno. Además, estableció para su identificación precoz, el uso del score SOFA (por sus siglas en inglés, Sequential Organ Failure Assesment Score), considerando la presencia de al menos dos puntos en pacientes con sospecha de infección. También, definió shock séptico, en pacientes con sepsis y requerimientos de vasopresores para mantener una presión arterial media (PAM) mayor o igual a 65 mmHg y un nivel de lactato sérico mayor o igual a 2 mmol/L en ausencia de hipovolemia.
En la población pediátrica en particular, desde el año 2005 y hasta el 2024, estaban vigentes los criterios publicados en la Conferencia Internacional de Consenso sobre Sepsis Pediátrica (IPSCC)[9] que incluyen, sepsis como confirmación o sospecha de infección en paciente con presencia de síndrome de respuesta inflamatoria sistémica (SIRS); Sepsis grave, como sepsis con presencia de disfunción cardiovascular o del sistema respiratorio o de al menos otros dos sistemas y finalmente, shock séptico, como sepsis con presencia de hipotensión, requerimiento de drogas vasoactivas o evidencia de alteración de la perfusión periférica a pesar de reanimación con fluidos y uso de al menos 40 ml/kg de cristaloides.
Los criterios IPSCC demostraron ciertas limitaciones tales como, la inclusión de una gran cantidad de niños con enfermedad leve y no identificaron de manera precoz ni confiable a los niños que presentaron una infección con mayor riesgo, existiendo, además, variabilidad en la aplicación de éstos en distintos escenarios clínicos[10],[11]. Por esta razón, fue necesario volver a mirar la definición en pediatría, en concordancia con el llamado de la OMS. Es así como, en el año 2024, el grupo de trabajo de Sepsis de la Society of Critical Care Medicine (SCCM), que incluyó la participación de 35 médicos y enfermeras expertos, actualizó los criterios para definir sepsis y el shock séptico en niños, introduciendo el Phoenix Sepsis Score (Tabla 1), para niños menores de 18 años a excepción de los recién nacidos o neonatos con una edad postconcepcional menor de 37 semanas; teniendo como objetivo una aproximación operacional, sensible y específica, que permita la identificación temprana de pacientes en riesgo y la implementación de intervenciones adecuadas[1].
La innovación clave de este consenso fue la adopción de una escala basada en medidas validadas de disfunción orgánica como criterios para evaluar el riesgo de sepsis y shock séptico en niños. Una puntuación de al menos dos puntos en el score identificó una disfunción potencialmente mortal en los sistemas respiratorio, cardiovascular, de coagulación y/o neurológico, en niños con infección sospechada.
Este cambio metodológico representa una evolución respecto a los criterios previos que se apoyaban en el SIRS y la categoría de sepsis severa, ahora considerados redundantes ya que la sepsis implica por definición una disfunción orgánica potencialmente mortal asociada a infección, denotando así una condición médica grave.
El shock séptico pediátrico, bajo estos nuevos lineamientos, se especifica como sepsis con disfunción cardiovascular, evidenciada por al menos un punto en la componente cardiovascular del Phoenix Sepsis Score[1]. Este criterio abarca la hipotensión severa ajustada por edad, niveles de lactato sanguíneo superiores a 5 mmol/L o la necesidad de fármacos vasoactivos. La finalidad de esta actualización es ofrecer un estándar globalmente relevante, fundamentado en una amplia base de datos internacionales y un enfoque consensuado, para potenciar la atención clínica, la evaluación epidemiológica y la investigación sobre la sepsis y el shock séptico pediátrico a nivel mundial.
Además, se destaca que los niños con sepsis que manifiestan disfunción de órganos distantes al sitio de infección presentan un mayor riesgo de muerte, lo que indica procesos sistémicos subyacentes potencialmente mortales[1]. Los criterios de Phoenix incluyen tanto a niños con disfunción de órganos limitada al órgano infectado primariamente, como a aquellos cuyos puntajes indican disfunción de órganos distantes al sitio primario de infección. Cabe destacar que, aquellos niños con sepsis y disfunción de órganos diferentes al sitio de infección primaria, incluyendo casos de shock séptico y disfunción multiorgánica, representan un subconjunto importante y distinto, con tasas de mortalidad del 8,0% y 32,3% en contextos de mayor y menor recursos, respectivamente[1]. En contraste, niños con una puntuación Phoenix de al menos 2 y disfunción de órganos limitada al sitio de infección primaria mostraron una mortalidad de 1,7% y 6,1% en contextos de mayor y menor recursos, respectivamente.
Estos criterios reflejan un esfuerzo colaborativo y basado en evidencia para avanzar en la prevención, el diagnóstico y el tratamiento de la sepsis en la población pediátrica a nivel mundial, reconociendo la complejidad de esta condición en niños y la necesidad de un abordaje específico que mejore los resultados clínicos. Cabe destacar, que no fueron diseñados como herramienta para una detección precoz de niños con sepsis o shock séptico, quedando como tarea pendiente su desarrollo manteniendo los lineamientos del consenso de Phoenix.
-
¿Qué importancia tiene el reconocimiento precoz y los sistemas de alerta temprana?
El reconocimiento temprano y la intervención oportuna en casos de sepsis y shock séptico pediátrico son fundamentales para mejorar el pronóstico en esta población. Los sistemas de alerta pediátrica temprana (PEWS, por sus siglas en inglés) facilitan la identificación precoz del deterioro fisiológico en pacientes hospitalizados, permitiendo así intervenciones tempranas decisivas. A pesar de los desafíos asociados con su implementación, incluyendo la variabilidad en el diseño y la falta de consenso sobre los parámetros óptimos, la adopción de PEWS como parte de un paquete de intervenciones integrales ha demostrado mejorar los resultados clínicos[12],[13]. Estos incluyen, un “paquete de reconocimiento” con herramientas de activación rápida para la identificación de sepsis, un “paquete de reanimación y estabilización” para adherirse a las mejores prácticas, y un “paquete de desempeño” para superar barreras en la atención[12],[14]. Este enfoque integrado, que combina la evaluación clínica, con la implementación de protocolos estandarizados, es esencial para el manejo efectivo de la sepsis y el shock séptico.
Los conocimientos a partir de Sepsis – 3 otorgaron ciertas directrices en el desarrollo de criterios para el reconocimiento temprano en la población pediátrica, sin embargo, la sepsis en niños tiene diferencias importantes respecto a los adultos, lo que hace difícil su reconocimiento, destacando diferencias epidemiológicas y fisiopatológicas, así como, la variabilidad de signos vitales específicos según grupo etario. El estudio Andrómeda-Shock[15], realizado en población adulta, evidenció la importancia de la evaluación de la perfusión periférica en pacientes con shock, lo cual resulta extrapolable a la población pediátrica, por lo cual, la evaluación del llene capilar es de gran relevancia. La mayoría de los niños debutan con taquicardia sin hipotensión, debido a la eficacia de los mecanismos fisiológicos compensatorios. La hipotensión es más bien un signo tardío y de mal pronóstico. Sin embargo, a diferencia del adulto, el compromiso cardiovascular puede manifestarse precozmente, lo que se conoce como “shock frío”, caracterizado por extremidades frías, alteración cualitativa de conciencia, llene capilar enlentecido, respuesta miocárdica disminuida y alta resistencia vascular sistémica (RVS), presente en alrededor del 60% de los casos[17],[18]. Esta entidad difiere notablemente del “shock caliente”, con una prevalencia del 20%[18], más comúnmente observado en adultos, con una resistencia vascular sistémica baja y taquicardia. Estas diferencias subrayan la necesidad de un enfoque específico para el diagnóstico precoz de la sepsis en la población pediátrica, haciendo especial énfasis en la evaluación del llene capilar y la presencia de taquicardia como signos precoces en la evaluación del paciente pediátrico con shock séptico[12].
| Tabla 1. Criterios de Phoenix | |||
| Sistema/condición y valor | Puntos | Vasoactivo | Lactato |
| Respiratorio: | |||
| PaO2/FiO2 > 400 | 0 | – | – |
| SpO2/FiO2 > 292 sin soporte respiratorio | 0 | – | – |
| PaO2/FiO2 < 400 con soporte respiratorio | 1 | – | – |
| SpO2/FiO2 < 292 con soporte respiratorio | 1 | – | – |
| PaO2/FiO2 100-200 con VMI | 2 | – | – |
| SpO2/FiO2 142-200 con VMI | 2 | – | – |
| PaO2/FiO2 < 100 con VMI | 3 | – | – |
| SpO2/FiO2 < 148 con VMI | 3 | – | – |
| Cardiovascular por Edad: | |||
| < 1 mes: | |||
| PAM > 30 | 0 | Sin vasoactivo | < 5 |
| PAM 17-30 | 1 | 1 vasoactivo | 5,1-9,9 |
| PAM < 17 | 2 | > 2 vasoactivos | > 11 |
| 1 a 11 meses: | |||
| PAM > 38 | 0 | Sin vasoactivo | < 5 |
| PAM 25-38 | 1 | 1 vasoactivo | 5,1-9,9 |
| PAM < 25 | 2 | > 2 vasoactivos | > 11 |
| 1 a < 2 años: | |||
| PAM > 43 | 0 | Sin vasoactivo | < 5 |
| PAM 31-43 | 1 | 1 vasoactivo | 5.1-9.9 |
| PAM < 31 | 2 | > 2 vasoactivos | > 11 |
| 2 a < 5 años: | |||
| PAM > 44 | 0 | Sin vasoactivo | < 5 |
| PAM 32-44 | 1 | 1 vasoactivo | 5,1-9,9 |
| PAM < 32 | 2 | > 2 vasoactivos | > 11 |
| 5 a < 12 años: | Sin vasoactivo | ||
| PAM > 48 | 0 | < 5 | |
| PAM 36-48 | 1 | 1 vasoactivo | 5.1-9.9 |
| PAM < 36 | 2 | > 2 vasoactivos | > 11 |
| 12 a 17 años: | |||
| PAM > 51 | 0 | Sin vasoactivo | < 5 |
| PAM 38-51 | 1 | 1 vasoactivo | 5,1-9,9 |
| PAM < 38 | 2 | > 2 vasoactivos | > 11 |
| Coagulación: | |||
| Plaquetas > 100 x 10A3/uL | 0 | – | – |
| INR < 1,3 | 0 | – | – |
| Dímero D < 2 mg/L FEU | 0 | – | – |
| Fibrinógeno > 100 mg/dL | 0 | – | – |
| Plaquetas < 100 x 10A3/uL | 1 | – | – |
| INR > 1,3 | 1 | – | – |
| Dímero D > 2 mg/L FEU | 1 | – | – |
| Fibrinógeno < 100 mg/dL | 1 | – | – |
| Neurológico: | |||
| Escala de coma de Glasgow > 10; pupilas reactivas | 0 | – | – |
| Escala de coma de Glasgow < 10 | 1 | – | – |
| Pupilas fijas bilateralmente | 2 | – | – |
| Criterios de Sepsis Phoenix: | |||
| Sospecha de infección y Phoenix > 2 puntos | Sepsis | – | – |
| Sepsis con > 1 puntos en cardiovascular | Shock séptico | – | – |
Modificado a español de Schlapbach LJ, Watson RS, Sorce LR, Argent AC, Menon K, Hall MW, et al. International Consensus Criteria for Pediatric Sepsis and Septic Shock. JAMA [Internet]. 27 de febrero de 2024;331(8):665. Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2814297
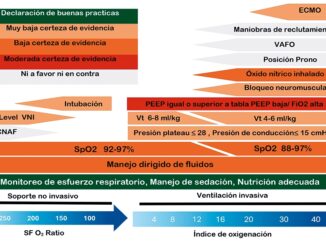
Se presenta en la Figura 1 un algoritmo para el reconocimiento precoz en sepsis pediátrica.
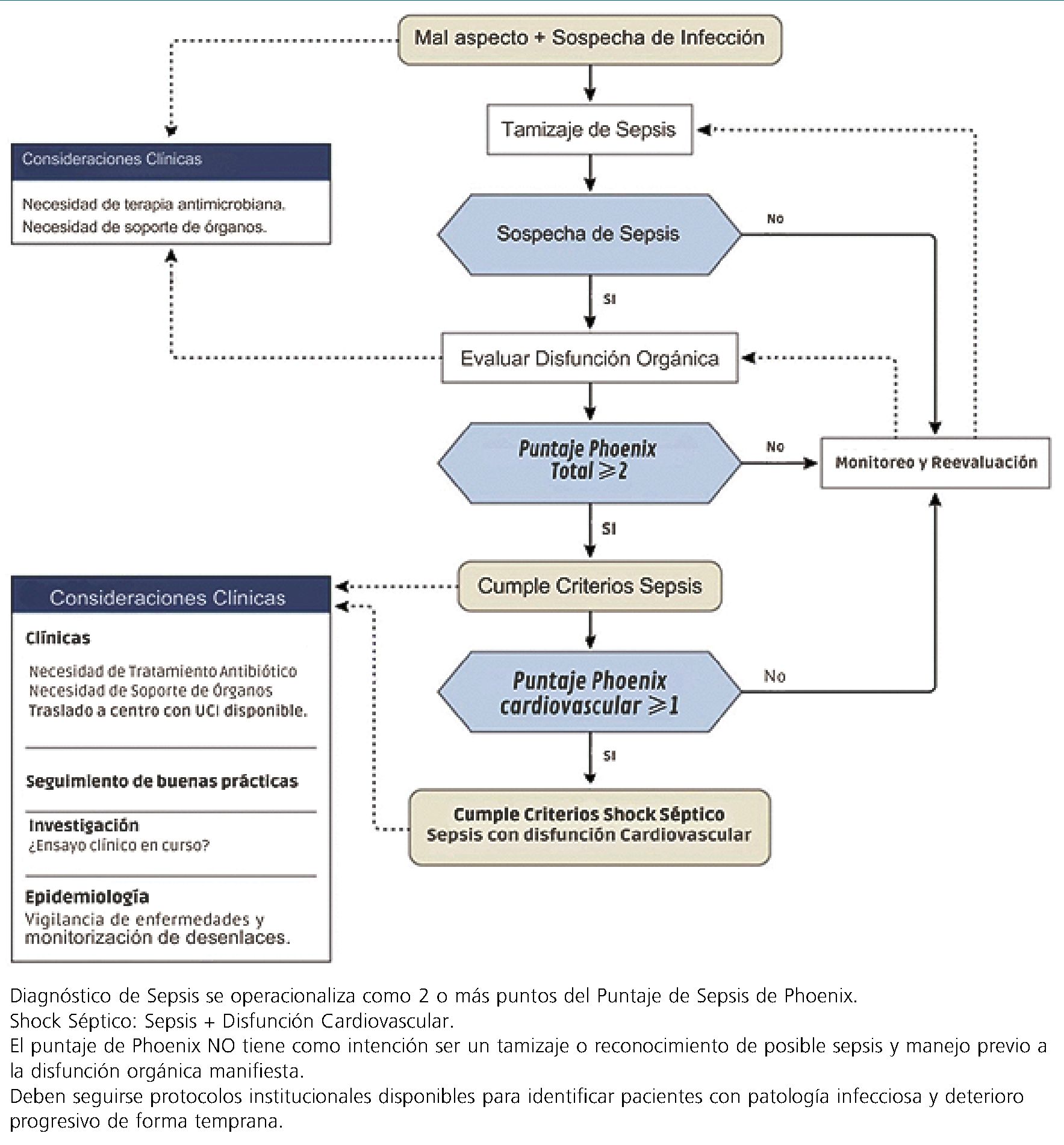
Figura 1. Algoritmo de reconocimiento Según Criterios de Severidad de Sepsis Phoenix. Modificado a español de Schlapbach LJ, Watson RS, Sorce LR, Argent AC, Menon K, Hall MW, et al. International Consensus Criteria for Pediatric Sepsis and Septic Shock. JAMA [Internet]. 27 de febrero de 2024;331(8):665. Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2814297
-
Anestesia y sepsis en pediatría
En la realidad nacional, por diversos factores sociosanitarios, generalmente el enfrentamiento inicial de los pacientes pediátricos con shock séptico se realiza en servicios de urgencia o en unidades de medicina crítica pediátrica, en los cuales la presencia del anestesiólogo es más infrecuente, a pesar de la tendencia actual de la especialidad hacia un enfoque de medicina crítica perioperatoria. En consecuencia, el anestesiólogo rara vez se verá enfrentado al manejo de estos pacientes dentro de la hora inicial. Por tanto, su rol dependerá del momento en el que el equipo multidisciplinario lo convoque.
La presencia de shock séptico en el perioperatorio responde a etiologías tanto de resolución quirúrgicas como médicas, siendo estas últimas más frecuentes en pacientes hospitalizados. Por lo cual, el anestesiólogo puede verse expuesto a diversos escenarios clínicos, dentro y fuera de pabellón, tales como el manejo avanzado de la vía aérea, instalación de acceso venoso central o periférico, cirugía de urgencia y diversos procedimientos o cirugías electivas, entre otros.
-
Monitorización perioperatoria
La monitorización perioperatoria será acorde al estándar de la American Society of Anesthesiologist (ASA) y debe ser individualizada al contexto del paciente, según la gravedad de la presentación clínica, la respuesta a la terapia y la magnitud de la cirugía o procedimiento a realizar. Los pacientes respondedores a fluidos pueden tratarse con monitorización no invasiva y laboratorio general, mientras que aquellos que requieren soporte vasoactivo y/o presenten refractariedad, se sugiere utilizar variables hemodinámicas avanzadas. La monitorización ecocardiográfica resulta de utilidad para evaluar la función miocárdica, respuesta a fluidos, evaluar la anatomía, causas reversibles de shock y signos de hipertensión pulmonar, entre otros. Así como el uso precoz de espectroscopia cercana al infrarrojo (NIRS, por sus siglas en inglés) para guiar el soporte hemodinámico en niños con sepsis severa y/o shock séptico refractario como se detalla más adelante[16].
También se sugiere usar tendencias en los niveles de lactato seriado junto al análisis simultáneo de parámetros sensibles a flujo, tales como; saturación venosa central de oxígeno (SvO2), gradiente de CO2 venoso central-arterial y la perfusión periférica (Figura 2). Reconocer un patrón clínico de hiperlactatemia asociado a hipoperfusión tisular es importante ya que optimizar el flujo sanguíneo sistémico en ese contexto podría mejorar el pronóstico[15].
Las tecnologías de monitoreo hemodinámico avanzadas, incluidos sistemas de obtención de gasto cardíaco (GC) por análisis del contorno de la onda de pulso (PiCCO por sus siglas en inglés) cumplen un rol en el manejo del shock séptico pediátrico, sin embargo, constituyen una herramienta de mayor disponibilidad en unidades de cuidados críticos pediátricos. En anestesiología, cobra mayor relevancia la integración de la ecocardiografía, especialmente a través del enfoque de ultrasonido cardíaco focalizado (FoCUS), dado su sostenido desarrollo en la especialidad y su disponibilidad, aportando información relevante durante todo el perioperatorio. Estas evaluaciones permiten obtener información en tiempo real del GC, el estado del volumen intravascular y la oxigenación de los tejidos[13],[19],[20].
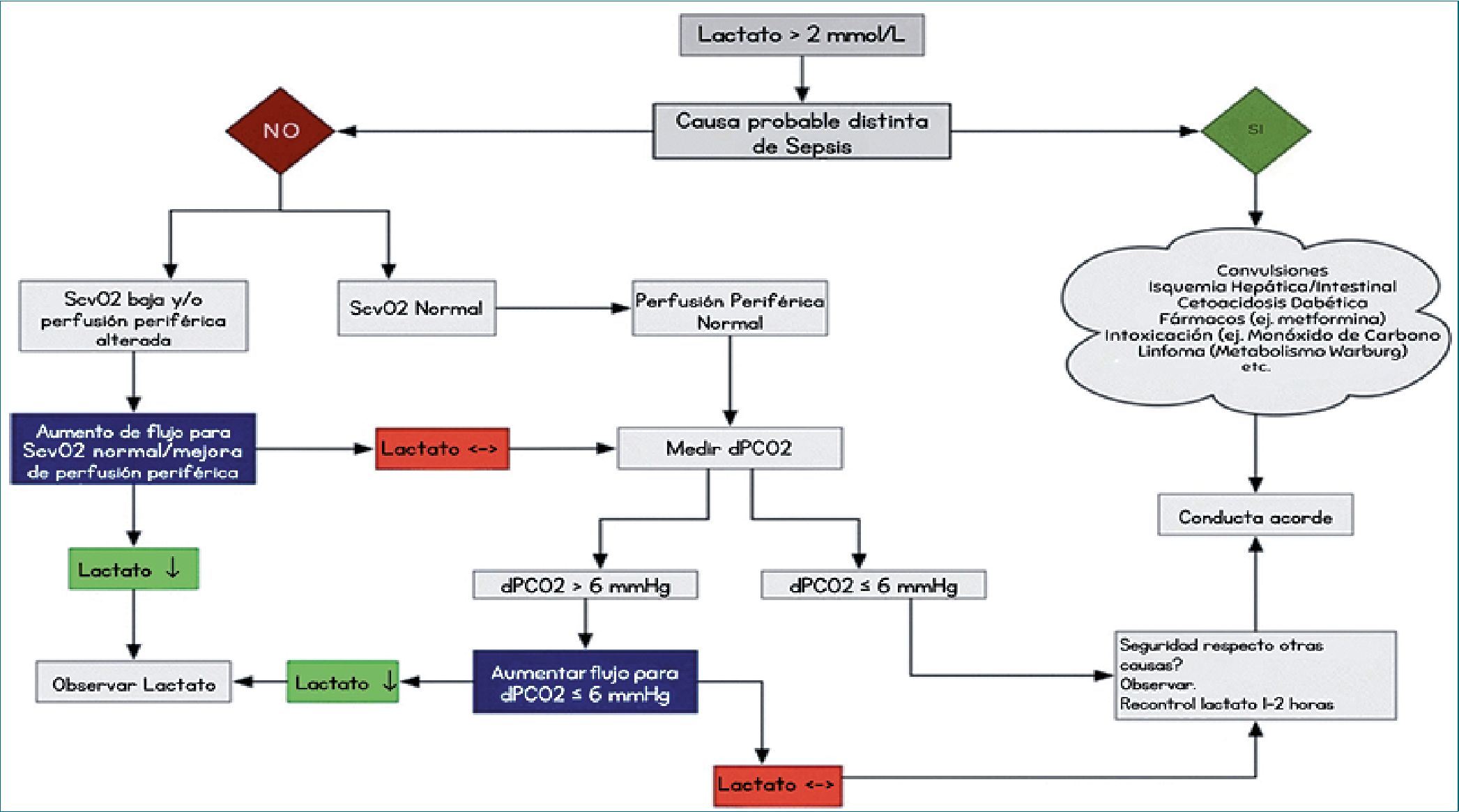
Figura 2. Consideraciones Respecto al Barrido (“Clearance”) de Lactato. ScvO2: oxigenación de hemoglobina venosa central; dPCO2: diferencia central veno-arterial de PCO2.[30]. Modificado a español de Hernández G, Bellomo R, Bakker J. The ten pitfalls of lactate clearance in sepsis. Intensive Care Med [Internet]. enero de 2019 [citado 8 de abril de 2024];45(1):82-5. Disponible en: http://link.springer.com/10.1007/s00134-018-5213-x
-
Aplicación de FoCUS en sepsis pediátrica
En el contexto perioperatorio, el FoCUS, no reemplaza la ecocardiografía realizada por un cardiólogo pediátrico, sino más bien, es una herramienta que pretende ser dirigida, orientada a un problema, con un objetivo limitado, simple, rápida, repetible, cualitativa o semicuantitativa y realizada durante la atención por el clínico[18]. Este examen no está orientado a la evaluación de pacientes con cardiopatías congénitas. Sus indicaciones más frecuentes son, hipotensión de etiología no precisada, taquicardia, causas reversibles de paro cardiorrespiratorio y como guía de diagnóstico de las causas de shock[19],[20],[21]. Existen reportes de cambios en el manejo, entre 30%-60% de los casos, luego de realizar FoCUS[19] en pacientes con shock séptico pediátrico.
En shock séptico, aproximadamente el 50% de los pacientes son refractarios a terapia con volumen[16],[20], por lo cual se debe tener claridad en qué aportar, cuánto y hasta qué momento. Si se define la condición de refractariedad a fluidos, se debe analizar el mejor perfil de drogas vasoactivas o inótropos, según su presentación. Se ha descrito que 66% de los pacientes que cursan con shock frío, según operadores expertos, presentan vasodilatación en el monitoreo hemodinámico avanzado. Por lo tanto, debemos integrar otras variables dentro de la monitorización[15],[16].
El FoCUS en pediatría se realiza con transductor sectorial y las ventanas básicas incluyen: Subcostal con visión de vena cava inferior (SIVC), (Figura 3), Subcostal 4 cámaras (S4CH), apical de 4 cámaras (A4CH), paraesternal eje corto (PSAX) (a nivel de músculos papilares) y eje largo (PLAX).
Para el anestesiólogo, es importante evaluar los siguientes aspectos utilizando estas ventanas:
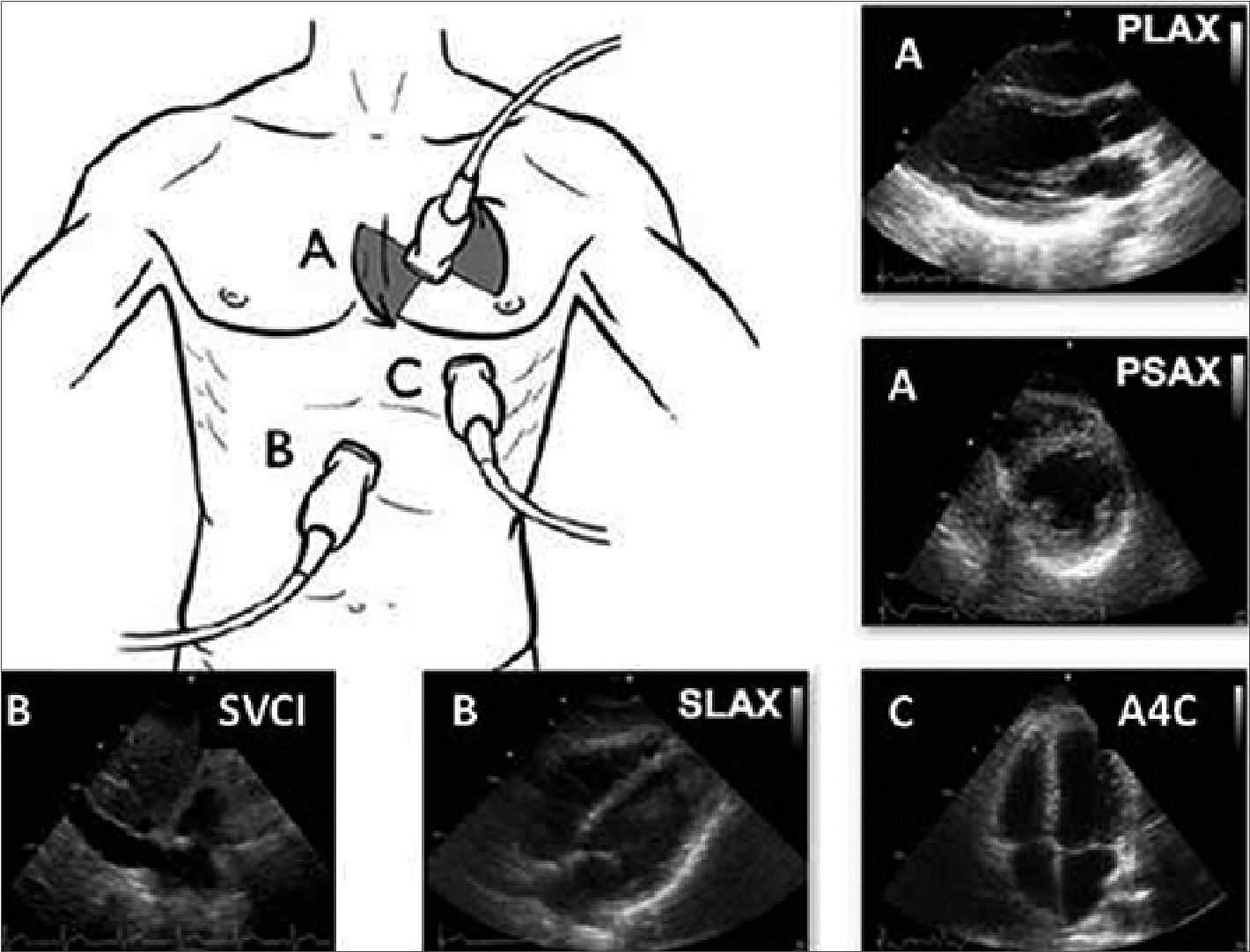
Figura 3. Ventanas y hallazgos en FoCUS. A) ventana paraesternal. PLAX: paraesternal eje largo, PSAX, paraesternal eje corto; B) ventaba subcostal; SVCI, subcostal vena cava inferior; SLAX, subcostal eje largo (también llamado subcostal 4 cámaras); C) ventana apical; A4C, apical 4 cámaras[20].
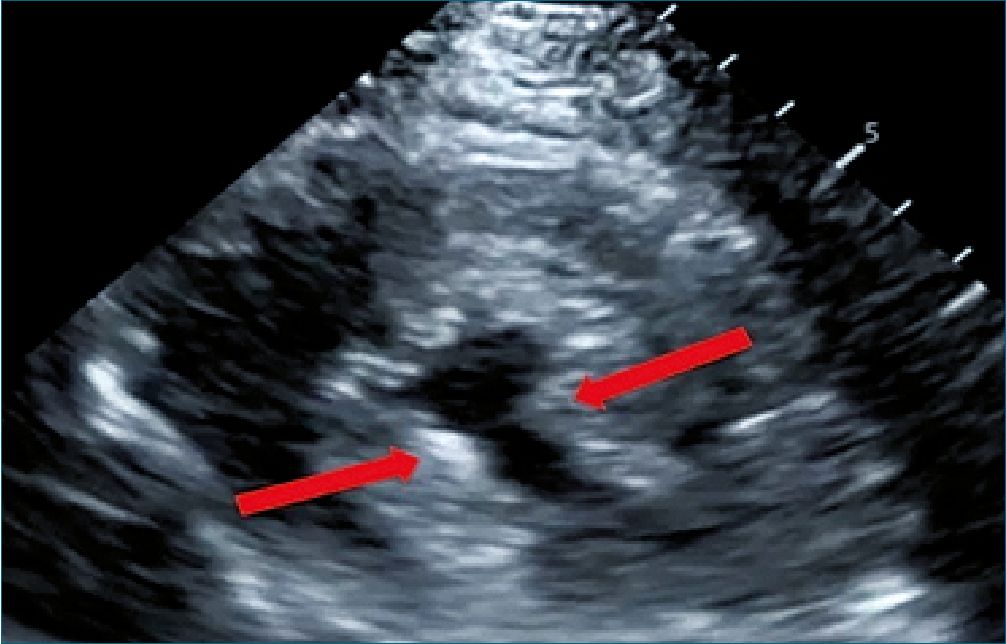
Figura 4. Eje corto paraesternal. Ventrículo izquierdo con colapso sis- tólico, con signo de los músculos papilares besándose como indica la flecha roja[20].
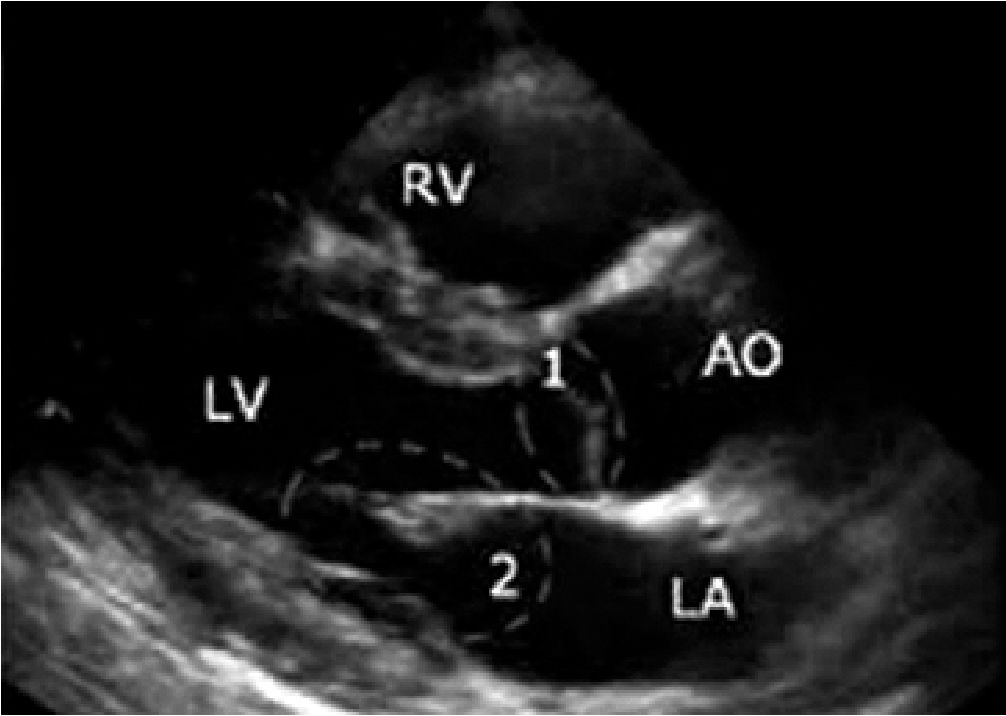
Figura 5. Eje largo paraesternal. 1: Válvula Aortica; 2: Válvula mitral. Se observa contacto del velo anterior de la válvula con el septum, signo de hipovolemia[20].
-
Evaluación de la precarga y respuesta a fluidos
La evaluación de la precarga se puede realizar en S4CH o A4CH. La presencia de un ventrículo derecho vacío y un ventrículo izquierdo hiper dinámico con colapso sistólico apoya el diagnóstico de hipovolemia[20].
Además, en PSAX, la presencia del signo de los músculos papilares “besándose” o en PLAX (Figura 4), el contacto de velo anterior de la válvula mitral con el septum (Figura 5), apoyan la presencia de hipovolemia en contexto de sepsis, por lo cual está indicado la administración de fluidos guiado por metas. Debemos considerar que estos parámetros también dependen de la postcarga, motivo por el cual, a menor postcarga pueden presentarse incluso en ausencia de hipovolemia.
En SIVC, el tamaño y la colapsabilidad dinámica de la vena cava inferior (VCI) son indicadores que pueden orientar hacia estado de la precarga. El colapso de la VCI o una variabilidad respiratoria > 50% en el diámetro máximo pueden correlacionarse con un estado de respuesta a los líquidos en niños. El diámetro máximo se evalúa durante la espiración en niños que ventilan espontáneamente y durante la inspiración en niños con ventilación mecánica. En pediatría, extrapolado de la evidencia en adultos, presenta mayor uso el índice de distensibilidad de vena cava inferior (mayor o igual al 18%), para evaluar respuesta a terapia. Cabe destacar, que existen otras variables que pueden generar colapsabilidad dinámica de la VCI, en ausencia de hipovolemia, como es el caso de la hipertensión intrabdominal. Por lo tanto, la evaluación debe ser interpretada en un contexto y no de forma aislada.
-
Función ventricular izquierda
La evaluación del ventrículo izquierdo (VI) se obtiene a través de una visión S4CH, A4CH y en PSAX. Permite medir la función sistólica, derrame pericárdico y el tamaño de las cámaras. La función sistólica del VI puede sobreestimarse según el grado de vasoplejia que presente el paciente, por lo cual, debemos considerarlo al momento de realizar la evaluación de la función miocárdica.
Las causas más frecuentes de deterioro corresponden a miocarditis, isquemia y depresión miocárdica en shock séptico[20].
La disfunción del VI se clasifica en: normal – supra normal – ligeramente deprimida -claramente deprimida.
La disfunción miocárdica es común en el shock séptico pediátrico y se asocia con una mayor mortalidad. La identificación temprana puede guiar el inicio oportuno de inotrópos[20].
-
Función ventricular derecha
Para evaluar la función del ventrículo derecho (VD), el anestesiólogo deberá obtener una visión en A4CH, en la cual una relación VD/VI > 0,6 en niños mayores y > 1 en lactantes y neonatos (Figura 6), sugiere disfunción del VD.
La vista en eje corto paraesternal puede mostrar un tabique interventricular invertido en sístole hacia la izquierda. La vena cava inferior puede estar dilatada y el foramen oval presentar un shunt de derecha a izquierda. En dichos casos se debe descartar la presencia de tromboembolismo pulmonar, hipertensión pulmonar o neumotórax atensión[19],[20].
El uso de FoCUS en cuidados perioperatorios no está exenta de limitaciones. Se debe considerar que es una medida cualitativa y no cuantitativa a diferencia de la ecocardiografía 2D. La sobreestimación de la competencia ecográfica de un proveedor puede dar lugar a diagnóstico erróneo e interpretaciones inexactas y requiere de capacitación.
-
Aplicación de NIRS en sepsis pediátrica
Las variables fisiológicas no logran reflejar completamente la perfusión de órganos específicos al enfrentarse a un escenario clínico complejo en que la distribución del GC es desigual y la respuesta a fármacos vasoactivos puede ser impredecible. El desafío clínico se vuelve aún mayor al considerar que factores como PaCO2, PaO2, niveles de hemoglobina y condiciones que afectan el consumo de oxígeno pueden alterar la oxigenación cerebral independientemente del GC y la RVS[16].
Es aquí donde cobra relevancia el NIRS, el cual destaca como una estrategia complementaria y avanzada para la evaluación no invasiva de la perfusión orgánica mediante el uso de electrodos para medir la saturación venosa regional de oxígeno (rSO2), cerebral o somática[22]. Esto permite reflejar el equilibrio local entre el suministro y la demanda de oxígeno al mismo tiempo que ofrece una alternativa a la medición de ScVO2.
Su uso precoz y continuo en el perioperatorio es especialmente valioso y debiese incorporarse en el cuidado crítico de pacientes con sepsis o shock séptico al permitir guiar los esfuerzos de reanimación avanzada, pudiendo así detectar hipoxia tisular tempranamente[22].
Un nivel bajo 60% de rSO2 o un descenso significativo (más del 20% del basal), variabilidad de más de 10% entre lateralidad izquierda y derecha o una tendencia al descenso o al ascenso, son indicadores de perfusión tisular inadecuada y deben alertar al anestesiólogo[22].
-
Manejo del shock séptico pediátrico
El manejo óptimo del shock séptico pediátrico requiere un enfoque multidisciplinario y protocolizado[16], con el objetivo de restaurar la perfusión tisular, tratar la infección subyacente y brindar soporte. Las guías internacionales de la Campaña Sobrevivir a la Sepsis[6] proporcionan recomendaciones basadas en evidencia para el manejo de niños con shock séptico y disfunción orgánica asociada a sepsis.
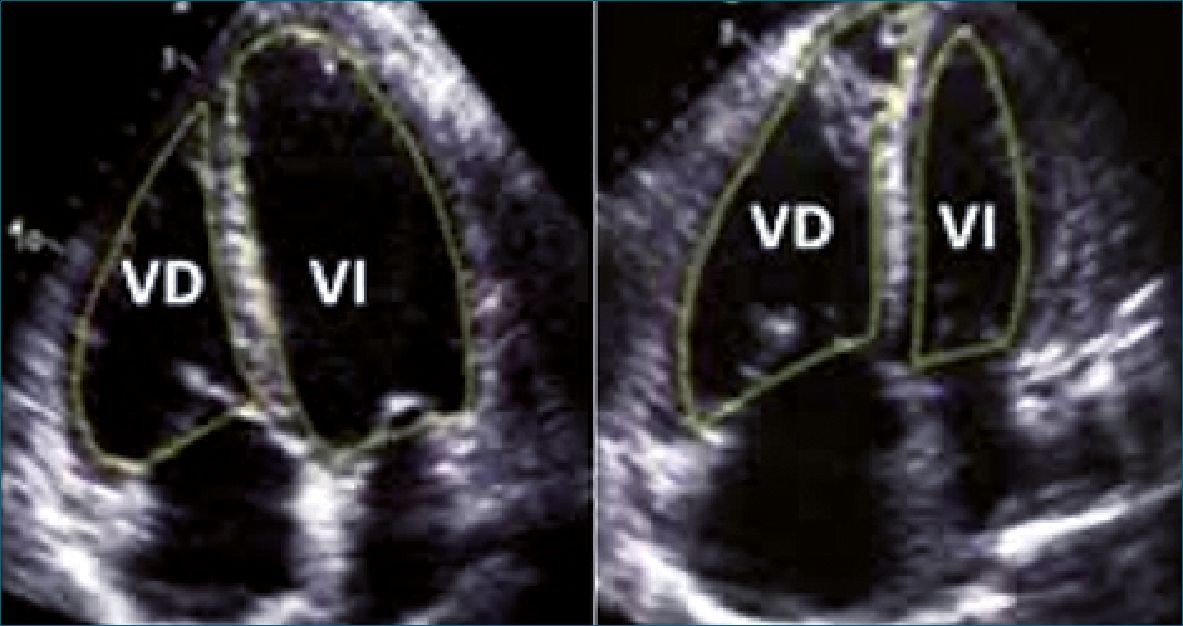
Figura 6. A la izquierda relación VD/VI > 0,6 en niños mayores; a la derecha relación VD/VI >1 en lactantes[19],[20].
-
Objetivos del manejo perioperatorio
El primer objetivo es realizar una correcta evaluación preoperatoria haciendo énfasis en el estado de reanimación actual y condiciones perioperatorias optimizables, considerando los exámenes de laboratorio, imágenes complementarias y tratamientos efectuados. Evaluar la presencia de un acceso vascular seguro (central o periférico), para finalmente establecer un plan anestésico individualizado.
Los objetivos de tratamiento son restaurar la perfusión tisu- lar, considerando la presión arterial acorde a la edad y el gasto cardíaco, corregir las anormalidades metabólicas e hidroelectrolíticas y prevenir la disfunción orgánica[2],[16],[23]. En ese sentido, cobra relevancia la medición seriada y aclaramiento de lactato sérico para mantener niveles menores o igual a 2 mmol/ dL, sumado a una diuresis mayor o igual a 1 ml/kg/h[24],[25]. Mantener la normotermia y optimizar la entrega de oxígeno tisular durante el período perioperatorio[2].
A estos objetivos de manejo enunciados previamente, debemos incorporar un traslado seguro desde y hacia las unidades de manejo, con una entrega estandarizada del paciente.
-
Acceso vascular
El acceso vascular en el paciente pediátrico con sepsis y shock séptico es difícil, entidad reconocida como DIVA[26]. Ante una situación de emergencia, sin acceso vascular, se debe establecer un acceso venoso seguro periférico y/o central, ante los requerimientos de uso de drogas vasoactivas (DVA). Si el acceso venoso no se encuentra disponible de inmediato, se debe considerar el acceso intraóseo[2].
Una vez finalizada la emergencia o ante procedimientos programados, se debe planificar la instalación del acceso vascular tanto arterial como venoso, cuidando el capital venoso, para lo cual se recomienda, el uso de ultrasonido en forma precoz y por el operador más calificado. Ambas consideraciones han demostrado disminuir el número de intentos y complicaciones.
-
Manejo de vía aérea avanzada
El paciente pediátrico que cursa con shock séptico en general requiere de un manejo avanzado de la vía aérea, se considera estómago lleno y con escasa reserva de oxígeno, lo que resulta en una vía aérea difícil fisiológica. En consecuencia, el anestesiólogo debe planificar el abordaje de la vía aérea, poniendo atención en el estado de reanimación actual, para realizar una correcta titulación de fármacos, una adecuada técnica de preoxigenación, intubación con técnica de secuencia rápida modificada y una extubación segura en caso de ser necesario[2].
El plan de manejo debe ser protocolizado a nivel institucional y conocido por todo el equipo. En este contexto, se recomienda el uso de videolaringoscopía con hoja adecuada según edad, para optimizar el primer intento de intubación[27].
-
Control de la infección
Se deben iniciar antibióticos empíricos de amplio espectro de manera precoz y adecuada, orientada según el foco de infección, dentro de la primera hora en caso de shock séptico o dentro de las primeras tres horas en caso de sepsis. En caso de realizar una cirugía, el anestesiólogo debe velar por la administración correcta y oportuna de los ntibióticos[6],[28],[29].
Además, es fundamental identificar y controlar quirúrgicamente el foco infeccioso a través de los medios menos invasivos y tan pronto como sea posible[6],[28]. El objetivo primordial no es la resolución definitiva, sino que la urgencia consiste en disminuir la carga bacteriana derivada de colecciones (abscesos, empiemas, entre otros), retiro de dispositivos invasivos responsables del origen de la infección o bien, el desbridamiento de tejidos comprometidos. En ese contexto, se recomienda el retiro de dispositivos de acceso intravascular los cuales hayan sido confirmados como causa de sepsis o shock séptico, después de que se haya establecido otro acceso vascular seguro y dependiendo tanto del patógeno como del balance riesgo beneficio del procedimiento a realizar[6],[28],[29].
-
Consideraciones farmacológicas
La sepsis puede alterar la farmacodinamia y farmacocinética en forma importante y se debe tener en cuenta en la elección del fármaco y su dosis para no causar efectos no deseados[2].
Durante el curso de un shock séptico, existe redistribución de flujo sanguíneo hacia territorios nobles, por lo cual se ve disminuido el flujo hacia la circulación enteral, piel y tejido muscular, entre otros. Por este motivo, no se recomienda el uso de fármacos vía oral o subcutánea ya que su absorción será lenta y errática. Igualmente, la distribución se verá afectada dado la alteración de la perfusión regional, alteración en la permeabilidad de membrana, disminución de proteínas plasmáticas, agua corporal y pH. En general, los fármacos utilizados en anestesiología se metabolizan a nivel hepático, aunque puede ocurrir también a nivel renal o pulmonar. En presencia de sepsis, el flujo sanguíneo hepático estará alterado, existe disfunción hepática, menor actividad intrínseca de hepatocitos y mayor fracción libre de droga. El metabolismo de primer y segundo paso hepático están alterados[2]. Además, la injuria renal en sepsis es frecuente, por tanto, la eliminación del fármaco no será normal.
Las consideraciones farmacológicas de uso habitual se exponen en la Tabla 2.
-
Fluidoterapia
En la primera hora de reanimación, se recomienda administrar bolos de cristaloides idealmente balanceados (10-20 ml/kg por bolo) hasta un máximo de 40-60 ml/kg, guiándose según marcadores clínicos, vigilando signos de sobrecarga como edema pulmonar o hepatomegalia[6],[30]. Si el paciente presenta patología o compromiso cardiovascular se debe administrar 5 a 10 ml/kg en 20 minutos. El uso de NaCl 0,9% en grandes cantidades puede generar hipercloremia y acidosis metabólica.
No se recomienda el uso rutinario de coloides[30],[31], en caso de requerir su uso, está indicado la utilización de albúmina[6]. El estudio ALBIOS[31], con un total de 1.818 pacientes con sepsis severa, randomizó dos grupos, uno de los cuales recibió albumina al 20% (para un objetivo de albúmina plasmática de 30 g/L o más) más cristaloides y el otro solo cristaloides. Los autores concluyeron que el reemplazo de albúmina más cristaloides no presenta beneficio, salvo en pacientes con enfermedad severa. Además, no mejora la sobrevida a 28 ni a 90 días.
| Tabla 2. Principales consideraciones para fármacos de uso habitual en anestesia durante el manejo de vía aérea avanzado o inducción anestésica | |
| Medicamento | Indicaciones |
| Ketamina | La dosis de inducción debe reducirse (0,25-0,5 mg/kg), administrarse lentamente y ajustarse según el efecto
La Ketamina es un depresor miocárdico directo. (En un niño con sepsis, sin reserva catecolaminérgica, la Ketamina puede causar una depresión cardiovascular profunda) El deterioro hepático puede prolongar los efectos de la Ketamina |
| Benzodiacepinas | La dosis de inducción debe reducirse (es decir, midazolam 0,05-0,1 mg/kg), ajustarse según el efecto y las infusiones deben administrarse con precaución
La disfunción hepática y renal prolonga los efectos Las concentraciones disminuidas de albúmina sérica pueden potenciar la respuesta La dosis debe reducirse y ajustarse según el efecto (fentanilo 0,5-2 ug/kg o morfina 0,025-0,05 mg/kg) |
| Opioides | Considerar el uso de opioides en combinación con otros agentes
La sepsis relacionada con la disminución del volumen de distribución prolonga los efectos La hipoperfusión hepática causa una disminución en la depuración de morfina y fentanilo. Considerar que la eliminación a nivel renal puede estar alterada El metabolismo del remifentanilo no cambia en la sepsis Considerar la administración de fármacos inotrópicos y vasopresores o líquidos para contrarrestar los efectos depresores cardiovasculares Precaución en el uso en pacientes con sepsis que tienen inestabilidad cardiovascular |
| Propofol | La dosis de inducción debe reducirse (0,5-1 mg/kg), administrarse lentamente y ajustarse según el efecto
El propofol puede causar una profunda depresión cardiovascular La inducción puede prolongarse secundariamente a la miocardiopatía inducida por sepsis Mayor riesgo de síndrome de infusión de Propofol. La dosis y duración de la infusión no deben exceder 4 mg/kg/h |
| Rocuronio | La disfunción hepática, la hipoalbuminemia, las anomalías electrolíticas, la acidosis y la hipotermia prolongan los efectos La duración impredecible de la acción en la sepsis requiere de monitoreo neuromuscular |
| Succinilcolina | Evitar su uso en niños con sepsis, hipotonía subyacente, lesión renal asociada con hiperkalemia, rabdomiólisis o inmovilidad prolongada
La sepsis puede resultar en una deficiencia adquirida de colinesterasa plasmática La duración impredecible de la acción requiere de monitoreo neuromuscular |
| Etomidato | No se recomienda su uso en inducción anestésica o manejo de vía aérea dado su potencial efecto de supresión adrenocortical |
Confeccionado a partir de O’Reilly HD, Menon K. Sepsis in paediatrics. BJA Educ [Internet]. febrero de 2021;21(2):51-8. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S2058534920301396
Por otro lado, La Campaña Sobrevivir a la Sepsis recomienda el uso de albúmina durante la reanimación de pacientes con sepsis severa o shock séptico que requieren grandes cantidades de cristaloides[6].
Se debe evitar el uso de almidones dado su potencial riesgo de injuria renal[6],[32].
-
Drogas vasoactivas (DVA)
En caso de no presentar respuesta clínica favorable, se recomienda iniciar uso de drogas vasoactivas si el shock persiste durante o después de la reanimación con fluidos, con epinefrina o norepinefrina como agentes de primera línea según el tipo de shock. Se debe considerar el uso de inodilatadores como milrinona o dobutamina en pacientes con disfunción miocárdica persistente a pesar de una adecuada reanimación con líquidos y vasopresores[6],[14] en conjunto a otras medidas de soporte y sistema de monitorización[14].
-
Drogas vasoactivas ¿Qué elegir?
La adrenalina es recomendada como el inótropo inicial en casos de shock frío pediátrico, dado sus potentes efectos inotrópicos y vasoconstrictores. Generalmente, se inicia en administración a dosis de 0,05-0,3 pg/kg/min. Es seguro su uso a través de un acceso periférico inicial y así, evitar el retraso de apoyo vasoactivo. Es importante monitorear de cerca el lugar de infusión periférica para detectar signos de infiltración o isquemia en caso de iniciar la terapia por esta vía. La noradrenalina se prefiere en casos de shock caliente, presentando un perfil de administración similar a la adrenalina. Aunque la dopamina se consideraba una opción, ya no es la primera línea debido a la evolución en la evidencia y práctica[6],[14].
-
Soporte inotrópico y vasopresor avanzado
En el manejo del shock séptico pediátrico, la elección y aplicación de inótropos es crucial para el soporte hemodinámico efectivo. Los niños con shock séptico presentan estados cardiovasculares complejos y dinámicos que requieren un enfoque detallado en la terapia inotrópica. Para casos que no responden a los inótropos iniciales, la selección de terapias subsecuentes se guía por una evaluación hemodinámica detallada, a menudo facilitada por la ecocardiografía o monitoreo invasivo. La vasopresina puede considerarse como terapia de rescate en shock caliente refractario a altas dosis de norepinefrina u otros simpaticomiméticos, aunque su uso rutinario como terapia adyuvante no está recomendado. La eficacia de la vasopresina en el shock séptico pediátrico sigue siendo incierta, lo que requiere una consideración cuidadosa de su uso en este contexto[14].
El estudio VASST[33] (Vasopressin and Septic Shock Trial), ensayo clínico multicéntrico, doble ciego, aleatorizado, incluyó 778 pacientes con shock séptico recibiendo una dosis de norepinefrina (NE) > 5 pg/min. Los pacientes fueron asignados a una infusión de vasopresina (VP) (0,01 a 0,03 U/min) o NE (5 a 15 pg/min). El desenlace primario del estudio fue mortalidad a 28 días. El grupo de autores no logró demostrar una reducción en la mortalidad con el empleo de VP, a pesar de que su administración se asoció a una reducción significativa en las dosis de NE (p < 0,001).
El análisis de un subgrupo definido a priori de pacientes menos graves (requerimiento de NE 5 a 14 pg/min al momento de la aleatorización), documentó que el grupo tratado con la combinación NE/VP, experimentó una reducción significativa de la mortalidad a 90 días en comparación al grupo que recibió solamente NE (35,8% vs 46,1%; p = 0,04). Por otra parte, la administración concomitante de VP y corticoides puede resultar en una interacción farmacodinámica y farmacocinética potencialmente beneficiosa. Estos hallazgos, derivados desde la población adulta, aportan sustento hacia el uso más precoz de VP acorde a la terapia individualizada.
El uso de milrinona, dobutamina y excepcionalmente levosimendán, están indicados en pacientes con shock y disfunción ventricular refractaria al uso de adrenalina como se indica en el algoritmo de manejo de pacientes pediátricos con shock séptico según tiempo de evolución (Figura 7).
En caso de shock séptico refractario a pesar del manejo óptimo, se pueden considerar terapias adicionales como la terapia de remplazo renal continua de alto flujo, plasmaféresis, y oxigenación por membrana extracorpórea venoarterial (ECMO VA) como última medida de rescate[14],[18].
-
Drogas vasoactivas (DVA)
En caso de no presentar respuesta clínica favorable, se recomienda iniciar uso de drogas vasoactivas si el shock persiste durante o después de la reanimación con fluidos, con epinefrina o norepinefrina como agentes de primera línea según el tipo de shock. Se debe considerar el uso de inodilatadores como milrinona o dobutamina en pacientes con disfunción miocárdica persistente a pesar de una adecuada reanimación con líquidos y vasopresores en conjunto a otras medidas de soporte y sistema de monitorización.
-
Drogas vasoactivas ¿Qué elegir?
La adrenalina es recomendada como el inótropo inicial en casos de shock frío pediátrico, dado sus potentes efectos inotrópicos y vasoconstrictores. Generalmente, se inicia en administración a dosis de 0,05-0,3 pg/kg/min. Es seguro su uso a través de un acceso periférico inicial y así, evitar el retraso de apoyo vasoactivo. Es importante monitorear de cerca el lugar de infusión periférica para detectar signos de infiltración o isquemia en caso de iniciar la terapia por esta vía. La noradrenalina se prefiere en casos de shock caliente, presentando un perfil de administración similar a la adrenalina. Aunque la dopamina se consideraba una opción, ya no es la primera línea debido a la evolución en la evidencia y práctica.
-
Soporte inotrópico y vasopresor avanzado
En el manejo del shock séptico pediátrico, la elección y aplicación de inótropos es crucial para el soporte hemodinámico efectivo. Los niños con shock séptico presentan estados cardiovasculares complejos y dinámicos que requieren un enfoque detallado en la terapia inotrópica. Para casos que no responden a los inótropos iniciales, la selección de terapias subsecuentes se guía por una evaluación hemodinámica detallada, a menudo facilitada por la ecocardiografía o monitoreo invasivo. La vasopresina puede considerarse como terapia de rescate en shock caliente refractario a altas dosis de norepinefrina u otros simpaticomiméticos, aunque su uso rutinario como terapia adyuvante no está recomendado. La eficacia de la vasopresina en el shock séptico pediátrico sigue siendo incierta, lo que requiere una consideración cuidadosa de su uso en este contexto.
El estudio VASST (Vasopressin and Septic Shock Trial), ensayo clínico multicéntrico, doble ciego, aleatorizado, incluyó 778 pacientes con shock séptico recibiendo una dosis de norepinefrina (NE) > 5 pg/min. Los pacientes fueron asignados a una infusión de vasopresina (VP) (0,01 a 0,03 U/min) o NE (5 a 15 pg/min). El desenlace primario del estudio fue mortalidad a 28 días. El grupo de autores no logró demostrar una reducción en la mortalidad con el empleo de VP, a pesar de que su administración se asoció a una reducción significativa en las dosis de NE (p < 0,001).
El análisis de un subgrupo definido a priori de pacientes menos graves (requerimiento de NE 5 a 14 pg/min al momento de la aleatorización), documentó que el grupo tratado con la combinación NE/VP, experimentó una reducción significativa de la mortalidad a 90 días en comparación al grupo que recibió solamente NE (35,8% vs 46,1%; p = 0,04). Por otra parte, la administración concomitante de VP y corticoides puede resultar en una interacción farmacodinámica y farmacocinética potencialmente beneficiosa. Estos hallazgos, derivados desde la población adulta, aportan sustento hacia el uso más precoz de VP acorde a la terapia individualizada.
El uso de milrinona, dobutamina y excepcionalmente levosimendán, están indicados en pacientes con shock y disfunción ventricular refractaria al uso de adrenalina como se indica en el algoritmo de manejo de pacientes pediátricos con shock séptico según tiempo de evolución (Figura 7).
-
Hemoderivados
Se sugiere no transfundir glóbulos rojos si la concentración de hemoglobina en sangre es > 7 g/dL en niños hemodinámicamente estables[6 ]. No existe una recomendación sobre los umbrales de transfusión de hemoglobina en niños con shock séptico inestable. También se sugiere no realizar transfusiones profilácticas de plaquetas o plasma en niños con shock séptico en ausencia de sangrado. El uso de otros hemoderivados deberá ser evaluado según cada contexto clínico y acorde a pruebas viscoelásticas de la coagulación[6].
-
Control metabólico y endocrino
La corrección de la hipoglicemia y la hipocalcemia es un aspecto importante en el manejo de las alteraciones metabólicas en pacientes pediátricos con sepsis. El anestesiólogo debe controlar estas variables activamente en el perioperatorio. Los niveles de glucosa inferiores a 60 mg/dL necesitan corrección. Asimismo, los niveles de calcio ionizado deben monitorearse; niveles menores o iguales que 1,0 – 1,2 mmol/L (o calcio total corregido 8,5 – 9,0 mg/dL) requieren de corrección y seguimiento[6 ]. Esto es de relevancia, al considerar que los mecanismos fisiopatológicos y hemodinámicos implicados en el shock séptico dependen estrechamente de la calcemia en pacientes pediátricos.
-
Consideraciones endocrinas
La disfunción endocrina, como el hipocortisolismo y el hipotiroidismo, puede ocurrir en pacientes pediátricos con sepsis. El hipocortisolismo puede ocurrir debido a disfunción de la glándula suprarrenal o a una supresión del eje hipotálamo- hipófisis – suprarrenal[6 ].
-
Corticosteroides en el shock séptico pediátrico
Los corticosteroides tienen roles potenciales en el shock séptico debido a sus efectos en la homeostasis y la respuesta al estrés. Pueden disminuir la recaptación de norepinefrina y mejorar la disponibilidad de calcio en las células del músculo liso vascular y miocárdico, promoviendo la contractilidad miocárdica y la vasoconstricción. El cortisol también ayuda a aumentar el tono vascular, modulando la fuga capilar y aumentando la actividad de los receptores betaadrenérgicos en el corazón. Su uso en este contexto sigue siendo un tema de debate, con algunas guías sugiriendo su consideración a pesar de evidencia emergente de posibles daños en sepsis pediátrica[6],[35].
-
Uso rutinario de corticoides con estabilidad hemodinámica
Se sugiere evitar la hidrocortisona intravenosa en niños con shock séptico si la reanimación con líquidos y la terapia con vasopresores tienen éxito en restaurar la estabilidad hemodinámica[6],[35],[36].
La hidrocortisona intravenosa puede ser considerada si la reanimación adecuada con líquidos y la terapia con vasopresores no logran restaurar la estabilidad hemodinámica. El estudio ADRENAL[37] cuenta con un tamaño muestral de 3.800 pacientes en shock séptico, todos en ventilación mecánica. Se los aleatorizó en 2 grupos; el grupo de tratamiento recibió infusión continua de 200 mg de hidrocortisona durante un máximo de 7 días o hasta el alta de UCI y/o el fallecimiento (lo que ocurriese primero) y el grupo de control recibió placebo. Se aplicaba como objetivo primario la mortalidad a los 90 días de la inclusión independiente de la causa. El estudio concluye en que no existen diferencias estadísticamente significativas en mortalidad ni en los objetivos secundarios valorados por subgrupos.
En paralelo, el grupo de Annane et al., desarrolló un estudio multicéntrico, aleatorizado, controlado y a doble ciego con un esquema a priori similar (estudio APROCCHSS)[38]. Alea- torizaron a un total de 1.241 pacientes en 2 grupos. Al grupo de intervención se le administraron 200 mg de hidrocortisona fraccionados en 4 dosis de 50 mg/6h junto con 50 pg de flu- drocortisona por vía enteral. Como objetivo primario se estableció la mortalidad a 90 días. Concluye que los tratados con corticoides tuvieron menor mortalidad tanto a los 90 días como al alta de UCI y el alta hospitalaria, pero no a los 28 días. Del mismo modo, tuvieron menos días de asistencia vasopresora en las primeras 4 semanas y más días sin fallo de órganos.
Los posibles efectos adversos de la terapia con corticosteroides, como la hiperglicemia, la debilidad neuromuscular difusa relacionada con el catabolismo (incluido el diafragma) y las infecciones adquiridas en el hospital, pueden contribuir a peores resultados en pacientes críticamente enfermos[6],[35],[36].
Los desafíos en el uso de cortisol aleatorio o pruebas de estimulación para guiar la prescripción de corticosteroides incluyen la variabilidad en el ensayo de cortisol, el metabolismo del cortisol durante la sepsis, las concentraciones de globulina fijadora de corticosteroides y múltiples factores tisulares y celulares. Por lo tanto, no se recomienda el uso de estas pruebas para guiar la prescripción de corticosteroides en niños con shock séptico.
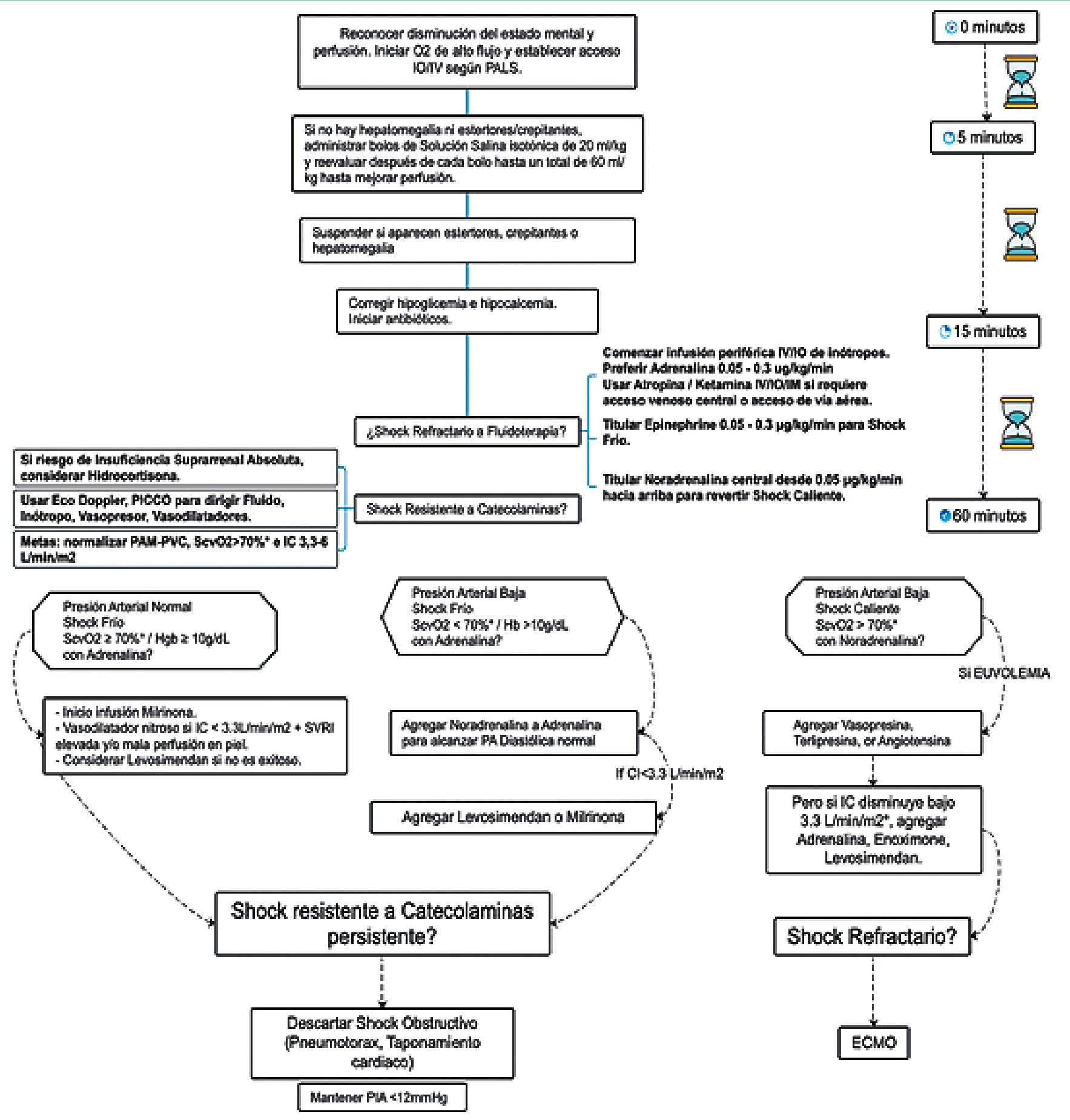
Figura 7. Algoritmo de Manejo de Sepsis en Pediatría Según Tiempo de Evolución. Modificado a español de Davis AL, Carcillo JA, Aneja RK, Deymann AJ, Lin JC, Nguyen TC, et al. American College of Critical Care Medicine Clinical Practice Parameters for Hemodynamic Support of Pediatric and Neonatal Septic Shock. Crit Care Med [Internet]. junio de 2017;45(6):1061-93. Disponible en: https://journals.lww.com/00003246-201706000-00018.
-
Manejo del dolor
El enfoque terapéutico actual debe ser multimodal, recordando los principios farmacocinéticos y farmacodinámicos, que genere la mayor eficacia posible evitando la toxicidad en el contexto de disfunción orgánica frecuente en esta entidad. En esa línea, es importante recordar los aspectos fisiológicos en los niños, los cuales los exponen a mayor riesgo de intoxicación por anestésicos locales (AL). Sin embargo, la población pediátrica que cursa con sepsis o shock séptico, y especialmente lactantes, presentan un aumento en la liberación de proteínas de fase aguda, dentro de las cuales, la alfa 1 glicoproteína acida, principal proteína de unión de los AL estará aumentada. Por lo cual, existe menor fracción libre de droga, disminuyendo el riesgo de técnicas regionales.
Las técnicas neuro axiales están contraindicadas en pacientes pediátricos que cursan con shock séptico y deterioro hemodinámico, sin embargo, frente a estadios iniciales o en sepsis sin deterioro hemodinámico podrían ser una alternativa dependiendo de la evaluación específica para cada caso. En suma, las técnicas locorregionales son una herramienta de gran utilidad, con un enfoque multimodal, en el manejo del dolor de pacientes pediátricos que cursan con sepsis. De ser factible, el anestesiólogo deberá efectuarlas siempre de manera ecoguíada disminuyendo aún más los riesgos asociados.
-
Otros escenarios perioperatorios
Existen condiciones médicas y/o quirúrgicas, las cuales pueden conllevar a un estado permanente de refractariedad a las medidas iniciales. Si bien son varios los aspectos a considerar como posible etiología, en pacientes pediátricos con sepsis que ingresan a pabellón, es importante considerar tres causas de shock obstructivo: derrame pericárdico, neumotórax e hipertensión intraabdominal.
La presión intraabdominal (PIA) normal en personas que respiran espontáneamente es cercana a cero mmHg, y en niños con ventilación mecánica es de 7 ± 3 mmHg independientemente del peso del niño[39]. Los niños tienen PAM más bajas que los adultos; por lo tanto, puede ocurrir falla multiorgánica en niños con umbrales de PIA más bajos que los definidos para adultos. La hipertensión intraabdominal (HIA) tiene muchas causas, incluyendo trauma abdominal, ascitis y obstrucción intestinal. La HIA puede progresar a síndrome compartimental abdominal (SCA), donde la presión intraabdominal se asocia con una nueva disfunción orgánica. La HIA/SCA puede causar un cambio del patrón ventilatorio, siendo superficial con un volumen corriente disminuido, sumado a una disminución del gasto cardíaco y del retorno venoso, lo que conduce a un shock obstructivo y que ante el cese de la ventilación espontánea puede ocasionar un colapso hemodinámico. El tratamiento implica como medidas iniciales el vaciado gástrico, sondeo rectal, manejo racional de fluidos, sedonalagesia y un adecuado bloqueo neuromuscular. En caso de persistir, la descompresión abdominal está indicada mediante drenaje percutáneo o laparotomía.
Por lo anterior, la inducción anestésica es un momento crítico que precisa un tratamiento que contemple una reanimación efectiva, preoxigenación adecuada y descompresión de la cámara gástrica.
-
Discusión y Conclusión
La sepsis y el shock séptico continúan siendo una causa importante de morbimortalidad en la población pediátrica a nivel mundial. El reconocimiento precoz y el manejo inicial son fundamentales para mejorar los resultados en estos pacientes.
El anestesiólogo desempeña un papel crucial en el manejo perioperatorio de niños con sepsis. La comprensión de las definiciones actualizadas, así como los criterios de Phoenix, han modificado la mirada de la sepsis en pediatría, por lo cual debemos estar actualizados y en conocimiento de ellas para un adecuado manejo perioperatorio. Las herramientas como los sistemas de alerta temprana pediátrica y un enfoque integrado que combine la evaluación clínica con protocolos estandarizados facilitan la detección y el tratamiento oportuno.
El manejo del shock séptico pediátrico requiere un abordaje multidisciplinario. La reanimación debe seguir el enfoque ABCDE, fluidoterapia, soporte vasoactivo precoz usando epinefrina o norepinefrina como agentes de primera línea, y antibióticos empíricos de amplio espectro, considerando las alteraciones farmacocinéticas y farmacodinámicas. La monitorización he- modinámica avanzada, incluyendo ecografía y espectroscopía cercana al infrarrojo, guían el manejo perioperatorio individualizado.
La presente revisión destaca las consideraciones claves para el anestesiólogo en el manejo perioperatorio de la sepsis pediátrica, con el objetivo de avanzar en la atención y mejorar el pronóstico de estos pacientes críticos. Un enfoque sistemático, basado en la evidencia y adaptado a los recursos locales, que enfatice la intervención oportuna y el trabajo en equipo mul- tidisciplinario, es esencial para mejorar los resultados en esta población.
Derechos: Se ceden los derechos de propiedad intelectual del presente artículo a la Revista Chilena de Anestesiología.
-
Referencias
1. Schlapbach LJ, Watson RS, Sorce LR, Argent AC, Menon K, Hall MW, et al. International Consensus Criteria for Pediatric Sepsis and Septic Shock. JAMA [Internet]. 27 de febrero de 2024 [citado 7 de abril de 2024];331(8):665. Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2814297 https://doi.org/10.1001/jama.2024.0179.
2. O’Reilly HD, Menon K. Sepsis in paediatrics. BJA Educ [Internet]. febrero de 2021 [citado 7 de abril de 2024];21(2):51-8. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S2058534920301396 https://doi.org/10.1016/j.bjae.2020.09.004.
3. De Souza DC, Shieh HH, Barreira ER, Ventura AM, Bousso A, Troster EJ. Epidemiology of Sepsis in Children Admitted to PICUs in South America*. Pediatr Crit Care Med [Internet]. agosto de 2016 [citado 7 de abril de 2024];17(8):727-34. Disponible en: https://journals.lww.com/00130478-201608000-00005
4. Fleischmann-Struzek C, Goldfarb DM, Schlattmann P, Schlapbach LJ, Reinhart K, Kissoon N. The global burden of paediatric and neonatal sepsis: a systematic review. Lancet Respir Med [Internet]. marzo de 2018 [citado 7 de abril de 2024];6(3):223-30. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S2213260018300638 https://doi.org/10.1016/S2213-2600(18)30063-8.
5. World Health Organization. Global report on the epidemiology and burden of sepsis: current evidence, identifying gaps and future directions. World Health Organization; 2020.
6. Weiss SL, Peters MJ, Alhazzani W, Agus MS, Flori HR, Inwald DP, et al. Surviving Sepsis Campaign International Guidelines for the Management of Septic Shock and Sepsis-Associated Organ Dysfunction in Children. Pediatr Crit Care Med [Internet]. febrero de 2020 [citado 7 de abril de 2024];21(2):e52-106. Disponible en: https://journals.lww.com/10.1097/PCC.0000000000002198
7. Wang Y, Sun B, Yue H, Lin X, Li B, Yang X, et al. An Epidemiologic Survey of Pediatric Sepsis in Regional Hospitals in China*: Pediatr Crit Care Med [Internet]. noviembre de 2014 [citado 7 de abril de 2024];15(9):814-20. Disponible en: http://journals.lww.com/00130478-201411000-00004
8. Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA [Internet]. 23 de febrero de 2016 [citado 7 de abril de 2024];315(8):801. Disponible en: http://jama.jamanetwork.com/article.aspx?doi=10.1001/jama.2016.0287
9. Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: Definitions for sepsis and organ dysfunction in pediatrics*: Pediatr Crit Care Med [Internet]. enero de 2005 [citado 7 de abril de 2024];6(1):2-8. Disponible en: http://journals.lww.com/00130478-200501000-00002
10. Menon K, Schlapbach LJ, Akech S, Argent A, Chiotos K, Chisti MJ, et al. Pediatric Sepsis Definition—A Systematic Review Protocol by the Pediatric Sepsis Definition Taskforce. Crit Care Explor [Internet]. junio de 2020 [citado 7 de abril de 2024];2(6):e0123. Disponible en: https://journals.lww.com/10.1097/CCE.0000000000000123
11. Carrol ED, Ranjit S, Menon K, Bennett TD, Sanchez-Pinto LN, Zimmerman JJ, et al. Operationalizing Appropriate Sepsis Definitions in Children Worldwide: Considerations for the Pediatric Sepsis Definition Taskforce. Pediatr Crit Care Med [Internet]. junio de 2023 [citado 7 de abril de 2024];24(6):e263-71. Disponible en: https://journals.lww.com/10.1097/PCC.0000000000003263
12. Hilarius KW, Skippen PW, Kissoon N. Early Recognition and Emergency Treatment of Sepsis and Septic Shock in Children. Pediatr Emerg Care [Internet]. febrero de 2020 [citado 7 de abril de 2024];36(2):101-6. Disponible en: https://journals.lww.com/10.1097/PEC.0000000000002043 https://doi.org/10.1097/PEC.0000000000002043.
13. Chapman SM, Maconochie IK. Early warning scores in paediatrics: an overview. Arch Dis Child [Internet]. abril de 2019 [citado 7 de abril de 2024];104(4):395-9. Disponible en: https://adc.bmj.com/lookup/doi/10.1136/archdischild-2018-314807 https://doi.org/10.1136/archdischild-2018-314807.
14. Davis AL, Carcillo JA, Aneja RK, Deymann AJ, Lin JC, Nguyen TC, et al. American College of Critical Care Medicine Clinical Practice Parameters for Hemodynamic Support of Pediatric and Neonatal Septic Shock. Crit Care Med [Internet]. junio de 2017 [citado 3 de abril de 2024];45(6):1061-93. Disponible en: https://journals.lww.com/00003246-201706000-00018
15. Hernández G, Ospina-Tascón GA, Damiani LP, Estenssoro E, Dubin A, Hurtado J, et al.; The ANDROMEDA SHOCK Investigators and the Latin America Intensive Care Network (LIVEN). Effect of a Resuscitation Strategy Targeting Peripheral Perfusion Status vs Serum Lactate Levels on 28-Day Mortality Among Patients With Septic Shock: The ANDROMEDA-SHOCK Randomized Clinical Trial. JAMA. 2019 Feb;321(7):654–64. https://doi.org/10.1001/jama.2019.0071 PMID:30772908
16. Fathi EM, Narchi H, Chedid F. Noninvasive hemodynamic monitoring of septic shock in children. World J Methodol [Internet]. 26 de junio de 2018 [citado 7 de abril de 2024];8(1):1-8. Disponible en: http://www.wjgnet.com/2222-0682/full/v8/i1/1.htm https://doi.org/10.5662/wjm.v8.i1.1.
17. Aneja R, Carcillo J. Differences between adult and pediatric septic shock. Minerva Anestesiol. Octubre de 2011;77(10):986-92
18. Ceneviva G, Paschall JA, Maffei F, Carcillo JA. Hemodynamic support in fluid-refractory pediatric septic shock. Pediatrics. 1998 Aug;102(2):e19. https://doi.org/10.1542/peds.102.2.e19 PMID:9685464
19. Boretsky KR, Kantor DB, DiNardo JA, Oren-Grinberg A. Focused Cardiac Ultrasound in the Pediatric Perioperative Setting. Anesth Analg [Internet]. octubre de 2019 [citado 7 de abril de 2024];129(4):925-32. Disponible en: https://journals.lww.com/10.1213/ANE.0000000000004357 https://doi.org/10.1213/ANE.0000000000004357.
20. Oulego I. Ecografía en el paciente hemodinámicamente inestable. Rev Esp Pediatr [Internet]. 2016;72:62-9. Disponible en: https://www.secip.com/images/uploads/2018/05/Ecografia-en-el-paciente-hemodinamicamente-inestable-Dr-Oulego.pdf
21. Ranjit S, Aram G, Kissoon N, Ali MK, Natraj R, Shresti S, et al. Multimodal Monitoring for Hemodynamic Categorization and Management of Pediatric Septic Shock: A Pilot Observational Study*. Pediatr Crit Care Med [Internet]. enero de 2014 [citado 8 de abril de 2024];15(1):e17-26. Disponible en: http://journals.lww.com/00130478-201401000-00023
22. Mohamed El-Dib. Janet S. Soul. Monitoring and management of brain hemodynamics and oxygenation. Linda S. de Vries, Hannah C. Glass. Handbook of Clinical Neurology. Elsevier; 2019. pp. 295–314.
23. Alobaidi R, Morgan C, Basu RK, Stenson E, Featherstone R, Majumdar SR, et al. Associations Between Fluid Balance and Outcomes in Critically Ill Children: A Protocol for a Systematic Review and Meta-analysis. Can J Kidney Health Dis [Internet]. enero de 2017 [citado 8 de abril de 2024];4:205435811769256. Disponible en: http://journals.sagepub.com/doi/10.1177/2054358117692560 https://doi.org/10.1177/2054358117692560.
24. Scott HF, Brou L, Deakyne SJ, Kempe A, Fairclough DL, Bajaj L. Association Between Early Lactate Levels and 30-Day Mortality in Clinically Suspected Sepsis in Children. JAMA Pediatr [Internet]. 1 de marzo de 2017 [citado 8 de abril de 2024];171(3):249. Disponible en:http://archpedi.jamanetwork.com/article.aspx?doi=10.1001/jamapediatrics.2016.3681
25. Hernandez G, Bellomo R, Bakker J. The ten pitfalls of lactate clearance in sepsis. Intensive Care Med. 2019 Jan;45(1):82–5. https://doi.org/10.1007/s00134-018-5213-x PMID:29754310
26. Borchert BE, Lacassie HJ, Concha PM, Rattalino FM, Lema FG. Acceso venoso difícil en pediatría. Rev Chil Anest [Internet]. 2021;50(5):685–9. https://doi.org/10.25237/revchilanestv50-03-08.
27. Disma N, Asai T, Cools E, Cronin A, Engelhardt T, Fiadjoe J, et al.; and airway guidelines groups of the European Society of Anaesthesiology and Intensive Care (ESAIC) and the British Journal of Anaesthesia (BJA). Airway management in neonates and infants: European Society of Anaesthesiology and Intensive Care and British Journal of Anaesthesia joint guidelines [Internet]. Eur J Anaesthesiol. 2024 Jan;41(1):3–23. https://doi.org/10.1097/EJA.0000000000001928 PMID:38018248
28. De Waele JJ, Girardis M, Martin-Loeches I. Source control in the management of sepsis and septic shock. Intensive Care Med [Internet]. diciembre de 2022 [citado 9 de abril de 2024];48(12):1799-802. Disponible en: https://link.springer.com/10.1007/s00134-022-06852-5 https://doi.org/10.1007/s00134-022-06852-5.
29. Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, et al. Duration of hypotension before initiation of effective antmicrobial therapy is the critical determinant of survival in human septic shock*: Crit Care Med [Internet]. junio de 2006 [citado 8 de abril de 2024];34(6):1589-96. Disponible en: http://journals.lww.com/00003246-200606000-00001
30. Brown RM, Semler MW. Fluid Management in Sepsis. J Intensive Care Med [Internet]. mayo de 2019 [citado 8 de abril de 2024];34(5):364-73. Disponible en: http://journals.sagepub.com/doi/10.1177/0885066618784861
31. Caironi P, Tognoni G, Masson S, Fumagalli R, Pesenti A, Romero M, et al.; ALBIOS Study Investigators. Albumin replacement in patients with severe sepsis or septic shock. N Engl J Med. 2014 Apr;370(15):1412–21. https://doi.org/10.1056/NEJMoa1305727 PMID:24635772
32. Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D, et al.; CHEST Investigators; Australian and New Zealand Intensive Care Society Clinical Trials Group. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N Engl J Med. 2012 Nov;367(20):1901–11. Available from: https://www.nejm.org/doi/full/10.1056/NEJMoa1209759 https://doi.org/10.1056/NEJMoa1209759 PMID:23075127
33. Patiño CR, Rojas V, Cariqueo M, y cols. Vasopresina en shock séptico: De la fisiología a la evidencia clínica. Rev Chil Med Intensiv. 2022;37:22-32. Disponible en: https://www.medicina-intensiva.cl/revista/pdf/76/47.pdf
34. Deep A, Goonasekera CD, Wang Y, Brierley J. Evolution of haemodynamics and outcome of fluid-refractory septic shock in children. Intensive Care Med [Internet]. septiembre de 2013 [citado 8 de abril de 2024];39(9):1602-9. Disponible en: http://link.springer.com/10.1007/s00134-013-3003-z https://doi.org/10.1007/s00134-013-3003-z.
35. Annane D, Bellissant E, Bollaert PE, Briegel J, Keh D, Kupfer Y, et al. Corticosteroids for treating sepsis in children and adults. Cochrane Emergency and Critical Care Group, editor. Cochrane Database Syst Rev [Internet]. 6 de diciembre de 2019 [citado 7 de abril de 2024];2019(12). Disponible en: http://doi.wiley.com/10.1002/14651858.CD002243.pub4 https://doi.org/10.1002/14651858.CD002243.pub4.
36. Lamontagne F, Rochwerg B, Lytvyn L, Guyatt GH, Møller MH, Annane D, et al. Corticosteroid therapy for sepsis: a clinical practice guideline. BMJ. 10 de agosto de 2018;362:k3284. https://doi.org/10.1136/bmj.k3284.
37. Venkatesh B, Finfer S, Cohen J, Rajbhandari D, Arabi Y, Bellomo R, et al.; ADRENAL Trial Investigators and the Australian–New Zealand Intensive Care Society Clinical Trials Group. Adjunctive Glucocorticoid Therapy in Patients with Septic Shock. N Engl J Med. 2018 Mar;378(9):797–808. https://doi.org/10.1056/NEJMoa1705835 PMID:29347874
38. Annane D, Renault A, Brun-Buisson C, Megarbane B, Quenot JP, Siami S, et al.; CRICS-TRIGGERSEP Network. Hydrocortisone plus Fludrocortisone for Adults with Septic Shock. N Engl J Med. 2018 Mar;378(9):809–18. https://doi.org/10.1056/NEJMoa1705716 PMID:29490185
39. Thabet FC, Ejike JC. Intra-abdominal hypertension and abdominal compartment syndrome in pediatrics. A review [Internet]. J Crit Care. 2017 Oct;41:275–82. https://doi.org/10.1016/j.jcrc.2017.06.004 PMID:28614762

 ORCID
ORCID