Raúl Nachar1*
Recibido: 12-08-2025
Aceptado: 14-09-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 533-541|https://doi.org/10.25237/revchilanestv54n5-08
PDF|ePub|RIS
Cerebral oxygenation monitoring using near-infrared spectroscopy (NIRS) in newborns
Abstract
Cerebral oxygenation measurement using near-infrared spectroscopy (NIRS) is being incorporated into intensive care monitoring of critically ill neonatal patients and patients with congenital heart disease in the preoperative, operating room, and postoperative periods. By considering CrSO2 (regional cerebral saturation) values and calculating cFETO (cerebral oxygen fraction of tissue extraction), we provide real-time, non-invasive information on the balance between oxygen delivery and utilization to the brain. This allows for the early detection of situations and pathologies that can cause brain cell damage and/or death and their timely, rational treatment. This review presents the general operation of this technology and the equipment available for clinical use. It also describes which patient groups and clinical situations could benefit from this monitoring. Practical algorithms are also presented for the interpretation and possible intervention in the event of abnormalities in CrSO2 and cFETO values, highlighting its role as a trend monitor. Given that neonatal and cardiac intensive care is largely “brain-oriented,” this technology may be relevant for achieving better outcomes, especially in chronic morbidity caused by disturbances in cerebral O2 supply and utilization.
Resumen
La medición de oxigenación cerebral a través de la espectroscopia cercana al infrarrojo (NIRS) está siendo incorporada en la monitorización en Cuidados intensivos del paciente neonatal grave y del paciente con cardiopatia congènita en período prequirúrgico, pabellón y postquirúrgico. Considerando los valores de CrSO2 (saturación regional cerebral) y el cálculo de cFETO (fracción de extracción tisular de oxígeno cerebral) podemos tener información en tiempo real, y de forma no invasiva del balance entre la entrega de oxígeno al cerebro y su utilización, lo que permite detectar oportunamente situaciones y patologías que pueden generar daño y/o muerte a nivel celular cerebral y tratarlas a tiempo de forma racional. En esta revisión se expone el funcionamiento general de esta tecnología y los equipos que se encuentran disponibles para el uso clínico. Además, se describen que grupo de pacientes y en que situaciones clínicas pudiesen verse beneficiados de la utilización de esta monitorización. También se exponen algoritmos prácticos para la interpretación y eventual intervención frente a alteraciones en valores de CrSO2 y FETO, destacando su rol como monitor de tendencia. Dado que los cuidados intensivos neonatales y del paciente cardioquirúrgico están en gran parte “orientados al cerebro”, esta tecnología puede ser relevante para lograr mejores resultados, en especial en morbilidad crónica determinada por disturbios en el aporte y utilización de O2 cerebral.
-
Introducción
En los últimos 40 años se ha avanzado en disminuir significativamente la mortalidad neonatal, gracias al avance en el conocimiento de la fisiopatología de las diferentes patologías que afectan al recién nacido y al desarrollo tecnológico que ha permitido tener disponibles equipos cada vez más modernos necesarios para el manejo y monitorización adecuada del recién nacido enfermo.
Especialmente, los últimos 15 años ha traído consigo una mayor sobrevida en los recién nacidos prematuros extremos (menores de 32 semanas de edad gestacional y/o menores de 1.500 g de peso de nacimiento). Pese a este avance, el porcentaje de recién nacidos prematuros que sobrevive con secuelas moderadas a severas, principalmente en el área neurológica, sigue siendo alto. Joseph R y col., reportan que en una cohorte de 873 prematuros extremos (menores de 28 semanas), más del 50%, presentan déficits neurocognitivos moderados a severos a los 10 años de vida[1]. Por lo tanto, el desafío actual está en poder disminuir casos de alteraciones en neurodesarrollo y patología crónicas del recién nacido, en las que juega un rol fisiopatológico clave, la alteración en perfusión tisular. Clásicamente, la evaluación del compromiso de la perfusión tisular ha considerado monitorización de presión arterial, evaluación de intermitente de flujo sistémico y su distribución a los diversos tejidos (a través de ecocardiografía y ecografía Doppler), y recientemente se ha integrado la monitorización continua de la oxigenación tisular regional, a través de espectroscopia cercana a infrarrojo, abreviado clásicamente como NIRS (Near infrared spectroscopy). Esta monitorización es relevante en período neonatal, por ser una etapa muy dinámica, en la cual todos los sistemas están en un proceso continuo de adaptación y maduración y en los que una noxa o injuria no detectada oportunamente puede provocar daño potencialmente crónico o irreversible. Es así como asegurar la homeostasis circulatoria neonatal es vital si queremos evitar injuria cerebral y de otros sistemas en maduración. Esto sólo se puede lograr, a través de una monitorización integrada de la hemodinamia neonatal, en que, sumada a la monitorización clásica, la ecocardiografía funcional al lado del paciente, y la espectroscopía cercana al infrarrojo son fundamentales. Estudios recientes han demostrado que es posible estabilizar la oxigenación cerebral y monitorear la reactividad cerebrovascular usando NIRS, respaldando la idea de que el monitoreo a tiempo real de la oxigenación puede tener un impacto positivo en el resultado de los recién nacidos prematuros y aquellos de termino enfermos[2],[3]. Considerando que los cuidados intensivos neonatales y del paciente cardioquirúrgico están en gran medida enfocados en la protección cerebral, esta tecnología puede ser clave para mejorar los resultados, en particular, podría reducir la morbilidad crónica relacionada con alteraciones en el aporte y uso de oxígeno cerebral.
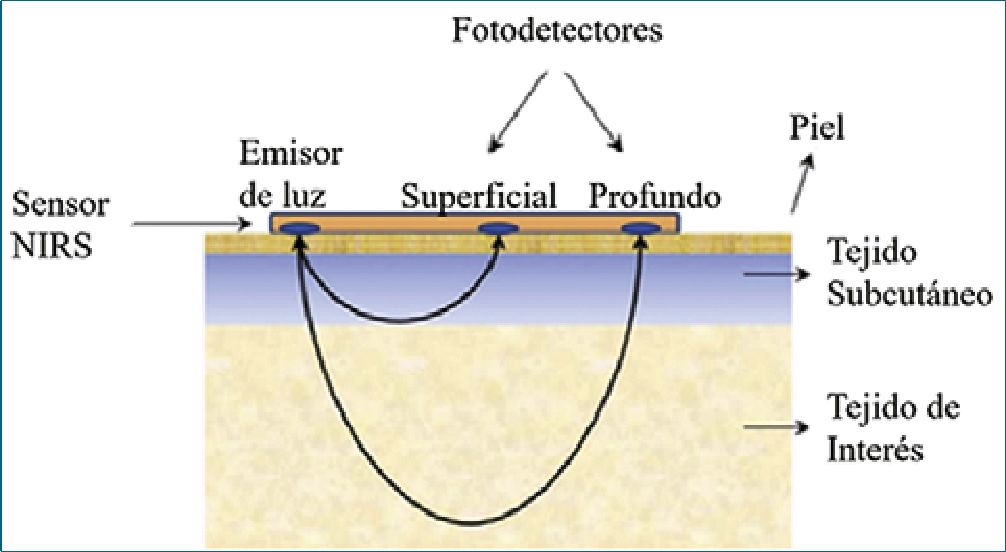
Figura 1. Esquema adaptado que muestra el sensor de NIRS, con el emisor de luz y los 2 receptores.
-
¿Qué es la espectroscopía cercana al infrarrojo?
La espectroscopia cercana al infrarrojo (NIRS) es un método no invasivo que permite monitorizar en forma continua, al lado del paciente y a tiempo real, la oxigenación tisular, expresada como saturación regional de oxígeno (rSO2). Se puede utilizar para monitorizar diversos parénquimas, pero la mayor experiencia y publicaciones es en su utilización en el cerebro, permitiendo monitorizar la oxigenación cerebral en forma continua, no invasiva y al lado del paciente[4].
-
Funcionamiento de la espectroscopía cercana al infrarrojo
La monitorización con espectroscopía cercana al infrarrojo se basa en la transparencia relativa de los tejidos biológicos a la luz infrarroja en rango de longitudes de onda que van de 700-900 nm. Las moléculas de hemoglobina oxigenada (HbO2) y desoxigenada (Hb) absorben esta luz que entra a los tejidos, pero lo hacen en diferentes espectros de absorción, lo que permite a través de Ley de Beer-Lambert modificada, estimar cambios en la concentración de ambas y así determinar el grado de saturación de oxígeno del tejido, expresado como saturación regional (rSO2) tisular, la cual se obtiene mediante la siguiente fórmula:
rSO2 = Hb oxigenada / (Hb oxigenada + Hb desoxigenada)
En general los diversos equipos de NIRS utilizan sensores que se disponen sobre la piel del parénquima a evaluar, siendo la mayoría de ellos desechables y de una vida útil relativamente corta (3 a 5 días). La mayoría de estos sensores poseen un emisor de luz (que emite luz infrarroja) y 2 receptores (que captan la luz infrarroja que no fue absorbida por Hb y HbO2). Este sistema dual de receptores permite hacer una medición diferenciada por estrato tisular, entregando finalmente el porcentaje de hemoglobina oxigenada en el tejido de interés (profundo), descartando los valores de Hb y HbO2 en piel y tegumentos que no son de interés (superficial). Para esto los detectores, están ubicados en general a 30 mm (superficial o proximal) y 40 mm (profundo o distal) del emisor. Finalmente, la saturación de oxígeno regional (rSO2) se determina a través de un algoritmo del equipo que resta los datos obtenidos por el detector proximal (a 30 mm) a los datos obtenidos por el detector distal (a 40 mm) (Figura 1)[5],6].
De esta forma, una saturación regional de Hb (rSO2) de 70%, significa que el 70% de las moléculas de Hb en el tejido evaluado están saturadas con O2.
Los equipos utilizados con mayor frecuencia tanto en protocolos de investigación como monitorización clínica en recién nacidos son el monitor NIRO (Hamamatsu, Japón) y el monitor INVOS (Medtronic, USA) y recientemente O3 Regional Oximetry de Masimo (Tabla 1). El monitor INVOS es actualmente el más utilizado en las unidades de cuidados intensivos neonatales en Chile. Existen diversos equipos de NIRS disponibles en el mercado mundial para uso clínico en neonatos, ellos utilizan básicamente el funcionamiento previamente descrito, pero se diferencian en el número de longitudes de onda que emite el emisor y la distancia que existe en el sensor entre el emisor y los receptores proximal (superficial) y distal (profundo). Otro aspecto para destacar es que la mayoría de los equipos actualmente disponibles para uso clínico, utilizan espectroscopía con resolución espacial y onda continua, esto permite tener medición de oxigenación tisular expresado con saturación regional, pero no pueden determinar concentración absoluta de hemoglobina en el tejido. Nuevos equipos utilizados aun en contexto de investigación y que usan espectroscopia con dominio de frecuencia, dominio de tiempo y en especial espectroscopia de correlación difusa permiten estimar perfusión y consumo de oxígeno cerebral, pero su alto costo y complejidad de uso impiden aún su adopción en contexto clínico[7].
Tabla 1. Equipos de monitorización de espectroscopía cercana al infrarrojo utilizados en clínica y sus características
| Equipo | Sensor neonatal | Longitud de onda (nm) | Separación máxima emisor – detector (mm) | Fabricante |
| INVOS | Si | 2 (730 – 810) | 40 | Medtronic |
| Fore-Sight Elite & HemoSphere | Si | 5 (685, 730,770,810, 870) | 50 | Edwards Lifesciences |
| Equanox | Si | 3 (730, 810, 880) | 40 | Nonin |
| NIRO | Si | 4 (775, 810, 850 y 910) | 50 | Hamamatsu Photonics |
| 03 Regional Oximetry | Si | 4 (730, 760, 805, 880) | 40 | Masimo |
Según el monitor NIRS que se utilice, se puede monitorizar más de un parénquima, por ejemplo, en el monitor INVOS se pueden monitorizar 4 territorios a la vez en forma simultánea. Además, se puede visualizar el valor basal de saturación regional de oxígeno de un determinado parénquima, el cual se fija al inicio de la monitorización y también el porcentaje de variación (%) entre el valor en tiempo real y el valor basal que se ha fijado.
A diferencia de la saturación pulsátil de oxígeno, que se enfoca en el componente arterial pulsátil, el sistema de monitoreo de oxigenación NIRS se centra en la señal luminosa total[8], es decir, detecta la oxigenación de la hemoglobina en sangre arterial y venosa del tejido evaluado. En consecuencia, se puede decir, que la oximetría de pulso proporciona una medición de la saturación de oxígeno arterial (SaO2), que refleja sólo el suministro de oxígeno al tejido, mientras que la saturación regional tisular (rSO2) medido por NIRS, refleja el equilibrio entre el suministro y el consumo de oxígeno del tejido. Por esto mismo es que la monitorización de oxigenación tisular con NIRS debe considerarse complementaria a la oximetría de pulso.
El valor de saturación regional (rSO2) entregado por NIRS, por tratarse de Hb en el tejido, tiene un componente venoso (que va entre 70% a 80%) que ya pasó por los capilares e hizo intercambio gaseoso; 5% capilar y 15% a 25% arterial (Figura 2)[9].
| * En la formula, SapO2 es la saturación arterial pulsátil que es parte de la monitorización actual |
Teniendo en cuenta que la rSO2 tiene un componente ma- yoritariamente venoso, algunos autores han utilizado la rSO2 para calcular la fracción de extracción tisular de oxígeno (FETO) de forma no invasiva[10]. La fracción de extracción de oxígeno tisular (FETO), da una estimación de la cantidad de oxígeno extraída por el tejido evaluado y refleja el equilibrio entre el suministro y el consumo de oxígeno del tejido subyacente[11]. Wardle y cols., demostraron que la FETO se correlaciona en forma negativa con la concentración de hemoglobina y con el contenido de oxígeno arterial, es decir, a menor contenido de oxígeno arterial mayor es la extracción tisular de éste, lo que queda reflejado por un aumento en la FETO[12].
La FETO se obtiene mediante la siguiente fórmula:
FETO = [(SapO2 – rSO2) / SapO2]
-
¿Qué representa el valor de la saturación regional tisular (rSO2) que se ve en pantalla de equipos NIRS?
Como se explicó previamente es el porcentaje de Hb que está unida a O2 en el tejido evaluado y su principal determinante es el flujo sanguíneo al tejido evaluado (perfusión tisular), así como también tiene relación directa al contenido arterial de oxígeno, por lo que la saturación pulsátil de oxígeno y la concentración de hemoglobina lo afectan positivamente.
Por el contrario, el gasto metabólico tisular (consumo de oxígeno) tiene relación inversa al valor de rSO2, de tal forma que, a mayor consumo de oxígeno por el tejido, menor será el valor de rSO2.
Otros factores que influyen son la autorregulación de flujo que pudiese tener el tejido (relevante en cerebro) y la contribución relativa de sangre arterial y venosa al tejido.
-
¿Qué significa un cambio en el valor de rSO2?
De acuerdo con lo establecido previamente, una disminución del valor de rSO2 puede deberse a: 1. Disminución en entrega de oxígeno (disminución de perfusión y/o el contenido de oxígeno) y/o 2. Aumento del consumo de O2 tisular (Figura 2).
Por el contrario, un aumento del valor de rSO2 es explicable por: 1. Aumento en entrega de oxígeno (aumento de la perfusión y/o del contenido de oxígeno) y/o 2. Disminución del consumo de O2 tisular.
-
Aplicación en neonatología
La monitorización tisular se utilizó con fines de investiga-
ción inicialmente y hace pocos años en contexto clínico, principalmente para monitorizar de forma continua y no invasiva la oxigenación cerebral. De hecho, ya en 1977 Jobsis publicaba la posibilidad de medir oxigenación cerebral utilizando NIRS tanto con fines de investigación como clínicos[13]. En población neonatal las primeras publicaciones en contexto clínico se dieron a comienzos de este siglo, principalmente en pacientes con car- diopatías congénitas sometidos a cardiocirugía, en los que se evidenció que valores bajos de oximetría cerebral se asociaron a aparición de lesiones cerebrales o la extensión de lesiones preexistentes[14].
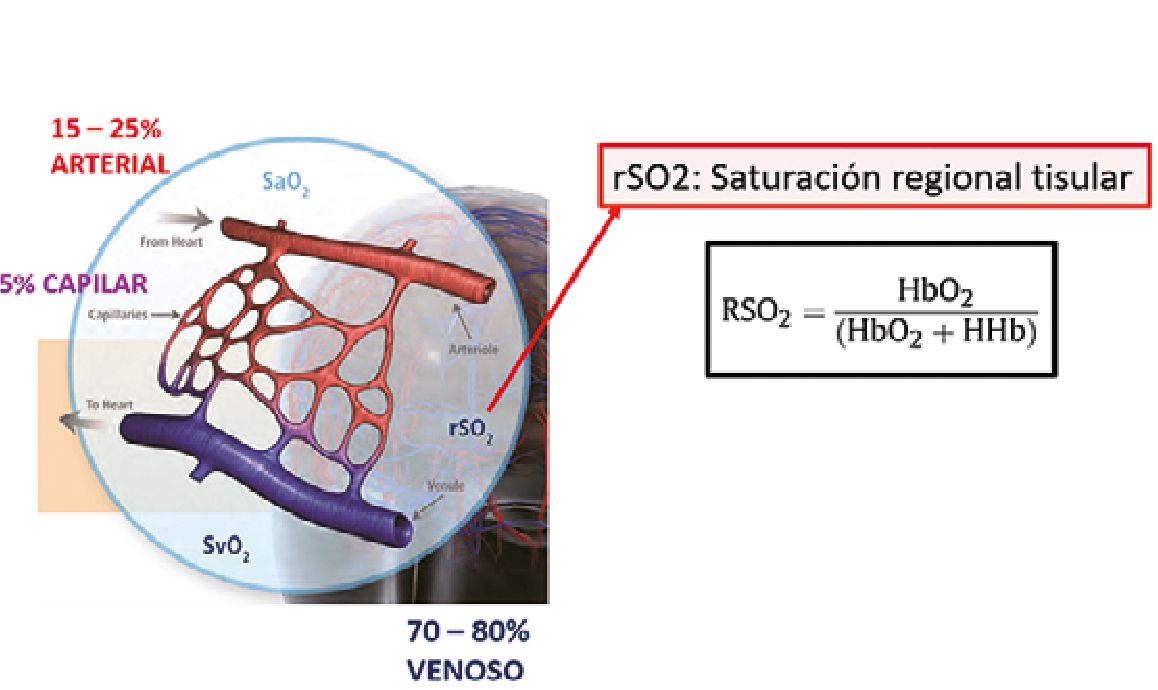
Figura 2. Composición del valor de saturación regional tisular. rSO2: saturación regional tisular; HbO2: hemoglobina oxigenada; HHb: hemoglobina no oxigenada.
-
¿Cuál es el valor normal de saturación regional cerebral (crSO2), medida por NIRS en recién nacidos?
Estudios realizados en animales y humanos, permitieron dar las primeras luces acerca de los valores de normalidad. Kurth C y col., observó en un estudio realizado en cerdos que al disminuir la saturación regional cerebral de oxígeno (crSO2) por debajo de 50%, aparecían cambios menores en el EEG y niveles de lactato cerebral anormalmente elevados en algunos animales. Cuando la crSO2 disminuyó por debajo de 40%, todos los animales tuvieron cambios evidentes en el EEG, niveles de lactato anormalmente altos y niveles de ATP anormalmente bajos[15]. Hou X y col., en un estudio realizado en cerdos observó que con crSO2 < 40%, los animales presentaban manifestaciones significativas de hipoxia, con glucólisis anaeróbica compensadora y aumento significativo del nivel de ácido láctico en sangre. También observaron que al presentar crSO2 < 40%, presentaron lesión cerebral significativa, con elementos de inflamación mitocon- drial, desgranulación en los retículos endoplásmicos rugosos y dilatación leve del complejo de Golgi[16]. Los modelos fisiológicos y fisiopatológicos en animales como cerdos también han permitido establecer la utilidad de la medición de oxigenación tisular cerebral y de otros tejidos para caracterizar los efectos específicos de diversas drogas vasoactivas en la perfusión de los diversos parénquimas[17].
En recién nacidos los primeros estudios que orientaron al valor “normal“ de crSO2 con NIRS fueron en neonatos con car- diopatía congénita. Austin EH y col., en un estudio retrospectivo de 250 pacientes pediátricos con cardiopatía congénita, al monitorizar con NIRS, demostró que las intervenciones basadas
evitar disminución relativa del 20% del valor basal inicial en la crSO2, durante la cirugía, redujeron la incidencia de secuelas neurológicas posoperatorias y la duración de los días de hos- pitalización[18]. Este hallazgo reforzó la importancia de la tendencia en el valor de saturación regional cerebral, en que no solo es importante tener un valor sobre un límite determinado, sino que también descensos de 20% o más del valor basal son probablemente sinónimos de alteración en entrega y/o consumo de oxígeno cerebral.
Por otra parte, Dent CL y cols., observó, en un estudio de 22 recién nacidos que se sometieron a una intervención de Norwood por síndrome del corazón izquierdo hipoplásico, que aquellos que presentaron una crSO2 posoperatoria < 45% en forma prolongada, por más de 180 minutos, se asociaron con hallazgos anormales en las resonancias magnéticas posoperatorias (nuevas lesiones o mayor extensión de preexistentes) [14].
En la población de recién nacidos pretérminos, las primeras publicaciones con números significativos que aportaron sobre valores de normalidad de CRSO2 fueron europeos, destacando trabajos de Alderliesten, Lemmers y Van Bel. Su amplia experiencia en este grupo de pacientes se plasmó en publicación de 2016, con un n = 999 pacientes, sobre valores normales de CRSO2 en recién nacidos prematuros menores de 32 semanas en sus primeros 3 días de vida. Los valores ahí publicados están estratificados por grupos de edad gestacional. Cabe destacar que se utilizó mayormente un sensor de NIRS pequeño de adulto, lo que hace que valores sean 10% más bajo que lo medido con sensor neonatal actualmente utilizado. A grandes rasgos ellos mostraron que rScO2 promedio fue de ~ 65% al ingreso, y este valor aumentó con la edad gestacional (1% por semana) y siguió una curva parabólica en relación con la edad posnatal, con un peak a las ~ 36 h. La cFETO presentó como era de esperar un comportamiento inverso con relación a su variación con edad postnatal y EG, con valor promedio que varió de 0,25 a 0,34 durante las primeras 72 h de vida[19]. Probablemente con sensores neonatales el valor normal de cFETO debiera oscilar entre 0,15 a 0,35. El aumento de cFETO indica que el cerebro está en situación de estrés metabólico de oxígeno (por ejemplo, por disminución de la entrega de oxígeno (ya sea por diminución de perfusión cerebral o del contenido de oxígeno) y/o por aumento del consumo de oxígeno cerebral), mientras que su
¿Que representa saturación regional tisular (rSO2)?
disminución refleja aumento de la entrega de oxígeno al cerebro y/o disminución del consumo de oxígeno cerebral.
Diversas publicaciones en los últimos años han permitido objetivar con NIRS el efecto en la oxigenación cerebral de variables como Presión Arterial Media, pCO2 arterial, presión media de vía aérea, presencia de Ductus arterioso permeable hemo- dinámicamente significativo, anemia, transfusiones de glóbulos rojos, etc.[20],[21],[22]. En este sentido hay que destacar el importante efecto de pCO2 arterial en la oxigenación cerebral en la población neonatal, explicable por su efecto vasodilatador vascular cerebral. Un ejemplo es la Figura 3 en que pueden ver las variaciones en la oxigenación cerebral de un paciente recién nacido, secundarios a cambios en pCO2 derivados de modificación en la modalidad ventilatoria. El paciente se manejó en todo ese momento con FIO2 1,0, por su gravedad, por lo que esta variable no afectó la oxigenación cerebral. Destaca que al disminuir la pCO2 disminuye la saturación regional cerebral, pese a tener FIO2 y SapO2 estables, lo que se explica por la vasoconstricción cerebral que ocurre secundario a hipocapnia.
Estudios realizados en Europa[23] en pacientes con encefalopatía hipóxico-isquémica, NIRS permitió mostrar los cambios en la oxigenación cerebral durante hipotermia y fase de recalentamiento. Es habitual que en durante hipotermia la crSO2 se eleve y que con recalentamiento descienda a valores habituales. Lemmers y cols., han evidenciado que aquellos pacientes en que no se produce el descenso de crSO2 en fase de recalentamiento y por el contrario presentan elevación significativa de crSO2 presentan peor pronóstico neurológico a los 2 años. La capacidad predictora de valores de crSO2 se ve potenciada si se le adiciona la evaluación de electroencefalograma de amplitud integrada.
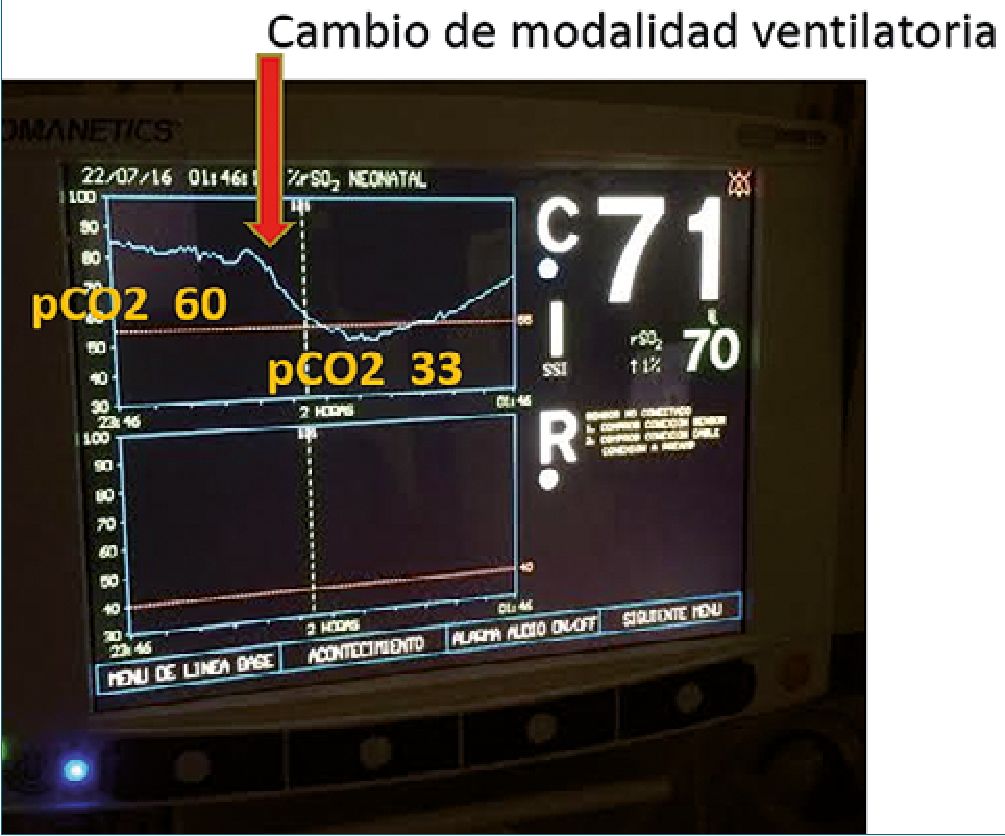
Figura 3. Efectos de la variación de pCO2 en oxigenación cerebral.
Alderliesten y cols., publicaron en 2019, un artículo cuyo objetivo fue evaluar si los niveles altos y bajos de oxigenación cerebral (crSO2) en recién nacidos < 32 semanas de gestación se asociaron con resultados adversos en neurodesarrollo a largo plazo. La crSO2 fue monitoreada continuamente 72 h después del nacimiento usando NIRS. El “outcome” fue evaluado a los 15 y 24 meses de edad corregido. Con análisis multivariado
lograron determinar que aquellos pacientes que pasaron 20% del tiempo con valores de crSO2 < 55% y/o -1,5 DS, tuvieron resultado cognitivo desfavorable definido como score 1DS bajo el promedio o muerte [OR de 1,4 (IC 1,1-1,7)]. Además, los resultados a los 15 meses fueron comparables con 24 meses[24]. Coincidente con estos hallazgos, Tombolini más recientemente (2022) publicó que en una población de recién nacidos prematuros menores de 28 semanas y menores de 1.000 g de peso de nacimiento, el tener CRSO2 < 55% por más de 10 h, durante los 3 primeros días de vida, resultó ser predictor de problemas del neurodesarrollo a los 24 meses en recién nacidos sin lesión cerebral en estudio imagenológico[25].
Por último, un grupo de investigadores europeos realizó estudio de fase II multicéntrico, aleatorizado para determinar factibilidad de estabilizar oxigenación cerebral de RN prematuros utilizando oximetría por NIRS (estudio Safe BoosC II). Se enrolaron 166 recién nacidos, de EG menor de 28 semanas. Todos los pacientes fueron monitorizados con NIRS, pero el grupo “experimental” fue manejado con una guía de tratamiento para mantener crSO2 entre 55% y 85%, mientras que el grupo “control” fue manejado con la monitorización y cuidados standard y los tratantes fueron “ciegos” a los valores de crSO2. Los resultados mostraron una disminución significativa del tiempo de hipoxia cerebral en el grupo experimental en comparación con el grupo control. No hubo diferencias entre los grupos con relación a hiperoxia. Los investigadores concluyeron que es posible estabilizar la oxigenación cerebral en recién nacidos prematuros utilizando una guía de tratamiento específico en combinación con monitorización continua de crSO2 utilizando NIRS. Además, como resultado secundario mostraron que el grupo “experimental” tuvo menor mortalidad a las 40 semanas de EG corregida en comparación con el grupo “control” (14% vs 25%), que si bien no alcanzó a ser estadísticamente significativa fue llamativa. Además, las lesiones severas también fueron menor en grupo “experimental” vs “control”, siendo 13% vs 23%, sin alcanzar a ser significativas[26].
Estos alentadores resultados, motivaron la realización de un estudio fase 3 (SafeBoosC-III) que evaluó los beneficios y/o eventuales daños del tratamiento basado en la monitorización de oxigenación cerebral con NIRS en comparación con el tratamiento habitual. Se enrolaron 1.601 recién nacidos, en diseño similar al estudio previo, salvo que esta vez el grupo control no fue monitorizado con NIRS. Lamentablemente, los resultados fueron desalentadores al no evidenciarse disminución en muerte o lesión cerebral grave a las 36 semanas de EGC entre ambos grupos. Sin embargo, analizando en profundo este estudio nos encontramos que a diferencia del anterior en que solo fueron 8 centros con experiencia en NIRS, en este protocolo se enroló pacientes en 70 centros, algunos con escasa o ninguna experiencia en monitorización NIRS y aunque se desarrolló un programa de capacitación en la web para que el personal clínico lograra competencias básicas, la capacitación no era obligatoria. Además, la monitorización con NIRS en grupo de intervención no se realizó desde sala de partos (ni durante primeras horas en UCIN) y se realizó solo por 72 h. Se monitorizó una pequeña parte de curso clínico que normalmente dura varios meses para estos neonatos. El objetivo de oximetría cerebral en este ensayo fue evitar lesión hipóxica-isquémica, por lo que otras causas pudieran ser responsables de muerte o lesión cerebral grave en estos recién nacidos prematuros[27].
-
Monitorización de la oxigenación cerebral con NIRS en contexto clínico
A la luz del conocimiento actual, resulta necesario evaluar con un método objetivo, no invasivo y al lado del paciente, cómo está llegando el O2 a los tejidos y su utilización. Diversos protocolos sugieren que la monitorización de oxigenación cerebral y/o tisular con NIRS debiese ser parte de la evaluación he- modinámica integrada que considera la clínica del paciente, la monitorización clásica continua (PANI, SapO2, FC), exámenes de laboratorio (gases arteriales y láctico), diuresis y ecocardiogra- fía funcional, con el objeto de poder diagnosticar precozmente alteraciones hemodinámicas, así como disminuir las complicaciones en neurodesarrollo a largo plazo. Es así como varias unidades de Europa, EE.UU. y algunos centros en nuestro país se ha incorporado la monitorización con NIRS cerebral (y renal), en los siguientes casos:
Indicaciones sugeridas de monitorización de oxigenación cerebral y tisular con NIRS en Neonatología:
• RN pretérminos menores de 32 semanas de EG y/o menores de 1.500 g de peso de nacimiento los primeros 5 días de vida (por DAP HS, mala adaptación hemodinámica, ventilación mecánica, riesgo de HIC, etc).
• RN de término con encefalopatía hipóxica isquémica en hipotermia.
• RN de término con hipertensión pulmonar que requiere óxido nítrico, VAF y drogas vasoactivas.
• RN con falla respiratoria que requiere ventilación mecánica de alta frecuencia o convencional con índice de oxigenación mayor a 15 y/o pCO2 > 55 mmHg.
• RN con DAP hemodinámicamente significativo (HS) más allá de los primeros 5 días de vida.
• Recién nacidos con episodios de apneas, bradicardias y desaturaciones frecuentes (más de 6 en 24 h), para investigar repercusión en oxigenación cerebral de estos.
• RN con cardiopatía congénita compleja con probable hipo- perfusión sistémica (preoperatorio, en cirugía y posoperatorio).
• RN que cursen con compromiso hemodinámico manifestado como:
– PAM menor que la correspondiente a su EG, los primeros 3 días de vida o valores menores a p10 desde el 4° día de vida.
– Caída de diuresis (menor a 1 ml/kg en 6 h).
– Acidosis metabólica (BE menor a -10 persistente) y/o aumento del ácido láctico (mayor a 27 mg/dL o 3 mmol/L).
– Necesidad de drogas vasoactivas para estabilización y manejo de presión arterial, gasto cardíaco o función miocárdica.
• Otras indicaciones según disponibilidad y criterio de neona- tólogo tratante:
– RN con anemia y que puedan requerir transfusión.
– RN con hidrocefalia hasta su intervención definitiva.
– RN con encefalopatía u otro trastorno neurológico agudo (convulsiones, infarto, malformaciones vasculares, etc).
-
Intervenciones sugeridas frente a valores anormales o tendencias ascendente y descendente significativas
Considerando los factores que más frecuentemente afectan la oxigenación tisular cerebral, se propone un algoritmo de in
tervención racional (Figuras 5) basado en publicación de El Dib y modificado de acuerdo con nuestra experiencia clínica[28].
En caso de valor de CrSO2 bajo 55% o si se presenta un descenso del valor de 20% con relación al valor basal o aumenta la fracción de extracción de O2 sobre 0,35 se sugiere el algoritmo de la Figura 4, en el que frente a descenso de oxigenación cerebral debe investigarse si es por disminución de entrega de O2 (que puede ser debido a disminución de contenido de O2, explicable por anemia o por disminución de saturación de Hb arterial) o si es por disminución de perfusión cerebral, en que pueden influir variables como hipocapnia, hipotensión, uso de presión intratorácica elevada en ventilación mecánica, disminución del gasto cardíaco o la presencia de Ductus arterioso persistente hemodinámicamente significativo (DAP HS). En caso de no tener respuesta en esa línea, evaluar causas de aumento del consumo de O2 cerebral, como pueden ser fiebre, dolor, agitación o convulsiones.
Por otro lado, en caso de CrSO2 sobre 85% o si presenta un ascenso del valor de 20% con relación al valor basal o disminuye la fracción de extracción de O2 bajo 0,10 se sugiere el algoritmo de la Figura 5. En este caso, buscaremos causas de aumento de entrega de oxígeno, como podrían ser aumento del contenido de oxígeno debido a hiperoxia o aumento de perfusión cerebral debido a hipercapnia o a hipertensión arterial. De no encontrar respuesta en esa línea, buscar causas de disminución de consumo de O2 cerebral, como podrían ser causas metabólicas (hipoglicemia), sedación excesiva o la aparición de lesión cerebral severa.
-
Monitorización de oxigenación cerebral en anestesia pediátrica cardioquirúrgica
Aunque la evidencia del uso de oximetría tisular cerebral con NIRS para mejorar los resultados neurológicos en cirugía cardíaca pediátrica es escasa, existe un uso creciente de esta tecnología. (74%, con una variación regional significativa). En operación de Norwood para síndrome de Hipoplasia de Ventrículo Izquierdo (SHVI), el 97% de UCI en EE.UU. utilizan oxime- tría cerebral (pre, durante y postcirugía).
De momento la monitorización de CrSO2 durante cirugía cardíaca y en período pre, peri y posoperatorio puede ayudar a identificar aquellos recién nacidos y lactantes con riesgo de lesión cerebral y/o resultado neurológico adverso, permitiendo utilizar estrategias para optimizar oxigenación y perfusión cerebral y así mejorar resultado, lo que se ha visto refrendado en series de pacientes con SHVI, coartación aortica y transposición de grandes vasos, en que se ha sido de utilidad prequirúrgica, durante cirugía y postquirúrgica. En 2020, Zaleski publicó un algoritmo de manejo practico para este grupo de pacientes (teniendo en consideración que la heterogeneidad de estos pacientes requiere una aproximación individualizada a su condición fisiopatológica)[29].
En este algoritmo se propone que aquellos pacientes en que CrSO2 sea menor a 60%, o muestre tendencia al descenso, exista diferencia mayor a 10% entre valor derecho e izquierdo o no aumente con hipotermia, primero que nada, debe asegurarse vía aérea permeable y adecuada oxigenación. Si hecho esto, no mejoran los valores, verificar integridad de la monitori- zación (confirmar adecuado posicionamiento del sensor, evitar fuentes luminosas que afecten las mediciones, evitar rotación de cabeza, colocando en línea media y verificar buena calidad de señal).
Habiendo pasado esta estos puntos, enfocarse entonces en buscar causas de menor entrega de O2 cerebral (evaluar FIO2, descartar hipocapnia, evaluar hemodinamia y corregir anemia si la hay, considerando en pacientes con cardiopatía cianótica hematocrito menor a 40%). En caso de estar en bypass cardiopulmonar excluir malposición de cánula (aortica y venosa), evaluar adecuado soporte de bypass cardiopulmonar. Por otro lado, descartar causas de aumento del consumo de O2 cerebral, en ese caso optimizar sedación/anestesia, prevenir hipertermia, considerar hipotermia, descartar convulsiones y patología intracraneana (Zaleski).
-
Medición de oxigenación tisular somática
Las mediciones de oxigenación somática con NIRS (renal y mesentérico), han mostrado que un descenso sostenido de la saturación regional somática puede ser signo precoz de compromiso circulatorio, especialmente si la autorregulación cerebral está intacta ya que tomará más tiempo evidenciarse el compromiso en descenso de CrSO2.
En relación con la medición de oxigenación renal con NIRS (RrSO2), se ha documentado en los últimos años que la injuria renal aguda en período neonatal puede ser sustrato para daño renal crónico en edades pediátricas o adultez. Además, la creatinina y el débito urinario pueden permanecer inalterados hasta 24 – 48 h después de que noxa haya afectado riñón, por lo que, en la búsqueda de monitorizar continuamente riñón, se comenzó a utilizar NIRS renal (RrSO2), acumulando información en diversas condiciones destacando recién nacidos prematuros extremos, neonatos con encefalopatía hipóxico-isquémica (EHI) en hipotermia terapéutica, recién nacidos con Ductus arterioso persistente hemodinámicamente significativo (DAP HS), hipotensión y/o sepsis. En condiciones habituales un descenso mantenido en sus valores puede ser un signo precoz de cambio en la perfusión sistémica y regional, como también de disminución del gasto cardíaco, hasta horas antes de la aparición de manifestaciones clínicas o de laboratorio y la explicación es la incapacidad del riñón de autorregular flujo sanguíneo. Existe literatura creciente acerca de valores normales de RrSO2 y se han publicado algoritmos para su interpretación y eventual intervención terapéutica, teniendo en cuenta que al igual que con CrSO2, esta información debe interpretarse en contexto clínico y en integración con examen físico, monitorización habitual y hallazgos ecográficos[30],[31],[32].
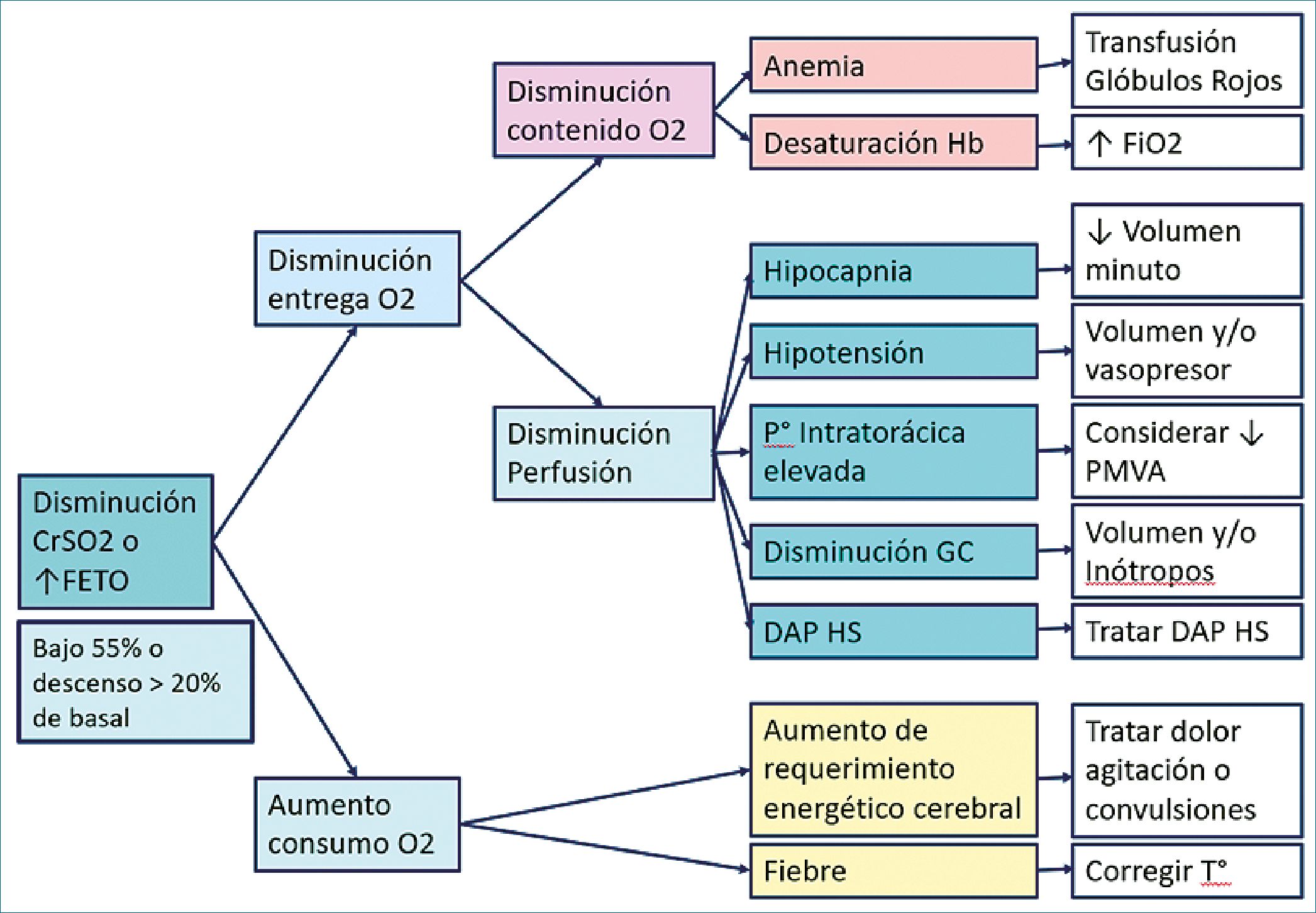
Figura 4. Algoritmo sugerido para descenso de CrSO2 o elevación de FTOE. CrSO2: saturacion reghional cerebral; FETO: fracción de extracción tisular de oxígeno; O2: oxígeno; Hb: hemoglobina; P°: presión; GC: gasto cardíaco; DAP HS: ductus arterioso persistente hemodinamicamente signioficativo; FiO2: fracción inspirada de oxígeno; PMVA: presión media de vía aerea; T°: temperatura.
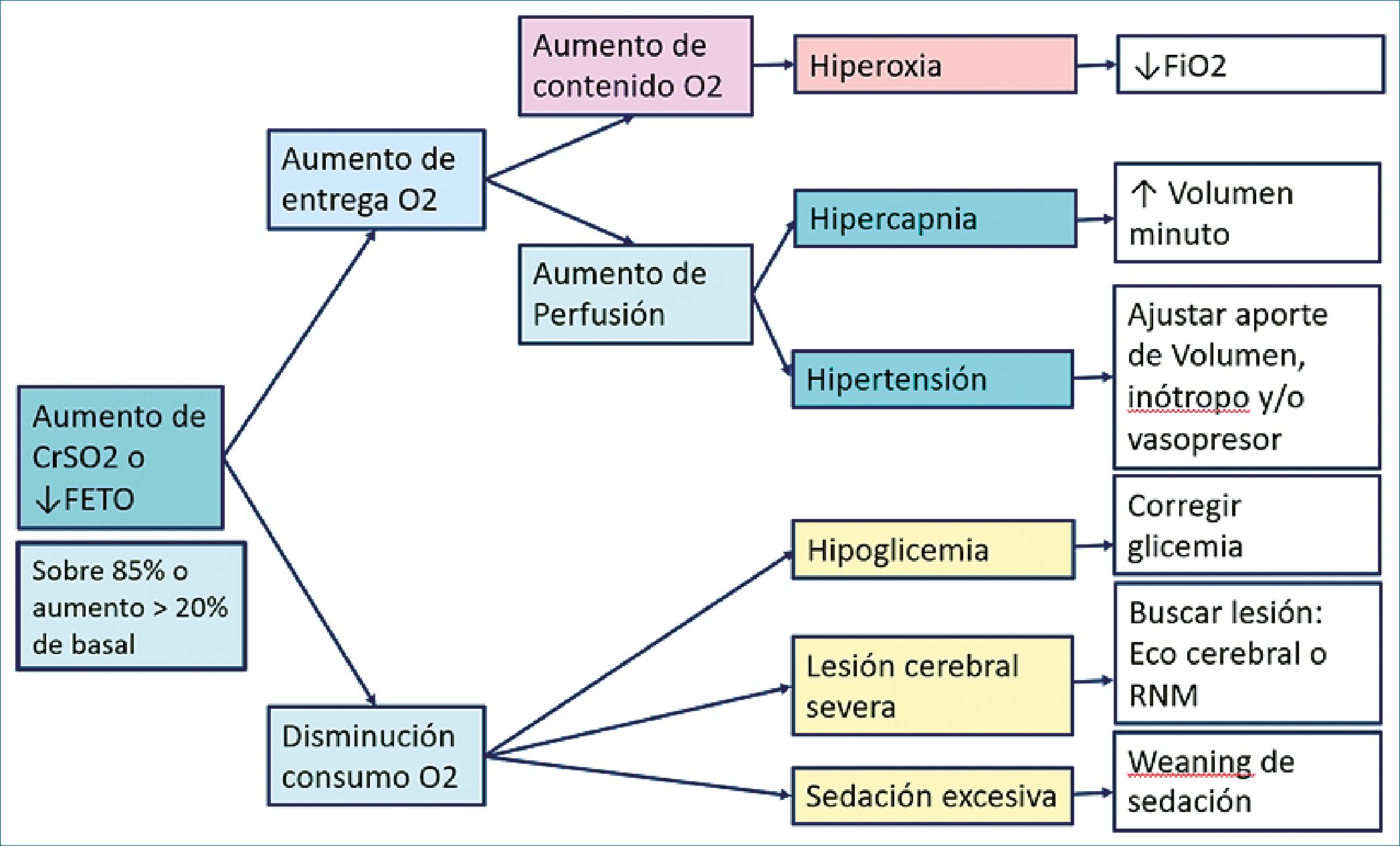
Figura 5. Algoritmo sugerido para ascenso de CrSO2 o disminución de FTOE. CrSO2: saturación regional cerebral; FETO: fracción de extracción tisular de oxígeno; O2: oxígeno; FiO2: fracción inspirada de oxígeno; RNM: resonancia magnética cerebral.
Respecto a la oxigenación tisular mesentérica (MrSO2), sus valores tienen mucha mayor variabilidad que las mediciones a nivel cerebral (CrSO2) y renal (RrSO2)[33]. Esto está dado por la interfase aire – líquido del intestino subyacente al sensor y por la absorción de luz por pigmentos presentes en meco- nio. La tendencia en el tiempo de los valores ha mostrado ser más valiosa y útil que valores aislados. De todas formas, se ha observado correlación con NEC e hipoxia intestinal los descensos sostenidos de saturación mesentérica con aumento de fracción de extracción de O2 mesentérico y disminución de variabilidad en los valores de saturación mesentérica. De momento, es difícil definir un valor de corte específico en cada paciente. Sin embargo, valores inferiores al 42% se correlacionaron fuertemente con isquemia, mientras que valores superiores a 52% son más indicativos de pacientes sin patología intestinal[34].
Finalmente, la monitorización continua con NIRS mesenté- rico (MrSO2) o renal (RrSO2) es útil para evaluar de forma no invasiva los cambios en perfusión abdominal en recién nacidos con gastrosquisis durante la fase de reducción intestinal. En pacientes con gastrosquisis que han sido sometidos a reducción intestinal y que corren riesgo de síndrome compartimental abdominal e isquemia intestinal, la monitorización con NIRS en este período (principalmente saturación renal) como indicador indirecto de perfusión mesentérica y sistémica, puede detectar tempranamente isquemia intestinal. Esto se explica porque el flujo sanguíneo renal y mesentérico se autorregula de forma menos eficaz que el cerebral, por lo que descenso sostenido de RrSO2 o MrSO2 en estos pacientes es un signo de alerta precoz de síndrome compartimental abdominal[35].
En resumen, la medición de oxigenación cerebral a través de NIRS, con la tecnología actualmente en uso, tiene la ventaja de ser método no invasivo de monitorización de oxigenación cerebral, al lado del paciente y en tiempo real. En recién nacidos se consideran valores normales de crSO2: 55 – 60 (límite bajo) a 85% – 90% (límite alto), sin olvidar que variaciones de más de 20% del valor en un paciente que se encontraba estable también es signo de cambio en perfusión/oxigenación que amerita estudio, resaltando la importancia de las tendencias. Valores fuera de rango normal o con tendencia al descenso o ascenso significativo, amerita investigar la etiología que originaron estos cambios y entonces actuar. Si bien evidencia aun es escasa, ha incrementado su uso en UCIN y pabellón, dada su sensibilidad para detectar hipoxia cerebral. Como desventaja actual se deben considerar que la interpretación de un determinado valor puede ser algo compleja sin entrenamiento adecuado, por lo que es relevante interiorizarse en su funcionamiento y tener claro que su utilidad depende de la integración con información obtenida del examen físico, la monitorización clásica, parámetros bioquímicos y ecografía cardíaca, cerebral y/o pulmonar (ya sea point of care o formal).
Conflicto de intereses:
Desarrollo de laboratorio de Monitorización hemodinámica entre 2015 y 2019, realizado en dependencias de Facultad de Medicina Occidente de la Universidad de Chile, apoyado por Medtronic.
-
Referencias
1. Joseph RM, O’Shea TM, Allred EN, Heeren T, Hirtz D, Jara H, et al.; ELGAN Study Investigators. Neurocognitive and Academic Outcomes at Age 10 Years of Extremely Preterm Newborns. Pediatrics. 2016 Apr;137(4):e20154343. https://doi.org/10.1542/peds.2015-4343 PMID:27006473
2. Hyttel-Sorensen S, Pellicer A, Alderliesten T, Austin T, van Bel F, Benders M, et al. Cerebral near infrared spectroscopy oximetry in extremely preterm infants: phase II randomised clinical trial. BMJ. 2015 Jan;350 jan05 2:g7635. https://doi.org/10.1136/bmj.g7635 PMID:25569128
3. da Costa CS, Czosnyka M, Smielewski P, Mitra S, Stevenson GN, Austin T. Monitoring of cerebrovascular reactivity for determination of optimal blood pressure in preterm infants. J Pediatr. 2015 Jul;167(1):86–91. https://doi.org/10.1016/j.jpeds.2015.03.041 PMID:25891381
4. van Bel F, Lemmers P, Naulaers G. Monitoring neonatal regional cerebral oxygen saturation in clinical practice: value and pitfalls. Neonatology. 2008;94(4):237–44. https://doi.org/10.1159/000151642 PMID:18784420
5. Wahr JA, Tremper KK, Samra S, Delpy DT. Near-infrared spectroscopy: theory and applications. J Cardiothorac Vasc Anesth. 1996 Apr;10(3):406–18. https://doi.org/10.1016/S1053-0770(96)80107-8 PMID:8725427
6. Garvey AA, Dempsey EM. Applications of near infrared spectroscopy in the neonate. Curr Opin Pediatr. 2018 Apr;30(2):209–15. https://doi.org/10.1097/MOP.0000000000000599 PMID:29369068
7. Althobaiti M, Al-Naib I. Recent developments in instrumentation of functional Near Infrared Spectroscopy Sistems. Appl Sci (Basel). 2020;10(18):6522. https://doi.org/10.3390/app10186522.
8. Lima A, Bakker J. Noninvasive monitoring of peripheral perfusion. Intensive Care Med. 2005 Oct;31(10):1316–26. https://doi.org/10.1007/s00134-005-2790-2 PMID:16170543
9. Watzman HM, Kurth CD, Montenegro LM, Rome J, Steven JM, Nicolson SC. Arterial and venous contributions to near-infrared cerebral oximetry. Anesthesiology. 2000 Oct;93(4):947–53. https://doi.org/10.1097/00000542-200010000-00012 PMID:11020744
10. Naulaers G, Meyns B, Miserez M, Leunens V, Van Huffel S, Casaer P, et al. Use of tissue oxygenation index and fractional tissue oxygen extraction as non-invasive parameters for cerebral oxygenation. A validation study in piglets. Neonatology. 2007;92(2):120–6. https://doi.org/10.1159/000101063 PMID:17377413
11. Sood BG, McLaughlin K, Cortez J. Near-infrared spectroscopy: applications in neonates. Semin Fetal Neonatal Med. 2015 Jun;20(3):164–72. https://doi.org/10.1016/j.siny.2015.03.008 PMID:25934116
12. Wardle SP, Yoxall CW, Weindling AM. Cerebral oxygenation during cardiopulmonary bypass. Arch Dis Child. 1998 Jan;78(1):26–32. https://doi.org/10.1136/adc.78.1.26 PMID:9534672
13. Jobsis FF. Noninvasive, infrared monitoring of cerebral and myocardial oxygen sufficiency and circulatory parameters. Science 1977;198:1264e7. https://doi.org/10.1126/science.929199.
14. Dent CL, Spaeth JP, Jones BV, Schwartz SM, Glauser TA, Hallinan B, et al. Brain magnetic resonance imaging abnormalities after the Norwood procedure using regional cerebral perfusion. J Thorac Cardiovasc Surg. 2006 Jan;131(1):190–7. https://doi.org/10.1016/j.jtcvs.2005.10.003 PMID:16399311
15. Kurth CD, Levy WJ, McCann J. Near-infrared spectroscopy cerebral oxygen saturation thresholds for hypoxia-ischemia in piglets. J Cereb Blood Flow Metab. 2002 Mar;22(3):335–41. https://doi.org/10.1097/00004647-200203000-00011 PMID:11891439
16. Hou X, Ding H, Teng Y, Zhou C, Tang X, Li S, et al. Research on the relationship between brain anoxia at different regional oxygen saturations and brain damage using near-infrared spectroscopy. Physiol Meas. 2007 Oct;28(10):1251–65. https://doi.org/10.1088/0967-3334/28/10/010 PMID:17906392
17. Nachar RA, Booth EA, Friedlich P, Borzage M, Soleymani S, Wider MD, et al. Dose-dependent hemodynamic and metabolic effects of vasoactive medications in normotensive, anesthetized neonatal piglets. Pediatr Res. 2011 Nov;70(5):473–9. https://doi.org/10.1203/PDR.0b013e31822e178e PMID:21775923
18. Austin EH 3rd, Edmonds HL Jr, Auden SM, Seremet V, Niznik G, Sehic A, et al. Benefit of neurophysiologic monitoring for pediatric cardiac surgery. J Thorac Cardiovasc Surg. 1997 Nov;114(5):707–15. https://doi.org/10.1016/S0022-5223(97)70074-6 PMID:9375600
19. Alderliesten T, Dix L, Baerts W, Caicedo A, van Huffel S, Naulaers G, et al. Reference values of regional cerebral oxygen saturation during the first 3 days of life in preterm neonates. Pediatr Res. 2016 Jan;79(1-1):55–64. https://doi.org/10.1038/pr.2015.186 PMID:26389823
20. P. Lemmers & cols. Clinical Applications of Near-Infrared Spectroscopy in Neonates. Hemodynamics and Cardiology: Neonatology Questions and Controversies. 3rd ed. Elsevier, Inc.; 2019.
21. Alderliesten T, Lemmers PM, van Haastert IC, de Vries LS, Bonestroo HJ, Baerts W, et al. Hypotension in preterm neonates: low blood pressure alone does not affect neurodevelopmental outcome. J Pediatr. 2014 May;164(5):986–91. https://doi.org/10.1016/j.jpeds.2013.12.042 PMID:24484771
22. Sood BG, McLaughlin K, Cortez J. Near-infrared spectroscopy: applications in neonates. Semin Fetal Neonatal Med. 2015 Jun;20(3):164–72. https://doi.org/10.1016/j.siny.2015.03.008 PMID:25934116
23. Lemmers PM, Zwanenburg RJ, Benders MJ, de Vries LS, Groenendaal F, van Bel F, et al. Cerebral oxygenation and brain activity after perinatal asphyxia: does hypothermia change their prognostic value? Pediatr Res. 2013 Aug;74(2):180–5. https://doi.org/10.1038/pr.2013.84 PMID:23728382
24. Alderliesten, van Bel, van der Aa, Steendijk, van Haastert, de Vries, Groenendaal & Lemmers. Low Cerebral Oxygenation in Preterm Infants Is Associated with Adverse Neurodevelopmental Outcome. J Pediatr. 2019. Apr;207:109-116
25. Tombolini S, De Angelis F, Correani A, Marchionni P, Monachesi C, Ferretti E, et al. Is low cerebral near infrared spectroscopy oximetry associated with neurodevelopment of preterm infants without brain injury? J Perinat Med. 2022 Mar;50(5):625–9. https://doi.org/10.1515/jpm-2021-0498 PMID:35316597
26. Hyttel-Sorensen S, Pellicer A, Alderliesten T, Austin T, van Bel F, Benders M, et al. Cerebral near infrared spectroscopy oximetry in extremely preterm infants: phase II randomised clinical trial. BMJ. 2015 Jan;350 jan05 2:g7635. https://doi.org/10.1136/bmj.g7635 PMID:25569128
27. Hansen ML, Pellicer A, Hyttel-Sørensen S, Ergenekon E, Szczapa T, Hagmann C, et al. Cerebral Oximetry Monitoring in Extremely Preterm Infants. N Engl J Med. 2023 Apr;388(16):1501–11. https://doi.org/10.1056/NEJMoa2207554 PMID:37075142
28. El-Dib M, Soul JS. Monitoring and management of brain hemodynamics and oxygenation. Handb Clin Neurol. 2019;162:295–314. https://doi.org/10.1016/B978-0-444-64029-1.00014-X PMID:31324316
29. Zaleski KL, Kussman BD. Near-Infrared Spectroscopy in Pediatric Congenital Heart Disease. J Cardiothorac Vasc Anesth. 2020 Feb;34(2):489–500. https://doi.org/10.1053/j.jvca.2019.08.048 PMID:31582201
30. Bonsante F, et al. Low Renal O2 Saturation (NIRS), the 1st day of life is associated with AKI in very preterm infants, Bonsante F. Neonatology. 2019;115(3):198–204. https://doi.org/10.1159/000494462 PMID:30645992
31. Harer MW, Chock VY. Renal Tissue Oxygenation Monitoring-An Opportunity to Improve Kidney Outcomes in the Vulnerable Neonatal Population. Front Pediatr. 2020 May;8:241. https://doi.org/10.3389/fped.2020.00241 PMID:32528917
32. Rallis D, Christou H, Abdulhayoglu E, El-Dib M. A narrative review of the clinical applications of renal NIRS and integration with cerebral NIRS in the NICU. J Perinatol. 2025 Apr; https://doi.org/10.1038/s41372-025-02303-3 PMID:40234599
33. McNeill S, Gatenby JC, McElroy S, Engelhardt B. Normal cerebral, renal and abdominal regional oxygen saturations using near-infrared spectroscopy in preterm infants. J Perinatol. 2011 Jan;31(1):51–7. https://doi.org/10.1038/jp.2010.71 PMID:20539273
34. Metcalfe KH, Stienstra R, McHoney M. NIRS as a biomarker of bowel ischaemia & surgical pathology: A meta-analysis of studies in newborns. Early Hum Dev. 2021 Oct;161:105437. https://doi.org/10.1016/j.earlhumdev.2021.105437 PMID:34411803
35. Variane GF, Pietrobom RF, Noh CY, Van Meurs KP, Chock VY. Newer indications for neuromonitoring in critically ill neonates. Front Pediatr. 2023 Apr;11:1111347. https://doi.org/10.3389/fped.2023.1111347 PMID:37187586

 ORCID
ORCID