Mauricio Ibacache Figueroa1,2
Recibido: 21-08-2025
Aceptado: 10-09-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 621-631|https://doi.org/10.25237/revchilanestv54n5-18
PDF|ePub|RIS
Pharmacological considerations in the anesthesia of the obese pediatric patient
Abstract
Pediatric obesity is a prevalent problem in Chile. The pathophysiological changes associated with obesity affect pharmacological parameters, which induce potential dosing errors, especially during pediatric anesthesia. Dosing based on total body weight would be inadequate in this population, so diverse metrics, such as ideal body weight or lean body weight, among others, have been proposed to improve dosing accuracy. However, there is no single metric applicable to all anesthetics. The choice of an appropriate size descriptor depends on the drug, dosing type (bolus or maintenance), and available pharmacokinetic information. The use of pharmacokinetic/pharmacodynamic models, incorporated into infusion pumps, and effect monitoring are essential for individualizing dosing. This article reviews the relevance and definition of pediatric obesity, its pathophysiological consequences, and pharmacological considerations for safer anesthetic dosing.
Resumen
La obesidad infantil es un problema prevalente en Chile. Los cambios fisiopatológicos asociados a la obesidad provocan alteraciones en los parámetros farmacológicos que inducen potenciales errores de dosificación, especialmente durante la anestesia pediátrica. La dosificación basada en el peso corporal total sería inadecuada en esta población, por lo que se han propuesto diversas métricas, como el peso corporal ideal, el peso corporal magro, entre otras, para mejorar la precisión en la dosificación. Sin embargo, no existe una métrica única aplicable a todos los anestésicos. La elección del escalar de peso depende del fármaco, tipo de dosificación (bolo o mantenimiento) y la información farmacocinética disponible. El uso de modelos farmacocinéticos/farmacodinámicos, incorporados en bombas de infusión y la monitorización de los efectos es fundamental para individualizar la dosificación. El artículo revisa la relevancia y definición de la obesidad infantil, sus efectos fisiopatológicos y las consideraciones farmacológicas para una dosificación anestésica más segura.
Este artículo pretende revisar la relevancia y definición de obesidad en pediatría, sus alteraciones fisiopatológicas asociadas y proponer algunas consideraciones farmacocinéticas y farmacodinámicas relevantes para la dosificación de anestésicos en esta población.
-
Relevancia de la obesidad infantil
La obesidad infantil en Chile es un problema grave, con tasas que se encuentran entre las más altas de Latinoamérica. Esta situación se ha visto exacerbada en nuestra sociedad por factores socioculturales tales como: el sedentarismo, la mala alimentación, hábitos familiares poco saludables y desigualdades socioeconómicas[10].
El Mapa Nutricional de Junaeb 2024 muestra que 27% de los niños preescolares hasta 1° medio tienen sobrepeso, 17,9% obesidad y 6% obesidad severa, lo que significa que más de la mitad de los niños y adolescentes tienen sobrepeso u obesidad[11].
Además, es importante recordar que la obesidad infantil se asocia a una serie de consecuencias que pueden afectar nuestro quehacer anestesiológico. La obesidad infantil puede estar asociada a enfermedades crónicas como diabetes tipo 2, hígado graso no alcohólico, apnea obstructiva del sueño, hipertensión y problemas cardiovasculares. También puede afectar la salud mental, con problemas de autoestima, ansiedad y depresión que pueden influir marcadamente en el manejo y los resultados de procedimientos anestésico-quirúrgicos[6],[10].
-
Definición de obesidad infantil
En Chile, la obesidad infantil se define como un aumento del peso corporal más allá de los valores aceptables para la edad y la estatura, a expensas de un aumento de la masa grasa, que implica riesgos para la salud[12].
En niños menores de 5 años, se define en la práctica clínica como una desarmonía entre el peso y la talla, siendo el primero excesivo en relación con la segunda, según una población de referencia. Se utiliza la relación peso para la talla (P/T) en relación a estándares internacionales de la OMS, diagnosticándose obesidad cuando la relación P/T es mayor a +2 desviaciones estándar (DE) y sobrepeso cuando la relación es +1 a 1,9 DE (Tabla 1)[12].
Entre los 5 a los 19 años, se evalúa utilizando el índice de masa corporal (IMC = peso en kg/talla en m2) para la edad y el sexo. Específicamente, se considera obesidad cuando el IMC está por encima del percentil 95 para la edad y sexo del niño y sobrepeso si el IMC está entre el percentil 85 y 95, según los estándares de referencia del National Center for Health Statistics (NCHS) de Estados Unidos, que son utilizados en Chile (Tabla 2) [12].
| Tabla 1. Puntos de corte que definen el estado nutricional de niños y adolescentes menores a 5 años | |
| Estado nutricional según P/T | DE (estándar OMS) |
| Obesidad | > +2 |
| Sobrepeso | +1 a +1,9 |
| Eutrofia | -0,9 a +0,9 |
| Riesgo de desnutrición | -1 a -1,9 |
| Desnutrición | < -2 |
Cambios fisiopatológicos relevantes en niños obesos
Dosificar anestésicos y en especial los anestésicos intravenosos en niños con obesidad puede llegar a ser un desafío significativo debido a los cambios fisiológicos y patológicos asociados la obesidad.
• Composición corporal: Existe un aumento significativo tanto en la masa grasa como en la masa libre de grasa (MLG) [13]. La masa grasa puede representar 30% al 50% del peso total y hasta el 73% del exceso de peso en niños obesos[3],[14].
En general, como ocurre en adultos, la MLG también aumenta y lo hace en menor proporción que la masa grasa, reduciendo el porcentaje de MLG por kilogramo de PCT[2],[14]. Se acepta que la MLG en niños obesos tiene mayor contenido de agua debido a una expansión del espacio de agua extracelular. La relación de masa magra a grasa cambia de aproximadamente 4:1 en niños no obesos, a 3:2 en niños obesos[15]. Sin duda estos cambios pueden influenciar importantemente la disposición de los fármacos anestésicos.
• Sistema cardiovascular: Se observa un aumento del volumen sanguíneo, el gasto cardíaco y el flujo a los órganos (esplácnico y hepático)[13]. Estos cambios pueden impactar la distribución y el aclaramiento de los fármacos, especialmente para aquellos con altas tasas de extracción hepática[4].
• Sistema respiratorio: Los niños obesos pueden presentar una reducción de los volúmenes pulmonares, la capacidad residual funcional, la capacidad vital, el volumen espiratorio forzado y la distensibilidad pulmonar total. También experimentan un aumento del trabajo respiratorio, obstrucción de la vía aérea pequeña y presencia de atelectasias. Estos cambios pueden impactar la entrada y salida de los fármacos inhalatorios[1].
• Sistema hepático: Es común encontrar la presencia de hígado graso en niños obesos, que puede progresar a estea- tohepatitis[2]. Estos cambios pueden alterar la expresión y actividad de las enzimas metabólicas (citocromos P450 y enzimas UDP-glucoronosiltranferasas), lo que podría afectar el metabolismo y la eliminación de los fármacos[1],[5],[6]. Sin embargo, la evidencia disponible sobre el impacto específico en la actividad enzimática es contradictorio; por ejemplo, la actividad de CYP3A puede disminuir con la duración de la obesidad, mientras que otras enzimas pueden aumentar o no verse afectadas[1],[5],[13]. En la mayoría de los niños obesos, la función hepática (incluido el flujo sanguíneo hepático) permanece relativamente inalterada[1].
• Sistema renal: Se ha reportado un mayor tamaño renal y un aumento en la tasa de filtración glomerular[1],[2],[13]. Sin embargo, la obesidad prolongada puede llevar a daño renal y eventualmente reducir el aclaramiento de algunos fármacos, pero la evidencia disponible es contradictoria[4]. Se cree que la secreción tubular activa de fármacos puede estar aumentada en pacientes obesos[5].
• Unión a proteínas: En obesos, se ha reportado variaciones en la unión a proteínas plasmáticas como la a1-glicoproteína ácida, y la alteración de la unión a lipoproteínas debido a niveles elevados de colesterol y triglicéridos, aunque el impacto general en los volúmenes de distribución no es concluyente[2],[5].
• Motilidad y permeabilidad gastrointestinal: Se ha observado un aumento en el vaciamiento gástrico, la motilidad y la permeabilidad intestinales en niños obesos[5],[14]. Estos cambios podrían teóricamente mejorar la biodisponibilidad, aunque muchos estudios no han encontrado un impacto significativo[4],[5].
• Inflamación crónica: La obesidad se asocia con una respuesta inflamatoria crónica que puede afectar la respuesta a los tratamientos inmunológicos con escasa relevancia para el manejo anestésico[4],[5].
-
Desafíos en la dosificación de fármacos
La dosificación óptima de fármacos en niños obesos presenta desafíos significativos debido a los cambios fisiológicos y en la composición corporal que afectan la farmacocinética y la farmacodinamia de los fármacos en general, pero en especial aquellos que son administrados de forma intravenosa. El exceso de peso en sujetos obesos es aproximadamente 75% de masa grasa y el resto masa magra. El aumento de la masa grasa afecta en mayor medida la distribución de los anestésicos lipofílicos, y el aumento de la masa magra influye en el aclaramiento de estos. La dosificación lineal basada en el PCT es a menudo inadecuada y puede resultar en errores de dosificación significativos[1],[2],[6]. Se han propuesto diversas escalas de peso para una dosificación más precisa, incluyendo el peso corporal ideal (PCI), la masa o peso corporal magro (PCM), el peso corporal ajustado (PCA) y la alometría, entre otros. Sin embargo, no existe una regla universal sobre qué métrica utilizar, y su cálculo puede ser complejo para los clínicos[4],[7]-[9]. Existe, menos información sobre el impacto de la obesidad en la farmacodinamia, y si bien la evidencia que sugiere que los pacientes obesos pueden mostrar una respuesta alterada a fármacos antihipertensivos, hipoglicemiantes u otros, pareciera ser que el impacto en la dinamia de los anestésicos es escaso[3],[5]. Sin embargo, las alteraciones farmacodinámicas en niños obesos, en comparación con niños no obesos, son complejas y menos comprendidas que los cambios farmacocinéticos.
Tabla 2. Puntos de corte que definen el estado nutricional de niños y adolescentes entre 5 y 19 años.
| Estado nutricional según IMC | z IMC (OMS) | IMC a los 19 años |
| Obesidad severa | > +3 | 36 |
| Obesidad | +2 a +2,9 | 30 |
| Sobrepeso | +1 a +1,9 | 25 |
| Eutrofia | -0,9 a +0,9 | 19 – 24 |
| Riesgo de desnutrición | -1 a -1,9 | 18,5 – 17,5 |
| Desnutrición | < -2 | 16,5 – 17,5 |
Impacto de la obesidad en los parámetros farmacocinéticos de anestésicos intravenosos
La literatura sobre la farmacocinética y la dosificación adecuada en niños obesos es escasa, con un número limitado de estudios y, a menudo, con muestras pequeñas o diseños retrospectivos[1],[5],[6],[16]. Tanto en adultos como en niños, la obesidad se asocia con numerosos cambios fisiológicos y patológicos que pueden afectar la disposición de los medicamentos, incluyendo el aumento del gasto cardíaco y el volumen sanguíneo circulante, la alteración del flujo sanguíneo regional y la función hepática y renal[1],[5],[6],[13]. Estos cambios influyen en los parámetros farmacocinéticos como la biodisponibilidad, el volumen de distribución y el aclaramiento[4],[6],[13]. Los dos parámetros farmacocinéticos que sustentan la estimación de una dosis de anestésicos endovenosos son: el volumen de distribución y el aclaramiento o “clearance”. Es importante señalar que, en niños no obesos, estos parámetros contribuyen a la mayor variabilidad de la dosis observada en la anestesia pediátrica, que además considera la influencia de la maduración de los procesos metabólicos en la población pediátrica más pequeña[9]. Esto implica que los clínicos que administren fármacos anestésicos a niños deben tener una acabada comprensión inicial de los principios farmacocinéticos que rigen la dosificación en un niño típico, ya que la obesidad propiciará cambios adicionales en estos parámetros, complejizando la dosificación de los anestésicos en niños obesos.
• Biodisponibilidad (F): Este parámetro farmacocinético es menos relevante en la anestesia, ya que la mayoría de los fármacos utilizados con este propósito son administrados vía endovenosa con una biodisponibilidad del 100%. Potencialmente, el aumento de la motilidad y permeabilidad intestinal descrita en niños obesos pudiese modificar la absorción de los fármacos. Se ha descrito una mayor biodisponibilidad de midazolam en pacientes obesos mórbidos adolescentes y adultos. No es claro que estos hallazgos sean directamente comparables en niños obesos de menor edad, aunque la evidencia sugiere que los cambios en la biodisponibilidad del midazolam podrían ser más aparentes en la obesidad extrema y potencialmente ligados a la duración de la obesidad[5],[14]. Sin embargo, la biodisponibilidad y la tasa de absorción de la mayoría de los fármacos administrados por vía oral, parece no alterarse significativamente en pacientes obesos. A su vez, la vía intramuscular no está recomendada y debe evitarse en población obesa debido a la infiltración grasa y el aumento del contenido de agua en el músculo que hacen que a la absorción sea impredecible[6],[15].
• Volumen de Distribución (VD): El VD determina la dosis de carga (inducción) de un fármaco[2],[9],[13]. En pacientes obesos los cambios en el VD pueden ser impredecibles, lo que complejiza el cálculo de bolos de carga para algunos fármacos[6],[14].
Similar a lo que ocurre en los adultos obesos, en niños obesos el VD de fármacos lipofílicos puede aumentar, disminuir o permanecer inalterado dependiendo del nivel de liposolubilidad del fármaco[6],[14]. En general, para la mayoría de los anestésicos liposolubles utilizados en una inducción anestésica, el VD aumenta en paralelo, pero no linealmente, con la masa grasa y el PCT[1],[4]. De esta forma, el cálculo de dosis de inducción (bolos) para fármacos que se distribuyen parcialmente en el tejido graso debe basarse en un PCA y que corresponde a la suma del PCI, más un porcentaje variable del exceso de peso sobre PCI. Para aquellos fármacos lipofílicos que se distribuyen marcadamente en el tejido graso o libremente entre el tejido magro y el graso, el cálculo podría basarse en el PCT[4],[9],[17].
Para fármacos hidrofílicos, el VD tiende a permanecer inalterado o aumentar levemente ya que varía con el contenido de agua corporal y su distribución tiende a limitarse al tejido magro, que en obesos aumenta en menor proporción respecto del tejido graso[1],[4],[6]. De esta manera, para fármacos hidro- fílicos el cálculo de las dosis de carga debería basarse en el peso corporal magro (PCM) o el PCI[1].
• Aclaramiento o “clearance” (CL): El CL determina la dosis de mantención de un fármaco[1],[2],[4]. El CL de los fármacos (lipofílicos o hidrofílicos) no aumenta linealmente con el PCT en individuos obesos[2],[9],[13]. Este parámetro farmacocinético, es función de la capacidad metabólica intrínseca del organismo y de la perfusión de órganos como el hígado y los riñones, y se relaciona de mejor forma con la masa magra de un individuo[2]. Aunque, la masa magra absoluta aumenta en niños obesos, lo hace en una proporción menor del exceso de peso total. Esto implica que, el cálculo de una dosis de mantención por kilo suele ser menor en niños obesos[2]. En general, para los fármacos con metabolismo de Fase I, los cambios en el CL varían según la madurez y/o prevalencia de la enzima específica (aumentando o disminuyendo) y para los fármacos metabolizados por enzimas de Fase II tiende a aumentar proporcionalmente al aumento del peso[1],[5],[6],[13],[14]. El aumento del gasto cardíaco y la perfusión de órganos metabolizadores, muchas veces observado en pacientes obesos, pueden aumentar el CL de los fármacos anestésicos[6]. De esta manera, se sugiere que las dosis de mantenimiento en niños obesos se ajusten a una métrica de tamaño corporal más relacionada con la masa magra, como el PCM, y no con el PCT[9],[18].
-
Métricas de tamaño corporal para dosificar anestésicos intravenosos
Hemos revisado que la dosificación lineal de anestésicos intravenosos basada en el PCT puede llevar a errores significativos en niños obesos[1],[9],[14]. Se han propuesto diversas métricas de peso para escalar tanto el VD como el CL y lograr una dosificación más precisa en estos pacientes, pero no existe un método para estimar las dosis que sea universalmente aceptado y que se adapte a todos los fármacos o a las diferentes fases de la anestesia[4],[7]-[9],[18].
A continuación, se muestran algunos de los escaladores de peso propuestos en la literatura (Tabla 3) y sus limitaciones:
Tabla 3. Descriptores de tamaño o escalares de peso.
| Descriptor | Fórmula |
| PCI | IMC50 para la edad x talla (cm)2 |
| PCM | 0,0817 x PCT (kg)0,6469 x talla (cm)04236 |
| MLG masculino | 42,92 x PCT (kg) x talla (cm)2 / 30,93 x talla (cm)2 + PCT (kg) |
| femenino | 37,99 x PCT (kg) x talla (cm)2 / 35,98 x talla (cm)2 + PCT (kg) |
| PCA | PCI + factor x (PCT – PCI) |
| Alometría VD | VD [70 kg] x (PCT/70)1 |
| CL | CL [70 kg] x (Peso/70)0,75 |
| MGN | MLG + fFat x (PCT-MLG) |
| ASC | PCT (kg) x talla (cm) / 3.600 |
PCT = peso corporal total; PCI = peso corporal ideal; PCM = peso corporal magro; MLG = masa libre de grasa; PCA = peso corporal ajustado, VD = volumen de distribución; CL = aclaramiento (clearance); MNG = masa normal grasa; ASC = área de superficie corporal.
• Peso Corporal Total (PCT): Es la métrica o escalar más comúnmente utilizado para dosificar pacientes normopeso. Utilizado con precaución, en pacientes obesos, podría ser apropiado para la dosificación de algunos fármacos lipofílicos con mayor distribución en tejidos grasos, como la succinilcolina. Sin embargo, dosificar linealmente al peso de pacientes obesos puede llevar a una sobredosificación, especialmente para fármacos que no se distribuyen extensamente en el tejido adiposo, como son varios de los inductores anestésicos. Esta potencial sobredosificación puede ocurrir al estimar los bolos, pero es más sustancial para las dosis de mantenimiento, ya que el CL no aumenta proporcionalmente con el PCT en individuos con obesidad.
Limitaciones: La dosificación basada en mg/kg de PCT asume una relación lineal entre el parámetro medido y el peso, lo cual es inadecuado para la mayoría de los fármacos en niños cuyas dosis han sido estimadas en adultos y especialmente en infantes donde el CL por kg es más alto. A su vez, puede llevar a sobredosis de fármacos, especialmente los lipofílicos, ya que el CL de muchos fármacos no aumenta proporcionalmente con el aumento del PCT.
• Peso Corporal Ideal (PCI): Propuesto para fármacos hidrofílicos como la morfina, benzodiazepinas, etomidato y relajantes musculares no despolarizantes, donde la distribución se restringe a un poco más que el tejido magro. También, se sugiere su uso para la estimación de dosis de mantenimiento; aunque no es la mejor métrica para todos los fármacos y existe poca comprensión entre los clínicos sobre cuándo y cómo calcularlo. Si bien existen varias formas para estimarlo, la estatura por sí sola se utiliza comúnmente para estimar el (PCI) en pacientes adultos.
Limitaciones: Su cálculo preciso no es sencillo, y en pacientes obesos no es el mejor escalar para todos los fármacos, ya que la estimación de una dosis utilizando kg por kilo de PCI puede ser insuficiente. A menudo se requiere más masa de la esperada por el PCI para la mayoría de los fármacos. Propuesto como métrica preferida para las dosis de mantenimiento de algunos fármacos, pero no para todos. Su cálculo puede ser complejo y existen múltiples métodos para estimarlo.
• Peso Corporal Magro (PCM)/ Masa Libre de Grasa (MLG): Estima la masa magra (órganos mayores, músculo, hueso, fluido extracelular y otros tejidos). El PCM corresponde a la diferencia entre el PCT y peso de la masa grasa. Esta diferencia en pacientes normopeso corresponde al 70%-90% del PCT; relación que está alterada en paciente obesos. Se han descrito diversas fórmulas para su estimación. La MLG comprende al músculo, hueso, órganos y líquido extracelular. El PCM incluye además tejido lipídico cerebral, médula ósea y membranas celulares que representa menos del 3%- 5% del PCT y, por lo tanto, en la práctica clínica, el PCM se suele usar indistintamente con la MLG. Se ha afirmado que es el escalar óptimo para la mayoría de los fármacos utilizados en anestesia, incluidos los opioides y varios agentes de inducción anestésica. Sin embargo, esta afirmación no está probada para todos los fármacos y su cálculo exacto en niños no es sencillo en la práctica clínica.
Limitaciones: Su aplicabilidad universal no está probada. Las fórmulas para calcular la MLG pueden ser inconsistentes o biológicamente implausibles en los extremos de peso y estatura. Aunque teóricamente atractiva para la dosificación de fármacos, su cálculo en niños no es sencillo ni universalmente validado. Una de las razones para esto es, que el CL no necesariamente aumenta de forma lineal con la MLG o el PCM en todo el rango de pesos.
• Peso Corporal Ajustado (PCA): Una métrica empírica que combina PCI y un porcentaje del exceso de peso, estimado con un factor de corrección específico para cada fármaco. Se ha sugerido para fármacos lipofílicos con distribución parcial en la grasa, utilizándose con buenos resultados para la dosificación del propofol, aminoglucósidos, heparina y enoxaparina.
Limitaciones: Se debe conocer el factor de corrección para cada fármaco particular, cuya información es escasa y no ha sido validado en niños.
• Alometría: La dosificación alométrica permite reglas de dosificación comunes para pacientes de diferentes tamaños y formas. Permite la estimación de los parámetros farmacocinéticos en diversos individuos, al relacionar el valor del parámetro farmacocinético estándar (valor del parámetro en un individuo de 70 kg) con el valor del PCT del individuo escalado a un exponente especifico. Se recomienda el escalado alométrico con un exponente de 0,75 para el CL, de 1 para los VD y 0,25 para la vida media. Se ha observado que la estimación alométrica describe de mejor forma la relación no lineal entre el tamaño (peso) y los procesos funcionales como CL y permite la predicción de dosis en los extremos del peso (niños y adultos obesos). Lo que hace sentido ya que a medida que un organismo crece, su taza metabólica no aumenta directamente, sino que aumenta más lento que el aumento de peso.
Limitaciones: La comprensión y el escalado alométrico es complejo en la práctica clínica.
• Masa Grasa Normal (MGN): Esta estimación corresponde a un enfoque basado en principios teóricos que busca ser aplicable a todos los fármacos, considerando la MLG y una contribución específica de la masa grasa específica (fFat) para cada fármaco. Probablemente, ofrece una forma más flexible de considerar el peso y la obesidad. Puede usarse como escalador para la dosis de carga y mantenimiento, aunque el factor de grasa (fFat) para el VD diferirá del estimado para el CL. Así, si fFat es cero, la MLG predice el tamaño (ej. para CL de remifentanilo, dexmedetomidina); si fFat es uno, el PCT predice el tamaño (ej. propofol, paracetamol); si fFat tiene un valor negativo, sugiere disfunción orgánica asociada a la grasa (ej. CL de dexmedetomidina en adultos mórbidamente obesos). Puede usarse para describir el CL en conjunto con la alometría.
Limitaciones: Su cálculo manual es complejo y poco práctico para los clínicos en el entorno operativo. El valor de fFat para la mayoría de los fármacos aún es desconocido.
• Área de superficie corporal (ASC): El ASC es un escalador más empírico que se utiliza comúnmente en oncología para la dosificación de medicamentos antineoplásicos y en intensivo pediátrico para la dosificación de diversos fármacos usados en este entorno. Describe una relación no lineal entre peso y función, asumiendo que niños y adultos son geométricamente similares. La relación entre superficie corporal y peso disminuye, dando cuenta de que dosis y Cl tienen una relación no lineal con el peso.
Limitaciones: Al tener dimensiones de área ignora la cuantificación de masa corporal. Tiende a sobrepredicir las dosis y Cl en niños menos de 25 kg y áreas de 1,8 m2.
A manera de síntesis podemos decir que para estimar las dosis de carga de los anestésicos endovenosos el VD es el parámetro clave. Para fármacos hidrofílicos, el PCI o PCM/MLG son opciones viables para estimar las dosis. Para fármacos lipofílicos o parcialmente lipofílicos, el PCT o el PCA pueden ser adecuados. La MGN (si se conoce el fFat) ofrece un escalar consistente y promisorio. Para estimar dosis de mantenimiento el CL es el determinante principal. El PCM/MLG o el PCA suelen sugerirse como idóneos. Sin embargo, el escalado alométrico utilizando la MGN es un enfoque teórico que debería mejorar la dosificación en la población pediátrica normopeso y obesa. La Figura 1, muestra la relación no lineal entre el PCT y el CL, sobreestimando el CL a medida que el peso aumenta. El PCT subestima el CL en niños, mientras que el ASC lo sobreestima. Los demás escalares (no lineales) muestran concordancia entre los 40 y 100 kg. El uso de la alometría con un exponente de 0,75 del PCT y MLG son similares a masas corporales inferiores a 100 kg.
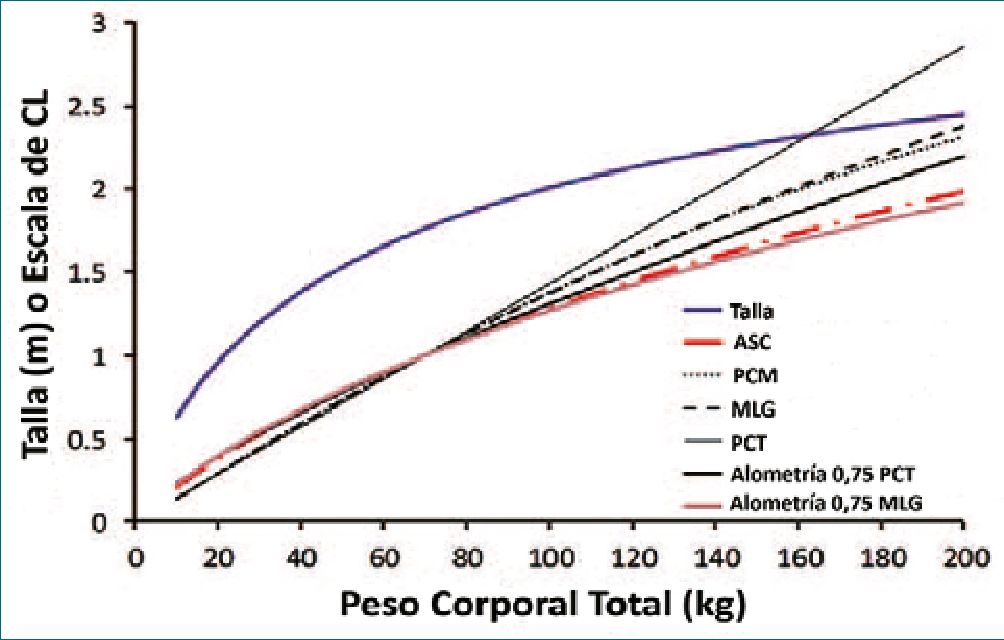
Figura 1. Métricas o escalares de tamaño corporal utilizadas para describir el CL en relación con 70 kg de PCT y maduración completa. Las métricas están basas en un hombre con una estatura típica para su edad y un PCT entre 10 y 200 kg. ASC= área de superficie corporal; ASC = área de superficie corporal; PCM = peso corporal magro; MLG = masa libre de grasa; PCT = peso corporal total. Modificado de Anderson BJ, Holford NH. What is the best size predictor for dose in the obese child? Paediatr Anaesth 2017; 27:1176-1184.
-
Cambios farmacocinéticos específicos de fármacos intravenosos
Las alteraciones farmacocinéticas en niños obesos son complejas y varían según el fármaco. Aunque hay una escasez de estudios directos que comparen la farmacocinética en niños obesos con otras poblaciones, tanto obesas como normopeso, la investigación existente sugiere que, en niños, los cambios en la composición corporal y la maduración influyen significativamente en la forma en que los medicamentos se distribuyen y eliminan. La dosificación de medicamentos en niños con obesidad es un área desafiante, y la extrapolación directa de los hallazgos farmacocinéticos de adultos obesos a niños obesos no siempre es científicamente sólida debido a las diferencias fisiológicas relacionadas con el crecimiento, la maduración y la progresión de la enfermedad.
• Propofol: La dosificación lineal basada en el PCT puede causar sobredosificación en niños obesos[1],[6],[8],[9],[19]. Si bien, hay evidencia que el uso de un PCA con un factor de 0,4 podría ser adecuado en pacientes obesos adultos, probablemente escalar el propofol con el PCT utilizando una función alométrica (exponente de 0,75) sería más recomen- dado[1],[17].
Se ha visto que el VD varía linealmente con el PCT y algunas fuentes lo han sugerido para estimar la dosis de inducción. Sin embargo, pareciera ser que el PCM podría ser más adecuado, ya que se correlaciona bien con el gasto cardíaco, aunque no existen estudios farmacométricos en niños que lo confirmen universalmente. Por lo tanto, se recomienda titular la dosis a la respuesta clínica durante la inducción. Un metaanálisis farmacocinético poblacional encontró que, al comparar adultos, adolescentes y niños obesos y no obesos, el CL de propofol estaba disminuido en adultos jóvenes, adolescentes y niños obesos[5],[19]. Específicamente, los adolescentes obesos con el mismo peso corporal que los adultos obesos, mostraron valores de CL más bajos que estos adultos. Sin embargo, sus valores de CL totales son más altos que los de adultos no obesos con pesos corporales más bajos. El CL del propofol aumentaría entonces con el exceso de peso corporal en adolescentes obesos, lo que significa que adolescentes obesos con pesos corporales superiores a los adultos no obesos pueden tener valores de CL de propofol más altos que los adultos no obesos. La evidencia sugiere que el CL del propofol aumenta de forma no lineal con el exceso de peso corporal. Así, para el mantenimiento, el PCT con un exponente alométrico de 0,75 sería una estrategia de dosificación adecuada[1],[9]. Las simulaciones indican que, con una tasa de administración fija en mg/kg/h, las concentraciones de propofol son más altas en niños obesos en comparación con niños normopeso. Esto se debe a que el CL por kilogramo es menor en niños obesos[5],[8].
• Fentanilo: El VD absoluto de fentanilo en adolescentes con obesidad severa fue comparable a los valores de adultos previamente establecidos[21]. Sin embargo, el VD normalizado por peso disminuyó con la obesidad en niños, lo que podría atribuirse a una mayor masa grasa corporal en niños obesos en comparación con los no obesos[22]. El metabolismo del fentanilo, un fármaco de alta extracción depende más del flujo sanguíneo hepático que de la capacidad enzimática del CYP3A4[23]. Un estudio piloto en adolescentes con obesidad severa encontró que el CL absoluto de fentanilo estaba aumentado en comparación con los valores previamente establecidos para adultos[21]. Sin embargo, cuando se normaliza por PCT, el CL normalizado por peso para el fentanilo disminuyó con la obesidad. Esto implica que regímenes de infusión similares basados en el peso pueden resultar en concentraciones de fentanilo en estado estacionario más altas en niños obesos, llevando a sobredosificación[23]. Se ha sugerido al PCM para el mantenimiento y PCA con un factor de 0,25 para la dosificación basada en el peso[1]. Los modelos farmacocinéticos fisiológicos sugieren que se necesita una tasa de infusión fija más baja, considerando la edad y el estado de obesidad[24].
• Remifentanilo: Es otro opioide comúnmente utilizado y apreciado por su corta duración de acción, lo que lo hace favorable en pacientes obesos. La farmacocinética del remifentanilo no difiere entre sujetos obesos y normopeso[6]. El metabolismo del remifentanilo se considera maduro al nacer y disminuye con la edad hasta alcanzar las tasas adultas en la adolescencia[1]. Se recomienda que la dosificación de remifentanilo se base en el PCM o el PCI y no en el PCT que puede resultar en concentraciones excesivamente altas[6]. El uso de la MLG en combinación con la alometría ha sido implementado con éxito en modelos que describen la farmacocinética del remifentanilo[1],[25].
• Morfina: El volumen de distribución de la morfina no cambia con la obesidad, y el fármaco no se acumula en la grasa corporal[6]. Esto significa que su distribución se basa principalmente en la masa magra. Debido a esta característica hidrofílica y a que su VD prácticamente no se ve afectado por la obesidad, la morfina se asemeja al comportamiento en niños no obesos[2],[6]. Se recomienda usar el PCI para dosificar la morfina en pacientes obesos[3],[6].
• Metadona: Las simulaciones de modelos PBPK indicaron que el CL absoluto aumentó con el incremento del tamaño corporal en cada grupo de edad, mientras que el CL normalizado por peso disminuyó[24]. El riesgo de sobredosificación aumenta ligeramente con la obesidad, siendo más pronunciado para ciertos genotipos Como el alelo CYP2B6*6/*6[24].
• Midazolam: La biodisponibilidad puede estar aumentada en pacientes obesos mórbidos. Los pacientes con obesidad mórbida tienen un VD sustancialmente aumentado[4],[5]. El CL aumenta con el peso en adolescentes obesos puede ser sustancialmente mayor que en adultos obesos mórbidos[5]. Estas diferencias podrían explicarse por la hipótesis de que, en la obesidad, la supresión de la actividad CYP3A aumenta con la duración de la enfermedad[23]. Un estudio farmacocinético dedicado en adolescentes con sobrepeso y obesidad mostró que el CL sistémico en estos adolescentes era sustancialmente más alto que el CL sistémico en adultos con obesidad mórbida[26]. De hecho, el CL de midazolam en adolescentes aumenta con la obesidad. Se recomienda al PCA o MLG para la dosificación[1].
• Dexmedetomidina: El VD de la dexmedetomidina, puede aumentar con la masa grasa[1],[27]. En un modelo universal de farmacocinética que revisó datos desde neonatos hasta adultos, se determinó que la masa grasa tiene una contribución con un factor fFat = 0,293 al VD[28]. Si bien la lipofilicidad por sí sola no siempre predice el VD, en el caso de la dexmedetomidina, la concentración en un niño obeso será mayor que en uno no obeso después de una dosis similar administrada como infusión[27]. La masa grasa, aunque de forma indirecta, también influye en el CL a través de la función metabólica y renal, independientemente de su efecto por el aumento de la masa corporal[9]. Simulaciones han mostrado que, aunque el CL expresado por kilo es menor en el niño obeso, el tiempo hasta el efecto pico se retrasa y las concentraciones plasmáticas son más altas en el niño obeso que en el no obeso, cuando se administra una dosis de 1 pg/kg[9]. Un estudio encontró que los niños con sobrepeso y los de peso normal requieren dosis similares de dexmedetomidina basadas en el peso corporal, ya que la masa grasa tendría un impacto mínimo hasta que el IMC no supere el percentil 95 para la edad[29]. Pareciera razonable que la dexmedetomidina se escale en niños obesos utilizando la MLG o la MGN, ya que su índice de contribución de la masa grasa está definido[9],[27],[28].
• Relajantes musculares: Los relajantes no depolarizantes son fármacos menos lipofílicos. Los estudios en adultos obesos han mostrado que no hay diferencias significativas en los parámetros farmacocinéticos entre pacientes obesos y no obesos, pero la duración de acción se prolonga cuando se dosifican por PCT. Se recomienda dosificarlos por PCI[6],[14]. Para la succinilcolina, la potencia en adolescentes obesos es similar a la de los no obesos, y si bien se sugiere dosificarla en función del PCT, la recuperación puede ser más prolongada[6],[30],[31].
-
Cambios farmacocinéticos de los anestésicos inhalatorios
Nuestra capacidad para predecir con precisión la dosificación de fármacos intravenosos es dimensionalmente más compleja que la de los anestésicos inhalatorios. Sin embargo, la administración de gases o anestesia inhalatoria en niños con obesidad presenta desafíos significativos debido a las alteraciones fisiológicas y farmacocinéticas que caracterizan a esta población[1]. Es crucial comprender estas particularidades para garantizar una anestesia segura y efectiva.
La obesidad afecta la absorción y eliminación (en inglés washin y washout) de los anestésicos inhalatorios. La farmacocinética de estos agentes depende principalmente de su solubilidad en la sangre (coeficiente de partición sangre/gas) y en los tejidos (coeficiente de partición tejido/sangre)[1],[6].
• Absorción (washin): Anestésicos como el sevoflurano y el desflurano son relativamente insolubles en la sangre y la mayoría de los órganos con alto flujo sanguíneo (grupo rico en vasos), lo que significa que sus constantes de tiempo son pequeñas y el equilibrio de la presión parcial se logra rápidamente entre la sangre y los tejidos. Sin embargo, en niños obesos, la hipertrofia orgánica (aumento del tamaño de los órganos) incrementa la capacidad de estos órganos para absorber el anestésico, lo que aumenta la constante de tiempo o el tiempo necesario para lograr el equilibrio de las presiones parciales en los diversos tejidos. El tiempo para equilibrar las presiones parciales en niños obesos es mayor que en niños no obesos, ya sea en el grupo rico en vasos (primeros 20 minutos de anestesia), en el grupo muscular (20 minutos a 2 h) o en el grupo de grasa (más de 2 h[1],[32].
• Eliminación (washout): La estrategia óptima para minimizar estas constantes de tiempo es utilizar el anestésico menos soluble. Por ejemplo, el desflurano tiene una solubilidad en grasa/sangre casi 100% menor que el sevoflurano, lo que significa que su eliminación después de más de 2 h de anestesia será más rápida[1],[32]. Los pacientes obesos pueden experimentar un retraso en la recuperación debido a la liberación tardía del anestésico volátil del tejido graso[6].
|Tomando en cuenta lo arriba descrito la elección del agente inhalatorio tiene mucho que ver con la solubilidad del agente empleado. En general, los anestésicos volátiles con menor solubilidad tienen un perfil de seguridad mejorado para los pacientes obesos. Aunque no hay estudios pediátricos
disponibles específicamente, se considera que el desflurano puede ser el anestésico volátil de elección para pacientes obesos debido a su menor solubilidad sangre-grasa, lo que permite una recuperación más rápida. Fármacos más liposolubles como el isoflurano, aumentan notablemente el tiempo de recuperación en individuos obesos[1],[6].
-
Impacto de la obesidad en la farmacodinamia
La farmacodinámica se refiere a los efectos de un medicamento en el cuerpo, incluyendo su eficacia y seguridad. Las alteraciones farmacodinámicas en niños obesos, en comparación con niños de peso normal o no obesos, son complejas y menos comprendidas que los cambios farmacocinéticos[5]. La evidencia disponible en este sentido es más limitada y de menos calidad. Es fundamental considerar la monitorización de los efectos, para guiar la dosificación y asegurar la profundidad anestésica adecuada.
A continuación, se detallan los cambios farmacodinámicos específicos observados o inferidos en niños obesos.
• Propofol: Los niños obesos pueden experimentar niveles de anestesia más profundos de lo necesario con las estrategias de dosificación habituales, lo que puede provocar un retraso en la recuperación y un aumento de los eventos respiratorios adversos perioperatorios[16],[33]. Un estudio mostró que la dosis de propofol necesaria para la pérdida del reflejo palpebral en niños obesos fue menor que en niños no obesos, lo que sugiere que los niños obesos podrían recibir una sobredosis si se les administra la misma dosis por kg que a los niños no obesos[34]. Por lo tanto, los niños obesos requieren menos propofol por kilo de PCT) para lograr el mismo efecto[3]. Sin embargo, otros estudios han indicado que la obesidad no afecta la relación concentración-BIS (Índice Biespectral) del propofol en adolescentes con obesidad grave. La concentración en el sitio de efecto para la mitad del efecto máximo (EC50) se ha estimado en 3,19 pg/mL, similar a la encontrada en niños no obesos y adultos obesos[35]. La nueromonitorización sigue siendo muy recomendada para guiar la dosificación de propofol en esta población.
• Analgésicos (opioides): Un estudio no encontró un aumento clínicamente significativo en las puntuaciones de dolor o el consumo de opioides en pacientes pediátricos (8-18 años) con un IMC más alto después de cirugía no cardíaca, a excepción de una ligera elevación del dolor después de cirugía neurocraneal. El estudio no encontró un aumento clínicamente importante en las puntuaciones de dolor ni en el consumo de opioides asociado a un mayor IMC en estos pacientes, cuando se administraron dosis ajustadas al PCT. De manera paradójica, un IMC más alto se asoció con una disminución del consumo de opioides posoperatorios (en equivalentes de morfina por kg)[36]. Se ha reportado que los niños obesos podrían tener mayor probabilidad de recibir sobredosis de morfina (cuando se corrige por el peso corporal ideal), lo que incrementa el riesgo de depresión respiratoria[3]. Este riesgo es particularmente preocupante debido a la alta prevalencia de la apnea obstructiva del sueño (SAOS) en niños obesos (13%-59% frente al 2%-3% en niños de peso normal)[6],[15]. Por ello, se recomienda reducir la dosis de opioides para mitigar la depresión respiratoria, especialmente en aquellos con SAOS[15].
• Dexmedetomidina: Un estudio determinó que la dosis efectiva (DE95) de dexmedetomidina para lograr una sedación adecuada fue similar en niños obesos y de peso normal (0,75 mg/kg frente a 0,74 mg/kg, basada en el PCT)[29]. Esto sugiere que, a pesar de los cambios fisiológicos, la respuesta a la dosis de este medicamento puede ser comparable. Vale la pena recordar que los niños obesos tienen un mayor riesgo de eventos respiratorios adversos perioperatorios. La dexmedetomidina es ventajosa en este contexto, ya que mantiene la permeabilidad y el tono de la vía aérea, incluso en niños con apnea obstructiva del sueño.
-
Rol de los modelos farmacocinéticos-farmacodinámicos (PK/PD)
Los modelos PK/PD integran las relaciones tiempo-concentración y tiempo-respuesta, incorporando efectos mixtos para estudiar la variabilidad en la respuesta a los fármacos. Estos modelos son fundamentales para optimizar la dosificación anestésica en diversas poblaciones ya que consideran los cambios relacionados con la edad, el tamaño y el desarrollo. La instalación de modelos PK/PD desarrollados en bombas de infusión continua, ha impulsado el desarrollo de la anestesia total endovenosa. Esta tecnología, permite la administración de infusiones continuas de anestésicos controladas por objetivo, en inglés Target Control Infusion (TCI), dirigidas a la obtención de concentraciones deseadas en plasma o en sitio efecto en poblaciones específicas[8],[9]. Aunque muchos modelos se desarrollaron en adultos, su aplicación se ha extendido a la pediatría[37]. Sin embargo, la generación de modelos PK/PD a partir de pacientes pediátricos obesos y su presencia en bombas de en esta población específica es escasa prácticamente inexistente.
Los modelos TCI pediátricos clásicos de propofol disponibles en las bombas comerciales, tales como Paedfusor[38] o Kataria[39] no están diseñados para uso en población obesa y cuando son utilizados en este tipo de pacientes pueden llevar a sobredosis, especialmente el modelo de Kataria que escala linealmente al PCT tanto los VD’s como los CL’s. Sin embargo, Paedfusor eleva su constante de eliminación a un exponente de 0,3, haciendo que su CL se escale casi alométricamente (escalamiento no lineal), por lo que debería dosificar mejor en esta población durante la mantención. Nuevos modelos que utilizan un escalamiento alométrico y el PCT, como el desarrollado por Eleveld et al.[40], ha mostrado buen rendimiento en adultos y niños normopeso, como también en adultos obesos. Aunque el modelo no ha sido validado específicamente en población pediátrica obesa, es probable que su utilización en esta población sea adecuada (Figura 2).
Al igual que con el propofol, la limitación más importante de una TCI de remifentanilo en pacientes pediátricos obesos es la ausencia de modelos adecuados programados en las bombas comerciales disponibles. El modelo de Minto et al.[41], disponible en las bombas de TCI, no se derivó de individuos obesos, ni tampoco de pacientes pediátricos, por lo tanto, su uso en población pediátrica obesa no estaría recomendado. El modelo de remifentanil desarrollado por Eleveld et al.[25], caracterizó la farmacocinética de este fármaco en pacientes adultos y niños no obesos, utilizando parámetros escalados a MLG con la ecuación de Al Sallami, un factor de maduración basado en la edad postmenstrual y relaciones alométricas compartimentales. Sin embargo, la presencia de población obesa en el modelo, especialmente niños obesos, es prácticamente nula. De esta forma, la dosificación y precisión en las concentraciones predichas es incierta en población pediátrica obesa, tanto del modelo de Eleveld, como el modelo pediátrico de Rigby-Jones et al.[42], para remifentanilo, que incluyen solo niños no obesos. En este sentido pareciera razonable utilizar estos modelos con pesos ajustados, asegurándose que administren velocidades de infusión (mcg/kg/min) más bajas en un niño con obesidad (Figura 3).
Morse et al.[28], desarrollaron un modelo farmacocinético universal para la administración de dexmedetomidina, utilizando datos pediátricos, adultos normopeso y obesos mórbidos para construirlo. El uso de la MGN para el cálculo de los volúmenes y de la MLG para el CL, el uso de alometría y la utilización de un factor de maduración basado en la edad postmenstrual, hace que este modelo sea consistente y probablemente utilizable en población pediátrica obesa. Sin embargo, se han descrito problemas en la estimación del V1 de este modelo y pareciera ser que administraría dosis de carga significativamente mayores a las recomendables[37]. Se sugiere entonces precaución en la utilización del modelo, aumentando el tiempo de inducción al inicio de las infusiones, evitando provocar hipertensión y bradicardia no deseadas. Este último punto podría ser relevante de considerar especialmente en la población pediátrica obesa.
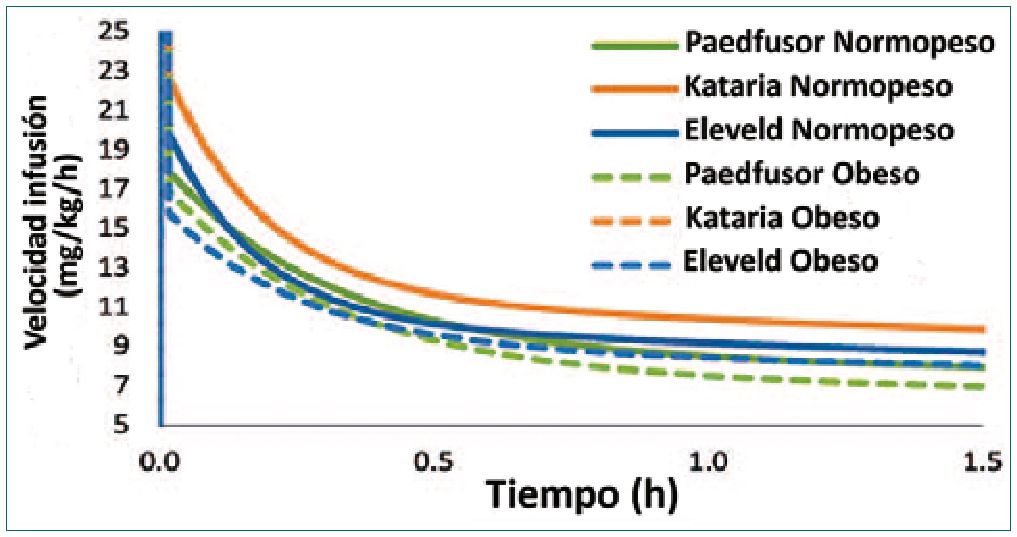
Figura 2. Velocidades de infusión de propofol predichas para alcanzar y mantener una concentración plasmática objetivo de 3 mcg/ml. Simulaciones en niño de 5 años y 105 cm de estatura, con PCT de 18 kg (líneas continuas) o PCT de 36 kg (líneas discontinuas). Las líneas que muestran las predicciones del modelo Kataria se superponen. La cantidad total de propofol administrada durante el período de 90 minutos por cada modelo para los niños normopeso y obesos, respectivamente, fueron: Paedfusor (299 y 544 mg), Kataria (347 y 695 mg) y Eleveld (301 y 547 mg). Modificado de Cortinez L, Anderson B. Advances in pharmacokinetic modeling: target controlled infusions in the obese. Curr Opin Anesthesiol 2018; 31:415-422.
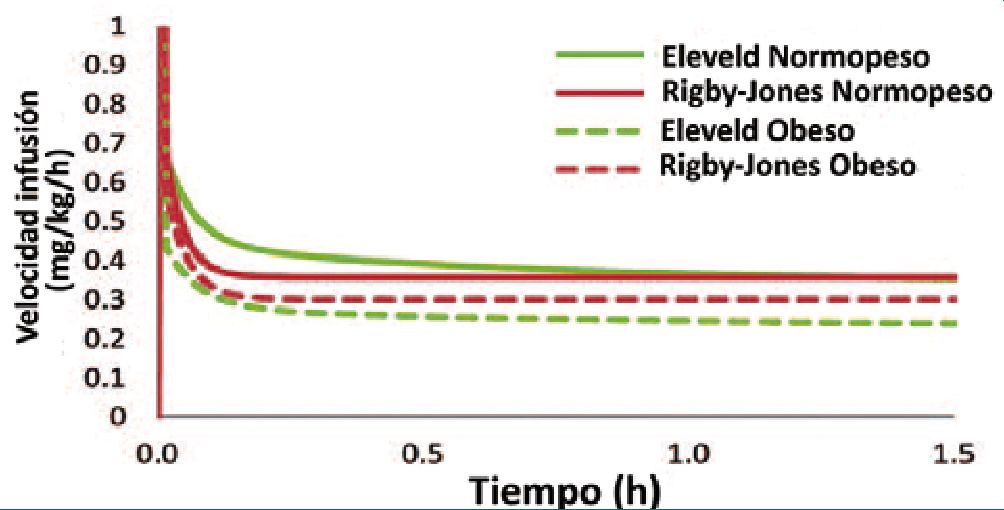
Figura 3. Velocidades de infusión de remifentanilo predichas para alcanzar y mantener una concentración plasmática objetivo de 6 ng/ml. El escenario simulado se presenta en un niño de 5 años, 105 cm de estatura, con un PCT de 18 kg (líneas continuas) o 36 kg (líneas discontinuas). La cantidad total de remifentanilo administrada durante el período de 90 minutos por cada modelo para los niños normopeso y obesos fue: Rigby-Jones (0,60 y 1,02 mg) y Eleveld (0,65 y 0,86 mg). Modificado de Cortinez L, Anderson B. Advances in pharmacokinetic modeling: target controlled infusions in the obese. Curr Opin Anesthesiol 2018; 31:415-422.
-
Conclusión
La dosificación de anestésicos intravenosos en niños con obesidad es un desafío significativo, no sólo por la influencia de la maduración en la población pediátrica más pequeña, sino que también por los cambios fisiológicos que acompañan a la obesidad, que alteran significativamente la forma en que los medicamentos se distribuyen y eliminan.
Las pautas de dosificación basadas en la evidencia disponible son escasas y poco comprendidas en los pacientes pediátricos obesos. No existe un descriptor de tamaño único, que sirva para dosificar todos los anestésicos disponibles en esta población. Esta realidad lleva a que la dosificación se base en la experiencia empírica o extrapolaciones de datos de adultos, lo que puede resultar en subdosificación o sobredosis. De forma racional, la elección de una determinada dosis de un anestésico específico dependerá de las propiedades fisicoquímicas del fármaco, si se trata de una dosis de carga o de mantenimiento, tomando en cuenta la información farmacocinética disponible.
Las bombas de TCI, que integran modelos PK/PD, se consideran la mejor guía disponible para la dosificación intravenosa en niños obesos, siempre y cuando los profesionales comprendan los elementos subyacentes al modelo utilizado. Aunque existen muchos modelos desarrollaron en adultos y niños, su precisión en niños obesos sigue siendo limitada debido a la falta de modelos PK específicos para esta población. El estado actual de los modelos PK/PD incorporados a las bombas de TCI disponibles, no permite una adecuada dosificación de la gran mayoría de anestésicos en pacientes pediátricos obesos. Sin embargo, la alometría y el empleo de mejores escalares prometen personalizar y mejorar la precisión.
Dosificar los anestésicos en niños obesos es como navegar en aguas poco exploradas con un mapa incompleto. Aunque conocemos la dirección general al dosificar utilizando diversas métricas de peso para evitar problemas, se requiere ajustar el tamaño de los bolos y las dosis de mantención. Las herramientas avanzadas, como los sistemas de TCI con modelos PK/PD, permiten una navegación más precisa, pero aún necesitamos más investigación para completar el mapa y garantizar una anestesia segura en niños obesos. En este sentido, titular las dosis administradas de forma cuidadosa basándose en el conocimiento de la farmacología específica y la evaluación clínica de los efectos con monitores adecuados, pareciera ser perentorio.
Declaración de autoría
El autor declara no haber enviado este artículo a otra revista científica para revisión.
Finananciamiento
No se obtuvo financiamiento externo. No existen conflicto de intereses que declarar.
Declaración de derechos
Se ceden los derechos de propiedad intelectual del artículo a la Revista Chilena de Anestesiología.
-
Referencias
1. Lerman J, Becke K. Perioperative considerations for airway management and drug dosing in obese children. Curr Opin Anaesthesiol. 2018 Jun;31(3):320–6. https://doi.org/10.1097/ACO.0000000000000600 PMID:29697466
2. Mulla H, Johnson TN. Dosing dilemmas in obese children. Arch Dis Child Educ Pract Ed. 2010 Aug;95(4):112–7. https://doi.org/10.1136/adc.2009.163055 PMID:20585055
3. Kendrick JG, Carr RR, Ensom MH. Pediatric Obesity: Pharmacokinetics and Implications for Drug Dosing. Clin Ther. 2015 Sep;37(9):1897–923. https://doi.org/10.1016/j.clinthera.2015.05.495 PMID:26361823
4. Xiong Y, Fukuda T, Knibbe CA, Vinks AA. Drug Dosing in Obese Children: Challenges and Evidence-Based Strategies. Pediatr Clin North Am. 2017 Dec;64(6):1417–38. https://doi.org/10.1016/j.pcl.2017.08.011 PMID:29173794
5. Krekels E and Knibbe. Pharmacokinetics and Pharmacodynamics of Drugs in Obese Pediatric Patients: How to Map Uncharted Clinical Territories. Handbook of Experimental Pharmacology. Volume 261. Pediatric Pharmacotherapy; 2004.
6. Chidambaran V, Tewari A, Mahmoud M. Anesthetic and pharmacologic considerations in perioperative care of obese children. J Clin Anesth. 2018 Mar;45:39–50. https://doi.org/10.1016/j.jclinane.2017.12.016 PMID:29275265
7. Anderson BJ, Holford NH. What is the best size predictor for dose in the obese child? Paediatr Anaesth. 2017 Dec;27(12):1176–84. https://doi.org/10.1111/pan.13272 PMID:29076211
8. Cortínez LI, Anderson BJ. Advances in pharmacokinetic modeling: target controlled infusions in the obese. Curr Opin Anaesthesiol. 2018 Aug;31(4):415–22. https://doi.org/10.1097/ACO.0000000000000619 PMID:29794852
9. Morse JD, Cortinez LI, Anderson BJ. Considerations for Intravenous Anesthesia Dose in Obese Children: understanding PKPD. J Clin Med. 2023 Feb;12(4):1642. https://doi.org/10.3390/jcm12041642 PMID:36836174
10. Camacho Valdés Z. Obesidad y sobrepeso infantil en Chile. Rev. Conflu [Internet]. 17 de julio de 2024. Disponible en: https://revistas.udd.cl/index.php/confluencia/article/view/1114 https://doi.org/10.52611/confluencia.2024.1114.
11. Mapa Nutricional. 2024 Junaeb. Disponible en https://www.junaeb.cl/mapa-nutricional/
12. Perret P, Péres V, Poblete V. Manual de pediatría (2018), Capitulo Obesidad infanto-juvenil. Chile Escuela de Medicina Facultad de Medicina, Pontificia Universidad Católica de Chile.
13. Matson KL, Horton ER, Capino AC. Medication Dosing for Children With Overweight and Obesity. J Pediatr Pharmacol Ther. 2024 Oct;29(5):550–3. https://doi.org/10.5863/1551-6776-29.5.550 PMID:39411409
14. Knibbe CA, Brill MJ, van Rongen A, Diepstraten J, van der Graaf PH, Danhof M. Drug disposition in obesity: toward evidence-based dosing. Annu Rev Pharmacol Toxicol. 2015;55(1):149–67. https://doi.org/10.1146/annurev-pharmtox-010814-124354 PMID:25340929
15. Manupipatpong K, Wayne CD, Tobias JD, Nafiu OO, Michalsky MP, Syed A. Anesthesia considerations for pediatric metabolic and bariatric surgery. Surg Obes Relat Dis. 2024 Dec;20(12):1322–8. https://doi.org/10.1016/j.soard.2024.07.004 PMID:39142958
16. Johnson PN, Stephens K, Barker P, Bergeron E, Lim SY, Hagemann TM, et al. Prescribing Patterns of Continuous Infusions in Nonobese versus Obese Children Admitted to the Pediatric Intensive Care Unit. J Pediatr Intensive Care. 2019 Dec;8(4):226–32. https://doi.org/10.1055/s-0039-1692669 PMID:31673458
17. Cortínez LI, De la Fuente N, Eleveld DJ, Oliveros A, Crovari F, Sepulveda P, et al. Performance of propofol target-controlled infusion models in the obese: pharmacokinetic and pharmacodynamic analysis. Anesth Analg. 2014 Aug;119(2):302–10. https://doi.org/10.1213/ANE.0000000000000317 PMID:24977639
18. Anderson BJ, Holford NH. Getting the dose right for obese children. Arch Dis Child. 2017 Jan;102(1):54–5. https://doi.org/10.1136/archdischild-2016-311696 PMID:27655657
19. Chidambaran V, Venkatasubramanian R, Sadhasivam S, Esslinger H, Cox S, Diepstraten J, et al. Population pharmacokinetic-pharmacodynamic modeling and dosing simulation of propofol maintenance anesthesia in severely obese adolescents. Paediatr Anaesth. 2015 Sep;25(9):911–23. https://doi.org/10.1111/pan.12684 PMID:25975390
20. Diepstraten J, Chidambaran V, Sadhasivam S, Blussé van Oud-Alblas HJ, Inge T, van Ramshorst B, et al. An integrated population pharmacokinetic meta-analysis of propofol in morbidly obese and nonobese adults, adolescents, and children. CPT Pharmacometrics Syst Pharmacol. 2013 Sep;2(9):e73. https://doi.org/10.1038/psp.2013.47 PMID:24026252
21. Vaughns JD, Ziesenitz VC, Williams EF, Mushtaq A, Bachmann R, Skopp G, et al. Use of Fentanyl in Adolescents with Clinically Severe Obesity Undergoing Bariatric Surgery: A Pilot Study. Paediatr Drugs. 2017 Jun;19(3):251–7. https://doi.org/10.1007/s40272-017-0216-6 PMID:28238111
22. Maharaj AR, Wu H, Zimmerman KO, Speicher DG, Sullivan JE, Watt K, et al.; Best Pharmaceuticals for Children Act – Pediatric Trials Network Steering Committee. Dosing of Continuous Fentanyl Infusions in Obese Children: A Population Pharmacokinetic Analysis. J Clin Pharmacol. 2020 May;60(5):636–47. https://doi.org/10.1002/jcph.1562 PMID:31814149
23. Brill MJ, Diepstraten J, van Rongen A, van Kralingen S, van den Anker JN, Knibbe CA. Impact of obesity on drug metabolism and elimination in adults and children. Clin Pharmacokinet. 2012 May;51(5):277–304. https://doi.org/10.2165/11599410-000000000-00000 PMID:22448619
24. Gerhart JG, Carreño FO, Ford JL, Edginton AN, Perrin EM, Watt KM, et al.; Best Pharmaceuticals for Children Act-Pediatric Trials Network Steering Committee. Use of physiologically-based pharmacokinetic modeling to inform dosing of the opioid analgesics fentanyl and methadone in children with obesity. CPT Pharmacometrics Syst Pharmacol. 2022 Jun;11(6):778–91. https://doi.org/10.1002/psp4.12793 PMID:35491971
25. Eleveld DJ, Proost JH, Vereecke H, Absalom AR, Olofsen E, Vuyk J, et al. An allometric model of remifentanil pharmacokinetics and pharmacodynamics. Anesthesiology. 2017 Jun;126(6):1005–18. https://doi.org/10.1097/ALN.0000000000001634 PMID:28509794
26. van Rongen A, Brill MJ, Vaughns JD, Välitalo PA, van Dongen EP, van Ramshorst B, et al. Higher midazolam clearance in obese adolescents compared with morbidly obese adults. Clin Pharmacokinet. 2018b May;57(5):601–11. https://doi.org/10.1007/s40262-017-0579-4 PMID:28785981
27. Morse JD, Cortinez LI, Anderson BJ. Pharmacokinetic concepts for dexmedetomidine target-controlled infusion pumps in children. Paediatr Anaesth. 2021 Sep;31(9):924–31. https://doi.org/10.1111/pan.14235 PMID:34085357
28. Morse JD, Cortinez LI, Anderson BJ. A Universal Pharmacokinetic Model for Dexmedetomidine in Children and Adults. J Clin Med. 2020 Oct;9(11):3480. https://doi.org/10.3390/jcm9113480 PMID:33126702
29. Wu B, Shan J, Zhou Q, Wang L. Determination of the ED95 of a single bolus dose of dexmedetomidine for adequate sedation in obese or nonobese children and adolescents. Br J Anaesth. 2021 Mar;126(3):684–91. https://doi.org/10.1016/j.bja.2020.11.037 PMID:33495020
30. Rose JB, Theroux MC, Katz MS. The potency of succinylcholine in obese adolescents. Anesth Analg. 2000 Mar;90(3):576–8. https://doi.org/10.1097/00000539-200003000-00015 PMID:10702440
31. Benumof JL, Dagg R, Benumof R. Critical hemoglobin desaturation will occur before return to an unparalyzed state following 1 mg/kg intravenous succinylcholine. Anesthesiology. 1997 Oct;87(4):979–82. https://doi.org/10.1097/00000542-199710000-00034 PMID:9357902
32. McKay RE, Malhotra A, Cakmakkaya OS, Hall KT, McKay WR, Apfel CC. Effect of increased body mass index and anaesthetic duration on recovery of protective airway reflexes after sevoflurane vs desflurane. Br J Anaesth. 2010 Feb;104(2):175–82. https://doi.org/10.1093/bja/aep374 PMID:20037150
33. Chidambaran V, Sadhasivam S, Diepstraten J, Esslinger H, Cox S, Schnell BM, et al. Evaluation of propofol anesthesia in morbidly obese children and adolescents. BMC Anesthesiol. 2013 Apr;13(1):8. https://doi.org/10.1186/1471-2253-13-8 PMID:23602008
34. Olutoye OA, Yu X, Govindan K, Tjia IM, East DL, Spearman R, et al. The effect of obesity on the ED(95) of propofol for loss of consciousness in children and adolescents. Anesth Analg. 2012 Jul;115(1):147–53. https://doi.org/10.1213/ANE.0b013e318256858f PMID:22575569
35. Chidambaran V, Venkatasubramanian R, Sadhasivam S, Esslinger H, Cox S, Diepstraten J, et al. Population pharmacokinetic-pharmacodynamic modeling and dosing simulation of propofol maintenance anesthesia in severely obese adolescents. Paediatr Anaesth. 2015 Sep;25(9):911–23. https://doi.org/10.1111/pan.12684 PMID:25975390
36. Cohen B, Tanios MA, Koyuncu O, Yilmaz HO, Raza S, Mukhdomi J, et al. Association between higher BMI and postoperative pain and opioid consumption in pediatric inpatients – A retrospective cohort study. J Clin Anesth. 2020 Jun;62:109729. https://doi.org/10.1016/j.jclinane.2020.109729 PMID:32006800
37. Vandemoortele O, Hannivoort LN, Vanhoorebeeck F, Struys MM, Vereecke HE. General Purpose Pharmacokinetic-Pharmacodynamic Models for Target-Controlled Infusion of Anaesthetic Drugs: A Narrative Review. J Clin Med. 2022 Apr;11(9):2487. https://doi.org/10.3390/jcm11092487 PMID:35566617
38. Absalom A, Kenny G. ‘Paedfusor’ pharmacokinetic data set. Br J Anaesth. 2005 Jul;95(1):110. https://doi.org/10.1093/bja/aei567 PMID:15941735
39. Kataria BK, Ved SA, Nicodemus HF, Hoy GR, Lea D, Dubois MY, et al. The pharmacokinetics of propofol in children using three different data analysis approaches. Anesthesiology. 1994 Jan;80(1):104–22. https://doi.org/10.1097/00000542-199401000-00018 PMID:8291699
40. Eleveld DJ, Proost JH, Cortínez LI, Absalom AR, Struys MM. A general purpose pharmacokinetic model for propofol. Anesth Analg. 2014 Jun;118(6):1221–37. https://doi.org/10.1213/ANE.0000000000000165 PMID:24722258
41. Minto CF, Schnider TW, Egan TD, Youngs E, Lemmens HJ, Gambus PL, et al. Influence of age and gender on the pharmacokinetics and pharmacodynamics of remifentanil. I. Model development. Anesthesiology. 1997 Jan;86(1):10–23. https://doi.org/10.1097/00000542-199701000-00004 PMID:9009935
42. Rigby-Jones AE, Priston MJ, Sneyd JR, McCabe AP, Davis GI, Tooley MA, et al. Remifentanil-midazolam sedation for paediatric patients receiving mechanical ventilation after cardiac surgery. Br J Anaesth. 2007 Aug;99(2):252–61. https://doi.org/10.1093/bja/aem135 PMID:17578905
-
Introducción
La obesidad infantil representa un problema de salud global creciente que plantea desafíos significativos para la administración de fármacos en el contexto de la anestesia pe- diátrica[1]. La dosificación de anestésicos en niños obesos es compleja, poco comprendida y con escasa información disponible para guiar las dosis administradas[1]-[3].
Los cambios fisiopatológicos asociados a la obesidad provocan alteraciones en los parámetros farmacológicos que inducen potenciales errores de dosificación, con consecuencias indeseables para los pacientes[4],[5]. El enfoque tradicional de dosificar los anestésicos basándose en el peso corporal total (PCT) puede llevar a subdosificación o sobredosificación sustancial de los fármacos, ya que el exceso de peso corporal no se compone de las mismas proporciones de tejido adiposo y magro comparado con niños de peso normal[1],[2],[6]. Además, los hallazgos en adultos obesos no son directamente extrapolables a los niños obesos, debido a las diferencias fisiológicas y de desarrollo entre ambas poblaciones[6]. Se han propuesto diversos descriptores de tamaño, para lograr una dosificación más precisa en la población obesa. Sin embargo, no existe un único “mejor” escalar que sirva para dosificar todos los anestésicos en niños obesos y su elección dependerá de las propiedades específicas del fármaco, si se trata de una dosis de carga o de mantenimiento, y de la información farmacológica disponible[4],[7]-[9]. En este incierto escenario, monitorizar los distintos efectos anestésicos (ej. nivel anestésico, bloqueo neuromuscular, nocicepción) es crucial para individualizar una adecuada dosificación.

 ORCID
ORCID